一种嵌合肽A6及其应用的制作方法
本发明属于蛋白质领域,具体地说,涉及一种嵌合肽及其应用。
背景技术
革兰氏阴性菌(g-),比如致病性大肠杆菌,沙门氏菌是两种重要的人畜共患病病原菌,其感染会导致畜禽和人细菌性腹泻、坏死性肠炎甚至败血症。在g-感染的发生发展乃至治疗过程中始终都伴随着细菌脂多糖(lps)的释放,抗生素虽然具有迅速抑菌杀菌作用、有效清除畜禽体内的病原微生物,但是也促进lps的释放,进而引起炎症反应。另一面,大多数抗生素拮抗lps的效果极弱,不能解决由此引起的lps中毒及其炎症问题,此外,长期不合理、过量使用或滥用抗生素导致了细菌出现不同程度的耐药性或诱发形成二重感染的问题也日益严重。
目前,已有研究结果表明抗菌肽不易对细菌产生耐药性,而且有些抗菌肽还具有中和lps的能力。因此在本研究通过不可剪切的刚性linker将抗菌肽n6与lps结合蛋白突变体lbp14连接,形成嵌和肽,使其兼具杀菌、去毒及降炎症的多重功能。
技术实现要素:
为了解决现有技术中存在的问题,本发明的目的是提供一种高抗菌活性、低细胞毒性和低溶血性的嵌和肽a6及其应用。
为了实现本发明目的,本发明的技术方案如下:
第一方面,本发明提供一种嵌和肽a6,其是由刚性linker“a(ea3k)2a”序列连接lbp14和n6而成的嵌合肽。
其中,所述lbp14为lps结合蛋白突变体,具有针对lps的靶向性;所述n6则为公开号cn107188944a的中国专利申请所记载的海蚯蚓抗菌肽nz17074衍生肽n6。
本发明通过利用刚性linker将lbp14和n6相连获得嵌和肽a6,获得了一种兼具杀菌和中和内毒素的双功能嵌合肽。
所述嵌和肽a6的氨基酸序列如seqidno.1所示,所述刚性linker的氨基酸序列如seqidno.2所示,所述嵌和肽a6编码基因的核苷酸序列如seqidno.3所示。
所述嵌合肽a6的制备方法采用固相合成法进行,本领域技术人员可依据常规技术手段实现,合成的嵌和肽a6的分子量为5164.02da。
其中,在seqidno.1中,c31-c40形成一对二硫键。
第二方面,本发明提供了所述嵌合肽a6在制备治疗革兰氏阴性菌感染的抗菌药物或组合物中的应用。
所述革兰氏阴性菌包括但不限于大肠杆菌、肠出血性大肠杆菌、沙门氏菌、肠炎沙门氏菌、鼠伤寒沙门氏菌、鸡白痢沙门氏菌、铜绿假单胞菌。
本发明还提供了所述嵌合肽a6在制备抗内毒素血症药物或组合物中的应用。
本发明还提供了由所述嵌合肽a6制备的治疗革兰氏阴性菌感染的抗菌药物或组合物,以及抗内毒素血症药物或组合物。
本发明的有益效果在于:
本发明的嵌和肽a6对革兰氏阴性菌具有很好的杀菌效果,并且显著降低了对小鼠红细胞的溶血活性以及对鼠源巨噬细胞的细胞毒性。小鼠毒血症模型试验结果表明,嵌和肽a6具有抗内毒素血症作用,能够显著提高小鼠的存活率,并且优于抗生素硫酸粘杆菌素。嵌和肽a6分子量小,易于人工合成,是极具应用价值的小分子多肽,可用于制备新型抗菌、中和内毒素药物制剂等,具有良好的应用前景。
附图说明
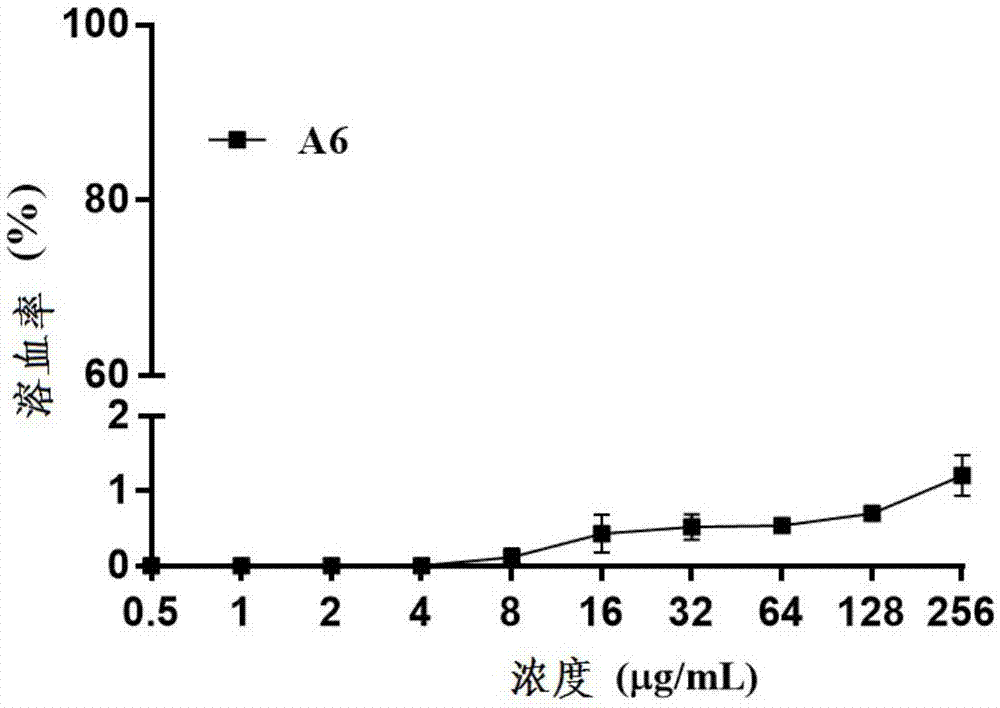
图1为本发明实施例3中嵌和肽a6的溶血性实验结果。
图2为本发明实施例3中嵌和肽a6的细胞毒性实验结果。
图3为本发明实施例4中嵌和肽a6对毒血症小鼠的保护实验结果。
图4为本发明实施例5中嵌和肽a6对lps的中和能力。
图5为本发明实施例6中嵌和肽a6对lps诱发毒血症小鼠2小时后体内炎症因子tnf-α的调节。
具体实施方式
下面结合实施例对本发明做进一步的解释说明。需要理解的是以下实施例的给出仅是为了起到说明的目的,并不是用于对本发明的范围进行限制。本领域的技术人员在不背离本发明的宗旨和精神的情况下,可以对本发明进行各种修改和替换。
下述实施例中所使用的实验方法如无特殊说明,均为常规方法。
下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
实施例1嵌和肽a6的设计与合成
1、以抗菌肽n6和lbp衍生物lbp14为基础,通过刚性linker将两者相连获得嵌和肽a6,期望兼具杀菌、中和内毒素的双功能,嵌和肽a6氨基酸序列如seqidno.1所示,linker氨基酸序列如seqidno.2所示,a6基因的核苷酸序列如seqidno.3所示。
2、嵌和肽合成采用固相合成法,通过十二通道半自动多肽合成仪进行合成。反向高效液相色谱c18柱测定合成肽纯度(>90%),esi-ms质谱确认嵌和肽a6的分子量。
实施例2嵌和肽a6的抑菌实验
本实施例中的病原菌来自于中国兽医微生物菌种保藏管理中心(cvcc),中国微生物菌种保藏管理委员会普通微生物中心(cgmcc)以及中国工业微生物菌种保藏管理中心(cicc),具体菌株如表1所示。
嵌和肽的最小抑菌浓度(mic,minimuminhibitoryconcentration)的测定参照临床和实验室标准协会(clsi,clinicalandlaboratorystandardsinstitute)制定的方法(wiegand等,agarandbrothdilutionmethodstodeterminetheminimalinhibitoryconcentration(mic)ofantimicrobialsubstances.natureprotocols,2008,3(2):163-175),根据具体情况略有改动,操作细节如下:
将受试菌株的单菌落挑至mh液体培养基中,37℃250rpm振荡过夜培养活化后,转接至mh液体培养基中培养至对数生长期(od600nm=0.4~0.6),然后制备成105cfu/ml的菌液,加入96孔无菌细胞培养板内,每孔90μl。
用pbs通过2倍倍比稀释法对嵌和肽进行稀释,每孔10μl抗菌肽,使其终浓度分别为128、64、32、16、8、4、2、1、0.5、0.25、0.125和0.0625μg/ml,阴性对照组为pbs代替抗菌肽的受试菌液,空白对照组为无菌mh培养基。每个处理做三个平行样。
将培养板置于37℃恒温培养箱孵育16~18h,直至阴性对照孔出现肉眼可见的明显浑浊菌液,能够完全抑制细菌生长的最低浓度即为抗菌肽对受试菌株的mic值。如果出现跳孔或平行样间结果不一致的情况,则重新测试。
结果如表1所示,抗菌肽对各革兰氏阴性菌种均体现出不同程度的较好抑菌效果。
表1嵌和肽a6的mic值测定
实施例3嵌和肽a6的细胞毒性研究
1、溶血性测定
溶血性是衡量抗菌肽是否适用于静脉注射治疗的重要指标,具体操作如下:
取6周龄spf级的icr雌鼠,眼球取血,使用肝素钠抗凝管收集。采集的血液于4℃,1500rpm离心10min,用无菌0.9%生理盐水重复洗涤红细胞三次,至上清无色透明,制成8%的红细胞悬浮液。
用无菌0.9%生理盐水溶解样品肽,配制成浓度为512μg/ml的母液,2倍倍比稀释至终浓度为1μg/ml。各取100μl红细胞悬浮液和抗菌肽溶液加入到96孔板中,红细胞终浓度为4%。
将混合液至于37℃恒温培养箱静置孵育,1h后,4℃,1500rpm离心5min,将上清吸取至96孔板中,使用酶标仪在540nm下检测紫外吸光值。在相同条件下测定生理盐水和0.1%tritonx-100,分别为0%和100%溶血对照实验。溶血率计算公式如下:
溶血度(%)=[(abs540nm抗菌肽-abs540nm生理盐水)/(abs540nm0.1%tritonx-100-abs540nm生理盐水)]×100%
实验结果如图1所示。嵌和肽a6在256μg/ml浓度下溶血率为1.2%,具有极低的溶血性,不易引起哺乳动物红细胞破裂溶解而产生伤害,因此十分有利于在医药领域中进一步的开发应用。
2、mtt细胞毒性试验
通过对鼠源腹腔巨噬细胞raw264.7存活率的影响来评价嵌和肽a6对哺乳动物免疫细胞的毒害程度。
将raw264.7细胞培养于含有10%胎牛血清的dmem培养基中,在37℃,5%co2及饱和湿度条件下的培养箱中培养。细胞生长到对数期,用0.25%胰酶消化单层细胞;用含10%小牛血清的dmem培养基重悬细胞,以5×l04个/ml密度接种于96孔板中,每孔100μl;设置3~5个副孔,放入co2恒温培养箱中培养24h后移除培养基。
用pbs清洗两遍后,每孔按浓度梯度加入100μl浓度为1、2、4、8、16、32、64、128μg/ml样品肽,同时以加细胞而不加抗菌肽的孔为阳性对照,不加抗菌肽和细胞的孔为阴性对照。将细胞继续孵育24h后,吸取孔内培养基,用pbs洗两遍,每孔中加入20μl浓度为5mg/ml的mtt(mtt操作需避光进行),然后放到培养箱继续培养4h。轻轻吸弃mtt液,加入150μldmso,微量振荡器振荡10min后,待孔底结晶完全溶解,酶标仪570nm波长处测各孔吸光度(od值)。根据下面公式计算细胞增殖抑制指数(ir):
存活率(%)=od加药/od阴性×100%
测定结果如图2所示。嵌和肽a6对raw264.7细胞的存活无影响,在抗菌肽浓度为0.5~128μg/ml的范围内,细胞的存活率都维持在100%,说明a6对动物真核细胞无细胞毒副作用。
实施例4嵌和肽a6对lps引起的小鼠毒血症的治疗效果
1、毒血症模型的建立
6周龄spf级icr雌鼠5只,体重20g左右,购于北京维通利华实验动物有限公司。用pbs配制13.5mg/kg来源于e.coli0111:b4的lps(脂多糖),进行腹腔注射。模型组动物12h内均呈现相应病态,蜷缩少动,精神萎靡,48h全部死亡,确定建模成功。
2、给药及治疗情况
将小鼠随机分组给药治疗,每组5只小鼠,共分七组:①生理盐水阴性对照组;②0.0625μmol/kg嵌和肽a6组;③0.125umol/kg嵌和肽a6组;④0.125μmol/kg抗菌肽n6;⑤0.25μmol/kg抗菌肽n6;⑥5μmol/kg硫酸粘杆菌素pmb阳性对照组;⑦10μmol/kg硫酸粘杆菌素pmb阳性对照组。小鼠用lps攻毒30min后,进行腹腔注射治疗,每只小鼠200μl。8h后再次进行治疗,连续观察7天,记录小鼠存活率。
小鼠存活率如图3所示。嵌和肽a6能有效提高小鼠存活率,仅0.125μmol/kg嵌和肽a6对毒血症小鼠保护率即达100%,治疗效果明显高于n6和阳性对照硫酸粘杆菌素pmb组。
实施例5抗菌肽与lps的体外结合试验
肽与lps的亲和性通过荧光探针bodipy-tr-cadaverine(bc探针)进行检测。bc探针与lps结合后造成荧光淬灭。如果抗菌肽与lps结合,可以将探针替换下来,造成探针与lps结合量减少,从而重新产生荧光。
(1)将e.coli0111:b4lps(sigma)与bc探针用50mmtirsbuffer(ph7.4)分别稀释至40μg/ml(即1μm)和10μm(即5.4μg/ml);
(2)将等体积的bc探针与lps混合(使bc/lps摩尔比为10:1)加入黑色96孔酶标板,每孔加入180μl混合液;
(3)每孔加入20μl不同浓度的a6,以与lps结合的粘杆菌素替代抗生素作为阳性对照,以不与lps结合的氨苄青霉素作为阴性对照;
(4)在室温下通过荧光分光光度仪测定荧光值的变化(激发波长580nm,发射波长620nm),从而测定抗菌肽与lps的结合能力。
bc替换率(%)=(1-(f0-f)/(f0-fmax))×100
式中f0是单独bc溶液的荧光强度,fmax是只有lps存在时候荧光强度,f是lps和bc混合物在不同浓度替换无存在的情况下的荧光强度。
bc探针置换率如图4所示。100μm嵌合肽a6对bc探针置换率为100%,高于n6(90.5%)、硫酸粘杆菌素pmb(83.7%)、lbp14(74.9%)和氨苄青霉素amp(0%),这说明了a6与lbp14的结合能力强于n6和硫酸粘杆菌素。
实施例6细胞因子测定
配置浓度为13.5mg/kglps,并对小鼠进行腹腔注射攻毒,攻毒30min后进行治疗,嵌和肽a6浓度为0.25μmol/kg,抗菌肽的浓度为0.25μmol/kg,硫酸粘杆菌素pmb的浓度为10μmol/kg。小鼠在治疗2h后对其眼球进行取血,置于离心管中,37℃温浴30min后于4℃静置过夜。将小鼠血于4℃,3000rpm离心10min后吸取上清,进行细胞因子的测定。
细胞因子tnf-α含量按照试剂盒说明书,采用双抗夹心酶联免疫吸附法进行测定。具体操作过程如下:
(1)用包被缓冲液稀释抗细胞因子单抗,浓度为10μg/ml,加入96孔板,每孔加100μl,4℃包被过夜;次日用洗液洗涤包被板3次;
(2)每孔加1%bsa-pbs封闭液200μl,室温封闭2h,用洗液洗3次;
(3)标准曲线的建立:标准品用样品稀释液倍比稀释,每孔加100μl。标准品通常储存在-30℃或冷冻干燥后4℃保存;
(4)检测标本适当稀释,每孔加入100μl,每一样本做双复孔。同时设正常对照和空白对照;
(5)37℃孵育1h或室温孵育2h,然后洗板3~5次;
(6)每孔加生物素-抗细胞因子抗体100μl,37℃孵育1h或室温孵育2h,然后洗板3~5次;
(7)每孔加抗生物素-酶100μl,37℃孵育30min,然后洗板3~5次;
(8)每孔显色液(tmb)100μl,37℃避光孵育20min;
(9)每孔加终止液100μl,混匀后即刻检测od450值(3min内)。
嵌合肽a6对促炎因子tnf-α影响如图5所示。在小鼠对照组(未攻毒lps),tnf-α含量为67.797pg/ml;lps攻毒小鼠后,tnf-α含量增至为416.074pg/ml,说明lps促进了tnf-α产生。小鼠经0.25μmol/kga6、n6和硫酸粘杆菌素pmb治疗后,tnf-α含量分别为150.087、260.693和450.397pg/ml,说明a6明显降低了促炎因子的产生,其效果优于n6;与之相反,硫酸粘杆菌素促进了炎症因子的产生。
虽然,上文中已经用一般性说明及具体实施方案对本发明作了详尽的描述,但在本发明基础上,可以对之作一些修改或改进,这对本领域技术人员而言是显而易见的。因此,在不偏离本发明精神的基础上所做的这些修改或改进,均属于本发明要求保护的范围。
序列表
<110>中国农业科学院饲料研究所
<120>一种嵌合肽a6及其应用
<130>2018
<141>2018-05-18
<160>3
<170>siposequencelisting1.0
<210>1
<211>45
<212>prt
<213>人工引物(artificialsequence)
<400>1
argvalglnglyargtrplysvalargalaserphephelysgluala
151015
alaalalysglualaalaalalysglyphealatrpasnvalcysval
202530
tyrargasnglyvalargvalcyshisargargalaasn
354045
<210>2
<211>10
<212>prt
<213>人工引物(artificialsequence)
<400>2
glualaalaalalysglualaalaalalys
1510
<210>3
<211>135
<212>dna
<213>人工引物(artificialsequence)
<400>3
cgcgtgcagggccgctggaaagtgcgcgcgagcttttttaaagaagcggcggcgaaagaa60
gcggcggcgaaaggctttgcgtggaacgtgtgcgtgtatcgcaacggcgtgcgcgtgtgc120
catcgccgcgcgaac135
- 还没有人留言评论。精彩留言会获得点赞!