一种高油酸花生突变基因AhFAD2B-814及应用的制作方法
本发明属于植物分子育种领域,具体地说,涉及高油酸花生编码油酸脱氢酶且可以提高花生油酸含量的突变基因核酸序列及其应用。
背景技术
花生是中国重要的油料与经济作物,花生油是中国传统食用油,也是国产食用植物油的主要来源。花生油中主要有棕榈酸(c16:0)、硬脂酸(c18:0)、油酸(c18:1)、亚油酸(c18:2)、山嵛酸(c22:0)和花生酸(c20:0)等脂肪酸。从各种脂肪酸的组成来看,不饱和脂肪酸约为80%(其中油酸36%-67%,亚油酸15%-43%),饱和脂肪酸占20%(其中棕榈酸6%-11%,硬脂酸2%-6%,花生酸5%-7%,山嵛酸2%-3%)。花生种子中的脂肪酸组成及其含量是衡量其品质优劣的重要指标。油脂稳定性方面,亚油酸属多不饱和脂肪酸,其油酰残基易氧化而导致油脂腐败劣变,严重影响油脂储存期;而油酸分子只含有一个双价不饱和键,化学结构相对比较稳定,抗氧化能力强,在精炼、储藏和煎炸时不易变质,与普通花生相比,高油酸含量的花生具有更长的货架期。营养价值方面,花生油的品质对花生油固定消费人群的健康具有重要影响。油酸的营养价值较高,其可降低血液中低密度脂蛋白的含量,同时维持有益高密度脂蛋白水平,更有效地保护心脑血管,还能逆转炎性细胞因子tnf-α对胰岛素产生的抑制作用。因此,提高油酸含量已经成为花生品质育种的一个重要目标。
油酸脱氢酶(δ12fad或fad2)是催化油酸的c12位上脱氢生成双不饱和亚油酸的关键酶,它控制油酸、亚油酸的含量及其比值(o/l)。分子生物学研究越来越多的证据表明,ahfad2是油酸生成亚油酸的关键基因,决定花生种子中油酸和亚油酸的相对含量。栽培种花生(arachishypogaea)是具有基因组a和基因组b的异源四倍体物种(2n=4x=40),ahfad2由位于不同基因组上的2对非等位同源基因ahfad2a和ahfad2b共同编码,它们分别来源于花生野生种a和b基因组,该2个基因均不属于种子特异表达基因,在普通油酸含量花生品种中这2个基因或者其中之一能正常表达;而在高油酸品种中,ahfad2a和ahfad2b基因均突变共同导致高油酸性状的产生。
美国科学家最早从花生资源中鉴定筛选出油酸含量79%(o/l为37)的高油酸花生自然突变体f435。通过对普通油酸花生与f435序列比对发现,在ahfad2a的编码区从起始密码子起第448bp碱基发现存在单碱基替换(g>a),使编码的蛋白质第150位氨基酸由天冬氨酸(d)转变为天冬酰胺(n),而d150残基在所有fad2中是绝对保守的,是高油酸性状的关键位点,突变导致ahfad2a酶活性降低;在ahfad2b基因起始密码子起第441_442bp处存在单碱基插入(442insa),造成密码突变,导致翻译的蛋白质序列提前终止,产生无活性的蛋白。之后,美国科学家利用化学诱变直接育成了高油酸花生品种c458和m2-225,它们在ahfad2a自然突变(g448a)基础上,诱变又使ahfad2b基因起始密码子后第665bp和997bp处分别插入微型反向重复转座元件mite(205bp),导致肽链提前终止,使蛋白功能丧失。以上ahfad2b突变基因均属于无义突变(nonsensemutation),使产生的蛋白不完全而丧失原基因的功能,已成为花生高油酸育种的基因源。
截至2016年12月底,我国育成的高油酸花生品种仅38个,国外已育成高油酸品种89个。系谱分析追溯已育成高油酸品种的高油酸基因来源,70%以上品种的高油酸基因供体来源于f435。高油酸基因源单一化,已造成育成的高油酸品种遗传基础相对狭窄、遗传多样性下降,产量与品质的矛盾及优质与抗病性的矛盾日益突出。目前,国内生产上大面积应用的花生品种油酸含量普遍较低(<50%),而棕榈酸含量较高(>11%)。另一方面,国内花生种质资源的油酸含量均未超过70%,最大含量仅67.2%,属于龙生型,其结果分散、生育期长,在育种中利用效果不理想。因此通过多途径挖掘和创造新的种质资源已经成为高油酸花生育种的当务之急。
最近,美国科学家又鉴定出2个新的高油酸花生自然突变体pi342664和pi342666,其ahfad2a基因编码区448位g>a突变与先前报道相同,而ahfad2b基因突变c301g导致氨基酸h101d改变属于新的突变位点,最终使突变体油酸含量达到79%以上。印度花生育种家采用γ射线诱变抗病品种,获得2个新的高油酸突变体(gm6-1和gm4-3),油酸含量均在75%以上,研究发现ahfad2b基因发生碱基替换g1111a导致氨基酸g372s改变,从而产生高油酸表型。另外,国内花生研究者利用ems化学诱变获得ahfad2b基因新的突变位点c313t,引起氨基酸序列h105y突变,使油酸含量由44%提高到60%以上。但是,这些突变体至今还未见在高油酸花生育种中应用的报道。
综上所述,育种上实际应用的高油酸花生种质油酸含量均在80%以下,缺乏超高油酸含量(至少>80%)的花生新种质。国内获得的少数高油酸花生材料基本都是在美国高油酸花生突变体的基础上杂交而来,高油酸基因或材料受知识产权保护,我国尚未获得具有自主知识产权的高油酸花生新种质。开发具有自主知识产权的花生高油酸基因,是促进我国高油酸花生产业化快速发展的重要保证。但迄今为止,国内还没有公开或发表过花生高油酸突变基因及其应用。
技术实现要素:
本发明的目的在于弥补已有专利或技术的不足,以我们研究的自然突变产生的高油酸花生突变体c814t为材料,提供一种新的高油酸花生ahfad2b突变基因核苷酸序列,其编码花生体内油酸脱氢酶(fad2),该酶是植物体内脂肪酸生物合成途径中催化油酸(c18:1)碳链第12碳位脱氢形成双键,向亚油酸转变的关键酶。本发明的另一个目的在于提供一种高油酸花生脂肪酸脱氢酶基因突变型的核苷酸序列在花生高油酸育种中的应用。
本发明为实现其目的采用的技术方案是:
一种高油酸花生突变基因ahfad2b-814,所述突变基因ahfad2b-814的核苷酸序列如seqidno.1所示,由1140个碱基组成;或seqidno:1所示的核苷酸序列经置换、插入或缺失衍生的表达相同功能蛋白质的核苷酸序列;或与seqidno:1所示核苷酸序列具有90%以上同源性且表达相同功能蛋白质的核苷酸序列或互补序列。
一种高油酸花生突变基因ahfad2b-814,所述的突变基因ahfad2b-814包含一处有义碱基突变:814c>t,在seqidno.1序列814bp处存在c814t的碱基置换。
如上述所述的一种高油酸花生突变基因ahfad2b-814,该突变基因编码的蛋白质序列如seqidno.2所示,由379个氨基酸残基组成,该蛋白质序列272氨基酸残基由组氨酸(h)转变为酪氨酸(y)。
一种检测高油酸花生fad2b突变基因型的pcr引物,
(1)设计对ahfad2b野生型基因的814bp位点碱基c扩增的引物对ahafd2b-c/ahfad2b-ro,
ahafd2b-c:5′—agttaccataacctatttgcagcacaaac—3′;
ahfad2b-ro:5′—ggcttctctccacaatgctttgtaaac—3′;
(2)设计对ahfad2b野生型基因的814bp位点碱基t扩增的引物对ahfad2b-fo/ahfad2b-t,
ahfad2b-fo:5′—catatctgctatatcacatagcaactt—3′;
ahfad2b-t:5′—gaatcatagtgaggcaatgatgccta—3′;
(3)设计对ahfad2b野生型和突变型基因包括814bp位点在内的片段扩增的引物对ahafd2b-fo/ahfad2b-ro,
ahfad2b-fo:5′—catatctgctatatcacatagcaactt—3′;
ahfad2b-ro:5′—ggcttctctccacaatgctttgtaaac—3′。
利用所述检测高油酸花生fad2b突变基因型的pcr引物的pcr检测方法,包括以下步骤:
(1)pcr扩增:
pcr反应体系:含1μl基因组dna模板(20ng/μl),2μl10×buffer、1.5μlmgcl2、2μldntp(2.5mmeach)、0.3μltaq酶(0.5u)、ahfad2b-c和ahfad2b-t引物各1.0μl、ahfad2b-fo和ahfad2b-ro引物各0.1μl,11μlddh2o;
pcr扩增程序:94℃预变性5min;94℃变性30s,59℃退火30s,72℃延伸1min10s,共35个循环;72℃延伸10min;
(2)电泳检测:将扩增产物用凝胶电泳检测,得到样本对应的基因型。
所述pcr引物在含有ahfad2b同源基因核苷酸序列c814t突变位点的高油酸花生品种(系)选育中的应用。
本发明的有益效果是:
本发明的花生高油酸突变体油酸脱氢酶基因的突变核苷酸序列,可以应用杂交、回交等植物常规育种方法将突变核苷酸序列导入其他普通油酸含量的花生品种或品系,提高导入ahfad2b-814基因突变核苷酸序列目标品种或品系的油酸含量,明显增加高油酸花生品种(系)的遗传多样性,拓宽高油酸花生的遗传基础。在高油酸花生育种中,可以通过选择携带ahfad2a突变基因型的花生材料做亲本,使育种后代的高油酸性状选择更有目的性,并提高目标性状的出现频率。
本发明的花生油酸脱氢酶基因突变核苷酸序列的应用研究包括,但不仅限于根据本发明研究的序列特征设计分子标记,检测花生高油酸新型突变基因的存在;及以该基因突变核苷酸序列构建载体,通过转基因方法培育高油酸花生品种。
与现有技术相比较,本发明具有下列优点和效果:
(1)本发明所述基因是在国际上首次研究发现的、不同于以往报道的栽培种花生ahfad2b基因新突变型。目前还没有报道表明,来自栽培种花生的fad2b的his272位点突变,会使得花生产生高油酸表型。通过对该基因的研究在理论上说明花生油酸含量的调控存在一种新的机制,从实践上可对提高油料作物油酸含量、改良油脂品质发挥重要作用。
(2)本发明所述的突变位点是我国新研究的具有自主知识产权的花生高油酸位点,打破了我国目前应用的花生高油酸基因主要靠国外引进的局面。
(3)所述突变位点指示的花生油酸含量更高,ahfad2a突变基因与本发明的花生高油酸新型ahfad2b-814突变基因同时存在,油酸含量可达85%,超过以往公开的花生其他位点或分子标记对应的油酸含量。
(4)通过分子检测目标突变位点,可以精准高效地筛选到具有高油酸含量性状的花生品种(系)。
本发明还适用于基于该突变基因的分子标记和基因功能研究,以及花生高油酸育种和转基因研究等方面。
附图说明
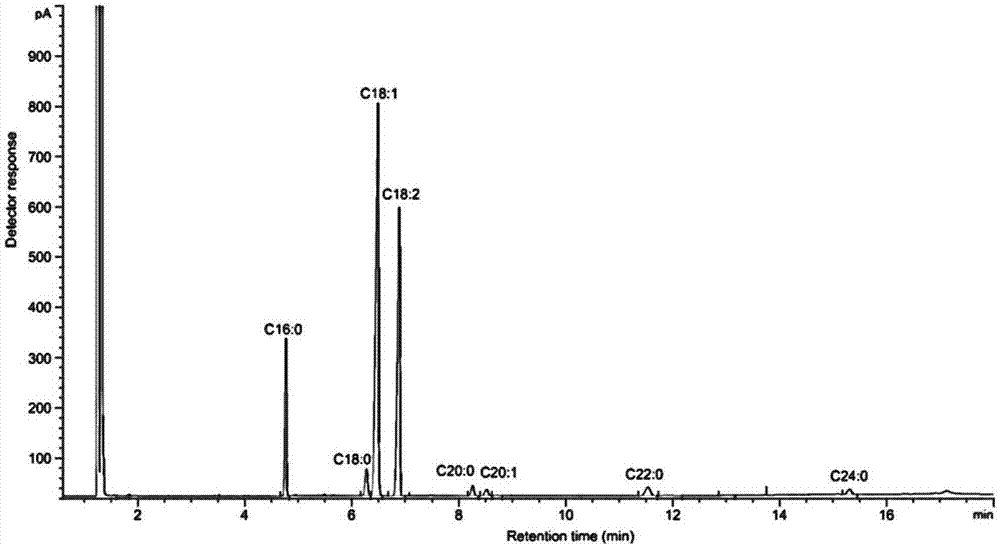
图1是普通油酸含量品种(冀花6号,油酸含量43.56%)花生油脂肪酸气相色谱图。
图2是f435型突变品系(kx016,油酸含量79.37%)花生油脂肪酸气相色谱图。
图3是新型高油酸突变体(hzy-2即c814t,油酸含量85.58%)花生油脂肪酸气相色谱图。
图4是ahfad2a基因测序部分序列441_442处峰图。
图5是ahfad2b基因测序核酸序列448bp处峰图。
图6是ahfad2b基因测序核酸序列814bp处峰图
图7是冀花6号、kx016、新型高油酸花生突变体c814t的ahfad2a基因编码的氨基酸序列比对。
图8是冀花6号、kx016、新型高油酸花生突变体c814t的ahfad2b基因编码的氨基酸序列比对。
图9是酿酒酵母总脂肪酸成分的气相色谱图,阴性对照,空载体pyes2.0转化子。
图10是酿酒酵母总脂肪酸成分的气相色谱图,阳性pyes/ahfad2b转化子。
图11是酿酒酵母总脂肪酸成分的气相色谱图,阳性pyes/ahfad2b-814转化子。
图12是ahfad2基因核苷酸突变位点特异引物在野生型普通油酸花生品种(冀花5号、冀花6号和潍花18号)和高油酸突变体(c814t)中的扩增情况。
图13是c814t突变位点ahfad2b-814的特异引物在育成高油酸花生品种中的扩增情况。
其中,
图1-3中,c16:0为棕榈酸,c18:0为硬脂酸,c18:1为油酸,c18:2为亚油酸,c20:0为花生酸,c20:1为花生酸一烯酸,c22:0为山嵛酸,c24:0为木质素酸;
图4-6中,箭头及数字表示突变差异位点及其位置;
图7-8中,kx016蛋白质序列为gap,因其编码基因存在插入突变而提前终止翻译;方框内表示突变氨基酸以及对应基因的野生型氨基酸、f435型氨基酸,最上面一行为一致序列,其上标识的数字为氨基酸残基在对应基因编码区的氨基酸位置;
图9-11中,c16:0为棕榈酸;c16:1为棕榈一烯酸;c18:0为硬脂酸;c18:1为油酸;c18:2为亚油酸;c18:3为亚麻酸;
图12中,m表示dna分子量标准,片段由上到下以此为2000、1000、750、500、250、100bp。编号a、b、c、d、e、f、g、h分别表示不同的点样孔,8个点样孔采用的dna模板和引物对组配各不相同;a和e的模板为冀花5号,b和f的模板为冀花6号,c和g的模板为潍花18号,d和h的模板为c814t;采用的引物组分别为:a、b、c、d为特异性扩增ahfad2a基因片段的ahfad2a-fo、ahfad2a-ro、ahfad2a-g和ahafd2a-a;d、e、f、g为特异性扩增ahfad2b基因片段的ahfad2b-fo、ahfad2b-ro、ahafd2b-c、ahfad2b-t引物组合;
图13中,m表示dna分子量标准,片段由上到下以此为2000、1000、750、500、250、100bp;编号1-24分别表示不同的点样孔,其中1、2分别为阴性对照冀花6号和阳性对照c814t突变体,3为h2o阴性对照,4-24个点样孔分别采用育成的高油酸花生品种(系)的基因组dna模板,依次为冀花11号(冀科成转鉴字(2013)第2-002号)、冀花13号(国品鉴花生2014005)、冀花16号(国品鉴花生2015006)、冀花18号(国品鉴花生2016009)、冀花19号(国品鉴花生2016004)、花育51(皖品鉴登字第1205005)、花育52(皖品鉴登字第1205006)、花育661(皖品鉴登字第1405002)、花育662(皖品鉴登字第1305001)、花育917(皖品鉴登字第1505012)、花育951(皖品鉴登字第1305019)、花育957(皖品鉴登字第1505024)、花育958(皖品鉴登字第1505025)、花育961(皖品鉴登字第1305010)、花育963(皖品鉴登字第1505029)、开农61(豫审花2012001)、开农71(豫审花2015002)、开农176(豫审花2013002)、开农1715(豫审花2014002)、豫花37(豫审花2015011)、中花24(国品鉴花生2015007)。所有点样孔使用的引物组为特异性扩增ahfad2b-814突变的ahfad2b-fo、ahfad2b-ro、ahafd2b-c和ahfad2b-t。
具体实施方式
本发明依据高油酸油料作物已有的研究结果,改变油酸脱氢酶(fad2)基因的表达水平,对油料作物种子的油酸含量产生显著影响。一般认为ahfad2基因是控制花生种子中油酸含量高低的重要候选基因之一。在对收集的大量资源材料进行表型精准鉴定基础上,通过近红外品质测试与气相色谱检测相结合,鉴定出高油酸花生突变体单株;通过单株的多代自交、后代分离,获得性状稳定一致的纯合株系;通过ahfad2a和ahfad2b基因克隆和测序分析,发掘出新的突变位点;通过与高产、优质、抗性强的品种杂交,采用突变位点特异引物作为选择标记,进行后代高油酸单株定向跟踪选择,获得高油酸花生新品种(系)。
下面结合实施例及说明书附图对本发明的技术方案做进一步阐述,下列实施例仅用于说明本发明,但不用来限定本发明的范围。实施例中若未特别指明,均按照常规条件或者制造厂商说明书建议的条件进行。所用试剂或者仪器未注明生产厂商者,均为可以市场购置的常规产品。
实施例1:高油酸花生突变单株的筛选与纯化
将收集的220份花生种质资源材料和创制的150份种质种植于大田,按材料种植成行,单粒播种,自交后成熟收获,按单株收获种子;第2年每个材料选取3个单株,稀植成株行种植于大田,对自交单株再次按照单株收获,种子自然风干后剥壳,采用波通(perten)da7200二极管阵列近红外分析仪检测各单株种子的脂肪酸含量,筛选出株行内单株油酸含量均在70%以上的株行9个。
利用美国agilent6890a气相色谱分析仪进一步准确检测这些株行的脂肪酸组成及含量,步骤如下:
(1)挑选适量饱满花生种子,研磨成粉末,称取约40-50mg于2ml离心管中,加入0.95ml色谱纯正己烷,超声波20min,取出加0.95ml正己烷,混合均匀,14000rpm离心10min,取上清备用。
(2)吸取上清液500μl加入2ml离心管中,再加入500μl0.4mol/lkoh-甲醇,混匀,60℃水浴20min,期间混匀颠倒4次。
(3)取出样品冷却到室温,每管加入600μl0.9%nacl水溶液,混匀,14000rpm离心10min,取上清300μl于上样瓶中,同时加入300μl正己烷,混匀进行气相色谱分析。
(4)使用附fid氢火焰离子化检测器,色谱柱hp-55%phenylmethylsiloxane:30m×320μ×0.25μ,进样口温度250℃,柱流量0.7ml/min,分流比20:1。升温程序:柱箱初始温度为150℃,以3℃/min上升到220℃,保持15min。fid温度250℃,检测器气体氢气30ml/min,空气400ml/min,尾吹氮气25ml/min,进样量2.0μl。
最终鉴定出油酸含量80%以上的单株2个,分别编号为hzy-1和hzy-2。
测定普通油酸品种冀花5号和冀花6号,以及f435型高油酸突变体kx016的脂肪酸含量,比较结果如表1所示。
表1不同花生品种(系)主要脂肪酸相对含量(%)
由表1可见,hzy-2比hzy-1的油酸含量高10.14%,比kx016、冀花5号和冀花6号的油酸含量分别高7.83%、96.46%和83.85%。气相色谱仪测试冀花6号、kx016和hzy-2的脂肪酸成分峰图如图1-3所示。
实施例2:高油酸花生油酸脱氢酶基因的突变核酸序列克隆及测序
(1)确定并获得花生高油酸性状的候选基因。
植物脂肪酸合成的生物途径已经较为清晰。已有研究证实,油酸生物合成有两条途径:一是以硬脂酸作为底物,在硬脂酰-coa脱饱和酶(sad)催化下生成油酸,该途径是油酸合成的主要途径;二是以棕榈一烯酸为底物,在脂酰-coa作用下将碳链进一步延长,生成油酸。合成的油酸一部分结合到甘油三酯的碳架上成为最终的储藏性油脂,一部分在油酸脱氢酶的作用下脱氢进一步形成具有双不饱和键的亚油酸,还有一小部分在碳链延长酶的作用下生成二十碳烯酸。此外,通过对高油酸油料作物及利用rnai方法获得高油酸花生的研究也指出,改变fad2基因的表达水平可以对花生的油酸含量产生显著影响。因此,可以认为花生fad2基因是控制花生油酸含量的重要候选基因之一。进而,通过克隆普通油酸含量花生品种、f435型高油酸品系和上述发掘出的2个高油酸花生单株中的fad2基因来探明hzy-1和hzy-2在fad2基因序列上可能存在的差异位点。
(2)高油酸花生突变体ahfad2基因克隆。
现有研究已表明,花生基因组中存在2个ahfad2等位基因,即ahfad2a和ahfad2b,分别来自花生a基因组和b基因组。利用ncbi数据库中已知的ahfad2a和ahfad2b基因序列。通过将已登录的ahfad2基因序列进行比对,发现获得的序列一致性达98%以上,ahfad2a和ahfad2b基因之间的主要区别在于后者起始密码子前-70bp处存在约8个碱基缺失,并且该基因内部无内含子,因此可以在基因编码区两侧差异区段内设计能分别特异扩增ahfad2a和ahfad2b基因全长的pcr引物,以基因组dna为模板进行pcr扩增来克隆ahfad2a和ahfad2b基因编码区序列全长。其正向引物ahfad2a-f:5′—gattactgattattgacttgctttg—3′,ahfad2b-f:5′—cagaaccattagctttgtagtagtg—3′,通用反向引物为ahfad2-r:5′—ctctgactatgcatcagaacttgt—3′。
研究使用的材料为上述发掘的高油酸单株hzy-1和hzy-2、kx016和冀花6号。采用ctab法提取幼苗叶片基因组dna,根据murray和thompson(1980)的操作并作简化,步骤如下:
(1)在2ml离心管中,加入800μl的2%ctab缓冲液和30μl的β-巯基乙醇,65℃预热。
(2)取幼嫩叶片1-2g,用蒸馏水冲洗干净,再用灭菌ddh2o冲洗2次,放入经液氮预冷的研钵中。加入液氮研磨至粉末状,用干净的灭菌不锈钢勺转移粉末到预热的离心管中,总体积达到1ml,在涡旋振荡器上充分混匀后,放置于65℃水浴中保温30-60min,不时轻轻转动离心管数次。
(3)在4℃条件下13000rpm离心15min,吸取上清液至另一个新的离心管中。
(4)加入3μlrnase(10mg/ml),37℃保温30-60min。
(5)加入等体积的氯仿/异戊醇(24:1),轻轻颠倒混匀10min,4℃下13000rpm离心10min,移上清至另一新的离心管中。
(6)再次在上清液中加入等体积的氯仿/异戊醇(24:1),轻轻地颠倒混匀10min,4℃下13000rpm离心10min,移上清至另一新离心管中。
(7)加入1/10体积的3mnaac(4℃预冷),轻轻混匀后,加入2倍体积的100%乙醇或0.7倍体积异丙醇(–20℃预冷),会出现絮状沉淀,–20℃放置30-60min或–80℃放置10min,12000rpm离心10-15min,回收dna沉淀。
(8)用70%乙醇清洗沉淀2次,吹干后溶于适量灭菌ddh2o或te中,37℃放置20-30min,使dna沉淀完全溶解。
(9)用0.8%琼脂糖凝胶电泳检测基因组dna完整性。利用epochtmmicroplatespectrophotometer检测基因组dna浓度和质量。
(10)取出5μl原液,统一稀释到20ng/μl作为工作液。
以提取的花生基因组dna为模板,利用设计的引物对进行pcr克隆4个花生材料的ahfad2a和ahfad2b基因。按北京全式金生物技术有限公司transstartfastpfudnapolymerase说明书配置20μlpcr反应体系:2×pcrmix10μl,正反向引物各1μl,基因组dna模板1μl,加入ddh2o至20μl。在bio-radt100tmpcr仪上进行扩增,扩增ahfad2a基因的反应程序为:94℃预变性5min;94℃变性30s,60℃退火30s,72℃延伸1min10s,共30个循环;72℃延伸10min。扩增ahfad2b基因的退火温度为50℃,其他程序同ahfad2a。
扩增产物用1%琼脂糖凝胶电泳分离,采用omegae.z.n.a.gelextractionkit进行dna片段回收与纯化,操作步骤按试剂盒操作说明进行。用北京天根生物技术公司的平末端加“a”反应试剂盒进行pcr产物加“a”反应后,连接于基因克隆载体pmd19-tsimplevector(购自大连takara生物技术有限公司),连接产物热激转化大肠杆菌(e.coli)感受态细胞trans5αchemicallycompetentcell(购自北京全式金生物技术有限公司)。在加有iptg、x-gal、氨苄青霉素amp的lb固体培养基上进行蓝白斑筛选,经pcr鉴定阳性单菌落,每个花生材料各挑取30个阳性克隆送华大基因科技服务有限公司测序。
(3)花生ahfad2同源基因序列分析。
测序片段使用lasergeneseqmanpro(dnastar)(http://www.dnastar.com)软件进行组装,最终获得120个基因全长序列。采用geneiouspro10软件进行同源性比对。选用普通油酸花生品种冀花6号的同源基因序列作为参考序列,比对结果如图4-6所示,表明3个高油酸花生材料hzy-1和hzy-2、kx016的ahfad2a基因在编码区的448bp处发生碱基置换g>a,使对应的蛋白序列第150残基由天冬氨酸(d)转变为天冬酰胺(n)。ahfad2b基因在3个高油酸材料中候选差异位点表现不同,其中kx016和hzy-1在起始密码子后441bp和442bp之间插入单碱基a(441_442insa),造成移码突变,使读码框在起始密码子后495位出现终止密码子;而hzy-2的突变位点在编码区的814bp处发生单个碱基置换c>t,使对应的蛋白序列第272位残基由组氨酸(his,h)转变为酪氨酸(tyr,y),故将该突变基因命名为ahfad2b-814,携带该基因的高油酸花生突变体hzy-2命名为c814t。
ahfad2b-814位点突变导致氨基酸突变的位置如图7-8所示。花生ahfad2b基因非常保守,除了上述差异位点外,所测花生材料该基因的其他核苷酸序列没有差异。
实施例3:高油酸花生ahfad2b新型突变基因在酿酒酵母中的表达及功能分析
上述花生ahfad2基因属内质网油酸脱氢酶,其功能分析的宿主首选是酵母,因为酵母中含有此类脱氢酶所需的电子传递系统和适宜的膜环境,而酿酒酵母(saccharomycescerevisiae)由于缺乏δ12(ω-6)和ω-3脂肪酸脱氢酶,不能产生内源多不饱和脂肪酸,细胞内脂肪酸成分简单,是外源脂肪酸脱氢酶基因最理想的表达系统。invsci/pyes2.0是常用的表达外源脂肪酸脱氢酶的酿酒酵母表达系统。
根据酿酒酵母表达载体pyes2.0的多克隆位点,分别在引物的5′端引入kpni和ecori的酶切位点设计ahfad2基因特异引物,其中正向引物pf1:5′—ggtaccatgggagctggagggc—3′,反向引物pr1:5′—gaattctcagaacttgttcttgtac—3′。采用获得的目的基因单克隆菌液为模板,以pf1-pr1引物对pcr扩增目的基因编码区,反应体系:2×pcrmix10μl,正反向引物各1μl,dna模板菌液1μl,加入ddh2o至20μl。扩增程序为:94℃预变性5min;94℃变性30s,65℃退火30s,72℃延伸30s,共30个循环;72℃延伸5min。扩增产物纯化后,经限制性内切酶kpni和ecori消化,与经相同酶消化后的pyes2.0连接,分别构建成酵母表达载体pyes2/ahfad2a和pyes2/ahfad2b。构建的载体经测序和酶切验证已正确插入pyes2.0中。此外,以pyes2.0空载体为阴性对照,将连接产物及阴性对照载体质粒各10μl加到制备好的invsci酵母菌(matαhis3-δ1leu2trp1-289ura3-52,invitrogen公司)感受态细胞中,混匀,冰上静置5min,1500v电转化,加入1ml预冷的山梨醇30℃复苏2-3h,离心后涂布含有0.05%his和0.01%trp和leu的md平板,30℃培养3d。接种鉴定的阳性单克隆至md(含0.05%his和0.01%trp和leu)培养基中,30℃过夜培养。将过夜培养菌株接种到250ml三角瓶内的50ml含2%半乳糖的md培养基中,参考invitrogen公司操作手册所示方法使od600达到0.4。30℃和120rpm条件下诱导培养72h后,以2000×g离心10min,弃去上清液,用去离子水洗涤2次,接着用石油醚-乙醚(1:1)洗涤2次除去菌体上粘附的脂肪酸。将细胞冻干后加入1m甲醇盐酸,在80℃反应3h后加入等体积的石油醚-乙醚(1:1)。采用气相色谱方法分析样品脂肪酸成分及含量。
表2酿酒酵母转化子脂肪酸组成分析
图9-11为不同来源的花生ahfad2基因在酿酒酵母中表达,引起酵母体内脂肪酸成分和含量变化的气相色谱分析图。在阳性转化子的脂肪酸色谱图中均具有c16:2和c18:2的特异脂肪酸峰,而在阴性对照pyes2.0转化子的色谱中则没有这2个特异脂肪酸峰,说明这些fad2均具备油酸脱氢酶功能,但是在酵母体系中花生ahfad2a和ahfad2b突变型和野生型基因编码酶催化生成亚油酸的量存在差异,具体数值如表2所示,其中转化子pyes2/ahfad2b-814的亚油酸含量仅为野生型ahfad2a和ahfad2b基因转化子的50.5%和46.5%,比f435型ahfad2a和ahfad2b突变基因转化子亚油酸含量分别减少3.82%和24.30%。另外,去饱和率是衡量脱氢酶活性的重要指标,去饱和率(%)=产物含量/(产物含量+底物含量)×100%。本研究中野生型ahfad2a和ahfad2b、f435突变型ahfad2a-448和ahfad2b-442以及新型突变ahfad2b-814基因的酵母转化子中c18:1的脱氢去饱和率分别为20.20%、21.35%、10.32%、13.49%、9.50%,说明ahfad2b-814的编码的突变型ahfad2b脱氢酶活性最低。因此,我们研究的新型高油酸花生突变体c814突变基因ahfad2b-814在降低油酸向亚油酸的催化活性中起着更为重要的作用。
实施例4:高油酸花生突变体c814t突变位点与高油酸含量的相关性分析
(1)油酸含量f2分离群体构建及群体单株油酸含量测定。
通过将发掘的高油酸花生突变体c814t与普通油酸含量品种杂交,后代进行自交获得f2性状分离单株。具体为:于2015年6月花生开花期利用高油酸突变体c814t为父本,分别与普通油酸含量品种冀花6号和潍花18号组配杂交组合,采用套龙骨瓣杂交授粉技术进行有性杂交,当年10月初收获杂交果(f0),获得不同遗传背景的杂交种子,“冀花6号×c814t”组合获得26个杂交果(44粒种子),“潍花18号×c814t”组合获得43个杂交果(71粒种子)。2016年5月在石家庄鹿泉区三五零二农场花生育种基地种植f1,单粒播种,自交繁殖,淘汰伪杂株,当年9月中旬成熟后分组合按单株收获,不做任何选择,分别晾晒,2个组合分别获得38和62个单株。2017年5月按株行分别种植f1单株种子,单粒播种,成熟后不做任何选择,仍按单株收获,2个组合分别获得1071和1835个单株。
该2个杂交组合f2单株荚果剥壳后,分别选取各单株饱满籽仁,采用da7200近红外分析仪小样品盘测试其脂肪酸含量。群体f2单株油酸含量测试结果如表3所示。
表3“冀花6号×c814t”(f2-a)和“潍花18号×c814t”(f2-b)f2单株油酸含量
(2)新突变位点与油酸含量相关性验证
根据群体测试结果,分别从以上2个群体中选择高值和低值两种极端表型的个体组成表型组,即选择10个油酸含量在各自组合中最高的单株(油酸含量均在80%以上)构建高油酸表型组,选取10个油酸含量最低的单株(油酸含量均在43%以下)组成低油酸表型组。分别从选择的单株种子中随机取5粒在培养箱内发芽获得单株叶片,按单株将叶片混合液氮中研磨,采用改良ctab法提取基因组dna,以引物对ahfad2a-f/ahfad2-r和ahfad2b-f/ahfad2-r进行pcr扩增各单株的ahfad2a和ahfad2b基因序列,克隆测序获得基因编码区全长序列。
将获得的序列进行比对,结果发现,在2个不同遗传背景的高油酸表型组单株和低油酸表型组单株中均出现相同的差异位点,即高油酸表型组单株的ahfad2a基因的448bp位点均为a,而低油酸表型组单株的ahfad2a基因的448bp位点处均为g;高油酸表型组单株的ahfad2b基因的814bp位点均为t,而低油酸表型组单株的ahfad2b基因的814bp位点处均为c。由此可见,高油酸表型组ahfad2a基因448bp位点的a和ahfad2b基因814位点的t均为高值表型组的高值基因型,而低油酸表型组均不具有该基因型。综上分析,ahfad2b基因c814t是高油酸单株的特异突变位点。
实施例5:ahfad2b-814突变位点的特异引物开发与应用
为了准确鉴定c814t突变体ahfad2b基因突变位点与高油酸性状的关系,我们根据ahfad2a和ahfad2b基因序列中存在2个突变位点的序列特征,设计开发了分别检测2个基因组同源基因突变位点的特异引物来准确的进行基因型鉴定。
设计的用于检测ahfad2a基因g448a突变的引物如下:
ahfad2a-fo:5′—agtgagaatgcagccttggatg—3′
ahfad2a-ro:5′—tgtgagtgtgatgaagagggag—3′
ahafd2a-a:5′—accggttccctcgacctca—3′
ahfad2a-g:5′—ggttttgggacaaacacttcttc—3′
设计的用于检测ahfad2b基因c814t突变的引物如下:
ahfad2b-fo:5′—catatctgctatatcacatagcaactt—3′
ahfad2b-ro:5′—ggcttctctccacaatgctttgtaaac—3′
ahafd2b-c:5′—agttaccataacctatttgcagcacaaac—3′
ahfad2b-t:5′—gaatcatagtgaggcaatgatgccta—3′
其中ahfad2a-fo/ahfad2a-g引物对能对花生ahfad2a野生型基因的448bp位点碱基g进行特异pcr扩增,扩增片段为210bp;ahafd2a-a/ahfad2a-ro引物对能对ahfad2a突变型基因的448bp位点碱基a进行特异pcr扩增,扩增片段为120bp;ahafd2a-fo/ahfad2a-ro引物配对能对ahfad2a野生型和突变型基因包括448bp位点在内的片段进行特异pcr扩增,扩增片段为267bp,该片段实际上起到了阳性对照的作用,可降低非特异pcr产物的扩增和引物二聚体形成。pcr扩增反应体系(20μl):含1μl基因组dna模板(20ng/μl),2μl10×buffer、1.5μlmgcl2、2μldntp(2.5mmeach)、0.3μltaq酶(0.5u)、ahafd2a-a和ahfad2a-g引物各1.0μl、ahafd2a-fo和ahfad2a-ro引物各0.1μl,11μlddh2o。以上扩增ahfad2a基因特异片段的反应程序为:94℃预变性5min;94℃变性30s,65℃退火30s,72℃延伸1min10s,共35个循环;72℃延伸10min。同样组配扩增ahfad2b基因特异突变位点引物,其中ahafd2b-c/ahfad2b-ro引物对能对ahfad2b野生型基因的814bp位点碱基c进行特异pcr扩增,扩增片段为280bp;ahfad2b-fo/ahfad2b-t引物对能对花生ahfad2b突变型基因的814bp位点碱基t进行特异pcr扩增,扩增片段为145bp;ahafd2b-fo/ahfad2b-ro引物配对能对ahfad2b野生型和突变型基因包括814bp位点在内的片段进行特异pcr扩增,扩增片段为371bp,作为阳性对照。pcr反应体系同上,但引物对使用本发明所述个片段特异性引物。扩增ahfad2b基因特异片段的反应程序为:94℃预变性5min;94℃变性30s,59℃退火30s,72℃延伸1min10s,共35个循环;72℃延伸10min。
用上述扩增a基因组和b基因组的4个引物链分别组成的3对引物对可在1个pcr反应中进行扩增(巢式pcr),扩增产物用凝胶电泳检测,出现2条带的是纯合型(g/g、a/a、c/c或t/t),出现3条带的是杂合型(g/a或者c/t)。
如图12是以上6对引物对普通油酸含量的具野生型ahfad2的冀花5号、冀花6号和潍花18号以及高油酸突变体c814t的基因组dna进行pcr扩增的结果。从图12中可以看出,ahfad2a-fo/ahfad2a-g和ahafd2b-c/ahfad2b-ro引物对仅能对野生型(冀花6号)扩增出条带,表明其在ahfad2a的448bp位点和ahfad2b的814bp位点处分别为g和c碱基;ahafd2a-a/ahfad2a-ro和ahfad2b-fo/ahfad2b-t引物对仅能对突变型(c814t)扩增处条带,表明其在ahfad2a的448bp位点和ahfad2b的814bp位点处分别为a和t碱基;ahafd2a-fo/ahfad2a-ro和ahafd2b-fo/ahfad2b-ro引物对作为阳性对照,在所有材料中均能扩增出条带。综上表明,与野生型普通油酸含量花生品种相比,高油酸突变体b基因组中具有特异的在814bp位点处存在t碱基。由此,我们成功开发出了针对含有ahfad2b-814新型突变位点和同时存在ahfad2a-448突变的高油酸花生基因型检测特异引物。
应用上述针对突变位点的特异引物对,对f2群体单株的基因型进行了大规模分子鉴定,从中鉴定出特异位点纯合的单株75个(f2-a)和128个(f2-b)。经卡方检验,符合2对隐性基因控制的性状遗传规律,即f2双隐性纯合子(aabb)分离比例为15:1。
该引物对可用于大规模筛选高油酸单株,同时也可集合微阵列凝胶电泳技术,使检测效率提高,实现碱基突变的高通量检测,大大提高高油酸花生育种性状鉴定的准确性,加快育种进程,为分子标记辅助选择高油酸杂交后代提供了可靠的技术手段。
实施例6:杂交后代单株基因分型与油酸含量的验证
采用ahfad2a基因448bp位点和ahfad2b基因814bp位点均为野生型的普通油酸含量花生品种冀花5号与新型高油酸花生突变体c814t组配杂交组合“冀花5号×c814t”,采用系谱法选择并异地南繁加代的方法获得f3:4后代群体,该群体包含602个单株。采用近红外光谱仪测定单株饱满种子的脂肪酸相对含量,采用ctab法提取单株基因组dna,利用上述设计的针对油酸脱氢酶基因突变位点的8个引物组配6对引物对进行pcr扩增,根据扩增结果带型确定单株的ahfad2a和ahfad2b基因型。将基因型与油酸含量进行比较列于表4。
由表4结果我们发现,(1)在ahfad2a各种背景下,ahfad2b-814突变位点均与高油酸性状高度相关,如aa背景下ahfad2b基因型从bb、bb至bb,油酸含量分别从40.83%、50.59%升高66.39%;(2)在同一ahfad2a背景下,ahfad2b-814突变位点纯合体单株油酸含量大于杂合体油酸含量,而该位点不突变的纯合体单株油酸含量最低;(3)ahfad2a和ahfad2b突变位点综合影响油酸含量,随突变位点(碱基)个数的增多,油酸含量也随之提高,无突变野生型(aa:bb)油酸含量34.81%,1个碱基突变(aa:bb或aa:bb)基因型的油酸含量平均为35.79%,2个碱基突变(aa:bb、aa:bb或aa:bb)基因型的油酸含量平均为41.40%,3个碱基突变(aa:bb或aa:bb)基因型的油酸含量平均为51.08%,4个碱基全部突变(aa:bb)的油酸含量为66.39%;(4)在ahfad2a或ahfad2b有一方发生突变的背景下,ahfad2b-814突变对油酸含量的提高幅度高于ahfad2a-448突变,即aa:bb基因型(油酸含量41.72%)比aa:bb基因型(40.83%)油酸含量高2.19%,aa:bb基因型(36.42%)较aa:bb基因型(35.16%)油酸含量高3.57%。
以上结果表明,ahfad2b的pcr分型结果与油酸含量变化一致,进一步验证了本发明所述的核苷酸位点对提高油酸含量作用明显,开发的ahfad2b-814突变位点特异引物可以用来指示花生高油酸含量性状。
表4“冀花5号×c814t”后代单株ahfad2基因核苷酸突变位点与油酸含量相关性
注:a和b分别表示ahfad2a和ahfad2b野生基因型;a和b分别表示ahfad2a和ahfad2b突变基因型。
实施例7:新型突变位点在已有高油酸花生品种中的特异性分析
为了证实ahfad2b-814突变位点在其他花生品种中是否具有特异性,我们以来自全国不同花生育种单位选育的高油酸品种的基因组dna为模板,以开发的针对该特异核苷酸突变位点的特异引物进行pcr。在扩增过程中,以冀花6号和h2o为阴性对照,以突变体c814t为阳性对照,设置反应体系和反应条件,获得预期的扩增结果,如图13所示。表明在选择的21个高油酸花生品种中均未出现本发明所述ahfad2b-814突变位点,进一步证明了本发明突变位点不同于经典的f435型突变,具有特异性。
sequence listing
<110>河北省农林科学院粮油作物研究所
<120>一种高油酸花生突变基因ahfad2b-814及应用
<160>15
<170>pstentinversion3.5
<210>1
<211>1323
<212>dna
<213>arachishypogaea
<400>1
acggccgccagtgtgctggaattgcccttcagaaccattagctttgtagtagtgcaaagt60
gctaactctttctttctacattggtaacaggagctttaacaacacaacaatgggagctgg120
agggcgtgtcactaagattgaagctcaaaagaagcctctttcaagggttccacattcaaa180
ccctccattcagtgttggccaactcaagaaagcaattccaccacattgctttgaacgttc240
tcttttcatatcattctcatatgttgtctatgatctcttaatggcctacttactcttcta300
cattgccaccacttatttccacaagcttccatacccattttccttccttgcttggccaat360
ctattgggccatccaaggctgcattctcaccggtgtttgggtgattgctcatgagtgtgg420
ccaccatgccttcagcaagtaccaacttgttgatgacatggttggtttgacccttcactc480
ttgtctattagttccttatttctcatggaaaatcagccaccgccgccaccactccaacac540
aggttccctcgaccgcgacgaagtgtttgtcccgaaaccaaaatcaaaggtatcatggta600
taacaagtacatgaacaatccaccagggagggctatttcccttttcatcacactcacact660
aggatggcccttgtacttggccttcaatgtttctggcagaccctatgatagatttgcaag720
ccactatgacccttatgctcccatatactctaacagggaaaggcttctaatttatgtctc780
agattcatctgtctttgctgtaacatatctgctatatcacatagcaactttgaaaggttt840
gggttgggtggtatgtgtttatggggtgccattgctcattgtgaatgggtttctagttac900
cataacctatttgcagcacacatatgcatcattgcctcactatgattcatccgaatggga960
ctggttaagaggagcattggcaacagtggacagagattatgggatactgaataaggcatt1020
tcatcatataactgatacgcatgtggctcatcatttgttctcaacaatgcctcattacca1080
tgcaatggaagcaaccaatgcaataaagccaatattgggtgattactaccaatttgatgg1140
caccccagtttacaaagcattgtggagagaagccaaagagtgcctctatgtggagccaga1200
tgatggagcttctcagaagggtgtttattggtacaagaacaagttctgatgcatagtcag1260
agaagggcaattctgcagatatccatcacactggcggccgctcgagcatgcatctagagg1320
gcc1323
<210>2
<211>379
<212>prt
<400>2
metglyalaglyglyargvalthrlysileglualaglnlyslyspro
151015
leuserargvalprohisserasnpropropheservalglyglnleu
202530
lyslysalaileproprohiscysphegluargserleupheileser
354045
phesertyrvalvaltyraspleuleumetalatyrleuleuphetyr
505560
ilealathrthrtyrphehislysleuprotyrpropheserpheleu
65707580
alatrpproiletyrtrpalaileglnglycysileleuthrglyval
859095
trpvalilealahisglucysglyhishisalapheserlystyrgln
100105110
leuvalaspaspmetvalglyleuthrleuhissercysleuleuval
115120125
protyrphesertrplysileserhisargarghishisserasnthr
130135140
glyserleuaspargaspgluvalphevalprolysprolysserlys
145150155160
valsertrptyrasnlystyrmetasnasnproproglyargalaile
165170175
serleupheilethrleuthrleuglytrpproleutyrleualaphe
180185190
asnvalserglyargprotyraspargphealaserhistyrasppro
195200205
tyralaproiletyrserasnarggluargleuleuiletyrvalser
210215220
aspserservalphealavalthrtyrleuleutyrhisilealathr
225230235240
leulysglyleuglytrpvalvalcysvaltyrglyvalproleuleu
245250255
ilevalasnglypheleuvalthrilethrtyrleuglnhisthrtyr
260265270
alaserleuprohistyraspserserglutrpasptrpleuarggly
275280285
alaleualathrvalaspargasptyrglyileleuasnlysalaphe
290295300
hishisilethraspthrhisvalalahishisleupheserthrmet
305310315320
prohistyrhisalametglualathrasnalailelysproileleu
325330335
glyasptyrtyrglnpheaspglythrprovaltyrlysalaleutrp
340345350
argglualalysglucysleutyrvalgluproaspaspglyalaser
355360365
glnlysglyvaltyrtrptyrlysasnlysphe
370375
<210>3
<211>27
<212>dna
<213>arachishypogaea
<400>3
catatctgctatatcacatagcaactt27
<210>4
<211>27
<212>dna
<213>arachishypogaea
<400>4
ggcttctctccacaatgctttgtaaac27
<210>5
<211>29
<212>dna
<213>arachishypogaea
<400>5
agttaccataacctatttgcagcacaaac29
<210>6
<211>26
<212>dna
<213>arachishypogaea
<400>6
gaatcatagtgaggcaatgatgccta26
<210>7
<211>22
<212>dna
<213>arachishypogaea
<400>7
agtgagaatgcagccttggatg22
<210>8
<211>22
<212>dna
<213>arachishypogaea
<400>8
tgtgagtgtgatgaagagggag22
<210>9
<211>19
<212>dna
<213>arachishypogaea
<400>9
accggttccctcgacctca19
<210>10
<211>23
<212>dna
<213>arachishypogaea
<400>10
ggttttgggacaaacacttcttc23
<210>11
<211>25
<212>dna
<213>arachishypogaea
<400>11
gattactgattattgacttgctttg25
<210>12
<211>25
<212>dna
<213>arachishypogaea
<400>12
cagaaccattagctttgtagtagtg25
<210>13
<211>24
<212>dna
<213>arachishypogaea
<400>13
ctctgactatgcatcagaacttgt24
<210>14
<211>22
<212>dna
<213>arachishypogaea
<400>14
ggtaccatgggagctggagggc22
<210>15
<211>25
<212>dna
<213>arachishypogaea
<400>15
gaattctcagaacttgttcttgtac25
- 还没有人留言评论。精彩留言会获得点赞!