一种三维肿瘤球培养基添加剂、培养基以及三维肿瘤球培养方法与流程
发明涉及生物领域,具体涉及一种制备肿瘤球的培养基及其肿瘤球大量三维(3d)制备的方法。
背景技术
肿瘤干细胞(cancerstemcells)理论认为肿瘤组织中有一群具有干细胞性质的肿瘤细胞,它们才是肿瘤发生、发展、复发、转移的根本原因。肿瘤球培养是目前最为常用的培养和富集肿瘤干细胞、鉴定细胞干性能力的方法。都是在无血清和非贴壁环境(超低粘附皿)下进行培养,经一周左右培养其中部分具有“干性”特征细胞形成肿瘤球。培养方案有多种,如经典的dmem/f12+20ng/mlegf+20ng/mlfgf+2%b27方案。具体所添加的成分包括:表皮生长因子(egf)、成纤维细胞生长因子(fgf)、白细胞抑制因子(lif)、b27、胰岛素、转化生长因子-β(tgf-β)等。
现有技术所采用的传统的肿瘤球培养法容易发生聚集、粘附、成团,失去肿瘤球单细胞来源的特征,且肿瘤球培养量少,费用高,操作难度大。
技术实现要素:
本发明的一个目的在于,提供一种三维(3d)肿瘤球培养基添加剂。
本发明的第二个目的在于,提供一种三维肿瘤球培养基。
本发明的第三个目的在于,提供一种三维肿瘤球培养方法。
根据本发明的一个方面,提供一种三维肿瘤球培养基添加剂,其由增稠剂和凝胶剂组成;
发明人认为传统细胞悬浮培养基中,由于在非贴壁环境下,细胞生长中无附着点,在外界微小作用力下便会出现移动进而导致聚集、粘附、成团。由于肿瘤球容易聚集、粘附因此在实际的应用中常通过降低细胞接种数量来较少以上现象;这就导致培养的肿瘤球量比较少。而本发明意外的发现通过加入增稠剂和凝胶剂两种生物材料就能实现高密度、大量培养肿瘤球的目的。
增稠剂可增加培养基黏度从而限制肿瘤球在各方向上的运动,凝胶剂具有促凝胶作用使培养基产生一定硬度进而控制肿瘤球的沉降速度,产生3d培养的效果。
进一步地,增稠剂选自甲基纤维素(mc)、乙基纤维素、基底膜基质、胶原蛋白中的一种或多种的组合;凝胶剂选自结冷胶、海藻酸或琼脂糖凝胶中的一种或多种的组合;
再进一步地,所述增稠剂与凝胶剂的质量比例为1-100:1,优选为5-15:1,更优选为10:1;
使用添加剂时,所述增稠剂与培养基的质量体积比为0.1-0.5%,优选为0.3%;凝胶剂与培养基的质量体积比为0.01%-0.05%,优选为0.03%。
根据本发明的又一个方面,提供了一种三维肿瘤球的培养基,其包括肿瘤细胞培养基和前述的三维肿瘤球培养基添加剂,所述肿瘤细胞培养基选自本领域常用的任意细胞培养基,优选为无血清肿瘤球培养基;
进一步地,本发明的三维肿瘤球的培养基为在dmem/f12中加入egf、fgf、b27、0.3%的甲基纤维素(mc)和0.03%结冷脚(gg)制成;
再进一步地,本发明的三维肿瘤球的培养基为在dmem/f12中加入20ng/ml的egf、20ng/ml的fgf、2%的b27(将商品b27溶液按照体积1:50添加)、0.3%的甲基纤维素(mc)和0.03%结冷胶(gg)制成;
本发明所述三维肿瘤球培养基的制备方法包括如下步骤:
1)配制三维肿瘤球培养基添加剂:分别以水溶解增稠剂和凝胶剂,配制成无菌的增稠剂水溶液和凝胶剂水溶液;
2)配制悬浮培养三维肿瘤球的培养基:将增稠剂水溶液、凝胶剂水溶液和肿瘤细胞培养基混合,得到悬浮培养三维肿瘤球的培养基。
其中,步骤1)中的增稠剂配制为0.1g/ml-0.5g/ml(优选为0.3g/ml),凝胶剂配制为0.01g/ml-0.05g/ml(优选为0.03g/ml)。
根据本发明的再一个方面,提供了三维肿瘤球培养的方法,其包括如下步骤:
ⅰ将肿瘤细胞消化并计数,并将消化好的肿瘤细胞接种到种到前述三维肿瘤球培养基中,
ⅱ培养肿瘤细胞至培养基变黄后离心法更换培养基,其后培养至肿瘤球完全形成;
其中,步骤ⅰ中所述消化好的肿瘤细胞密度为103-105cells/ml,显著高于传统培养基接种数量(103cells/ml);
其中,细胞培养于培养瓶或培养皿中,培养条件,37℃,5%co2。
其中,更换培养基过程为:
1)收集含有肿瘤球的培养基至离心管中,并加入等体积dmem溶液进行稀释;
2)离心机离心;
3)去除旧培养基,加入新的培养基。
其中,获得的肿瘤球的直径为超过100微米。
有益效果:
本发明的培养基添加剂,能改变传统培养基性质,并对肿瘤球观察、计数、统计,结果显示新技术可明显降低肿瘤球聚集、粘附、融合,并在培养瓶中实现高密度、大量培养,实现对肿瘤干细胞的富集培养,并且不降低肿瘤球的细胞干性,在多种细胞系中均得到良好的效果。
附图说明
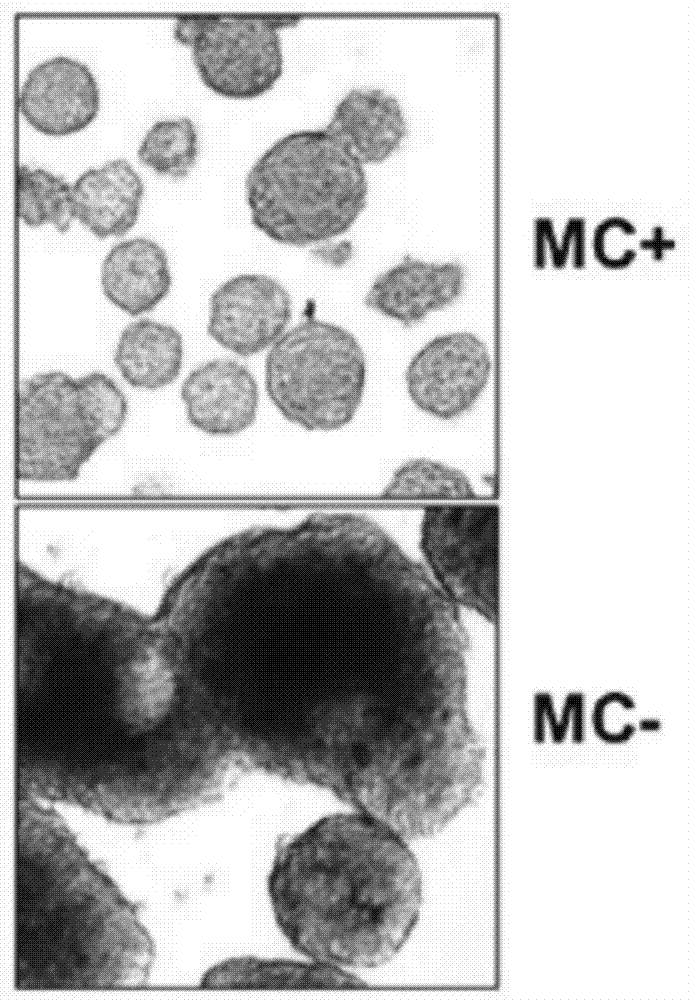
图1mc对培养基中肿瘤球聚集融合的影响
图2gg对培养基中肿瘤球沉降的影响
图3本申请3d培养基中5-8f肿瘤球形成过程
seedingcells:接种细胞;mediumchange:更换培养基;
图4其它癌细胞系在本申请3d培养基中形成的肿瘤球
图5本申请3d培养基和传统培养基形成的肿瘤球的干性相关基因转录水平比较
其中,纵座标表示mrna表达倍数改变
图6本申请3d培养基和传统培养基形成的肿瘤球的干性相关蛋白表达水平比较
从左至右,各泳道分别为贴壁细胞、传统培养基形成的肿瘤球、本申请3d培养基形成的肿瘤球
具体实施方式
可通过下面的实施例来更好地了解本发明,其用于说明目的,但不用来限制本发明权利要求。本发明申请所使用试剂材料均为市售。
本申请使用的癌细胞系:人鼻咽癌细胞系5-8f、人鼻咽癌细胞系sune1、人大细胞肺癌细胞系h460、人结肠癌细胞系sw480。上述细胞系来源于凯基生物有限公司。
本申请使用的细胞生长因子egf、fgf以及b27均购自美国peprotech公司。
实施例13d培养用生物材料的选择
将多种待测生物材料(甲基纤维素(mc)、结冷胶(gg)、基底膜基质、胶原蛋白、海藻酸和琼脂)分别以相同的浓度,添加到传统培养基(dmem/f12+egf20ng/ml+fgf20ng/ml+b272%)中配制成3d培养基,以10000cells/ml人鼻咽癌5-8f细胞接种,培养一周后观察肿瘤球培养效果,主要观察指标抗粘附能力、抗沉降能力、样品处理难度及配制费用。综合评价结果见表1。
表1.多种生物学材料的特征。
培养基中添加0.3%mc能有效抑制5-8f肿瘤球的融合,防止如图1所示,含mc培养基中正常粒径的肿瘤球比例远大于不含mc培养基的。5-8f肿瘤球的融合速率从15.8±3.9下降到2.9±1.0%,而类似地,h460肿瘤球的融合速率从19.7±4.0下降到3.4±0.7%,因此mc能有效抑制肿瘤球自发融合。
培养基中添加0.03%gg能有效防止肿瘤球沉降,如图2所示,不含gg的培养基中几乎看不到悬浮肿瘤球,而含gg的培养基中肿瘤球悬浮状况良好,按照3d分布。
实施例2配制培养3d培养系统培养基
3d肿瘤球培养系统的方案:dmem/f12+egf20ng/ml+fgf20ng/ml+b272%+甲基纤维素(mc)0.3%+结冷脚(gg)0.03%。
mc和gg保存液的配制:将3gmc和0.3ggg粉末分别溶于100ml的三蒸水中,常温下使用磁力搅拌器充分搅拌48小时,使纤维成分充分溶解;混匀后置于高压蒸汽灭菌器中,160℃,大于2小时,以去除内毒素,灭菌后温度降至室温,用力震荡反复多次,直至无凝块为止,置4℃备用,或者分装后-20℃保存。
3d培养系统中培养基的配制:首先配制传统的肿瘤球培养基500mldmem/f12+egf20μg+fgf10μg+b2710ml;再次加入55ml配制好的mc溶液和5ml配置好的gg溶液;最终3d肿瘤球培养基配制完成。
实施例3应用3d培养基大量制备肿瘤球。
肿瘤球培养过程:
1.将生长状态良好的目的人鼻咽癌5-8f细胞消化并计数;
2.根据实验目的将一定数量(根据研究目的,103-105cells/ml)的细胞接种到3d培养基中,于培养瓶或培养皿中培养,37℃,5%co2。
3.3d培养系统的换液:在肿瘤球培养的第3-5天,进行培养基更换,以溶液变黄为基本判断准则。
换液过程:1)收集含有肿瘤球的3d培养基至离心管中,并加入等体积dmem溶液进行稀释;
2)离心机离心200g,离心10分钟;
3)去除旧培养基,加入新的培养基。
4.经5-7天后可观察到直径超过100μm的肿瘤球的形成,加入等体积dmem溶液,离心,获取肿瘤球,进行下游研究。
如图3所示,在培养的头两天,由于非粘附的悬浮培养环境,出现一些细胞调亡,5天后,肿瘤球的粒径达到50-100μm。7天后,肿瘤球粒径达到100-200μm,并且肿瘤球的粒径均一,形状圆滑,融合的情况较少。
而如图4所示,sune1、h460和sw480细胞系在本申请3d培养基也能形成理想的肿瘤球。
实施例4本申请3d培养基形成的肿瘤球和传统培养基形成的肿瘤球的性质比较
4.1cd133检测
方法:使用抗cd133-藻红蛋白抗体(miltenyibiotecgmbh,
bergischgladbach,germany,catalogno.130-080-801,1:10)检测细胞培养物。收获贴壁细胞和肿瘤球,通过胰蛋白酶分解为单细胞悬浮液,并在4℃下在黑暗中用cd133-pe染色30分钟。使用流式细胞仪检测染色细胞,使用flowjo软件7.6进行数据分析。
对5-8f细胞和h460细胞进行试验,传统培养基和本申请3d培养基获得的肿瘤球所表达的cd133量相同,都是亲本贴壁细胞所表达的cd133量的4倍。
4.2干性相关基因检测
方法:使用rnaisoplus试剂(takarabio,inc.,otsu,japan)提取贴壁细胞和肿瘤球细胞总rna。通过紫外分光光度计(thermonanodrop2000,thermofisherscientific,inc.,waltham,ma,usa)测定rna的浓度。然后使用primescriptrt试剂盒(takarabio,inc。),根据说明书,进行rt。随后,使用sybrgreenrt-qpcrmastermix(takarabio,inc.)进行定量pcr。用于八聚体结合转录因子4(oct-4)、(性别决定区y)-box2(sox2)、nanog和gapdh的引物序列列于在表i中。gapdh用作参考基因。pcr反应涉及在95℃下初始变性2分钟,然后在95℃下保持15秒进行42个循环,在60℃下保持30秒,然后进行最后的孵育,在72℃下持续30秒。
检测了5-8f细胞和h460细胞,如图5所示,传统培养基和本申请3d培养基形成的肿瘤球的干性相关基因转录水平近似。
4.30干性相关蛋白检测
方法:对肿瘤球以200×g离心5分钟除去培养基、pbs洗涤并在室温下收集在ep管中。接下来,用4%多聚甲醛将肿瘤球固定在ep管中。加入兔抗人类一抗,包括sox2(ab97959;1:1,000)、oct4(ab19857;1:200)和nanog(ab109250;1:200;均来自abcam),4℃震荡孵育培养过夜。随后用pbs清洗洗肿瘤球三次,添加与cy3结合的山羊抗兔二抗(p0183;beyotimeinstituteofbiotechnology;;1:1,500),将肿瘤球在室温下孵育1小时。dapi用于核染色(蓝色)。荧光显微镜观察图像。
检测了5-8f细胞和h460细胞,如图6所示,传统培养基和本申请3d培养基形成的肿瘤球的干性相关蛋白表达水平近似。
- 还没有人留言评论。精彩留言会获得点赞!