一种热稳定性壳聚糖酶的制备方法与流程
本发明属于微生物基因工程领域,涉及一种热稳定性壳聚糖酶的制备方法。
背景技术
壳寡糖是目前自然界中发现的唯一一种碱性氨基寡聚糖,是一种动物性纤维素。由于其可溶性好,具有较强的阴离子交换能力,以及高的生物活性,壳寡糖已经被广泛应用于医药、食品、农业、化工等领域。而目前壳寡糖的制备主要有物理、化学和生物方法。物理方法简单易操作,但是很难控制特定分子量的壳寡糖的生产,原材料浪费严重。化学法反应迅速,但是反应条件苛刻,成本高,对环境的污染不容忽视。相对而言,生物法简单,无需额外的药品添加,反应条件和成本低。生物法的关键就是利用壳聚糖酶特异催化壳聚糖β-1,4-糖苷键的活性,反应过程温和,成本低,无单糖的产生。
目前已经在很多微生物中分离纯化到壳聚糖酶,其酶学性质和发酵条件的优化也取得了很大的进展。但是由于产酶菌株产酶量及酶活性普遍较低,难以规模化生产和广泛应用。因此继续筛选酶活性高,并通过基因工程的方法提高产酶量是充分发挥壳聚糖酶在壳寡糖工业生产中应用的关键。本发明从本实验室筛选到的一株具有高壳聚糖酶活性的菌株中克隆到了一个壳聚糖酶基因,该酶反应条件温和,常温酶活持久,本发明运用基因工程手段实现了该壳聚糖酶的高效稳定表达。
技术实现要素:
本发明的目的在于提供一种热稳定性壳聚糖酶的制备方法。本发明方法如下步骤:
一、高催化活性,常温酶活性持久的壳聚糖酶基因的克隆。
1、壳聚糖酶bmcsn部分序列的获得
具有高壳聚糖酶催化活性的菌株来自于烟台海岸带沙质土壤中,菌株分类鉴定为bacillusmojavensis,该菌株已经收藏于中国工业微生物菌种保藏中心,保藏号为cgmccno.7187。由于b.mojavensis的基因组序列尚未公布,利用同样来自于芽孢杆菌属其它壳聚糖酶的序列比对设计简并性引物,上游引物bmcsn-partialf为5’-gaaagcgatgacata(c)agcaa-3’(seqidno.1),下游引物bmcsn-partialr为5’-acacgggcaaca(t/c)gattctctcc-3’(seqidno.2),获得b.mojavensis壳聚糖酶的部分序列bmcsn-partial(seqidno.3)。测序结果显示该部分序列为壳聚糖酶bmcsn的部分序列,序列信息如下:
gaaagcgatgacatcagcaatctcaagggattcgcttccgcctgggagtcgcttggaaatgataaggaattccgcgctgctcaagacgcagtaaatgacagcttgtattatcagcctgccatgaaacgatccgatcatgccggactgaaaacggcactggcaagagctgtgatgtacgatacagttattcagcatggcgatggtgatgaccccgactccttttatgccttgatcaaacgcacgaacaaaaaagcgggcggttcacctaaagacggaattgatgagaagaaatggttacatgaattcttggatgtgcgatatgacgacctgatgaatccggcagatcctgacacccgtgatgagtggagagaatc
2、染色体步移法获得bmcsn的全长序列信息
染色体步移法的具体步骤如下:
5’未知序列的获取:根据bmcsn基因的已知序列设计3条高退火温度的特异性下游引物sp1:5’-actgcgtcttgagcagcgcggaattcc-3’(seqidno.4)、sp2:5’-tatcatttccaagcgactcccaggcgg-3’(seqidno.5)、sp3:5’-tgctgatgtcatcgctttcttcttcgg-3’(seqidno.6),同时使用试剂盒中低退火温度的简并引物ap1、ap2、ap3、ap4中的一种,利用特异性引物与简并引物之间退火温度的差异进行热不对称pcr,通过三次巢式pcr获取壳聚糖酶bmcsn的5’侧翼序列。
3’未知序列的获取:根据bmcsn基因的已知序列设计3条高退火温度的特异性上游引物sp4:5’-atgagaagaaatggttacatgaattc-3’(seqidno.7)、sp5:5’-atgacgacctgatgaatccggcagatcc-3’(seqidno.8)、sp6:5’-acacccgtgatgagtggagagaatcgg-3’(seqidno.9),同时使用试剂盒中低退火温度的简并引物ap1、ap2、ap3、ap4中的一种,利用特异性引物与简并引物之间退火温度的差异进行热不对称pcr,通过三次巢式pcr获取壳聚糖酶bmcsn的3’侧翼序列。
根据获得的壳聚糖酶基因的部分序列、5’侧翼序列和3’侧翼序列拼接后获得壳聚糖酶基因bmcsn的全长基因序列(seqidno.10),序列信息如下:
tgcatgggacgttgcggaatctagcattcttatcttacttgccattttcatcacctcccaactattcgatgatcatttccattataaaatagattaaagccttattgcattttgttaaataaagttgcagcaaaagggattctcccagagagagaggggctaaggctgattggcaataaaaaaagagtaagattcaagctgccagccttttattattactttagattcaatattgacaaaacgatgtattttcaacaatagagcagccccttgctgtatactgtgtctttatttacaatatttagtaggaggtaatcgaatgaaaatcagtttgaagaaaaaaacgggtttctggaagaaagcagcgatttcatcacttgttttcaccctgtttttaaccttgatgatgagtgaaacggtttttgcggcgggactgaataaggatcaaaagctccgggcagaacagctgaccagtatctttgaaaacggcacgacggagatccaatacggatatgtggaacccttggatgatggaagaggctatacatgcggacgggcaggctttacaacagctaccggggatgcattggaagtagtggaagtatacacaaaggcggtacagaataacaaactgaaaaagtacttgcctgaattgcgccgtctggccgaagaagaaagcgatgacatcagcaatctcaagggattcgcttccgcctgggagtcgcttggaaatgataaggaattccgcgctgctcaagacgcagtaaatgacagcttgtattatcagcctgccatgaaacgatccgatcatgccggactgaaaacggcactggcaagagctgtgatgtacgatacagttattcagcatggcgatggtgatgaccccgactccttttatgccttgatcaaacgcacgaacaaaaaagcgggcggttcacctaaagacggaattgatgagaagaaatggttacatgaattcttggatgtgcgatatgacgacctgatgaatccggcagatcctgacacccgtgatgagtggagagaatcggttgcccgtgtggacgtgcttcgctcaatcgccaaggagaacaactataatttaaacggaccgattcatgttcgttcaaaggaatacggtaattttgtaatcaat
其中大写部分为b.mojavensis壳聚糖酶的开放阅读框,黑体atg表示起始密码子,黑体taa为终止密码子。
根据得到的b.mojavensis壳聚糖酶的开放阅读框序列信息,设计特异性引物,上游引物bmcsn-bamhi-f为5’-aaggatccatgaaaatcagtttgaag-3’(其中ggatcc为bamhi限制性内切酶位点,seqidno.11),下游引物bmcsn-xhoi-r为5’-aactcgagattgattacaaaattac-3’(seqidno.12),以b.mojavensis的基因组dna为模板进行pcr扩增,获得一段长约837bp的片段,连接peasy-t1后,送公司测序,经序列测定验证为b.mojavensis的壳聚糖酶基因,并命名为bmcsn,获得的重组质粒命名为t-bmcsn。
二、含高催化活性,常温酶活性持久的壳聚糖酶工程菌的构建和酶活鉴定。1、含高催化活性,常温酶活性持久的壳聚糖酶基因表达载体的构建
利用限制性内切酶bamhi和xhoi双酶切t-bmcsn获得bmcsn的酶切片段,与经同样双酶切的质粒载体pet28a(+)连接,验证正确的重组载体命名为pet28a-bmcns。该基因的反向引物bmcsn-xhoi-r中不含有终止密码子,因此后续诱导的重组bmcsn蛋白的c-末端带有6个组氨酸标签。
2、含高催化活性,常温酶活性持久的壳聚糖酶工程菌的构建
将获得的重组质粒pet28a-bmcns热激转化大肠杆菌bl21(de3),获得含高催化活性,常温酶活性持久的壳聚糖酶工程菌bl21-bmcsn。
3、壳聚糖酶bmcsn的酶活鉴定
(1)壳聚糖酶bmcsn蛋白的诱导
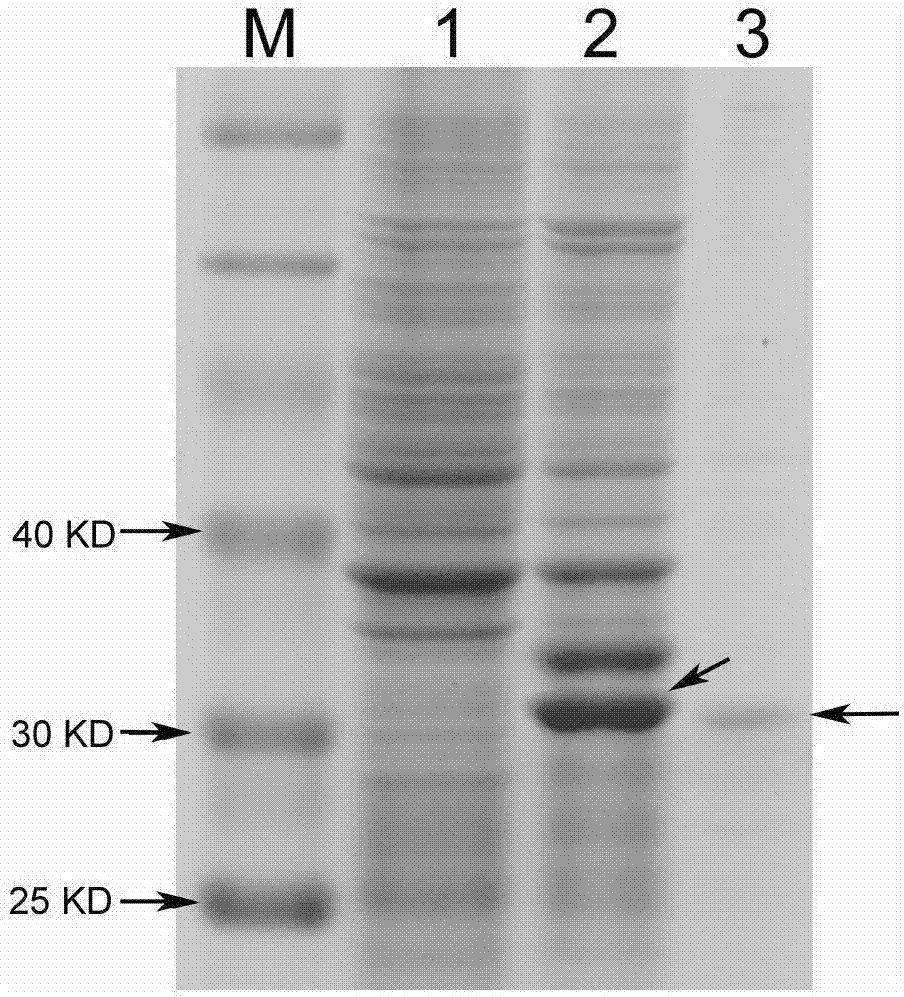
将表达菌株bl21-bmcsn接入lb培养基(含kana50ng/ml)中,37℃培养。当od600值达到0.4~0.6时,加入异丙基-β-d-硫代半乳糖苷(iptg)至终浓度为0.1mmol/l,25℃诱导16h,sds-page电泳检测可溶性蛋白的表达。结果表明加入iptg后,bmcsn(mr约3.1×104d)有明显表达条带,与预期大小相符。iptg诱导前后bmcsn表达的sds-page检测结果见图1(泳道m为蛋白质分子量标准,泳道1为空载体阴性对照,泳道2箭头所示为诱导蛋白)。
(2)壳聚糖酶bmcsn蛋白的提纯
诱导后收集的菌体沉淀重新溶解在50mm的pbs磷酸缓冲液中,加入pmsf(phenylmethanesulfonyfluoride,苯甲基黄酰氟)蛋白酶抑制剂后进行超声波破碎,破碎后离心,因为bmcsn重组蛋白的末端带有6个组氨酸标签,上清可以利用histraphp进行纯化,纯化获得的蛋白利用hitrapdesalting脱盐处理后进行定量测定和sds-page电泳检测,结果见图1(泳道3箭头所示为提纯蛋白)。
(3)壳聚糖酶的活性鉴定
取纯化蛋白20μl加入0.02mol/lph5.6的hac-naac缓冲液980μl,与ph5.6,10g/l粉末壳聚糖的hac溶液1ml混匀后,50℃水浴15min,离心后取上清,加3,5-二硝基水杨酸试剂1.5ml终止反应,沸水浴5min显色,冷却后,离心,取上清液测520nm波长处的吸光度。以每mg提纯蛋白每分钟产生1μmol还原糖所需的酶量为一个酶活力单位(u)。结果显示,壳聚糖酶bmcsn的酶活高达800u/mg蛋白。
(4)壳聚糖酶bmcsn的稳定性检测
提纯蛋白放置于28℃,分别于0、1、2、3、5、7天取样进行酶活测定(方法如上所述),结果显示该蛋白活性稳定,28℃保存7天,酶活仅比最初降低5%。酶活稳定性检测的结果见图2。提纯蛋白放置于28℃,分别于0、1、2、3、5、7天取样进行酶活测定,设定0天时的酶活为100%。
三、高催化活性,常温酶活性持久的壳聚糖酶bmcsn的制备方法。
1、培养基配制
(1)固体保藏培养基:酵母浸粉5g/l,蛋白胨10g/l,nacl5g/l,卡那霉素50mg/l,琼脂20g/l,ph7.0,121℃高压蒸汽灭菌20min;
(2)液体种子培养基:酵母浸粉1-10g/l,蛋白胨5-10g/l,nacl1-5g/l,卡那霉素50mg/l,ph7.0,121℃高压蒸汽灭菌20min;
(3)发酵培养基:葡萄糖20,酵母浸粉10、蛋白胨20,mgso440.5、nacl2.5、kh2po42、cacl20.1,ph6.5,121℃高压蒸汽灭菌20min。
2、菌株活化:挑取菌种划线接种至固体保藏培养基,于恒温培养箱37℃培养14~20h;
3、液体种子制备:挑取活化菌株接种于装有种子培养基的三角瓶中,纱布封口,于37℃,160~200r/min摇床振荡培养12~24h,得液体种子;
4、液体发酵:按5~10%接种量向发酵培养基接入液体种子,转速200r/min,ph7.0,菌液在37℃培养2-3小时,至od600≈0.3-0.5时加入乳糖0.1-0.5%诱导,乳糖诱导后降温至25-30℃,发酵时间12-20小时,结束后再以6000rpm转速离心10min,得到含壳聚糖酶的湿菌体。
5、壳聚糖酶bmcsn的活性鉴定:
取发酵液1ml所得湿菌体加入0.02mol/lph5.6的hac-naac缓冲液1ml,ph5.6,10g/l粉末壳聚糖的hac溶液1ml,50℃水浴15min,离心后取上清,加3,5-二硝基水杨酸试剂1.5ml终止反应,沸水浴5min显色,冷却后,离心,取上清液测520nm波长处的吸光度。等量煮沸灭活的发酵液收集得到的湿菌体作为空白对照。并绘制氨基葡萄糖标准曲线,计算反应液中的还原糖含量,换算壳聚糖酶的酶活力。酶活力单位定义:每ml发酵液每分钟产生1μmol还原糖所需的酶量为一个酶活力单位(u)。
本发明的有益效果
1、本发明的壳聚糖酶具有明显的稳定性,28℃保温7天,酶的活性仅较最初活性降低5%。高于已报道一般产品的稳定性。
2、本发明的壳聚糖酶进行的发酵条件的优化,其蛋白量高达4.5g/l。
3、本发明中的壳聚糖酶经高密度发酵后,其酶活高达834u/ml发酵液。
附图说明
图1是诱导前后bmcsn表达的sds-page检测结果图;
图2是壳聚糖酶bmcsn的热稳定性检测图。
具体实施方式
下面结合具体实施方式对本发明进行详细说明。
提供这些实施例是为了能够更透彻地理解本发明,并且能够将本发明的范围完整的传达给本领域的技术人员。
如在通篇说明书及权利要求当中所提及的“包含”或“包括”为一开放式用语,故应解释成“包含但不限定于”。说明书后续描述为实施本发明的较佳实施方式,然所述描述乃以说明书的一般原则为目的,并非用以限定本发明的范围。本发明的保护范围当视所附权利要求所界定者为准。
本发明中使用的材料如下:大肠杆菌e.colidh5α、e.colibl21(de3)、transtaqdna聚合酶、t4dna连接酶、标准相对分子量(mr)dna(即dnamarker,mr250~10,000)、标准mr蛋白质等试剂均可购置于北京全式金生物技术有限公司;壳聚糖(美国sigma-aldrich公司);genomewalkingkit、卡那霉素(kana)购自上海生工生物技术有限公司;蛋白胨和酵母提取物(英国oxoid公司);其他试剂均购自国药试剂有限公司。
实施例1一种热稳定性壳聚糖酶的制备方法,具体步骤如下:
1、壳聚糖酶bmcsn的克隆
(1)壳聚糖酶bmcsn部分序列的获得
具有高壳聚糖酶催化活性的菌株来自于烟台海岸带沙质土壤中,菌株分类鉴定为bacillusmojavensis,该菌株已经收藏于中国工业微生物菌种保藏中心,保藏号为cgmccno.7187。由于b.mojavensis的基因组序列尚未公布,利用同样来自于芽孢杆菌属其它壳聚糖酶的序列比对设计简并性引物,上游引物bmcsn-partialf为5’-gaaagcgatgacatmagcaa-3’(seqidno.1),下游引物bmcsn-partialr为5’-acacgggcaachgattctctcc-3’(seqidno.2),获得b.mojavensis壳聚糖酶的部分序列bmcsn-partial(seqidno.3)。测序结果显示该部分序列为壳聚糖酶bmcsn的部分序列。
(2)染色体步移法获得bmcsn的全长序列信息
染色体步移法的具体步骤如下:
5’未知序列的获取:根据bmcsn基因的已知序列设计3条高退火温度的特异性下游引物sp1:5’-actgcgtcttgagcagcgcggaattcc-3’(seqidno.4)、sp2:5’-tatcatttccaagcgactcccaggcgg-3’(seqidno.5)、sp3:5’-tgctgatgtcatcgctttcttcttcgg-3’(seqidno.6),同时使用试剂盒中低退火温度的简并引物ap1、ap2、ap3、ap4中的一种,利用特异性引物与简并引物之间退火温度的差异进行热不对称pcr,通过三次巢式pcr获取壳聚糖酶bmcsn的5’侧翼序列。
3’未知序列的获取:根据bmcsn基因的已知序列设计3条高退火温度的特异性上游引物sp4:5’-atgagaagaaatggttacatgaattc-3’(seqidno.7)、sp5:5’-atgacgacctgatgaatccggcagatcc-3’(seqidno.8)、sp6:5’-acacccgtgatgagtggagagaatcgg-3’(seqidno.9),同时使用试剂盒中低退火温度的简并引物ap1、ap2、ap3、ap4中的一种,利用特异性引物与简并引物之间退火温度的差异进行热不对称pcr,通过三次巢式pcr获取壳聚糖酶bmcsn的3’侧翼序列。
根据获得的壳聚糖酶基因的部分序列、5’侧翼序列和3’侧翼序列拼接后获得壳聚糖酶基因bmcsn的全长基因序列(seqidno.10)。
(3)壳聚糖酶bmcsn基因的克隆
根据得到的b.mojavensis壳聚糖酶的开放阅读框序列信息,设计特异性引物,上游引物bmcsn-bamhi-f为5’-aa
2、含高催化活性,常温酶活性持久的壳聚糖酶工程菌的构建。
(1)含高催化活性,常温酶活性持久的壳聚糖酶基因表达载体的构建
设计两端带有特定酶切位点的引物(bmcsn-bamhi-f:aa
(2)含高催化活性,常温酶活性持久的壳聚糖酶工程菌的构建
将获得的重组质粒pet28a-bmcns热激转化大肠杆菌bl21(de3),获得含高催化活性,常温酶活性持久的壳聚糖酶工程菌bl21-bmcsn。
实施例2一种热稳定性壳聚糖酶的制备方法,具体步骤如下:
1、培养基配制
(1)固体保藏培养基:酵母浸粉5g/l,蛋白胨10g/l,nacl5g/l,卡那霉素100mg/l,琼脂20g/l,ph7.0,121℃高压蒸汽灭菌20min;
(2)液体种子培养基:酵母浸粉1-10g/l,蛋白胨10g/l,nacl5g/l卡那霉素100mg/l,,ph7.0,121℃高压蒸汽灭菌20min;
(3)发酵培养基:葡萄糖20g/l,酵母浸粉10、蛋白胨20g/l,mgso440.5、nacl2.5、kh2po42、cacl20.1,ph6.5,121℃高压蒸汽灭菌20min。
2、菌株活化:挑取实施例1获得的壳聚糖酶工程菌bl21-bmcsn菌种划线接种至固体保藏培养基,于恒温培养箱37℃培养14~20h;
3、液体种子制备:挑取活化菌株接种于装有种子培养基的三角瓶中,纱布封口,于37℃,160~200r/min摇床振荡培养12~24h,得液体种子;
4、液体发酵按照正交实验设计:
按5%接种量向发酵培养基接入液体种子,转速200r/min,ph7.0,菌液在37℃培养2-3小时,至od600≈0.3-0.5时加入乳糖0.1%诱导,乳糖诱导后降温至25℃,发酵时间12小时,结束后再以6000rpm转速离心10min,获得含壳聚糖酶的湿菌体,壳聚糖酶活力达到最高值700u/ml。
实施例3一种热稳定性壳聚糖酶的制备方法,具体步骤如下:
(1)壳聚糖酶工程菌bl21-bmcsn的获得与实施例1相同。
(2)培养基的配制与实施例2相同。
(3)壳聚糖酶的发酵条件如下:按5%接种量向发酵培养基接入液体种子,转速200r/min,ph7.0,菌液在37℃培养2-3小时,至od600≈0.3-0.5时加入乳糖0.3%诱导,乳糖诱导后降温至28℃,发酵时间16小时,结束后再以6000rpm转速离心10min,获得含壳聚糖酶的湿菌体,壳聚糖酶活力达到最高值750u/ml。
实施例4一种热稳定性壳聚糖酶的制备方法,具体步骤如下:
(1)壳聚糖酶工程菌bl21-bmcsn的获得与实施例1相同。
(2)培养基的配制与实施例2相同。
(3)壳聚糖酶的发酵条件如下:按5%接种量向发酵培养基接入液体种子,转速200r/min,ph7.0,菌液在37℃培养2-3小时,至od600≈0.3-0.5时加入乳糖0.5%诱导,乳糖诱导后降温至30℃,发酵时间20小时,结束后再以6000rpm转速离心10min,获得含壳聚糖酶的湿菌体,壳聚糖酶活力达到最高值780u/ml。
实施例5一种热稳定性壳聚糖酶的制备方法,具体步骤如下:
(1)壳聚糖酶工程菌bl21-bmcsn的获得与实施例1相同。
(2)培养基的配制与实施例2相同。
(3)壳聚糖酶的发酵条件如下:按7%接种量向发酵培养基接入液体种子,转速200r/min,ph7.0,菌液在37℃培养2-3小时,至od600≈0.3-0.5时加入乳糖0.1%诱导,乳糖诱导后降温至28℃,发酵时间20小时,结束后再以6000rpm转速离心10min,获得含壳聚糖酶的湿菌体,壳聚糖酶活力达到最高值834u/ml。
实施例6一种热稳定性壳聚糖酶的制备方法,具体步骤如下:
(1)壳聚糖酶工程菌bl21-bmcsn的获得与实施例1相同。
(2)培养基的配制与实施例2相同。
(3)壳聚糖酶的发酵条件如下:按7%接种量向发酵培养基接入液体种子,转速200r/min,ph7.0,菌液在37℃培养2-3小时,至od600≈0.3-0.5时加入乳糖0.3%诱导,乳糖诱导后降温至30℃,发酵时间12小时,结束后再以6000rpm转速离心10min,获得含壳聚糖酶的湿菌体,壳聚糖酶活力达到最高值719u/ml。
实施例7一种热稳定性壳聚糖酶的制备方法,具体步骤如下:
(1)壳聚糖酶工程菌bl21-bmcsn的获得与实施例1相同。
(2)培养基的配制与实施例2相同。
(3)壳聚糖酶的发酵条件如下:按7%接种量向发酵培养基接入液体种子,转速200r/min,ph7.0,菌液在37℃培养2-3小时,至od600≈0.3-0.5时加入乳糖0.5%诱导,乳糖诱导后降温至25℃,发酵时间16小时,结束后再以6000rpm转速离心10min,获得含壳聚糖酶的湿菌体,壳聚糖酶活力达到最高值789u/ml。
实施例8一种热稳定性壳聚糖酶的制备方法,具体步骤如下:
(1)壳聚糖酶工程菌bl21-bmcsn的获得与实施例1相同。
(2)培养基的配制与实施例2相同。
(3)壳聚糖酶的发酵条件如下:按10%接种量向发酵培养基接入液体种子,转速200r/min,ph7.0,菌液在37℃培养2-3小时,至od600≈0.3-0.5时加入乳糖0.1%诱导,乳糖诱导后降温至30℃,发酵时间16小时,结束后再以6000rpm转速离心10min,获得含壳聚糖酶的湿菌体,壳聚糖酶活力达到最高值791u/ml。
实施例9一种热稳定性壳聚糖酶的制备方法,具体步骤如下:
(1)壳聚糖酶工程菌bl21-bmcsn的获得与实施例1相同。
(2)培养基的配制与实施例2相同。
(3)壳聚糖酶的发酵条件如下:按10%接种量向发酵培养基接入液体种子,转速200r/min,ph7.0,菌液在37℃培养2-3小时,至od600≈0.3-0.5时加入乳糖0.3%诱导,乳糖诱导后降温至25℃,发酵时间20小时,结束后再以6000rpm转速离心10min,获得含壳聚糖酶的湿菌体,壳聚糖酶活力达到最高值798u/ml。
实施例10一种热稳定性壳聚糖酶的制备方法,具体步骤如下:
(1)壳聚糖酶工程菌bl21-bmcsn的获得与实施例1相同。
(2)培养基的配制与实施例2相同。
(3)壳聚糖酶的发酵条件如下:按10%接种量向发酵培养基接入液体种子,转速200r/min,ph7.0,菌液在37℃培养2-3小时,至od600≈0.3-0.5时加入乳糖0.5%诱导,乳糖诱导后降温至28℃,发酵时间12小时,结束后再以6000rpm转速离心10min,获得含壳聚糖酶的湿菌体,壳聚糖酶活力达到最高值725u/ml。
本发明中克隆到的来源于bacillusmojavensis的壳聚糖酶活性强,具有极好的热稳定性,常温放置一周酶活依旧保持95%左右。壳聚糖酶的发酵培养基起始ph7.0,起始接种量7%,乳糖诱导浓度0.1%,发酵温度28℃,发酵时间20小时,菌株产壳聚糖酶活力最高,为834u/ml为工业化生产壳聚糖酶及酶法制备壳寡糖提供理论依据。
以上所述仅是对本发明的较佳实施方式而已,并非对本发明作任何形式上的限制,凡是依据本发明的技术实质对以上实施方式所做的任何简单修改,等同变化与修饰,均属于本发明技术方案的范围内。
序列表
<110>鲁东大学
<120>一种热稳定性壳聚糖酶的制备方法
<160>12
<170>siposequencelisting1.0
<210>1
<211>19
<212>dna
<213>人工序列(artificialsequence)
<400>1
gaaagcgatgacatagcaa19
<210>2
<211>21
<212>dna
<213>人工序列(artificialsequence)
<400>2
acacgggcaacgattctctcc21
<210>3
<211>374
<212>dna
<213>人工序列(artificialsequence)
<400>3
gaaagcgatgacatcagcaatctcaagggattcgcttccgcctgggagtcgcttggaaat60
gataaggaattccgcgctgctcaagacgcagtaaatgacagcttgtattatcagcctgcc120
atgaaacgatccgatcatgccggactgaaaacggcactggcaagagctgtgatgtacgat180
acagttattcagcatggcgatggtgatgaccccgactccttttatgccttgatcaaacgc240
acgaacaaaaaagcgggcggttcacctaaagacggaattgatgagaagaaatggttacat300
gaattcttggatgtgcgatatgacgacctgatgaatccggcagatcctgacacccgtgat360
gagtggagagaatc374
<210>4
<211>27
<212>dna
<213>人工序列(artificialsequence)
<400>4
actgcgtcttgagcagcgcggaattcc27
<210>5
<211>27
<212>dna
<213>人工序列(artificialsequence)
<400>5
tatcatttccaagcgactcccaggcgg27
<210>6
<211>27
<212>dna
<213>人工序列(artificialsequence)
<400>6
tgctgatgtcatcgctttcttcttcgg27
<210>7
<211>26
<212>dna
<213>人工序列(artificialsequence)
<400>7
atgagaagaaatggttacatgaattc26
<210>8
<211>28
<212>dna
<213>人工序列(artificialsequence)
<400>8
atgacgacctgatgaatccggcagatcc28
<210>9
<211>27
<212>dna
<213>人工序列(artificialsequence)
<400>9
acacccgtgatgagtggagagaatcgg27
<210>10
<211>1320
<212>dna
<213>人工序列(artificialsequence)
<400>10
tgcatgggacgttgcggaatctagcattcttatcttacttgccattttcatcacctccca60
actattcgatgatcatttccattataaaatagattaaagccttattgcattttgttaaat120
aaagttgcagcaaaagggattctcccagagagagaggggctaaggctgattggcaataaa180
aaaagagtaagattcaagctgccagccttttattattactttagattcaatattgacaaa240
acgatgtattttcaacaatagagcagccccttgctgtatactgtgtctttatttacaata300
tttagtaggaggtaatcgaatgaaaatcagtttgaagaaaaaaacgggtttctggaagaa360
agcagcgatttcatcacttgttttcaccctgtttttaaccttgatgatgagtgaaacggt420
ttttgcggcgggactgaataaggatcaaaagctccgggcagaacagctgaccagtatctt480
tgaaaacggcacgacggagatccaatacggatatgtggaacccttggatgatggaagagg540
ctatacatgcggacgggcaggctttacaacagctaccggggatgcattggaagtagtgga600
agtatacacaaaggcggtacagaataacaaactgaaaaagtacttgcctgaattgcgccg660
tctggccgaagaagaaagcgatgacatcagcaatctcaagggattcgcttccgcctggga720
gtcgcttggaaatgataaggaattccgcgctgctcaagacgcagtaaatgacagcttgta780
ttatcagcctgccatgaaacgatccgatcatgccggactgaaaacggcactggcaagagc840
tgtgatgtacgatacagttattcagcatggcgatggtgatgaccccgactccttttatgc900
cttgatcaaacgcacgaacaaaaaagcgggcggttcacctaaagacggaattgatgagaa960
gaaatggttacatgaattcttggatgtgcgatatgacgacctgatgaatccggcagatcc1020
tgacacccgtgatgagtggagagaatcggttgcccgtgtggacgtgcttcgctcaatcgc1080
caaggagaacaactataatttaaacggaccgattcatgttcgttcaaaggaatacggtaa1140
ttttgtaatcaattaagcagagagtgaaaagaaaccgctacagatgaactaaatctaaaa1200
gataccaaagatgttggtatctttttttatttgcagtaaaaaagtattcaattttctcta1260
taacgattaggttttggtatcctctggggtaattatccagatggatcaggtttagtgtcc1320
<210>11
<211>25
<212>dna
<213>人工序列(artificialsequence)
<400>11
aggatccatgaaaatcagtttgaag25
<210>12
<211>25
<212>dna
<213>人工序列(artificialsequence)
<400>12
aactcgagattgattacaaaattac25
- 还没有人留言评论。精彩留言会获得点赞!