一种界面自组装羰基还原酶及在(R)-3-羟基-3-苯基丙酸乙酯合成中的应用的制作方法
本发明涉及一种微生物来源界面自组装羰基还原酶的制备及其在制备治疗adhd的非中枢兴奋药物r-托莫西汀关键手性中间体(r)-3-羟基-3-苯基丙酸乙酯中的应用。
(二)背景技术
界面自组装酶是聚合物-酶复合物,是将酶与大分子聚合物结合使被修饰的酶具有两亲性结构,结构类似于以蛋白质为基础的表面活性剂,既含有亲水性的蛋白质头部还含有疏水性聚合物尾,当被放到油-水体系中时,聚合物-酶中的聚合物部分伸展到油相,而酶部分嵌入在水相中,将酶固定在油-水界面上催化油水两相中的化学反应。将羰基还原酶与聚合物在合适的油水界面结合形成界面自组装羰基还原酶,并将其应用于油水两相体系催化羰基化合物的不对称还原制备手性药物中间体对于提高油水两相体系生物催化效率具有积极的意义。
具有选择性的羰基还原酶可以不对称还原羰基化合物制备手性化合物。羰基还原酶广泛存在于微生物体内,直接采用含有羰基还原酶的微生物不对称还原潜手性羰基化合物可以制备手性醇。微生物细胞通常在水溶液中能够发挥较高的活性,而有机底物水溶性较低,因此微生物细胞在水相中催化水溶性较低的底物转化效率较低。采用水/有机相两相体系转化水溶性较低的底物有望提高转化效率。将存在于微生物细胞中的羰基还原酶分离提取出来并制备成界面自组装酶有利于实现酶的重复利用,并在油水界面实现快速转化,有利于提高水不溶性底物的生物转化效率。
托莫西汀分子结构中有一个手性碳原子,具有r型和s型两种对映异构体。其中,(r)-托莫西汀是(s)-托莫西汀药效的9倍,市售的药品均为(r)-托莫西汀。(r)-3-羟基-3-苯基丙酸乙酯((r)-ethyl-3-hydroxy-3-phenylpropinate)是合成r-托莫西汀的关键手性中间体。其分子式c11h14o3,分子量194.23,cas号72656-47-4,沸点315.3±20℃,密度1.119。不对称还原3-羰基-3-苯基丙酸乙酯可以制备(r)-3-羟基-3-苯基丙酸乙酯。
(r)-托莫西汀,英文名:atomoxetine,cas登录号:83015-26-3,分子式c17h21no,分子量255.355。(r)-托莫西汀是神经系统药物,临床上主要用于注意缺陷障碍(adhd)的治疗。注意缺陷障碍(adhd)又称儿童多动症,目前多认为其发病机制与儿茶酚胺类神经递质多巴胺和去甲肾上腺素翻转效应降低有关。托莫西汀可选择性抑制去甲肾上腺素的突触前运转,增强去甲肾上腺素功能,从而改善adhd的症状,间接促进认知的完成和注意力的集中。对其他神经递质受体(如胆碱能、组胺、多巴胺、5-羟色胺以及α-肾上腺素受体)几乎无亲和力。
(r)-3-羟基-3-苯基丙酸乙酯可以通过化学法不对称还原3-羰基-3-苯基丙酸乙酯而获得,该方法需要制备化学催化剂,具有不对称还原能力的催化剂往往含有贵金属,价格昂贵。也可采用化学法或酶法不对称拆分3-羟基-3-苯基丙酸乙酯制备(r)-3-羟基-3-苯基丙酸乙酯,该方法理论上最高转化率只能达到50%。采用微生物全细胞不对称还原3-羰基-3-苯基丙酸乙酯也可以获得(r)-3-羟基-3-苯基丙酸乙酯,理论上最高转化率可以达到100%,但底物的处理量较低,生产效率不高。为进一步提高生产效率,本发明分离提取微生物细胞中的羰基还原酶,并将羰基还原酶进行界面自组装制备界面自组装羰基还原酶,在水/有机相两相体系中转化3-羰基-3-苯基丙酸乙酯制备(r)-3-羟基-3-苯基丙酸乙酯,提高底物的处理量和生产效率。
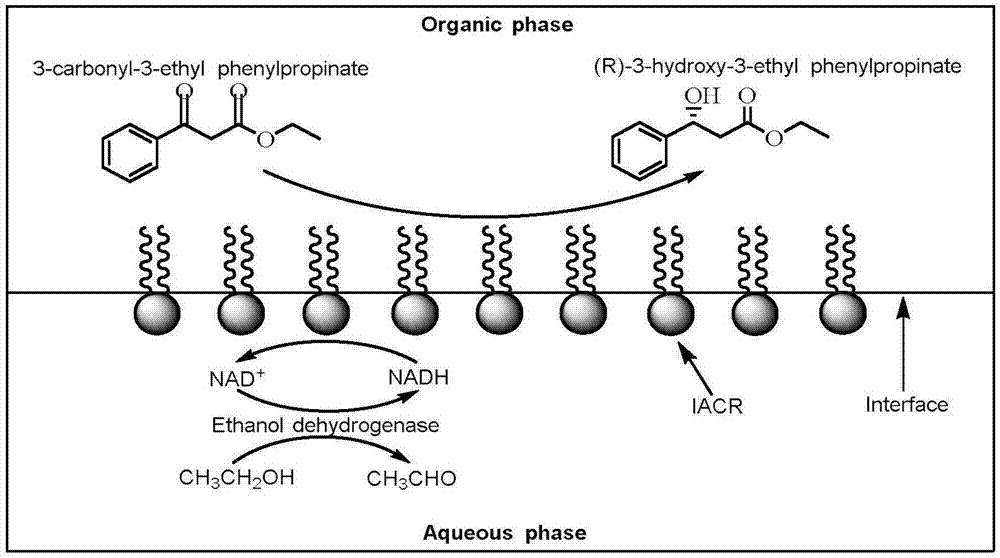
以3-羰基-3-苯基丙酸乙酯为底物,以界面自组装羰基还原酶为催化剂,在有机相/水两相体系中进行催化反应可以将3-羰基-3-苯基丙酸乙酯转化为(r)-3-羟基-3-苯基丙酸乙酯。界面自组装酶的亲水部分分布在水相,疏水部分分布在有机相中,界面自组装酶被锚固在有机相/水界面。底物3-羰基-3-苯基丙酸乙酯和产物(r)-3-羟基-3-苯基丙酸乙酯分布在有机相中,底物与有机相/水界面的界面自组装酶接触实现催化反应。还原反应需要辅酶nadh为反应过程提供氢,因此,在水相中添加nadh,同时添加乙醇脱氢酶和乙醇实现nadh的再生,为还原反应提供源源不断的供氢体,反应机理见图1所示。
(三)
技术实现要素:
本发明目的是提供一种界面自组装羰基还原酶,并采用该界面自组装羰基还原酶在有机相/水两相体系中不对称还原3-羰基-3-苯基丙酸乙酯制备(r)-3-羟基-3-苯基丙酸乙酯,为(r)-托莫西汀的生物合成提供新途径,该方法在有机相/水两相体系中完成有利于底物和产物的分离提取;反应条件温和;界面自组装酶可以实现重复利用,提高底物的生物转化效率。
本发明采用的技术方案是:
第一方面,本发明提供一种界面自组装羰基还原酶,所述界面自组装羰基还原酶按如下方法制备:将羰基还原酶加入ph6~9(优选ph7.9)、0.05m的tirs-hcl缓冲液中,再加入聚苯乙烯的甲苯溶液,在黑暗、40-100r/min(优选80r/min)、20-40℃(优选30℃)条件下,于摇床中震荡反应1-4小时(优选2小时),离心(优选将反应液10000r/min离心10min),获得上层为有机相、中间层为界面自组装羰基还原酶、下层为水相的反应体系,将中间层(即分布于油水界面的界面自组装羰基还原酶)用甲苯和ph6~9(优选ph7.9)、0.05m的tris-hcl缓冲液分别洗涤3-5次(优选3次),获得界面自组装羰基还原酶;所述羰基还原酶加入量以缓冲液体积计为20~200u/ml(优选144u/ml),所述聚苯乙烯的甲苯溶液浓度为1.0~4.0g/l(优选3.75g/l),所述聚苯乙烯的甲苯溶液与缓冲液体积比为1-3:1,优选1.6:1。
进一步,所述羰基还原酶来自热带假丝酵母(candidatropicalis)cgmccno.15016,保藏于中国微生物菌种保藏管理委员会普通微生物保藏中心,保藏号cgmccno.15016,保藏日期2017年12月4日,保藏地址:北京市朝阳区北辰西路1号院3号,中国科学院微生物研究所,邮编100101。
进一步,所述羰基还原酶按如下方法制备:(1)将candidatropicaliscgmccno.15016经发酵培养获得的湿菌体分散于50mltris-hcl(0.05m、ph7.9)缓冲溶液中,菌体浓度为2g/l(菌体干重/缓冲液体积),置于冰水浴(0~4℃)中进行超声破胞;将超声探头浸入菌悬液液面下1~1.5cm,功率405w,工作2s,间歇4s,超声破胞20min,破碎后的样品于8000r/min的离心机中4℃离心10min,所得上清液,即粗酶液ⅰ;
(2)将粗酶液ⅰ进行硫酸铵分级沉淀:将酶液ⅰ置于冰水浴中预冷至0~4℃,边温和地搅拌,边缓慢加入预先研磨成粉的硫酸铵,至硫酸铵饱和度为40%,待其溶解完全,继续冰浴搅拌1h,于10000×g,4℃,离心10min,得到的沉淀于1~2倍沉淀物体积的tris-hcl缓冲液中复溶,得粗酶液ⅱ;
(3)将粗酶液ⅱ进行超滤浓缩:将粗酶液ⅱ置于10kdmillipore超滤离心管中,于3500×g,4℃条件下,离心20min,套管中的浓缩液即为羰基还原酶酶液,酶活优选为180u/mg,4℃保存备用。
进一步,所述湿菌体按如下方法制备:1)将热带假丝酵母(candidatropicalis)cgmccno.15016接种到斜面培养基中,于30℃培养3-5天,获得斜面菌体;斜面培养基组成:葡萄糖20g/l,硫酸铵1g/l,磷酸二氢钾0.5g/l,磷酸氢二钾1.5g/l,氯化钠1g/l,硫酸镁0.1g/l,琼脂20g/l,溶剂为去离子水,ph值自然;2)将斜面上的菌体接种入装液25ml种子培养基的100ml三角瓶中,30℃,120r/min培养24h,获得种子液;种子培养基组成:葡萄糖46g/l,酵母汁25g/l,磷酸二氢钾4g/l,磷酸氢二钾4g/l,氯化钠0.1g/l,溶剂为去离子水,ph值自然;3)将培养24h的种子液,以体积浓度10%的接种量接入装液250ml发酵培养基的1000ml三角瓶中,30℃,120r/min培养24h,将获得的发酵液于8000r/min的离心机中离心20分钟,弃去上清液,获得湿菌体;发酵培养基组成:葡萄糖46g/l,酵母汁25g/l,磷酸二氢钾4g/l,磷酸氢二钾4g/l,氯化钠0.1g/l,溶剂为去离子水,ph值自然。
第二方面,本发明还提供一种所述界面自组装羰基还原酶在不对称还原3-羰基-3-苯基丙酸乙酯制备(r)-3-羟基-3-苯基丙酸乙酯中的应用。
进一步,所述应用方法为:以界面自组装羰基还原酶为催化剂,以3-羰基-3-苯基丙酸乙酯为底物,以nadh为辅酶,以乙醇为辅助底物,加入乙醇脱氢酶用于辅酶nadh的原位再生,以ph3.0~8.0(优选7.9)的tris-hcl缓冲液与甲苯形成的tris-hcl/甲苯两相体系为反应介质,在20~40℃(优选35℃)、80-120r/min(优选120r/min)的摇床中反应,反应完全后,将反应液分离纯化,获得所述的(r)-3-羟基-3-苯基丙酸乙酯;所述催化剂用量以缓冲液体积计为5~200u/ml(优选31-36u/ml),底物用量以缓冲液体积计为0.010~0.070mol/l(优选0.037-0.062mol/l,最优选0.056mol/l),所述乙醇体积用量以缓冲液体积计分别为1~12%(优选6-10%,最优选10%);所述nadh用量以缓冲液体积计为0.02~0.14mol/l(优选0.04-0.14mol/l,最优选0.10mol/l),所述乙醇脱氢酶(优选300u/mg)用量以缓冲液体积计为0.01~0.4g/l,或者3000-120000u/l(优选6000u/l),所述甲苯与缓冲液体积比为2.5-20:10(优选10-15:10,最优选12.5:10)。
进一步,反应结束后,将反应液10000r/min离心10min,离心后可以获得含有3-羰基-3-苯基丙酸乙酯和(r)-3-羟基-3-苯基丙酸乙酯的有机相、中间层和水相,(r)-3-羟基-3-苯基丙酸乙酯存在于有机相中,水相采用等量乙酸乙酯萃取三次,合并萃取液,旋转蒸发掉大部分乙酸乙酯后与有机相合并,经过硅胶柱层析进一步分离3-羰基-3-苯基丙酸乙酯和(r)-3-羟基-3-苯基丙酸乙酯,即可获得(r)-3-羟基-3-苯基丙酸乙酯;所述中间层回收界面自组装羰基还原酶重复利用。
与现有技术相比,本发明有益效果主要体现在:
本发明构建的界面自组装羰基还原酶在有机相和水两相界面具有较好的催化功能,能够将3-羰基-3-苯基丙酸乙酯转化为(r)-3-羟基-3-苯基丙酸乙酯,(r)-3-羟基-3-苯基丙酸乙酯的对映体过剩值大于99%。在水相中,辅酶nadh能够顺利实现原位再生,有利于提高底物的转化率,同样反应条件下加入辅酶nadh可将底物转化率提高到原来的24%。底物和产物溶解于有机相中,催化反应在有机相和水界面进行,有利于产物的后续分离提取。与传统游离酶在两相体系中的催化相比,可以减少酶活损失,提高酶的催化效率。界面自组装酶能够实现多次重复利用,这也是游离酶不可比拟的优势。界面自组装羰基还原酶在有机相和水的界面发挥催化功能为(r)-3-羟基-3-苯基丙酸乙酯的合成提供了新途径。
(四)附图说明
图1为本发明反应机理示意图。
图2菌株412显微照片。
图3供试菌株与酵母其他种属间的系统进化树。
(五)具体实施方式
下面结合具体实施例对本发明进行进一步描述,但本发明的保护范围并不仅限于此:
实施例1热带假丝酵母(candidatropicalis)cgmccno.15016筛选及鉴定
1、菌种筛选过程:
(1)培养基
富集平板培养基(g/l):葡萄糖20,(nh4)2so41,kh2po40.5,k2hpo41.5,nacl1,mgso40.1,琼脂20,溶剂为去离子水,ph值自然。
斜面培养基(g/l):葡萄糖20,(nh4)2so41,kh2po40.5,k2hpo41.5,nacl1,mgso40.1,琼脂20,溶剂为去离子水,ph值自然。
种子培养基(g/l):葡萄糖20,酵母粉3,(nh4)2so41,kh2po40.5,k2hpo41.5,nacl1,mgso40.1,溶剂为去离子水,ph值自然。发酵培养基组成同种子培养基组成。
(2)培养方法
斜面培养:30℃培养3-5d。
种子培养:将培养好的斜面接入装液25ml种子培养基的100ml三角瓶中,30℃,120r/min培养24h。
发酵培养:将培养24h的种子液,以体积浓度10%的接种量接入装液25ml发酵培养基的100ml三角瓶中,30℃,120r/min培养24h。
(3)土壤样品的稀释
称取1g土壤样品,加入50ml蒸馏水,震荡均匀后静置,待上清液澄清备用。
(4)菌种筛选
底物β-羰基苯丙酸乙酯能随水蒸气挥发且不溶于水,因而无法配制以其为唯一碳源的固体培养基,选择熏蒸法进行初筛。将熏蒸后的土壤上清液进行平板划线,耐受底物的菌种能在平板上生长,其中可能有能利用底物并转化生成产物的菌株。
1)初筛
将5ml土壤上清液加入表面皿的下盖,上盖则涂上适量的底物苯甲酰乙酸乙酯,合上后静置24h。之后每隔24h在无菌环境下将土壤上清液接种于富集平板进行划线分离,直至平板上长不出菌落为止,共6d。将平板倒置于30℃生化培养箱中3d,观察其生长情况。
对平板上长出的菌落进行筛选,尽可能选择形态、颜色不同的单菌落。将筛选得到的菌株进行斜面培养后,4℃保藏,以备观察和后续实验使用。
2)复筛
将初筛得到的菌株进行种子和发酵培养,发酵液于8000r/min,离心10min。弃上清,将菌体用水清洗两次后分散于25ml磷酸盐缓冲液中,并加入0.056mol/l的底物β-羰基苯丙酸乙酯,30℃,120r/min进行还原反应48h。反应结束后将转化液离心后取适量上清,用5ml乙酸乙酯萃取,检测目的产物的转化率和对映体过量值,筛选得到转化率和对映体过量值均较高的菌株zjutss412。
采用岛津gc-2014气相色谱仪和手性柱supelcoβ-120(250×2.5mm)来检测底物和产物的浓度。gc检测条件:进样量1μl;柱温125℃;进样口温度250℃;检测口温度255℃;载气为氮气;载气流量2ml/min;分流比1:15;检测器为氢火焰离子化检测器(fid)。
2、菌种鉴定
菌株zjutss412经形态学鉴定后,交由上海生工生物工程公司测序进行菌种鉴定,通过邻接系统进化树进行分析。菌种鉴定实验过程如下:
1)基因组dna提取,按sk8257(酵母)试剂盒操作。
2)pcr扩增供试菌26srdnad1/d2区域序列。
3)凝胶电泳。1%琼脂糖电泳,150v,100ma,20min电泳观察。
4)纯化回收。pcr产物电泳条带切割所需dna目的条带,按sk8131试剂盒方法纯化,pcr产物用pcr引物直接测序。
(1)菌种形态学鉴定
将菌株zjutss412(酵母菌)活化一代后,经分区划线分离,观察单菌落的菌落形态。取适当稀释的菌悬液,经涂片、固定、结晶紫染色等步骤后镜检观察菌体的形态。
菌落特征:菌株zjutss412在固体培养基上呈卵圆形,较大;颜色为浅黄色;边缘整齐、表面光滑平坦、粘稠湿润。
菌株的显微结构:在10×100倍的显微镜下观察,菌株zjutss412细胞形态如图2所示,为卵圆形且较大。初步判断其为酵母菌。
(2)菌种保守rdna序列鉴定
将从土壤中筛选得到的菌株zjutss412的26srdna序列(seqidno.1所示)与ncbi数据库进行blast比对,发现该菌株序列与candidatropicalis具有99%的同源性。根据blast同源性对比结果以及mega6.0软件分析计算,得到供试菌株zjutss412的系统发育树(图3),确定供试菌株在系统发育学上的地位。该菌株与其他种属酵母菌间的系统进化关系如系统进化树所示,再结合其菌落形态学特征,确定该菌株属于假丝酵母属,命名为热带假丝酵母(candidatropicalis)zjutss412,保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏日期2017年12月4日,保藏编号cgmccno.15016,保藏地址:北京市朝阳区北辰西路1号院3号,中国科学院微生物研究所,邮编100101。
实施例2:羰基还原酶的制备
1、湿菌体
(1)将热带假丝酵母(candidatropicalis)cgmccno.15016接种到斜面培养基中,于30℃培养3-5天,获得斜面菌体;斜面培养基成分:葡萄糖20g/l,硫酸铵1g/l,磷酸二氢钾0.5g/l,磷酸氢二钾1.5g/l,氯化钠1g/l,硫酸镁0.1g/l,琼脂20g/l,溶剂为去离子水,ph值自然。
(2)将斜面上的菌体接种入装液25ml种子培养基的100ml三角瓶中,30℃,120r/min培养24h,获得种子液。种子培养基成分:葡萄糖46g/l,酵母汁25g/l,磷酸二氢钾4g/l,磷酸氢二钾4g/l,氯化钠0.1g/l,溶剂为去离子水,ph值自然。
(3)将培养24h的种子液,以体积浓度10%的接种量接入装液250ml发酵培养基的1000ml三角瓶中,30℃,120r/min培养24h。将获得的发酵液于8000r/min的离心机中离心20分钟,弃去上清液,获得湿菌体。发酵培养基成分:葡萄糖46g/l,酵母汁25g/l,磷酸二氢钾4g/l,磷酸氢二钾4g/l,氯化钠0.1g/l,溶剂为去离子水,ph值自然。
2、将candidatropicaliscgmccno.15016湿菌体分散于50mltris-hcl(0.05m、ph7.9)缓冲溶液中,菌体浓度为2g/l(菌体干重/缓冲液体积),置于冰水浴(0~4℃)中进行超声破胞。将超声探头浸入菌悬液液面下1~1.5cm,功率405w,工作2s,间歇4s,超声破胞20min,破碎后的样品于8000r/min的离心机中4℃离心10min,所得上清液,即粗酶液ⅰ。
3、将粗酶液ⅰ进行硫酸铵分级沉淀。将粗酶液ⅰ置于冰水浴中预冷至0~4℃,边温和地搅拌,边缓慢加入预先研磨成粉的硫酸铵,至硫酸铵饱和度为40%,待其溶解完全,继续冰浴搅拌1h,于10000×g,4℃,离心10min。得到的沉淀于1~2倍沉淀物体积的tris-hcl缓冲液(0.05m、ph7.9)中复溶,得粗酶液ⅱ。
4、将粗酶液ⅱ进行超滤浓缩。将粗酶液ⅱ置于10kdmillipore超滤离心管中,于3500×g,4℃条件下,离心20min。套管中的浓缩液即为羰基还原酶酶液,酶比活力为180u/mg,4℃保存备用。
本发明所述的羰基还原酶蛋白含量的测定方法为:采用bradford方法,以牛血清白蛋白做为标准蛋白质。
本发明所述的羰基还原酶酶活力的测定方法为:酶活力被定义为25℃条件下1分钟内催化1μmolnadh生成nad+所需要的羰基还原酶的量。100μl的酶加入到含有0.25mmol/lnadh和0.25mmol/l苯乙酮的5ml、ph7.9、50mmol/ltris-hcl缓冲液中,于25℃条件下反应5min。检测样品于340nm处的光吸收值。酶活力采用公式(1),相对酶活采用公式(2)进行计算。
酶活力(u)=e×v×103/(6220×1)(1)
酶的比活力(u/mg)=酶活力/蛋白质含量(2)
e代表1min在340nm处吸光度的变化。v代表反应液的体积。6220代表摩尔吸光系数(l·mol-1·cm-1)。1代表光程(cm)。
实施例3界面自组装羰基还原酶的制备及应用
(1)界面自组装羰基还原酶的制备
将实施例2制备的5mg羰基还原酶酶液(180u/mg)加入6.25ml、ph7.9、0.05m的tris-hcl缓冲溶液中配制成0.8g/l的酶液,再加入3.75g/l聚苯乙烯(mw10000da)甲苯溶液10ml,在黑暗、摇床转速80r/min、30℃条件下反应1小时。反应完成后1200r/min离心10min,界面自组装酶分布在水和有机相的两相界面(即上层为甲苯,中间为界面自组装酶,下层为tris-hcl缓冲溶液)。移去缓冲液和有机溶剂,连续用甲苯和ph7.9、0.05m的tris-hcl缓冲溶液分别洗涤中间层3次,除去游离的羰基还原酶和聚苯乙烯,获得界面自组装羰基还原酶2mg,表面积为16.6cm2,比活力为155u/mg。
本发明所述界面自组装羰基还原酶蛋白含量的测定方法为:界面自组装羰基还原酶的蛋白含量的测定方法采用物料平衡的方法进行计算。用于界面自组装的游离羰基还原酶的蛋白含量和界面自组装后残存于磷酸缓冲液中的蛋白质含量之间的差值即为被界面自组装羰基还原酶的蛋白含量。蛋白质含量采用bradford方法进行测定。
本发明所述的界面自组装羰基还原酶活力的测定方法为:界面自组装羰基还原酶加入到含有0.10mmol/lnadh和0.25mmol/l苯乙酮的5ml、ph7.9、0.05mol/l的tris-hcl缓冲液中,检测样品于340nm处的光吸收。采用实施例2公式(1)和(2)计算酶活力。
(2)3-羰基-3-苯基丙酸乙酯的不对称还原
在八个50ml锥形瓶中分别加入以缓冲液体积计0.10mol/lnadh,0.2mg乙醇脱氢酶(酶活300u/mg),10mltris-hcl(0.05mol/l、ph7.9)缓冲液,以缓冲液体积计浓度为10%的乙醇和步骤(1)制备的界面自组装羰基还原酶2mg(155u/mg)。在上述八个锥形瓶中分别加入2.5ml、5ml、7.5ml、10ml、12.5ml、15ml、17.5ml和20ml甲苯,再分别加入以缓冲液体积计0.056mol/l3-羰基-3-苯基丙酸乙酯,在35℃、120r/min的摇床中反应8h。反应结束后,将反应液10000r/min离心10min,分为三层,上层为有机相(甲苯),中间层为界面自组装酶,下层为缓冲液,甲苯相和tris-hcl缓冲液相能够实现很好的分离。离心后可以获得含有底物3-羰基-3-苯基丙酸乙酯和产物(r)-3-羟基-3-苯基丙酸乙酯的有机相。离心后获得的tris-hcl缓冲液采用等量乙酸乙酯萃取三次,合并萃取液,旋转蒸发掉乙酸乙酯后将样品与有机相合并,采用气相色谱gc进一步分析合并样品中3-羰基-3-苯基丙酸乙酯和(r)-3-羟基-3-苯基丙酸乙酯的含量,确定转化率和(r)-3-羟基-3-苯基丙酸乙酯的对映体过剩值。
采用岛津gc-2014气相色谱仪和手性柱supelcoβ-120(250×2.5mm)来检测底物和产物的浓度。gc检测条件:进样量1μl;柱温125℃;进样口温度250℃;检测口温度255℃;载气为氮气;载气流量2ml/min;分流比1:15;检测器为氢火焰离子化检测器(fid)。
表1甲苯与tris-hcl缓冲溶液体积比对还原反应的影响
生物转化过程中有机溶剂和缓冲液的体积比影响着3-羰基-3-苯基丙酸乙酯的生物转化率。表1表明,随着甲苯体积的不断增大,反应转化率也随之增大,当甲苯和tris-hcl缓冲溶液的体积比达到12.5:10时,转化率达到了最大值。之后,随着甲苯体积的增大,转化率开始迅速降低。这可能是由于过量的甲苯对界面自组装酶产生了一定的毒害。而两相体积比的变化对(r)-3-羟基-3-苯基丙酸乙酯的对映体过剩值几乎没有影响,产物(r)-3-羟基-3-苯基丙酸乙酯的对映体过剩值均为100%。因此,甲苯和tris-hcl缓冲溶液最适宜的体积比为12.5:10,反应转化率为96.2%,产物对映体过剩值为100%。
实施例4:
(1)界面自组装酶的制备:方法与实施例3相同。
(2)3-羰基-3-苯基丙酸乙酯的不对称还原:在五个50ml锥形瓶中分别加入以缓冲液体积计浓度分别为0.02、0.04、0.08、0.10和0.14mol/l的nadh,再在每个锥形瓶中分别加入0.2mg乙醇脱氢酶(酶活300u/mg),10mltris-hcl(0.05mol/l、ph7.9)缓冲液,以缓冲液体积计浓度为10%的乙醇和步骤(1)制备的界面自组装羰基还原酶2mg(155u/mg),12.5ml甲苯,以缓冲液体积计浓度为0.056mol/l3-羰基-3-苯基丙酸乙酯进行生物转化反应。在35℃、120r/min的摇床中反应8h。反应结束后,将反应液10000r/min离心10min,甲苯相和tris-hcl缓冲液相能够实现很好的分离。离心后可以获得含有底物3-羰基-3-苯基丙酸乙酯和(r)-3-羟基-3-苯基丙酸乙酯的有机相。离心后获得的tris-hcl缓冲液采用等量乙酸乙酯萃取三次,合并萃取液,旋转蒸发掉大部分乙酸乙酯后将样品与有机相合并。采用气相色谱gc进一步分析合并样品中3-羰基-3-苯基丙酸乙酯和(r)-3-羟基-3-苯基丙酸乙酯的含量,确定转化率和(r)-3-羟基-3-苯基丙酸乙酯的对映体过剩值。
表2nadh的添加量对还原反应的影响
nadh的添加量影响3-羰基-3-苯基丙酸乙酯的生物转化率。转化率随着nadh浓度的增加而增大,当nadh浓度达到0.10mol/l时,转化率不再增大。较佳的nadh添加量为0.10mol/l。nadh添加量的多少对(r)-3-羟基-3-苯基丙酸乙酯的对映体过剩值影响不大,(r)-3-羟基-3-苯基丙酸乙酯的对映体过剩值保持在100%。
实施例5:
(1)界面自组装酶的制备:方法与实施例3相同。
(2)3-羰基-3-苯基丙酸乙酯的不对称还原:在六个50ml锥形瓶中分别加入以缓冲液体积计浓度为0.10mol/l的nadh,0.2mg乙醇脱氢酶(酶活300u/mg),10mltris-hcl(0.05mol/l、ph7.9)缓冲液,以缓冲液体积计浓度为分别为0%、4%、6%、8%、10%和12%的乙醇和步骤(1)制备的界面自组装羰基还原酶2mg(155u/mg),12.5ml甲苯,以缓冲液体积计浓度为0.056mol/l3-羰基-3-苯基丙酸乙酯。在35℃、120r/min的摇床中反应8h。反应结束后,将反应液10000r/min离心10min,甲苯相和tris-hcl缓冲液相能够实现很好的分离。离心后可以获得含有底物3-羰基-3-苯基丙酸乙酯和(r)-3-羟基-3-苯基丙酸乙酯的有机相。离心后获得的tris-hcl缓冲液采用等量乙酸乙酯萃取三次,合并萃取液,旋转蒸发掉大部分乙酸乙酯后将样品与有机相合并。采用气相色谱gc进一步分析合并样品中3-羰基-3-苯基丙酸乙酯和(r)-3-羟基-3-苯基丙酸乙酯的含量,确定转化率和(r)-3-羟基-3-苯基丙酸乙酯的对映体过剩值。
表3乙醇的添加量对还原反应的影响
乙醇在乙醇脱氢酶的作用下转化为乙醛,生成的nadh为还原反应提供源源不断的辅酶,实现辅酶的再生。合适的乙醇添加量有助于提高转化率。最佳的乙醇添加量为10%。在乙醇的各种添加量的情况下,(r)-3-羟基-3-苯基丙酸乙酯的对映体过剩值均保持稳定,保持在100%。
实施例6:
(1)界面自组装酶的制备:方法与实施例3相同。
(2)3-羰基-3-苯基丙酸乙酯的不对称还原:在五个50ml锥形瓶中分别加入以缓冲液体积计浓度为0.10mol/lnadh,0.2mg乙醇脱氢酶(酶活300u/mg),10mltris-hcl(0.05mol/lph7.9)缓冲液和步骤(1)制备的界面自组装羰基还原酶2mg(155u/mg),以缓冲液体积计浓度为10%乙醇,12.5ml甲苯。在五只锥形瓶中分别加入以缓冲液体积计浓度分别为0.037mol/l,0.044mol/l,0.050mol/l,0.056mol/l和0.062mol/l的底物3-羰基-3-苯基丙酸乙酯进行生物转化反应。在35℃、120r/min的摇床中反应8h。反应结束后,将反应液10000r/min离心10min,甲苯相和tris-hcl缓冲液相能够实现很好的分离。离心后可以获得含有底物3-羰基-3-苯基丙酸乙酯和(r)-3-羟基-3-苯基丙酸乙酯的有机相。离心后获得的tris-hcl缓冲液采用等量乙酸乙酯萃取三次,合并萃取液,旋转蒸发掉大部分乙酸乙酯后将样品与有机相合并。采用气相色谱gc进一步分析合并样品中3-羰基-3-苯基丙酸乙酯和(r)-3-羟基-3-苯基丙酸乙酯的含量,确定转化率和(r)-3-羟基-3-苯基丙酸乙酯的对映体过剩值。
表43-羰基-3-苯基丙酸乙酯的添加量对还原反应的影响
底物浓度不同,界面自组装羰基还原酶的催化效率不同。底物浓度过高,对界面自组装酶会存在一定的毒性。底物浓度过低,生产效率不高。因此,合适的底物浓度对催化反应效率的提高至关重要。当底物的浓度由0.037mol/l增加到0.056mol/l时,反应转化率呈上升趋势,当浓度超过0.056mol/l时,转化率明显下降。因此,最适宜的底物浓度为0.056mol/l。底物浓度的大小对产物(r)-3-羟基-3-苯基丙酸乙酯的对映体过剩值没有影响,在底物浓度为0.037~0.062mmol/l的范围内,(r)-3-羟基-3-苯基丙酸乙酯的对映体过剩值为100%。
实施例7:
(1)界面自组装酶的制备:方法与实施例3相同。
(2)3-羰基-3-苯基丙酸乙酯的不对称还原:在五只50ml锥形瓶中分别加入以缓冲液体积计浓度为0.10mol/lnadh,0.2mg乙醇脱氢酶(酶活300u/mg),10mltris-hcl(0.05mol/l、ph7.9)缓冲液和步骤(1)制备的界面自组装羰基还原酶2mg(180u/mg),以缓冲液体积计浓度为10%乙醇,12.5ml甲苯,以缓冲液体积计浓度为0.056mol/l3-羰基-3-苯基丙酸乙酯,将五只锥形瓶分别放置在20℃、25℃、30℃、35℃和40℃,120r/min的摇床中反应8h。反应结束后,将反应液10000r/min离心10min,甲苯相和tris-hcl缓冲液相能够实现很好的分离。离心后可以获得含有底物3-羰基-3-苯基丙酸乙酯和(r)-3-羟基-3-苯基丙酸乙酯的有机相。离心后获得的tris-hcl缓冲液采用等量乙酸乙酯萃取三次,合并萃取液,旋转蒸发掉大部分乙酸乙酯后将样品与有机相合并。采用气相色谱gc进一步分析合并样品中3-羰基-3-苯基丙酸乙酯和(r)-3-羟基-3-苯基丙酸乙酯的含量,确定转化率和(r)-3-羟基-3-苯基丙酸乙酯的对映体过剩值。
表5反应温度对还原反应的影响
温度对还原反应的转化率影响较大。温度不仅影响着酶的稳定性和活性,还影响着反应的平衡。随着温度的不断升高,3-羰基-3-苯基丙酸乙酯的转化率也随之增大。当温度达到35℃时,反应转化率达到最大值,随后转化率随温度的升高开始下降。而温度的变化对(r)-3-羟基-3-苯基丙酸乙酯的对映体过剩值几乎没有影响。因此,反应最佳的温度为35℃。
实施例8:
(1)界面自组装酶的制备:方法与实施例3相同。
(2)3-羰基-3-苯基丙酸乙酯的不对称还原:在六只50ml锥形瓶中分别加入以缓冲液体积计浓度为0.10mol/lnadh,0.2mg乙醇脱氢酶(酶活300u/mg),10mltris-hcl(0.05mol/lph7.9)缓冲液和步骤(1)制备的界面自组装羰基还原酶2mg(155u/mg),以缓冲液体积计浓度为10%乙醇,12.5ml甲苯,以缓冲液体积计浓度为0.056mol/l3-羰基-3-苯基丙酸乙酯,将六只锥形瓶放置在35℃、120r/min的摇床中分别反应3h、4h、5h、6h、8h和10h。反应结束后,将反应液10000r/min离心10min,甲苯相和tris-hcl缓冲液相能够实现很好的分离。离心后可以获得含有3-羰基-3-苯基丙酸乙酯和(r)-3-羟基-3-苯基丙酸乙酯的有机相。离心后获得的tris-hcl缓冲液采用等量乙酸乙酯萃取三次,合并萃取液,旋转蒸发掉大部分乙酸乙酯后将样品与有机相合并。采用气相色谱gc进一步分析合并样品中3-羰基-3-苯基丙酸乙酯和(r)-3-羟基-3-苯基丙酸乙酯的含量,确定转化率和(r)-3-羟基-3-苯基丙酸乙酯的对映体过剩值。
表6反应时间对还原反应的影响
结果表明,随着反应时间的延长,生物转化率逐渐提高,当反应时间大于8小时转化率提高不大,因此确定最佳反应时间为8h。反应时间对(r)-3-羟基-3-苯基丙酸乙酯对映体过剩值的影响不大,均保持在100%。
实施例9:(重复利用)
(1)界面自组装酶的制备:方法与实施例3相同。
(2)3-羰基-3-苯基丙酸乙酯的不对称还原:在六只50ml锥形瓶中分别加入以缓冲液体积计浓度为0.10mol/lnadh,0.2mg乙醇脱氢酶(酶活300u/mg),10mltris-hcl(0.05mol/l、ph7.9)缓冲液和步骤(1)制备的界面自组装羰基还原酶2mg(155u/mg),以缓冲液体积计浓度为10%乙醇,12.5ml甲苯,以缓冲液体积计浓度为0.056mol/l3-羰基-3-苯基丙酸乙酯,将六只锥形瓶放置在35℃、120r/min的摇床中反应8h。反应结束后,将反应液10000r/min离心10min,甲苯相和tris-hcl缓冲液相能够实现很好的分离。离心后可以获得含有3-羰基-3-苯基丙酸乙酯和(r)-3-羟基-3-苯基丙酸乙酯的有机相。采用气相色谱gc进一步分析样品中3-羰基-3-苯基丙酸乙酯和(r)-3-羟基-3-苯基丙酸乙酯的含量,确定转化率和(r)-3-羟基-3-苯基丙酸乙酯的对映体过剩值。将离心后获得的界面自组装酶重新分散在10mltris-hcl(0.05mol/l、ph7.9)缓冲液体系中重复上述反应过程,研究界面自组装酶的重复利用情况。结果如表7所示。
表7反应时间对还原反应的影响
结果表明,随着界面自组装酶的多次重复利用,酶活逐渐降低,转化率逐渐降低。经过六次重复利用,底物的转化率仍然为首次转化率的68.3%。反应次数对(r)-3-羟基-3-苯基丙酸乙酯对映体过剩值的影响不大,均保持在100%。说明界面自组装酶能够很好地被重复利用6次。
实施例10:(对比试验)
(1)界面自组装酶的制备:方法与实施例3相同。
(2)分别以游离羰基还原酶和界面自组装羰基还原酶为催化剂在水相和tris-hcl/甲苯两相体系中催化3-羰基-3-苯基丙酸乙酯的不对称还原反应,进行对比试验。按照实施例2的方法制备得到5mg羰基还原酶(180u/mg),按照实施例3的方法制备得到2mg界面自组装羰基还原酶的比活力为155u/mg。对比试验中分别将5mg(180u/mg)羰基还原酶和由5mg(180u/mg)羰基还原酶制备的界面自组装酶2mg(155u/mg)分散在水相或者tris-hcl/甲苯两相体系中催化3-羰基-3-苯基丙酸乙酯的不对称还原。
两相体系中的对比反应条件如下:在两只50ml锥形瓶中分别加入界面自组装羰基还原酶2mg(155u/mg)和5mg(180u/mg)游离羰基还原酶。在两只锥形瓶中分别加入以缓冲液体积计浓度为0.10mol/lnadh,0.2mg乙醇脱氢酶(酶活300u/mg),10mltris-hcl(0.05mol/lph7.9)缓冲液,以缓冲液体积计浓度为10%乙醇,12.5ml甲苯,以缓冲液体积计浓度为0.056mol/l3-羰基-3-苯基丙酸乙酯,将两只锥形瓶放置在35℃、120r/min的摇床中反应8h,进行对比试验。
水相中的对比反应条件如下:在两只50ml锥形瓶中分别加入界面自组装羰基还原酶2mg(155u/mg)和5mg(180u/mg)游离羰基还原酶。在两只锥形瓶中分别加入以缓冲液体积计浓度为0.10mol/lnadh,0.2mg乙醇脱氢酶(酶活300u/mg),10mltris-hcl(0.05mol/lph7.9)缓冲液,以缓冲液体积计浓度为10%乙醇,以缓冲液体积计浓度为0.056mol/l3-羰基-3-苯基丙酸乙酯,将两只锥形瓶放置在35℃、120r/min的摇床中反应8h,进行对比试验。
反应结束后,将反应液于离心机中10000r/min离心10min,甲苯相和tris-hcl缓冲液相能够实现很好的分离。离心后可以获得含有3-羰基-3-苯基丙酸乙酯和(r)-3-羟基-3-苯基丙酸乙酯的有机相。采用气相色谱gc进一步分析样品中3-羰基-3-苯基丙酸乙酯和(r)-3-羟基-3-苯基丙酸乙酯的含量,确定转化率和(r)-3-羟基-3-苯基丙酸乙酯的对映体过剩值。对比反应结果如表8所示。
表8游离羰基还原酶和界面自组装羰基还原酶在水相和tris-hcl/甲苯两相体系
中催化3-羰基-3-苯基丙酸乙酯的不对称还原反应的对比
结果表明,界面自组装羰基还原酶在tris-hcl/甲苯两相体系中具有最好的还原效果。游离羰基还原酶在水相中具有较好的催化活性,但是底物在水中不溶解,羰基还原酶转化底物需要依靠酶与底物的充分接触连续反应,由于底物在水中溶解度很低,底物与酶的接触受到限制,另一方面,有机底物对酶蛋白分子还存在着活性抑制作用,使酶活性丧失,因此游离羰基还原酶在水相中的催化活性没有达到最佳效果。游离羰基还原酶在tris-hcl/甲苯两相体系的催化活性最低,转化率仅为42.5%,主要是由于有机相对游离酶的活性存在抑制作用。界面自组装羰基还原酶在tris-hcl/甲苯两相体系催化活性最高的原因是酶经过自组装固定化之后酶活稳定性增强,同时在界面处能够连续与底物充分接触进行生物转化反应,因而转化率较高。
实施例11界面自组装羰基还原酶(iacr)制备条件优化
1)有机溶剂的选择
将实施例3中甲苯分别替换为正己烷、正庚烷、二氯甲烷、氯仿、正丁醇和邻苯二甲酸二丁酯,界面自组装方法与实施例3相同。界面自组装酶的界面自组装效率是指界面自组装羰基还原酶的比活力与游离羰基还原酶比活力的比值。
表9不同有机溶剂对iacr界面自组装效率的影响
界面自组装酶的界面自组装效率受有机溶剂的影响。聚苯乙烯在正己烷、正庚烷、正丁醇和邻苯二甲酸二丁酯中的溶解度较低,导致iacr的比活力也偏低。聚苯乙烯易溶于苯、甲苯、二氯甲烷和氯仿,所以酶可以很容易地在tris-hcl/有机溶剂的界面与聚苯乙烯组装,界面自组装羰基还原酶的比活力也较高。界面自组装效率是界面自组装羰基还原酶与游离羰基还原酶的比活力的比例。游离羰基还原酶的比活力为180u/mg。表9表明,以甲苯为有机溶剂,界面自组装效率可达到87%,界面自组装羰基还原酶的比活力为155u/mg。因此,甲苯是制备界面自组装羰基还原酶的最佳有机溶剂,选择甲苯/tris-hcl为最佳两相反应体系。
2)游离羰基还原酶浓度对界面自组装羰基还原酶制备的影响
分别配置0.4g/l,0.8g/l,1.2g/l,1.6g/l,2.0g/l的不同浓度的游离羰基还原酶1.5ml,加入10ml的溶解10mg聚苯乙烯的有机溶剂,将实施例3步骤(1)中酶液的浓度分别改为0.4、0.8、1.2、1.6、2.0g/l,界面自组装方法同实施例3。
表10游离羰基还原酶浓度对界面自组装羰基还原酶制备的影响
在界面自组装羰基还原酶制备过程中,游离羰基还原酶在水相中的初始浓度对界面自组装羰基还原酶的界面组装效率有显著的影响。游离羰基还原酶的最佳初始浓度将有利于其与聚苯乙烯在tris-hcl和甲苯两相界面处的组装。蛋白质自组装率定义为在tris-hcl缓冲液中界面自组装羰基还原酶和游离羰基还原酶的蛋白质含量的比例。蛋白质自组装率高则表明更多的羰基还原酶与聚苯乙烯进行组装,它会随着游离羰基还原酶的初始浓度增加而降低。加入不同初始蛋白浓度的游离羰基还原酶,界面自组装羰基还原酶的界面组装效率基本保持在86%。因此,选择游离羰基还原酶的最佳初始浓度为0.8g/l。
3)聚苯乙烯浓度对iacr制备的影响
将1.5ml的羰基还原酶加入10ml的聚苯乙烯浓度分别为1.25g/l,2.50g/l,3.75g/l,5.00g/l,7.50g/l,10.00g/l的有机溶剂中,将实施例3步骤(1)中聚苯乙烯浓度分别改为1.25、2.5、3.75、5.0、7.5、10g/l,界面自组装方法同实施例3。蛋白自组装比率是指界面自组装酶中蛋白的含量与游离羰基还原酶中蛋白含量的比值。
表11聚苯乙烯浓度对iacr制备的影响
聚合物-酶缀合物可以在油/水界面处自组装并影响界面生物转化。由亲水蛋白质头部和疏水聚合物尾部组成的似表面活性剂的结构有利于界面自组装酶的构建。在制备iacr过程中,羰基还原酶浓度为0.8g/l时,适宜浓度的聚苯乙烯有利于其与羰基还原酶更好地结合,增加反应的催化活性,实验结果见表11。随着聚苯乙烯浓度的增加,蛋白质自组装率也随之增加,但当ps浓度超过5.00g/l时,蛋白质自组装率开始保持稳定。因此当羰基还原酶浓度为0.8g/l时,聚苯乙烯最适宜的浓度为5.00g/l。
序列表
<110>浙江工业大学
<120>一种界面自组装羰基还原酶及在(r)-3-羟基-3-苯基丙酸乙酯合成中的应用
<160>1
<170>siposequencelisting1.0
<210>1
<211>584
<212>dna
<213>热带假丝酵母(candidatropicalis)
<400>1
gcggaggaaaagaaaccaacagggattgccttagtagcggcgagtgaagcggcaaaagct60
caaatttgaaatctggctctttcagagtccgagttgtaatttgaagaaggtatctttggg120
tctggctcttgtctatgtttcttggaacagaacgtcacagagggtgagaatcccgtgcga180
tgagatgatccaggcctatgtaaagttccttcgaagagtcgagttgtttgggaatgcagc240
tctaagtgggtggtaaattccatctaaagctaaatattggcgagagaccgatagcgaaca300
agtacagtgatggaaagatgaaaagaactttgaaaagagagtgaaaaagtacgtgaaatt360
gttgaaagggaagggcttgagatcagacttggtattttgtatgttacttcttcgggggtg420
gcctctacagtttatcgggccagcatcagtttgggcggtaggagaattgcgttggaatgt480
ggcacggcttcggttgtgtgttatagccttcgtcgatactgccagcctagactgaggact540
gcggtttatacctaggatgttggcataatgatcttaagtcgccc584
- 还没有人留言评论。精彩留言会获得点赞!