苜蓿花叶病毒real-timeRT-PCR检测试剂盒及其检测方法与流程
本发明属于生物技术领域,涉及一种苜蓿病害的检测方法,主要针对苜蓿花叶病毒的检测。
背景技术
由苜蓿花叶病毒(alfalfamosaicvirus,amv)引起的花叶病,首次报道于1931年,目前在世界各地都有发生。苜蓿花叶病毒属于雀麦花叶病毒科(bromoviridae)苜蓿花叶病毒属(alfamovirus)的确定种。该病毒寄主范围广,自然发生在许多草本和木本植物上,能侵染51个科的430种双子叶植物,其中具有经济价值的重要寄主有苜蓿、马铃薯、大豆、豇豆、赤豆、绿豆、草木樨、三叶草、野豌豆、羽扇豆、香豌豆、鹰嘴豆、豌豆、蚕豆、小扁豆、菜豆、烟草、辣椒、番茄、啤酒花和芹菜等。
苜蓿花叶病毒可通过蚜虫、汁液、花粉和种子进行传播,种子是远距离传播的主要途径。该病毒在苜蓿、大豆、辣椒上可种传。苜蓿种传率10%,辣椒种传率1%~5%,假酸浆种传率23%。病毒在苜蓿种子内至少存活10年,种子带毒率0~10%,一般为2%~4%。该病毒可与其它病毒混合侵染,影响作物产量,造成严重的经济损失。
实时荧光定量pcr(real-timepcr)技术完全闭管扩增和检测,无须pcr的后处理,可有效地防范pcr扩增物的污染,通过荧光pcr检测仪自动收集和分析数据,无须人工判断,观察结果可靠。该技术可实现对dna/rna模板的定量,具有灵敏度和特异性高、能进行多重反应、自动化程度高、无污染、实时和准确等特点,目前已广泛应用于分子生物学研究领域。建立苜蓿花叶病毒实时荧光rt-pcr检测方法,可用于携带有苜蓿花叶病毒的种子、苗木、繁殖材料及其产品的检测,及时、快速、准确地检测苜蓿花叶病毒,防止其随种子苗木扩散传播,为农业生产安全提供技术保障。
技术实现要素:
本发明的目的提供一种苜蓿花叶病毒real-timert-pcr检测试剂盒,检测病原为苜蓿花叶病毒。
本发明的又一目的提供一种苜蓿花叶病毒real-timert-pcr检测方法,适合种子、苗木、繁殖材料中苜蓿花叶病毒的测定。
为实现上述目的,本发明的技术方案是:
一种苜蓿花叶病毒real-timert-pcr检测试剂盒,检测病原为苜蓿花叶病毒,包括以下组分:
rt-pcrbuffer,2×rt-pcrbuffer,40-250μl;extaqhs5u/μl,1.5-20μl;primescriptrtenzymemix,1.5-20μl;苜蓿花叶病毒amv上游引物,浓度为10μmol/l,1.5-30μl;苜蓿花叶病毒amv下游引物,浓度为10μmol/l,1.5-30μl;苜蓿花叶病毒amv探针10μmol/l,1.5-30μl;无rna酶的去离子水,20μl-1ml;苜蓿花叶病毒amv无侵染活性的阳性对照6-60μl。rt-pcr扩增引物和探针为:
苜蓿花叶病毒amv上游引物为:5′-gctacaggagagttagtg-3′;
苜蓿花叶病毒amv下游引物为:5′-gacagcagagttcatattg-3′;
苜蓿花叶病毒amv探针序列为:5′-tgttgacaccgaccatgatgcta-3′。
一种苜蓿花叶病毒real-timert-pcr检测方法,具体为:
1)待测样品rna提取;
2)rt-pcr反应体系为20μl,其中2×onesteprt-pcrbuffer10μl,extaqhs5u/μl0.4μl,primescriptrtenzymemix0.4μl,苜蓿花叶病毒amv上下游引物10μmol/l各0.4μl,苜蓿花叶病毒amvprobe10μmol/l0.8μl,总rna模板2μl,无rna酶的去离子水;
3)rt-pcr反应条件为:
cdna合成:42℃5min,1个循环;
pcr扩增:95℃10s;95℃5s,59℃34s,40个循环;
4)采用实时荧光pcr检测仪进行pcr扩增及结果分析,通过荧光定量检测,根据荧光检测的ct值判断结果,荧光rt-pcr反应呈阳性,则待测样品中含有amv核酸。
本发明根据amv的保守序列区设计了检测引物和探针,建立了实时荧光rt-pcr反应体系和反应程序。
有益效果:本发明能检测苜蓿花叶病毒,检测周期短。利用该检测方法能特异扩增出苜蓿花叶病毒的基因片段,检测的稳定性好,特异性强,一致性高,可用于amv的早期诊断和田间病原调查,实现了苜蓿花叶病毒病的高效快速检测,有利于摸清田间病害发生状况,可为苜蓿健康生产提供有效的监控手段,还对苜蓿其它病原的检测具有一定的参考价值。
附图说明
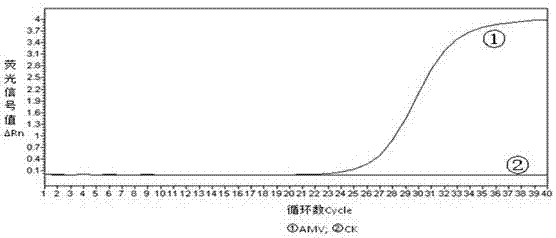
图1为本发明real-timert-pcr扩增曲线;
图中:①:苜蓿花叶病毒;②:阴性对照;
图2为本发明real-timert-pcr灵敏度扩增曲线;
图中:①:苜蓿花叶病毒rna抽提液;②:101倍梯度稀释;③:102倍梯度稀释;④:103倍梯度稀释;⑤:104倍梯度稀释;⑥:105倍梯度稀释;
图3为本发明感病样品进行real-timert-pcr检测的扩增曲线;
图中:①:感染苜蓿花叶病毒的苜蓿样品;②:水对照。
具体实施方式
以下对本发明的原理和特征进行描述,所举实例只用于解释本发明,并非用于限定本发明的范围。所述技术领域的普通技术人员依据以上本发明公开的内容和各参数所取范围,均可实现本发明的目的。
实施例1:一种苜蓿花叶病毒real-timert-pcr检测试剂盒,检测病原为苜蓿花叶病毒,其包括以下组分:
rt-pcrbuffer,2×rt-pcrbuffer,250μl;extaqhs5u/μl,20μl;primescriptrtenzymemix,20μl;苜蓿花叶病毒amv上游引物,浓度为10μmol/l,30μl;苜蓿花叶病毒amv下游引物,浓度为10μmol/l,30μl;苜蓿花叶病毒amv探针10μmol/l,30μl;无rna酶的去离子水,1ml;苜蓿花叶病毒amv无侵染活性的阳性对照60μl。
rt-pcr扩增引物和探针为:
苜蓿花叶病毒amv上游引物为:5′-gctacaggagagttagtg-3′;
苜蓿花叶病毒amv下游引物为:5′-gacagcagagttcatattg-3′;
苜蓿花叶病毒amv探针序列为:5′-tgttgacaccgaccatgatgcta-3′。
实施例2:一种苜蓿花叶病毒real-timert-pcr检测试剂盒,苜蓿病原为苜蓿花叶病毒,其包括以下组分:
rt-pcrbuffer,2×rt-pcrbuffer,40μl;extaqhs5u/μl,1.5μl;primescriptrtenzymemix,1.5μl;苜蓿花叶病毒amv上游引物,浓度为10μmol/l,1.5μl;苜蓿花叶病毒amv下游引物,浓度为10μmol/l,1.5μl;苜蓿花叶病毒amv探针10μmol/l,1.5μl;无rna酶的去离子水,20μl;苜蓿花叶病毒amv无侵染活性的阳性对照6μl。
rt-pcr扩增引物和探针为:
苜蓿花叶病毒amv上游引物为:5′-gctacaggagagttagtg-3′;
苜蓿花叶病毒amv下游引物为:5′-gacagcagagttcatattg-3′;
苜蓿花叶病毒amv探针序列为:5′-tgttgacaccgaccatgatgcta-3′。
实施例3:一种苜蓿花叶病毒real-timert-pcr检测方法,具体为:
1)待测样品rna提取;
2)rt-pcr反应体系为20μl,其中2×onesteprt-pcrbuffer10μl,extaqhs5u/μl0.4μl,primescriptrtenzymemix0.4μl,苜蓿花叶病毒amv上下游引物10μmol/l各0.4μl,苜蓿花叶病毒amvprobe10μmol/l0.8μl,总rna模板2μl,无rna酶的去离子水补足反应总体积;
3)rt-pcr反应条件为:
cdna合成:42℃5min,1个循环;
pcr扩增:95℃10s;95℃5s,59℃34s,40个循环;
4)采用实时荧光pcr检测仪进行pcr扩增及结果分析,通过荧光定量检测,根据荧光检测的ct值判断结果,荧光rt-pcr反应呈阳性,则待测样品中含有amv核酸。
实验例1:一种苜蓿花叶病毒real-timert-pcr检测方法,其步骤为:
1.待测苜蓿叶片样品核酸提取;
2.rt-pcr扩增:
rt-pcr扩增所需体系如下:在20μl反应体系中进行rt-pcr扩增,其中2×onesteprt-pcrbuffer10μl,extaqhs0.4μl,primescriptrtenzymemix0.4μl,10μmol/lamv上下游引物各0.4μl,10μmol/lamvprobe0.8μl,总rna模板2μl,无rna酶的去离子水补足反应总体积。上述各条引物在反应体系中的终浓度如下:amv上下游引物终浓度为0.2μmol/l,amvprobe终浓度为0.4μmol/l。
rt-pcr反应条件为:
cdna合成:42℃5min,1个循环;
pcr扩增:95℃10s;95℃5s,59℃34s,40个循环。
3.pcr扩增产物检测:
real-timepcr扩增结束后,利用荧光定量pcr仪分析软件对扩增的图谱进行分析,如果pcr反应有明显的扩增曲线,初始循环数(ct)≤35时,判定pcr反应为阳性;ct≥40时,判定pcr反应为阴性。荧光rt-pcr反应呈阳性,则待测样品中含有amv核酸。
4.扩增结果分析:
以苜蓿花叶病毒rna为模板进行real-timert-pcr扩增,结果显示实时荧光反应具有良好的扩增曲线(ct值为22.52)(见图1)。表明用以检测所设计的引物、探针、real-timepcr反应体系和反应条件均能满足amv实时荧光pcr检测的需要。
5.rt-pcr灵敏度的测试:
分别用无rna酶的去离子水10倍梯度稀释总核酸模板,各取2μl作模板检测real-timert-pcr的灵敏度,结果显示:总rna使用量从100到105稀释范围内可以得到较好的实时荧光检测结果,见图2。
实验例2,一种苜蓿花叶病毒real-timert-pcr检测方法,其步骤为:
1.待测苜蓿种子样品核酸提取;
2.rt-pcr扩增:
rt-pcr反应体系为20μl,其中2×onesteprt-pcrbuffer10μl,extaqhs0.4μl,primescriptrtenzymemix0.4μl,10μmol/lamv上下游引物各0.4μl,10μmol/lamvprobe0.8μl,总rna模板2μl,rnasefreedh2o5.6μl。
rt-pcr反应条件为:
cdna合成:42℃5min,1个循环;
pcr扩增:95℃10s;95℃5s,59℃34s,40个循环。
3.pcr扩增产物检测:
real-timepcr扩增结束后,利用荧光定量pcr仪分析软件对扩增的图谱进行分析,如果pcr反应有明显的扩增曲线,初始循环数(ct)≤35时,判定pcr反应为阳性;ct≥40时,判定pcr反应为阴性。
结果表明,该检测样品有扩增曲线(ct值为25.58),而阴性对照无扩增(图3),待测样品amv检测为阳性。
上述实施例3及实验例1、2中待测样品核酸提取方法:利用trizol提取植物总rna,具体:
1)取感染苜蓿花叶病毒的苜蓿叶片或种子,称取0.1g感病样品组织倒在洁净的研钵内,加液氮研磨成粉末状;
2)移入1.5ml离心管中,然后加入1ml的trizol,剧烈振荡3min以上;
3)4℃下,12000rpm离心10min以除去不溶成分,将上清转入另一新的1.5ml离心管中;
4)在室温下静置5min,加0.2ml氯仿/mltrizol,剧烈振荡15s,然后在室温下静置15min,再于4℃、12000rpm的条件下离心15min;
5)将上层水相转移到新的1.5ml离心管中,加0.5ml异丙醇/mltrizol,上下颠倒混匀,室温静置15min;
6)4℃、12000rpm离心10min;
7)弃上清,加入75%的乙醇洗涤沉淀,然后4℃、7500rpm离心2min,弃乙醇;
8)沉淀在室温下干燥10min或在冷冻离心浓缩机上浓缩5min,加入30µl无rnase水溶解,-70℃保存备用。
- 还没有人留言评论。精彩留言会获得点赞!