一种提取地杆菌胞外多聚物的方法与流程
本发明涉及一种提取地杆菌胞外多聚物的方法,属于微生物领域。
背景技术:
微生物胞外多聚物eps主要由多糖、蛋白和腐殖酸组成,是由微生物分泌的一类粘性有机高分子多聚物,附在细菌表面或者围绕在细菌周围,形成一层保护层,从而使微生物在干燥、温度和ph等环境因素不利的条件下也能生存。目前研究将胞外多聚物分为可溶性胞外多聚物(s-eps)、疏松结合型胞外多聚物(lb-eps)、紧密结合型胞外多聚物(tb-eps),由外及里分布在细菌的表面及周围。胞外多聚物有很多种提取方法,但其提取方法还没有统一的标准,胞外多聚物的特性也会随着提取方法的改变发生变化。
地杆菌geobactersulfurreducenspca和geobactersoligss01具有高效的胞外电子传递能力,可作为地杆菌研究的模式物种。地杆菌作为研究胞外电子传递途径的重要菌株,其电子传递途径类别目前已知的有三种,直接电子传递,电子穿梭体传递和纳米导线电子传递。现有技术中,大多是对好氧颗粒污泥提取胞外多聚物。研究表明,胞外多聚物中存在着参与胞外电子传递途径的氧化还原介体,因此找到一种高效提取地杆菌的胞外多聚物是迫在眉睫的,这能为胞外多聚物eps与胞外电子传递途径的关系研究提供技术支持。
技术实现要素:
本发明的目的在于提供一种提取地杆菌胞外多聚物的方法。
本发明所采取的技术方案是:
一种提取地杆菌胞外多聚物的方法,所述的步骤如下:
1)收集微生物燃料电池的电解液中可溶的s-eps;将微生物燃料电池石墨板电极上的生物膜刮下,用溶液将生物膜悬浮得生物膜悬浮液;
2)将生物膜悬浮液超声、震荡、超声、离心得上清液和沉淀,上清液过滤取滤液得lb-eps;
3)将步骤2)离心后的沉淀悬浮在溶液中,超声、离心分离得到上清液和沉淀,重复2~3次,将所有获得的上清液混合过滤膜,取滤液得到tb-eps。
进一步的,步骤1)所述的溶液为0.9%nacl溶液。
进一步的,步骤2)所述的超声为在冰水浴中超声1~5分钟。
进一步的,步骤2)所述的震荡条件为100~200转/分钟震荡7~15分钟。
进一步的,步骤2)、3)离心条件为在4000~7000g、4~6℃离心10~20min。
进一步的,步骤2)、3)所述的超声功率为300~500w,超声时间为5~12分钟。
进一步的,步骤2)、3)使用0.22μm孔径的滤膜过滤。
根据上述任一项所述的方法制备的胞外多聚物。
进一步的,所述的胞外多聚物为可溶性胞外多聚物、疏松结合胞外多聚物和紧密结合胞外多聚物的至少一种。
本发明的有益效果是:
本发明是提供一种高效提取地杆菌胞外多聚物的方法,采用微生物燃料电池培养生物膜,将超声与离心方法相结合,进行地杆菌胞外多聚物的分层提取,分别提取出可溶性s-eps、疏松结合eps(lb-eps)和紧密结合eps(tb-eps)。本发明对地杆菌进行胞外多聚物的分层提取,可以减少提取过程中细菌的损伤,而且尽可能地提高胞外多聚物的提取量。本发明提取的胞外多聚物含有的氧化还原活性蛋白较多,并且首次对地杆菌胞外多聚物的特性进行表征,这可为胞外多聚物eps与胞外电子传递途径之间的研究提供技术支持。
附图说明
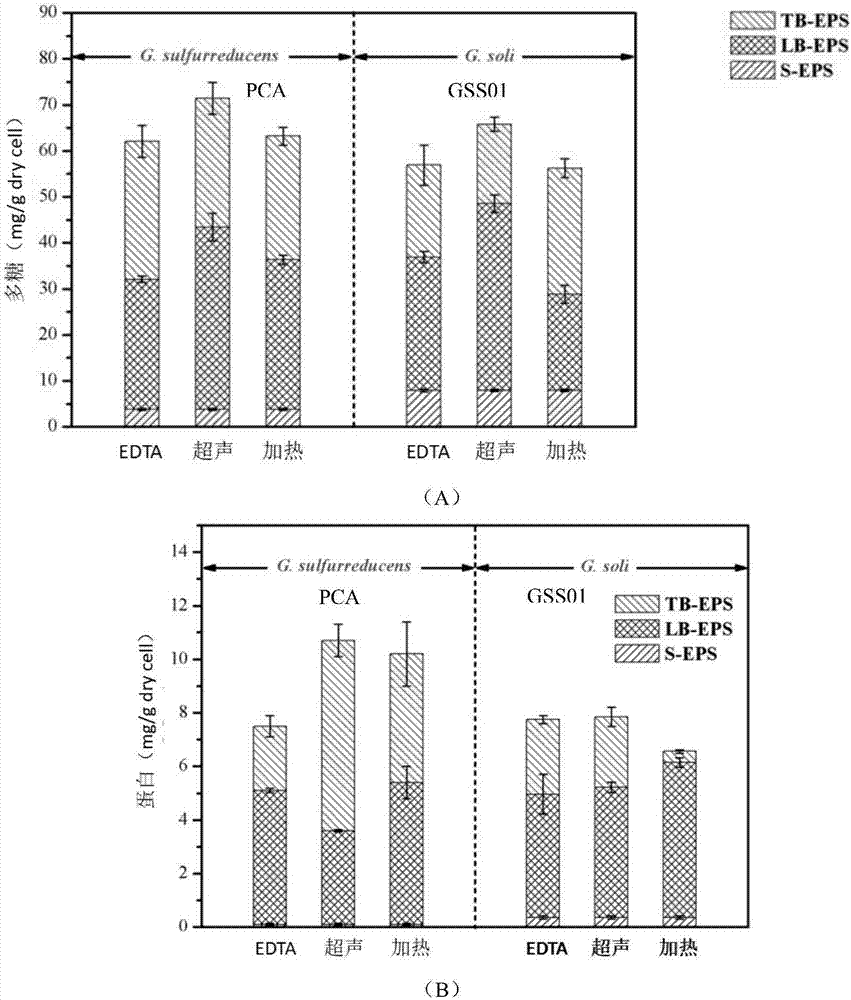
图1为pca和gss01在不同方法提取的eps的多糖(a)、蛋白(b)含量;
图2为菌株pca在edta法(b)、超声法(c)和加热法(d)提取三种了胞外多聚物后的扫描电镜图;
图3为菌株gss01在edta法(b)、超声法(c)和加热法(d)提取了三种胞外多聚物后的扫描电镜图;
图4为菌株pca在edta法(b)、超声法(c)和加热法(d)提取eps后的荧光显微镜图;
图5为菌株gss01在edta法(b)、超声法(c)和加热法(d)提取eps后的荧光显微镜图;
图6为使用不同方法对菌株pca提取的s-eps、lb-eps和tb-eps的荧光光谱图;
图7为使用不同方法对菌株gss01提取的s-eps、lb-eps和tb-eps的荧光光谱图;
图8为菌株pca在不同方法提取的lb-eps(a)、tb-eps(b)的cv图;
图9为菌株gss01在不同方法提取的lb-eps(a)、tb-eps(b)的cv图。
具体实施方式
下面结合实施例对本发明作进一步说明。
实施例1
1)利用chi1010c电化学工作站培养阳极生物膜,微生物燃料电池采用三电极体系,其中饱和甘汞电极为参比电极,15mm*10mm*5mm长方体石墨板为工作电极和对电极,电化学工作站运行amperometrici-tcurve模式,当电流运行至第三周期最高点时,电化学工作站停止运行。拆开电池,取下工作电极石墨板,取电解液获取可溶性eps(s-eps),用0.9%nacl溶液冲洗石墨板电极,以去除石墨板上沾有的可溶性eps(s-eps)。将石墨板上的生物膜刮下,悬浮于0.9%nacl溶液中,得生物悬浮液,取一定体积悬浮液测出od600值,又取一定体积悬浮液烘干,计算其密度,并算出细胞量;
2)取步骤1)中的生物悬浮液1ml置于离心管中,另加0.9%nacl溶液至7ml,调节超声细胞破碎仪(scientz-ⅱd)功率至480w,将生物悬浮液冰水浴超声2min,然后在150转/分钟条件下水平震荡10min,再超声2min,接着5000g、4℃离心15min,将沉淀和上清液分离,上清液使用0.22μm孔径的滤膜过滤,取滤液得疏松结合eps(lb-eps);
3)将步骤2)离心后的沉淀,用0.9%nacl溶液重悬补足至4ml,调节超声细胞破碎仪(scientz-ⅱd)功率至480w,冰水浴超声10min,5000g、4℃离心20min,收集上清液;再使用1ml0.9%nacl溶液重悬离心后的沉淀,5000g、4℃离心15min,收集上清液;再使用1ml0.9%nacl溶液重悬离心后的沉淀,5000g、4℃离心15min,收集上清液;最后将3次上清液混合,使用0.22μm孔径的滤膜过滤,取滤液得到紧密结合eps(tb-eps)。
实施例2
1)利用chi1010c电化学工作站培养阳极生物膜,微生物燃料电池采用三电极体系,其中饱和甘汞电极为参比电极,15mm*10mm*5mm长方体石墨板为工作电极和对电极,电化学工作站运行amperometrici-tcurve模式,当电流运行至第三周期最高点时,电化学工作站停止运行。拆开电池,取下工作电极石墨板,取电解液获取可溶性eps(s-eps)s-eps,用0.9%nacl溶液冲洗石墨板电极,以去除石墨板上沾有的可溶性eps(s-eps)。将石墨板上的生物膜刮下,悬浮于0.9%nacl溶液中,得生物悬浮液,取一定体积悬浮液测出od600值,又取一定体积悬浮液烘干,计算其密度,并算出细胞量;
2)取步骤1)中的生物悬浮液1ml置于离心管中,另加0.9%nacl溶液至7ml,调节超声细胞破碎仪(scientz-ⅱd)功率至500w,将生物悬浮液冰水浴超声5min,然后在200转/分钟条件下水平震荡10min,超声2min,接着5000g、6℃离心20min,将沉淀和上清液分离,上清液使用0.22μm孔径的滤膜过滤,取滤液得疏松结合eps(lb-eps);
3)将步骤2)离心后的沉淀,用0.9%nacl溶液重悬补足至4ml,调节超声细胞破碎仪(scientz-ⅱd)功率至500w,超声12min后,7000g、6℃离心20min,收集上清液;再使用1ml0.9%nacl溶液重悬离心后的沉淀,7000g、6℃离心20min,收集上清液;再使用1ml0.9%nacl溶液重悬离心后的沉淀,7000g、4℃离心15min,收集上清液;最后将3次上清液混合,使用0.22μm孔径的滤膜过滤,取滤液得到紧密结合eps(tb-eps)。
实施例3
1)利用chi1010c电化学工作站培养阳极生物膜,微生物燃料电池采用三电极体系,其中饱和甘汞电极为参比电极,15mm*10mm*5mm长方体石墨板为工作电极和对电极,电化学工作站运行amperometrici-tcurve模式,当电流运行至第三周期最高点时,电化学工作站停止运行。拆开电池,取下工作电极石墨板,取电解液获取可溶性eps(s-eps)s-eps,用0.9%nacl溶液冲洗石墨板电极,以去除石墨板上沾有的可溶性eps(s-eps)。将石墨板上的生物膜刮下,悬浮于0.9%nacl溶液中,得生物悬浮液,取一定体积悬浮液测出od600值,又取一定体积悬浮液烘干,计算其密度,并算出细胞量;
2)取步骤1)中的生物悬浮液1ml置于离心管中,另加0.9%nacl溶液至7ml,调节超声细胞破碎仪(scientz-ⅱd)功率至500w,将生物膜悬浮液冰水浴超声1min,然后在200转/分钟条件下水平震荡7min,超声2min,接着4000g、4℃离心10min,将沉淀和上清液分离,上清液使用0.22μm孔径的滤膜过滤,取滤液得疏松结合eps(lb-eps);
3)将步骤2)离心后的沉淀,用0.9%nacl溶液重悬补足至4ml,调节超声细胞破碎仪(scientz-ⅱd)功率至300w,超声5min后,4000g、4℃离心10min,收集上清液;再使用1ml0.9%nacl溶液重悬离心后的沉淀,4000g、4℃离心10min,收集上清液;再使用1ml0.9%nacl溶液重悬离心后的沉淀,4000g、4℃离心15min,收集上清液;最后将3次上清液混合,使用0.22μm孔径的滤膜过滤,取滤液得到紧密结合eps(tb-eps)。
对本发明做进一步效果检测。
1.不同方法提取的eps的蛋白、多糖比较
将s-eps、lb-eps以及tb-eps的多糖、蛋白进行检测,检测方法步骤如下:
利用苯酚硫酸法检测eps的多糖含量,具体步骤如下:1)取1ml样品,加入2.5ml96%的硫酸水解;2)加入500μl4%的苯酚溶液显色;3)显色30min,用紫外分光光度计(uv2600)检测样品,检测波长为490nm。
利用bradford剂进行蛋白检测,具体操作步骤如下:1)取20μl样品以及bsa加入酶标板孔,加入200μlbradrod溶液;2)室温25-30℃反应5min,在酶标仪(bio-radimark,ty0608)测波长为a595的吸光度值。
结果:由图1可见,菌株gss01和pca用超声法提取胞外多聚物的多糖、蛋白含量最多,而胞外多聚物主要由多糖和蛋白组成,所以可以推断出超声法提取的胞外多聚物的含量最多。
2.不同提取eps方法的形貌特征
利用扫描电镜(ultra55)观察细胞形貌,扫描电镜样品制备步骤如下:
1)2.5%戊二醛固定5h;
2)蒸馏水浸泡6次,每次10-20min;
3)用乙醇梯度脱水,30%乙醇浸泡两次,每次10min;
4)50%%乙醇浸泡两次,每次10min;
5)70%乙醇浸泡两次,每次15min;
6)90%乙醇浸泡两次,每次15min;
7)无水%乙醇浸泡两次,每次15min;
8)放冷冻干燥机(scientz-10n)冷冻干燥12h;
9)样品干燥后贴台,溅射黄金,样品制作完成。
结果:由图2和图3扫描电镜图可见,从细菌破损率看,相对于对照组,无论是pca(图2)还是gss01(图3),加热法造成的细菌破损率比较多,edta法和超声法细菌破损的较少。无论是gss01还是pca,与对照组相比,超声法提取后细菌表面较光滑,表明残留在细菌表明的eps含量减少,这显示了超声法提取的eps含量最多。
3.不同提取eps方法的细胞损伤率
利用live/deadbaclightbacterialviabilitykit试剂盒(invitrogen,ca)对从石墨板刮下的细胞膜进行染色,然后通过流式细胞仪(bdfacscanto)和倒置荧光显微镜(olympusix53)确定超声提取法对细胞损伤率最小(流式细胞仪检测结果见表1,倒置荧光显微镜检测结果见图4和图5)。
具体染色步骤如下:1)将生物膜悬浮于0.9%nacl溶液中,待染样品:染料混合液按照1000:3进行染色;2)染料混合液由syto9.0和pi等比例混合而成;3)染色在暗环境中操作,染色后避光反应15min,染色完成后用无菌生理盐水清洗,去除多余的染色液。染色完成后立即观察结果。生物膜的绿色部分越多,则活细胞越多,反之越低。
表1不同提取方法的细胞损失率
结果:由图4(pca)和图5(gss01)可知,加热法的红色荧光最多,细胞损伤率是最高的,超声法和edta法红色部分都相对较少,细胞损伤率较低。而pi的荧光强度越强,表示细胞死亡率越高,由表1可知gss01超声提取后的pi值为95463,pca超声提取后pi值为28628,无论是pca还是gss01,超声法提取后的荧光强度是最低的,表明了超声提取后的细胞损伤率是最低的。
4.不同提取方法得到的eps组分特征
三维荧光光谱是由激发波长(y轴)、发射波长(x轴)、荧光强度(z轴)三维坐标所表征的矩阵光谱。三维荧光光谱图一般有三维投影图和等高线荧光光谱图这两种表示方式。物质的荧光强度与激发光的波长和所测量发射光的波长有关,所以可以利用三维荧光光谱确定未知物质的组分。
本实验中,利用荧光分光光度计(日立f-7000)测定eps的三维荧光光谱,三维荧光光谱的激发波长范围为200-450nm,增量为5nm,发射波长为200-600nm,增量为5nm。图6为菌株pca在不同方法提取的eps的荧光光谱图,图7为菌株gss01在不同方法提取的eps的荧光光谱图。
结果:由图6和图7可知,s-eps的三维荧光光谱共发现三个吸收峰:ex/em=275/350nm,315/400nm,230/380nm,275/350nm为色氨酸吸收峰,一般代表蛋白质,315/400nm为腐殖酸类物质吸收峰,230/380nm为富里酸类物质吸收峰;lb-eps和tb-eps的三维荧光光谱共发现两个吸收峰:ex/em=275/350nm,225/350nm,其中225/350nm为芳香族氨基酸吸收峰。
综上,eps组分中除了含有蛋白质、多糖和核酸外,还存在富里酸和腐殖酸。这是首次对地杆菌胞外多聚物的特性进行表征。
5.不同提取方法得到的eps的伏安分析
利用循环伏安法(cyclicvoltammetry,cv)对不同提取方法的胞外多聚物的氧化还原性进行研究。cv扫描在电化学工作站chi660e上完成,cv扫描参数如下:inite(v)=0.2v,highe(v)=0.2v,lowe(v)=-0.8v,finale(v)=0.2v,扫描速度=5mv/s。
结果:由图8(pca)和图9(gss01)可知,lb-tbs和tb-eps的cv扫描图都有两对氧化还原峰,表观电位为-0.5v左右和0v左右,这说明三种方法提取的lb-eps和tb-eps有相同的氧化还原活性蛋白。从峰值大小来看,峰值大小与氧化还原活性蛋白成正比,超声法和加热法的峰值要大于edta的峰值,说明超声法和加热法的提取的eps氧化还原活性蛋白含量要比edta法多。在pca和gss01的tb-epscv扫描图中(见图8(b)和图9(b)),超声法的峰值比edta法和加热法高,说明超声法提取的tb-eps中含有的氧化还原活性蛋白最多。
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!