一种盐酸左布诺洛尔的制备方法与流程
本发明涉及医药合成技术领域,具体涉及一种盐酸左布诺洛尔的制备方法。
背景技术:
盐酸左布诺洛尔是一类非选择性β-受体阻滞剂,对开角型青光眼具有良好的治疗效果,已被美国fda列为治疗青光眼的首选药物。作为一种手性药物,现有的合成路线包括手性拆分(中国药物化学杂志,2010,20,1,32)或直接不对称合成(us5426227a;中国药物化学杂志,2003,13,3,166),但是,采用手性拆分法制备盐酸左布诺洛尔普遍存在拆分后合成效率不高的问题,直接不对称合成盐酸左布诺洛尔通常采用手性环氧氯丙烷作为原料,由于环氧氯丙烷分子与亲核试剂反应时,有2个反应位点(1位和3位,对消旋环氧氯丙烷来说,1位和3位反应得到的产物一致;但是对手性环氧氯丙烷来说,1位和3位反应得到的产物的立体构型发生翻转),存在区域选择性差造成光学纯度难以控制的问题。
技术实现要素:
本发明的目的在于提供一种盐酸左布诺洛尔的制备方法,本发明提供的方法盐酸左布诺洛尔收率和光学纯度高。
为了实现上述发明目的,本发明提供以下技术方案:
本发明提供了一种盐酸左布诺洛尔的制备方法,包括以下步骤:
将5-羟基-1-四氢萘酮与s-1-叔丁基-环氧基甲基胺、碱性试剂和溶剂混合,进行取代反应,得到s-5-(3′-叔丁胺基-2′-羟基)-丙氧基-3,4-二氢-1(2h)萘满酮;
将所述s-5-(3′-叔丁胺基-2′-羟基)-丙氧基-3,4-二氢-1(2h)萘满酮进行酸化处理,得到盐酸左布诺洛尔。
优选地,所述5-羟基-1-四氢萘酮的制备方法,包括以下步骤:
将1,5-二羟基萘、金属催化剂、还原剂和醇-水溶剂混合,进行还原反应,得到5-羟基-1-四氢萘酮。
优选地,所述金属催化剂包括钯碳或雷尼镍;所述金属催化剂的质量为1,5-二羟基萘质量的0.5~10%。
优选地,所述还原剂包括甲酸铵、甲酸钠、甲酸钾、甲酸和水合肼中的一种或多种;所述还原剂与所述1,5-二羟基萘的摩尔比为(1~3):1。
优选地,所述醇-水溶剂中的醇类化合物包括甲醇、乙醇、正丙醇、异丙醇、正丁醇、异丁醇和仲丁醇种的一种或多种;所述醇-水溶剂中的醇类化合物和水的质量比为(0.05~20):1;所述醇-水溶剂与1,5-二羟基萘的质量比为(5~15):1。
优选地,所述还原反应在常压条件下进行;所述还原反应的温度为60~120℃,时间为3~9h。
优选地,所述碱性试剂包括氢氧化钠、乙醇钠、甲醇钠或氢氧化钾;所述溶剂包括甲醇、乙醇、甲醇水溶液或乙醇水溶液。
优选地,所述5-羟基-1-四氢萘酮、s-1-叔丁基-环氧基甲基胺与碱性试剂的摩尔比1:(0.8~1.1):(1~3);所述5-羟基-1-四氢萘酮与溶剂的质量比为1:(5~15)。
优选地,所述取代反应的温度为20~90℃,时间为3~12h。
优选地,所述酸化处理后还包括:
将酸化处理后所得体系进行抽滤,采用乙醇对所得滤饼进行重结晶,干燥,得到盐酸左布诺洛尔。
本发明提供了一种盐酸左布诺洛尔的制备方法,本发明采用s-1-叔丁基-环氧基甲基胺与5-羟基-1-四氢萘酮进行取代反应,经酸化处理后制备得到目标产物盐酸左布诺洛尔。本发明提供的方法大大提升了反应的区域选择性,避免发生副反应,有效提高了盐酸左布诺洛尔的收率和光学纯度,收率达87.3%,ee值超过99%。
进一步地,本发明在常压条件下以1,5-二羟基萘为反应原料制备中间体5-羟基-1-四氢萘酮,操作简单,避免现有技术中在高压条件下进行还原氢化反应而需要使用压力容器的问题,且5-羟基-1-四氢萘酮的收率高,达83.3%。
附图说明
图1为实施例1制备的5-羟基-1-四氢萘酮的核磁图谱氢谱;
图2为实施例1制备的5-羟基-1-四氢萘酮的核磁图谱碳谱;
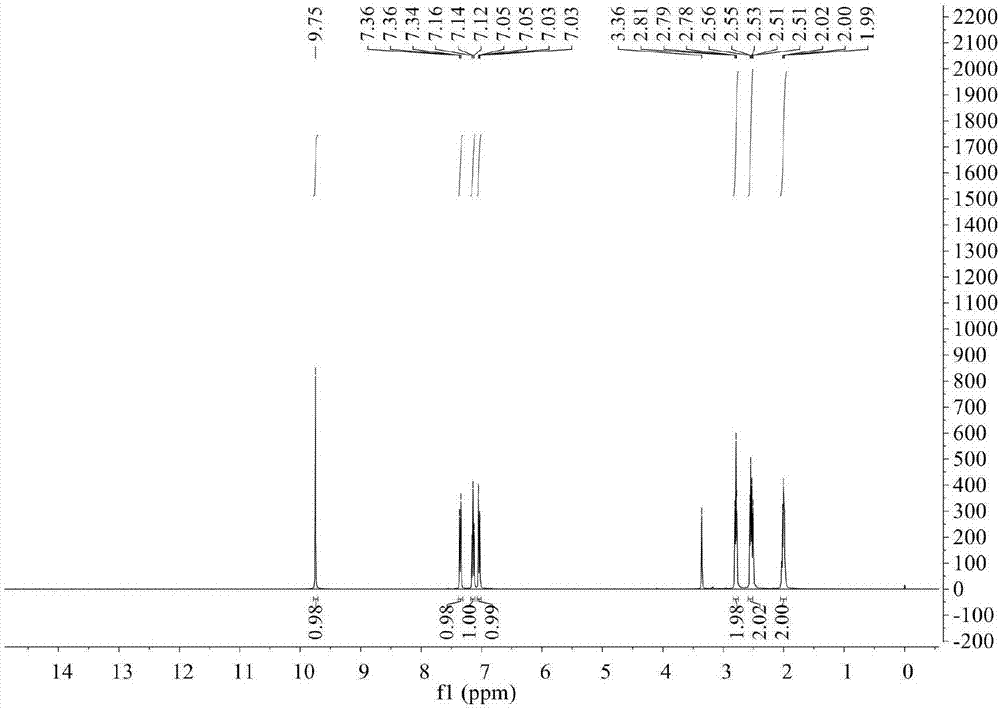
图3为实施例1制备的盐酸左布诺洛尔的核磁图谱氢谱;
图4为实施例1制备的盐酸左布诺洛尔的核磁图谱碳谱。
具体实施方式
本发明提供了一种盐酸左布诺洛尔的制备方法,包括以下步骤:
将5-羟基-1-四氢萘酮与s-1-叔丁基-环氧基甲基胺、碱性试剂和溶剂混合,进行取代反应,得到s-5-(3′-叔丁胺基-2′-羟基)-丙氧基-3,4-二氢-1(2h)萘满酮;
将所述s-5-(3′-叔丁胺基-2′-羟基)-丙氧基-3,4-二氢-1(2h)萘满酮进行酸化处理,得到盐酸左布诺洛尔。
在本发明中,所述5-羟基-1-四氢萘酮的制备方法,优选包括以下步骤:
将1,5-二羟基萘、金属催化剂、还原剂和醇-水溶剂混合,进行还原反应,得到5-羟基-1-四氢萘酮。
在本发明中,所述金属催化剂优选包括钯碳或雷尼镍;所述金属催化剂的质量优选为1,5-二羟基萘质量的0.5~10%,更优选为2~5%。在本发明中,所述还原剂优选包括甲酸铵、甲酸钠、甲酸钾、甲酸和水合肼中的一种或多种;所述还原剂与所述1,5-二羟基萘的摩尔比优选为(1~3):1,更优选为2:1。在本发明中,所述醇-水溶剂中的醇类化合物优选包括甲醇、乙醇、正丙醇、异丙醇、正丁醇、异丁醇和仲丁醇种的一种或多种;所述醇-水溶剂中的醇类化合物和水的质量比优选为(0.05~20):1,更优选为(0.5~10):1,最优选为(2~5):1;所述醇-水溶剂与1,5-二羟基萘的质量比优选为(5~15):1,更优选为(8~12):1。
在本发明中,所述还原反应优选在常压条件下进行;所述还原反应的温度优选为60~120℃,更优选为80~90℃;所述还原反应的时间优选为3~9h,更优选为4~5h。
完成所述还原反应后,本发明优选将还原反应后所得体系与氢氧化钠混合,抽滤,采用盐酸调节所得滤液的ph值为2~3,析出固体后抽滤,对所得滤饼进行重结晶,干燥,得到5-羟基-1-四氢萘酮。在本发明的实施例中,具体是采用质量浓度为31%的工业盐酸调节所述滤液的ph值为2~3。本发明采用氢氧化钠是为了增加反应的选择性和使体系保持碱性,使得原料和产物能够溶解;采用盐酸是为了使5-羟基-1-四氢萘酮钠盐变成5-羟基-1-四氢萘酮,溶解度减小从体系中析出。在本发明中,所述重结晶所采用的重结晶试剂优选为甲醇和水的混合物;所述甲醇和水的体积比优选为(2~4):1。在本发明中,所述干燥优选为真空干燥;本发明对于所述真空干燥的具体操作条件没有特殊限定,采用本领域技术人员熟知的真空干燥操作条件即可。
得到5-羟基-1-四氢萘酮后,本发明将所述5-羟基-1-四氢萘酮与s-1-叔丁基-环氧基甲基胺、碱性试剂和溶剂混合,进行取代反应,得到s-5-(3′-叔丁胺基-2′-羟基)-丙氧基-3,4-二氢-1(2h)萘满酮。在本发明中,所述5-羟基-1-四氢萘酮、s-1-叔丁基-环氧基甲基胺与碱性试剂的摩尔比优选1:(0.8~1.1):(1~3),更优选为1:1:2;所述5-羟基-1-四氢萘酮与溶剂的质量比优选为1:(5~15),更优选为1:(8~12)。本发明对所述s-1-叔丁基-环氧基甲基胺的来源没有特殊要求,采用本领域技术人员熟知的方法进行制备即可;在本发明的实施例中,具体是按照凯莱英生命科学技术(天津)有限公司的授权专利:zl200910070239.5中公开的技术方案制备。在本发明中,所述碱性试剂优选包括氢氧化钠、乙醇钠、甲醇钠或氢氧化钾。在本发明中,所述溶剂优选包括甲醇、乙醇、甲醇水溶液或乙醇水溶液;当所述溶剂为甲醇水溶液或乙醇水溶液时,所述溶剂中甲醇或乙醇的质量与水的质量比优选>90:1,更优选为(92~98):1。
在本发明中,所述取代反应的温度优选为20~90℃,更优选为30~50℃;时间优选为3~12h,更优选为5~6h。
完成所述取代反应后,本发明优选去除所得体系中溶剂,采用乙酸乙酯和水的混合物对所得剩余物进行萃取,分离水层和有机层,去除所得有机层中的溶剂,得到s-5-(3′-叔丁胺基-2′-羟基)-丙氧基-3,4-二氢-1(2h)萘满酮。本发明对于去除溶剂所采用的具体方法没有特殊限定,采用本领域技术人员熟知的去除溶剂的方法即可;具体如旋转蒸发。在本发明中,所述萃取所采用的乙酸乙酯和水的体积比优选为1:(0.5~1.5),更优选为1:1。在本发明的实施例中,具体是将取代反应后所得体系进行旋转蒸发,采用乙酸乙酯和水的混合物(乙酸乙酯和水的体积比为1:(0.5~1.5))对所得剩余物进行萃取,分离水层和有机层,将所述有机层进行旋转蒸发,得到s-5-(3′-叔丁胺基-2′-羟基)-丙氧基-3,4-二氢-1(2h)萘满酮。
得到s-5-(3′-叔丁胺基-2′-羟基)-丙氧基-3,4-二氢-1(2h)萘满酮后,本发明将所述s-5-(3′-叔丁胺基-2′-羟基)-丙氧基-3,4-二氢-1(2h)萘满酮进行酸化处理,得到盐酸左布诺洛尔。在本发明中,所述酸化处理所采用的酸化试剂优选为氯化氢的乙醇溶液;本发明优选将所述s-5-(3′-叔丁胺基-2′-羟基)-丙氧基-3,4-二氢-1(2h)萘满酮与氯化氢的乙醇溶液混合进行酸化处理,得到盐酸左布诺洛尔。
在本发明中,所述氯化氢的乙醇溶液中氯化氢的摩尔浓度优选为1~3mol/l,更优选为2mol/l;所述氯化氢的乙醇溶液为干燥氯化氢气体通入无水乙醇制得。
在本发明中,所述酸化处理的温度优选为20~50℃,更优选为30~40℃;时间优选为1.5~2.5h,更优选为2h。
完成所述酸化处理后,本发明优选将酸化处理后所得体系进行抽滤,采用乙醇对所得滤饼进行重结晶,干燥,得到盐酸左布诺洛尔。在本发明中,所述干燥优选为真空干燥;本发明对于所述真空干燥的具体操作条件没有特殊限定,采用本领域技术人员熟知的真空干燥操作条件即可。
在本发明中,制备所述盐酸左布诺洛尔的反应路线具体如下:
下面将结合本发明中的实施例,对本发明中的技术方案进行清楚、完整地描述。显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
实施例1
将32g1,5-二羟基萘、400g水、80g异丙醇、0.16g钯碳和40.8g甲酸钠混合,在常压条件下加热至60℃进行还原反应9h,向所得体系中加入12g氢氧化钠,搅拌,趁热抽滤,用质量浓度为31%的工业盐酸调节所得滤液的ph值为2,析出固体后抽滤,采用甲醇和水的混合物(甲醇和水的体积比为2:1)对所得滤饼进行重结晶,真空干燥,得到5-羟基-1-四氢萘酮23.7g,液相纯度大于99%,收率73.1%。
将8.1g5-羟基-1-四氢萘酮、39.5g甲醇、2g氢氧化钠和6.44gs-1-叔丁基-环氧基甲基胺混合,在20℃条件下进行取代反应12h,将所得体系蒸干,采用乙酸乙酯和水的混合物80ml(乙酸乙酯和水的体积比为1:1)对所得剩余物进行萃取,分离水层和有机层,将所述有机层蒸干,向剩余物中加入氯化氢的乙醇溶液(60ml,其中,氯化氢的摩尔浓度为1mol/l),在20℃条件下搅拌1h,抽滤,采用乙醇对所得滤饼进行重结晶,真空干燥,得到盐酸左布诺洛尔11.5g,液相纯度大于99%,ee值大于99%,收率73.1%。
图1和图2为本实施例制备得到的5-羟基-1-四氢萘酮的核磁图谱,由图1和图2可知,本实施例制备得到的产物确实为5-羟基-1-四氢萘酮。
图3和图4为本实施例制备得到的盐酸左布诺洛尔的核磁图谱,由图3和图4可知,本实施例制备得到的产物确实为盐酸左布诺洛尔。
实施例2
将32g1,5-二羟基萘、8g水、152g正丁醇、3.2g钯碳和12.6g甲酸铵混合,在常压条件下加热至120℃进行还原反应3h,向所得体系中加入12g氢氧化钠,搅拌,趁热抽滤,用质量浓度为31%的工业盐酸调节所得滤液的ph值为3,析出固体后抽滤,采用甲醇和水(甲醇和水的体积比为4:1.)对所得滤饼进行重结晶,真空干燥,得到5-羟基-1-四氢萘酮27.0g,液相纯度大于99%,收率83.3%。
将8.1g5-羟基-1-四氢萘酮、118.5g甲醇、6g氢氧化钠和8.85gs-1-叔丁基-环氧基甲基胺混合,在70℃条件下进行取代反应6h,将所得体系蒸干,采用乙酸乙酯和水的混合物90ml(乙酸乙酯和水的体积比为2:1)对所得剩余物进行萃取,分离水层和有机层,将所述有机层蒸干,向剩余物中加入氯化氢的乙醇溶液(30ml,其中,氯化氢的摩尔浓度为3mol/l),在50℃条件下搅拌1h,抽滤,采用乙醇对所得滤饼进行重结晶,真空干燥,得到盐酸左布诺洛尔13.8g,液相纯度大于98%,ee值大于99%,收率85.4%。
实施例3
将32g1,5-二羟基萘、10g水、200g乙醇、1.6g钯碳、13.6g甲酸钠和9.2g甲酸混合,在常压条件下加热至90℃进行还原反应6h,向所得体系中加入12g氢氧化钠,搅拌,趁热抽滤,用质量浓度为31%的工业盐酸调节所得滤液的ph值为2.5,析出固体后抽滤,采用甲醇和水(甲醇和水的体积比为3:1)对所得滤饼进行重结晶,真空干燥,得到5-羟基-1-四氢萘酮24.9g,液相纯度大于99%,收率76.9%。
将8.1g5-羟基-1-四氢萘酮、100g乙醇、10g水、6g氢氧化钾和8.05gs-1-叔丁基-环氧基甲基胺混合,在90℃条件下进行取代反应3h,将所得体系蒸干,采用乙酸乙酯和水的混合物100ml(乙酸乙酯和水的体积比为2:3)对所得剩余物进行萃取,分离水层和有机层,将所述有机层蒸干,向剩余物中加入氯化氢的乙醇溶液(40ml,其中,氯化氢的摩尔浓度为2mol/l),在30℃条件下搅拌1h,抽滤,采用乙醇对所得滤饼进行重结晶,真空干燥,得到盐酸左布诺洛尔13.3g,液相纯度大于99%,ee值大于99%,收率82.4%。
实施例4
将32g1,5-二羟基萘、300g水、15g甲醇、1.2g钯碳和42g甲酸钾混合,在常压条件下加热至70℃进行还原反应6h,向所得体系中加入12g氢氧化钠,搅拌,趁热抽滤,用质量浓度为31%的工业盐酸调节所得滤液的ph值为2,析出固体后抽滤,采用甲醇和水(甲醇和水的体积比为4:1)对所得滤饼进行重结晶,真空干燥,得到5-羟基-1-四氢萘酮24.9g,液相纯度大于99%,收率82.4%。
将8.1g5-羟基-1-四氢萘酮、100g甲醇、10g水、6g乙醇钠和8.05gs-1-叔丁基-环氧基甲基胺混合,在50℃条件下进行取代反应5h,将所得体系蒸干,采用乙酸乙酯和水的混合物80ml(乙酸乙酯和水的体积比为1:1)对所得剩余物进行萃取,分离水层和有机层,将所述有机层蒸干,向剩余物中加入氯化氢的乙醇溶液(35ml,其中,氯化氢的摩尔浓度为2mol/l),在35℃条件下搅拌1h,抽滤,采用乙醇对所得滤饼进行重结晶,真空干燥,得到盐酸左布诺洛尔14.1g,液相纯度大于99%,ee值大于99%,收率87.3%。
实施例5
将32g1,5-二羟基萘、200g水、150g正丙醇、1.2g雷尼镍和25g水合肼混合,在常压条件下加热至85℃进行还原反应6h,向所得体系中加入12g氢氧化钠,搅拌,趁热抽滤,用质量浓度为31%的工业盐酸调节所得滤液的ph值为2,析出固体后抽滤,采用甲醇和水(甲醇和水的体积比为3:1)对所得滤饼进行重结晶,真空干燥,得到5-羟基-1-四氢萘酮23.7g,液相纯度大于99%,收率73.1%。
将8.1g5-羟基-1-四氢萘酮、80g乙醇、2g水、6.8g乙醇钠和8.05gs-1-叔丁基-环氧基甲基胺混合,在30℃条件下进行取代反应6h,将所得体系蒸干,采用乙酸乙酯和水的混合物80ml(乙酸乙酯和水的体积比为1:1)对所得剩余物进行萃取,分离水层和有机层,将所述有机层蒸干,向剩余物中加入氯化氢的乙醇溶液(30ml,其中,氯化氢的摩尔浓度为2mol/l),在25℃条件下搅拌1h,抽滤,采用乙醇对所得滤饼进行重结晶,真空干燥,得到盐酸左布诺洛尔13.3g,液相纯度大于99%,ee值大于99%,收率82.4%。
实施例6
将32g1,5-二羟基萘、200g水、150g异丁醇、1.2g钯碳、13.6g甲酸钠、10g水合肼和12.6g甲酸铵混合,在常压条件下加热至90℃进行还原反应6h,向所得体系中加入12g氢氧化钠,搅拌,趁热抽滤,用质量浓度为31%的工业盐酸调节所得滤液的ph值为2,析出固体后抽滤,采用甲醇和水(甲醇和水的体积比为3:1)对所得滤饼进行重结晶,真空干燥,得到5-羟基-1-四氢萘酮26.6g,液相纯度大于99%,收率82.1%。
将8.1g5-羟基-1-四氢萘酮、50g甲醇、2g水、5.4g甲醇钠和8.05gs-1-叔丁基-环氧基甲基胺混合,在40℃条件下进行取代反应6h,将所得体系蒸干,采用乙酸乙酯和水的混合物80ml(乙酸乙酯和水的体积比为1:1)对所得剩余物进行萃取,分离水层和有机层,将所述有机层蒸干,向剩余物中加入氯化氢的乙醇溶液(40ml,其中,氯化氢的摩尔浓度为1.5mol/l),在30℃条件下搅拌1h,抽滤,采用乙醇对所得滤饼进行重结晶,真空干燥,得到盐酸左布诺洛尔13.6g,液相纯度大于99%,ee值大于99%,收率84.2%。
实施例7
将32g1,5-二羟基萘、200g水、150g仲丁醇、1.2g钯碳、13.6g甲酸钠和25.2g甲酸铵混合,在常压条件下加热至80℃进行还原反应6h,向所得体系中加入12g氢氧化钠,搅拌,趁热抽滤,用质量浓度为31%的工业盐酸调节所得滤液的ph值为2,析出固体后抽滤,采用甲醇和水对(甲醇和水的体积比为4:1)所得滤饼进行重结晶,真空干燥,得到5-羟基-1-四氢萘酮25.9g,液相纯度大于99%,收率79.9%。
将8.1g5-羟基-1-四氢萘酮、100g甲醇、8g水、3.5g乙醇钠和8.05gs-1-叔丁基-环氧基甲基胺混合,在40℃条件下进行取代反应6h,将所得体系蒸干,采用乙酸乙酯和水的混合物80ml(乙酸乙酯和水的体积比为1:1)对所得剩余物进行萃取,分离水层和有机层,将所述有机层蒸干,向剩余物中加入氯化氢的乙醇溶液(35ml,其中,氯化氢的摩尔浓度为2mol/l),在40℃条件下搅拌1h,抽滤,采用乙醇对所得滤饼进行重结晶,真空干燥,得到盐酸左布诺洛尔13.8g,液相纯度大于99%,ee值大于99%,收率85.4%。
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!