肝素黄杆菌肝素酶Ⅰ的高效制备方法与流程
本发明涉及一种肝素酶ⅰ的制备方法,尤其涉及一种使用渗透胁迫产生粗酶,并经一步cs层析纯化制备肝素酶ⅰ的方法。
背景技术:
肝素酶是指一类能够特异性裂解肝素和类肝素主链糖苷键的酶,最初是从肝素黄杆菌中发现并分离出来的,其后,又陆续在一些微生物和动物组织中发现存在肝素酶。肝素酶的应用十分广泛,如:清除血液中残存肝素、防止凝血、生产低分子肝素、研究肝素的结构。
已从肝素黄杆菌中分离纯化出的肝素酶有三种,分别为肝素酶i、ii、iii,这三种酶的酶学特性各不相同。在肝素黄杆菌纯化出的三种肝素酶中,只有肝素酶ii的结构被解析,它的底物特异性也最差;肝素酶i则最适用于低分子量肝素的制备。
肝素酶ⅰ是一种分子量大约43kd的单体蛋白质,其等电点为9.0,可能是现有肝素酶中裂解肝素能力最强的酶,目前被大量用于凝血弹力图检测仪配用耗材肝素酶杯中。
肝素酶ⅰ的制备工作有许多研究报道,但已报道的制备工艺大都存在工艺复杂、收率低等缺点。
yang等人(jbiolchem,1985,260(3):1849-1857)用羟基磷灰石处理、qae-葡聚糖柱层析、等电聚焦、凝胶过滤等四步纯化,首先制得纯酶,活性收率大约1%;
daniel等人(jbiochem,1992,267(34):24347-24355)用羟基磷灰石处理、qae-葡聚糖凝胶层析、羟基磷灰石hplc、mono-sfplc、gpc-hplc等五步纯化,最终获得纯酶,活性回收率10.8%;
马小来等(食品与药品,2005,32(5):446-450)使用羟基磷灰石处理、deae-sepharose柱层析、cm-cellose柱层析等三步纯化法,纯化得到酶,活性收率13.4%;
xiaolaima等(jchromb,2006,843(2):209-215)通过硫酸铵沉淀、octyl-sepharose柱层析、cm-650柱层析、sp-650柱层析、sephadexg-100柱层析等五步纯化法获得纯酶,收率达17.8%;
中国专利cn200910039360-一种肝素黄杆菌肝素酶ⅰ的制备方法,公开了一种工艺,通过对粗酶液进行连续三次洗脱条件各不相同的sp-sepharoseff层析,纯化得到高纯度的酶,获得高达30%的活性收率,为已报道的最高收率制备纯化技术。
绝大多数肝素酶制备工艺中粗酶从细胞中的释放采用超声破碎法,该法需要特殊设备,处理效率低,而且制得的粗酶含有的杂蛋白较多导致纯化步骤复杂。
zimmermann等(applbiochembiotechnol.1991aug;30(2):137-48.)通过渗透胁迫法使得肝素酶从菌体内部释放出来,可免于使用超声破碎仪。
本发明在借鉴使用渗透压胁迫法制备粗酶时,采用了新的工艺,降低了粗酶中的杂蛋白含量,粗酶从细胞中的释放处理效率大为提高,本发明进一步对粗酶进行纯化,发现使用cs柱层析可容易的获得高纯度的酶。而现有技术中使用cs柱层析则需要复杂的层析过程。
技术实现要素:
本发明提供一种新的肝素酶ⅰ的制备方法,可快速有效地通过一次柱层析即获得高纯度酶,进一步提高肝素酶ⅰ的纯酶活性收率。
本发明包括下述顺序的步骤:
(1)肝素黄杆菌的发酵制备:将肝素黄杆菌从平板或斜面上刮取两环菌接到50ml种子培养基中,23℃、150rpm培养1天,然后按5%接种量二级种子培养基同样条件培养1天,再按5%接种量接入发酵培养基,培养2-3天,菌液10000rpm、4℃离心30分钟,收集沉淀,为含酶的菌体细胞;
(2)渗透胁迫法制备粗酶液:将含酶的菌体细胞4℃悬浮在蔗糖溶液中0.5-24小时,4℃、10000rpm离心30min,取沉淀悬浮于tris-hcl缓冲液中,冰浴中渗透胁迫提取0.5小时以上,再离心,得到的清液为粗酶提取液,将沉淀再渗透胁迫提取一次,合并二次提取液,即为粗酶液;
(3)肝素酶ⅰ的cs(cellufinesulfate)柱纯化:步骤(2)得到的粗酶液上一根用tris-hcl缓冲液平衡过的cs柱,以同样缓冲液平衡3个柱体积,再以梯度浓度线性上升的缓冲液中含氯化钠线形梯度0-0.5m洗脱3-6个柱体积,收集有酶活性的含0.35-0.5m氯化钠缓冲液洗脱各管,合并,以截留分子量10kd的超滤离心管浓缩,得到纯化的肝素酶ⅰ。
其中,步骤(1)所述的发酵培养基组成为:肝素8g/l,k2hpo42.5g/l,nah2po42.5g/l,nh4cl2.0g/l,mgcl20.5g/l,组氨酸0.5g/l,甲硫氨酸0.5g/l,微量元素namoo3、cucl2、fecl2、cocl2、mncl2、cacl2各1×10-4m。步骤(1)所述的种子培养基和二级种子培养基的组成均为:牛肉膏0.5%,蛋白胨1%,酵母粉0.5%,nacl为0.5%,ph7.0。
其中,步骤(2)渗透压胁迫法所用蔗糖溶液为10-40%(m/v),优选30-40%;所用tris-hcl缓冲液浓度为5-50mm,优选10-20mm;tris-hcl缓冲液含0.1-10mmcacl2,优选浓度为1-5mm;tris-hcl缓冲液含50-250mmnacl,优选浓度为100-200mm;tris-hcl缓冲液ph6.5-8.0,优选ph7.0-7.5)。
其中,步骤(3)所用tris-hcl缓冲液浓度为5-150mm,优选10-100mm;其ph在6.5-8.0之间,优选ph7.0-7.5;tris-hcl缓冲液含0.1-20mmcacl2,优选浓度为1-10mm。步骤(3)所用cs层析柱的填料优选使用chisso公司的亲和层析填料cellufinesulfate,也可使用其它类似亲和填料。
对本发明所得肝素酶ⅰ进行活性测定,测定方法如下:
肝素酶i活性测定:在5ml石英比色皿中加入在30℃预热过的2.5ml肝素浓度为1mg/ml的tris-hcl(50mm,含cacl210mm,ph7.0)缓冲液,移取5-20μl酶液,摇匀后在232nm测定吸光值,读取每分钟的变化量。根据摩尔消光系数计算单位时间产生的双键的摩尔数,并由此计算酶液的单位活性(iu/ml)。本发明中纯化中肝素酶ⅰ的酶活性为0.3-30iu/ml,最终获得的酶活性为9-10iu/ml。
对本发明所得肝素酶ⅰ进行蛋白质浓度测定,测定方法如下:
蛋白质浓度测定:向5ml考马斯亮蓝溶液中加蛋白0.1ml,摇匀,测定a595,根据标准曲线换算蛋白浓度。本发明纯化前粗酶蛋白质浓度为0.9-1.0mg/ml,纯化后肝素酶ⅰ的蛋白质浓度为0.05-0.1mg/ml。
本发明在现有技术的基础上对现有技术进行了改进,并对每一个步骤中的相关条件进行了筛选,以取得最好结果,本发明的筛选过程如下:
步骤1
步骤2
步骤3
经过本发明的研究改进,本发明的制备方法在以下方面优于现有技术
根据以上筛选数据,本发明的核心改进在于:
采用了一种渗透胁迫法将粗酶从细菌细胞中释放出来,并对过程中的蔗糖浓度、缓冲液浓度、氯化钙和氯化钠用量、ph值等做优化。
采用cs柱层析,使用了一种缓冲液浓度随氯化钠浓度同时线性梯度上升的洗脱方式,将肝素酶ⅰ只用一步柱层析即纯化获得,而现有技术基本都需要至少三步柱层析,在层析方法上比本发明复杂许多。通过上述改进,本发明借鉴采用渗透胁迫法产生粗酶,高效、快速,设备需求简单;本发明进一步借鉴柱层析进行纯化,意外的发现,纯化出肝素酶ⅰ只需要一步柱层析,即可达到现有技术中多出柱层析的结果,极为简单明了。所制备的肝素酶ⅰ比活可达135iu/mg,每升发酵液可最终得到约75iu的纯化肝素酶ⅰ,纯化工艺活性收率达到57%,高于已有报道的最高值约一倍。本发明所述制备方法,还具有工艺简单、产品单次制备量大、试剂成本低的特点,可用以工业大规模制备高纯度肝素酶ⅰ。
附图说明
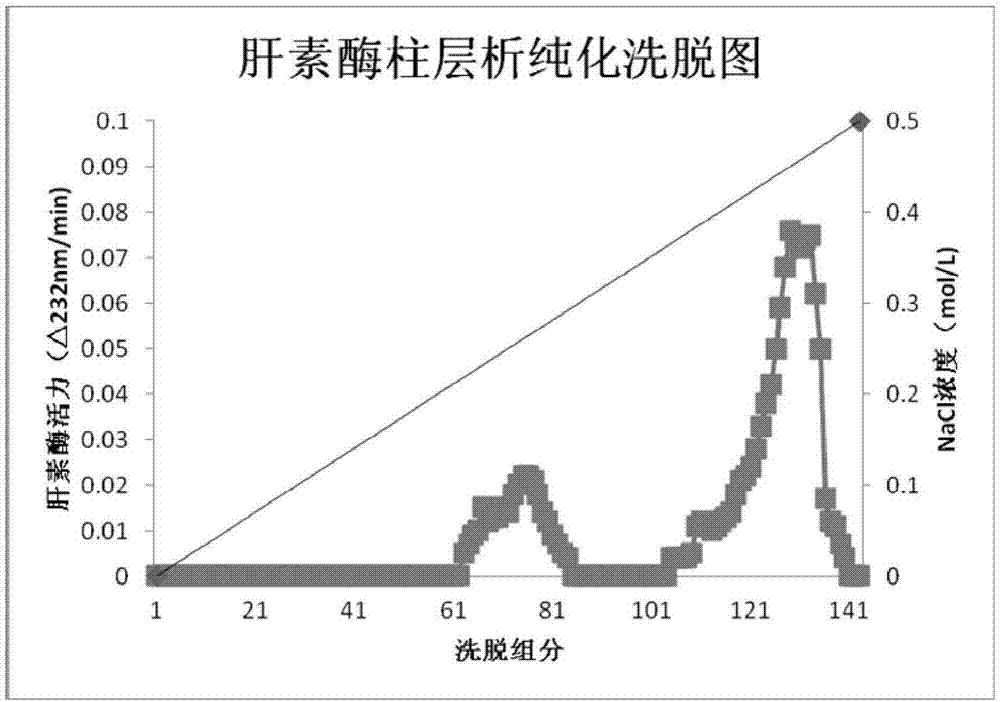
图1.肝素酶经cs柱纯化后的组分分布
图2.肝素酶纯化前后电泳分析。其中:m-低分子量标准蛋白,c-粗酶液,e-纯化后的肝素酶ⅰ。
具体实施方式
下面结合实例对本发明所述内容作进一步阐述。
实施例1
肝素酶的发酵制备:从肝素黄杆菌平板或斜面上刮取两环菌接到50ml种子培养基(牛肉膏0.5%,蛋白胨1%,酵母粉0.5%,nacl0.5%,ph7.0)中,23℃,150rpm,培养1天。按5%接种量接入二级种子培养基同样条件培养1天。再按5%接种量接入4l发酵培养基培养2天。发酵培养基组成:肝素8g/l,k2hpo42.5g/l,nah2po42.5g/l,nh4cl2.0g/l,mgcl20.5g/l,组氨酸0.5g/l,甲硫氨酸0.5g/l,微量元素namoo3、cucl2、fecl2、cocl2、mncl2、cacl2各1×10-4m,ph7.0。23℃,150rpm,培养2天。菌液10000rpm,4℃离心30分钟,收集沉淀。
将含酶的菌体细胞4℃悬浮在40ml蔗糖溶液中2小时,4℃、10000rpm离心30min,取沉淀悬浮于80ml10mmtris-hcl缓冲液(含cacl21mm及nacl150mm、ph7.0)中,冰浴中渗透胁迫提取2小时以上,再如前离心,得到的160ml粗酶提取液,将沉淀再如前渗透胁迫提取一次,合并二次提取液,得到约400ml粗酶液。
将粗酶液用10mmtris-hcl缓冲液(含cacl21mm、ph7.0)稀释4倍,上一根用同样缓冲液平衡过的cs柱(2.5×40cm),以10mmtris-hcl缓冲液(含cacl21mm、ph7.0)冲洗平衡300ml,以10mmtris-hcl缓冲液(含cacl21mm、ph7.0)至100mmtris-hcl缓冲液(含cacl210mm及nacl500mm、ph7.0)各300ml线形梯度洗脱柱子,测定各洗脱组分酶活力,结果如附图1。收集合并有酶活性的洗脱管第110-140管,以截留分子量10kd的超滤离心管浓缩,得到肝素酶ⅰ,冷冻保藏。纯化前后记录体积,并分别测定活性、蛋白浓度,计算比活性、总活性、收率等,见表1。对所制得的肝素酶ⅰ进行测定,活性为135.43iu/mg,纯化活性收率为57.13%,sds-page电泳显示为单一蛋白条带,见附图2。
表1.肝素酶ⅰ纯化表
- 还没有人留言评论。精彩留言会获得点赞!