一种转化L-苏氨酸生产L-2-氨基丁酸的重组菌的构建及应用的制作方法
本发明涉及一种转化l-苏氨酸生产l-2-氨基丁酸的重组菌的构建及应用,属于生物工程技术领域。
背景技术:
l-2-氨基丁酸是一种非天然手性氨基酸,具有抑制人体神经信息传递、加强葡萄糖磷酸酯酶的活性和促进脑细胞代谢的作用。同时2-氨基丁酸也是一种重要的化工原料和医药中间体,已广泛用于药物的合成,如抗结核药物盐酸乙胺丁醇和抗癫痫药物左乙拉西坦的合成。
目前,l-2-氨基丁酸的合成方法包括化学法和生物法。化学法主要包括酮丁酸还原法、脱硫反应法、氨解反应法、卤代氨解法、化学拆分法等。但是此类方法反应条件苛刻、易生成副产物;成本较高,不宜进行工业生产;同时大量使用有机溶剂易造成环境污染。
生物法合成l-2-氨基丁酸具有立体选择性高、反应条件温和、环境污染少等特点,具有广阔的工业化开发前景。生物法又包括微生物发酵法和细胞外酶转化法。微生物发酵法专属性较强,条件温和,环境污染少,但发酵过程会产生与目标产物结构相似的副产物,反应产物成分复杂,后续分离困难。酶催化转化则是一种高选择性反应,可达到定向转化的目的。但多酶转化工艺多面临着酶活力低、酶稳定性低、辅酶循环再生效率低、多酶添加复杂、工程放大难等问题。而重组菌全细胞参与转化能在一定程度上解决上述问题,但仍存在转化时间长、转化效果差等问题。
技术实现要素:
本发明的目的在于克服目前生产技术上的问题,提供一种高效简便、低成本、易于工业化生产的转化l-苏氨酸制备l-2-氨基丁酸的方法。
本发明首先提供了一种转化l-苏氨酸生产l-2-氨基丁酸的重组菌,所述重组菌是以大肠杆菌为宿主,双质粒表达系统表达苏氨酸脱氨酶、甲酸脱氢酶、亮氨酸脱氢酶,所述双质粒表达系统包括petduet-1质粒和prsfduet-1质粒。
在本发明的一种实施方式中,所述petduet-1质粒用于表达苏氨酸脱氨酶、甲酸脱氢酶,所述prsfduet-1质粒用于表达亮氨酸脱氢酶。
在本发明的一种实施方式中,所述苏氨酸脱氨酶选自大肠杆菌,优选大肠杆菌escherichiacoliw3110,基因序列为seqidno:1,氨基酸序列为seqidno:5。
在本发明的一种实施方式中,所述亮氨酸脱氢酶选自苏云金芽孢杆菌,优选苏云金芽孢杆菌bacillusthuringiensisserovarkurstakiybt-1520,基因序列为seqidno:2,氨基酸序列为seqidno:6。
在本发明的一种实施方式中,所述甲酸脱氢酶选自假丝酵母。
在本发明的一种实施方式中,优选的,所述甲酸脱氢酶经过密码子优化后核苷酸序列如seqidno:4所示,氨基酸序列如seqidno:7所示。
在本发明的一种实施方式中,所述宿主优选为e.colibl21(de3)。
本发明还提供了一种转化l-苏氨酸生产l-2-氨基丁酸的方法,所述方法为利用上述的转化l-苏氨酸生产l-2-氨基丁酸的重组菌将底物转化为l-2-氨基丁酸,并偶联辅酶再生体系。
在本发明的一种实施方式中,所述辅酶再生体系以甲酸铵为底物,通过甲酸脱氢酶将nad+转化为nadh的辅酶再生系统。
在本发明的一种实施方式中,所述底物中l-苏氨酸浓度为30~40g/l,甲酸铵浓度为10~30g/l,nad+浓度为0.4~1.0g/l,所述重组菌经培养后以菌液的形式添加,转化温度为30~40℃,转化ph为7.0~8.5。
在本发明的一种实施方式中,所述转化的时间为8-12h。
在本发明的一种实施方式中,所述菌液的制备方式为离心收集菌体后溶于ph为7.0~8.5的nah2po4-na2hpo4缓冲液,菌体的添加量为30~50g/l。
本发明的有益效果为:
(1)本发明所提供的利用重组菌转化l-苏氨酸生产l-2-氨基丁酸的方法中,转化底物为价格低廉的天然氨基酸l-苏氨酸,三种酶可在一种重组菌中同时高效表达,所述重组菌可大量培养,不需经过细胞破碎、冷冻干燥等处理过程,成本较低且操作简便,可建立一个高效、低成本、易于工业化放大生产的生物酶法合成工艺。
(2)本发明所述的生产方法在将中间产物转化为l-2-氨基丁酸的过程中利用辅酶再生体系,通过将nad+转化为nadh,使得nadh在体系中浓度相对稳定,转化能够高效进行。
(3)在此过程中由甲酸铵转化而来的co2可溶于转化体系中生成的氨水,对环境污染小,有工业化应用价值。
(4)本方法具有专一性强、底物成本低、产物光学纯度高等优点,采用本方法制备l-2-氨基丁酸,添加苏氨酸40g/l,l-2-氨基丁酸产量为46g/l,转化率达99.9%以上,除此之外,本发明的重组菌的转化时间仅需要8-12h,即可达到转化率99%以上,转化时间段且转化效率高。
附图说明
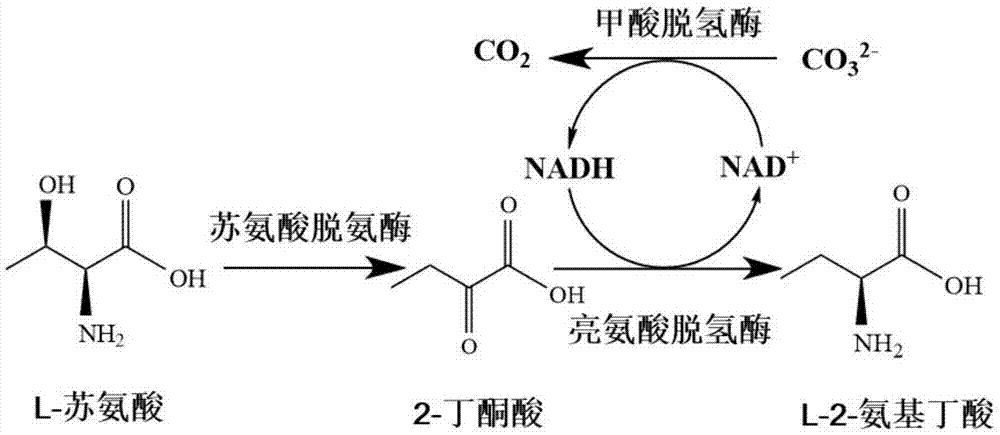
图1:转化l-苏氨酸生产l-2-氨基丁酸的反应原理图。
图2:质粒prsfduet-btleudh和petduet-cbfdh-ectd表达后双酶切的sds-page蛋白检测图。
图3:质粒petduet-btleudh-cbfdh-ectd表达后菌落pcr的sds-page蛋白检测图。
具体实施方式
以下实施案例都是采用常规实验方法,实验材料均从商业途径可得。
样品预处理:取转化液12000rpm离心10min收集上清液,并以2-氨基丁酸作为标准品,配制标准溶液。将适度稀释后的上清液和标准溶液分别经0.22μm微孔滤膜过滤后,用高效液相色谱法测定2-氨基丁酸。
苏氨酸脱氨酶酶活检测:取200μl终浓度为5g/l的苏氨酸脱氨酶产生菌液加入3800μl底物(底物体系:采用50mmol/lph7.5磷酸二氢钾-磷酸氢二钾缓冲液溶解20μmol/lplp和50mmol/l苏氨酸),于40℃恒温水浴反应15min,然后煮沸以终止反应。样品稀释10倍,采用hplc-opa柱前衍生法测量苏氨酸减少量。酶活单位u定义为1min内苏氨酸减少1μmol所需的酶量。
亮氨酸脱氢酶酶活检测:分别取200μl终浓度为10g/l的亮氨酸脱氢酶产生菌的菌液和甲酸脱氢酶产生菌的菌液加入1600μl底物(底物体系:采用50mmol/lph8.0磷酸二氢钠-磷酸氢二钠缓冲液溶解0.6g/lnad+、20mmol/l的2-丁酮酸、40mmol/l的甲酸铵),于30℃恒温水浴反应15min,然后煮沸以终止反应。样品稀释10倍,采用hplc-opa柱前衍生法测量2-氨基丁酸生成量。酶活单位u定义为1min内2-氨基丁酸增加1μmol所需的酶量。
甲酸脱氢酶酶活检测:在300μl反应体系中,加入0.1mol/lβ-巯基乙醇,1.67mmol/lnad+,167mmol/l甲酸钠,共200μl,100μlfdh产生菌的菌液,缓冲液为10mmol/lph7.5的磷酸溶液。在30℃条件下反应,利用酶标仪每隔30s检测nadh在340nm处的吸光度,并作图。配置不同浓度的nadh标准溶液(0-0.6mmol/l)在340nm处测定吸光值,绘制标准曲线,拟合回归方程。酶活单位u定义为1min内生成1μmolnadh所需的酶量。
2-氨基丁酸含量的测定:高效液相色谱法,以邻苯二甲醛(opa)为衍生化试剂,色谱柱:zorbaxsb-c18,流动相a为10mmol/lkh2po4(4mol/lkoh调节ph5.3),流动相b为乙腈:甲醇:a相=5:3:1(冰醋酸调ph5.3)梯度洗脱,流速1ml/min,荧光检测器,检测波长330,460nm,柱温30℃。
2-丁酮酸含量的测定:高效液相色谱法,流动相成分:5mmol/l稀硫酸,流速0.6ml/min;进样体积:10μl;色谱柱:aminexhpx-87hionexclusioncolumn,300×7.8mm;检测器:紫外检测器,波长为210nm。
实施例1:生产大肠杆菌苏氨酸脱氨酶的基因工程菌的获取
(1)大肠杆菌w3110接种于lb培养基,37℃培养12h收集菌体,使用细菌基因组提取试剂盒提取基因组dna。
(2)分别以引物ectd-1(5'cgggatccatggctgactcgcaacccctg3',seqidno:8)和ectd-2(5'cccaagcttctaacccgccaaaaagaacctgaac3',seqidno:9)从基因组中克隆苏氨酸脱氨酶的基因ectd;
(3)将目的基因连接至pmd19simple克隆载体测序,选取正确基因片段用bamhi和xhoi双酶切后连接于经同样两种酶双酶切过的质粒pet28a;
(4)将构建好的表达质粒导入e.colibl21(de3),在含有卡纳霉素的lb平板中进行筛选和验证,选出目的基因完全正确的菌株,基因序列为seqidno:1,氨基酸序列为seqidno:5。
(5)将上述得到的含有重组质粒的工程菌接种于含有100mg/l卡那霉素的lb液体培养基中,37℃、200r/min振荡过夜培养。将上述过夜培养物按4%的接种量接种于含100mg/l卡那霉素的tb培养基中,37℃、200r/min振荡培养至菌液od600=0.6-0.8,加入诱导剂iptg,终浓度100mg/l,25℃、200r/min诱导培养10h,离心收集菌体。
(6)将上述收集得到的菌体溶于ph为7.5的磷酸二氢钾-磷酸氢二钾缓冲液中,使其浓度为100g/l并根据前述方法检测酶活,其苏氨酸脱氨酶的酶活为1350u。
实施例2:生产苏云金芽孢杆菌亮氨酸脱氢酶的基因工程菌的获取
(1)苏云金芽孢杆菌接种于lb培养基,37℃培养12h收集菌体,使用细菌基因组提取试剂盒提取基因组dna。
(2)分别以引物btleudh-1(5’cgggatccatgcgcgttatggtcttg3’,seqidno:10)和btleudh-2(5’cccaagcttttagcgacggctaataatatcgtg3’,seqidno:11)从基因组dna中克隆得到苏云金芽孢杆菌亮氨酸脱氢酶基因btleudh。
(3)将目的基因连接至pmd19simple克隆载体测序,选取正确基因片段用bamhi和xhoi双酶切后连接于经同样两种酶双酶切过的pet28a;
(4)将构建好的表达质粒导入e.colibl21(de3),在含有卡纳霉素的lb平板中进行筛选和验证,选出目的基因完全正确的菌株,其中苏云金芽孢杆菌亮氨酸脱氢酶基因如seqidno:2,氨基酸序列为seqidno:6。
(5)将上述得到的含有重组质粒的工程菌分别接种于含有100mg/l卡那霉素的lb液体培养基中,37℃、200r/min振荡过夜培养。将上述过夜培养物按4%的接种量接种于含100mg/l卡那霉素的tb培养基中,37℃、200r/min振荡培养至菌液od600=0.6-0.8,加入诱导剂iptg,终浓度100mg/l,25℃、200r/min诱导培养10h,离心收集菌体。
(6)将上述收集得到的菌体溶于ph为8.5的磷酸二氢钠-磷酸氢二钠缓冲液中,使其浓度为100g/l并根据前述方法检测酶活,其亮氨酸脱氢酶的酶活为184u。
实施例3:生产甲酸脱氢酶的基因工程菌的获取
对来源于candidaboidinii甲酸脱氢酶基因(fdh)进行密码子优化(原基因序列如seqidno:3)使得基因序列更适应大肠表达系统,优化后基因序列如seqidno:4,氨基酸序列如seqidno:7。将人工合成的含有bamhi和xhoi酶切位点的fdh基因片段进行双酶切,然后与同样双酶切得到的表达载体pet28a相连接构建重组质粒pet28a-fdh,将重组质粒转入表达宿主e.colibl21(de3)中,在含有卡纳霉素的lb平板中进行筛选和验证,筛选出正确的阳性菌株。
将上述经密码子优化的工程菌接种于含有100mg/l卡那霉素的lb液体培养基中,37℃、200r/min振荡过夜培养。将上述过夜培养物按4%的接种量接种于含100mg/l卡那霉素的tb培养基中,37℃、200r/min振荡培养至菌液od600=0.6-0.8,加入诱导剂iptg,终浓度100mg/l,25℃、200r/min诱导培养10h,离心收集菌体。
将上述收集得到的菌体溶于ph为8.5的磷酸二氢钠-磷酸氢二钠缓冲液中,使其浓度为100g/l并根据前述方法检测酶活,其甲酸脱氢酶的酶活为178u。
实施例4:苏氨酸脱氨酶转化苏氨酸生成2-丁酮酸
菌液浓度对转化率的影响:在20ml转化体系中,将转化体系中的底物l-苏氨酸浓度定为50g/l不变,加入20μmol/l的plp,转化液为ph7.5的磷酸钠缓冲液。在37℃恒温摇床中转化,转速200r/min,于14~20h取样,设置苏氨酸脱氨酶生产菌的菌液浓度梯度为15g/l、20g/l、25g/l、30g/l、35g/l。在37℃恒温摇床中转化,转速200r/min,分别于12~20h取样,煮沸使终止反应,离心取上清液液相色谱检测2-丁酮酸产量。分析表2结果可知,在此条件下最适菌液浓度为15g/l,2-丁酮酸产量为41.6g/l,转化率达到97%。
表1不同菌液浓度对2-丁酮酸生产的的影响。
底物浓度对转化率的影响:在20ml转化体系中,设置苏氨酸浓度梯度为20g/l、30g/l、40g/l、50g/l、60g/l,加入15g/l苏氨酸脱氨酶生产菌的菌液、20μmol/l的plp,转化液为ph7.5的磷酸钠缓冲液。在37℃恒温摇床中转化,转速200r/min,于14~20h取样,液相色谱检测上清液中2-丁酮酸产量。从表3结果可知,在此条件下最适底物浓度为50g/l,2-丁酮酸产量为41.0g/l,苏氨酸摩尔转化率达到95%以上。
表2不同底物浓度对2-丁酮酸生产的的影响。
由上述实验过程,确定苏氨酸脱氨酶转化苏氨酸生成2-丁酮酸体系最适底物浓度为50g/l,最适菌液浓度为15g/l,此时苏氨酸转化率达到95%以上。
实施例5:亮氨酸脱氨酶转化2-丁酮酸生成2-氨基丁酸
菌液浓度对转化率的影响:在20ml转化体系中,设置2-丁酮酸浓度为50g/l,加入20g/l甲酸铵、10g/l甲酸脱氢酶生产菌的菌液、0.6g/lnad+,转化缓冲体系为ph8.0的nah2po4-na2hpo4缓冲液,亮氨酸脱氢酶生产菌的菌液浓度梯度为,15g/l、20g/l、25g/l、30g/l、35g/l。在37℃恒温摇床中转化,转速200r/min,于14~20h取样,高效液相色谱法检测2-氨基丁酸产量。从表4分析结果可知,在此条件下最适菌液浓度为20g/l,此时2-丁酮酸浓度为32.4g/l,转化率64.2%。
表3不同菌液浓度对2-氨基丁酸生产的影响。
底物浓度对转化率的影响:在20ml转化体系中,设置2-丁酮酸浓度梯度为25g/l、30g/l、35g/l、40g/l,加入10~30g/l甲酸铵、20g/l亮氨酸脱氢酶生产菌的菌液、10g/l甲酸脱氢酶生产菌的菌液、0.6g/lnad+、转化液为ph=8.0的nah2po4-na2hpo4缓冲液,在37℃恒温摇床中转化,转速200r/min,14~20h取样,高效液相色谱法检测2-氨基丁酸产量。由表5可知,在此条件下最适底物浓度为35.0g/l,2-氨基丁酸产量为33.9g/l,转化率达到96.0%。
表4不同底物浓度对2-氨基丁酸生产的影响。
由上述实验过程,确定亮氨酸脱氢酶转化2-丁酮酸生成2-氨基丁酸体系最适底物浓度为35g/l,最适菌液浓度为20g/l,此时转化率达到96%。
实施例6:苏氨酸浓度对三酶级联转化l-苏氨酸生产l-2-氨基丁酸体系的影响
在20ml转化体系中,加入15g/l苏氨酸脱氨酶生产菌的菌液、20g/l氨基酸脱氢酶生产菌的菌液、10g/l甲酸脱氢酶生产菌的菌液,设置苏氨酸浓度梯度为20g/l、30g/l、40g/l、50g/l,10~30g/l甲酸铵、0.6g/lnad+、5~20μmol/lplp,转化液为ph=8.0的nah2po4-na2hpo4缓冲液。在32~37℃恒温摇床中转化,转速200r/min,14~20h取样,高效液相色谱法检测2-氨基丁酸产量。从表6可知,此条件下最适苏氨酸浓度为40g/l,l-2-氨基丁酸产量为34.3g/l,光学纯度ee为99%,转化率达99%以上。
表5不同底物浓度对2-氨基丁酸生产的影响。
实施例7:质粒prsfduet-btleudh的构建
苏云金芽孢杆菌ybt-1520接种于lb培养基,37℃培养12h收集菌体,使用细菌基因组提取试剂盒提取基因组dna。分别以引物btleudh-1(5'catcatcaccacagccaggatccaatgacattagaaatcttcgaatacttag3',seqidno:12)和btleudh-2(5'gcggtttctttaccagactcgagttagcgacggctaataatatcgtg3',seqidno:13)从基因组中克隆亮氨酸脱氢酶的基因btleu;将pcr获得的dna片段经琼脂糖凝胶电泳分离纯化,回收片段经bamhi和xhoi双酶切后,与同样双酶切处理后经琼脂糖凝胶电泳分离纯化回收的双启动子高拷贝表达载体prsfduet-1经一步同源重组法连接。连接产物经化学转化法转化至jm109感受态细胞,后培养1h后涂布于含卡那霉素的lb平板上培养10h,将长出的菌落划线分离培养12h,选取单菌落进行菌落pcr鉴定阳性克隆。将阳性克隆接种于lb培养基,37℃培养12h后提取质粒,双酶切后进行sds-page检测,检测结果见图2。经测序验证,构建得重组质粒prsfduet-btleudh。
实施例8:质粒petduet-cbfdh-ectd的构建
大肠杆菌w3110、假丝酵母接种于lb培养基,按实施例7所述方法提取基因组dna。分别以引物cbfdh-1(5'ccatcatcaccacagccaggatccaatgaagatcgtgttagtcctttacgacg3',seqidno:14)和cbfdh-2(5'ggtacctttctcctctttaatctgcagttattattttttatcgtgtttcccgtag3',seqidno:15)从基因组中克隆甲酸脱氢酶的基因cbfdh;分别以引物ectd-1(5'ctgcagattaaagaggagaaaggtaccatggctgactcgcaacccc3',seqidno:16)和ectd-2(5'agcggtttctttaccagactcgagttaacccgccaaaaagaacctg3',seqidno:17)从基因组中克隆苏氨酸脱氨酶的基因ectd。将pcr获得的两个dna片段分别经bamhi和xhoi双酶切后,采用一步同源重组法连接,得到cbfdh与ectd两基因片段串联的连接产物cbfdh-ectd,经琼脂糖凝胶电泳验证片段长度正确。分别以引物cbfdh-1(5'ccatcatcaccacagccaggatccaatgaagatcgtgttagtcctttacgacg3',seqidno:14)和ectd-2(5'agcggtttctttaccagactcgagttaacccgccaaaaagaacctg3',seqidno:17)扩增片段cbfdh-ectd,pcr获得的cbfdh-ectd片段经琼脂糖凝胶电泳分离纯化,回收片段经bamhi和xhoi双酶切后,与同样双酶切处理后经琼脂糖凝胶电泳分离纯化回收的单启动子低拷贝表达载体petduet-1经一步同源重组法连接,连接产物经化学转化法转化至jm109感受态细胞,后培养1h后涂布于含氨苄青霉素的lb平板上培养10h,将长出的菌落划线分离培养12h,选取单菌落进行菌落pcr鉴定阳性克隆。将阳性克隆接种于lb培养基,37℃培养12h后提取质粒,双酶切后进行sds-page检测,检测结果见图2。经测序验证,构建得重组质粒petduet-cbfdh-ectd。
实施例9:质粒petduet-btleudh-cbfdh-ectd的构建
苏云金芽孢杆菌ybt-1520接种于lb培养基,37℃培养12h收集菌体,使用细菌基因组提取试剂盒提取基因组dna。分别以引物btleudh-1(5'catcatcaccacagccaggatccaatgacattagaaatcttcgaatacttag3',seqidno:12)和btleudh-3(5'gtaaaggactaacacgatcttcatgagctctttctcctctttgatatcttagcgacggctaataatatcgtg3',seqidno:18)从基因组中克隆亮氨酸脱氢酶的基因btleu。将实施例8构得的petduet-cbfdh-ectd质粒用bamh1单酶切后,经琼脂糖凝胶电泳分离纯化,回收片段,与pcr扩增得到的片段btleu一步同源重组连接,连接产物经化学转化法转化至jm109感受态细胞,后培养1h后涂布于含氨苄青霉素的lb平板上培养10h,将长出的菌落划线分离培养12h,选取单菌落进行菌落pcr鉴定阳性克隆,sds-page检测结果见图3。将阳性克隆接种于lb培养基,37℃培养12h后提取质粒。经测序验证,构建得重组质粒petduet-btleudh-cbfdh-ectd。
实施例10:单质粒重组菌的构建、表达、转化、筛选
将实施例9构得的质粒petduet-btleudh-cbfdh-ectd经化学转化法转化至bl21感受态细胞,后培养1h后涂布于含氨苄青霉素的lb平板上培养10h,将长出的菌落划线分离培养12h,挑取三个单菌落分别接种于含有100mg/l氨苄青霉素的lb液体培养基中,37℃、200r/min振荡过夜培养。将上述过夜培养物按4%的接种量分别接种于含100mg/l氨苄青霉素的tb培养基中,37℃、200r/min振荡培养至菌液od600=0.6-0.8,加入诱导剂iptg,终浓度100mg/l,25℃、200r/min诱导培养10h,分别离心收集菌体a1(bl21/petduet-btleudh-cbfdh-ectd)、a2(bl21/petduet-btleudh-cbfdh-ectd)、a3(bl21/petduet-btleudh-cbfdh-ectd).
在20ml转化体系中,加入40g/l苏氨酸、42g/l甲酸铵、0.6g/lnad+、20μmol/lplp、45g/l单质粒重组菌,转化液为ph=8.0的nah2po4-na2hpo4缓冲液。在32~37℃恒温摇床中转化,转速200r/min,8-24h取样,可知其转化时间为18h,高效液相色谱法检测2-氨基丁酸产量。从表6可知,此条件下最佳单质粒重组菌为a2,l-2-氨基丁酸产量为36.2g/l,转化率达83.5%。
表6单质粒重组菌的催化效果。
实施例11:双质粒重组菌的构建、表达、转化、筛选
将实施例7构得的质粒prsfduet-btleudh和实施例8构得的质粒petduet-cbfdh-ectd经化学转化法同时转化至bl21感受态细胞,后培养1h后涂布于同时含氨苄青霉素和卡那霉素的lb平板上培养10h,将长出的菌落划线分离培养12h,挑取三个单菌落分别接种于含有100mg/l氨苄青霉素和100mg/l卡那霉素的lb液体培养基中,37℃、200r/min振荡过夜培养。将上述过夜培养物按4%的接种量分别接种于含100mg/l氨苄青霉素和100mg/l卡那霉素的tb培养基中,37℃、200r/min振荡培养至菌液od600=0.6-0.8,加入诱导剂iptg,终浓度100mg/l,25℃、200r/min诱导培养10h,分别离心收集菌体b1(bl21/prsfduet-btleudh+petduet-cbfdh-ectd)、b2(bl21/prsfduet-btleudh+petduet-cbfdh-ectd)和b3(bl21/prsfduet-btleudh+petduet-cbfdh-ectd)。
在20ml转化体系中,加入40g/l苏氨酸、42g/l甲酸铵、0.6g/lnad+、20μmol/lplp、45g/l双质粒重组菌,转化液为ph=8.0的nah2po4-na2hpo4缓冲液。在32~37℃恒温摇床中转化,转速200r/min,8-20h取样,10h转化完全,高效液相色谱法检测2-氨基丁酸产量。从表7可知,此条件下最佳双质粒重组菌为b1,l-2-氨基丁酸产量为43.3g/l,转化率达99.9%以上。
表7双质粒重组菌(prsfduet-btleudh+petduet-cbfdh-ectd)的催化效果
对比例1:质粒petduet-1中酶基因cbfdh和ectd的构建顺序改变
分别以引物ectd-1(seqidno:16)和cbfdh-2(seqidno:15)扩增实施例8获得的串联片段ectd-cbfdh,pcr获得的ectd-cbfdh片段经琼脂糖凝胶电泳分离纯化,回收片段经bamhi和xhoi双酶切后,与同样双酶切处理后经琼脂糖凝胶电泳分离纯化回收的单启动子低拷贝表达载体petduet-1经一步同源重组法连接,连接产物经化学转化法转化至jm109感受态细胞,后培养1h后涂布于含氨苄青霉素的lb平板上培养10h,将长出的菌落划线分离培养12h,选取单菌落进行菌落pcr鉴定阳性克隆。将阳性克隆接种于lb培养基,37℃培养12h后提取质粒,双酶切后进行sds-page检测。经测序验证,构建得重组质粒petduet-ectd-cbfdh。
将该质粒petduet-ectd-cbfdh和实施例7构得的质粒prsfduet-btleudh经化学转化法同时转化至bl21感受态细胞,后培养1h后涂布于同时含氨苄青霉素和卡那霉素的lb平板上培养10h,将长出的菌落划线分离培养12h,挑取三个单菌落分别接种于含有100mg/l氨苄青霉素和100mg/l卡那霉素的lb液体培养基中,37℃、200r/min振荡过夜培养。将上述过夜培养物按4%的接种量分别接种于含100mg/l氨苄青霉素和100mg/l卡那霉素的tb培养基中,37℃、200r/min振荡培养至菌液od600=0.6-0.8,加入诱导剂iptg,终浓度100mg/l,25℃、200r/min诱导培养10h,分别离心收集菌体c1(bl21/prsfduet-btleudh+petduet-ectd-cbfdh)、c2(bl21/prsfduet-btleudh+petduet-ectd-cbfdh)和c3(bl21/prsfduet-btleudh+petduet-ectd-cbfdh)。
在20ml转化体系中,加入40g/l苏氨酸、42g/l甲酸铵、0.6g/lnad+、20μmol/lplp、45g/l双质粒重组菌,转化液为ph=8.0的nah2po4-na2hpo4缓冲液。在32~37℃恒温摇床中转化,转速200r/min,8-20h内取样,14h转化完全,高效液相色谱法检测2-氨基丁酸产量。从表8可知,此条件下最佳双质粒重组菌为c3,l-2-氨基丁酸产量为35.8g/l,转化率达82.7%。
与实施例11相比,改变cbfdh和ectd的连接顺序,使得其完全转化的时间增长,且l-2-氨基丁酸产量和转化率均明显下降。
表8双质粒重组菌(prsfduet-btleudh+petduet-ectd-cbfdh)的催化效果
对比例2:不同质粒和酶的搭配
将实施例8中pcr获得的ectd基因片段经琼脂糖凝胶电泳分离纯化,回收片段经bamhi和xhoi双酶切后,与同样双酶切处理后经琼脂糖凝胶电泳分离纯化回收的双启动子高拷贝表达载体prsfduet-1经一步同源重组法连接。连接产物经化学转化法转化至jm109感受态细胞,后培养1h后涂布于含卡那霉素的lb平板上培养10h,将长出的菌落划线分离培养12h,选取单菌落进行菌落pcr鉴定阳性克隆。将阳性克隆接种于lb培养基,37℃培养12h后提取质粒,双酶切后进行sds-page检测,检测结果见图3。经测序验证,构建得重组质粒prsfduet-ectd。
将实施例7中pcr得到的btleu基因片段和实施例8中pcr得到的cbfdh基因片段分别经bamhi和xhoi双酶切后,采用一步同源重组法连接,得到btleu与cbfdh两基因片段串联的连接产物btleu-cbfdh,经琼脂糖凝胶电泳验证片段长度正确。分别以引物btleu-1(seqidno:12)和cbfdh-2(seqidno:15)扩增片段btleu-cbfdh,pcr获得的btleu-cbfdh片段经琼脂糖凝胶电泳分离纯化,回收片段经bamhi和xhoi双酶切后,与同样双酶切处理后经琼脂糖凝胶电泳分离纯化回收的单启动子低拷贝表达载体petduet-1经一步同源重组法连接,连接产物经化学转化法转化至jm109感受态细胞,后培养1h后涂布于含氨苄青霉素的lb平板上培养10h,将长出的菌落划线分离培养12h,选取单菌落进行菌落pcr鉴定阳性克隆。将阳性克隆接种于lb培养基,37℃培养12h后提取质粒,双酶切后进行sds-page检测,检测结果见图3。经测序验证,构建得重组质粒petduet-btleu-cbfdh。
将质粒prsfduet-ectd和质粒petduet-btleu-cbfdh经化学转化法同时转化至bl21感受态细胞,后培养1h后涂布于同时含氨苄青霉素和卡那霉素的lb平板上培养10h,将长出的菌落划线分离培养12h,挑取三个单菌落分别接种于含有100mg/l氨苄青霉素和100mg/l卡那霉素的lb液体培养基中,37℃、200r/min振荡过夜培养。将上述过夜培养物按4%的接种量分别接种于含100mg/l氨苄青霉素和100mg/l卡那霉素的tb培养基中,37℃、200r/min振荡培养至菌液od600=0.6-0.8,加入诱导剂iptg,终浓度100mg/l,25℃、200r/min诱导培养10h,分别离心收集菌体d1(bl21/prsfduet-ectd+petduet-btleu-cbfdh)、d2(bl21/prsfduet-ectd+petduet-btleu-cbfdh)和d3(bl21/prsfduet-ectd+petduet-btleu-cbfdh)。
在20ml转化体系中,加入40g/l苏氨酸、42g/l甲酸铵、0.6g/lnad+、20μmol/lplp、45g/l双质粒重组菌,转化液为ph=8.0的nah2po4-na2hpo4缓冲液。在32~37℃恒温摇床中转化,转速200r/min,8-20h取样,16h完全转化,高效液相色谱法检测2-氨基丁酸产量。从表9可知,此条件下最佳双质粒重组菌为d1,l-2-氨基丁酸产量为30.8g/l,转化率达71.1%。
与实施例11相比,此对比例下得到的重组菌在转化l-苏氨酸生产l-2-氨基丁酸的过程中,转化时间更长,且l-2-氨基丁酸产量和转化率均明显下降。
表9双质粒重组菌(prsfduet-ectd+petduet-btleu-cbfdh)的催化效果
对比例3采用密码子未优化的甲酸脱氢酶基因进行双质粒重组菌的重组
此对比例中甲酸脱氢酶基因采用未优化的基因,记作cbfdh0,按照实施例7、8、11中的方法构建得到双质粒重组菌,prsfduet-btleudh+petduet-cbfdh0-ectd,在相同的条件下进行转化,8-20h取样,12h转化完全,高效液相色谱法检测2-氨基丁酸产量。从表10可知,此条件下最佳双质粒重组菌为e1,l-2-氨基丁酸产量为36.8g/l,转化率达88.6%。
与实施例11相比,此对比例下未经密码子优化的fdh基因参与构建的重组菌在转化l-苏氨酸生产l-2-氨基丁酸的过程中,转化时间更长,且l-2-氨基丁酸产量和转化率均明显下降。
表10双质粒重组菌(prsfduet-btleudh+petduet-cbfdh0-ectd)的催化效果
虽然本发明已以较佳实施例公开如上,但其并非用以限定本发明,任何熟悉此技术的人,在不脱离本发明的精神和范围内,都可做各种的改动与修饰,因此本发明的保护范围应该以权利要求书所界定的为准。
sequencelisting
<110>江南大学
<120>一种转化l-苏氨酸生产l-2-氨基丁酸的重组菌的构建及应用
<160>18
<170>patentinversion3.3
<210>1
<211>1545
<212>dna
<213>大肠杆菌w3110
<400>1
atggctgactcgcaacccctgtccggtgctccggaaggtgccgaatatttaagagcagtg60
ctgcgcgcgccggtttacgaggcggcgcaggttacgccgctacaaaaaatggaaaaactg120
tcgtcgcgtcttgataacgtcattctggtgaagcgcgaagatcgccagccagtgcacagc180
tttaagctgcgcggcgcatacgccatgatggcgggcctgacggaagaacagaaagcgcac240
ggcgtgatcactgcttctgcgggtaaccacgcgcagggcgtcgcgttttcttctgcgcgg300
ttaggcgtgaaggccctgatcgttatgccaaccgccaccgccgacatcaaagtcgacgcg360
gtgcgcggcttcggcggcgaagtgctgctccacggcgcgaactttgatgaagcgaaagcc420
aaagcgatcgaactgtcacagcagcaggggttcacctgggtgccgccgttcgaccatccg480
atggtgattgccgggcaaggcacgctggcgctggaactgctccagcaggacgcccatctc540
gaccgcgtatttgtgccagtcggcggcggcggtctggctgctggcgtggcggtgctgatc600
aaacaactgatgccgcaaatcaaagtgatcgccgtagaagcggaagactccgcctgcctg660
aaagcagcgctggatgcgggtcatccggttgatctgccgcgcgtagggctatttgctgaa720
ggcgtagcggtaaaacgcatcggtgacgaaaccttccgtttatgccaggagtatctcgac780
gacatcatcaccgtcgatagcgatgcgatctgtgcggcgatgaaggatttattcgaagat840
gtgcgcgcggtggcggaaccctctggcgcgctggcgctggcgggaatgaaaaaatatatc900
gccctgcacaacattcgcggcgaacggctggcgcatattctttccggtgccaacgtgaac960
ttccacggcctgcgctacgtctcagaacgctgcgaactgggcgaacagcgtgaagcgttg1020
ttggcggtgaccattccggaagaaaaaggcagcttcctcaaattctgccaactgcttggc1080
gggcgttcggtcaccgagttcaactaccgttttgccgatgccaaaaacgcctgcatcttt1140
gtcggtgtgcgcctgagccgcggcctcgaagagcgcaaagaaattttgcagatgctcaac1200
gacggcggctacagcgtggttgatctctccgacgacgaaatggcgaagctacacgtgcgc1260
tatatggtcggcggacgtccatcgcatccgttgcaggaacgcctctacagcttcgaattc1320
ccggaatcaccgggcgcgctgctgcgcttcctcaacacgctgggtacgtactggaacatt1380
tctttgttccactatcgcagccatggcaccgactacgggcgcgtactggcggcgttcgaa1440
cttggcgaccatgaaccggatttcgaaacccggctgaatgagctgggctacgattgccac1500
gacgaaaccaataacccggcgttcaggttctttttggcgggttaa1545
<210>2
<211>1101
<212>dna
<213>苏云金芽孢杆菌ybt-1520
<400>2
atgacattagaaatcttcgaatacttagaaaaatatgattatgagcaagtagtattttgt60
caagataaagaatctggtttaaaagcaattattgcaattcatgatacaacacttggaccg120
gctcttggtggaacaagaatgtggacatatgattctgaagaagcggcgattgaagatgca180
ttgcgtcttgcaaaagggatgacatataaaaacgcagcagctggtttaaacttaggtggt240
gcgaaaacagtaattatcggtgatcctcgtaaagataagagcgaagcaatgttccgtgca300
ctaggacgttatatccaaggactaaacggacgttacattacagctgaagatgttggtaca360
acagtagatgatatggatattatccatgaagaaactgactttgtaacaggtatctcacca420
tcattcggttcttctggtaacccatctccagtaactgcatacggtgtttaccgtggtatg480
aaagcagctgcaaaagaagctttcggtactgacaatttagaaggaaaagtaattgctgtt540
caaggcgttggtaacgtagcatatcacctatgcaaacatttacacgctgaaggagcaaaa600
ttaatcgttacagatattaataaagaagctgtacaacgtgctgtagaagaattcggtgca660
tcagcagttgaaccaaatgaaatttatggtgttgaatgcgatatttacgcaccatgtgca720
ttaggcgcaacagttaatgatgaaactattccacaacttaaagcaaaagtaatcgcaggt780
tctgcaaataaccaattaaaagaaaatcgtcacggtgacatcattcatgaaatgggtatt840
gtatacgcaccagattatgtaattaatgcaggtggcgtaattaacgtagcagacgaatta900
tatggatacaatagagaacgtgcactaaaacgtgttgagtctatttatgacacaattgca960
aaagtaatcgaaatttcaaaacgcgatggcatagcaacttatgtagcggcagatcgtcta1020
gctgaagagcgcattgcaagcttgaaaaattctcgtagcacttacttacgcaacggtcac1080
gatattattagccgtcgctaa1101
<210>3
<211>1098
<212>dna
<213>假丝酵母原基因
<400>3
atgaagatcgtgttagtcctttacgacgcaggaaagcatgccgcggacgaggaaaagtta60
tacggatgtaccgaaaataaacttggtatcgcgaattggcttaaagatcaaggccatgag120
ctgattactaccagtgataaagaaggcgggaacagtgttttagaccaacatatcccagac180
gcggatattatcattaccaccccgtttcacccggcttatatcacgaaggagcgtattgat240
aaagccaagaagttgaagctggtggtagtcgccggggttggtagtgaccacatcgactta300
gactatatcaaccaaactggtaaaaaaattagtgttttggaagttactggatcaaacgta360
gtgtccgtggccgaacatgttgtaatgacgatgctggtgcttgttcgcaactttgtgccc420
gcgcacgagcaaattattaaccatgactgggaagtcgctgctattgcgaaagacgcttac480
gatatcgaagggaagactattgcaaccattggtgccggtcgcatcggttaccgcgtgtta540
gagcgccttgtcccgtttaaccctaaggaacttttgtattatgactatcaagcgctgcca600
aaggacgcggaggagaaagtgggagctcgccgcgtagagaatatcgaggagttagtagcc660
caggcggatatcgttactgtaaacgcccctttgcacgccggaactaagggcctgattaat720
aaagagttattaagcaaatttaagaagggagcttggttagtcaacactgctcgcggtgct780
atttgtgtggcagaggatgttgctgctgctttggaatcagggcagttacgtggatacggt840
ggtgatgtttggttccctcaaccagcgccgaaagaccacccgtggcgcgacatgcgtaat900
aagtatggggcagggaacgctatgacgccgcactattctggcactacattggatgcgcag960
acacgttacgctcaagggactaaaaacattttggagtctttcttcaccggtaagttcgat1020
taccgccctcaagatatcattcttttgaatggagaatacgtcacaaaggcctacgggaaa1080
cacgataaaaaataataa1098
<210>4
<211>1098
<212>dna
<213>人工序列
<400>4
atgaaaattgtgctggtgctgtatgatgcgggcaaacatgcggcggatgaagaaaaactg60
tatggctgcaccgaaaataaactgggcattgcgaactggctgaaagatcagggccatgaa120
ctgattaccacctctgataaagaaggcggcaacagcgttctggatcagcatattccggat180
gcggatattattattaccaccccgtttcatccggcgtatatcaccaaagaacgcatcgat240
aaagcgaaaaaactgaaactggtggtggtggcgggcgtgggcagcgatcatattgatctg300
gattatatcaaccagaccggtaaaaaaattagcgtgctggaagtgaccggcagcaacgtg360
gtgagcgtggcggaacatgtggtgatgaccatgctggtgctggtgcgtaactttgtgccg420
gcgcatgaacaaattattaaccacgattgggaagtggcggcgattgcgaaagatgcgtat480
gatatcgaaggcaaaaccattgcgaccattggcgcgggtcgtattggctatcgtgtgctg540
gaacgtctggtgccgtttaatccgaaagaactgctgtattatgattatcaggcgctgccg600
aaagatgcggaagaaaaagtgggtgcgcgtcgtgtggaaaacattgaagaactggtggcg660
caggcggatattgtgaccgtgaacgcgccgctgcatgcgggcaccaaaggcctgatcaac720
aaagagctgctgtctaagtttaaaaaaggcgcgtggctggtgaataccgcgcgtggcgcg780
atttgcgtggccgaagatgttgcggcggcgctggaaagcggtcagctgcgtggctatggc840
ggtgatgtgtggtttccgcagccggcgccgaaagatcatccgtggcgtgatatgcgtaac900
aaatatggcgcgggtaacgccatgaccccgcattatagcggcaccaccctggatgcgcag960
acccgttatgcgcagggcaccaaaaacattctggaaagctttttcaccggcaaatttgat1020
tatcgtccgcaggacattattctgctgaacggcgaatatgtgaccaaagcgtatggcaaa1080
cacgataaaaaataataa1098
<210>5
<211>514
<212>prt
<213>大肠杆菌w3110
<400>5
metalaaspserglnproleuserglyalaprogluglyalaglutyr
151015
leuargalavalleuargalaprovaltyrglualaalaglnvalthr
202530
proleuglnlysmetglulysleuserserargleuaspasnvalile
354045
leuvallysarggluaspargglnprovalhisserphelysleuarg
505560
glyalatyralametmetalaglyleuthrglugluglnlysalahis
65707580
glyvalilethralaseralaglyasnhisalaglnglyvalalaphe
859095
serseralaargleuglyvallysalaleuilevalmetprothrala
100105110
thralaaspilelysvalaspalavalargglypheglyglygluval
115120125
leuleuhisglyalaasnpheaspglualalysalalysalaileglu
130135140
leuserglnglnglnglyphethrtrpvalpropropheasphispro
145150155160
metvalilealaglyglnglythrleualaleugluleuleuglngln
165170175
aspalahisleuaspargvalphevalprovalglyglyglyglyleu
180185190
valalaglyvalalavalleuilelysglnleumetproglnilelys
195200205
valilealavalglualagluaspseralacysleulysalaalaleu
210215220
aspalaglyhisprovalaspleuproargvalglyleuphealaglu
225230235240
glyvalalavallysargileglyaspgluthrpheargleucysgln
245250255
glutyrleuaspaspileilethrvalaspseraspalailecysala
260265270
alametlysaspleuphegluaspvalargalavalalagluproser
275280285
glyalaleualaleualaglymetlyslystyrilealaleuhisasn
290295300
ileargglygluargleualahisileleuserglyalaasnvalasn
305310315320
phehisglyleuargtyrvalsergluargcysgluleuglyglugln
325330335
argglualaleuleualavalthrileprogluglulysglyserphe
340345350
leulysphecysglnleuleuglyglyargservalthrglupheasn
355360365
tyrargphealaaspalalysasnalacysilephevalglyvalarg
370375380
leuserargglyleuglugluarglysgluileleuglnmetleuasn
385390395400
aspglyglytyrservalvalaspleuseraspaspglumetalalys
405410415
leuhisvalargtyrmetvalglyglyargproserhisproleugln
420425430
gluargleutyrserpheglupheprogluserproglyalaleuleu
435440445
argpheleuasnthrleuglythrtyrtrpasnileserleuphehis
450455460
tyrargserhisglythrasptyrglyargvalleualaalapheglu
465470475480
leuglyasphisgluproaspphegluthrargleuasngluleugly
485490495
tyraspcyshisaspgluthrasnasnproalapheargphepheleu
500505510
alagly
<210>6
<211>366
<212>prt
<213>苏云金芽孢杆菌ybt-1520
<400>6
metthrleugluilepheglutyrleuglulystyrasptyrglugln
151015
valvalphecysglnasplysgluserglyleulysalaileileala
202530
ilehisaspthrthrleuglyproalaleuglyglythrargmettrp
354045
thrtyraspsergluglualaalailegluaspalaleuargleuala
505560
lysglymetthrtyrlysasnalaalaalaglyleuasnleuglygly
65707580
alalysthrvalileileglyaspproarglysasplyssergluala
859095
metpheargalaleuglyargtyrileglnglyleuasnglyargtyr
100105110
ilethralagluaspvalglythrthrvalaspaspmetaspileile
115120125
hisglugluthraspphevalthrglyileserproserpheglyser
130135140
serglyasnproserprovalthralatyrglyvaltyrargglymet
145150155160
lysalaalaalalysglualapheglythraspasnleugluglylys
165170175
valilealavalglnglyvalglyasnvalalatyrhisleucyslys
180185190
hisleuhisalagluglyalalysleuilevalthraspileasnlys
195200205
glualavalglnargalavalgluglupheglyalaseralavalglu
210215220
proasngluiletyrglyvalglucysaspiletyralaprocysala
225230235240
leuglyalathrvalasnaspgluthrileproglnleulysalalys
245250255
valilealaglyseralaasnasnglnleulysgluasnarghisgly
260265270
aspileilehisglumetglyilevaltyralaproasptyrvalile
275280285
asnalaglyglyvalileasnvalalaaspgluleutyrglytyrasn
290295300
arggluargalaleulysargvalgluseriletyraspthrileala
305310315320
lysvalilegluileserlysargaspglyilealathrtyrvalala
325330335
alaaspargleualaglugluargilealaserleulysasnserarg
340345350
serthrtyrleuargasnglyhisaspileileserargarg
355360365
<210>7
<211>364
<212>prt
<213>人工序列
<400>7
metlysilevalleuvalleutyraspalaglylyshisalaalaasp
151015
gluglulysleutyrglycysthrgluasnlysleuglyilealaasn
202530
trpleulysaspglnglyhisgluleuilethrthrserasplysglu
354045
glyglyasnservalleuaspglnhisileproaspalaaspileile
505560
ilethrthrprophehisproalatyrilethrlysgluargileasp
65707580
lysalalyslysleulysleuvalvalvalalaglyvalglyserasp
859095
hisileaspleuasptyrileasnglnthrglylyslysileserval
100105110
leugluvalthrglyserasnvalvalservalalagluhisvalval
115120125
metthrmetleuvalleuvalargasnphevalproalahisglugln
130135140
ileileasnhisasptrpgluvalalaalailealalysaspalatyr
145150155160
aspilegluglylysthrilealathrileglyalaglyargilegly
165170175
tyrargvalleugluargleuvalpropheasnprolysgluleuleu
180185190
tyrtyrasptyrglnalaleuprolysaspalagluglulysvalgly
195200205
alaargargvalgluasnileglugluleuvalalaglnalaaspile
210215220
valthrvalasnalaproleuhisalaglythrlysglyleuileasn
225230235240
lysgluleuleuserlysphelyslysglyalatrpleuvalasnthr
245250255
alaargglyalailecysvalalagluaspvalalaalaalaleuglu
260265270
serglyglnleuargglytyrglyglyaspvaltrppheproglnpro
275280285
alaprolysasphisprotrpargaspmetargasnlystyrglyala
290295300
glyasnalametthrprohistyrserglythrthrleuaspalagln
305310315320
thrargtyralaglnglythrlysasnileleugluserphephethr
325330335
glylyspheasptyrargproglnaspileileleuleuasnglyglu
340345350
tyrvalthrlysalatyrglylyshisasplyslys
355360
<210>8
<211>29
<212>dna
<213>人工序列
<400>8
cgggatccatggctgactcgcaacccctg29
<210>9
<211>34
<212>dna
<213>人工序列
<400>9
cccaagcttctaacccgccaaaaagaacctgaac34
<210>10
<211>26
<212>dna
<213>人工序列
<400>10
cgggatccatgcgcgttatggtcttg26
<210>11
<211>33
<212>dna
<213>人工序列
<400>11
cccaagcttttagcgacggctaataatatcgtg33
<210>12
<211>52
<212>dna
<213>人工序列
<400>12
catcatcaccacagccaggatccaatgacattagaaatcttcgaatacttag52
<210>13
<211>47
<212>dna
<213>人工序列
<400>13
gcggtttctttaccagactcgagttagcgacggctaataatatcgtg47
<210>14
<211>53
<212>dna
<213>人工序列
<400>14
ccatcatcaccacagccaggatccaatgaagatcgtgttagtcctttacgacg53
<210>15
<211>55
<212>dna
<213>人工序列
<400>15
ggtacctttctcctctttaatctgcagttattattttttatcgtgtttcccgtag55
<210>16
<211>46
<212>dna
<213>人工序列
<400>16
ctgcagattaaagaggagaaaggtaccatggctgactcgcaacccc46
<210>17
<211>46
<212>dna
<213>人工序列
<400>17
agcggtttctttaccagactcgagttaacccgccaaaaagaacctg46
<210>18
<211>72
<212>dna
<213>人工序列
<400>18
gtaaaggactaacacgatcttcatgagctctttctcctctttgatatcttagcgacggct60
aataatatcgtg72
- 还没有人留言评论。精彩留言会获得点赞!