一种沙门氏菌快速鉴定与分型方法及试剂盒与流程
本发明涉及兽用生物制品与食品微生物技术领域,尤其是一种沙门氏菌快速鉴定与分型方法及试剂盒,主要用于动物及其产品产业链样品中沙门氏菌及其血清型肯塔基的多重pcr检测。
背景技术:
沙门氏菌是一种重要的人兽共患病原菌,主要寄居于人和动物的肠道中,研究表明由沙门氏菌引起的食物中毒是所有细菌性食物中毒中比例最高、危害最广的一种。世界卫生组织(who)调查表明全球每年有上亿例人类胃肠炎是由沙门氏菌感染引起,其中死亡病例高达300万。
非伤寒沙门氏菌(nontyphoidalsalmonella,nts)能够引起肠胃炎(食物中毒)、菌血症以及继发的病灶感染等,是威胁全球的公共卫生问题。据报道,我国细菌性肠胃炎的常见致病菌中,nts仅次于副溶血弧菌,位居致病谱的第2位。大多数nts的感染归因于食用了受污染的动物性食品,引发带有腹部绞痛的肠胃炎、高热及腹泻等胃肠炎症状,虽然大多预后良好,但是对于年老体弱者或者免疫力低下者,仍会有致命的危险。
动物及动物产品产业中广泛存在着携带或污染沙门氏菌的情况,尤其是禽肉产业重,禽类食品是该类感染的重要载体。沙门氏菌是一种使宿主常呈现无明显症状的家禽肠道定植菌。应激或患病情况下的幼禽为沙门氏菌高频的水平传播提供了机会。来自美国usda-fsis数据显示每四块生鸡组织就非常可能出现1例沙门氏菌污染。不仅如此,优势的沙门血清型能传播到可再生组织,导致菌体和禽蛋相关沙门氏菌病的垂直传播。
氟喹诺酮类和三代头孢类抗生素是目前治疗沙门氏菌感染的首选用药。由于上述两类药物在禽类养殖业中也被广泛应用,因此养鸡场和市售鸡肉已成为含超广谱β-内酰胺酶(extendedspectrumβ-lactamases,esbls)和喹诺酮耐药沙门氏菌的重要储存库。准确、快速、经济地检测常见且具有重要公共卫生意义的沙门氏菌血清型十分关键。
肯塔基血清型沙门氏菌,最早鉴定于1937年,分离自养殖鸡体,考夫曼抗原式为8,20i:z6,该菌被公认为与禽类相关。肯塔基沙门氏菌流行于北非、欧洲、北美等地区,对环丙沙星及三代头孢菌素等抗生素呈现多重、高水平耐药,因此亦被欧美地区称为“超级耐药”肯塔基沙门氏菌。有流行病学证据证实“超级耐药”肯塔基沙门氏菌系通过旅游者从北非传播到欧洲和北美地区,因而欧洲和北美地区的食品及农业管理部门对其检出及传播高度关注,是上述地区非伤寒沙门氏菌重点监测的血清型之一。我国禽肉产业中四种沙门氏菌血清型是主要危害:肯塔基、肠炎、印第安纳、鸡白痢。肯塔基位列我国及美国等国家鸡肉产品中最常见血清型的前三位,并且也是零售禽肉产品中严重污染的菌株。该血清型中携带环丙沙星(cip)耐性的序列型st198菌株传播后可造成严重后果。
传统食源性致病菌的检测方法通常需要花费很长时间,许多快速、灵敏的分子生物学方法已被应用于食品微生物的检测、鉴定,克服了传统检测方法的缺陷,其中聚合酶链式反应(polymerasechainreaction,pcr)已成为最普通的食品微生物分子生物学检测方法。近年来在pcr的基础上发展了多重pcr(multiplexpcr,mpcr)技术,它是一种在一个反应体系中加入多对引物同时检测多个目的片段的技术,可以为单一模板也可以是几种不同的模板,其反应原理、反应试剂和操作过程与一般pcr相同。多重pcr在食源性致病菌的检测上已得到较好的应用,可以同时检测一种致病菌的多个基因,也可以同时检测多种致病菌。传统的pcr方法多采用inva、fimh、stn基因设计引物,灵敏度往往较好,但常出现假阳性率或假阴性率高的现象,一重pcr方法本身的特异性也不能令人信服。目前没有面向整个动物及其产品产业链(包括市售肉类)样品中沙门氏菌及肯塔基血清型的检测方案。
技术实现要素:
本发明的目的是设计沙门氏菌肠道种i型亚种的种属特异性引物及肯塔基血清型的血清型特异性引物,并且对pcr反应条件进行优化,建立同时扩增沙门氏菌多对基因的同一pcr反应条件。利用多重pcr方法快速检测禽肉生产链样品或分离株菌液中的沙门氏菌,同时指明其中是否含有肯塔基血清型。
本发明的技术目的是这样实现的:
一种沙门氏菌快速鉴定与分型的试剂盒,其特征在于该试剂盒包括:
1)空白对照:ddh20;
2)阳性参照品:s.kentucky1c1的dna,由试剂盒法或水煮法提取获得,作为pcr模板;
3)引物组,由引物stn-f、stn-r、gly-f、gly-r、bcf-f、bcf-r组成;各引物的核苷酸序列分别为:
stn-f:5′-ctttggtcgtaaaataaggcg-3′;
stn-r:5′-tgcccaaagcagagagattc-3′;
gly-f:5′-ttccaattgaaacgagtgcgg-3′;
gly-r:5′-actaaccgcttgggttgttgctgt-3′;
bcf-f:5′-gggtgggcggaaaactatttc-3′;
bcf-r:5′-cggcacggcggaatagagcac-3′;
4)反应酶:2xm5taqpcrmix;
6)dna分子量标准:dl2000dnamarker;
7)核酸染料;
8)琼脂糖。
所述水煮法包含以下步骤:涡旋振荡混匀s.kentucky1c1的样品增菌液,取1ml于2mlep管,13000rpm离心1.5min,弃上清,1ml双蒸水洗涤一遍,13000rpm离心1.5min,弃上清;加入70μl的双蒸水重悬,沸水煮30-35min,再立即冰浴5~10min,11000rpm离心3min,取上清液为pcr模板。
所述pcr模板进行多重pcr检测的反应体系为:反应酶2xm5taqpcrmix10μl;stn-f、stn-r引物各0.34μl,终浓度170nmol/l;gly-f、gly-r引物各0.48μl,终浓度240nmol/l;bcf-f、bcf-r引物各0.2μl,终浓度100nmol/l;pcr模板4μl,ddh203.96μl。
所述pcr模板进行多重pcr检测的反应条件:95℃预变性5min;95℃变性25s,59.4℃退火25s,72℃延伸60s,循环35次;72℃延伸8min。
本发明的另一个技术方案:一种沙门氏菌快速鉴定与分型的方法,其特征在于,包括以下步骤:
步骤1,基于s.kentucky1c1的菌液制备得到pcr模板;
步骤2,制备引物组,由stn-f、stn-r、gly-f、gly-r、bcf-f、bcf-r组成;各引物的核苷酸序列分别为:
stn-f:5′-ctttggtcgtaaaataaggcg-3′;
stn-r:5′-tgcccaaagcagagagattc-3′;
gly-f:5′-ttccaattgaaacgagtgcgg-3′;
gly-r:5′-actaaccgcttgggttgttgctgt-3′;
bcf-f:5′-gggtgggcggaaaactatttc-3′;
bcf-r:5′-cggcacggcggaatagagcac-3′;
步骤3,基于步骤1得到的pcr模板,利用步骤2得到的引物组建立多重pcr检测的反应体系,该多重pcr检测的反应体系在预定反应条件下得到pcr扩增产物;
步骤4,对步骤3获得的扩增产物进行电泳检测,根据电泳检测结果判定是否含有沙门氏菌。
所述pcr模板的制备方法是:基因组dna提取试剂盒从s.kentucky1c1的菌液提取得到dna作为pcr模板,或者水煮法从s.kentucky1c1的菌液提取得到dna作为pcr模板。
所述水煮法包含以下步骤:涡旋振荡混匀s.kentucky1c1的样品增菌液,取1ml于2mlep管,13000rpm离心1.5min,弃上清,1ml双蒸水洗涤一遍,13000rpm离心1.5min,弃上清;加入70μl的双蒸水重悬,沸水煮30-35min,再立即冰浴5~10min,11000rpm离心3min,取上清液为pcr模板。
所述pcr模板进行多重pcr检测的反应体系为:反应酶2xm5taqpcrmix10μl;stn-f、stn-r引物各0.34μl,终浓度170nmol/l;gly-f、gly-r引物各0.48μl,终浓度240nmol/l;bcf-f、bcf-r引物各0.2μl,终浓度100nmol/l;pcr模板4μl,ddh203.96μl。
所述pcr模板进行多重pcr检测的反应条件:95℃预变性5min;95℃变性25s,59.4℃退火25s,72℃延伸60s,循环35次;72℃延伸8min。
所述电泳检测的方法为:扩增产物经1.2%琼脂糖凝胶电泳进行检测,若沙门氏菌在993bp出现属特异性条带,260bp处出现肠道种i型亚种特异性条带,且仅该993bp、260bp两条特异性条带同时出现,判定为沙门氏菌阳性;在此基础上,若肯塔基沙门氏菌在170bp处也出现血清型特异性条带,此时993bp、260bp、170bp三条特异性条带同时出现,则判为肯塔基沙门氏菌阳性;若未见特异性条带则判为沙门氏菌阴性。
本发明具有的有益效果是:为了快速检测重要的沙门菌血清型(肯塔基沙门菌),本试验根据已知的沙门菌全基因组序列,通过分析筛选出沙门氏菌肠道种i型亚种及肯塔基血清型的不同分型层次特异性序列,进一步设计多重pcr引物,建立了该多重pcr检测方法。
通过特异性试验、敏感性试验以及临床样品的检测,表明建立的多重pcr方法可用于动物及其产品产业链样品中沙门氏菌(包括肯塔基沙门菌)的特异性快速检测,为科研及生产工作中的检测与分型提供了准确、快速、经济的新方法。
本试剂盒采用多重pcr方法,通过特异性条带检测动物及其产品产业链条中的肠道种i型亚种沙门氏菌,并可同时指示其中的肯塔基血清型菌株,适用于多种样本(如肛拭子、鼻拭子、肌肉组织、脏器、泄殖腔拭子等)中沙门氏菌尤其是肯塔基血清型菌株的检测。
附图说明
图1多重pcr反应体系引物浓度组合比的优化结果。
图2多重pcr反应体系退火温度的优化结果。
图3肯塔基沙门氏菌多重pcr的特异性试验检测结果。
图4dna模板稀释法测定的多重pcr敏感性试验结果。
具体实施方式
下面结合说明书附图,对本发明作进一步说明,但本发明并不局限于以下实施例。
一、本发明提供的沙门氏菌快速鉴定与分型的试剂盒,包括:
1、对照品:
空白对照:ddh2o;
阳性参照品:菌株s.kentucky1c1的dna,利用试剂盒法或水煮法提取dna,dna浓度200ng/ul,作为pcr模板;
2、试剂;
用于提取上述dna的细菌基因组dna提取试剂盒,商购获得;
反应酶2xm5taqpcrmix,商购获得;
dna分子量标准:dl2000dnamarker,商购获得;
核酸染料,商购获得;
琼脂糖,商购获得;
3、引物组,由本发明设计,由上海尚亚生物技术有限公司合成,引物组的引物及其核苷酸序列如下:
stn-f:5′-ctttggtcgtaaaataaggcg-3′;
stn-r:5′-tgcccaaagcagagagattc-3′;
gly-f:5′-ttccaattgaaacgagtgcgg-3′;
gly-r:5′-actaaccgcttgggttgttgctgt-3′;
bcf-f:5′-gggtgggcggaaaactatttc-3′;
bcf-r:5′-cggcacggcggaatagagcac-3′。
所述水煮法包含以下步骤:涡旋振荡混匀s.kentucky1c1的样品增菌液,取1ml于2mlep管,13000rpm离心1.5min,弃上清,1ml双蒸水洗涤一遍,13000rpm离心1.5min,弃上清;加入70μl的双蒸水重悬,沸水煮30-35min,再立即冰浴5~10min,11000rpm离心3min,取上清液为pcr模板。
二、本发明提供的沙门氏菌快速鉴定与分型的方法,其特征在于,包括以下步骤:
步骤1,基于s.kentucky1c1的菌液制备得到pcr模板;
步骤2,制备引物组,由stn-f、stn-r、gly-f、gly-r、bcf-f、bcf-r组成;
步骤3,基于步骤1得到的pcr模板,利用步骤2得到的引物组建立多重pcr检测的反应体系,该多重pcr检测的反应体系在预定反应条件下得到pcr扩增产物;
步骤4,对步骤3获得的扩增产物进行电泳检测,根据电泳检测结果判定是否含有沙门氏菌。
三、多重pcr检测的反应体系建立如下:
以菌株s.kentucky1c1提取的dna作为pcr模板,用ddh2o作为空白对照,进行多重pcr反应,经过对引物浓度组合比和退火温度的逐步优化,优化结果见图1、图2。
最终选用的反应体系为:
预定反应条件:
95℃预变性5min;95℃变性25s,59.4℃退火25s,72℃延伸60s,进行35次循环;72℃延伸8min。
图1中:bcf引物1-10的浓度分别为:240、240、240、240、170、170、170、100、100、100(nmol/l);gly引物1-10的浓度分别为:240、240、170、100、240、170、100、240、170、100(nmol/l);stn引物1-10的浓度分别为:30、30、170、100、100、30、170、170、170、30。
图1到图4中,m为dna标准分子量。
四、多重pcr的特异性测定:
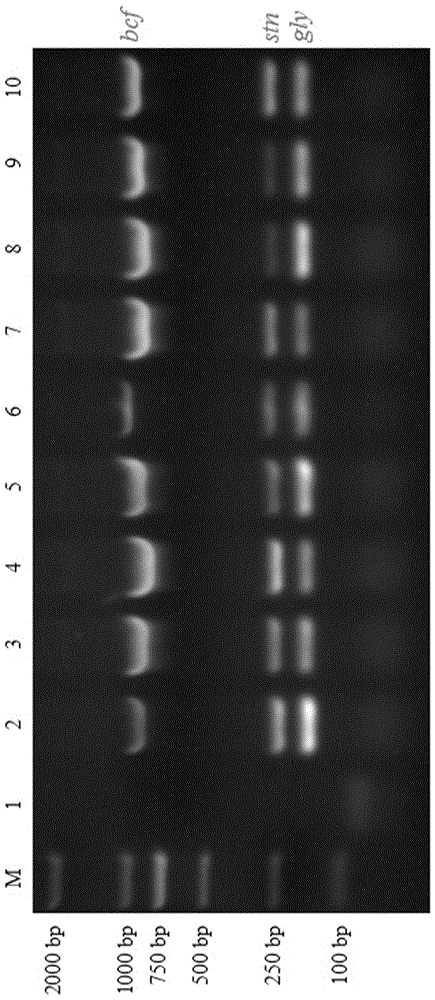
将6株肯塔基沙门氏菌(不同来源分离株)、7株其他血清型沙门氏菌(来自5个不同血清型)和其他6株非沙门氏菌(为来自5个不同属的重要标准或参考菌株)提取基因组dna,多重pcr方法的特异性结果显示如图3。4株肯塔基沙门氏菌(s.kentucky3b1、s.kentucky1f1、s.kentucky1e1、s.kentuckysk,2个肯塔基沙门氏菌人工污染样品(使用s.kentuckybd8、s.kentuckybb6建立污染鸡肉样品)、7株其他血清型沙门氏菌(s.enteritidis50335、s.pullorum15820、s.newport13282、s.heidelbergs116、s.enteritidiscgmcc50760、s.pullorumjxa-yangzl和atcc14028(鼠伤寒沙门氏菌,用于建立污染鸡肉样品)条带图谱符合预期,同时其他6株非沙门氏菌(atcc25923(金黄色葡萄球菌)、atcc27853(绿脓杆菌)、atcc25922(大肠杆菌)、atcc7982(气单胞菌)、streptococcussuiszyh33(猪链球菌ii型)、streptococcussuis9801(猪链球菌ii型))未见明显条带,说明该多重pcr方法具有良好特异性。
图3中,阴性对照;1、streptococcussuis9801(猪链球菌ii型);2、streptococcussuiszyh33(猪链球菌ii型);3、atcc7966(气单胞菌);4、atcc25922(大肠杆菌);5、atcc27853(绿脓杆菌);6、atcc25923(金黄色葡萄球菌);7、s.dublin8d(作为pcr阳性对照);8、s.kentuckybb6(检测污染鸡肉样品预增菌液);9、s.kentuckybd8(检测污染鸡肉样品预增菌液);10、atcc14028(鼠伤寒沙门氏菌检测污染鸡肉样品预增菌液);11、s.pullorumjxa-yangzl;12、s.kentuckysk;13、s.enteritidiscgmcc50760;14、s.heidelbergs116;15、s.newport13282;16、s.pullorum15820;17、s.enteritidis50335;18、s.kentucky1e1;19、s.kentucky1f1;20、s.kentucky3b1。
五、多重pcr的敏感性测定:
采用上述优化的多重pcr反应体系对菌株kentucky1c1进行敏感性试验。将提取的dna模板2ul(约200ng/ul)进行10倍梯度稀释,用ddh2o作为空白对照,选取最终的反应体系和反应条件进行多重pcr检测。敏感性试验结果显示如图4,多重pcr最低可检测到10-4ng/uldna,完全可应用于检测实践中。对不同分离菌株的检测进一步证明了该方法的可操作性及适用性,可以用于市售食物、家畜组织粪便、野生动物等多种来源样品的检验。
六、多重pcr检测技术的应用:
6.1样品采集:
6.1.1棉拭子样品;
所用取样器材必须经高压灭菌并烘干;
若样品为活禽,建议取泄殖腔拭子:将拭子深入泄殖腔转一圈沾取粪便。然后将拭子一起放入盛有1ml10mmpbs缓冲液(商购获得)的离心管中备用;
6.1.2食物样品
若样品为肌肉或脏器,取待检样品2~20g于已洗净、灭菌的采样管(或采样袋)中,备用;
6.1.3水样;
用移液器取1-5ml水样于无菌的10ml离心管中,备用;
6.2样品存放及运输;
制备的样品在2~8℃条件下保存应不超过24h;运输:采用冰壶或泡沫箱加冰密封进行运输;
6.3样品的预处理;
bpw缓冲蛋白胨水(用于沙门氏菌的增菌培养):nacl5g,蛋白胨10g,na2hpo4·12h2o9.0g,kh2po41.5g(商购获得),ph调至7.2±0.2,加入纯净水,定容至1l,高压灭菌后在4℃保存备用;
棉拭子样&水样:在含有采集样品的离心管中酌情添加10mmpbs缓冲液(商购获得)使液体便于吸取,振荡均匀备用;
食物样品或其他组织:按部位分类,置于无菌密封袋(或均质袋)中并编号,加入50~100mlbpw(缓冲蛋白胨水),条件允许时应先均质处理,后于37℃,120rpm振荡30min;
取上述步骤处理后1ml液体于盛有9mlbpw的试管中,于37℃摇床增菌3~4h;
6.4多重pcr鉴定;
取约1.0ml菌液提dna(pcr模板)并多重pcr鉴定,使用stn、gly和bcf引物进行多重pcr反应,反应总体积20μl,反应体系:
反应条件:
95℃预变性5min;95℃变性25s,59.4℃退火25s,72℃延伸60s,进行35次循环;72℃延伸8min;
6.5结果质控;
阳性菌株s.kentucky1c1模板pcr产物应见三个目的条带且阴性对照应未出现目的条带,否则判为结果无效应重做;
6.6结果判定;
扩增产物经1.2%琼脂糖凝胶电泳进行检测,沙门氏菌在993bp出现属特异性条带(bcf基因扩增产物),260bp处出现肠道种i型亚种特异性条带(stn基因扩增产物),若仅该两条带同时出现,判为沙门氏菌阳性(非肯塔基沙门氏菌),肯塔基沙门氏菌在170bp处出现血清型特异性条带,若三条带同时出现则判为肯塔基沙门氏菌阳性;若未见条带则判为沙门氏菌阴性。
以上所述仅为本发明的优选实施例,对于本领域的技术人员来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
序列表
浙大大学
一种沙门氏菌快速鉴定与分型方法
6
siposequencelisting1.0
1
21
dna
引物(primer)
1
ctttggtcgtaaaataaggcg21
2
20
dna
引物(primer)
2
tgcccaaagcagagagattc20
3
21
dna
引物(primer)
3
ttccaattgaaacgagtgcgg21
4
24
dna
引物(primer)
4
actaaccgcttgggttgttgctgt24
5
21
dna
引物(primer)
5
gggtgggcggaaaactatttc21
6
21
dna
引物(primer)
6
cggcacggcggaatagagcac21
stn基因目的片段(genbank中的accessionnumber:l16014(489-748))
ctttggtcgtaaaataaggcgtaaaaatcgcctccagctgatccggggcgatccctttcccgctatcggtaacagtgatgataacgcggtcggtcccactttcttttgcctctacgctaatcgttccctggcggccaatcgcatgaatagcgttcaggtacagattcaacagcacctgagtcagcctgtccgggtcagcctgaatacgcttaagcgtctcattcgccgtgaatctcaactgaatctctctgctttgggca
bcfc基因目的片段(genbank中的accessionnumber:am933172(25665–26657))
gggtgggcggaaaactatttcaacccggcatttctgtctgacgacccgtctgcggtggccgacctatcgaccttttcccgtaatgcccaggcggcagggatgtatcgcgttgacgtttacctgaacaatacgtttctcgcgaccagagacattgccttccaggcggtgaaaacgacgggaaaaagcgcgcccaccgatgacagcggattacgcgcctgcctgacgcctgaaatgcttaaaaatatgggggtaaacaccggggcgtttccactgttggcgaaggcggcggcgggaagttgccctgatctcgccagtgcgataccggccgcccggacccgctttgattttgcgcagcaacgtctcgacattagcatcccgcaggcggcgatggttgccagcgccagaggctatatcccaccgaaatactgggatgaaggtattaatgcgttgctattgaattacacctttaccggcgcgaatagtcaggatcggagcccaggcggcagtgcggagaacagctattttcttggattgaatagcggccttaatctgggggcctggcggttacgcgactactccacatggaacgcgaatagcggcgatcagaatagcgacagcgactggcagcacatcagtacttatctggaacgtgatgtggtctttttgcagggagaactgacggcaggcgatagttataccccctccgcattattcgacagccttccttttcgtgggctacaactggcgtctgacgacaatatgttgccagacagcatgaagggcttcgcaccgaccattcacggcattgccagaagcaacgcgcaagtgaccattcggcaaaacggctacatcattaatcagcgctatgtgccgcccggggcatttactattaatgatctctatcctaccgccgccagcggcgatttgactgtggaagtcaaagagtccgacggttctattaatcgctataacgtgccctattccgccgtgccg
gly基因目的片段(genbank中的accessionnumber:abei01000007(116981–117150))
ttccaattgaaacgagtgcggttgctgaatatttaaaagctggttggacttgttctattaggtaatttaatacgcttaatgtgccatatatatcaagtgagccagaaccaaggctggcagcccttccaccgttggcctcataaatcacagcaacaacccaagcggttagt
- 还没有人留言评论。精彩留言会获得点赞!