一种对PRRSV易感的猪子宫内膜上皮细胞系及其构建方法与流程
本发明涉及转基因技术领域,具体涉及一种对prrsv易感的猪子宫内膜上皮细胞系及其构建方法。
背景技术:
猪繁殖与呼吸障碍综合症,又叫猪蓝耳病,在猪的生产过程中造成巨大损失。该病由猪繁殖与呼吸障碍综合症病毒(prrsv)引起。该病只感染猪,其他动物不会感染此病毒,而且各个年龄和品种的猪都可以感染此病毒,其中以怀孕母猪和一月内的仔猪最为易感。临床上以妊娠母猪流产和胎儿的早产为特征性症状。前期研究表明,感染了prrsv病毒的胎儿会因为胎盘细胞的凋亡而造成流产。而子宫内膜与胎儿胎盘对于妊娠的建立和维持起着重要作用。有研究提出,胎儿的细胞膜,母体的子宫内膜上皮细胞的凋亡与妊娠的终止和失败有重要的关系。但受限于猪子宫内膜上皮细胞在每一次发情周期中的不断变化,迄今为止,猪的子宫内膜上皮细胞系仍然没有成功建立。
在前期细胞系的建立方法中,端粒酶和sv40大t抗原的方法是两种最常见的方法。端粒酶的方法是基于端粒的延长从而达到细胞系构建的目的,端粒酶的构建方式更有利于维持构建好的细胞系的生物学特性。但受限于子宫内膜上皮细胞的传代次数,目前利用端粒酶的技术来构建尚不成熟。而sv40大t抗原细胞系的构建方法则是使细胞向肿瘤化转变从而达到细胞系的构建条件,但sv40大t抗原方法构建的细胞系在长期传代的过程中,可能会伴有核型的改变。
由于至今仍没有治疗猪蓝耳病的特效药,所以疫苗成为控制prrsv爆发及传播的有效方法和主要手段。prrsv具有很强的宿主细胞嗜性,目前用于分离和培养prrsv的细胞主要是猪肺泡巨噬细胞(pam)和非洲绿猴肾细胞(marc-145),但pam并不是与子宫和胎盘相关的细胞;marc-145来源于猴,而非猪来源细胞,会导致prrsv体外研究受限于不能反应自然宿主细胞的感染情况。因此,亟需构建新的prrsv易感的猪来源的子宫内膜上皮细胞系,以模拟prrsv感染自然宿主细胞的过程,扩大研究范围。
技术实现要素:
针对上述现有技术,本发明的目的是提供一种对prrsv易感的猪子宫内膜上皮细胞系及其构建方法。本发明构建的猪子宫内膜上皮细胞系具有无限传代的功能,且能维持猪子宫内膜上皮细胞的特性,在传代过程中能够保持核型正常,不存在染色体结构和数目的变化;而且,该猪子宫内膜上皮细胞系对prrsv病毒敏感,可以用于prrsv的传代以及相关的研究。
为实现上述目的,本发明采用如下技术方案:
本发明的第一方面,提供一种对prrsv易感的猪子宫内膜上皮细胞系,是以猪子宫内膜上皮细胞作为宿主细胞,转染带有sv40t抗原基因的慢病毒表达质粒,经puromycin药物筛选、细胞扩大培养后获得。
优选的,所述慢病毒表达质粒包含:sv40大t抗原基因、抗生素筛选基因puro基因和egfp基因。
更优选的,所述慢病毒表达质粒为plvx-egfp-t2a-puro-sv40t。
本发明的第二方面,提供上述猪子宫内膜上皮细胞系的构建方法,包括以下步骤:
(1)获得原代猪子宫内膜上皮细胞,并进行培养;
(2)以plvx-egfp-t2a-puro-sv40t作为慢病毒载体,以pspax2和pcmv-vsv-g作为辅助包装载体,获得慢病毒颗粒;
(3)采用慢病毒颗粒转染培养后的原代猪子宫内膜上皮细胞;
(4)慢病毒颗粒转染猪子宫内膜上皮细胞后,在含血清的dmem/f12培养液中添加终浓度为2μg/ml的puromycin进行细胞筛选,获得阳性细胞;
(5)将筛选的阳性细胞用不含puromycin的培养液扩大培养,即构建得到对prrsv易感的猪子宫内膜上皮细胞系。
优选的,步骤(1)中,获得原代猪子宫内膜上皮细胞及培养的方法为:采集猪子宫内膜,将猪子宫内膜剪碎成小的组织碎片,直接接种至细胞培养皿,不加培养液放入培养箱中10-20min;取出后加入少量培养液,继续培养箱中培养,4h后补液至没过组织块,同时添加青霉素和链霉素,隔天换液一次。
更优选的,所述青霉素的加入量为100u/ml,链霉素的加入量为100μg/ml。
优选的,步骤(2)中,将plvx-egfp-t2a-puro-sv40t、pspax2和pcmv-vsv-g共同转染进入293t细胞,48h后收获上清;72h后收获上清和细胞,并与之前收获的上清混合,反复冻融使细胞破裂,过滤,收集上清液,将上清液与5×peg8000混合,4℃沉降过夜,4000g离心1h,去除上清,将沉淀用dmdm培养液溶解,即获得慢病毒颗粒。
由于上皮细胞,特别是猪子宫内膜上皮细胞的角化严重,因此进行转染非常困难。为了能对猪子宫内膜上皮细胞进行转染,本发明对用于转染的慢病毒颗粒进行了优选,结果发现,以plvx-egfp-t2a-puro-sv40t作为慢病毒载体,以pspax2和pcmv-vsv-g作为辅助包装载体,这样构建的慢病毒颗粒对猪子宫内膜上皮细胞的转染效果最佳。
优选的,步骤(3)中,待原代猪子宫内膜细胞培养至第七天时,进行慢病毒颗粒转染。本发明研究发现,当原代猪子宫内膜细胞培养至第七天时,细胞活力最好,有利于慢病毒颗粒的转染。
优选的,步骤(3)中,在进行慢病毒转染时,同时加入5μg/ml的polybrene;以提高病毒的转染能力。
优选的,步骤(5)中,将筛选的阳性细胞用不含puromycin的培养液扩大培养50代以上。当筛选的阳性细胞在扩大培养50代以后时,细胞系中转入的绿色荧光蛋白标签的启动子已经被甲基化,因此细胞系在荧光显微镜下无荧光,这样有利于采用本发明的细胞系进行后续荧光实验时不受影响。
本发明的第三方面,提供上述猪子宫内膜上皮细胞系在分离和/或培养prrsv中的应用。
本发明的有益效果:
(1)本发明首次构建得到对prrsv易感的猪子宫内膜上皮细胞系。本发明的猪子宫内膜上皮细胞系具有嘌呤霉素筛选标记;能够无限传代;能够维持猪子宫内膜上皮细胞的特性;在传代过程中能够维持核型正常,不存在染色体结构和数目的变化;细胞系中转入的绿色荧光蛋白标签的启动子已经被甲基化,在荧光显微镜下无荧光,有利于细胞系进行后续的荧光实验不受干扰;更为关键的是,该猪子宫内膜上皮细胞系对prrsv病毒敏感,prrsv能够造成其凋亡,同时prrsv也可以在此细胞内复制,可以用于prrsv的传代以及相关的研究,为prrsv的培养提供了一个新的细胞系,扩大了prrsv研究的宿主细胞的范围,对于prrsv对生殖系统的致病机理研究有重要的意义。
(2)本发明通过转染含有目的基因sv40t外源性表达载体,使猪子宫内膜上皮细胞跳过g1期进入s期,从而延长细胞周期。
(3)本发明将含有目的基因sv40t外源性表达载体转染到猪子宫内膜上皮细胞,构建转基因的猪子宫内膜上皮细胞系;荧光显微镜观察标记基因egfp的表达情况,并经puromycin筛选获得阳性细胞,并进行pcr鉴定证实目的基因sv40t整合到猪子宫内膜上皮细胞的基因组。
附图说明
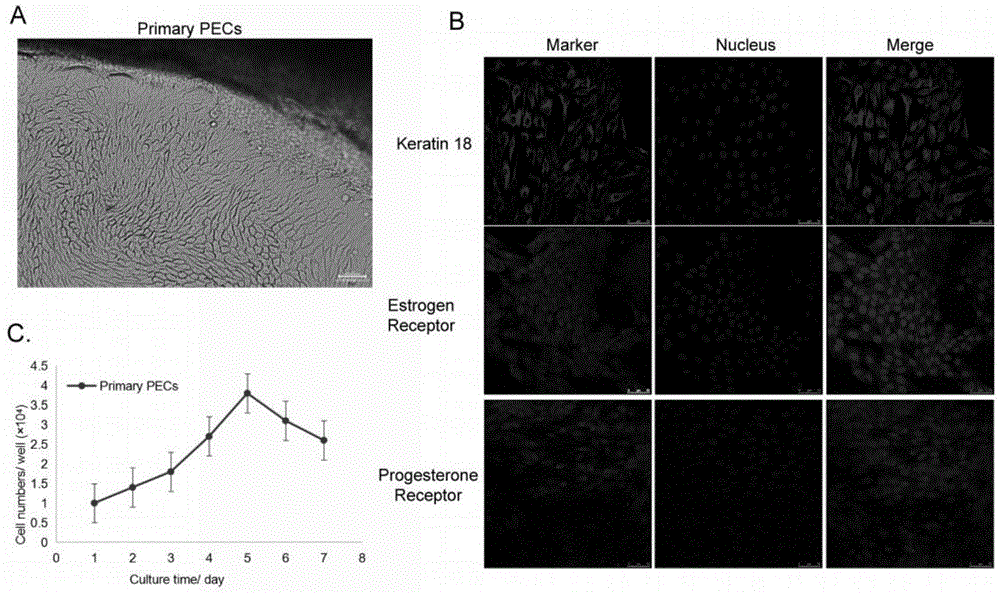
图1-a是组织块法细胞培养七天后的图;
图1-b是原代细胞免疫荧光鉴定图;
图1-c是原代细胞的生长曲线图;
图2是本发明的猪子宫内膜上皮细胞系构建的技术路线图;
图3-a是转染plvx-egfp-t2a-puro-sv40t质粒后获得的单克隆细胞图;
图3-b是获得的细胞系传代第5,10,20,30,40,50代的图;
图4-a是原代细胞和获得的细胞系的生长曲线比较的图;
图4-b是原代细胞和获得的细胞系的细胞周期图;
图4-c是原代细胞和获得的细胞系免疫印记检测erα和pr的结果图;
图4-d是pcr检测sn,cd163,sv40,gapdh的结果图;
图4-e是获得的细胞系核型分析图;
图4-f是获得的细胞系免疫荧光鉴定图;
图5-a~b是原代细胞和获得的细胞系感染prrsv后凋亡率变化图及统计分析柱状图。
图5-c是prrsv感染细胞系后病毒滴度的测定结果。
具体实施方式
应该指出,以下详细说明都是例示性的,旨在对本申请提供进一步的说明。除非另有指明,本文使用的所有技术和科学术语具有与本申请所属技术领域的普通技术人员通常理解的相同含义。
正如背景技术部分所介绍的,由于猪子宫内膜上皮细胞在每一次发情周期中的不断变化,而且猪子宫内膜上皮细胞的传代次数有限,因此难以利用端粒酶技术来构建猪子宫内膜上皮细胞系。而采用sv40大t抗原方法构建细胞系,在长期传代的过程中,可能会伴有核型的改变;再加之猪子宫内膜上皮细胞角化严重,因此进行转染非常困难。上述因素导致猪子宫内膜上皮细胞系的构建十分困难。
另外,prrsv具有很强的宿主细胞嗜性,目前用于分离和培养prrsv的细胞主要是猪肺泡巨噬细胞(pam)和非洲绿猴肾细胞(marc-145),如果能构建对prrsv易感的猪子宫内膜上皮细胞系,则对于prrsv的培养以及prrsv疫苗的研发具有重要的意义。
基于此,本发明的目的是提供一种对prrsv易感的猪子宫内膜上皮细胞系,本发明采用慢病毒包装感染的方式将外源性表达载体plvx-egfp-t2a-puro-sv40t(该外源性表达载体由西南民族大学提供;本领域技术人员也可以按常规的慢病毒载体构建方法构建得到)导入猪子宫内膜上皮细胞中,荧光显微镜观察标记基因egfp的表达情况,并经puromycin筛选获得阳性细胞,经pcr鉴定证实目的基因sv40t的确整合到猪子宫内膜上皮细胞的基因组中;通过免疫荧光技术检测上皮细胞标志性蛋白ck18,以及子宫内膜上皮细胞特异性受体erα和pr的表达,鉴定证实获得的细胞确实是子宫内膜上皮细胞;通过免疫印记技术(westernblotting,wb)证实子宫内膜上皮细胞特异性受体erα和pr确实存在;通过核型分析计数子宫内膜上皮细胞系中的染色体数量;经pcr鉴定prrsv受体sn和cd163在构建的细胞系中的表达;通过流式细胞仪检测其在感染prrsv后凋亡变化;与pams比较复制prrsv的能力。
为了使得本领域技术人员能够更加清楚地了解本申请的技术方案,以下将结合具体的实施例详细说明本申请的技术方案。
本发明实施例中所用的试验材料均为本领域常规的试验材料,均可通过商业渠道购买得到。未注明详细条件的实验方法是按照常规试验方法或按照供应商所建议的操作说明书进行的。
本发明实施例中所使用的部分试剂和材料的来源如下:
dmem/f12(gibco);含edta的trypsin(gibco);胎牛血清(四季青,浙江天杭生物科技股份有限公司);细胞培养板和培养皿(corning);质粒提取试剂盒(上海生工生物工程公司);puromycin;pspax2(addgene,#12260);pcmv-vsv-g(addgene,#8454);plvx-egfp-t2a-puro-sv40t(西南民族大学提供);0.45μm一次性滤器(
实施例1:猪子宫内膜上皮细胞构建细胞系的构建
1.猪子宫内膜上皮细胞的培养:
取新鲜猪子宫组织,冲洗干净后剖开腔面。pbs冲洗去除粘液和脱落的死细胞。将子宫内膜剪下,放入pbs中冲洗三次。将剪下的子宫内膜剪碎成小的组织碎片(1-2mm3大小),直接接种至6cm细胞培养皿,不加培养液放入培养箱中15min。取出后加少量培养液,继续培养箱中培养。四小时,后补液至没过组织块,同时添加青链霉素(青霉素100u/ml,链霉素100μg/ml)。隔天换液一次待猪子宫内膜上皮细胞在组织块周围汇合后,继续培养四天待用。
本发明以puromycin作为筛选药物,由于表达载体plvx-egfp-t2a-puro-sv40t上有puromycin抗性基因puro,外源基因得到表达的猪子宫内膜上皮细胞能够在含有一定浓度puromycin的培养液dmem/f12中存活,而未转染的正常细胞会在该浓度下死亡,因此需要确定正常细胞puromycin的最小致死浓度来作为筛选浓度。
puromycin的最小致死浓度测定:在猪子宫内膜上皮细胞的培养中加入浓度梯度的puromycin筛选一周,测定正常细胞puromycin的最小致死浓度。当培养液中puromycin的浓度达到2μg/ml时,显微镜下可见细胞全部死亡,所以puromycin的最小致死浓度为2μg/ml。
2.获得含有慢病毒载体plvx-egfp-t2a-puro-sv40t的慢病毒颗粒:
将pspax2(6μg),pcmv-vsv-g(6μg),plvx-egfp-t2a-puro-sv40t(7.5μg)共同转染进入293t细胞中。48小时后,荧光显微镜下观察表达egfp产生的荧光,同时收获上清。72小时后收获上清和细胞,与之前的上清混合。反复冻融三次使细胞破裂,然后用0.45μm滤器过滤,收集上清液。将上清液与5×peg8000混合,4℃沉降过夜,4000g离心一小时。去除上清,将沉淀用dmdm培养液溶解,-80℃储存待用。
3.慢病毒颗粒感染猪子宫内膜上皮细胞:
当原代猪子宫内膜上皮细胞生长到第七天时,进行慢病毒感染,同时加入polybrene(5μg/ml)提高病毒感染能力;感染24小时后,更换新鲜培养液;感染72小时后,加入puromycin至终浓度2μg/ml。
4.plvx-egfp-t2a-puro-sv40t载体阳性表达的筛选:
plvx-egfp-t2a-puro-sv40t慢病毒颗粒感染猪子宫内膜上皮细胞后,在含血清的dmem/f12培养液中添加终浓度为2μg/ml的puromycin进行细胞筛选。
慢病毒感染细胞72小时后,表达载体被表达并且在荧光显微镜下可以看到绿色荧光。当感染慢病毒的猪子宫内膜上皮细胞能够发出绿色荧光,说明plvx-egfp-t2a-puro-sv40t已经进入细胞并且阳性表达。此时将puromycin浓度减半持续筛选直到细胞长满皿底,可见阳性细胞呈岛屿状细胞群,在荧光显微镜下仍然呈绿色;然后消化细胞,用含puromycin的dmem/f12培养液扩大培养。
所筛选的阳性细胞都是稳定转染plvx-egfp-t2a-puro-sv40t的细胞,目的基因sv40t整合到细胞的基因组上,而不是游离于基因组之外;在稳定转染过程中,质粒plvx-egfp-t2a-puro-sv40t上携带的基因会整合到宿主的基因组上;通过puromycin筛选14天再半剂量持续筛选来达到稳定转染的目的,表现为报告基因在被转染的阳性细胞中持续表达,因此筛选的阳性细胞持续发出绿色荧光并呈现puromycin抗性。
将筛选的阳性细胞用不含puromycin的培养液至少扩大培养50代,即构建得到猪子宫内膜上皮细胞系。
本发明构建得到的猪子宫内膜上皮细胞系中转入的绿色荧光蛋白标签的启动子已经被甲基化,在荧光显微镜下无荧光,有利于细胞系进行后续的荧光实验不受干扰。
实施例2:猪子宫内膜上皮细胞原代细胞和构建的细胞系特征验证
1.试验方法:
1.1猪子宫内膜上皮细胞来源经免疫荧光技术验证
检测猪子宫内膜上皮细胞原代细胞和构建的细胞系(实施例1构建)中角蛋白18(ck18),雌激素受体ɑ(erɑ),孕酮受体(pr)的表达。猪子宫内膜上皮细胞原代细胞和构建的细胞系经免疫染色固定液室温固定一小时。利用triron-x100对细胞进行透化。pbs清洗三次,每次5分钟。然后覆盖10%胎牛血清进行封闭。吸掉血清,覆盖一抗,浓度为1:100,4℃过夜孵育。将一抗用pbs清洗三次,每次5分钟。覆盖上alexafluor555标记的荧光二抗,浓度为1:100,室温避光孵育一小时。用pbs清洗三次,每次5分钟。用pi染液进行染色,10分钟,然后用pbs洗掉,三次每次5分钟。荧光显微镜下观察细胞发出红色荧光,细胞核发出蓝色荧光。
1.2westernblotting检测erɑ和pr
猪子宫内膜上皮细胞原代细胞和构建的细胞系(实施例1构建)进行总蛋白提取。然后进行蛋白电泳,转膜。转好的膜用5%脱脂奶粉进行封闭100分钟,封闭结束后用tbst洗三次,每次5分钟。然后将膜浸在一抗中,4度孵育过夜。将一抗回收,然后膜用tbst洗三次,每次7分钟。接着孵育hrp二抗室温50分钟。将膜用tbst洗三次,每次7分钟。最后用ecl发光液进行化学发光检测。
1.3rt-pcr检测prrsv受体
提取猪子宫内膜上皮细胞原代细胞和构建的细胞系(实施例1构建)的rna。用反转录试剂盒进行cdna的合成。然后进行pcr检测。
25μl的反应体系为:12.5μlpcrsurpermix;1μl上游引物(10μmol/);1μl下游引物(10μmol/);cdna1μl;加超纯水至25μl。
pcr程序是:94℃预变性5分钟;94℃变性30秒,60℃退火30秒,72℃延伸30秒,34个循环;72℃完全延伸5分钟。其中sv40t退火温度为63℃。引物设计如下:
sv40t-上游引物:agtggctgggctgttctttt;(seqidno.1)
sv40t-下游引物:atgggagcagtggtggaatg;(seqidno.2)
sn-上游引物:ggattcgggcttctacttctg;(seqidno.3)
sn-下游引物:taccaggaaaaacgggtgtc;(seqidno.4)
cd163-上游引物:tgtggaagtgctgtcagtttct;(seqidno.5)
cd163-下游引物:aaatgtgtccagttccctcact;(seqidno.6)
gapdh-上游引物:tggtgaaggtcggagtgaac;(seqidno.7)
gapdh-下游引物:ggaagatggtgatgggatttc;(seqidno.8)
1.4细胞周期和生长曲线统计
收获细胞于离心管中,加入预冷的pbs清洗细胞。1000rpm离心10分钟,弃上清。逐滴加入5ml预冷的75%的乙醇,混匀细胞,4℃避光过夜。800g离心细胞10分钟,弃上清。之后清洗细胞2次以去除所有的乙醇。然后进行细胞染色,将细胞重悬于0.5mlpi/rnase染色液,室温避光孵育15分钟。分析前4℃避光保存样本。1小时之内上流式细胞仪检测。
将猪子宫内膜上皮细胞原代细胞和构建的细胞系(实施例1构建)传代到24孔板中,每孔1000个细胞。每天计数,连续7天。根据结果画出细胞生长曲线图。
1.5构建的猪子宫内膜上皮细胞系核型分析
细胞终止培养前四小时加入秋水仙素(0.1ug/ml)。将细胞消化收集,离心弃上清。加入37℃预热的低渗溶液(0.075mol/lkcl)5ml,吹打均匀,37℃水浴20min。离心弃上清。沿管壁加入1ml固定液(甲醇:冰乙酸=3:1,现配现用),边滴加边震荡均匀,静置5min离心弃上清。加入3ml固定液,静置30min,离心弃上清。再次加入3ml固定液,静置30min,离心弃上清。加入1ml固定液(额外添加pi染色液)重悬。滴管吸取细胞悬液,高空滴在冰冻玻片(95%乙醇浸泡24h,4℃保存)上,立即在酒精灯火焰下过火几次,置烘箱中烤片2h。
1.6prrsv感染构建的猪子宫内膜上皮细胞系引起细胞凋亡
prrsv感染构建的猪子宫内膜上皮细胞系48小时后,利用凋亡检测试剂盒对细胞进行处理。1小时之内上流式细胞仪检测。
1.7构建的猪子宫内膜上皮细胞系复制prrsv的能力
构建的猪子宫内膜上皮细胞系和pams同时感染prrsv。48小时后收集含病毒上清。分别将两种含病毒的上清梯度稀释(102、103、104、105),再次感染正常pams,连续七天观察细胞后计算出各自的病毒滴度ticd50。
2.猪子宫内膜上皮细胞原代细胞和构建的细胞系特征验证结果
2.1免疫荧光结果
组织块法细胞培养七天后,可见上皮细胞环绕这组织块紧密生长,呈铺路石状(图1-a)。其中夹杂的成纤维细胞经三次差速消化即可除去。
猪子宫内膜上皮细胞原代细胞和构建的细胞系经免疫荧光检测后可见ck18,erɑ,pr在细胞中均有表达(图1-b)。
2.2构建的猪子宫内膜上皮细胞系细胞性能检测结果
经免疫印记检测,证明子宫内膜上皮细胞上的功能性蛋白erɑ和pr可以正常表达;能够是细胞永生化的sv40t在pcr结果中有存在;作为prrsv的重要病毒受体,sn和cd163也可经pcr检测到;核型分析结果显示,构建的猪子宫内膜上皮细胞系染色体数量形态正常;流式细胞仪结果显示构建的猪子宫内膜上皮细胞系的g0和s期相较于原代细胞明显延长。
2.3构建的猪子宫内膜上皮细胞系对prrsv易感性
构建的猪子宫内膜上皮细胞系在感染prrsv48小时后,经流式细胞仪检测的凋亡率明显上升;感染病毒后的上清测试病毒滴度结果显示,构建的猪子宫内膜上皮细胞系获得滴度为3.23logticd50的含病毒上清,低于pams的3.45logticd50的含病毒上清。说明构建的猪子宫内膜上皮细胞系可以用于prrsv感染猪子宫内膜上皮细胞引起的凋亡相关研究,并且可以用于病毒的保存和扩增。
以上所述仅为本申请的优选实施例而已,并不用于限制本申请,对于本领域的技术人员来说,本申请可以有各种更改和变化。凡在本申请的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本申请的保护范围之内。
sequencelisting
<110>山东农业大学;宁波德方元生物技术有限公司
<120>一种对prrsv易感的猪子宫内膜上皮细胞系及其构建方法
<130>2018
<160>8
<170>patentinversion3.5
<210>1
<211>20
<212>dna
<213>人工序列
<400>1
agtggctgggctgttctttt20
<210>2
<211>20
<212>dna
<213>人工序列
<400>2
atgggagcagtggtggaatg20
<210>3
<211>21
<212>dna
<213>人工序列
<400>3
ggattcgggcttctacttctg21
<210>4
<211>20
<212>dna
<213>人工序列
<400>4
taccaggaaaaacgggtgtc20
<210>5
<211>22
<212>dna
<213>人工序列
<400>5
tgtggaagtgctgtcagtttct22
<210>6
<211>22
<212>dna
<213>人工序列
<400>6
aaatgtgtccagttccctcact22
<210>7
<211>20
<212>dna
<213>人工序列
<400>7
tggtgaaggtcggagtgaac20
<210>8
<211>21
<212>dna
<213>人工序列
<400>8
ggaagatggtgatgggatttc21
- 还没有人留言评论。精彩留言会获得点赞!