雷公藤红素衍生物及其应用的制作方法
本发明属于医药技术领域,具体涉及具有抑制肿瘤细胞活性的雷公藤红素衍生物及其药学上可接受的盐,该类衍生物的制备方法,以该衍生物为活性成分的药物组合物,及其在制备用于治疗和/或预防各种癌症的药物中的用途。
背景技术:
恶性肿瘤的发生和发展是一个多步骤多阶段的复杂过程,严重威胁人类的健康和生命。虽然目前临床上有多种抗癌药物供使用,但是癌症病因复杂、易产生耐药性,而且由于抗癌药物的毒副作用等原因使得现有药物不能满足妥善治疗或个体化治疗的需要。肿瘤干细胞是指肿瘤组织中的一类分化程度极低、增殖能力极强、可长期自我更新并分化为多种类型的细胞,或具有干细胞样能力的肿瘤细胞亚群,所占比例不足1%,但却与肿瘤的发生、发展、侵袭、复发、转移及耐药等有着密切关系。从理论上讲,彻底杀死肿瘤干细胞可以很好地抑制肿瘤的转移和复发,降低化疗药物的副作用。
天然产物一直是抗癌药物发现的重要来源之一。雷公藤红素(celastrol),又称为南蛇藤素,来源于传统中药卫矛科植物雷公藤(tripterygiumwilfordiihookf),是醌甲基型五环三萜类化合物。雷公藤红素具有抗炎,抗病毒,免疫调节,抗肿瘤等多种药理活性,其中抗肿瘤作用尤为显著。雷公藤红素对肺癌,卵巢癌,肝癌,胃癌,白血病,结肠癌,乳腺癌等多种癌细胞具有抑制作用。雷公藤红素发挥抗癌活性的作用机制主要包括诱导细胞凋亡,抑制细胞增殖,抑制迁移、侵袭,抑制血管生成等。
本发明人设计并合成了一系列雷公藤红素衍生物,经细胞水平活性评价,所合成的化合物具有较好的抗肿瘤细胞增殖活性,同时对肿瘤干细胞的抑制作用增强。
技术实现要素:
本发明的目的是提供一种雷公藤红素衍生物及其在抗肿瘤药物方面的用途,为了实现上述目的,根据本发明的一个方面,提供了一种如式i所示的雷公藤红素衍生物或其药学上可接受的盐:
其中,
x为
进一步地,x为
进一步地,x为
进一步地,x为
进一步地,x为
除另有所指,本文中所述“卤素”指氟原子、氯原子、溴原子、碘原子等取代;所述“c1-4卤代烷基”指被单个或多个卤素原子取代的甲基或乙基;“c1-4烷基”指含有1~4个碳原子的烃部分去除一个氢原子衍生的直链或支链的烷基,如甲基、乙基、正丙基、异丙基、正丁基、异丁基、仲丁基、叔丁基等;“c1-4烷氧基”指术语“c1-4烷基”通过氧原子与其它结构相连的基团,如甲氧基、乙氧基、正丙氧基、异丙氧基、正丁氧基、异丁氧基、仲丁氧基、叔丁氧基等。
进一步地,本发明的通式i所示的化合物或其药学上可接受的盐选自以下任意一种化合物或其药学上可接受的盐:
(e)-1-(4-(3-羟基-9β,13α-二甲基-2-氧代--24,25,26-三去甲齐墩果烷-1(10),3,5,7-四烯-29-酰基)哌嗪-1-基)-3-苯基-2-丙烯-1-酮(i-1);
(e)-1-(4-(3-羟基-9β,13α-二甲基-2-氧代--24,25,26-三去甲齐墩果烷-1(10),3,5,7-四烯-29-酰基)哌嗪-1-基)-3-(4-三氟甲基苯基)-2-丙烯-1-酮(i-2);
(e)-1-(4-(3-羟基-9β,13α-二甲基-2-氧代--24,25,26-三去甲齐墩果烷-1(10),3,5,7-四烯-29-酰基)哌嗪-1-基)-3-(4-氟苯基)-2-丙烯-1-酮(i-3);
(e)-1-(4-(3-羟基-9β,13α-二甲基-2-氧代--24,25,26-三去甲齐墩果烷-1(10),3,5,7-四烯-29-酰基)哌嗪-1-基)-3-(2-三氟甲基苯基)-2-丙烯-1-酮(i-4);
(e)-1-(4-(3-羟基-9β,13α-二甲基-2-氧代--24,25,26-三去甲齐墩果烷-1(10),3,5,7-四烯-29-酰基)哌嗪-1-基)-3-(3-三氟甲基苯基)-2-丙烯-1-酮(i-5);
(e)-1-(4-(3-羟基-9β,13α-二甲基-2-氧代--24,25,26-三去甲齐墩果烷-1(10),3,5,7-四烯-29-酰基)哌嗪-1-基)-3-(3,4,5-三甲氧基苯基)-2-丙烯-1-酮(i-6);
(e)-1-(4-(3-羟基-9β,13α-二甲基-2-氧代--24,25,26-三去甲齐墩果烷-1(10),3,5,7-四烯-29-酰基)哌嗪-1-基)-3-(4-溴苯基)-2-丙烯-1-酮(i-7);
(e)-1-(4-(3-羟基-9β,13α-二甲基-2-氧代--24,25,26-三去甲齐墩果烷-1(10),3,5,7-四烯-29-酰基)哌嗪-1-基)-3-(4-氯苯基)-2-丙烯-1-酮(i-8);
(e)-1-(4-(3-羟基-9β,13α-二甲基-2-氧代--24,25,26-三去甲齐墩果烷-1(10),3,5,7-四烯-29-酰基)哌嗪-1-基)-3-(4-甲氧基苯基)-2-丙烯-1-酮(i-9);
(e)-1-(4-(3-羟基-9β,13α-二甲基-2-氧代--24,25,26-三去甲齐墩果烷-1(10),3,5,7-四烯-29-酰基)哌嗪-1-基)-3-(4-甲基苯基)-2-丙烯-1-酮(i-10);
(e)-1-(4-(3-羟基-9β,13α-二甲基-2-氧代--24,25,26-三去甲齐墩果烷-1(10),3,5,7-四烯-29-酰基)哌嗪-1-基)-3-苯丙基-1-酮(i-11);
(e)-1-(4-(3-羟基-9β,13α-二甲基-2-氧代--24,25,26-三去甲齐墩果烷-1(10),3,5,7-四烯-29-酰基)哌嗪-1-基)-2-甲基-3-苯基-2-丙烯-1-酮(i-12);
(e)-1-(4-(3-羟基-9β,13α-二甲基-2-氧代--24,25,26-三去甲齐墩果烷-1(10),3,5,7-四烯-29-酰基)乙二胺-1-基)-3-苯基-2-丙烯-1-酮(i-13);
(e)-1-(4-(3-羟基-9β,13α-二甲基-2-氧代--24,25,26-三去甲齐墩果烷-1(10),3,5,7-四烯-29-酰基)乙二胺-1-基)-3-(4-三氟甲基苯基)-2-丙烯-1-酮(i-14);
(e)-1-(4-(3-羟基-9β,13α-二甲基-2-氧代--24,25,26-三去甲齐墩果烷-1(10),3,5,7-四烯-29-酰基)乙二胺-1-基)-3-(4-氟苯基)-2-丙烯-1-酮(i-15);
(e)-1-(4-(3-羟基-9β,13α-二甲基-2-氧代--24,25,26-三去甲齐墩果烷-1(10),3,5,7-四烯-29-酰基)乙二胺-1-基)-3-(2-三氟甲基苯基)-2-丙烯-1-酮(i-16);
(e)-1-(4-(3-羟基-9β,13α-二甲基-2-氧代--24,25,26-三去甲齐墩果烷-1(10),3,5,7-四烯-29-酰基)乙二胺-1-基)-3-(3-三氟甲基苯基)-2-丙烯-1-酮(i-17);
(e)-1-(4-(3-羟基-9β,13α-二甲基-2-氧代--24,25,26-三去甲齐墩果烷-1(10),3,5,7-四烯-29-酰基)乙二胺-1-基)-3-(3,4,5-三甲氧基苯基)-2-丙烯-1-酮(i-18);
(e)-1-(4-(3-羟基-9β,13α-二甲基-2-氧代--24,25,26-三去甲齐墩果烷-1(10),3,5,7-四烯-29-酰基)乙二胺-1-基)-3-(4-溴苯基)-2-丙烯-1-酮(i-19);
(e)-1-(4-(3-羟基-9β,13α-二甲基-2-氧代--24,25,26-三去甲齐墩果烷-1(10),3,5,7-四烯-29-酰基)乙二胺-1-基)-3-(4-氯苯基)-2-丙烯-1-酮(i-20);
(e)-1-(4-(3-羟基-9β,13α-二甲基-2-氧代--24,25,26-三去甲齐墩果烷-1(10),3,5,7-四烯-29-酰基)乙二胺-1-基)-3-(4-甲氧基苯基)-2-丙烯-1-酮(i-21)
(e)-1-(4-(3-羟基-9β,13α-二甲基-2-氧代--24,25,26-三去甲齐墩果烷-1(10),3,5,7-四烯-29-酰基)乙二胺-1-基)-3-(4-甲基苯基)-2-丙烯-1-酮(i-22)
(e)-1-(4-(3-羟基-9β,13α-二甲基-2-氧代--24,25,26-三去甲齐墩果烷-1(10),3,5,7-四烯-29-酰基)乙二胺-1-基)-3-苯丙基-1-酮(i-23)
(e)-1-(4-(3-羟基-9β,13α-二甲基-2-氧代--24,25,26-三去甲齐墩果烷-1(10),3,5,7-四烯-29-酰基)乙二胺-1-基)-2-甲基-3-苯基-2-丙烯-1-酮(i-24)
根据本发明的另一方面,还提供了一种药物组合物,该组合物含有通式(i)的雷公藤红素衍生物或其药学上可接受的盐和药学上可接受的辅料。
进一步地,药学上可接受的辅料是指药学领域的稀释剂、辅助剂和/或载体。
进一步地,本发明药物组合物的载体是药物领域中可得到的常见类型,包括:口服制剂的粘合剂、润滑剂、崩解剂、助溶剂、稀释剂、稳定剂、悬浮剂、色素、矫味剂等;可注射制剂用的防腐剂、加溶剂、稳定剂等;局部制剂用的基质、稀释剂、润滑剂、防腐剂等。
根据本发明的另一方面,还提供通式i所示化合物或其药学上可接受的盐在制备用于抑制肿瘤细胞生长的药物中的应用。
根据本发明的另一方面,还提供通式i所示化合物或其药学上可接受的盐在制备用于抑制肿瘤干细胞药物中的应用。
根据本发明的另一方面,还提供通式i所示化合物或其药学上可接受的盐在制备抗肿瘤药物中的应用。
进一步地,通式i所示化合物或其药学上可接受的盐在制备治疗卵巢癌、乳腺癌、前列腺癌、肺癌、直肠癌、胃癌、膀胱癌、子宫癌或胰腺癌的药物的应用。
本发明活性化合物可作为唯一的抗癌药物使用,或者与一种或多种其他抗肿瘤药物联合使用。联合治疗通过将各个治疗组分同时、顺序或隔开给药来实现。
下文中提供的实施例和制备例进一步阐明和举例说明本发明化合物及其制备方法。应当理解,下述实施例和制备例的范围并不以任何方式限制本发明的范围。
下面的合成路线描述了本发明的通式i衍生物的制备,所有的原料都是通过这些路线中描述的方法、通过有机化学领域普通技术人员熟知的方法制备的或者可商购。本发明的全部最终衍生物都是通过这些路线中描述的方法或通过与其类似的方法制备的,这些方法是有机化学领域普通技术人员熟知的。这些路线中应用的全部可变因素如下文的定义或如权利要求中的定义。
按照本发明的通式i衍生物,在上述路线中,各取代基如发明内容部分所定义。该路线产品纯度高,原料易得,收率稳定。
本发明合成了一系列雷公藤红素衍生物,体外细胞水平活性评价试验表明,本发明公开的化合物具有较好的抗肿瘤细胞增殖活性,同时对肿瘤干细胞也有较强的抑制作用,因此,在抗肿瘤方面,有较好的应用前景。
附图说明
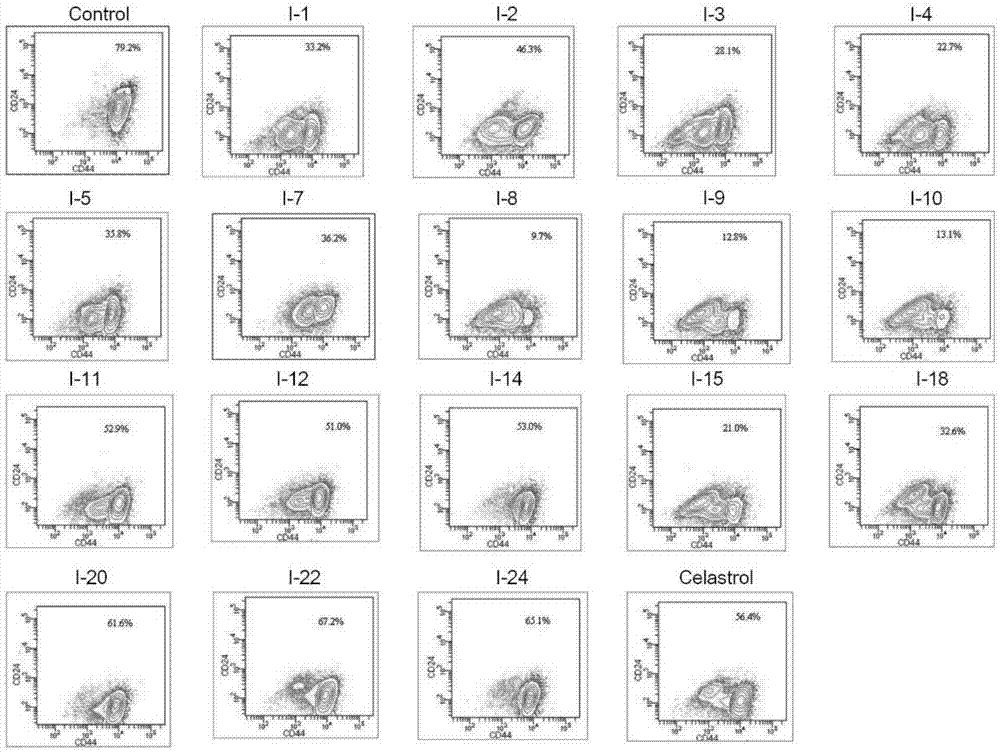
图1为合成的雷公藤红素衍生物对skov-3细胞cd44+cd24-的影响
具体实施方式
以下结合实施例进一步说明本发明,所举之例不应视为对本发明保护范围的限制。实施例中未注明具体条件的实验方法,通常按照常规条件以及手册中所述的条件,或按照制造厂商所建议的条件;所用的设备、材料、试剂等,如无特殊说明,均可从商业途径得到。
实施例1
x为
步骤a:
称取5mmol取代的反式肉桂酸衍生物1,慢慢加入10mlsocl2,室温搅拌1h,若反应物不溶解可加热至40℃搅拌0.5h,蒸干溶剂,得到取代的肉桂酸酰氯;然后加入少量无水二氯甲烷溶解,所得的溶液转移到恒压滴液漏斗中,称取10mmol哌嗪溶于20ml冰醋酸中,将恒压滴液漏斗中的溶液缓慢滴加到哌嗪中,室温搅拌2h。反应液用40%naoh调节ph至7-9,用二氯甲烷萃取3次,合并有机相,有机相用饱和nacl洗涤3次,无水硫酸钠干燥,,减压浓缩,得黄色油状物,经过硅胶柱层析分离(二氯甲烷:甲醇=20:1)得到淡黄色油状固体,收率60~83%。
步骤b:
称取0.1g(0.221mmol)雷公藤红素,加入5mldmf溶解,加入0.101g(0.265mmol)hatu、155ul(0.884mmol)dipea,室温搅拌30min,然后加入0.243mmol的化合物3,100℃搅拌反应5h,冷却至室温,将反应液倒入水中,边倒边搅拌,析出大量红棕色固体,抽滤,干燥。制备薄层色谱分离得到目标化合物i-1~i-12,收率45%~74%。
部分化合物分析数据:
化合物i-1:(e)-1-(4-(3-羟基-9β,13α-二甲基-2-氧代--24,25,26-三去甲齐墩果烷-1(10),3,5,7-四烯-29-酰基)哌嗪-1-基)-3-苯基-2-丙烯-1-酮
δh(400mhz,cdcl3)7.70(1h,d,j15.4),7.56–7.46(2h,m),7.42–7.30(3h,m),7.00(1h,d,j6.3),6.94(1h,s),6.84(1h,d,j15.4),6.51(1h,s),6.34(1h,d,j7.2),3.89-3.54(8h,m),2.33(2h,d,j15.3),2.20(3h,s),2.16(1h,d,j13.7),2.10-2.04(1h,m),1.45(3h,s),1.31(3h,s),1.30(3h,s),1.15(3h,s),0.59(3h,s).
δc(101mhz,cdcl3)178.28,176.32,169.73,165.68,164.43,146.09,143.60,135.01,133.98,129.78,128.78,127.82,127.42,119.55,118.34,117.14,116.47,44.76,44.69,42.88,40.25,39.60,38.25,36.27,35.99,34.10,33.39,31.91,31.03,30.76,30.62,29.99,29.67,28.92,22.47,18.79,10.22.
化合物i-6:(e)-1-(4-(3-羟基-9β,13α-二甲基-2-氧代--24,25,26-三去甲齐墩果烷-1(10),3,5,7-四烯-29-酰基)哌嗪-1-基)-3-(3,4,5-(三甲氧基)苯基)-2-丙烯-1-酮
δh(400mhz,cdcl3)7.61(1h,d,j15.3),7.01(1h,d,j7.0),6.94(1h,s),6.71(3h,d,j14.3),6.51(1h,s),6.35(1h,d,j7.1),3.88(6h,s),3.87(3h,s),3.84–2.59(8h,m),2.33(2h,d,j15.1),2.20(3h,s),1.45(3h,s),1.31(3h,s),1.29(3h,s),1.15(3h,s),0.58(3h,s).
δc(101mhz,cdcl3)178.27,176.30,169.71,165.61,164.43,153.37,145.99,143.69,139.82,134.01,130.55,127.39,119.51,118.34,117.16,115.69,105.09,60.93,56.19,44.77,44.71,42.87,40.25,39.57,38.26,36.26,35.91,34.13,33.39,31.88,31.01,30.79,30.60,29.99,29.66,29.28,28.86,27.18,22.37,18.77,10.22.
化合物i-9:(e)-1-(4-(3-羟基-9β,13α-二甲基-2-氧代--24,25,26-三去甲齐墩果烷-1(10),3,5,7-四烯-29-酰基)哌嗪-1-基)-3-(4-甲基苯基)-2-丙烯-1-酮
δh(400mhz,cdcl3)7.67(1h,d,j15.4),7.47(2h,d,j8.7),7.00(1h,d,j6.8),6.94(1h,s),6.88(2h,d,j8.7),6.71(1h,d,j15.3),6.51(1h,s),6.34(1h,d,j7.2),3.74(3h,s),4.20-3.50(8h,m),2.33(2h,d,j15.0),2.20(3h,s),1.45(3h,s),1.31(3h,s),1.30(3h,s),1.15(3h,s),0.59(3h,s).
δc(101mhz,cdcl3)178.27,176.31,169.67,165.97,164.38,160.99,146.00,143.32,133.92,129.42,127.76,127.42,119.54,118.33,117.10,114.22,113.90,55.32,44.76,44.69,42.88,40.23,39.60,38.22,36.28,36.01,34.08,33.38,31.90,31.02,30.75,30.62,29.99,28.93,22.48,18.77,10.20
化合物i-12:(e)-1-(4-(3-羟基-9β,13α-二甲基-2-氧代--24,25,26-三去甲齐墩果烷-1(10),3,5,7-四烯-29-酰基)哌嗪-1-基)-2-甲基-3-苯基-2-丙烯-1-酮
δh(400mhz,cdcl3)7.41–7.27(5h,m),7.02(1h,d,j7.0),6.96(1h,s),6.57(1h,s),6.54(1h,s),6.36(1h,d,j7.2),4.02–2.86(8h,m),2.21(3h,s),2.12(3h,s),1.46(3h,s),1.31(3h,s),1.31(3h,s),1.16(2h,s),0.60(3h,s).
δc(101mhz,cdcl3)178.29,176.28,172.60,169.74,164.44,146.00,135.55,134.05,132.17,130.50,129.04,128.35,127.64,127.40,119.49,118.36,117.15,44.74,44.63,42.90,40.24,39.61,38.21,36.25,36.04,34.06,33.40,31.91,31.02,30.73,30.67,29.96,28.93,22.54,18.78,16.29,10.23.
实施例2
x为
步骤a:
称取5mmol取代的反式肉桂酸衍生物1,慢慢加入10mlsocl2,室温搅拌1h,若反应物不溶解可加热至40℃搅拌0.5h,蒸干溶剂,得到取代的肉桂酸酰氯,然后加入10ml无水二氯甲烷溶解,滴加3ml甲醇,室温搅拌反应10min,减压浓缩得化合物4;将所得化合物4中加入20ml乙二胺,回流反应2h,放冷至室温,将反应液倒入水中,用乙酸乙酯萃取3次,合并有机相,有机相用饱和nacl洗涤3次,无水硫酸钠干燥,,减压浓缩,得黄色油状物,收率52~73%。
步骤b:
称取0.1g(0.221mmol)雷公藤红素(cel),加入5mldmf溶解,加入0.101g(0.265mmol)hatu、155ul(0.884mmol)dipea,室温搅拌30min,然后加入0.243mmol的化合物3,室温搅拌反应5h,将反应液倒入水中,边倒边搅拌,析出大量红棕色固体,抽滤,干燥。制备薄层色谱分离得到目标化合物i-13~i-24,收率38%~90%。
部分化合物分析数据:
化合物i-13:(e)-1-(4-(3-羟基-9β,13α-二甲基-2-氧代--24,25,26-三去甲齐墩果烷-1(10),3,5,7-四烯-29-酰基)乙二胺-1-基)-3-苯基-2-丙烯-1-酮
δh(400mhz,dmso)8.73(1h,s),8.39(1h,s),7.78(5h,s),7.69(1h,s),7.49(1h,d,j15.8),7.00(1h,d,j5.4),6.70(1h,d,j15.9),6.34(1h,s),6.22(1h,d,j7.4),3.27–3.03(4h,m),3.03–2.93(1h,m),2.39(1h,d,j16.1),2.06(3h,s),1.32(3h,s),1.17(3h,s),1.05(3h,s),1.03(3h,s),0.49(3h,s).
δc(101mhz,dmso)177.94,177.43,168.21,165.72,163.01,146.40,138.92,134.89,133.11,129.52,128.94,127.57,126.80,121.94,120.05,117.82,117.21,44.51,43.97,42.03,39.54,38.88,37.97,37.72,36.14,34.84,33.47,33.04,31.45,30.55,30.25,29.38,28.88,28.18,21.50,17.81,10.11.
化合物i-20:(e)-1-(4-(3-羟基-9β,13α-二甲基-2-氧代--24,25,26-三去甲齐墩果烷-1(10),3,5,7-四烯-29-酰基)乙二胺-1-基)-3-(4-氯苯基)-2-丙烯-1-酮
δh(400mhz,dmso)8.67(1h,s),8.18(1h,s),7.58(3h,d,j8.1),7.48(2h,d,j8.3),7.40(1h,d,j15.8),7.01(1h,d,j6.6),6.55(1h,d,j15.6),6.35(1h,s),6.22(1h,d,j6.7),3.33–2.90(8h,m),2.38(1h,d,j15.2),2.08(3h,s),1.33(3h,s),1.17(3h,s),1.05(3h,s),1.03(3h,s),0.50(3h,s).
δc(101mhz,dmso)177.97,177.45,168.25,165.47,163.02,146.43,137.57,133.96,133.88,133.16,129.29,129.00,126.82,122.77,120.07,117.85,117.25,44.53,43.98,42.06,38.88,38.04,37.75,36.16,34.88,33.48,33.04,31.47,30.56,30.26,29.41,28.90,28.20,21.52,17.83,10.13.
化合物i-23:(e)-1-(4-(3-羟基-9β,13α-二甲基-2-氧代--24,25,26-三去甲齐墩果烷-1(10),3,5,7-四烯-29-酰基)乙二胺-1-基)-3-苯丙基-1-酮
δh(400mhz,dmso)8.69(1h,s),7.83(1h,s),7.62(1h,s),7.25-7.11(5h,m),7.06(1h,d,j6.8),6.40(1h,s),6.34(1h,d,j7.1),3.02-2.75(4h,m),2.77(2h,t,j7.7),2.39(1h,d,j14.5),2.31(2h,t,j7.7),2.18(1h,d,j8.3),2.09(3h,s),1.38(3h,s),1.21(3h,s),1.07(3h,s),1.03(3h,s),0.52(3h,s).
δc(101mhz,dmso)177.96,177.36,171.76,168.27,163.02,146.41,141.27,133.17,128.23,128.17,126.81,125.85,120.08,117.92,117.23,44.55,43.99,42.07,39.53,38.89,38.01,37.77,37.06,36.19,34.86,33.37,33.07,31.48,31.07,30.59,30.28,29.39,28.90,28.24,21.51,17.83,10.10.
实施例3
本发明的雷公藤红素衍生物对肿瘤细胞的生长抑制作用
应用mtt法检测卵巢癌细胞skov-3和ovcar3的生长抑制作用。将2×103个细胞接种于96孔板中,并让其贴壁、生长48h后,加入各浓度受试药。培养后,每孔加入50μlmtt溶液(2mg/ml),继续孵育4h后,甩板去除培养液,加入dmso,于570nm下测其吸光度。通过加药组与空白对照组的吸光度比值(%)求得受试药所致的细胞生长抑制率,计算ig50,结果见表1。
表1.化合物对肿瘤细胞的生长抑制活性
实施例4
本发明的雷公藤红素衍生物对肿瘤干细胞的抑制作用
流式细胞仪检测cd44+cd24-细胞的改变:在细胞培养体系中分别加入不同浓度的目标化合物处理2天后消化收集各组细胞,1200rpm离心5min,弃上清,加入pbs洗一次;每管100μlpbs,1×106个细胞,每组分别加入5μl的fitc标记的抗cd44抗体和5μlpe标记的抗cd24的抗体,另外对照组设置空白管(只加细胞),cd44+管、cd24+管及对应的同型对照管,室温避光孵育20min;加入5mlpbs,1200rpm离心5min,弃上清,重复用pbs洗1次;用400μlpbs重悬细胞,流式细胞仪检测。结果见图1。
从以上的描述中,可以看出,本发明上述的实施例实现了如下技术效果:
cd24-和cd44+为卵巢癌干细胞的特征性表面标记物,可用流式细胞仪检测。空白对照组cd44+cd24-细胞比例为79.2%,用雷公藤红素处理后cd44+cd24-细胞比例为56.4%,用本文中合成的雷公藤红素衍生物处理后cd44+cd24-细胞比例为9.7%~67.2%,且大部分化合物优于雷公藤红素,表明本文中合成的雷公藤红素衍生物对肿瘤干细胞的抑制作用增强。
以上所述仅为本发明的优选实施例而已,并不用于限制本发明,对于本领域的技术人员来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!