基于mitoTALENs的iPSCs线粒体DNA突变位点的修复方法与流程
本发明涉及基因敲除方法,尤其涉及基于mitotalens的ipscs线粒体dna突变位点的修复方法。
背景技术:
线粒体脑肌病伴高乳酸血症和脑卒中样发作(mitochondrialmyopathy,encephalopathy,lacticacidosisandstroke-likeepisodes,melas)综合征是最常见的母系遗传线粒体疾病之一。分子遗传学研究已经将melas表型与不同的线粒体trna或蛋白质编码基因中的10多个突变相关联,尽管发现大多数具有melas(>80%)的患者在线粒体trnaleu中具有a3243g突变uur基因。据估计,这种突变的发生率在6000人中有1人(260人)。这种mt3243a>g突变导致线粒体翻译和蛋白质合成受损,包括导致线粒体能量产生受损的线粒体电子传递链复合物亚基(可参见:whitehead,m.t.,etal.,corticalvenousdiseaseseverityinmelassyndromecorrelateswithbrainlesiondevelopment.neuroradiology,2017.59(8):p.813-818;cai,s.s.,r.voncoelln,andt.j.kouo,migratorystroke-likelesionsinacaseofadult-onsetmitochondrialencephalomyopathy,lacticacidosis,andstroke-likeepisodes(melas)syndromeandareviewofimagingfindings.radiolcaserep,2016.11(4):p.425-429.)。众所周知,线粒体功能障碍不能产生足够的能量以满足各种器官的需要,因此导致多系统功能障碍疾病,具有广泛的表现,包括中风样发作,痴呆,癫痫,乳酸血症,肌病,复发性头痛,听力障碍,糖尿病,并在melas综合征中观察到身材矮小,melas综合征严重影响患者正常的生活质量(可参见:el-hattab,a.w.,m.almannai,andf.scaglia,arginineandcitrullineforthetreatmentofmelassyndrome.jinbornerrorsmetabscreen,2017.5;ganetzky,r.d.andm.j.falk,8-yearretrospectiveanalysisofintravenousargininetherapyforacutemetabolicstrokesinpediatricmitochondrialdisease.molgenetmetab,2018.123(3):p.301-308.)。
基因打靶技术是一种按照dna同源重组原理,以胚胎干细胞为主要操作对象,结合分子克隆与细胞培养、转染、筛选技术在细胞水平引入、改造、修饰特定遗传信息的实验手段。它是建立在胚胎干细胞培养技术(embryonicstemcells,escs)和同源重组技术基础上发展起来的一门新技术,该技术具有定位性强、打靶后的新基因可随染色体稳定遗传等特点。
细胞基因组dna都会不时出现双链或单链断裂等损伤,这主要是由细胞外界生存环境条件的改变、细胞内部的氧化及物理损伤及细胞的dna复制和减数分裂引起的(可参见:lander,e.s.,initialimpactofthesequencingofthehumangenome.nature,2011.470(7333):p.187-197.)。这种现象在我们人类细胞中发生的频率从数次到数千次不等,若细胞中的dna损伤在细胞进入下一个细胞分裂前不能得到正确修复,就会导致细胞遗传信息的改变,细胞分裂停止或是机体清除,因此我们生物机体在进化过程中发展出了dna损伤修复系统(可参见:luo,b.,etal.,highlyparallelidentificationofessentialgenesincancercells.proceedingsofthenationalacademyofsciencesoftheunitedstatesofamerica,2008.105(51):p.20380-20385;lieber,m.r.,nhejanditsbackuppathwaysinchromosomaltranslocations.naturestructural&molecularbiology,2010.17(4):p.393-395.)。研究发现在真核细胞中,染色体dna出现的单链断裂和双链断裂可依两条途径进行自我修复:同源重组(hr)和非同源末端连接(nhej)(可参见:lander,e.s.,initialimpactofthesequencingofthehumangenome.nature,2011.470(7333):p.187-197;lieber,m.r.,themechanismofhumannonhomologousdnaendjoining.journalofbiologicalchemistry,2008.283(1):p.1-5.)。
基因打靶技术主要是借助于真核细胞自身的这种dna损伤修复机制,根据相关基因在基因组的结构和功能信息,借助分子克隆技术设计相应同源打靶片段,将目的基因特异敲除或用其它基因替代失活,从而人为地修饰基因组,实现对靶基因的定点敲除或将目的基因片段定点整合到基因组的一项转基因技术。该技术除了可部分或完全中止某一基因的表达外,还包括引入新基因及引入定点突变。既可以使用突变基因或其它基因代替正常基因,也可以用正常基因代替突变基因。
由于基因修饰技术近几年取得了很大的突破,目前可以把基因打靶技术分为传统的基因打靶技术和新型基因打靶技术;也可根据研究目的和打靶模式,将基因打靶技术分为:靶向基因敲除、条件性基因打靶、基因定位整合、基因靶向修饰、以及可以特异降低靶基因mrna的小rna干扰技术(可参见:valente,a.,etal.,genome-wideassociationstudyheterogeneouscohorthomogenizationviasubjectweightknock-down.plosone,2012.7(10);houzet,l.andk.t.jeang,genome-widescreeningusingrnainterferencetostudyhostfactorsinviralreplicationandpathogenesis.experimentalbiologyandmedicine,2011.236(8):p.962-967.)。
在过去的十年间,人工核酸酶(engineeredendonuclease,een)介导的基因组编辑技术的日渐成熟,将这一现状彻底改变,使得研究人员可以操作各种细胞类型和生物的任何基因,使得这项技术被naturemethods杂志评选为2011年度最受关注的技术成果(hubbard,n.,etal.,targetedgeneeditingrestoresregulatedcd40lfunctioninx-linkedhyper-igmsyndrome.blood,2016.127(21):p.2513-2522.)。从技术的发展来看,这类酶主要包括3种:锌指核酸酶(zincfingernucleases,zfn)、转录激活因子样效应物核酸酶(transcriptionactivator-likeeffectornucleases,talen),以及crispr-cas9技术。这种技术突破了传统基因打靶技术的限制,理论上能在任何物种基因组的能在内源性序列上引入特异性修改,切除基因片段,定点整合目的基因以及进行碱基替换,使之成为在多种细胞类型和生物体内进行高效、位点特异性的基因修饰的一个常用工具,在生物基因组改造、基因功能分析,动植物抗病育种等重大的基因组学问题的解决中将具有广阔的应用前景(可参见:gaj,t.,c.a.gersbach,andc.f.barbas,zfn,talen,andcrispr/cas-basedmethodsforgenomeengineering.trendsinbiotechnology,2013.31(7):p.397-405.)。
与细胞核dna相比,线粒体dna是通过母体遗传给后代的,并且双链断裂修复机制是不存在的,所以突变率较高(可参见:moretton,a.,etal.,selectivemitochondrialdnadegradationfollowingdouble-strandbreaks.plosone,2017.12(4):p.e0176795;adcock,g.j.,etal.,mitochondrialdnasequencesinancientaustralians:implicationsformodernhumanorigins.procnatlacadsciusa,2001.98(2):p.537-42.)。线粒体病通常是由突变的线粒体dna(mtdna)引起的,在大部分情况下它与野生型mtdna共同存在,导致mtdna出现异质性。常见的线粒体病包括线粒体肌病、线粒体脑病和线粒体脑肌病,如leber遗传性视神经病(lhon)。研究人员在实验室中使用细胞来设计线粒体靶向的talens(mitotalens),来结合并切割线粒体dna,正是这段基因中的一个突变引起了lhon。他们随后检测了mitotalens是否清除了mtdna。分析结果表明,细胞中总的mtdna暂时下降,这是由于突变mtdna的下降(可参见:bacman,s.r.,etal.,specificeliminationofmutantmitochondrialgenomesinpatient-derivedcellsbymitotalens.natmed,2013.19(9):p.1111-3.)。
talens作为一种全新的基因组编辑工具,近年来引起了人们的极大兴趣。与zfn相比,它更便宜,更高效,脱靶率低。利用这种技术,研究人员已经开发出多种疾病的动物模型,有助于疾病的分子机制研究。在研发talens技术过程中,科研人员发现来自植物病原菌xanthomonas中的tal蛋白核酸结合域的氨基酸序列与其靶位点的核酸序列有较恒定的对应关系。利用此恒定对应关系,构建与核酸内切酶的融合蛋白,在特异位点打断目标基因组dna序列,从而可在该位点进行dna编辑修饰操作,比如knock-out、knock-in、碱基替换、点突变或者基因修饰等。该技术能识别任意目标基因序列,不受上下游序列影响等问题,因此使得基因操作更加简单方便。
talen技术是目前商业化最成功的技术,虽然将单个的talen模块进行组装需要大量的分子克隆和测序操作,十分繁琐,但是很多商业公司可以提供组装好的三联密码子talen模块,甚至四联密码子talen模块,这样就大大缩短了构建talen元件的实验周期(可参见:bacman,s.r.,etal.,specificeliminationofmutantmitochondrialgenomesinpatient-derivedcellsbymitotalens.natmed,2013.19(9):p.1111-3.)。mitotalens是专门设计切割线粒体突变dna的技术,选择性强,修复效率高,脱靶率低,可以成功利用到melas患者特异来源的诱导多能干细胞(可参见:yang,y.,etal.,targetedeliminationofmutantmitochondrialdnainmelas-ipscsbymitotalens.proteincell,2018.9(3):p.283-297.)。
mitotalens具有针对线粒体dna突变位点的准确定位的能力,通过瞬时的表达mitotalens,可以显著的降低突变的线粒体dna,并且可以恢复诱导多能干细胞以及神经干细胞的代谢功能,同时显微注射mitotalensmrna可以显著的降低重组猪卵细胞内人类突变线粒体dna(可参见yang,y.,etal.,targetedeliminationofmutantmitochondrialdnainmelas-ipscsbymitotalens.proteincell,2018.9(3):p.283-297.)。
zfn技术则是最早被广泛使用的基因组定点修饰技术,各大平台均比较完善,有很多可以直接使用的资源。然而由于其自身的三联属性,其设计比talen更为繁琐,而且高度依赖于目标序列及其上下游序列,还具有脱靶率高。一种dna靶向技术,若应用于实际的科研或医疗中,需要有高度的特异性,即要避免错误的酶切(off-target)。然而事实上,dna剪切的准确性由于zfn剪切的机制而并不像人们预期的那样强:dna的剪切需要两个foki切割区域的二聚化,和至少一个单元结合dna。因为二聚化的过程是独立于dna剪切的,异二聚体的形成,和两种单元所形成的同源二聚体,同样可以造成dna的剪切,并且他们有着不同的识别序列。可以想象,具有较低特异性的同源二聚体形式的zfn会切割基因组中的假回文序列。而且,在某些特定条件下,单一zfn单元结合于dna(识别序列只有9~12bp)也会造成dna的剪切。如此,两个不同的zfn单元总共可能产生七种不同识别序列的内切酶,这些非特异性行为均可能带来zfn毒性(可参见:laoharawee,k.,etal.,dose-dependentpreventionofmetabolicandneurologicdiseaseinmurinempsiibyzfn-mediatedinvivogenomeediting.molther,2018.26(4):p.1127-1136.)。
crispr/cas技术摆脱了合成并组装具有特异性dna识别能力蛋白模块的繁琐操作,其grna的设计和合成工作量远远小于talen和zfn技术的dna识别模块的构建过程,且毒性远远低于zfn技术。此系统的工作原理是crrna(crispr-derivedrna)通过碱基配对与tracrrna(trans-activatingrna)结合形成tracrrna/crrna复合物,此复合物引导核酸酶cas9蛋白在与crrna配对的序列靶位点剪切双链dna。而通过人工设计这两种rna,可以改造形成具有引导作用的sgrna(single-guiderna),足以引导cas9对dna的定点切割。作为一种rna导向的dsdna结合蛋白,cas9效应物核酸酶是已知的第一个统一因子(unifyingfactor),能够共定位rna、dna和蛋白,从而拥有巨大的改造潜力。将蛋白与无核酸酶的cas9(cas9nuclease-null)融合,并表达适当的sgrna,可靶定任何dsdna序列,而sgrna的末端可连接到目标dna,不影响cas9的结合。因此,cas9能在任何dsdna序列处带来任何融合蛋白及rna,这为生物体的研究和改造带来巨大潜力(可参见:liu,x.andy.zhao,crispr/cas9genomeediting:fuelingtherevolutionincancerimmunotherapy.currrestranslmed,2018.)。
crispr(clusteredregularlyinterspersedshortpalindromicrepeats)是细菌用来抵御病毒侵袭/躲避哺乳动物免疫反应的基因系统。科学家们利用rna引导cas9核酸酶可在多种细胞(包括ips)的特定的基因组位点上进行切割,修饰。rudolfjaenisch研究组将cas9与te1和tet2特异的sgrna共注射到小鼠的受精卵中,成功得到双基因敲除的纯合子小鼠,效率高达80%。他们将cas9/sgrna与带突变序列的引物共注射,能准确在小鼠两个基因引入所要的点突变。在es细胞中他们更是成功的一次敲除了五个基因。与zfn/talen相比,crispr/cas更易于操作,效率更高,更容易得到纯合子突变体,而且可以在不同的位点同时引入多个突变。但该系统面临脱靶危机。最新研究表明,修复导致小鼠失明基因后,小鼠体内有超过1500个单核苷酸发生了突变(可参见:mucha,o.,etal.,pharmacologicalversusgeneticinhibitionofhemeoxygenase-1-thecomparisonofmetalloporphyrins,shrnaandcrispr/cas9system.actabiochimpol,2018.)。
由于线粒体dna缺乏dna双链损伤修复机制,易导致其受损,通过设计线粒体特异的核酸酶mitotalens(限制性内切核酸酶和定制的核酸酶),已经在人类肿瘤来源的细胞株和老鼠模型中成功修复线粒体dna突变位点。与限制性内切酶,zfn,talens相比mitotalens更灵活,根据碱基配对一一对应的方式对单链dna特点位点,以及两种氨基酸序列在一个转录激活因子样效应子的重复。
crispr/cas技术广泛的被利用在细胞核dna的靶向修复,截至目前只有一项研究显示其利用在线粒体dna的基因编辑上(可参见:jo,a.,etal.,efficientmitochondrialgenomeeditingbycrispr/cas9.biomedresint,2015.2015:p.305716.)。同时与其他的内切核酸酶不同,crispr/cas技术是利用碱基互补配对的原理通过grna引导cas9对dna特定位点进行识别,因此grna的设计需要提高对线粒体的定位和单碱基配对方式的基因识别能力。根据我们的前期研究和以往的研究报道阐明线粒体特异的核酸酶mitotalens可以非常特异的单碱基配对定位线粒体突变dna位点。
发明人发现,上述技术的缺点是由于以下原因造成的:
1、需要大量的分子克隆和测序操作,十分繁琐,虽然很多商业公司提供组装好的模块,缩短了构建实验周期,绝大多数实验室都难以自行完成talen技术的完整操作,对其推广造成了障碍;
2、zfn技术的三联属性,其设计比talen更为繁琐,而且高度依赖于目标序列及其上下游序列,脱靶率高及细胞毒性大等限制性因素;
3、然而crispr/cas技术有上下文依赖性,目前只能应用于上游有pam序列的靶位;
技术实现要素:
基于此,本发明采用了一种使用线粒体特异的核酸酶mitotalens对基因修饰系统进行补救。
一方面,本发明提供了一种修复melas患者来源的ipscs线粒体突变位点的talens识别序列对,所述talens识别序列对由左臂识别序列和右臂识别序列组成;所述左臂识别序列如seqidno:1所示;所述右臂识别序列如seqidno:2所示。
另一方面,本发明还提供了一种修复melas患者来源的ipscs线粒体突变位点的talens表达质粒对,所述talens表达质粒对含有以上所述的talens识别序列对。
再一方面,本发明还提供了一种修复melas患者来源的ipscs线粒体突变位点的talens表达质粒对,所述talens表达质粒对包括talenl链和talenr链,所述talenl链由seqidno:3所示序列的碱基编码;所述talenl链由seqidno:5所示序列的碱基编码。
又一方面,本发明还提供了一种melas患者来源的ipscs线粒体突变位点修复试剂盒,其包括以上所述的talens表达质粒对。
又一方面,本发明还提供了一种用于治疗melas综合症的药物,其包括以上所述的talen表达质粒对。
又一方面,本发明还提供了以上所述的talens识别序列、以上所述talens表达质粒对在修复melas患者来源的ipscs线粒体突变位点中的用途。
又一方面,本发明还提供了一种melas患者来源的ipscs线粒体突变位点的修复方法,其包括以下步骤:
利用线粒体特异靶标信号通路分析,设计线粒体特异的talens,用荧光报告定位确定线粒体特异的mts外源蛋白,筛选出信号肽,确定线粒体特异的talens;
针对ipscs线粒体a3243g突变位点,设计talens识别序列对,talens识别序列对如seqidno:1和seqidno:2所示;
根据线粒体特异的talens和所述的talens识别序列对,构建靶向a3243g突变位点的talens的表达质粒;
将构建好的talens的表达质粒电转至表达a3243g突变位点的melas患者来源的ipscs中。
进一步地,所述线粒体特异的talens选自atp5b-mts、cox8a-mts或sod2-mts,其中,atp5b-mts的核苷酸序列如seqidno.:7所示,cox8a-mts的核苷酸序列如seqidno:9所示,sod2-mts的核苷酸序列如seqidno:11所示。
进一步地,所述线粒体特异的talens为cox8a-mts。
与现有方案相比,本发明具有以下有益效果:
本发明是根据目前所使用的基因修饰方法的不足而提出的,经过反复模式和调试所总结的新的技术方法,不但提高了基因修饰的效率,而且大大说短了实验时间,为线粒体dna突变基因的修饰工作带来的巨大的方便。
mitotalens特异定位线粒体突变dna位点,mitotalens是专门设计切割线粒体突变dna的技术,选择性强,修复效率高,脱靶率低,可以成功利用到melas患者特异来源的诱导多能干细胞mipscs,其异质性m.3243a>g比率高达90%,经过mitotalens技术其mtdna突变位点的修复,利于rflp和sanger测序检测其修复率达到了100%。对线粒体基因组进行illumina测序检测异质率分别为92%和89%的mipsc5和对照组经mitotalens技术修复后的实验组的异质率mipsc5-t1降低为27%,mipsc5-t3与mipsc5-t7的异质率降到正常水平。聚合酶链反应对mtdna的拷贝数检测野生型的hipsc和mipsc与修复的mipsc比较其克隆数量是没有差异的。修复后的mipsc通过免疫荧光检测多能性和畸胎瘤形成实验的方面都是没有特性差异的,其细胞核型分析结果保持二倍体并且在数量和结构上没有检测到异常。患者纤维细胞来源的npcs经过mitotalens技术修复后其线粒体代谢功能得到了恢复。携带人类m.3243a>g突变的重组猪卵细胞直接注射mitotalensmrna后其异质性降低了。
根据本发明,以病人纤维细胞来源的mipsc为研究对象,利用:neontransfectionsystem(lifetechnologies),talensmonomer,pegfp-n1,可以特异的对线粒体突变dna进行定点基因修饰得到成功。
附图说明
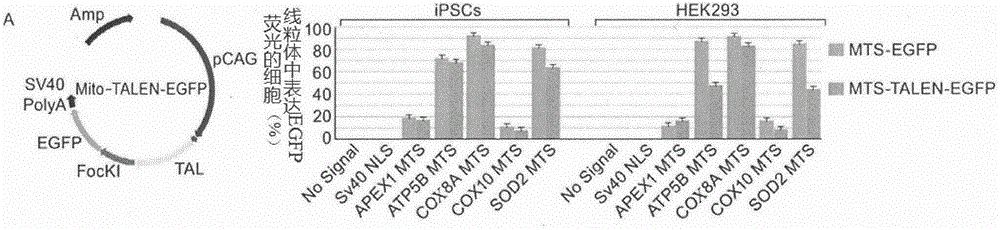
图1显示了5个mts中atp5b,cox8a和sod2特异性定位到hek293和hips细胞的线粒体;
图2a显示了对3243g线粒体dna突变进行定点修复的配对mitotalens;图2b、2c通过荧光显微镜拍照和流式分析egfp阳性细胞的比率,显示了talen-lwt/talen-r3243g质粒对反义链线粒体dna243位点的特异靶向性在突变和野生序列的切割能力表现出明显的差异,而talen-l3243/talen-rwt质粒对突变和野生型序列的切割效果没有差异性;
图3为ssareportermt3243质粒图谱;
图4a、4b显示了与对照组对比mitotalens显著的降低了3243a>g的突变比例;图4c显示了利用illumianmiseq平台对mipsc5及其修复后的细胞克隆进行3242a>g所具有的突变比例;图4d显示了在传代扩增的细胞克隆的容易发生脱靶位点没有发现任何脱靶效应;图4e显示了mitotalens对于细胞核基因的脱靶效应的评估结果;
图5a、5b显示了3243a>g异质性高的mipscs的ocrs水平与健康人hipscs的ocrs相比由显著的降低;
图6a、6b显示了注射人类含有线粒体dna3243a>g点突变的mipscs到mii期的猪卵细胞内制造人工合成猪卵细胞,随后注射含有人线粒体dna3243a>g的转录mitotalensmrna和egfpmrna的过程;图6c显示了与对照组相比注射mitotalensmrna组3243a>g的异质性明显降低。
具体实施方式
为了便于理解本发明,下面将参照相关附图对本发明进行更全面的描述。附图中给出了本发明的较佳实施例。但是,本发明可以以许多不同的形式来实现,并不限于本文所描述的实施例。相反地,提供这些实施例的目的是使对本发明的公开内容的理解更加透彻全面。
除非另有定义,本文所使用的所有的技术和科学术语与属于本发明的技术领域的技术人员通常理解的含义相同。本文中在本发明的说明书中所使用的术语只是为了描述具体的实施例的目的,不是旨在于限制本发明。本文所使用的术语“和/或”包括一个或多个相关的所列项目的任意的和所有的组合。
实施例1
一种melas患者来源的ipscs线粒体突变位点的修复方法,其包括以下步骤:
(1)获取melas综合症病人的mipscs
获取melas综合症病人的皮肤(含有大于90%3243a>g突变效率mtdna)成纤维细胞重编程(非转基因),无血清,无饲养层的条件下的mipscs,其m3243a>g异质率大于80%。
用dna提取试剂盒提取细胞总dna,所使用的pcr引物序列:f:cctcggagcagaacccaacct,r:cgaagggttgtagtagcccgt,野生型细胞pcr产物为634bp,当线粒体dnaa3243g存在突变时,pcr产物可以被内切酶apai切割成两段:424和210bp,软件imagej进行后续分析;
(2)talen氨基酸序列确定:
线粒体dna仅仅编码1%线粒体蛋白质组,其余的99%由细胞核基因组编码,在胞浆内进行线粒体蛋白质合成时需要细胞核基因组来源的线粒体特异信号(mitochondrialtargetingsignals,mts)蛋白并且运输到线粒体内。与内源性mts相互作用的转运蛋白和内切酶,可以用于治疗由于线粒体相关疾病。为设计线粒体dna特异的mitotalens,首先通过荧光共定位分析不同内源性mts与外源性蛋白对线粒体的定位效果,选定细胞核基因apex1,atp5b,cox8a,cox10,sod2,在n末端融合线粒体特异的mito-egfp和talen-egfp,用点转染的方法瞬时转入hipsc和hek293细胞,以sv40标记的细胞核信号定位的egfp和talen-egfp作为实验对照,转染24小时后检测gfp表达情况。用mitotracker染色线粒体,hoechst33342染色细胞核,荧光共定位分析绿色荧光与mitotracker的共定位情况,结果如图1所示,结果显示5个mts中atp5b,cox8a和sod2特异性定位到hek293和hips细胞的线粒体,故可选择atp5b-mts、cox8a-mts、sod2-mts为线粒体特异talens,其中cox8a-mts的特异性最高,所选择cox8a-mts作为最优选的线粒体特异talens。
atp5b-mts、cox8a-mts、sod2-mts作为线粒体特异talens时,它们的核苷酸序列和氨基酸序列如下所示:
atp5b-mts:
核苷酸序列:
氨基酸序列:
cox8a-mts:
核苷酸序列:
氨基酸序列:
sod2-mts:
核苷酸序列:
氨基酸序列:
设计配对mitotalens:设计mitotalens时每条需要靶向有14.5-16.5重复序列的线粒体dna,其一应该结合突变序列位置,两外一条有14-17碱基与正常序列配对,与其偶联的foki核酸内切酶具有切割特异dna序列的活性,使用ssa(single-strandannealing)载体进行分析,当线粒体dna突变位点被修复后则荧光报告基因会表达。mitotalens进行修复时使用talen-lwt/talen-r3243g质粒对,对males综合症mips细胞线粒体mtdna3243位点进行识别。talen-lwt/talen-r3243g的序列如下所示:
选择talen-lwt/talen-r3243g质粒对,是根据以下试验做出的判断:
设计配对mitotalens对3243g线粒体dna突变进行定点修复。其中一条与突变位点(靠近目标序列3’末端)序列结合,另外一条野生型序列结合,由foki核酸内切酶的二聚化作用对突变位点进行切割(如图2a所示)。通过ssa(single-strandannealing)分析mitotalens对线粒体3243g以及野生型3243a的切割效率,设计mitotalens对野生型序列的切割作用为对照。ssa分析共转染mitotalens到hek93细胞,并且通过荧光显微镜拍照和流式分析egfp阳性细胞的比率(如图2b所示),结果显示talen-lwt/talen-r3243g质粒对反义链线粒体dna243位点的特异靶向性在突变和野生序列的切割能力表现出明显的差异,而talen-l3243/talen-rwt质粒对突变和野生型序列的切割效果没有差异性,所以在随后的突变位点的修复实验使用talen-lwt/talen-r3243g质粒对(如图2c所示)。
将靶点识别单元模块的基因片段分别按照seqidno:1和seqidno:2所示的序列进行串联,串联成功后,前端加入cox8a-mts序列,并组装上ptal骨架序列后,克隆入ssareportermt3243质粒(如图3所示),共构建1对talen表达质粒对;
所述靶点识别单元模块包括ni、ng、hd和nn;单元模块ni识别碱基a,其氨基酸序列为:
ltpeqvvaiasniggkqaletvqrllpvlcqahg(seqidno:14);单元模块ng识别碱基t,其氨基酸序列为:
ltpeqvvaiasngggkqaletvqrllpvlcqahg(seqidno:15);单元模块hd识别碱基c,其氨基酸序列为:
ltpeqvvaiashdggkqaletvqrllpvlcqahg(seqidno:16);单元模块nn识别碱基g,其氨基酸序列为:
靶点识别单元模块的基因片段按照seqidno:1所示的序列进行串联,前端加入cox8a-mts序列,并组装上ptal骨架序列后,得到的melas-talen2f对应的氨基酸序列如seqidno:4所示,其核苷酸序列如seqidno:3所示;按照seqidno:2序列进行串联,前端加入cox8a-mts序列,并组装上ptal骨架序列后,得到的melas-talen2r对应的氨基酸序列如seqidno.6所示,其核苷酸序列如seqidno:5所示,具体如下:
melas-talen2f:核苷酸序列
melas-talen2f:氨基酸序列
melas-talen2r:核苷酸序列
melas-talen2r:氨基酸序列
ssareportermt3243质粒的核苷酸序列为:
(3)mitotalens(talen-lwt+talen-r3243g)修复线粒体d3243a>gmtdna
根据mitotalensz对靶向ssa分析载体的特异性和高效的切割能力,检测mitotlens:talen-lwt+talen-r3243g对拥有90%m.3243a>g突变率的mipsc5细胞株的修复效果。
利用电转的方法把mitotalens质粒对与egfp质粒共同转染入mipsc5,转染后48小时,通过流式细胞仪进行筛选egfp阳性细胞,并且传代扩增备异质性的检测,以egfp表达质粒和非靶向修复的mitotalens共同转染细胞作为对照组。筛选后的egfp阳性细胞经过一周的培养扩增后利用rflp进行3243a>g异质性的水平,与对照组对比mitotalens显著的降低了3243a>g的突变比例(如图4a和4b所示),并且通过rflp(restrictionfragmentlengthpolymorphism)和sanger方法检测mipsc5-t3和mipsc5-t7两株修复后的细胞中没有检测到3243a>g的突变。为了更深入的检测修复效果,利用illumianmiseq平台对mipsc5及其修复后的细胞克隆进行3242a>g所具有的突变比例进行确定(如图4c所示),mipsc5和对照组的3243a>g比率分别具有高达92%、89%,而mipsc5-t1的3243a>g突变比率是27%,mipsc5-t3、mipsc5-t7没有检测到3243a>g的突变。
利用t7e1核酸内切酶分析和sanger测序分析检测mitotalens的脱靶效应,在传代扩增的细胞克隆的容易发生脱靶位点没有发现任何脱靶效应(如图4d所示)。为了更深入的评估mitotalens对于细胞核基因的脱靶效应,设计了双重荧光报告慢病毒载体:pef1α-mcherry-egfp,在mcherry与egfp基因之间具有mt3243mitotalen靶序列(如图4e所示),慢病毒转染细胞株后约27小时利用facs对荧光阳性细胞进行筛选,进而对mitotalens在细胞核基因的脱靶效应(如图4e所示)。
(4)mitotalens修复线粒体d3243a>gmtdnaipscs代谢水平的修复情况检测
线粒体dna243a>g的突变扰乱了亮氨酸1(uua/g)trna的功能,影响了线粒体的蛋白合成、耗氧以及能量的产生。通过xf24细胞外流量分析方法(seahorsebiosciences)分析细胞的氧消耗率ocrs(oxygenconsumptionrates),其数据可以反应线粒体的呼吸作用以及能量的产生能力。寡霉素、fccp、鱼藤酮和抗霉素a的混合物分别用于检测atp的产生量,最大呼吸作用和非线粒体呼吸作用(如图5a所示),3243a>g异质性高的mipscs的ocrs水平与健康人hipscs的ocrs相比由显著的降低(如图5a和5b所示),通过mitotalens修复后的mipsc5-t3和mipsc5-t7的线粒体呼吸作用得到了恢复。
(5)利用合成猪胚胎检测mitotalens特异性减少人类m.3423a>gmtdna突变
为了评价mitotalens特异清除病人来源的mipscs线粒体dna突变以及预防突变线粒体dna生殖遗传的能力,进行了mitotalens可以降低哺乳动物卵细胞内线粒体dna突变水平的验证。通过注射人类含有线粒体dna3243a>g点突变的mipscs到mii期的猪卵细胞内制造人工合成猪卵细胞(如图6a所示),随后注射含有人线粒体dna3243a>g的转录mitotalensmrna和egfpmrna,以仅仅注射egfpmrna的卵细胞为对照组,注射48小时后监测egfp的表达(如图6b所示),并且通过rflp分析细胞内的3242a>g的异质性。结果显示与对照组相比注射mitotalensmrna组3243a>g的异质性明显降低(如图6c所示)。
以上所述实施例的各技术特征可以进行任意的组合,为使描述简洁,未对上述实施例中的各个技术特征所有可能的组合都进行描述,然而,只要这些技术特征的组合不存在矛盾,都应当认为是本说明书记载的范围。
以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。
- 还没有人留言评论。精彩留言会获得点赞!