一种预防鹅星状病毒感染的VLP疫苗及其制备方法和应用与流程
本发明涉及一种预防鹅星状病毒感染的vlp疫苗及其制备方法和应用,属于兽用生物制品领域。
背景技术:
鹅星状病毒主要引起鹅群发生严重的严重内脏痛风及关节痛风,且在全国各地鹅厂均有发生。据文献报道及养殖户口述,此病最早发生于2011年,河北省引进法国奥尔维亚公司投资新建朗德鹅场,当年12月来自奥尔维亚公司的朗德鹅苗就出现痛风症状,以后逐年在国内扩散,到2016~2017年,在国内所有鹅种、所有养鹅地方都出现病例。该病主要在雏鹅上发病,感染日龄为2~25日龄,主要为15日龄以内雏鹅易感。本病常年发生,每年11月到次年5月为高峰季节,可能与通风、保温有关,其它时间发病减少。病死率受感染日龄、继发感染等因素影响,鹅群感染率在80%以上,发病率最高可达50%,该病已经成为危害养鹅业健康发展一种重要传染病。
目前,疫苗接种是预防、控制甚至消灭鹅星状病毒的主要措之一,亚单位疫苗,尤其是类病毒样颗粒疫苗(viruslikeparticles,vlps),这类疫苗不含有核酸物质,安全性较好,接种后不会产生持续感染或潜伏感染,产生的免疫应答可以与野毒感染相区分,有利于疫病的控制和消灭。
因此研制一种生产成本低、生产效率高以及疫苗免疫效果好的鹅星状病毒亚单位疫苗的生产方法具有重要的现实意义。
技术实现要素:
本发明的第一个目的是提供一种用于预防鹅星状病毒感染的抗原,所述抗原含有seqidno.1所示的氨基酸序列。
在本发明的一种实施方式中,所述抗原的氨基酸序列如seqidno.1所示。
本发明的第二个目的是提供编码所述抗原的dna。
本发明的第三个目的是提供含有所述抗原的组合物。
在本发明的一种实施方式中,所述抗原经过bei灭活。
本发明的第四个目的是提供鹅星状病毒病毒vlp疫苗,含有所述抗原和疫苗佐剂。
在本发明的一种实施方式中,所述抗原的含量为25~100μg/ml。
在本发明的一种实施方式中,所述佐剂为油性佐剂。
本发明的第五个目的是提供应用所述抗原免疫反应获得的抗体。
本发明的第六个目的是提供所述抗体在制备防治鹅星状病毒感染的药物方面的应用。
本发明还要求保护含有与所述抗原特异性结合的抗体的药物组合物。
有益效果:本发明将表达的鹅星状病毒capsid蛋白的重组杆状病毒rbac-goasv-capsid,接入昆虫细胞高效的表达capsid蛋白,经过离心去除细胞碎片,加入bei灭活后,加入油佐剂混合乳化制成疫苗。本发明制备的疫苗具有高效、安全性好的优点,可有效刺激种鹅产生主动免疫、雏鹅产生被动免疫,且产生的抗体水平可帮助雏鹅抵御致死剂量病毒的攻击。应用本发明制备的疫苗免疫的雏鹅,4~5周后卵黄goasv琼扩抗体效价平均值均≥3.0log2;免疫健康易感产蛋种鹅28d后各组鹅的鹅星状病毒琼扩抗体效价平均值均≥3.6log2,被动免疫组雏鹅血清goasv琼扩抗体效价平均值均≥2.7log2,攻毒后14日保护率可达100%。
附图说明
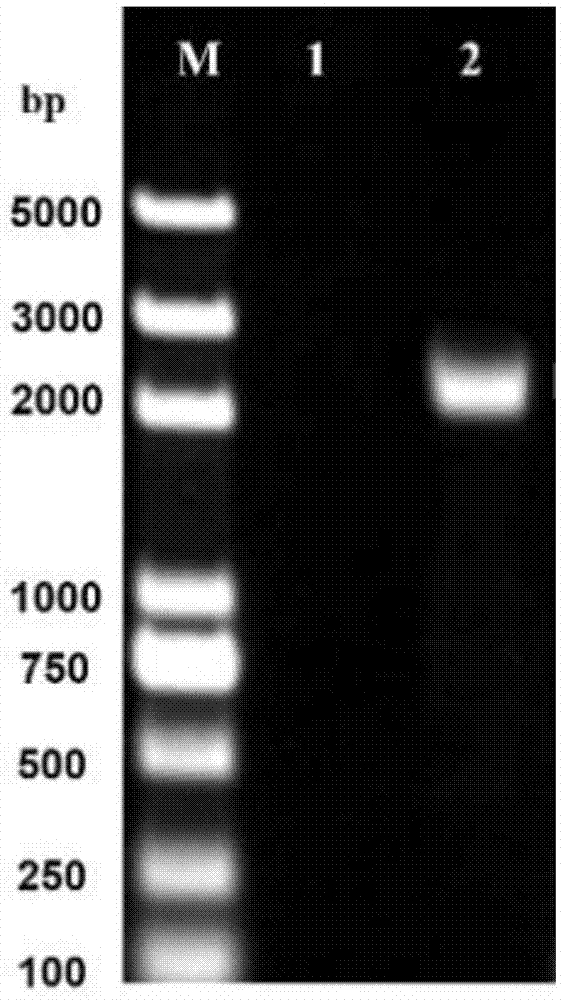
图1是capsid完整开放阅读框的pcr扩增结果图;其中,m:dl5000dnamarker;1:对照;2:pcr产物;
图2是转移载体构建pcr鉴定结果图;其中,m:dl5000dnamarker;1~7:7个不同菌落pcr;
图3是重组杆粒pcr鉴定结果图;其中,m:dl5000dnamarker;1~7:7个不同菌落pcr;
图4是sds-page检测重组杆状病毒表达产物;其中,m:预染蛋白质marker;1:sf9细胞培养物;2:野生杆状病毒感染sf9细胞;3:f3代重组杆状病毒;
图5是westernblot鉴定重组杆状病毒表达产物;其中,m:预染蛋白质marker;1:感染空杆状病毒的sf9细胞;2:f3代重组杆状病毒;
图6是重组病毒样颗粒电镜照片。
具体实施方式
实施例1:重组杆状病毒的构建
1、鹅星状病毒rna提取:用trizolreagent试剂盒提取鹅星状病毒lh株总rna;
2、鹅星状病毒cdna合成:按照hiscriptiionesteprt-pcrkit试剂盒(南京诺唯赞生物科技有限公司,产品编号:p611-01)操作说明进行cdna合成。
3、引物设计与合成:根据genbank已公布的鹅星状病毒capsid基因序列(登录号:nc_034567)设计一对特异性引物,并在引物两端分别添加ecori和xhoi酶切位点,可扩增出2124bp的目的片段。引物序列分别为:
p1:ccggaattcatggccgacaaggtcactgtctcag
p2:ccgctcgagttaatcaaactcttgtccgcccttc
4、capsid基因片段扩增与回收
(1)pcr扩增:以提取的dna为模板,步骤2中的引物做pcr。pcr反应体系为(总体积25μl):dna模板0.5μl、p1和p2个0.5μl、dna聚合酶12.5μl及无菌水11μl。pcr反应条件为:95℃,5min;95℃30s,65℃30s,72℃120s,30个循环;72℃10min。1%琼脂糖凝胶电泳显示,成功扩增出约2124bp的特异性条带,与预期大小相符(图1)。
(2)目的片段胶回收:将pcr产物经1%琼脂糖凝胶电泳,在紫外灯下切胶回收目的片段。具体操作参照胶回收试剂盒说明书进行。
4、目的基因与中转质粒连接:将pfastbaci和capsid基因扩增片段用ecori和xhoi酶切后分别回收、纯化,用t4dna连接酶4℃连接过夜。
5、连接产物转化感受态细胞:将连接产物在无菌条件下转化t1感受态细胞中,混匀,冰浴30min,42℃热激90s,立即冰浴2min,无菌条件下加入800ullb培养基于37℃震荡培养60min。将培养物14000rpm离心1min,吸取800ul上清,将剩余培养物涂布于lb(含氨苄青霉素抗性)固体培养基中,37℃过夜培养。挑取单菌落作菌落pcr鉴定,阳性质粒送检测序(图2)。测序正确的重组质粒命名为pfastbaci-goasv-capsid。
6、重组杆状病毒构建:将鉴定正确的中转质粒pfastbaci-goasv-capsid转入大肠杆菌dh10bac感受态细胞中,挑选阳性克隆用m13引物作pcr鉴定。
m13-f:tgtaaaacgacggccagt
m13-r:caggaaacagctatgac
pcr反应体系为(总体积25μl):dna模板0.5μl、m13-f和m13-r个0.5μl、dna聚合酶12.5μl及无菌水11μl。pcr反应条件为:93℃,5min;94℃30s,55℃45s,72℃5min,30个循环;72℃10min。1%琼脂糖凝胶电泳显示,成功扩增出约4500bp的特异性条带,与预期大小相符(图3)。阳性重组杆粒命名为rbacmid-goasv-capsid。
7、重组杆粒转染sf9细胞:将提纯的重组杆粒用脂质体转染的方法将重组杆粒转染sf9细胞,具体操作方法参照赛默飞世尔科技(中国)有限公司的cellfectin转染试剂说明书进行,获得f1代重组杆状病毒rbac-goasv-capsid。
实施例2:重组capsid蛋白的制备
1、重组杆状病毒扩增:将重组杆状病毒rbac-goasv-capsid接种昆虫细胞sf9,27℃培养4天,收集培养物,离心取上清即获得f2代重组杆状病毒;
2、表达蛋白鉴定:
(1)将上述f2代重组杆状病毒以moi=5~10的接种量接入昆虫细胞sf9,27℃培养4天,收集培养物,离心取上清即获得重组capsid蛋白;
(2)sds-page鉴定:将上述上清液进行sds-page电泳;电泳结束后,经染色和脱色后发现,大约在80kda位置,其分子量与理论大小相符,说明表达成功(图4),经测序,该蛋白的氨基酸序列如seqidno.1所示。
(2)westernblot鉴定:取sds-page电泳后凝胶,直接用bio-lab转印装置将其转印到nc膜上,转印结束后,按常规方法进行westernblot鉴定。用鹅星状病毒阳性血清参考品(1:200)作为一抗;用辣根过氧化物酶标记的兔抗鹅igg(1:2000)作为酶标二抗;最后用tmb显色(碧云天生物技术研究所)。结果表明,在80kda处出现1条明显的特异性条带,而阴性对照无此特异性反应,说明该重组蛋白可被鹅星状病毒阳性血清中的抗体识别,具有良好的特异性和反应原性(图5)。
10、重组capsid蛋白的大量表达:将鉴定正确的重组病毒以moi=1~10的接毒量接种hf细胞大量培养,离心收集培养液上清,即获得含有大量的重组capsid蛋白,将表达的重组capsid蛋白进行电镜检测(图6)。
实施例3:疫苗制备
1、灭活:将实施例2中大量制备的重组capsid蛋白加入到灭活罐中,加入终浓度为0.2%~0.5%灭活剂bei,于37℃灭活24h。
2、半成品检验
(1)无菌检验:按现行《中国兽药典》附录进行无菌检验。
(2)蛋白含量测定:按bca法检测蛋白含量。
(3)灭活检验:将灭活后的蛋白液取昆虫细胞sf9,置于27℃继续培养72小时。观察无病变出现,判定灭活检验合格。
3、vlp疫苗制备:
经过检验合格后的半成品蛋白抗原进行疫苗制备(以下配制中各液体成分按体积比计)。
(1)油相制备:取兽用白油95份,硬脂酸铝1份,置于油相制备罐中加热至80℃后,再加5份司本-80,至温度达到115℃时,维持,冷却后备用。
(2)水相制备将重组蛋白使用生理盐水稀释成50μg/ml。取灭菌后的5份吐温-80,加入配液罐中,同时加入制苗用蛋白液95份,搅拌20~30min,使吐温-80完全溶解。
(3)乳化取油相2份放于高速剪切机内,开动电机慢速转动搅拌,同时徐徐加入水相1份,以10000rpm乳化5分钟。乳化后,取10ml,以3000rpm离心15min,管底析出的水相应不超过0.5ml。
,实施例4:疫苗成品检验
1、性状
外观:疫苗应为乳白色白乳剂,无杂质并且外包装应合格;
剂型:油包水型。取一清洁吸管,吸取少量疫苗滴入冷水中,除第一滴外,均应不扩散。
稳定性:吸取疫苗10ml加入离心管中,以3000rpm离心15min,管底析出水相应不超过0.5ml。
黏度:按现行《中国兽药典》附录进行,应符合规定。
2、装量检查:按现行《中国兽药典》附录进行,应符合规定。
3、无菌检验:按现行《中国兽药典》附录进行,应符合规定。
4、安全检验:
按实施例3的方法制备鹅星状病毒vlp疫苗,批号分别为rcapsid-001p、rcapsid-002p、rcapsid-003p共3批。鹅星状病毒琼扩抗体阴性的3~5日龄雏鹅、1月龄鹅、7月龄开产种鹅、9月龄产蛋种鹅。每批疫苗分别选取3~5日龄雏鹅10只、1月龄鹅10只、7月龄开产种鹅10只、9月龄产蛋种鹅10只,雏鹅每只胸部肌肉注射0.2ml,其余鹅每只胸部肌肉注射疫苗1.0ml,每组均另取10只相同来源、相同日龄的鹅,作为非免疫对照组。注射后连续观察21日,每日观察各组鹅精神状况、饮水、进食量等情况;免疫后7日、14日、21日触摸检查各免疫组鹅注射部位是否有红肿等局部注射反应;免疫前与免疫21日后称重;产蛋种鹅统计产蛋情况,分别任取每批次疫苗免疫后21日种鹅所产鹅胚20枚,做好标记,比较鹅胚孵化率是否有差异;剖杀所有鹅,检查注射部位疫苗吸收情况、是否有病理变化;每组随机筛选10只雏鹅称重后饲养至1月龄,统计成活率及相对日增重,比较免疫组与对照组雏鹅成活率及平均相对日增重的差异。
5、效力检验:
(1)分组与免疫
选取8月龄健康开产种鹅80只(鹅星状病毒琼扩抗体阴性),随机分成4组,每组20只。任选三组分别免疫rcapsid-001p、rcapsid-002p、rcapsid-003p批次疫苗,胸部肌肉注射1ml/只,剩余一组为非免疫对照组,各实验组鹅分别做好标记。
(2)种鹅血清、卵黄抗体检测
各实验组鹅免疫后每周逐只采血至免疫后28日,分离血清,检测goasv琼扩抗体;每组分别任取免疫后4~5周内种鹅所产鹅蛋10枚(连同对照组),检测卵黄中goasv琼扩抗体。
分别将三批疫苗以1ml/只剂量免疫,免疫健康易感产蛋种鹅,28d后各组鹅的鹅星状病毒琼扩抗体效价平均值均≥3.6log2,非免疫对照组的抗体均为阴性,具体结果见表1。
表1种鹅免疫28天后血清goasv琼扩抗体
鹅蛋卵黄抗体检测:
每批次疫苗免疫组免疫后4~5周内任取10枚鹅蛋,其卵黄goasv琼扩抗体效价平均值均≥3.0log2,非免疫对照组10枚鹅蛋卵黄goasv琼扩抗体均为阴性,结果见表2。
表2免疫后4~5周内鹅蛋卵黄goasv琼扩抗体效价
(3)3日龄雏鹅被动免疫攻毒实验
每实验组分别任取免疫后4~5周内所产种蛋30枚(连同对照组),做好标记,置38℃孵化箱孵化29~30日,将免疫组孵出的雏鹅任选20只,对照组20只,戴上脚标,置于攻毒区隔离器中饲养3日,每组雏鹅采血分离血清,检测goasv琼扩抗体。同时进行攻毒实验:goasv攻毒组,用goasv-lh株f3代攻毒(每毫升尿囊液病毒含量104.03eld50/0.2ml),每只雏鹅口服0.5ml,颈部皮下注射0.5ml,攻毒10只;免疫组与对照组分别隔离饲养观察14日,记录发病、死亡及保护情况。
结果显示,3批疫苗被动免疫组每组10只雏鹅血清goasv琼扩抗体效价平均值均≥2.7log2,结果见表3。
表33日龄雏鹅被动免疫血清goasv琼扩抗体效价
(4)3日龄雏鹅被动免疫攻毒实验:
3批疫苗被动免疫组每组10只雏鹅攻毒后采食、饮水、精神状态均正常,无鹅星状病毒临床症状发生,攻毒后14日每组均10/10健活。非被动免疫对照组雏鹅攻毒后第3日精神开始出现精神沉郁、厌食、站立不稳、离群,排稀灰白色或黄绿色粪便,攻毒后第5日出现死亡,至攻毒后10日共死亡5只雏鹅。每只病死鹅剖检,跖、跗、趾关节肿大皮下有大量尿酸盐;整个心脏和部分肝脏出现石灰样尿酸盐沉积;肾脏肿大、充血、表面布满石灰样尿酸盐沉积;肺脏表面散布表酸盐沉积;腺胃散布尿酸盐沉积;脾脏出血严重,有灰白色坏死灶等。被动免疫攻毒保护结果见表4。
表43日龄雏鹅被动免疫攻毒(鹅星状病毒lh株)
上述结果表明,3批次疫苗对种鹅具有很好的免疫效果,使雏鹅出雏时血清中含有较高水平的goasv抗体,可以有效的抵抗鹅星状病毒的攻击。
虽然本发明已以较佳实施例公开如上,但其并非用以限定本发明,任何熟悉此技术的人,在不脱离本发明的精神和范围内,都可做各种的改动与修饰,因此本发明的保护范围应该以权利要求书所界定的为准。
sequencelisting
<110>扬州优邦生物药品有限公司
<120>一种预防鹅星状病毒感染的vlp疫苗及其制备方法和应用
<160>5
<170>patentinversion3.3
<210>1
<211>504
<212>prt
<213>goasvlh株capsid蛋白氨基酸序列
<400>1
metalaasplysvalthrvalservallyslysalalysalaarggly
151015
argthrargserargserargserargserargserargserarggly
202530
lysargvalileilelyslyslyslysalalysthrilelyslyslys
354045
arglyslysargvalarglysvalargargilelysglyargvalser
505560
aspthrlysthrthrvalthrglyargvalglyasnaspaspserser
65707580
arglysvalasnthrmetlysasnaspalaglyseralaserserthr
859095
ileargalasertyrglytrpargilevalcysvalargthralagly
100105110
alaalaasnvalglythrvalvalalaaspserglyvalalathrala
115120125
seraspthrilelysalaarghisvalservalglymetargtyrval
130135140
trplysilelysargglyargglytrptrpasnmetaspthrglyasp
145150155160
aspthrasnserglyalailesertrpthrtyrargthrvalalaser
165170175
serthrasnservalglyglyilevalalaasnvalargtyrserasn
180185190
tyrthrlysasnalametasnargilethrvallysserglyilethr
195200205
lysasnaspthraspglyservalvalmetvalaspalaargalaile
210215220
aspasnargargthrasnalaserglyglylystrpalavalserthr
225230235240
thrvalvalaspvalvalalaaspalaileglytrpglytrplysgly
245250255
glytrptrpvalilearglysileglyalaalaglyasnalaserlys
260265270
tyralailetyralaservalaspalalysasnasnserlysileval
275280285
lysserileserasnargvalilethrileasnvalasnserglyile
290295300
alathrthrglyglyalaalavalalailetyrargilealaasnasn
305310315320
iletyraspvalaspargvalaspglyasptrptyrcysasnasngly
325330335
ilealathrthrvalthralaserseralametglythralaasnval
340345350
argthrargthrasntrpvalasptyrseraspasnglyvalserthr
355360365
histhrglyvalthrthralaalaasniletrpserserserargthr
370375380
hisalathrsercysaspglythrargthrglyileserasnaspval
385390395400
lysglyvaltrpserthrasnasnalaserglyservalileasnasn
405410415
asnmetglytrpvalvalserlyshislysvalargvaltyrtrpthr
420425430
glyserasnasptyrilevaltrpvallysservalseralatyrmet
435440445
glysertrpasnasnasntyrargargalaaspaspileaspmetser
450455460
ilethrilelysserargaspthraspserlyscysserlysthrser
465470475480
aspalaargalatyrtrpargalalysalaalalysalametserala
485490495
thrglyvalarglysglyglyasp
500
<210>2
<211>34
<212>dna
<213>人工序列
<400>2
ccggaattcatggccgacaaggtcactgtctcag34
<210>3
<211>34
<212>dna
<213>人工序列
<400>3
ccgctcgagttaatcaaactcttgtccgcccttc34
<210>4
<211>18
<212>dna
<213>人工序列
<400>4
tgtaaaacgacggccagt18
<210>5
<211>17
<212>dna
<213>人工序列
<400>5
caggaaacagctatgac17
- 还没有人留言评论。精彩留言会获得点赞!