一种通过糖多孢红霉菌SACE_5717基因提高红霉素产量的方法与流程
本发明涉及一种提高发酵生产红霉素产量的方法,尤其涉及一种通过糖多孢红霉菌sace_5717基因提高红霉素产量的方法。
背景技术:
放线菌是一类能产生次级代谢产物的重要微生物资源,与人类密切相关,目前应用广泛的抗生素中约75%是由放线菌产生。常见的万古霉素、红霉素、林可霉素、四环素等不同类型次级代谢产物都是由放线菌产生的。放线菌中的抗生素合成是受合成基因簇控制,而合成基因簇的转录普遍依赖于特异性调控蛋白或全局性调控蛋白的调控,通过对此调控蛋白的研究,并对调控蛋白基因进行修饰,以对次级代谢进行调控,改变抗生素的产量。传统高产工业菌株是通过随机物理或化学诱变获得,随机诱变技术不但具有不确定性,而且不能对育种进行理性指导。本发明目的就是通过基因工程途径定向改变基因来获得红霉素高产菌株,用于红霉素或中间产物的生产。
糖多孢红霉菌是1952年从土壤中分离出的革兰氏阳性丝状放线菌,而红霉素a是其重要的大环内脂类次级代谢产物。目前,红霉素化学衍生物在医药领域具有很重要的应用价值,红霉素及其衍生物每年的世界销售额达到近百亿美元。据此,关于如何提高红霉素产量这一问题也逐渐引起越来越多科学家的关注。2003年,rodriguez等报道红霉素高产主要原因是由于其调控基因,而不是合成基因,使得研究的重点转向了调控基因。2007年,oliynyk等完成了糖多孢红霉菌基因组测序。到目前为止,关于糖多孢红霉菌调控基因的研究依然很少,仅仅只有bldd(sace_2077)、sace_7040、sace_0012、sace_5599、sace_3986、sace_3986和sace_5388等调控基因的研究报道。
原核生物的转录调控子可以分为lysr、arac/xyls、tetr、luxr、laci、arsr、icir、merr、lrp/asnc、marr、ntrc(ebp)、ompr、deor、coldshock、gntr和crp等16个家族。lrp/asnc家族转录调控因子广泛存在于细菌和古细菌中,在结构上具有共同的特征,核心结构一般是由两个部分组成,n端结构域是由具有保守的螺旋-转角-螺旋(helix-turn-helix,hth)结构组成,它能够与靶dna特异性结合;c端结构域为配体结合结构域(也称调控氨基酸代谢结构域,ramdomain),具典型的αβ-三明治折叠结构,c端结构域还参与介导多聚体的形成。lrp/asnc家族的蛋白调控功能广泛,大多数都参与调控氨基酸代谢和小分子的转运。基于糖多孢红霉菌基因组序列推测,糖多孢红霉菌sace_5717基因属于lrp/asnc家族,并且,经本申请实验室研究发现,糖多孢红霉菌sace_5717基因是一个参与红霉素生物合成的负调控因子。
据此,目前急需一种通过糖多孢红霉菌sace_5717基因提高红霉素产量的方法。
技术实现要素:
本发明所要解决的技术问题在于提供一种通过糖多孢红霉菌sace_5717基因提高红霉素产量的方法。
本发明采用以下技术方案解决上述技术问题:
一种通过糖多孢红霉菌sace_5717基因提高红霉素产量的方法,先通过基因工程途径在糖多孢红霉菌中失活sace_5717基因,以获得糖多孢红霉菌红霉素高产菌株,再将获得的相应糖多孢红霉菌红霉素高产工程菌株用于发酵生产红霉素;其中,sace_5717基因的核苷酸序列如seqidno.1所示,核苷酸序列编码的氨基酸序列如seqidno.2所示。
作为本发明的优选方式之一,所述在糖多孢红霉菌中失活sace_5717基因中失活sace_5717基因的步骤中,采用的糖多孢红霉菌原始菌株具体为糖多孢红霉菌a226菌株。
作为本发明的优选方式之一,所述糖多孢红霉菌a226菌株为目前已公开、且为公众所得的菌株,由安徽大学提供,并由安徽大学于本申请申请日以前送往中国药用微生物菌种保藏管理中心进行保藏与登记,保藏编号为cgmcc8279。
作为本发明的优选方式之一,具体方法如下:以糖多孢红霉菌sace_5717基因或其表达产物为出发点,在红霉素高产菌株缺失lrp/asnc家族转录调控基因sace_5717,获得糖多孢红霉菌红霉素高产菌株,用于发酵生产红霉素。
作为本发明的优选方式之一,所述糖多孢红霉菌sace_5717基因的基因产物用于负向调控红霉素生物合成。
本发明相比现有技术的优点在于:
本发明研究中筛选到了红霉素生物合成负调控基因sace_5717,通过基因工程途径失活糖多孢红霉菌中sace_5717基因,能够获得红霉素高产菌株,为工业生产提高红霉素发酵产量提供技术支持。其中,当于糖多孢红霉菌a226中敲除sace_5717基因时,红霉素产量提高了27%;而在δsace_5717失活突变株中回补sace_5717基因时,红霉素产量则得到了恢复;由此表明,sace_5717是一个参与红霉素生物合成的负调控因子。利用高产菌株wb作为出发菌株,失活sace_5717基因,红霉素产量提高25%,说明失活sace_5717基因提高红霉素产量的技术在工业高产菌株中同样适用。
附图说明
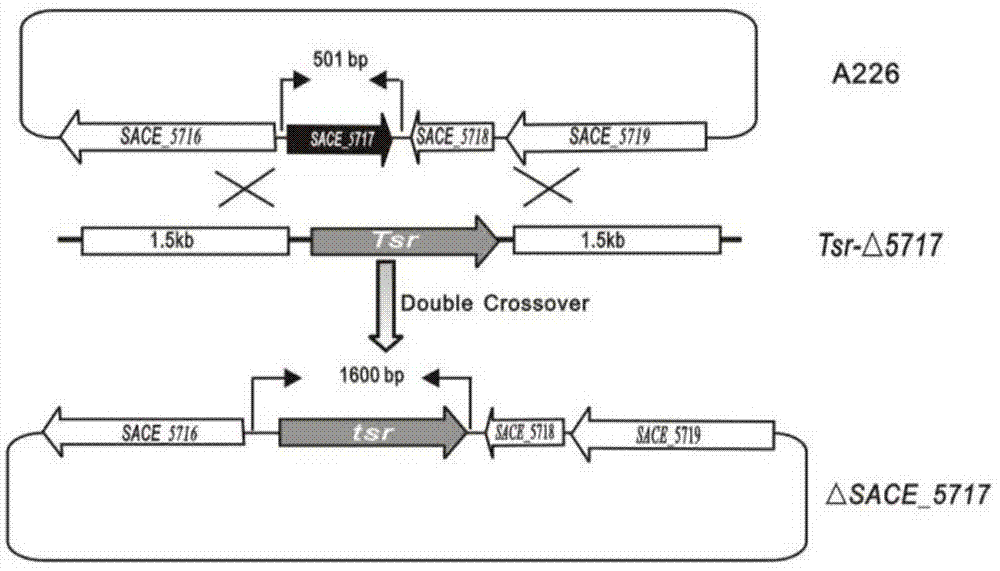
图1是实施例7中sace_5717基因失活突变株δsace_5717的构建过程示意图;
图2是实施例7中失活突变株的pcr验证图(硫链丝菌肽抗性基因(tsr)替换了糖多孢红霉菌染色体上sace_5717基因,sace_5717基因(501bp)被tsr(1360bp)替换后长度变为1600bp;图中,m:5000bpdnamarker);
图3是实施例7中突变体的红霉素产量分析图(具体为出发菌株a226、失活突变株δsace_5717、失活回补菌株、过表达菌株a226/pib139-5717及过表达空载对照菌株在r5培养基中30℃发酵6天产物hplc分析);
图4是实施例7中突变体的生物量检测结果图(具体为出发菌株a226及失活突变株δsace_5717发酵过程中菌体干重的分析);
图5是实施例7中δsace_5717突变株和野生型a226菌株的孢子生长情况显示图(图中,1:a226菌株;2:δsace_5717突变株;3:回复菌株δsace_5717/pib139-5717;4:影响糖多孢红霉菌形态分化菌株δbldd);
图6是实施例7中δsace_5717与出发菌株a226中相关基因转录分析图(sace_5717失活突变株中,红霉素生物合成酶基因eryai(sace_0721)和红霉素抗性基因erme(sace_0733),邻近的赖氨酸转运蛋白基因sace_5716转录水平有显著提高);
图7是实施例7中工业高产wb/δsace_5717突变体的pcr鉴定图(sace_5717基因(501bp)被tsr抗性基因(1360bp)替换后长度变为1600bp;m:5000bpdnamarker);
图8是实施例7中高产菌株wb及失活突变株wb/δsace_5717红霉素a产量的hplc分析图。
本发明使用的重要菌株来源说明:
本发明使用的糖多孢红霉菌a226菌株为目前已公开、且为公众所得的菌株,由安徽大学提供,并由安徽大学于本申请申请日以前送往中国药用微生物菌种保藏管理中心进行保藏与登记,经鉴定表现为存活,保藏编号为cgmcc8279。
本发明使用的糖多孢红霉菌wb(工业高产菌株),为目前已公开、且为公众所得的菌株,由安徽大学提供,并由安徽大学于本申请申请日以前送往中国药用微生物菌种保藏管理中心进行保藏与登记,经鉴定表现为存活,保藏编号为cgmcc8280。
具体实施方式
本发明试验中使用到的菌株和质粒见表1。大肠杆菌在液体lb培养基或在添加2.0%琼脂的lb固体平板上于37℃进行培养。红霉素产生菌糖多孢红霉菌a226及其工业高产菌wb在胰蛋白胨大豆肉汤(tsb)培养基或在含有2.2%琼脂的r3m平板上于30℃进行培养。
本发明试验中使用到的peg3350、溶菌酶、tes、酪蛋氨基酸、硫链丝菌肽、安普霉素从sigma公司购买。tsb、酵母提取物、蛋白胨购买于oxoid公司。甘氨酸、琼脂粉、氯化钠和其它生物学试剂都购于试剂公司。大肠杆菌和糖多孢红霉菌的一般操作技术按照标准操作。引物的合成和dna测序由通用生物系统(安徽)有限公司完成。
表1本发明试验中使用到的菌株和质粒
下面对本发明的实施例作详细说明,本实施例在以本发明技术方案为前提下进行实施,给出了详细的实施方式和具体的操作过程,但本发明的保护范围不限于下述的实施例。
实施例1sace_5717基因失活突变体的构建:
puctsr质粒是在puc18的bamhi和smai酶切位点之间插入1360bp硫链丝菌肽抗性基因(tsr)。为了敲除糖多孢红霉菌中的sace_5717基因,分别用pup1/pup2和pd1/pd2为引物、糖多孢红霉菌基因组为模板,pcr扩增sace_5717基因的上下游各约1.5kb的同源臂su和sddna片段。
pcr扩增sudna片段的引物为pup1、pup2,pup1的核苷酸序列如seqidno.3所示,pup2的核苷酸序列如seqidno.4所示;其中,pup1序列中的“aagctt”为hindiii的酶切位点,pup2序列中的“tctaga”为xbal的酶切位点。
pcr扩增sddna片段的引物为pd1、pd2,pd1的核苷酸序列如seqidno.5所示,pd2的核苷酸序列如seqidno.6所示;其中,pd1序列中的
“ggtacc”为kpni的酶切位点,pd2序列中的“gaattc”为ecori的酶切位点。
分别将上述su和sd两个dna片段连接到puctsr的tsr抗性基因两侧,完成构建质粒puc-δsace_5717;以pup1和pd2为引物、puc-δsace_5717质粒为模板,pcr扩增tsr-δsace_5717dna片段,利用染色体片段同源重组技术将tsr-δsace_5717片段导入糖多孢红霉菌原生质体中,根据硫链丝菌肽抗性筛选突变体,即获得sace_5717基因被硫链丝菌肽抗性基因(tsr)替换的基因工程菌株,使用p1/p2引物pcr验证该突变体被成功构建,命名为δsace_5717。其中,p1引物的核苷酸序列如seqidno.7所示,p2引物的核苷酸序列如seqidno.8所示。
实施例2sace_5717基因回复菌株的构建:
为了在δsace_5717中引入sace_5717基因,设计了pcr扩增sace_5717基因引物,即p3、p4;p3的核苷酸序列如seqidno.9所示,p4的核苷酸序列如seqidno.10所示;其中,p3序列中的“catatg”为ndei的酶切位点,p4序列中的“tctaga”为xbai的酶切位点。
从糖多孢红霉菌a226基因组中扩增出sace_5717基因,插入到pib139的ndei和xbai酶切位点之间,构建表达质粒pib139-5717,然后通过peg介导的原生质体转化方法将pib139-5717导入δsace_5717中。通过安普霉素初步筛选,以安普霉素抗性基因(apr)为对象进行pcr鉴定,获得的回复菌株命名为δsace_5717/pib139-5717。
实施例3糖多孢红霉菌a226中过量表达sace_5717基因:
pib139-5717通过peg介导的原生质体转化技术导入糖多孢红霉菌a226中,以安普霉素抗性基因(apr)为对象进行pcr鉴定,获得菌株命名为a226/pib139-5717。
实施例4糖多孢红霉菌发酵产物检测:
接种糖多孢红霉菌于tsb培养基,在30℃/220rpm振荡培养2天后,转接r5液体培养基30℃/220rpm振荡培养6天。发酵结束后对红霉素进行萃取和hplc检测。
实施例5δsace_5717中相关基因的转录分析:
将分别培养2天的δsace_5717和出发菌株a226菌液采用赛百盛rna提取试剂盒获得所需rna,反转成cdna后,使用实时荧光定量pcr仪上机检测。
实施例6红霉素工业高产菌株wb中失活sace_5717:
puctsr质粒是在puc18的bamhi和smai酶切位点之间插入1360bp硫链丝菌肽抗性基因(tsr)。为了敲除红霉素工业高产菌中的sace_5717基因,分别用上述相同的pup1/pup2(同实施例1中pup1/pup2)和pd1/pd2(同实施例1中pd1/pd2)为引物、糖多孢红霉菌基因组为模板,pcr扩增sace_5717基因的上下游各约1.5kb的同源臂su和sddna片段。
分别将上述su和sd两个dna片段连接到puctsr的tsr抗性基因两侧,完成构建质粒puc-δsace_5717;以pup1和pd2为引物、puc-δsace_5717质粒为模板,pcr扩增tsr-δsace_5717dna片段,利用染色体片段同源重组技术将tsr-δsace_5717片段导入糖多孢红霉菌原生质体中,根据硫链丝菌肽抗性筛选突变体,即获得sace_5717基因被硫链丝菌肽抗性基因(tsr)替换的红霉素高产基因工程菌株,使用p1/p2引物(同实施例1中p1/p2引物)pcr验证该突变体被成功构建,命名为wb/δsace_5717。
实施例7
本实施例用以总结分析上述各实施例实验结果:
1、sace_5717基因的基本信息
sace_5717基因在糖多孢红霉菌染色体上的位置参见ncbi,sace_5717基因的核苷酸序列如seqidno.1所示,核苷酸序列编码的氨基酸序列如seqidno.2所示。
2、δsace_5717比出发菌株a226红霉素产量提高
sace_5717基因失活突变株δsace_5717的构建过程见图1。在含有硫链丝菌肽的r3m平板上筛选失活突变子并通过pcr证实(电泳结果见图2)。δsace_5717在r5液体培养基中发酵6天,萃取浓缩后经hplc分析,其红霉素产量比出发菌株a226的产量提高了26.5%(见图3),表明sace_5717可能是参与调控红霉素生物合成的负调控子。同时,取每天发酵的菌体进行生物量测定,结果显示δsace_5717与a226的菌体量差异不大(见图4),暗示着sace_5717的失活并未影响菌株的菌体生长。
3、sace_5717基因回复
为了确认突变株δsace_5717的表型是完全由于sace_5717基因突变引起的,本发明研究设计了sace_5717基因回补实验。pib139-5717包含有红霉素抗性基因强启动子perme*以及完整的sace_5717基因,用于回补突变株δsace_5717。经发酵和hplc检测,δsace_5717/pib139-5717的红霉素产量恢复到与出发菌株a226的相一致水平(见图3)。
4、a226中过表达sace_5717基因引起红霉素产量降低
为了进一步验证sace_5717在宿主糖多孢红霉菌中的功能,确认其与红霉素产量的关系,本发明同时设计了sace_5717过表达实验,将表达载体pib139-5717导入到a226中构建过表达菌株a226/pib139-5717。经发酵和hplc检测,发现其红霉素产量比对照a226/pib139相比,产量降低了19.6%(见图3),综上结果证实了sace_5717是糖多孢红霉菌中红霉素生物合成的负调控基因,通过基因工程途径失活糖多孢红霉菌中sace_5717基因可以提高红霉素等产量。
5、失活sace_5717基因对菌体孢子形态分化的影响。
为了确定sace_5717基因是否调控菌体的孢子形成,将突变株δsace_5717、回复菌株δsace_5717/pib139-5717、过表达菌株a226/pib139-5717、野生型对照菌株a226以及影响孢子形态分化菌株δbldd同时涂于r3m平板上,30℃培养84小时,观察菌株孢子生长情况。结果显示相比于a226,δsace_5717突变体的孢子形态无明显差异(见图5),说明sace_5717基因的失活不影响孢子的形成。
6、δsace_5717失活突变株中相关基因的转录分析
qrt-pcr结果证实,在δsace_5717突变株中,红霉素生物合成基因簇上的结构基因eryai的表达量较出发菌株a226提高了5倍,抗性基因erme提高了1.2倍,而上游邻近的赖氨酸转运蛋白基因sace_5716的转录水平提高了4倍(见图6),说明sace_5717的突变可以造成红霉素生物合成基因簇以及邻近基因转录水平的上升。
7、改造的工业高产菌株wb/δsace_5717红霉素产量显著提高
在含有硫链丝菌肽的r3m平板上筛选失活突变子并通过pcr鉴定(见图7)。将突变株wb/δsace_5717与对照菌株wb涂板活化,然后分别接入工业种子培养基的摇瓶中,30℃转速220rpm下恒温振荡培养2天后,转接工业发酵培养基中,继续培养6天。发酵结束后萃取浓缩经hplc分析,相比较出发菌株wb,wb/δsace_5717的红霉素产量分别提高了25%(见图8)。
实施例8
基于实施例1-7实验结果,我们可知:通过基因工程途径在糖多孢红霉菌中失活sace_5717基因,红霉素产量得到提高;在突变菌株中回补sace_5717基因,红霉素产量恢复到原来水平;因此确定sace_5717基因为控制红霉素生物合成的负向调控基因。
据此,可获得一种通过糖多孢红霉菌sace_5717基因提高红霉素产量的方法:以糖多孢红霉菌sace_5717基因或其表达产物为出发点,在红霉素高产菌株缺失lrp/asnc家族转录调控基因sace_5717(具体见上述各实施例),以获得糖多孢红霉菌红霉素高产菌株,再将获得的相应糖多孢红霉菌红霉素高产工程菌株用于发酵生产红霉素。
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明的保护范围之内。
sequencelisting
<110>安徽农业大学、安徽大学
<120>一种通过糖多孢红霉菌sace_5717基因提高红霉素产量的方法
<130>2018
<160>10
<170>patentinversion3.3
<210>1
<211>474
<212>dna
<213>糖多孢红霉菌
<400>1
gtggactggcagatcctcgaggagttgcagaacgacgcgaccctgcccaaccgcacgctc60
gccgatcgggtcgggctggccgcgtcgagctgcctgcaacgggtgcgccggctgcgtgaa120
cagggcgtgatcagggggtcgcacatcgacgtcgacccggcggccaccgggctggcgctg180
gaggcgatcgtgtcgatcaacgtccggccgcacacccgcgaagtcgtcgaccagttccgc240
aagttcgtgctggcgcagcccgagacgcggtcgctgctgcacgtcagcgggcaggccgac300
ttcctcctgcacgtcgcggtggccgacaccgcgcacctgcagggcttcctggtcgacaag360
ctggcgtcgcgcccggaggtccgccacttcaccagctcgatcgtgctggagcaggtgcac420
acccgggcgctgacggcgcccgcgcacctgcggccgaagcggcgacgcaagtag474
<210>2
<211>157
<212>prt
<213>糖多孢红霉菌
<400>2
valasptrpglnileleuglugluleuglnasnaspalathrleupro
151015
asnargthrleualaaspargvalglyleualaalasersercysleu
202530
glnargvalargargleuarggluglnglyvalileargglyserhis
354045
ileaspvalaspproalaalathrglyleualaleuglualaileval
505560
serileasnvalargprohisthrarggluvalvalaspglnphearg
65707580
lysphevalleualaglnprogluthrargserleuleuhisvalser
859095
glyglnalaasppheleuleuhisvalalavalalaaspthralahis
100105110
leuglnglypheleuvalasplysleualaserargprogluvalarg
115120125
hisphethrserserilevalleugluglnvalhisthrargalaleu
130135140
thralaproalahisleuargprolysargargarglys
145150155
<210>3
<211>29
<212>dna
<213>人工序列
<400>3
aaaaagcttattctgcgcggagccccggt29
<210>4
<211>29
<212>dna
<213>人工序列
<400>4
aaatctagattgcaggcagctcgacgcgg29
<210>5
<211>29
<212>dna
<213>人工序列
<400>5
aaaggtacccacctgcggccgaagcggcg29
<210>6
<211>29
<212>dna
<213>人工序列
<400>6
aaagaattccgaccccgagacgctgccga29
<210>7
<211>29
<212>dna
<213>人工序列
<400>7
aaacatatgatgcgtgaatccgtagaact29
<210>8
<211>29
<212>dna
<213>人工序列
<400>8
aaatctagactacttgcgtcgccgcttcg29
<210>9
<211>29
<212>dna
<213>人工序列
<400>9
aaacatatgatgcgtgaatccgtagaact29
<210>10
<211>29
<212>dna
<213>人工序列
<400>10
aaatctagactacttgcgtcgccgcttcg29
- 还没有人留言评论。精彩留言会获得点赞!