用于治疗和/或预防与肝炎病毒相关的疾病或病症的双二氮杂双环化合物的制作方法
本发明涉及用于治疗和/或预防与肝炎病毒相关的疾病或病症的双二氮杂双环化合物,使用它治疗和/或预防与肝炎病毒有关的疾病或病症的方法,以及它在制备用于治疗和/或预防与抗肝炎病毒相关疾病或病症或消除和/或缓解与肝炎病毒相关疾病或病症的药物中的用途。
背景技术:
肝炎或肝部疾病通常是由肝炎病毒引发的疾病,肝炎病毒通常可分为:甲、乙、丙、丁、戊及庚等类型,其中乙型肝炎病毒引发的是目前全世界分布的慢性疾病,如控制不当,其疾病发展后期会有相当大比例的乙型肝炎会转化为肝癌。目前全世界估计有280,000,000名乙型肝炎病毒(hbv携带者)。
根据2015年中国慢乙肝(chb)防治指南,慢乙肝治疗的目标是最大限度地长期抑制hbv复制,减轻肝细胞炎性坏死及肝纤维化,达到延缓和减少肝功能衰竭、肝硬化失代偿、hcc及其它并发症的发生,从而改善生活质量和延长生存时间。在治疗过程中,对于部分适合的患者应尽可能追求慢性乙肝的临床治愈,即停止治疗后持续的病毒学应答、hbsag阴转或伴有抗-hbs阳转、alt正常、肝组织病变轻微或无病变。而完全治愈是指机体除抗体外,消除hbvdna,消除各种抗原,消除cccdna。
当前,国际上多个慢乙肝防治指南皆将表面抗原(hbsag)转阴(又称功能性治愈)作为chb抗病毒治疗的理想目标,但现有的抗病毒治疗药物如干扰素(interferonalpha,ifn-α)和核苷(酸)类似物[nucleos(t)ideanalogues,nucs]等药物虽然可以抑制病毒复制,但是在有限或长期疗程内均难以发生hbsag清除或血清学转换。目前,美国fda批准用于治疗慢乙肝感染的抗病毒药物有7种,包括普通和长效干扰素以及5种口服核苷(酸)类似物---拉米夫定、阿德福韦酯、恩替卡韦、替比夫定和富马酸替诺福韦酯(tenofovirdisoproxilfumarate,tdf),其中恩替卡韦(entecavir,etv)、富马酸替诺福韦酯作为一线药物推荐为治疗首选(liaw,leungetal.2008;lokandmcmahon2009;liu,yangetal.2014;gish,givenetal.2015)。但临床上使用现有nucs类药物治疗5年,hbsag转阴率不足5%;接受长效干扰素(peg-ifn)治疗后取得应答者,长期随访过程中hbsag转阴率亦不到10%(sundaramandkowdley2015)。对于chb患者,nucs药物只能抑制核衣壳内病毒正反链的合成,在抗病毒治疗过程中,消失的主要是复制型dna,对肝细胞核内的cccdna及其转录表达的病毒抗原并无直接作用(wong,
setoetal.2013)。另一类药物ifnα兼具免疫调节和直接抗病毒效应,可以诱导hbv感染的肝细胞内表达apobec3a,通过碱基编辑作用,促进cccdna降解,发挥直接抗病毒作用(lucifora,xiaetal.2014)。但hbv已经证实能拮抗ifnα信号通路,导致ifnα类药物治疗疗效不佳(bertolettiandferrari2012)。因此,考虑到当前抗病毒药物的局限性,其他的治疗策略如刺激和/或恢复抗病毒免疫是目前清除慢性hbv感染研究的热点(luciforaandtrepo2015)。
宿主特异性免疫应答对hbv的清除至关重要。hbv特异性t淋巴细胞应答是机体清除肝细胞内hbv感染最重要的效应细胞。hbv通过钠离子/牛磺胆酸共转运多肽受体感染进入肝细胞后,病毒基因组可被宿主dna聚合酶修复成稳定的共价闭合环状dna(covalentlyclosedcirculardna,cccdna)寄生于肝细胞核内。作为肝内病毒复制和基因表达的原始模板,cccdna微染色体的难以清除是临床抗病毒治疗难以治愈的重要原因(nassal2015)。hbv效应t细胞可以通过颗粒酶、穿孔素的杀伤作用或通过fasl诱导肝细胞凋亡的细胞毒途径,直接杀伤感染的肝细胞,诱导靶细胞凋亡,清除cccdna及其它病毒产物(hoh,heegetal.2015)。另外,效应t细胞分泌的ifnγ和tnfα等细胞因子,亦可以作用于感染肝细胞,通过非溶细胞途径,诱导胞内抗病毒基因表达而抑制病毒复制和cccdna合成(guidotti,rochfordetal.1999)。最新的研究提示,效应t细胞可以通过血小板锚定至肝血窦,通过内皮细胞间隙直接与递呈病毒抗原的感染肝细胞接触,进而分泌ifnγ、tnfα等细胞因子直接诱导感染肝细胞凋亡来清除hbv(guidotti,inversoetal.2015)。此外,b细胞对控制hbv感染也具有十分重要的作用。急性hbv感染时,b细胞产生的乙肝表面抗原抗体(hbsab)可以中和、阻断hbv感染肝细胞。
iap蛋白是一类关键细胞凋亡调节剂,并且特征在于一个或多个bir(杆状病毒iap重复)结构域的存在。在iap间,细胞iap1(ciap1)和ciap2在死亡受体介导的细胞凋亡的调节中发挥关键作用,而x连锁的iap(xiap)通过结合和抑制胱天蛋白酶-3/7和胱天蛋白酶-9(对于执行细胞凋亡关键的三种半胱氨酸蛋白酶)抑制死亡受体介导的和线粒体介导的细胞凋亡。这些iap蛋白在癌细胞系和人肿瘤组织中都高度过表达,并且在正常细胞和组织中具有低表达。广泛的研究已经表明,iap蛋白的过表达使癌细胞抵抗多种抗癌药物的细胞凋亡诱导。iap蛋白和它们的作用的详细讨论是癌症,并且细胞凋亡记载于美国专利号7,960,372。
一类细胞凋亡的中心负调节剂是细胞凋亡蛋白(iap)的抑制剂。这一类别包括蛋白例如xiap、ciap1、ciap2、ml-iap、hiap、kiap、tsiap、naip、生存素、livin、ilp-2、apollon和bruce。
iap蛋白的小分子抑制剂也是已知的。例如,美国专利公开申请号2005/0197403和美国专利号7,960,372公开了二聚的smac模拟物化合物。其中,双二氮杂双环化合物是一类抑制iap的化合物。
研究已经显示,基于肽的抑制剂是阐明iap的抗细胞凋亡功能和iap在癌细胞对化疗剂的响应方面的作用的有用工具。现有技术中并未公开或暗示双二氮杂双环化合物在抑制或消除肝炎病毒,特别是hbv病毒方面是有效的。
技术实现要素:
在研究中,本申请的发明人出人意料地发现,双二氮杂双环化合物在抑制和/或消除肝炎病毒,特别是hbv病毒是极其有效的。
因此,在本发明的第一方面,涉及用于治疗和/或预防与肝炎病毒相关的疾病或病症的双二氮杂双环化合物,其中所述化合物是双二氮杂双环化合物。进一步地,所述双二氮杂双环化合物是具有下述结构的化合物或其药学上可接受的盐:
其中x选自:
y选自-nh-、-o-、-s-和不存在;
r选自
r1选自
优选地,在所述化合物中r是
优选地,在所述化合物中r1是
优选地,在所述化合物中x是so2,且y不存在。
优选地,所述化合物是
优选地,所述化合物选自:
进一步地,所述与肝炎病毒相关的疾病或病症是与感染肝炎病毒晚期相关的疾病或病症。优选地,所述与肝炎病毒相关的疾病或病症是与甲型肝炎病毒、乙型肝炎病毒或丙型肝炎病毒相关的疾病或病症。更优选地,所述与肝炎病毒相关的疾病或病症包括但不限于:甲型肝炎、乙型肝炎、丙型肝炎和肝硬化。进一步地,所述化合物通过调节免疫应答来治疗和/或预防与肝炎病毒相关的疾病或病症。
在本发明的第二方面,涉及如上定义的化合物在制备用于治疗和/或预防与肝炎病毒相关的疾病或病症的药物中的用途。
在本发明的第三方面,涉及如上定义的化合物用于治疗和/或预防与肝炎病毒相关的疾病或病症的方法,其包括对患有与肝炎病毒相关的疾病或病症的患者施用治疗和/或预防有效量的所述化合物,且所述化合物是双二氮杂双环化合物。
在本发明的第四方面,涉及含有如上定义的化合物的药物组合物,所述药物组合物用于治疗和/或预防与肝炎病毒相关的疾病或病症。
附图说明
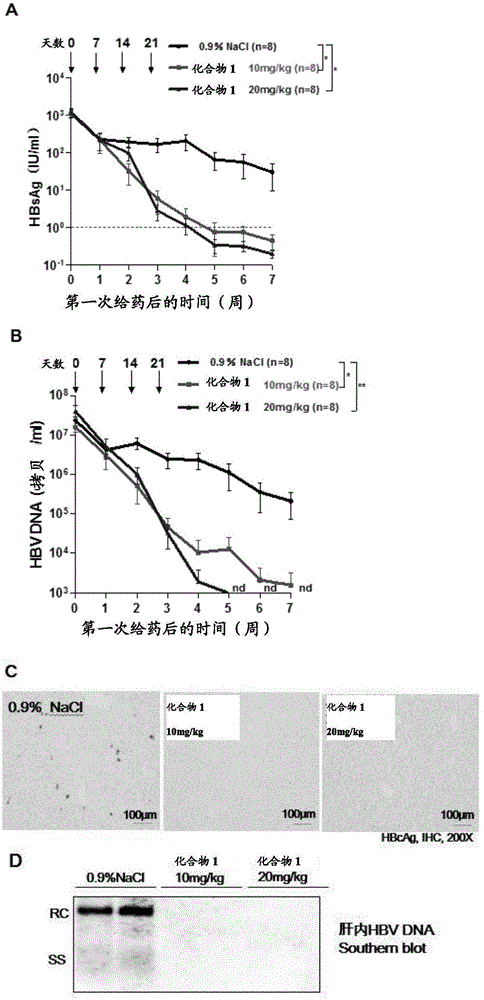
图1.显示化合物1单药注射对paav-hbv1.2质粒高压尾静脉注射的c57bl/6j小鼠模型体内hbv的影响。a:各组血清中hbsag的动态变化;b:各组血清中hbvdna的动态变化;c:免疫组化染色检测7周时各组肝组织hbcag表达;d:southernblot检测7周时各组肝内hbv复制中间体。
图2.显示化合物1联合富马酸替诺福韦酯(tdf)给药对paav-hbv1.2质粒高压尾静脉注射的c57bl/6j小鼠模型体内hbv的影响。a:各组血清中hbsag在不同时间点的清除率比较;b:各组血清中hbvdna在不同时间点的清除率比较。
图3.显示化合物1对hbv感染的小鼠肝细胞凋亡的影响。a:paav-hbv1.2质粒高压尾静脉注射的c57bl/6j小鼠血清alt、ast在化合物1注射后不同时间点的动态变化;b:肝组织内ciaps在化合物1注射后不同时间点的表达变化;c:化合物1注射后不同时间点小鼠肝组织切片he染色;d:hbcag免疫荧光和tunnel法双染检测hbv感染肝细胞凋亡。
图4.显示化合物1治疗对小鼠体内hbv免疫应答的影响效应。a:化合物1治疗组小鼠肝内病毒清除后,肝内总淋巴细胞计数改变;b:肝内浸润的cd4+t细胞和cd8+t细胞的频数改变;c:hbv特异性cd4+t细胞分泌ifnγ、tnfα、il-2的功能;d:hbv特异性cd8+t细胞分泌ifnγ、tnfα、il-2的功能。
图5.显示化合物1联合ifnα2a给药在慢性hbv感染的c57bl/6j小鼠模型中抗乙肝病毒的作用。其中图5a:第一次给药二十一天内,在不同时间点各组(a组(0.9%生理盐水注射组):paav-hbv1.2+pkcmvint+0.9%nacl;b组(化合物110mg/kg静脉注射组):paav-hbv1.2+pkcmvint+化合物110mg/kg;c组(ifnα-2a组):paav-hbv1.2+pkcmvintifnα-2a+0.9%nacl;d组(化合物1联合ifnα-2a组):paav-hbv1.2+pkcmvintifnα-2a+apg10mg/kg)血清hbsag个体水平变化。图5b:第一次给药二十一天内,不同时间点各组(a组(0.9%生理盐水注射组):paav-hbv1.2+pkcmvint+0.9%nacl;b组(化合物110mg/kg静脉注射组):paav-hbv1.2+pkcmvint+化合物110mg/kg;c组(ifnα-2a组):paav-hbv1.2+pkcmvintifnα-2a+0.9%nacl;d组(化合物1联合ifnα-2a组):paav-hbv1.2+pkcmvintifnα-2a+apg10mg/kg)血清hbeag个体水平变化。
图6.显示化合物1和birinapant在paav-hbv1.2质粒高压尾静脉注射建立的慢性hbv感染c57bl/6j小鼠模型中抗乙肝病毒作用的比较。图6a:第一次给药五周内,在不同时间点各组(a组:0.9%nacl生理盐水注射组;b组:化合物120mg/kg静脉注射组;c组:birinapant20mg/kg静脉注射组)血清hbsag总体水平变化。图6b:第一次给药五周内,在不同时间点各组(a组:0.9%nacl生理盐水注射组;b组:化合物120mg/kg静脉注射组;c组:birinapant20mg/kg静脉注射组)血清hbeag总体水平变化。图6c:第一次给药五周内,在不同时间点各组(a组:0.9%nacl生理盐水注射组;b组:化合物120mg/kg静脉注射组;c组:birinapant20mg/kg静脉注射组)血清hbsag个体水平变化。图6d:第一次给药四周内,在不同时间点各组(a组:0.9%nacl生理盐水注射组;b组:化合物120mg/kg静脉注射组;c组:birinapant20mg/kg静脉注射组)血清hbeag个体水平变化。
图7.显示化合物1联合抗-pd1抗体给药在paav-hbv1.2质粒高压尾静脉注射建立的慢性hbv感染c57bl/6j小鼠模型中抗乙肝病毒的作用。图7a:第一次给药五周内,在不同时间点各组(a组:0.9%nacl生理盐水注射组;b组:化合物120mg/kg静脉注射组;c组:抗-pd1抗体腹腔注射组;d组:化合物1联合抗-pd1抗体组)血清hbsag总体水平变化。图7b:第一次给药五周内,在不同时间点各组(a组:0.9%nacl生理盐水注射组;b组:化合物120mg/kg静脉注射组;c组:抗-pd1抗体腹腔注射组;d组:化合物1联合抗-pd1抗体组)血清hbeag总体水平变化。图7c:第一次给药五周内,在不同时间点各组(a组:0.9%nacl生理盐水注射组;b组:化合物120mg/kg静脉注射组;c组:抗-pd1抗体腹腔注射组;d组:化合物1联合抗-pd1抗体组)血清hbsag个体水平变化。图7d:第一次给药四周内,在不同时间点各组(a组:0.9%nacl生理盐水注射组;b组:化合物120mg/kg静脉注射组;c组:抗-pd1抗体腹腔注射组;d组:化合物1联合抗-pd1抗体组)血清hbeag个体水平变化。
图8.显示化合物1与sf18在raav8-hbv1.3(ayw)病毒尾静脉注射的c57bl/6j小鼠模型中抗乙肝病毒作用。图8a:第一次给药四周内,在不同时间点各组(a组:0.9%nacl生理盐水注射组;b组:化合物120mg/kg静脉注射组;c组:sf1820mg/kg静脉注射组)hbsag个体水平变化。图8b:第一次给药四周内,在不同时间点各组(a组:0.9%nacl生理盐水注射组;b组:化合物120mg/kg静脉注射组;c组:sf1820mg/kg静脉注射组)hbeag个体水平变化。
发明详述
定义
如本文使用的术语“c4-8脂族环”是指未取代或被1至3个基团(例如,c1-4烷基、卤素、三氟甲基、三氟甲氧基、羟基、烷氧基、硝基、氰基、烷基氨基或氨基)取代的环丁基、环戊基、环己基、环庚基或环辛基。
如本文使用的术语“烷基”是指直链和支链饱和的c1-10烃基,其非限制性实例包括甲基、乙基和直链和支链的丙基、丁基、戊基、己基、庚基、辛基、壬基和癸基。
术语“c3-6亚环烷基”是指具有3至6个碳原子的二取代的环烷烃,例如,
如本文使用的术语“卤素”被定义为氟、氯、溴或碘。
如本文使用的术语“羟基”被定义为-oh。
如本文使用的术语“烷氧基”被定义为-or,其中r是烷基。
如本文使用的术语“氨基”被定义为-nh2,并且术语“烷基氨基”被定义为-nr2,其中至少一个r是烷基并且第二个r是烷基或氢。
如本文使用的术语“硝基”被定义为-no2。
如本文使用的术语“氰基”被定义为-cn。
如本文使用的术语“三氟甲基”被定义为-cf3。
如本文使用的术语“三氟甲氧基”被定义为-ocf3。
如本文使用的术语“任选取代的”是指被一个或多个并且特别是一个至四个独立选自以下的基团取代:例如,卤素、烷基、烯基、-ocf3、-no2、-cn、-nc、-oh、烷氧基、氨基、烷基氨基、-co2h、-co2烷基、炔基、环烷基、硝基、巯基、亚氨基、酰胺基、膦酸酯、亚膦酸酯、甲硅烷基、烷硫基、磺酰基、磺酰胺、醛、杂环烷基、三氟甲基、芳基和杂芳基。
如本文使用的术语“芳基”是指单环或多环的芳香基团,优选是单环或二环的芳香基团,例如苯基或萘基。
如本文使用的术语“杂芳基”是指含有一个或两个芳香环并且在一个芳香环中含有至少一个且至多四个氮原子的单环或二环的环系统。
术语“疾病”或“病症”表示紊乱和/或异常,所述紊乱和/或异常通常被认为是病理状态或功能,并且可以将它们自己表现为特定体征、病症、和/或功能障碍的形式。
术语“治疗”疾病或病症表示消除、抑制、减轻或缓解疾病或病症,且术语“预防”表示避免和防止疾病或病症或使所述疾病或病症不发生或出现。
在本发明的第一方面,涉及双二氮杂双环化合物,所述化合物用于治疗和/或预防,或者消除和/或缓解与肝炎病毒相关的疾病或病症,其中所述化合物是双二氮杂双环化合物。
进一步地,所述双二氮杂双环化合物是具有下述结构的化合物或其药学上可接受的盐:
其中x选自:
y选自-nh-、-o-、-s-和不存在;
r选自
r1选自
优选地,在所述化合物中r是
优选地,在所述化合物中r1是
优选地,在所述化合物中x是so2,且y不存在。
优选地,所述化合物是
进一步地,所述双二氮杂双环化合物是具有下述结构的化合物或其药学上可接受的盐:
其中x选自:
y选自-nh-、-o-、-s-和当x为-so2-时,不存在;
r选自
r1选自
其中环a是c4-8脂族环;且b是苯基、萘基、吡啶基、哒嗪基、吡嗪基或嘧啶基,且任选被1-4个独立选自卤素、-ocf3、-no2、-cn、-nc、-oh、氨基、c1-10烷基、c1-10烷基氧基和c1-10烷基氨基的基团取代。
优选地,在所述化合物中,r是
优选地,在所述化合物中,r是
优选地,在所述化合物中,r是
优选地,在所述化合物中,r1是
优选地,在所述化合物中,r1是
优选地,在所述化合物中,x是
优选地,在所述化合物中,x是
优选地,所述化合物选自
优选地,所述化合物是
优选地,所述化合物其选自
优选地,所述化合物是sf18,其具有下述结构:
优选地,所述化合物是化合物1,即,1,3‐苯二[7‐(3s,5s,9ar)‐5‐((s)‐2‐甲胺基‐丙酰胺基)‐3‐二苯甲胺酰‐4‐氧代‐3a,7‐二氮杂‐十氢环戊烷并环辛烯)]‐磺酰胺,具有下述结构:
根据本发明,所述化合物按照pct/us2013/055384(wo2014/031287)中公开的制备方法获得,其全部内容通过引用并入本文作为参考。
根据本发明,本发明化合物可以以单体或组合物的形式使用。进一步地,本发明化合物可通过肠道,非肠道或局部途径给予需治疗的所述患者,肠道途径通常包括口服,本发明化合物肠道使用形式包括:口服液、片剂、胶囊、颗粒剂和悬浮剂。非肠道途径通常包括皮下、肌肉、腹膜内和静脉滴注等,本发明化合物非肠道使用形式包括注射剂和冻干制剂等,本发明化合物局部使用的形式包括贴剂、糊剂和软膏剂等。
进一步地,所述与肝炎病毒相关的疾病或病症是与感染肝炎病毒晚期相关的疾病或病症;所述与肝炎病毒相关的疾病或病症是与甲型肝炎病毒、乙型肝炎病毒或丙型肝炎病毒相关的疾病或病症;优选地,所述与肝炎病毒相关的疾病或病症包括但不限于:甲型肝炎、乙型肝炎、丙型肝炎和/或肝硬化。
进一步地,所述化合物通过调节免疫应答来治疗和/或预防与肝炎病毒相关的疾病或病症。优选地,所述免疫应答涉及对肝炎病毒(包括但不限于,甲型肝炎病毒、乙型肝炎病毒和丙型肝炎病毒,特别是乙型肝炎病毒)的特异性t细胞应答。更优选地,所述免疫应答涉及cd4+t细胞和cd8+t细胞中ifnγ、tnfα、il-2的分泌。
在本发明的第二方面,涉及双二氮杂双环化合物在制备用于治疗和/或预防,或者消除和/或缓解与肝炎病毒相关的疾病或病症的药物中的用途。
进一步地,所述化合物是如上述定义的化合物。更进一步地,所述药物还包括已知治疗肝炎病毒,特别是hbv的药物,所述药物包括但不限于:ifnα-2a、birinapant、抗-pd1抗体、聚乙二醇干扰素α2b、聚乙二醇干扰素α2a、拉米夫定、阿德福韦、恩替卡韦和/或替诺福韦(特别是,富马酸替诺福韦酯)。
进一步地,所述与肝炎病毒相关的疾病或病症是与感染肝炎病毒晚期相关的疾病或病症;所述与肝炎病毒相关的疾病或病症是与甲型肝炎病毒、乙型肝炎病毒或丙型肝炎病毒相关的疾病或病症;优选地,所述与肝炎病毒相关的疾病或病症包括但不限于:甲型肝炎、乙型肝炎、丙型肝炎和/或肝硬化。
进一步地,所述药物通过调节免疫应答来治疗和/或预防与肝炎病毒相关的疾病或病症。优选地,所述免疫应答涉及对肝炎病毒(包括但不限于,甲型肝炎病毒、乙型肝炎病毒和丙型肝炎病毒,特别是乙型肝炎病毒)的特异性t细胞应答。更优选地,所述免疫应答涉及cd4+t细胞和cd8+t细胞中ifnγ、tnfα、il-2的分泌。
在本发明的第三方面,涉及双二氮杂双环化合物用于治疗和/或预防,或者消除和/或缓解与肝炎病毒相关的疾病或病症的方法,所述方法包括对患有与肝炎病毒相关的疾病或病症的患者施用治疗和/或预防有效量的所述化合物。
进一步地,所述化合物是如上述定义的化合物。更进一步地,所述化合物可以进一步与已知治疗肝炎病毒,特别是hbv的药物组合使用,所述已知治疗肝炎病毒,特别是hbv的药物包括但不限于:聚乙二醇干扰素α2b、聚乙二醇干扰素α2a、拉米夫定、阿德福韦(特别是,阿德福韦酯)、恩替卡韦和/或替诺福韦(特别是,富马酸替诺福韦酯)。
进一步地,所述化合物与已知治疗肝炎病毒,特别是hbv的药物组合使用中,所述化合物与所述已知治疗肝炎病毒,特别是hbv的药物可以一起同时,分开并按先后顺序施用。
进一步地,所述与肝炎病毒相关的疾病或病症是与感染肝炎病毒晚期相关的疾病或病症;所述与肝炎病毒相关的疾病或病症是与甲型肝炎病毒、乙型肝炎病毒或丙型肝炎病毒相关的疾病或病症;优选地,所述与肝炎病毒相关的疾病或病症包括但不限于:甲型肝炎、乙型肝炎、丙型肝炎和/或肝硬化。
进一步地,所述化合物通过调节免疫应答来治疗和/或预防与肝炎病毒相关的疾病或病症。优选地,所述免疫应答涉及对肝炎病毒(包括但不限于,甲型肝炎病毒、乙型肝炎病毒和丙型肝炎病毒,特别是乙型肝炎病毒)的特异性t细胞应答。更优选地,所述免疫应答涉及cd4+t细胞和cd8+t细胞中ifnγ、tnfα、il-2的分泌。
在本发明的第四方面,涉及含有双二氮杂双环化合物的药物组合物,所述药物组合物用于治疗和/或预防,或者消除和/或缓解与肝炎病毒相关的疾病或病症。
进一步地,所述双二氮杂双环化合物是如上定义的化合物。更进一步地,所述药物组合物还包括已知治疗肝炎病毒,特别是hbv的药物,所述药物包括但不限于:干扰素α2b、干扰素α2a、拉米夫定、阿德福韦(特别是,阿德福韦酯)、恩替卡韦和/或替诺福韦(特别是,富马酸替诺福韦酯)。
进一步地,所述与肝炎病毒相关的疾病或病症是与感染肝炎病毒晚期相关的疾病或病症;所述与肝炎病毒相关的疾病或病症是与甲型肝炎病毒、乙型肝炎病毒或丙型肝炎病毒相关的疾病或病症;优选地,所述与肝炎病毒相关的疾病或病症包括但不限于:甲型肝炎、乙型肝炎、丙型肝炎和/或肝硬化。
进一步地,所述化合物通过调节免疫应答来治疗和/或预防与肝炎病毒相关的疾病或病症。优选地,所述免疫应答涉及对肝炎病毒(包括但不限于,甲型肝炎病毒、乙型肝炎病毒和丙型肝炎病毒,特别是乙型肝炎病毒)的特异性t细胞应答。更优选地,所述免疫应答涉及cd4+t细胞和cd8+t细胞中ifnγ、tnfα、il-2的分泌。
具体实施方式
下面的实施例用于进一步描述本发明,但其不意味着对本发明的任何限制。
实施例1.化合物1单药注射对paav-hbv1.2质粒高压尾静脉注射的c57bl/6j小鼠模型体内hbv的影响
1.1实验方法
使用paav-hbv1.2质粒高压尾静脉注射c57bl/6j小鼠建立慢性hbv感染小鼠模型,模拟可自发获得免疫控制的慢性乙型肝炎患者。选取雄性c57/b6小鼠(周龄6-8w,体重20±2g)构建高压尾静脉注射小鼠模型,用75%酒精擦拭小鼠尾部,再用远红外理疗仪照射2~3min,使小鼠尾静脉充盈清晰可见。沿着尾静脉平行进针,可感觉到落空感或见回血,表明已进入静脉,然后轻推注射在10s内完成。每只小鼠注射10μgpaav/hbv1.2质粒,注射液体(pbs)的量为体重的10%(2ml/20g)。注射后第14天采血检测hbsag,筛选hbsag>500iu/ml的造模成功小鼠进行下一步实验(huang,wuetal.2006;chou,chienetal.2015)。c57bl/6j小鼠建模成功后,分为4组,0.9%nacl生理盐水静脉注射组(图1a和1b中第1组,黑色线条)、化合物110mg/kg静脉注射组(图1a和1b中第2组,红色线条)、化合物120mg/kg静脉注射组(图1a和1b中第3组,蓝色线条)。每组6-8只小鼠,每周给药1次,连续4次,观察7周。
小鼠血清用pbs20倍稀释后,美国雅培i2000sr微粒子化学发光自动检测仪检测血清中hbsag和hbeag滴度。血清hbvdna通过qiaampdnaminikit(qiagen)提取,使用dnaamplificationsybrgreenkit(roche)通过realtime-pcr(lightcycler480,roche)定量血清中hbvdna水平,利用一系列浓度梯度的hbv质粒psm2作为标准品。本实验中用到的hbv引物由英潍捷基(上海)贸易有限公司合成,引物序列如下:hbvhope-f(5’至3’tactaggaggctgtaggcata)和hbvhope-r(5’至3’ggagactctaaggcttccc)。小鼠肝组织常规福尔马林固定-石蜡包埋、4μm切片,65℃烤片2h,常规乙醇梯度脱水,过氧化氢室温浸润30min,pbs清洗5min/次,洗3次,室温封闭1h,加入兔抗人hbcag(b0586,dako)室温于湿盒中孵育1h,用gtvisionⅲ免疫组化检测试剂盒抗兔抗鼠通用型(gk50075,上海基因科技公司)孵育二抗和显色,在普通光学正置显微镜拍片,放大倍数200x。称量60mg肝组织匀浆,加入900μl裂解液(50mmol/ltris-hclph7.5+1mmol/ledta)冰上放置,所有样品处理后再加入5ulnp-10冰上裂解,用苯酚/氯仿萃取肝组织中hbvdna,加15ulrnasefreewater溶解,1%琼脂糖凝胶跑电泳,转膜,后加地高辛标记的全长hbv探针,46℃过夜,digwashingbuffer5min1次,加入anti-digoxigenin-apfabfragment(11093274910,roche),用imagequantlas4000mini曝光检测。
采用graphpadprism5.0作图及相关统计学分析,同一时间点各组间多重比较使用kruskal-wallish检验和dunn'smultiplecomparison检验,血清中hbsag和hbvdna清除率比较使用log-rankmantel-cox检验,*代表p<0.05,**代表p<0.01,***代表p<0.001。其中,p<0.05被认为具有统计学显著性差异。
1.2实验结果
如附图1所示,与生理盐水注射对照组相比,化合物1注射组在给药后血清hbsag(fig.1a)和血清hbvdna(fig.1b)均快速下降,至第7周,血清中hbsag与hbvdna均位于检测线以下。其中化合物120mg/kg注射组第五周即可完全清除血清hbsag和hbvdna,要快于化合物110mg/kg剂量组。肝组织hbcag免疫组化染色显示,给药7周后化合物1注射组小鼠肝内均未观察到hbcag表达,然而生理盐水对照组部分小鼠仍然可以检测到肝内hbcag的表达(fig.1c)。给药7周后肝组织中hbvdnasouthernblot显示,与生理盐水组对比,化合物1注射组的肝组织中未检测到hbv复制中间体(fig.1d)。
以上结果证实,连续4次化合物120mg/kg静脉注射可以在第5周完全清除慢性hbv感染小鼠模型外周血中hbsag和hbvdna,肝内hbcag表达和hbv复制中间体亦完全清除。所述结果表明,化合物1可以完全清除慢性hbv感染者体内的病毒抗原与核酸产物。(*,p<0.05;**,p<0.01)。
实施例2.化合物1联合富马酸替诺福韦酯(tdf)给药对paav-hbv1.2质粒高压尾静脉注射的c57bl/6j小鼠模型体内hbv影响
2.1实验方法
使用paav-hbv1.2质粒高压尾静脉注射c57bl/6j小鼠建立模型。c57bl/6j小鼠(周龄6-8w,体重20±2g)建模成功后分为4组,0.9%nacl静脉注射组(图2a和2b中第1组,黑色线条)、化合物110mg/kg静脉注射组(图2a和2b中第2组,红色线条)、tdf53mg/kg灌胃组(图2a和2b中第3组,蓝色线条)、化合物110mg/kg联合tdf53mg/kg给药组(图2a和2b中第4组,紫色线条)。每组6-8只小鼠,化合物1每周注射1次,连续4次,tdf每天灌胃给药,总计10天,观察7周。血清学hbsag、hbvdna检测方法同上。
2.2实验结果
如附图2所示,在血清hbsag的清除率上(fig.2a),化合物1单药和化合物1联合tdf两实验组与对照组相比,血清hbsag的清除率有统计学显著差异,且化合物1联合tdf组与单用化合物1组或者单用tdf组相比,可以更快清除血清中hbsag,并且有统计学显著差异。以上结果说明化合物1联合tdf可以协同清除血清中hbsag。在血清hbvdna的清除率方面(fig.2b),化合物1、tdf和化合物1联合tdf三个实验组与对照组相比均有统计学显著差异,并且化合物1联合tdf组比单用tdf组或者单用化合物1组更快清除血清中hbvdna。
以上结果表明,化合物1联合tdf用药可以更快促进血清中hbvdna的清除,从而发挥抗病毒的协同效应。(*,p<0.05;**,p<0.01;***,p<0.001)。
实施例3.化合物1对hbv感染的小鼠肝细胞细胞凋亡的影响
3.1实验方法
分别使用paav-hbv1.2质粒高压尾静脉注射或重组病毒raav8-1.3hbv注射c57bl/6j小鼠(周龄6-8w,体重20±2g)建立慢性hbv感染小鼠模型。在paav-hbv1.2质粒高压尾静脉注射的c57bl/6j小鼠建模成功后,静脉注射化合物110mg/kg,收集注射后12h、24h、48h小鼠血清和肝组织。通过谷草转氨酶(ast/got)测试盒(南京建成,c010-2)和谷丙转氨酶(alt/gpt)测试盒(南京建成,c009-2)检测血清中alt和ast水平。通过westernblot检测肝组织内ciaps分子的表达,β-actin设为对照。肝内炎症与肝细胞坏死采用肝组织切片he染色方法检测。利用raav8-1.3hbv(ayw)病毒通过常规尾静脉注射c57bl/6j小鼠,病毒注射量为5×105v.g./只(yang,liuetal.2014),建立raav8-hbv1.3病毒注射c57bl/6j小鼠模型,静脉注射化合物120mg/kg后12h处死,hbcag免疫荧光和tunnel法双染检测hbv感染肝细胞凋亡。
3.2实验结果
如附图3所示,化合物1注射后,血清中反映肝细胞损伤的转氨酶alt和ast均有一过性增加,在12h升到最高值,然后再缓慢下降,在48h左右恢复至正常水平(fig.3a)。通过westernblot检测肝内iaps分子发现,化合物1在肝组织中对ciap2有强烈的抑制作用,12h最强;对ciap1亦有抑制效应,但要明显弱于ciap2;对xiap并未观察到显著抑制作用(fig.3b)。肝组织he染色亦显示,注射后12h,肝组织内汇管区附近出现了散在的坏死灶,同时伴随有淋巴细胞浸润(fig.3c)。通过tunel染色和hbcag荧光双染实验观察hbv感染肝细胞凋亡情况,结合双染3d图片分析,发现注射化合物1后12h可以诱导hbcag阳性的肝细胞发生凋亡(fig.3d)。
以上结果提示,化合物1可以特异性诱导hbv感染的肝细胞发生凋亡,有助于病毒的清除,且其仅诱导一过性的肝内炎症,不会导致暴发性肝炎,减少治疗可能引起相关的不良反应。
实施例4.化合物1对小鼠体内hbv免疫应答的影响
4.1实验方法
使用paav-hbv1.2质粒高压尾静脉注射c57bl/6j小鼠(周龄6-8w,体重20±2g)建立慢性hbv感染小鼠模型。建模成功后分为两组:a组:0.9%nacl生物盐水注射组;b组:化合物120mg/kg注射组。每组5-6只小鼠,每周给药1次,连续4次,第7周时处死,分离小鼠肝脏淋巴细胞,细胞计数及流式细胞术检测肝脏内淋巴细胞cd4、cd8分子的表达。hbv特异性t细胞应答的检测利用hbv核心单肽(core93-100)刺激淋巴细胞,流式细胞仪细胞因子胞内染色法检测分泌ifnγ、tnfα、il-2的cd4+和cd8+t细胞频数。
4.2实验结果
如附图4所示,化合物1治疗组小鼠肝内病毒清除后,肝内总淋巴细胞数显著高于生理盐水对照组(fig.4a)。进一步分析发现,与对照相比,肝内浸润的cd4+t细胞和cd8+t细胞的频数均显著增加(fig.4b);采用hbv核心单肽(core93-100)刺激后,cd4+t细胞分泌ifnγ、tnfα、il-2的细胞频数显著增加(fig.4c),cd8+t细胞分泌ifnγ、tnfα、il-2的细胞频数显著增加(fig.4d)。
以上结果表明,通过化合物1治疗,清除病毒后,肝内针对hbv的特异性t细胞应答功能显著增强,有利于病毒的清除。进一步地,化合物1可以通过上调hbv特异性t细胞应答,特异性诱导hbv感染的肝细胞发生凋亡,从而清除病毒抗原及其他病毒产物。
实施例5.化合物1联合ifnα2a给药在慢性hbv感染的c57bl/6j小鼠模型中抗乙肝病毒的作用
5.1实验方法
利用paav-hbv1.2质粒和pkcmvintifnα-2a质粒或pkcmvint对照质粒(6ug/只)混合后高压尾静脉注射c57bl/6j小鼠(周龄6-8w,体重20±2g)建立慢性hbv感染小鼠模型并表达ifnα2a。建模1天后分为四组,a组(0.9%生理盐水注射组):paav-hbv1.2+pkcmvint+0.9%nacl;b组(化合物110mg/kg静脉注射组):paav-hbv1.2+pkcmvint+化合物110mg/kg;c组(ifnα-2a组):paav-hbv1.2+pkcmvintifnα-2a+0.9%nacl;d组(化合物1联合ifnα-2a组):paav-hbv1.2+pkcmvintifnα-2a+apg10mg/kg。每组5只小鼠(其中d组7只)。连续给药三次,分别为建模后第1天,建模后第7天和第14天,给药前一天眶缘采血一次,利用罗氏601仪器检测血清hbsag/hbeag水平。
5.2实验结果
如图5a和5b所示,在建模后第7、14及21天,不同治疗组间血清hbsag及hbeag水平都具有统计学差异。如图5a所示,b组、c组、d组与a组,三组不同药物组间血清hbsag在第7、14及21天具有统计学差异,即在第7天p值为0.010、第14天p值为0.008、第21天p值为0.004,p值小于0.05即表示组间具有统计学差异。其中联合治疗组d组血清hbsag下降最为显著。在第21天,与c组相比,b组和d组血清下降显著,p值均为0.008,即c组与b组比较其p值为0.008,c组与d组比较其p值为0.008(两者单独比较的p值未在图中表示出)。如图5b所示,b组、c组、d组与a组,三组不同药物组间血清hbeag在第7、14及21天具有统计学差异,即在第7天p值为0.004、第14天p值为0.021、第21天p值为0.001,p值小于0.05即表示组间具有统计学差异。其中联合治疗组d组血清hbeag下降最为显著。在第21天,与c组和b组相比,d组血清下降显著,p值均为0.008,即d组与b组比较其p值为0.008,d组与c组比较其p值为0.008(两者单独比较的p值未在图中表示出)。
以上结果表明,化合物1与ifnα2a联合组降低hbsag/hbeag作用最为明显。因此,化合物1与ifnα2a联合组在paav-hbv1.2质粒和pkcmvintifnα-2a质粒或pkcmvint对照质粒混合后高压尾静脉注射c57bl/6j小鼠建立的慢性hbv感染小鼠模型中具有抗乙肝病毒作用。
实施例6.化合物1和birinapant在paav-hbv1.2质粒高压尾静脉注射建立的慢性hbv感染c57bl/6j小鼠模型中抗乙肝病毒作用的比较
6.1实验方法
利用paav-hbv1.2质粒高压尾静脉注射c57bl/6j小鼠(周龄6-8w,体重20±2g)建立慢性hbv感染小鼠模型。建模成功后分为三组:a组:0.9%nacl生理盐水注射组;b组:化合物120mg/kg静脉注射组,c组:birinapant20mg/kg静脉注射组。其中,a组和b组每组7只小鼠,c组每组6只小鼠。化合物1与birinapant均为每周给药1次,连续给药五周,每周给药前进行眶缘采血,利用罗氏601仪器检测上清中hbsag/hbeag水平。
6.2实验结果
从血浆中hbsag和hbeag总体水平变化来看,如图6a所示,在hbsag的清除效果方面,化合物1静脉注射组与生理盐水注射组有统计学显著差异。如图6b所示在hbeag的清除效果方面,化合物1静脉注射组与birinapant组有统计学的显著差异(*,p<0.05)。
从血浆中hbsag和hbeag个体水平变化来看,如图6c所示,在药物治疗1周后,两个给药治疗组的药物血清hbsag水平显著下降,且化合物1组血清hbsag水平显著低于brinapant组(p=0.035)。
在给药4周后,化合物1组中86%的小鼠血清hbsag水平低于检测下限,而brinapant组中比例为57%,图6a已说明该数值(数据未显示)。
以上结果表明,就hbsag和hbeag的清除效果而言,化合物1均优于birinapant。因此,在同等给药剂量及给药方式上,化合物1的抗病毒效果优于birinapant。
实施例7.化合物1联合抗-pd1抗体给药在paav-hbv1.2质粒高压尾静脉注射建立的慢性hbv感染c57bl/6j小鼠模型中抗乙肝病毒的作用
7.1实验方法
利用paav-hbv1.2质粒高压尾静脉注射c57bl/6j小鼠(周龄6-8w,体重20±2g)建立慢性hbv感染小鼠模型。建模成功后分为四组:a组:0.9%nacl生理盐水注射组;b组:化合物120mg/kg静脉注射组,c组:抗-pd1抗体200ug/只/次腹腔注射组,d组:化合物1联合抗-pd1抗体组。其中,每组均为7只小鼠。化合物1每周静脉给药1次,抗-pd1抗体腹腔注射,每周给药2次。每周化合物1给药前进行眶缘采血,利用罗氏601仪器检测上清中hbsag/hbeag水平。
7.2实验结果
从血浆中hbsag和hbeag总体水平变化来看,如附图7a和7b所示,化合物1单药组和化合物1联合抗-pd1抗体给药组均可显著降低血清中hbsag/hbeag水平。抗-pd1抗体单药组无明显降低hbsag/hbeag作用。
从血浆中hbsag和hbeag个体水平变化来看,如图7c所示,b组、c组、d组与a组,三组不同药物组间血清hbsag在给药后第2、3及4周具有统计学差异,即在第2周p值为0.035、第3周p值为0.005、第4周p值为0.013,p值小于0.05即表示组间具有统计学差异。其中联合治疗组d组血清hbsag下降最为显著。在用药后第2和第3周,与c组相比,d组血清hbsag下降更为显著,p值分别为0.015和0.037(在第2周和第3周两者的单独比较的p值未在图中表示出)。如图7d所示,b组、c组、d组与a组,三组不同药物组间血清hbeag在给药后第1周和第2周具有统计学差异,即在第1周p值为0.029、第2周p值为0.009,p值小于0.05即表示组间具有统计学差异。在用药后第1周和第2周,与c组相比,b组和d组血清hbeag下降更为显著,在第1周p值分别为0.016和0.007,在第2周p值分别为0.007和0.002(在第1周和第2周两者的单独比较的p值未在图中表示出),但b组和d组之间无统计学差异。
以上结果表明,化合物1和化合物1联合抗-pd1抗体给药在paav-hbv1.2质粒高压尾静脉注射建立的慢性hbv感染c57bl/6j小鼠模型中具有抗乙肝病毒的作用。
实施例8.化合物1与sf18在raav8-hbv1.3(ayw)病毒尾静脉注射的c57bl/6j小鼠模型中抗乙肝病毒作用
8.1实验方法
利用raav8-hbv1.3(ayw)病毒通过常规尾静脉注射c57bl/6j小鼠,病毒注射量为5×105v.g./只(yang,liuetal.2014),建立raav8-hbv1.3病毒注射c57bl/6j小鼠模型。建模成功后分为三组,a组:0.9%nacl生理盐水注射组;b组:化合物120mg/kg静脉注射组,c组:sf1820mg/kg静脉注射组。其中,每组均为3只小鼠。连续给药四周,每周眶缘采血一次,利用罗氏601仪器检测上清中hbsag/hbeag水平。
8.2实验结果
如图8a和8b所示,sf18用药组小鼠血清中hbsag/hbeag下降速度显著快于化合物1用药组,但是在第二周和第四周sf18给药时,分别出现了一只小鼠死亡。
以上结果表明,化合物1与sf18均具有抗乙肝病毒作用,其中sf18抗hbv病毒效应强于化合物1。
参考文献:
bertoletti,a.andc.ferrari(2012)."innateandadaptiveimmuneresponsesinchronichepatitisbvirusinfections:towardsrestorationofimmunecontrolofviralinfection."gut61(12):1754-1764.
chou,h.h.,w.h.chien,l.l.wu,c.h.cheng,c.h.chung,j.h.horng,y.h.ni,h.t.tseng,d.wu,x.lu,h.y.wang,p.j.chenandd.s.chen(2015)."age-relatedimmuneclearanceofhepatitisbvirusinfectionrequirestheestablishmentofgutmicrobiota."procnatlacadsciusa112(7):2175-2180.
europeanassociationforthestudyofthe,l.(2012)."easlclinicalpracticeguidelines:managementofchronichepatitisbvirusinfection."jhepatol57(1):167-185.
gish,r.g.,b.d.given,c.-l.lai,s.a.locarnini,j.y.n.lau,d.l.lewisandt.schluep(2015)."chronichepatitisb:virology,naturalhistory,currentmanagementandaglimpseatfutureopportunities."antiviralresearch121:47-58.
guidotti,l.g.,d.inverso,l.sironi,p.dilucia,j.fioravanti,l.ganzer,a.fiocchi,m.vacca,r.aiolfi,s.sammicheli,m.mainetti,t.cataudella,a.raimondi,g.gonzalez-aseguinolaza,u.protzer,z.m.ruggeri,f.v.chisari,m.isogawa,g.sitiaandm.iannacone(2015)."immunosurveillanceoftheliverbyintravasculareffectorcd8(+)tcells."cell161(3):486-500.
guidotti,l.g.,r.rochford,j.chung,m.shapiro,r.purcellandf.v.chisari(1999)."viralclearancewithoutdestructionofinfectedcellsduringacutehbvinfection."science284(5415):825-829.
hoh,a.,m.heeg,y.ni,a.schuch,b.binder,n.hennecke,h.e.blum,m.nassal,u.protzer,m.hofmann,s.urbanandr.thimme(2015)."hepatitisbvirus-infectedhepg2hntcpcellsserveasanovelimmunologicaltooltoanalyzetheantiviralefficacyofcd8+tcellsinvitro."jvirol89(14):7433-7438.
huang,l.r.,h.l.wu,p.j.chenandd.s.chen(2006)."animmunocompetentmousemodelforthetoleranceofhumanchronichepatitisbvirusinfection."procnatlacadsciusa103(47):17862-17867.
liaw,y.f.,n.leung,j.h.kao,t.piratvisuth,e.gane,k.h.han,r.guan,g.k.lau,s.locarniniandb.g.w.p.o.t.a.-p.
a.f.t.s.o.t.l.chronichepatitis(2008)."asian-pacificconsensusstatementonthemanagementofchronichepatitisb:a2008update."hepatolint2(3):263-283.
liu,j.,h.i.yang,m.h.lee,s.n.lu,c.l.jen,r.batrla-utermann,l.y.wang,s.l.you,c.k.hsiao,p.j.chen,c.j.chenandr.e.v.e.a.l.h.s.group(2014)."spontaneousseroclearanceofhepatitisbseromarkersandsubsequentriskofhepatocellularcarcinoma."gut63(10):1648-1657.
lok,a.s.andb.j.mcmahon(2009)."chronichepatitisb:update2009."hepatology50(3):661-662.
lucifora,j.andc.trepo(2015)."hepatitis:afterhcvcure,hbvcure?"natrevgastroenterolhepatol12(7):376-378.
lucifora,j.,y.xia,f.reisinger,k.zhang,d.stadler,x.cheng,m.f.sprinzl,h.koppensteiner,z.makowska,t.volz,c.remouchamps,w.m.chou,w.e.thasler,n.huser,d.durantel,t.j.liang,c.munk,m.h.heim,j.l.browning,e.dejardin,m.dandri,m.schindler,m.heikenwalderandu.protzer(2014)."specificandnonhepatotoxicdegradationofnuclearhepatitisbviruscccdna."science343(6176):1221-1228.
nassal,m.(2015)."hbvcccdna:viralpersistencereservoirandkeyobstacleforacureofchronichepatitisb."gut64(12):1972-1984.
sundaram,v.andk.kowdley(2015)."managementofchronichepatitisbinfection."bmj351:h4263.
wong,d.k.,w.k.seto,j.fung,p.ip,f.y.huang,c.l.laiandm.f.yuen(2013)."reductionofhepatitisbsurfaceantigenandcovalentlyclosedcirculardnabynucleos(t)ideanaloguesofdifferentpotency."clingastroenterolhepatol11(8):1004-1010e1001.
yang,d.,l.liu,d.zhu,h.peng,l.su,y.x.fuandl.zhang(2014)."amousemodelforhbvimmunotoleranceandimmunotherapy."cellmolimmunol11(1):71-78.
- 还没有人留言评论。精彩留言会获得点赞!