BnCER1-2基因在促进油菜角质层烷类合成和抗旱性中的应用的制作方法
本发明属于dna重组技术领域,尤其涉及一种bncer1-2基因在促进油菜角质层烷类合成和抗旱性中的应用。
背景技术:
目前,业内常用的现有技术是这样的:油菜是我国重要的油料作物之一,经济价值高。我国油菜产业每年可生产约450万吨菜籽油,占我国自产植物油总量41%以上,占国内植物油消费量19.7%,在国内食用油市场中具有举足轻重的地位。此外,油菜产业还为饲料产业每年提供600多万吨的高蛋白饲用饼粕。但长期以来,油菜生产已经无法满足国内的消费需求,大量的缺口只能依靠从国外进口。因此提高产量是我国油菜研究在未来相当长一段时间内的重心。油菜在生长的过程中常会遇到一些影响产量的不利环境因素,如干旱、低温、渍水等。这些外界因素很难克服,易造成油菜严重倒伏,菌核病大量发生。因此,筛选出耐旱、抗病、抗倒伏的基因性品种,对于实现油菜高产稳产具有重要意义。植物对干旱胁迫能够产生一定的响应,当外界环境的刺激传递到植物体后,其体内会产生一系列响应信号,以调节其对干旱胁迫的适应性。例如,气孔关闭和渗透系数的调节等。随着分子生物学的发展,我国油菜抗旱性研究方向不再只停留在传统育种的研究层面上,研究者们开始探索用基因工程手段选育新型高抗或多抗植物品种。人们相继发现并克隆出了一些重要的耐旱基因,这些耐旱相关基因主要用于增加目标植物中的渗透调节物质(如脯氨酸和甜菜碱)或增强植物对活性氧自由基的清除能力(如过氧化物酶pod等)。
角质层是植物与外界环境的第一层屏障,其中疏水的蜡质层在植物生长发育以及抵御逆境胁迫中起着重要作用,例如,可防止植物体内水分丧失、减少短波辐射以及保护叶片免受积聚灰尘和菌类致死孢子的影响。甘蓝型油菜叶角质层蜡质主要由长链脂肪酸(c>18)和由长链脂肪酸衍生而来的醛、一级醇、二级醇、烷、酮、酯等组成,其中烷类物质是其最主要的蜡质组份,占其叶片蜡质总量的80%左右。非极性的烷类物质在限制植物水分散失中起重要作用,但表皮烷类对甘蓝型油菜抗旱性的贡献还未研究,也没有任何通过转基因分子育种促进烷类合成增强油菜抗(耐)逆性的报道。蒺藜苜蓿乙烯响应类型转录因子wxp1在拟南芥中超表达时,促进c29、c31和c33烷类的合成,转基因植株表现出耐旱性增强(zhangetal.,2007)。cer1在拟南芥中超表达显著增加了蜡质中奇数碳链烷与支链烷烃的含量,并表现出角质层渗透性减小、对土壤水分缺乏不敏感等(bourdenxetal.,2011)。这表明cer1所调控的烷类物质合成与对干旱胁迫的响应有关。本研究从油菜中分离cer1基因,并通过转基因过表达研究明确cer1在油菜烷类物质合成与抗旱性中的功能,这为提高油菜的抗旱性提供了备选基因和可行方法。
综上所述,现有技术存在的问题是:关于表皮烷类对甘蓝型油菜抗旱性的贡献还不明确,也没有任何通过转基因分子育种促进烷类合成增强油菜抗旱性的报道。
解决上述技术问题的难度和意义:由于植物的抗旱性是数量性状,由多基因控制,具体到哪种植物适合哪种基因还有待于进一步研究确定。本技术难点在于通过遗传转化分析目标基因在油菜烷类物质合成与抗旱性中的功能,开发出能够提高油菜蜡烷含量、增强植株抗旱性的备选基因,这将为提高植物抗旱性提供了新的有效选择和可行方法,具有良好的应用前景。
技术实现要素:
针对现有技术存在的问题,本发明提供了一种bncer1-2基因在促进油菜角质层烷类合成和抗旱性中的应用。
本发明是这样实现的,一种bncer1-2基因,所述bncer1-2基因的核苷酸序列seqidno:1,序列全长为1887bp。;编码的氨基酸序列为seqidno:2。
本发明的另一目的在于提供一种包含所述bncer1-2基因的重组载体。
本发明的另一目的在于提供一种利用所述bncer1-2基因提高抗旱性的方法,所述bncer1-2基因提高抗逆性的方法包括以下步骤:
以拟南芥cer1基因为探针,在甘蓝型油菜中克隆促进蜡烷合成、提高植物抗旱性的bncer1-2基因,核苷酸序列如seqidno:1所示;
构建bncer1-2的过表达载体,并将该载体转化到农杆菌中;
通过农杆菌介导的方法转化甘蓝型油菜,筛选得到bncer1-2的转基因过表达纯合体植株;
对过表达转化植株进行表型分析及抗旱性分析。
本发明的另一目的在于提供一种包含所述重组载体的转基因植物。
本发明的另一目的在于提供一种所述重组载体在促进植物蜡烷合成、提高植物抗旱性中的应用。
本发明的另一目的在于提供一种所述bncer1-2基因在促进植物蜡烷合成、提高植物抗旱性中的应用。
本发明的另一目的在于提供一种利用包含所述重组载体转化植物细胞促进表皮烷类生物合成的方法。
本发明的另一目的在于提供一种利用包含所述重组载体生产表皮烷含量增加的转基因植物的方法,以及生产的表皮烷类含量增加的植物和种子。
综上所述,本发明的优点及积极效果为:本发明公开了甘蓝型油菜bncer1-2基因在提高植物角质层烷类物质含量与抗旱性的方法与用途。在本发明的实施例中,实验证明转入了bncer1-2基因的油菜植株叶片烷类物质含量增加了12.01%—48.04%,其中c29烷、c31烷含量与对照相比分别增加了6.09%和190%。本发明实验结果还表明,转bncer1-2基因的油菜叶片烷类含量的增加导致叶角质层水分损失率降低33.5%,植株抗旱性也因此得到增强,这为提高植物抗旱性提供了新的有效选择和可行方法,具有良好的应用前景。
附图说明
图1是本发明实施例提供的bncer1-2基因在促进油菜角质层烷类合成方法流程图。
图2是本发明实施例提供的bncer1-2基因在甘蓝型油菜不同组织器官中的表达模式图。
图3是本发明实施例提供的bncer1-2基因在有蜡粉材料中双11与无蜡粉材料nowax茎、叶中的差异表达模式图。
图4为植物过表达载体结构图。其中,a为pcambia2301m1dpb载体示意图;b为pcambia-35s-bnkcs1-2载体示意图。
图5是本发明实施例提供的bncer1-2转基因油菜的pcr鉴定结果示意图。
图6是本发明实施例提供的bncer1-2基因过表达与对照植株基因定量分析示意图。
图7是本发明实施例提供的bncer1-2基因过表达与对照植株叶片表皮蜡质晶体结构比较示意图;
图中:a:中双11;b:过表达植株cer1-2ox7-1;标尺=10μm。
图8是本发明实施例提供的bncer1-2基因过表达株系cer1-2ox7与对照植株叶片角质层蜡质组份与含量分析示意图。
图9是本发明实施例提供的bncer1-2基因过表达株系cer1-2ox7与对照植株叶角质层水分损失率比较示意图。
具体实施方式
为了使本发明的目的、技术方案及优点更加清楚明白,以下结合实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。
本发明公开了甘蓝型油菜bncer1-2基因在提高植物角质层烷类含量及抗旱性中的用途,具体涉及包含bncer1-2的dna分子、载体、该基因编码的蛋白质及相关的转化细胞和转基因植物,还涉及所述基因在提高植物角质层烷类含量和抗旱性中应用和培养相关转基因植物的方法。
下面结合附图对本发明的应用原理作详细的描述。
本发明实施例提供的bncer1-2基因的核苷酸序列seqidno:1;编码的氨基酸序列为seqidno:2。
克隆bncer1-2基因的引物,其核苷酸序列如下:
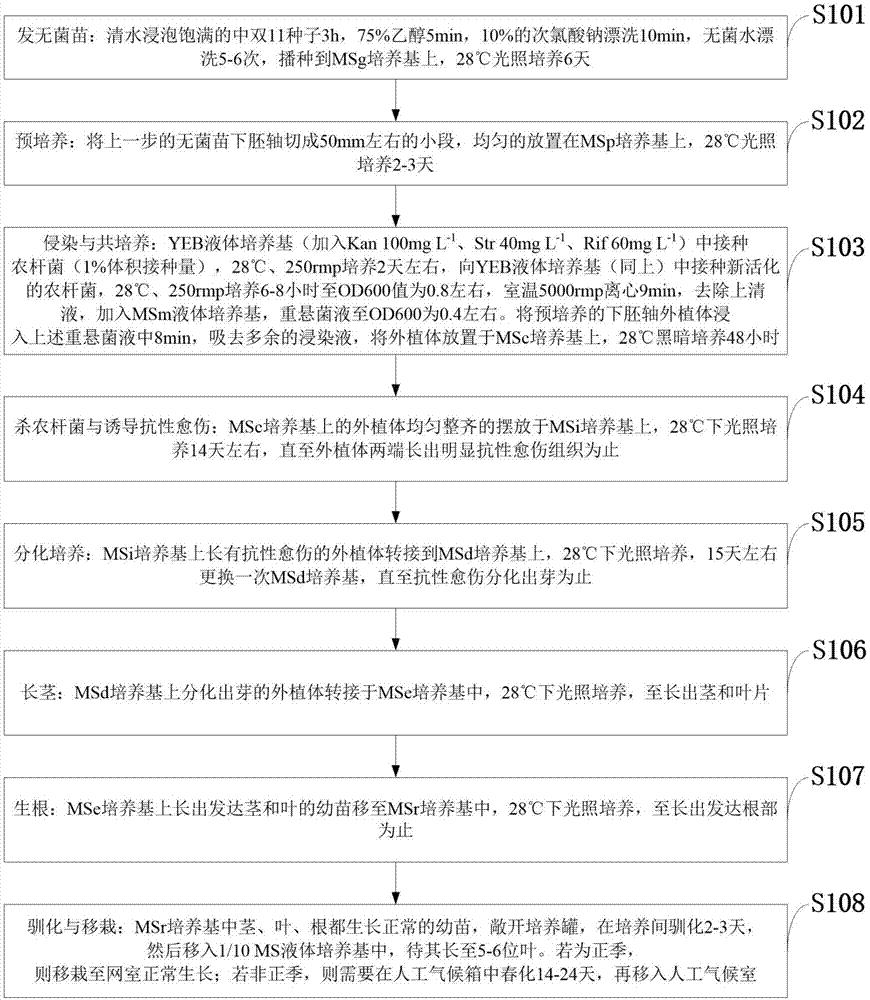
如图1所示,本发明实施例提供的bncer1-2基因在促进油菜角质层烷类合成方法包括以下步骤:
s101:发无菌苗:清水浸泡饱满的中双11种子3h,75%乙醇5min,10%的次氯酸钠漂洗10min,无菌水漂洗5-6次,播种到msg培养基上,28℃光照培养6天;
s102:预培养:将上一步的无菌苗下胚轴切成50mm左右的小段,均匀的放置在msp培养基上,28℃光照培养2-3天;
s103:侵染与共培养:yeb液体培养基(加入kan100mgl-1、str40mgl-1、rif60mgl-1)中接种农杆菌(1%体积接种量),28℃、250rmp培养2天左右,向yeb液体培养基(同上)中接种新活化的农杆菌,28℃、250rmp培养6-8小时至od600值为0.8左右,室温5000rmp离心9min,去除上清液,加入msm液体培养基,重悬菌液至od600为0.4左右。将预培养的下胚轴外植体浸入上述重悬菌液中8min,吸去多余的浸染液,将外植体放置于msc培养基上,28℃黑暗培养48小时;
s104:杀农杆菌与诱导抗性愈伤:msc培养基上的外植体均匀整齐的摆放于msi培养基上,28℃下光照培养14天左右,直至外植体两端长出明显抗性愈伤组织为止;
s105:分化培养:msi培养基上长有抗性愈伤的外植体转接到msd培养基上,28℃下光照培养,15天左右更换一次msd培养基,直至抗性愈伤分化出芽为止;
s106:长茎:msd培养基上分化出芽的外植体转接于mse培养基中,28℃下光照培养,至长出茎和叶片;
s107:生根:mse培养基上长出发达茎和叶的幼苗移至msr培养基中,28℃下光照培养,至长出发达根部为止;
s108:驯化与移栽:msr培养基中茎、叶、根都生长正常的幼苗,敞开培养罐,在培养间驯化2-3天,然后移入1/10ms液体培养基中,待其长至5-6位叶。若为正季,则移栽至网室正常生长;若非正季,则需要在人工气候箱中春化14-24天,再移入人工气候室。
下面结合具体实施例对本发明的应用原理作进一步的描述。
实施例1甘蓝型油菜bncer1-2基因的获得
1、核酸的提取及cdna的合成:
采用植物总rna提取试剂盒提取甘蓝型油菜中双11叶片的总rna,具体操作参照transgen试剂盒的说明书进行。以rna为模板,使用takara公司的primescripttmrtreagentkitwithgdnaeraser合成cdna第一链,操作参照所用试剂盒说明进行。
2、bncer1-2的pcr扩增:
以已知的拟南芥cer1为探针,在甘蓝型油菜基因组数据库中进行同源性blast分析,电子克隆得到2个编码序列,命名为bncer1-1和bncer1-2。根据电子克隆序列设计引物fbncer1与rbncer1(序列同上)。以中双11叶片cdna为模板,进pcr扩增,得到大小为1887bp的条带。50ul的扩增体系如下:
反应程序:94℃2min;94℃30s,58℃30s,72℃2min,30个循环;72℃10min;16℃10min。反应结束后,对目的片段进行胶回收,连接至pmd-19t载体,最后转化大肠杆菌感受态细胞,挑选阳性克隆子进行测序,获得bncer1-1和bncer1-2基因的编码区序列。bncer1-2基因编码区核苷酸序列以及编码的氨基酸序列如序列图seqidno:1所示。
实施例2油菜bncer1-2基因的表达分析
1、bncer1-2基因在油菜各组织器官中的表达分析
提取甘蓝型油菜中双11的各组织器官的总rna,然后反转录cdna(方法同实施例1),将合成的cdna第一链作为模板,采用实时定量试剂盒(bio-rad)进行表达分析。
荧光定量pcr所用上游引物为:5’-aacaaggtatggctgatgggagaa-3’,下游引物为:5’-gaattattaaagccggtggagtatgat-3’。
反应体系如下:
荧光定量pcr反应程序为:95℃30s;95℃10s,57℃30s,45个循环;65℃5s。actin7(at5g09810)作为检测表达量的内参基因,上游内参引物为:5’-gtgacaatggaactggaatggtga-3’,下游内参引物为:5’-gtgcctaggacgaccaacaatactc-3’。
荧光定量pcr结果(如图2所示)表明,bncer1-2主要在甘蓝型油菜地上部分器官茎、叶、花、角果中表达,在叶片中的表达量最高,这与蜡质在油菜地上部各组织器官的分布特征相一致,表明这个基因可能参与了甘蓝型油菜地上部分各组织器官的角质层蜡质的合成。
2、bncer1-2基因在油菜蜡质差异材料中的表达分析
提取甘蓝型油菜中双11和nowax的茎、叶rna,然后反转录cdna(方法同实施例1),将合成的cdna第一链作为模板,采用实时定量试剂盒(bio-rad)进行表达分析。荧光定量pcr所用的引物、pcr反应程序同上。
对蜡质沉积差异材料中的基因表达分析结果(如图3所示)显示,bncer1-2在有蜡粉材料的茎和叶中的表达量均显著高于无蜡粉材料,表明bncer1-2的转录水平与蜡质合成密切相关。
这个结果进一步说明bncer1-2基因在油菜蜡质沉积中具有重要作用。
实施例3bncer1-2基因的植物过表达载体的构建
用xmai和saci对上述经过测序验证后的bncer1-2序列从pmd-19t载体上切下来,同时用xmai和saci酶切植物表达载体pcambia2301m1dpb,然后利用t4连接酶将切下来的bncer1-2与pcambia2301载体骨架进行连接。该植物表达载体含有1套camv35s启动子控制nptii基因的植物表达元件、1套camv35s启动子控制报告基因gus的植物表达元件、1套mas启动子控制bar基因的植物表达元件和一套camv35s启动子控制目标基因的植物表达元件,可实现kan、gus和basta的三重标记筛选。在多克隆位点插入外源基因,可以实现外源基因的超量表达。构建成功的bncer1-2基因的重组植物过表达载体命名为pcambia-35s-bncer1-2(图4)。
实施例4甘蓝型油菜的遗传转化与检测
1.农杆菌介导的遗传转化
用冻融法将构建好的植物超表达载体导入农杆菌lba4404菌株,并利用农杆菌介导的下胚轴转化方法导入油菜。具体方法如下:
(1)发无菌苗:清水浸泡饱满的中双11种子3h,75%乙醇5min,10%的次氯酸钠漂洗10min,无菌水漂洗5-6次,播种到msg培养基上,28℃光照培养6天。
(2)预培养:将上一步的无菌苗下胚轴切成50mm左右的小段,均匀的放置在msp培养基上,28℃光照培养2-3天。
(3)侵染与共培养:yeb液体培养基(加入kan100mgl-1、str40mgl-1、rif60mgl-1)中接种含有bncer1-2植物过表达载体的农杆菌(1%体积接种量),28℃、250rmp培养2天左右,向yeb液体培养基(同上)中接种新活化的农杆菌,28℃、250rmp培养6-8小时至od600值为0.8左右,室温5000rmp离心9min,去除上清液,加入msm液体培养基,重悬菌液至od600为0.4左右。将预培养的下胚轴外植体浸入上述重悬菌液中8min,吸去多余的浸染液,将外植体放置于msc培养基上,28℃黑暗培养48小时。
(4)杀农杆菌与诱导抗性愈伤:msc培养基上的外植体均匀整齐的摆放于msi培养基上,28℃下光照培养14天左右,直至外植体两端长出明显抗性愈伤组织为止。
(5)分化培养:msi培养基上长有抗性愈伤的外植体转接到msd培养基上,28℃下光照培养,15天左右更换一次msd培养基,直至抗性愈伤分化出芽为止。
(6)长茎:msd培养基上分化出芽的外植体转接于mse培养基中,28℃下光照培养,至长出茎和叶片。
(7)生根:mse培养基上长出发达茎和叶的幼苗移至msr培养基中,28℃下光照培养,至长出发达根部为止。
(8)驯化与移栽:msr培养基中茎、叶、根都生长正常的幼苗,敞开培养罐,在培养间驯化2-3天,然后移入1/10ms液体培养基中,待其长至5-6位叶。若为正季,则移栽至网室正常生长;若非正季,则需要在人工气候箱中春化14-24天,再移入人工气候室。
遗传转化中所用培养基配方如下:
msg培养基:ms粉41.74gl-1,调ph值至5.8-6.0后定容至1l,121℃高温灭菌25min后备用。
msp培养基:ms粉41.74gl-1、2,4-d1mgl-1、6-ba1mgl-1,调ph值至5.8-6.0后定容至1l,121℃高温灭菌25min后备用。
msc培养基:ms粉41.74gl-1、2,4-d1mgl-1、6-ba1mgl-1、as50μm,调ph值至5.8-6.0后定容至1l,121℃高温灭菌25min,培养基温度降至70℃后加入50μmas备用。
msi培养基:ms粉41.74gl-1、2,4-d1mgl-1、6-ba1mgl-1、kan50mgl-1、cef500mgl-1,调ph值至5.8-6.0后定容至1l,121℃高温灭菌25min,培养基温度降至70℃后加入50mgl-1kan和500mgl-1cef备用。
msd培养基:ms粉41.74gl-1、zt2mgl-1、6-ba4mgl-1、kan50mgl-1、cef500mgl-1、agno35mgl-1,调ph值至5.8-6.0后定容至1l,121℃高温灭菌25min,培养基温度降至70℃后加入50mgl-1kan、5mgl-1agno3和500mgl-1cef备用。
mse培养基:ms粉41.74gl-1、6-ba0.05mgl-1、kan50mgl-1、cef300mgl-1,调ph值至5.8-6.0后定容至1l,121℃高温灭菌25min,培养基温度降至70℃后加入50mgl-1kan和300mgl-1cef备用。
msr培养基:ms粉41.74gl-1、iba5mgl-1、cef300mgl-1,调ph值至5.8-6.0后定容至1l,121℃高温灭菌25min,培养基温度降至70℃后加入300mgl-1cef备用。
2.转基因植株的检测
对获得的转基因植株进行阳性鉴定可分别采取组织化学染色鉴定与pcr扩增鉴定。
gus染液检测:剪取bncer1-2过表达转基因植株的一小块叶片,放入1.5ml离心管中,加入200μl的gus染液,37℃12h以上,至显蓝色,再用75%乙醇脱色后观察拍照。以含过表达pc2301-bncer1-2质粒的工程菌株作为阳性对照,以中双11叶片为阴性对照,以水为空白对照。转基因植株叶片gus染色后均变蓝色,阴性对照不变色。
过表达植株的pcr检测:提取过表达植株的gdna作为模板,采用引物组合fapha2(5’-taaagggaccacctatga-3’)和rapha2(5’-ggacgcagaaggcaat-3’)进行nptii标记基因扩增。pcr程序如下:94℃预变性5min,94℃变性30s,57℃复性30s,72℃延伸1min,30个循环后,72℃延伸10min,4℃10min。琼脂糖电泳检测结果显示,大多数转化植株均能够扩增出预期大小的条带(527bp),检测结果如图5所示。
实施例5检测bncer1-2基因在转基因油菜中的表达水平
按照实施例1中提取油菜rna的方法,提取转基因油菜和对照油菜叶片的总rna,并合成cdna一链。用荧光定量pcr方法分析转基因油菜中目的基因的表达。pcr体系与扩增程序与实施例2相同。荧光定量结果如图6所示,超表达转基因植株中bncer1-2基因的表达量显著上调,为对照的10-40倍。此结果说明已获得超量表达bncer1-2的转基因油菜植株。
实施例6bncer1-2转基因植株的叶片蜡质组份与结构分析
过表达转基因植株叶表皮蜡质结构分析:采相同环境下长势一致的转基因植株和未转化的中双11对照植株的第3片真叶,加入标本夹阴干,剪取相似位置的样品,于扫描电子显微镜(hitachis3000-n)下对其叶片表面进行观察。结果显示如图7所示,bncer1-2过表达转基因植株叶片表皮蜡质晶体结构增多,主要以杆状结构为主;zs11叶表皮蜡质晶体颗粒状为主,杆状晶体较少。
叶角质层蜡质分析:分别取对照植株和过表达转基因植株的叶片,计算叶面积后剪碎置于大试管中,加入10μlc24烷(浓度1μg/μl)作为内标,每次加入2ml氯仿于涡旋振荡器上涡旋30s,收集提取液,浸提2次。浸提液用氮吹仪45℃吹干,加入50μlbstfa(n,o-bis(trimethylsily)trifluoroa-cetamide,bstfa)和20μl吡啶70℃衍生45min,吹干衍生剂,产物溶于1000μl氯仿,备用。用气相色谱仪分析测定蜡质组分及含量进行分析,具体程序及参数设置如下:气相色谱(gc)毛细管柱长30m,直径0.32mm,液膜厚度0.25μm;氮气作为载气;进样量为1.0μl。柱膜和fid检测器的温度分别为300℃和320℃。程序升温方式:初始温度80℃,恒温时间0.1s,以每分钟15℃升至245℃,保持5min;然后以每分钟2℃升温至325℃,保持12min。蜡质量化基于fid峰值,根据质谱所鉴定的标准确定色谱中各种化学成分的出峰位置,用内标计算出植物叶片每平方厘米叶面积各蜡质组分的含量。叶面积利用imagej软件进行测定并记录。最终结果发现,过表达转基因和对照植株的蜡质组成主要由烷类、一级醇、次级醇、酸类、酮类、醛类和酯类组成。与对照相比,过表达转基因植株的烷烃的含量显著增加,酸类、醛类、次级醇、酮和酯类存在不同程度的减少(图8)。
实施例7bncer1-2转基因植株的叶角质层水分损失率分析
分别取对照植株和bncer1-2过表达转基因植株的叶片,于黑暗环境下冰蒸馏水浸泡4h,称重,作为叶片饱和重量。后将叶片放入20℃的培养箱(黑暗),每15min取出叶片称重一次,至数据趋于平稳后,将叶片70℃的烘箱中干燥24h,称干重。计算其失水率,水分损失率公式如下:水分损失率=(饱和重量–每个时间点的重量)/(饱和重量–干重)。分析结果发现,bncer1-2过表达转基因植株的水分损失率明显低于对照植株,表明bncer1-2过表达植株的角质层渗透性降低(如图9)。
实施例8转基因植株的抗旱性分析
分别对转bncer1-2油菜植株和对照植株进行干旱胁迫处理,停止浇水7天后,过表达植株轻度萎蔫,而对照植株严重萎蔫,停止浇水11天后,对照幼苗已停止生长,所有叶片均已干枯萎蔫,而过表达植株幼苗仍能生长,且保持有绿叶。干旱胁迫复水后,过表达植株恢复生长,而对照植株幼苗干枯接近死亡。表明过表达转基因植株较对照zs11相比抗旱性增强。
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明的保护范围之内。
序列表
<110>西南大学
<120>bncer1-2基因在促进油菜角质层烷类合成和抗旱性中的应用
<160>2
<170>siposequencelisting1.0
<210>1
<211>1887
<212>dna
<213>甘蓝型油菜(brassicanapusl.)
<400>1
atggctacgaaaccaggcatccccaccgattggccttggacaccccttgggaatttcaag60
tacatagtaatagcaccatgggcggtccatagcacatacaagtttgtgactgatgatccg120
gtggatctcggatactccctcgtattgcccttcttgctcttcagaattcttcacaaccag180
gtttggatctctctttcccgttactatacaaccaagggaaagagacgcatcctcgacaaa240
ggtatcgacttcaatcaggtcgacagggagaccaactgggatgaccaaatattgttcaac300
ggattgctgttctatatagggatcatgctgctgccgcaggcaaagcaacttccctggtgg360
aggacagacggagtgttgatggctgcgatgcttcatgccgggccggtggagttcctctat420
tattggctccacaaagctcttcaccaccactttctttactcccgctaccattcccaccac480
cactcctctatcgtcactgaacccatcacttcggtgatacatccattcgcggagcatata540
gcatacttcattcttttcgccataccattgttgacaacgttgttaacgaaaacggcatcc600
atagcgtcgttctccggatatgtaatctacatagacttcatgaacaacatgggacactgc660
aacttcgagctcgtccctaagcgccttttccacctctttcctccactcaagtacctctgc720
tacactccctcattccactcgctgcaccacacccaattccgaactaactactccctcttc780
atgcccttgtatgactacatctacggcacaatggatgaaacctcggatacattgtatgag840
aaatctctagaaagaggagaagatagagtggacgtcgtgcacttaactcacctgacgact900
cccgagtccatataccatttacggattggcttggcttcatttgcctcctaccccttctct960
tatagatggttcatgcgccttttgtggcctttcacatctctctccatgctcttcactctc1020
ttctacgccagcctctttgtctctgagagaaactctttcgagaagctcaacttgcagtct1080
tggatcatacccagatataatctgcagtacttgttaaaatggaggaaagacgcgatcaac1140
aacatgattgagaaagcgatactggaggcaaatgaaaaaggagtgaaggtgcttagcctg1200
ggtctcatgaaccaaggggaggagctaaacaggaatggagaggtgtatattcacaagcat1260
ccagaaatgaaagtaagagtggtggacggcagtagattaacagcagccgttgtgataaat1320
agtctacccaaatcaacgacaaaaatagtgatgacaggcaatctcacaaaggtggcatac1380
accatcgcctctgctctttgccagagaggtgttgaggtcttgactctattacctgaagag1440
tatgagaaactaagttcatttgttccaaaagaatgcagagaccgtttgatccttttaacc1500
tctgaaacactcgcatcaaacaaggtatggctgatgggagaaggaacaacgagaggggaa1560
caggaaatggccacaaaaggaacgttatttatcccattctcacagttccccctcaagcag1620
ttacgaagagattgtatctatcatactccaccggctttaataattccaaaatctctggtc1680
aatatccactcctgtgagaactggttaccgagaagggcgatgagtgcaactagagtggct1740
ggcatattgcacgccttagaaggatgggaaacgcatgagtgcggcacatccaatattctt1800
ctctcagatttggaccaagtgtgggaagcttgtctcagccacggcttccagcctctgctg1860
cttccacatcacttccaatacccctga1887
<210>2
<211>628
<212>prt
<213>甘蓝型油菜l.(brassicanapusl.)
<400>2
metalathrlysproglyileprothrasptrpprotrpthrproleu
151015
glyasnphelystyrilevalilealaprotrpalavalhisserthr
202530
tyrargphevalthraspaspprovalaspleuglytyrserleuval
354045
leupropheleuleupheargileleuhisasnglnvaltrpileser
505560
leuserargtyrtyrthrthrlysglylysargargileleuasplys
65707580
glyileasppheasnglnvalasparggluthrasntrpaspaspgln
859095
ileleupheasnglyleuleuphetyrileglyilemetleuleupro
100105110
glnalalysglnleuproleutrpargthraspglyvalleumetala
115120125
alametleuhisalaglyprovalglupheleutyrtyrtrpleuhis
130135140
lysalaleuhishishispheleutyrserargtyrhisserhishis
145150155160
hisserserilevalthrgluproilethrservalilehisprophe
165170175
alagluhisilealatyrpheileleuphealaileproleuleuthr
180185190
thrleuleuthrargthralaserilealaserphealaglytyrval
195200205
iletyrileaspphemetasnasnmetglyhiscysasnphegluleu
210215220
valprolysargleuphehisleupheproproleulyspheleucys
225230235240
tyrthrproserphehisserleuhishisthrglnpheargthrasn
245250255
tyrserleuphemetproleutyrasptyriletyrglythrmetasp
260265270
gluthrseraspthrleutyrglulysserleugluargglygluasp
275280285
argvalaspvalvalhisleuthrhisleuthrthrprogluserile
290295300
tyrhisleuargileglyleualaserphealasertyrpropheser
305310315320
tyrargtrpphemetargleuleutrpprophethrserleusermet
325330335
leuphethrleuphetyralaserleuphevalsergluargasnser
340345350
pheglulysleuasnleuglnsertrpileileproargtyrasnleu
355360365
glntyrleuleulystrparglysaspalaileasnasnmetileglu
370375380
lysalaileleuglualaasnlyslysglyvallysvalleuserleu
385390395400
glyleumetasnglnglyglugluleuasnargasnglygluvaltyr
405410415
ilehislyshisproglumetlysvalargvalvalaspglyserarg
420425430
leuthralaalavalvalileasnserleuprolysserthrthrlys
435440445
ilevalmetthrglyasnleuthrlysvalalatyrthrilealaser
450455460
alaleucysglnargglyvalgluvalleuthrleuleuprogluglu
465470475480
tyrglulysleuargserleuvalproglnglucysargaspargleu
485490495
valleuleuthrsergluthrleualaserasnlysvaltrpleumet
500505510
glygluglythrthrargglugluglnglumetalathrlysglythr
515520525
leupheilepropheserglnpheproleulysglnleuargargasp
530535540
cysiletyrhisthrproproalaleuileileprolysserleuval
545550555560
asnilehissercysgluasntrpleuproarglysalametserala
565570575
thrargvalalaglyileleuhisalaleugluglytrpglumethis
580585590
glucysglythrserasnileleuleuseraspleuaspglnvaltrp
595600605
glualacysleuthrhisglypheglnproleuleuleuprohishis
610615620
pheglntyrpro
625
- 还没有人留言评论。精彩留言会获得点赞!