一种快速分离肝脏门管区和中央静脉区肝细胞的方法与流程
本发明属于医学领域,具体涉及一种快速分离肝脏门管区和中央静脉区肝细胞的方法。
背景技术:
肝脏结构较为复杂。其中的肝静脉起源于肝小叶的中央静脉,逐级汇合成肝左、中、右静脉,注入下腔静脉,尾状叶及其附近的小静脉直接汇入下腔静脉。门静脉经肝门入肝,反复分支最后汇入肝小叶的肝血窦。因此,肝静脉和门静脉走行相反,肝静脉越靠近膈肌口径越大,最后汇入三大主干注入下腔静脉;门静脉则越靠近肝门口径越大。肝内门静脉和肝静脉互相穿插,其行走如双手十指交叉。
肝脏的复杂结构造成了对肝脏门管区和中央静脉区的原代肝细胞分离的困难,并对后续针对上述原代细胞的培养、研究造成阻碍。
授权专利201210083696.x公开了一种分离培养肝脏原代细胞的方法,包括以下步骤:1)从肝脏的肝门静脉输入灌流液;2)输入胶原酶灌流液;3)将消化成熟的肝脏浸泡于胶原酶灌流液中;4)加清洗液终止消化,过滤,收集肝细胞悬液;5)离心,弃上清,用完全培养基重悬,培养。本发明方法操作简单,成本低,稳定高效,肝细胞得率高,活力高,易贴壁。此法得到了原代肝细胞。但并未对肝脏细胞进行分类,无法完成获得某种类型肝细胞的目的。
目前,国内尚无能够分离肝脏门管区和中央静脉区的肝细胞的优良方法。
因此开发一种快速分离肝脏门管区和中央静脉区肝细胞的方法。
技术实现要素:
有鉴于此,本发明的目的在于提供一种分离肝脏门管区肝细胞或中央静脉区肝细胞的方法,通过不同方向灌注毛地黄皂苷(digitonin)溶液及后续细胞纯化来获得目的细胞:分离门管区细胞时,中央静脉区细胞已被毛地黄皂苷杀死,门管区的细胞未受影响,通过后续分离纯化获得门管区细胞;分离中央静脉区细胞时,门管区细胞被毛地黄皂苷杀死,中央静脉区细胞未受影响,通过后续分离去除血管中的红细胞,获得中央静脉区细胞。
本发明的方法解决了无法从肝脏中分离门管区肝细胞和中央静脉区肝细胞的问题,同时操作简单,获得的原代肝细胞纯度高。
为实现上述目的,本发明的技术方案为:
一种分离肝脏门管区肝细胞或中央静脉区肝细胞的方法,其特征在于,所述方法包括以下步骤:
1)麻醉动物,打开腹腔,结扎门静脉分支,结扎肝下腔静脉;
2)用灌注液1从门静脉流入,灌注洗净肝内血液;
3)反向(分离门管区肝细胞)或正向(分离中央静脉区肝细胞)灌注加入毛地黄皂苷的灌注液1,观察肝组织表面褪色的模式,当观察到适当的模式时,停止灌注;
4)立即反向以步骤3)相反的方向灌注灌注液2;
5)正向灌注加入胶原蛋白水解酶的灌注液3至肝组织变软或出现破裂,停止灌注;
6)取出每个肝叶,放入重悬液中,去除肝包膜并使肝叶细胞分离,去除支架部分,过滤获得细胞;
7)对获得的细胞进行percoll离心纯化,获得门管区肝细胞或中央静脉区肝细胞,置于培养基中培养;
所述反向灌注为从肝下腔静脉进行灌注,所述正向灌注为从门静脉进行灌注;
所述灌注液1、灌注液2、灌注液3和重悬液相同或不同,其均为缓冲盐溶液。
本发明的方法中,分离门管区肝细胞时,步骤3)为反向灌注;分离中央静脉区肝细胞时,步骤3)为正向灌注。
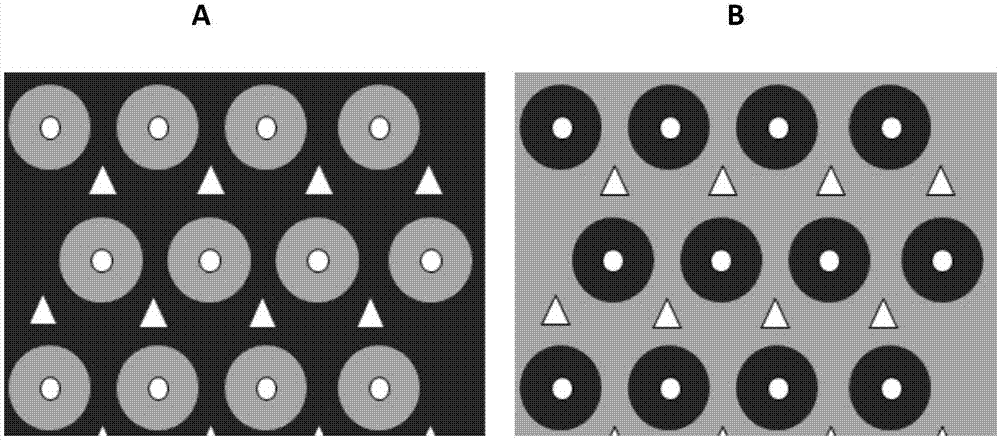
在本发明的方法中,分离门管区肝细胞时,步骤3)所述适当的模式为门管区为暗红色,中央静脉区为灰白色;分离中央静脉区肝细胞时,步骤3)所述适当的模式为中央静脉区为暗红色,门管区为灰白色。见图1所示。
优选的,步骤7)所述percoll离心纯化具体为:所述重悬液中加入percoll细胞分离液,获得分离溶液,其密度为1.08g/ml;步骤6)获得的细胞用所述分离溶液重悬,40-80g离心2-5min,去上清,重复2-3次;使用基础培养基重悬细胞,40-80g,离心3-7min,去上清,重复2-3次。
优选的,所述灌注液2、灌注液3和重悬液为hepes缓冲盐溶液;所述灌注液1为krebs/henseleit缓冲液。
优选的,步骤1)中还结扎肝动脉。
优选的,步骤2)和步骤5)所述灌注速度为2-4ml/min。
优选的,所述加入毛地黄皂苷的灌注液1中毛地黄皂苷的浓度为3-10mmol/l。
进一步优选的,所述加入毛地黄皂苷的灌注液1中毛地黄皂苷的浓度为4-6mmol/l。
优选的,当所述动物为小鼠时,所述加入毛地黄皂苷的灌注液1的灌注量为0.5-2ml。
进一步优选的,当所述动物为小鼠时,所述加入毛地黄皂苷的灌注液1的灌注量为0.8-1.2ml。优选的,所述加入胶原蛋白水解酶的灌注液3中胶原蛋白水解酶浓度为13000u/l-20000u/l。
进一步,所述加入胶原蛋白水解酶的灌注液3中胶原蛋白水解酶浓度为15000u/l-17000u/l。
优选的,步骤5)所述加入胶原蛋白水解酶的灌注液3灌注1-3min后,向所述加入胶原蛋白水解酶的灌注液3中加入cacl2至浓度为3-6mmol/l,继续灌注至肝组织变软或出现破裂。
优选的,步骤2)的灌注中门静脉插有导管。
进一步,步骤3)开始,肝下腔静脉插有导管。
优选的,步骤5)所述灌注使用再循环灌注系统。
优选的,所述灌注液1、灌注液2、灌注液3和重悬液分别为:
①灌注液1:2g/l葡萄糖,118mmol/lnacl,4.7mmol/lkcl,1.17mmol/lmgso4,1.18mmol/lkh2po4,2.54mmol/lcacl2,25mmol/lnahco3,溶剂为水,ph为7.4;
②灌注液2:145mmol/lnacl,5.4mmol/lkcl,0.77mmol/lmgso4,0.93mmol/lmgcl2,0.44mmol/lkh2po4,0.34mmol/lna2hpo4,10mmol/lhepes,溶剂为水,ph为7.4;
③灌注液3:145mmol/lnacl,5.4mmol/lkcl,0.77mmol/lmgso4,0.93mmol/lmgcl2,0.44mmol/lkh2po4,0.34mmol/lna2hpo4,10mmol/lhepes,2g/l葡萄糖,2g/lbsa,溶剂为水,ph为7.4;
④重悬液:137mmol/lnacl,5.4mmol/lkcl,1.2mmol/lmgso4,0.15mmol/lkh2po4,0.79mmmol/lna2hpo4,1mmol/lcacl2,10mmol/lhepes,2g/l葡萄糖,溶剂为水,ph为7.4。
本发明的有益效果在于:本发明提供的分离肝脏门管区肝细胞或中央静脉区肝细胞的方法,
1)通过不同方向灌注毛地黄皂苷溶液及后续细胞纯化来获得目的细胞:分离门管区细胞时,中央静脉区细胞已被毛地黄皂苷杀死,门管区的细胞未受影响,通过后续分离纯化获得门管区细胞;分离中央静脉区细胞时,门管区细胞被毛地黄皂苷杀死,中央静脉区细胞未受影响,通过后续分离纯化,获得中央静脉区细胞。
2)解决了无法从肝脏中分离门管区肝细胞和中央静脉区肝细胞的问题,操作简单,获得的原代肝细胞纯度高,活细胞率高。
附图说明
图1为用毛地黄皂苷处理后的肝表面模式图;图a分离门管区细胞,图b分离中央静脉区细胞。
图2为分离后的小鼠肝脏门管区(左)和中央静脉区(右)肝细胞台盼蓝染色图。
图3为分离后的门管区和中央静脉区肝细胞标志基因表达情况。
具体实施方式
以下将(参照附图)对本发明的优选实施例进行详细描述。优选实施例中未注明具体条件的实验方法,通常按照常规条件,所举实施例是为了更好地对本发明的内容进行说明,但并不是本发明的内容仅限于所举实施例。所以熟悉本领域的技术人员根据上述发明内容对实施方案进行非本质的改进和调整,仍属于本发明的保护范围。
所需耗材:
恒流泵、软管、留置针(洁瑞,针管回缩式,22g)、棉球、小镊子(2-3把)、大镊子(1-2把)、小剪刀(1-2把)、大剪刀、止血钳(2-3把)、纱布、帽子、口罩、手术丝线、注射器(1ml,20ml,多个)、3m胶带、培养皿、50ml管、冰、细胞筛。
溶液配制:
①戊巴比妥钠溶液:取0.6g溶于100ml无菌pbs中,现配现用。
②krebs/henseleit缓冲液:1000ml
③溶液a(重悬液):1000ml
④溶液b(灌注液2):1000ml
⑤溶液c(灌注液3):1000ml
⑥5mmdigitonin(毛地黄皂苷)溶液:6.1mgdigitonin溶于1mlkrebs/henseleit缓冲液。
⑦含胶原蛋白水解酶的溶液c:1600u溶于100ml溶液c。
⑧含cacl2的胶原蛋白水解酶溶液:1600u胶原蛋白水解酶溶于1000ml溶液c中,加入5ml1mcacl2。
⑨含percoll细胞分离液的溶液a(分离溶液):10mlpercoll溶于90ml溶液a,密度为1.08g/ml。
实施例1肝组织处理
1.用70%乙醇消毒所有耗材,包括恒流泵内部;
2.腹腔注射戊巴比妥钠溶液(0.5%,50g小鼠约0.7ml)使小鼠麻醉;
3.打开腹腔,结扎门静脉分支,结扎肝下腔静脉(活),如果可能结扎动脉;
4.插入导管至门静脉;
5.在37℃用溶液krebs/henseleit缓冲液以35ml/min(210ml/h)的速度洗净肝内血液;
6.持续灌注约10min,同时插入第二个导管到肝下腔静脉;
7.用注射器推digitonin溶液(1ml);(分离门管区细胞,灌注的方向是从下腔静脉逆向灌注;分离中央静脉区细胞,方向是从门静脉正向灌注)
8.仔细观察肝组织表面褪色的模式(见图1),整个肝组织表明应显示同样的模式,约10s;
9.当观察到适当的模式时,立即停止灌注;
10.立即用步骤7的灌注方向的反方向灌注溶液b直至80ml都用完;
11.结束原位灌注后,下腔静脉的导管要连接到再循环灌注系统的溶液中;
12.用再循环灌注系统正向灌注含1600u/100ml胶原酶的溶液c,速度是210ml/h;
13.2分钟后,加入cacl2到溶液c中至终浓度5mm;
14.当肝组织变软或出现破裂时(通常是15-20min,不能超过25min),停止灌注;
15.小心的用镊子从基部取出每个肝叶,放入冷的溶液a中;
16.剪破并去除肝包膜;
17.晃动肝叶至细胞分离,去除余下的支架部分(白色);
18.用纱布和细胞筛过滤细胞。
分离门管区肝细胞时,步骤9所述适当的模式为门管区为暗红色,中央静脉区为灰白色;分离中央静脉区肝细胞时,步骤9所述适当的模式为中央静脉区为暗红色,门管区为灰白色。
图1为用digitonin处理后的肝表面模式图。其中图a分离门管区细胞,图b分离中央静脉区细胞。图中的黑色表示正常灌注后的肝组织(活),灰色表示digitonin处理后的肝组织(死);图中三角形表示门管区,圆形表示中央静脉区。
其中图a:digitonin处理后,灰色的圆形区域表示中央静脉区细胞已被杀死,圆形中央的白色小圆为血管。而门管区的细胞(三角形)未受影响,可通过后续分离纯化获得门管区细胞。
图b:digitonin处理后,灰色的底色及三角形表示门管区细胞被杀死,圆形代表的中央静脉区细胞未受影响。通过后续分离去除白色小圆代表的血管中的红细胞及死细胞,即可获得中央静脉区细胞。
实施例2纯化肝细胞
1.把实施例1获得的细胞用含percoll细胞分离液的溶液a制备成悬液,放入50ml的离心管,50g离心3.5min,去上清;
2.用含percoll细胞分离液的溶液a重悬,再次离心;
3.重复步骤2两次;
4.收集细胞,使用基础培养基重悬细胞;
5.50g,离心5min,重复离心纯化2次,细胞经台盼蓝染色,计数,按照1x106/25cm2的细胞数分瓶,使用完全培养基+20%fbs在含5%co2的培养箱37℃培养。
6.18h后换液,以后每天换液。
台盼蓝染色结果见图2。活细胞率>95%。
实施例3标志基因表达情况
中央静脉区(pv)肝脏细胞标志基因glul和cyp1a2,门管区(pp)肝脏细胞标志基因arg1和pck1在分离后的两群肝细胞中的qrt-pcr检测。检测结果见图3。
中央静脉区肝脏细胞标志基因glul和cyp1a2在中央静脉区表达量远超过其在门管区肝细胞中的表达。反之,门管区肝脏细胞标志基因arg1和pck1在门管区表达量远超过其在中央静脉区肝细胞中的表达。这表明我们分离的细胞纯度很高。
实施例4肝细胞功能分析
中央静脉区肝脏细胞、门管区肝脏细胞的cyp3a4酶活力和尿素生产能力在分离后的两群肝细胞中的测试,结果见表1。
表1.中央静脉区和门管区肝细胞cyp3a4酶活力和尿素生产能力测试
如表1所示,中央静脉区肝脏细胞在解毒能力上明显强于门管区肝细胞。反之,门管区肝脏细胞在尿素生产能力上要明显强于中央静脉区肝细胞中的表达,这些结果与已知肝脏细胞功能分区相吻合,同时也表明我们分离的细胞纯度很高。
最后说明的是,以上实施例仅用以说明本发明的技术方案而非限制,尽管参照较佳实施例对本发明进行了详细说明,本领域的普通技术人员应当理解,可以对本发明的技术方案进行修改或者等同替换,而不脱离本发明技术方案的宗旨和范围,其均应涵盖在本发明的权利要求范围当中。
- 还没有人留言评论。精彩留言会获得点赞!