一种蛙来源的创伤修复肽及其合成方法与流程
本申请属于生物医药领域,涉及一种新的多肽及其合成方法。更具体地,涉及一种新的蛙创伤修复肽及其合成方法。
背景技术:
许多因素会造成细胞和组织的损伤。损伤后组织部位及其附近存活的健康细胞不断进行分裂和增殖,以取代死亡细胞和修复受损组织,生物体的这种生理机能称为再生和修复。
正常情况下,人体不同器官的修复和再生能力有所不同。表皮细胞(如呼吸道、消化管和泌尿生殖器的粘膜被覆上皮)、淋巴细胞、造血细胞等属于再生力强的细胞,这些种类的细胞每时每刻都在进行衰老与新生,具有应对损伤的强大再生修复能力,因此属于再生能力较强的细胞。而其他如血管内皮细胞、骨膜细胞、各种腺体器官的细胞如肝、胰、内分泌腺、汗腺、皮脂腺及肾小管上皮细胞等则属于次一级的有较强再生力的细胞,当受到损伤时,也能表现出一定的再生能力。具体反映在局部组织当这些正常的细胞被破坏后,由残留的同类细胞分裂、补充;而如果该局部的细胞完全被破坏,细胞全部坏死,则该部位就不能被修复。另外,还有再生力微弱或无再生力的细胞,如中枢神经细胞和神经节细胞再生很弱,遭损坏后极难恢复原有功能;心肌细胞再生能力极弱,损毁后均由纤维结缔组织代替,很难恢复原有的结构和功能。
影响组织再生的因素有很多。除了组织和细胞自身的再生能力外,还有如下几种因素:(1)组织受损伤的程度和范围:程度和范围越大则修复和再生的时间越长,因为大范围的细胞坏死后,难以有相当数量的同类细胞代替,需要健康的细胞产生新细胞,新生细胞再生成新细胞,需要的时间就要漫长一些。(2)年龄因素:儿童和青少年组织再生能力强,创伤愈合快;老年人组织再生能力弱,愈合慢。(3)营养状况:充足的蛋白质、维生素c、e和矿物质钙、锌供应能够促进损伤的修复,反之则会延缓各种损伤的修复。(4)药物影响:有些药物如肾上腺皮质激素和垂体促肾上腺皮质激素能抑制炎症,但不利于机体消除伤口感染,还能抑制肉芽组织生长和胶原合成,加速胶原分解;还有抗癌药中的细胞毒药物也可延缓愈合。(5)血液供应:组织损伤后,由于局部毛细血管也受到破坏,或者其他因素导致血管硬化等,都会导致血液供应不足而导致组织营养不良,妨碍愈合。(6)神经支配:失去神经支配的组织会丧失再生能力。
由上可知,机体的组织受到损失后,除却无法通过外界干预的如年龄等客观因素外,从增加受损部位的营养供给、采用药物干预其促进存活细胞增殖、促进毛细血管的新生和神经细胞的再生等,可以加快组织的修复。
本申请主要涉及皮肤组织的创伤修复。
皮肤是人体面积最大的且最直接与外界接触组织,同时也是最容易受到外界刺激而损伤的器官。正常创伤的愈合对维持机体稳态至关重要,而异常愈合如大面积烧烫伤造成的不愈或者迟愈、其他疾病导致的慢性创面愈合、以及不正常的愈合如病理性瘢痕的形成等等不仅影响了美观,更会造成结构和功能的障碍,往往对患者造成沉重的心理压力,严重影响着患者的身心健康。因此,如何在皮肤创伤治疗中快速达到最佳愈合效果,一直是人们研究的热点。
皮肤的愈合过程是一个复杂的、协调有序的组织修复再生过程,是多种细胞及细胞因子共同作用完成的过程。该过程大致可以分为炎症反应期、增生期和重塑期,三个期相互交叉并无严格的界线,且均有大量的细胞及细胞因子参与愈合过程。参与愈合的细胞包括角质细胞、血管内皮细胞、成纤维细胞、中性粒细胞、单核/巨噬细胞和肥大细胞等;参与愈合的细胞因子包括成纤维细胞生长因子(fibroblastgrowthfactor,fgf)、血管内皮生长因子(vascularendothelialgrowthfactor,vegf)、血小板衍生因子(plateletderivedgrowthfactor,pdgf)、肿瘤坏死因子-α(tumornecrosisfactor-α,tnf-α)、转化生长因子(transforminggrowthfactor,tgf)、胰岛素样生长因子(insulin-likegrowthfactors,igf)和多种凝血因子等。细胞分泌细胞因子调节创伤愈合,细胞因子又反过来影响细胞的功能,其中任何一个环节的异常都可能造成皮肤愈合结果的异常,而且皮肤愈合过程受到的影响因素众多(年龄、营养状况、内分泌变化、药物、局部血液循环、感染、电离辐射和系统性疾病等),因此,皮肤愈合的机制目前仍不完全明确。
目前临床上,皮肤创伤修复主要针对急性皮肤软组织创伤、慢性皮肤软组织创伤来进行不同的用药和处理。基于我国传统中医药的优势,在创伤修复领域涌现了许多单方如康复新液,复方则由少则四、五味,多则二三十味中药进行配伍制备而来,例如治疗烧烫伤的“湿润烧伤膏”、“京万红”等。现代医药开发特别是基因工程技术介入的生物医药开发后,促细胞生长的重组生长因子的生产也是创伤修复药物开发的生力军,比如已经在临床上应用于创伤、烧烫伤等的生物技术药物--外用重组碱性成纤维细胞生长因子(basicfibroblastgrowthfactor,bfgf),就是我国第二个基因工程i类新药(注:碱性成纤维细胞生长因子又称为成纤维细胞生长因子-2,fgf2)。
与皮肤修复的多肽药物开发方面,2014年中科院昆明动物研究所报道了来源于蜥蜴的一条强效的皮肤修复肽tylotoin,含12个氨基酸残基,表现出强烈的促创伤愈合活性,可以促进角质上皮和成纤维细胞的增殖和迁移,还能促进tgf-b和il-6的生成。
两栖动物的生活环境复杂,它们的皮肤裸露、光滑、潮湿,容易受到各种病原微生物侵袭和紫外线辐射损伤。在长期的自然选择过程中,两栖动物逐渐进化出了独特的、高效的皮肤多肽防御系统。广泛的研究表明:两栖动物皮肤受到创伤后能快速修复,因此两栖动物皮肤被视为具有巨大开发潜力的促创伤修复药物资源宝库。两栖动物皮肤包含丰富的小分子多肽,这些小分子肽具有各种生物活性,如抗菌性、抗氧化性以及免疫活性。目前,从两栖动物皮肤中筛选一些药理活性单体化合物是新药发明的热点。据国内外文献报道,已从各种生物来源分离得到不同的活性多肽,而且有些已进入临床阶段。然而,到目前为止,对于两栖动物皮肤具有皮肤促创伤修复活性多肽的认知还非常匮乏。
在这方面,天然蛙创伤修复肽是一种发现于绿臭蛙表皮分泌物中,并经分离纯化得到的天然多肽。这种多肽具有促进成纤维细胞的分裂以及迁移,和促进伤口愈合的能力。因此,该多肽具有药物开发的潜能。
目前获得这种蛙创伤修复肽的方法主要有以下两种:
一种是直接从绿臭蛙表皮分泌物中提取,然后通过反相高效液相色谱c18柱分离纯化,以便直接从表皮分泌物中分离单一的组分。通过这种方法可以获得天然创伤修复肽,但是这种方法的缺点在于得到的天然修复肽的量非常微小。例如1毫克皮肤分泌物经过分离纯化,仅仅可以获得微克级的目的多肽。因此,这种提取方法不适合大规模生产操作。
另一种方法是采用化学合成来制备。这种合成方法通过在自动化肽合成仪上进行固相肽合成来获取粗制直链产物,之后再进行二硫键重构和hplc纯化过程,从而得到目的多肽。由于增加了二硫键重构和hplc纯化步骤,往往会导致复性效率较低,目的多肽的产率降低。
因此,本领域急需高效地获得蛙创伤修复肽的方法。
发明概述
本申请提供了合成一种高效的蛙来源的创伤修复肽的方法,这种方法操作简便,所获得的蛙创伤修复肽在合成之后是直接是环形肽,无需经过变复性的过程。同时,本申请的合成方法能以高产率获得目的多肽。
另一方面,通过本申请的方法制备的蛙创伤修复肽中引入了c-s键替换容易断裂的s-s键,从而稳定了蛋白质的空间构象。因此,本申请所提供的蛙创伤修复肽具有稳定的结构,获得了很好的稳定性。
具体地,本申请涉及以下方面:
在一个方面,本申请提供一种蛙创伤修复肽,其特征在于:所述肽的氨基酸序列中的两个半胱氨酸之间的s-s键被替换为c-s键。
在一个优选的实施方案中,本申请提供的蛙创伤修复肽,其特征在于:所述肽的氨基酸序列如seqidno.1所示,seqidno.1为lvgkllkgavgdvcgllpic,且其中从c端至n端第1位与第7位之间的s-s键被替换为c-s键。
在另一个优选的实施方案中,本申请的提供的另一种蛙创伤修复肽,其特征在于:所述肽的氨基酸序列如seqidno.2所示,seqidno.2为pfcfkgtpcg,且其中从c端至n端第2位与第8位之间的s-s键被替换为c-s键。
在另一个方面,本申请提供了一种蛙创伤修复肽的合成方法,其特征在于,所述方法包括以下步骤:
1)按照蛙创伤修复肽的序列由c端至n端合成其序列所示的至少包括第1个半胱氨酸至第2个半胱氨酸前一位的氨基酸在内的肽段,其中所述肽段从c端至n端第1个半胱氨酸是二氨基二酸;
2)脱除二氨基二酸的保护基团;
3)将上述二氨基二酸与所述肽段从c端至n端第2个半胱氨酸前一位的氨基酸环化缩合;
4)从c端至n端合成蛙创伤修复肽的剩余肽段,从而获得所述蛙创伤修复肽。
在一个具体的实施方案中,在本申请提供了合成seqidno.1所示的蛙创伤修复肽的方法,所述方法的特征在于,所述方法包括以下步骤:
1)按照seqidno.1所示的序列由c端至n端合成seqidno.1所示的多肽的至少包括第1个半胱氨酸至第2个半胱氨酸前一位的氨基酸在内的肽段,其中从seqidno.1的c端至n端第1个半胱氨酸是二氨基二酸;
2)脱除二氨基二酸的保护基团;
3)将所述二氨基二酸与从c端至n端第2个半胱氨酸前一位的氨基酸环化缩合;
4)从c端至n端合成seqidno.1所示的多肽的剩余的肽段,从而获得所述蛙创伤修复肽。
优选地,在本申请提供的合成seqidno.1所示的蛙创伤修复肽的合成方法中,其特征在于,在所述步骤1)中从seqidno.1的c端至n端1位是二氨基二酸,优选地在所述步骤3)中从c端至n端第2个半胱氨酸前一位的氨基酸是从c端至n端6位氨基酸。
优选地,在本申请提供的合成seqidno.1所示的蛙创伤修复肽的合成方法中,在所述步骤1)中按照seqidno.1所示的序列由c端至n端合成seqidno.1所示的多肽的6位氨基酸。
在另一个具体的实施方案中,在本申请提供了合成seqidno.2所示的蛙创伤修复肽的方法,其特征在于,所述方法包括以下步骤:
1)按照seqidno.2所示的序列由c端至n端合成seqidno.2所示的多肽包括第1个半胱氨酸至第2个半胱氨酸前一位的氨基酸在内的肽段,其中从seqidno.2的c端至n端第1个半胱氨酸是二氨基二酸;
2)脱除二氨基二酸的保护基团;
3)将所述二氨基二酸与seqidno.2从c端至n端第2个半胱氨酸前一位的氨基酸环化缩合;
4)从c端至n端合成seqidno.2所示的多肽的剩余的肽段,从而获得所述蛙创伤修复肽。
优选地,在本申请提供的合成seqidno.2所示的蛙创伤修复肽的合成方法中,其特征在于,在所述步骤1)中从seqidno.2的c端至n端2位是二氨基二酸,优选地在所述步骤3)中从c端至n端第2个半胱氨酸前一位的氨基酸是从c端至n端7位氨基酸。
优选地,在本申请提供的合成seqidno.2所示的蛙创伤修复肽的合成方法中,其特征在于,在所述步骤1)中按照seqidno.2所示的序列由c端至n端合成seqidno.2所示的多肽的7位氨基酸。
在一个实施方案中,在本申请提供的合成蛙创伤修复肽的方法中,在所述步骤1)中按照蛙创伤修复肽的序列由c端至n端合成其序列所示的至少包括第1个半胱氨酸至第2个半胱氨酸前一位的氨基酸在内的肽段,其中所述肽段从c端至n端第2个半胱氨酸是二氨基二酸。
在一个具体的实施方案中,在本申请提供的合成seqidno.1所示的蛙创伤修复肽的合成方法中,在所述步骤1)中,seqidno.1的从c端至n端第7位半胱氨酸被替换为二氨基二酸。
在一个具体的实施方案中,在本申请提供的合成seqidno.2所示的蛙创伤修复肽的合成方法中,在所述步骤1)中,seqidno.2的从c端至n端第8位半胱氨酸被替换为二氨基二酸。
在一个优选的实施方案中,在本申请提供的合成蛙创伤修复肽的方法中,所述方法还包括在所述步骤4)后,经切割液处理和复性,从而获得所述蛙创伤修复肽,所述切割液优选为[v(tfa):v(苯酚):v(水):v(三异丙基硅烷,tips)=88:5:5:2]。
在一个优选的实施方案中,在本申请提供的合成蛙创伤修复肽的方法中,在所述步骤2)中使用脱除试剂脱除二氨基二酸的保护基团。优选地,所述脱除试剂是四(三苯基膦)钯与苯硅烷的混合物,优选摩尔比1:5的四(三苯基膦)钯与苯硅烷的混合物。
在一个优选的实施方案中,在本申请提供的合成蛙创伤修复肽的方法中,使用fmoc固相合成法合成蛙创伤修复肽的序列,例如seqidno.1或seqidno.2所示的序列。
更优选地,在本申请提供的合成蛙创伤修复肽的方法中,在所述fmoc固相合成法中以树脂作为固相载体,经缩合剂活化来合成蛙创伤修复肽的序列,其中所述树脂优选为2-cl-trt树脂。
在一个具体的实施方案中,在本申请提供的合成蛙创伤修复肽的方法中,所述方法还包括在所述步骤2)和3)之间和/或所述步骤4)之后,脱除氨基酸的fmoc保护基,优选使用脱除试剂,例如20%哌啶的dmf溶液脱除氨基酸的fmoc保护基。
优选地,在本申请提供的合成蛙创伤修复肽的方法中,所述方法还包括,在所述切割液处理和复性后,用冰乙醚沉淀,离心,得到所述蛙创伤修复肽。
更优选地,在本申请提供的合成蛙创伤修复肽的方法中,所述切割液处理和复性包括将切割液加入到所合成的多肽内,反应一段时间(优选2h),以将所述蛙创伤修复肽切割下来,收集切割液,用氮气鼓泡,浓缩溶液。更具体地,在本申请提供的合成蛙创伤修复肽的方法中,所述方法还包括在将所述蛙创伤修复肽切割下来后,在收集切割液之前,脱除所述蛙创伤修复肽的侧链保护基团。
优选地,在本申请提供的合成蛙创伤修复肽的方法中,所述方法还包括在冰乙醚沉淀,离心后,使用半制备型hplc分离得到所述蛙创伤修复肽。
在一个方面,本申请涉及一种组合物,其包含前述权利要求中任一项的肽和任选地药学上可接受的载体、赋形剂。
在一个实施方案中,本申请提供的组合物用于促进创伤后组织修复与再生,优选皮肤创伤、烧烫伤、慢性创面愈合、皮肤细胞修复和新生。
在一个优选的实施方案中,本申请提供的组合物为医用产品、护肤品或化妆品。
在一个具体的实施方案中,本申请提供的组合物的剂型为溶液、冻干制剂、乳剂、霜剂、凝胶、面膜或敷料。
在另一个方面,本申请还涉及本申请的蛙创伤修复肽或本申请的组合物在制备制剂中的用途,所述制剂用于促进创伤后组织修复与再生,优选皮肤创伤、烧烫伤、慢性创面愈合、皮肤细胞修复和新生。
发明详述
本申请提供了合成一种高效的蛙来源的创伤修复肽的方法。这种方法操作简便,所获得的蛙创伤修复肽在合成之后是直接是环形肽,无需经过变复性的过程。同时,本申请的合成方法能以高产率获得目的多肽。
另一方面,通过本申请的方法制备的蛙创伤修复肽中引入了c-s键替换容易断裂的s-s键,从而稳定了蛋白质的空间构象。因此,本申请所提供的蛙创伤修复肽具有稳定的结构,获得了很好的稳定性。
本申请提供了一种新的蛙创伤修复肽,其特征在于:所述肽的氨基酸序列如seqidno.1所示,seqidno.1为lvgkllkgavgdvcgllpic,且其中从c端至n端第1位与第7位之间的s-s键被替换为c-s键。
本发明还提供了seqidno.1所示的蛙创伤修复肽的合成方法,其特征在于,所述方法主要包括以下步骤:
采用fmoc固相合成法,以树脂作为固相载体,经缩合剂活化。固相树脂连接的第一个氨基酸(第1位,由c端向n端计)为二氨基二酸,按照seqidno.1所示的序列将氨基酸由c端向n端逐个偶联到树脂上。待seqidno.1所示的序列将氨基酸由c端向n端第6位甘氨酸缩合完毕后,使用脱除试剂脱除二氨基二酸的保护基团。之后,将从c端至n端第1位的二氨基二酸与第6位氨基酸环化缩合。接下来继续耦合其余氨基酸。最后经切割液处理以及复性后,获得所述蝎毒素多肽。
并且,本申请还提供了另一种蛙创伤修复肽,其特征在于:所述肽的氨基酸序列如seqidno.2所示,seqidno.2为pfcfkgtpcg,且其中从c端至n端第2位与第8位之间的s-s键被替换为c-s键。
同时,本发明还提供了seqidno.2所示的蛙创伤修复肽的合成方法,其特征在于,所述方法主要包括以下步骤:
采用fmoc固相合成法,以树脂作为固相载体,经缩合剂活化。固相树脂连接的第一个氨基酸(由n端向c端计)为甘氨酸,按照seqidno.2所示的序列将氨基酸由c端向n端逐个偶联到树脂上。待按照seqidno.2所示的序列由c端至n端第7位氨基酸缩合完毕后,使用脱除试剂脱除二氨基二酸的保护基团。之后,将从seqidno.2的c端至n端第2位的二氨基二酸与第7位氨基酸环化缩合。接下来继续耦合其余氨基酸。最后经切割液处理以及复性后,获得所述蝎毒素多肽。
本发明的有益效果
一方面本申请的合成蛙创伤修复肽的方法操作简便,所获得的蛙创伤修复肽在合成之后是直接是环形肽,无需经过变复性的过程。同时,本申请的合成方法能以高产率获得目的多肽。
另一方面,本申请所提供的蛙创伤修复肽中引入了c-s键替换容易断裂的s-s键,从而稳定了蛋白质的空间构象。因此,本申请所提供的蛙创伤修复肽具有稳定的结构,获得了很好的稳定性。
在一个方面,本申请提供了包含蛙创伤修复肽的组合物。可以将本发明的蛙创伤修复肽与合适的载体、赋形剂及提供改善的转移、递送、耐受等的其他试剂一起配制为组合物。可以与蛙创伤修复肽一起配制的多种适合的试剂可以在所有药剂师已知的处方中发现:remington'spharmaceuticalsciences,mackpublishingcompany,easton,pa。这些组合物的剂型包括例如粉剂、糊剂、软膏、凝胶剂、蜡、油、脂质、含有小泡(诸如lipofectintm)的脂质(阳离子的或阴离子的)、dna缀合物、无水吸收糊剂、水包油和油包水乳剂、乳剂碳蜡(多种分子量的聚乙二醇)、半固体凝胶、和含有碳蜡的半固体混合物。还参见powell等人,compendiumofexcipientsforparenteralformulationspda(1998)jpharmscitechnol52:238-311。
向患者施用的蛙创伤修复肽的剂量可以根据患者的年龄和尺寸、目标疾病、状况、施用途径等而变化。通常根据体重或体表面积计算优选的剂量。根据病症的严重性,可以调整治疗的频率和持续时间。施用蛙创伤修复肽的有效剂量和时间表可以根据经验来确定;例如,可以通过定期评估监测患者病程,并相应地调整剂量。此外,可以使用本领域中众所周知的方法进行剂量的种间类推(例如,mordenti等,1991,pharmaceut.res.8:1351)。
多种递送系统是已知的并且可用于施用本发明的组合物,例如,脂质体中封装、微粒、微胶囊、能够表达突变病毒的重组细胞、受体介导的内吞作用(参见,例如,wu等,1987,j.biol.chem.262:4429-4432)。导入的方法包括但不限于真皮内、肌内、腹膜内、静脉内、皮下、鼻内、硬膜外和口服途径。组合物可以通过任何常规途径施用,例如通过输注或团注、通过上皮或皮肤粘膜(例如,口腔粘膜、直肠粘膜和肠粘膜等)施用,并可以与其他生物学上有活性的试剂一同施用。施用可以是全身性的或局部的。
附图描述
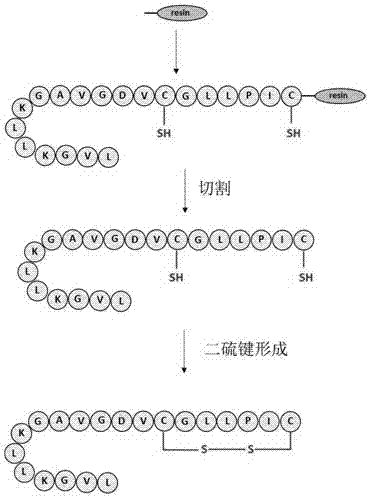
图1.seqidno.1所示的蛙创伤修复肽常规合成方式的流程图。
图2.以常规方式合成的seqidno.1所示的蛙创伤修复肽在变复性之前的合成质谱图。
图3.以常规方式合成的seqidno.1所示的蛙创伤修复肽在变复性之后的合成质谱图。
图4.以本申请的方法合成seqidno.1所示的蛙创伤修复肽的流程图。
图5.以本申请的方法合成seqidno.1所示的蛙创伤修复肽的hplc色谱图。
图6.以本申请的方法合成seqidno.1所示的蛙创伤修复肽的质谱图。
图7.以本申请的方法合成seqidno.2所示的蛙创伤修复肽的流程图。
图8.以本申请的方法合成seqidno.2所示的蛙创伤修复肽的hplc色谱图。
图9.以本申请的方法合成seqidno.2所示的蛙创伤修复肽的质谱图。
同时本申请提供了以下实施例,以帮助理解本发明,在所附权利要求中给出了本发明的真正的范围。应当理解,在不背离本发明精神的情况下,可以对给出的方法进行修改。
实施例
实施例1:如seqidno.1所示的蛙创伤修复肽的常规制备方法
本申请提供的蛙创伤修复肽之一的氨基酸序列如seqidno.1所示,seqidno.1为lvgkllkgavgdvcgllpic。蛙创伤修复肽的常规合成中需要先合成线性多肽,切割之后需要有变复性的过程。
合成如seqidno.1所示蛙创伤修复肽的传统方法的流程图如图1中所示。
合成具体步骤如下:
称取2-cl-trt树脂或者是wang树脂(0.125mmol)于固相合成管中,使用dcm/dmf溶胀树脂15-30min。抽干溶剂,用dcm洗涤后,依次按照多肽序列进行缩合反应。以常温fmoc-固相合成技术进行多肽链合成(fmoc-氨基酸0.4mmol,hctu0.38mmol,diea8mmol),室温反应45分钟。采用20%哌啶的dmf溶液脱除氨基酸的fmoc保护基(2min+5min)。待所有的氨基酸耦合完后,用dmf,dcm,dmf各洗5次,加入含有哌啶(体积分数20%)的dmf溶液反应2次(2min,10min各一次),以脱除fmoc保护基。
随后使用三氟乙酸:水:苯酚:edt:茴香硫醚=85:5:5:2.5:2.5的体积比的切割试剂进行多肽的切割反应。切割完毕之后使用hplc分离纯化获取粗肽,通过冻干获取粗肽冻干粉。
接下来使用变复性方式促进二硫键的形成。使用还原型谷胱甘肽:氧化型谷胱甘肽=10:1,溶液使用ph=8.0。反应使用hplc时实检测,反应结束之后使用hplc分离目标产物,冻干,得到目标产物。
图2中显示了以常规方式合成的seqidno.1所示的蛙创伤修复肽在变复性之前的合成质谱图。
图3中显示了以常规方式合成的seqidno.1所示的蛙创伤修复肽在变复性之后的合成质谱图。
实施例2:以本申请的方法合成seqidno.1所示的蛙创伤修复肽
本申请提供的蛙创伤修复肽的氨基酸序列如seqidno.1所示,seqidno.1为lvgkllkgavgdvcgllpic,且其中从c端至n端第1位cys上的s原子由c原子所替换,由此导致从c端至n端第1位与第7位之间的s-s键被替换为c-s键。
合成如seqidno.1所示蛙创伤修复肽的流程图如图4中所示。
合成具体步骤如下:
称取2-cl-trt树脂(0.125mmol)于固相合成管中,使用dcm/dmf溶胀树脂15-30min。抽干溶剂,用dcm洗涤后,依次按照多肽序列进行缩合反应。
与固相树脂连接的第一个氨基酸(第1位,由c向n端计数)为二氨基二酸。称取适量二氨基二酸(0.25mmol)溶解于dcm中,加入1mmoldiea后,加入含有树脂的固相合成管反应过夜。之后以常温fmoc-固相合成技术进行多肽链合成(fmoc-氨基酸0.4mmol,hctu0.38mmol,diea8mmol),室温反应45分钟。采用20%哌啶的dmf溶液脱除氨基酸的fmoc保护基(2min+5min)。
其中,从c端至n端第6位半胱氨酸被替换为二氨基二酸。待从c端至n端第6位甘氨酸缩合完毕后,先采用四(三苯基膦)钯与苯硅烷的混合物(摩尔比1:5)作为脱除试剂脱除其alloc保护基团与allyl保护基团,采用20%哌啶的dmf溶液脱除氨基酸的fmoc保护基。将所述从c端至n端第1位的二氨基二酸与第6位氨基酸环化缩合。然后从c端至n端合成seqidno.1所示的多肽的剩余的氨基酸。
待所有的氨基酸耦合完后,用dmf,dcm,dmf各洗5次,加入含有哌啶(体积分数20%)的dmf溶液反应2次(2min,10min各一次),以脱除fmoc保护基。
组装完肽链后,将8ml切割液[v(tfa):v(苯酚):v(水):v(三异丙基硅烷,tips)=88:5:5:2]加入到多肽合成管内,反应2h。将多肽从树脂上切下,并脱除侧链保护基团,将切割液聚集于离心管中,用氮气鼓泡,浓缩溶液,最后用冰乙醚沉淀,离心,得到粗肽,使用半制备型hplc分离得到纯肽。
图5中显示了所合成的seqidno.1所示的蛙创伤修复肽的hplc色谱图。同时,图6显示了所合成的seqidno.1所示的蛙创伤修复肽的质谱图。
实施例3:以本申请的方法合成seqidno.2所示的蛙创伤修复肽
本申请提供的另一种蛙创伤修复肽的氨基酸序列如seqidno.2所示,seqidno.2为pfcfkgtpcg,且其中从c端至n端第2位与第8位之间的s-s键被替换为c-s键。
合成如seqidno.2所示蛙创伤修复肽的流程图如图7中所示。
合成具体步骤如下:
称取2-cl-trt树脂(0.125mmol)于固相合成管中,使用dcm/dmf溶胀树脂15-30min。抽干溶剂,用dcm洗涤后,依次按照多肽序列进行缩合反应。
与固相树脂连接的第一个氨基酸(第1位,由c端向n端计)为甘氨酸。称取适量甘氨酸溶解于dcm中,加入1mmoldiea后,加入含有树脂的固相合成管反应过夜。之后以常温fmoc-固相合成技术进行多肽链合成(fmoc-氨基酸0.4mmol,hctu0.38mmol,diea8mmol),室温反应45分钟。采用20%哌啶的dmf溶液脱除氨基酸的fmoc保护基(2min+5min)。之后依次按照多肽序列进行缩合反应。
其中,由c端向n端第2位和第8位的半胱氨酸由二氨基二酸替代。待由c端向n端第7位氨基酸缩合完毕后,先采用四(三苯基膦)钯与苯硅烷的混合物(摩尔比1:5)作为脱除试剂脱除其alloc保护基团与allyl保护基团,采用20%哌啶的dmf溶液脱除氨基酸的fmoc保护基。再令c端向n端第2位二氨基二酸结构单元与第7位氨基酸进行环化缩合。然后继续耦合其余氨基酸。
待所有的氨基酸耦合完后,用dmf,dcm,dmf各洗5次,加入含有哌啶(体积分数20%)的dmf溶液反应2次(2min,10min各一次),脱除fmoc保护基。
组装完肽链后,加入8ml切割试剂[v(tfa):v(苯酚):v(水):v(三异丙基硅烷,tips)=88:5:5:2]于多肽合成管内,反应2h,将多肽从树脂上切下,并脱除侧链保护基团,将切割液聚集于离心管中,用氮气鼓泡,浓缩溶液,最后用冰乙醚沉淀,离心,得到粗肽,使用半制备型hplc分离得到纯肽
图8中显示了所合成的seqidno.2所示的蛙创伤修复肽的hplc色谱图。同时,图9显示了所合成的seqidno.2所示的蛙创伤修复肽的质谱图。
- 还没有人留言评论。精彩留言会获得点赞!