Nannocystins衍生物及其用途的制作方法
本发明涉及nannocystins衍生物,以及在制备治疗癌症药物或治疗癌症的辅助药物中的用途,属于药物化学领域。
背景技术:
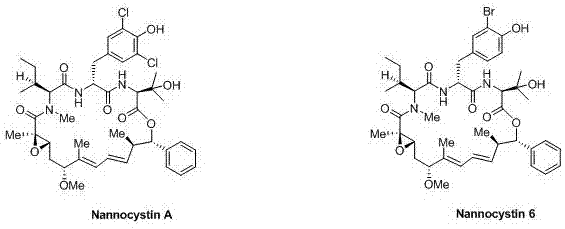
由微生物产生的次级代谢物是发现新药及其先导化合物的重要源泉。近年来粘细菌(myxobacteria)作为重要的药源性微生物受到越来越多的关注。最近分别由brönstrup和hoepfner领导的两个独立研究组先后发表文章,报道从粘细菌nannocyctis的两个不同菌株st201196和mb1016的发酵培养液中发现了一个具有新颖结构的化合物nannocystina。该分子为21元大环结构,其骨架由聚酮和三肽两个片段首尾相接组成,总共含有9个手性中心和两个共轭的反式烯烃双键。该分子中的α,β-环氧酰胺为nannocystin类化合物独有,迄今尚未在其它已知天然产物中发现
技术实现要素:
。
brönstrup等测试了nannocystina对于14种癌细胞系的抑制效果,发现其具有很高的抗癌活性,ic50值可达较低纳摩尔浓度范围。特别是该分子对于普通人乳腺癌细胞mda-mb231和耐药乳腺癌细胞mda-a1均显示良好的抑制效果,其ic50值分别为6.5nm和12nm;相比之下,紫杉醇类抗癌药多西他赛(docetaxel)对于耐药癌细胞mda-a1的抑制效果(ic50=570nm)与mda-mb231(ic50=0.3nm)相比则下降很多。这显示了nannocystina作为先导化合物在发展新型抗癌药物中的重要价值。目前已发现的其他具有“聚酮-三肽”结构的活性大环天然产物包括chondramide,jasplakinolide,seragamide,miuraenamide等。研究表明这些分子的作用靶标均为肌动蛋白。有趣的是,brönstrup等发现nannocystina能在细胞周期的早期诱导凋亡,这与上述化合物的作用机制截然不同。
发明内容
本发明提供了如下式1结构的化合物,
其中,r1=r2=cl或r1=br,r2=h。
化合物结构为:
化合物1a、1b与ef-1α结合蛋白的结合方式。对接结果表明所有含有二甲基基团化合物的二甲基部分都是位于氨基酸残基ala397附近的疏水空腔中,但是具有羟基缬氨酸残基天然产物nannocystina和nannocystin6的结合方式却不同于去羟基衍生物1a和1b。nannocystina和nannocystin6的羟基可与氨基酸残基arg379形成距离为2.61å的氢键,然而在1a和1b中与arg379形成氢键的是其酚羟基部分。
如上所述的化合物在制备治疗癌症药物或治疗癌症的辅助药物中的的用途,其中癌症为结肠癌。
附图说明
图1nannocystina和nannocystin6的结构
图2化合物nannocystina、nannocystin6和1a、1b的分子对接结果
具体实施方式
实施例1:合成了nannocystin衍生物1a(r1=r2=cl)
化合物1a的相关数据:[α]d27=-16.8(c0.45,chcl3);ir(kbr)νmax:3835,3612,3291,2963,2926,2855,1736,1688,1664,1495,1461,1262,1094,1023,801cm-1;1hnmr(400mhz,dmso)δ9.81(s,1h),8.55(d,j=9.7hz,1h),7.97(d,j=9.5hz,1h),7.43–7.26(m,7h),6.43–6.33(m,1h),6.16–6.06(m,3h),4.75–4.64(m,2h),4.47(d,j=11.3hz,1h),3.59(d,j=10.5hz,1h),3.07(s,3h),2.97(s,3h),2.80(d,j=12.6hz,1h),2.69(br,1h),2.63–2.53(m,2h),2.32(br,1h),2.12(t,j=12.5hz,1h),1.79–1.70(m,1h),1.68(s,3h),1.42(s,4h),1.21(br,1h),0.96(d,j=6.0hz,3h),0.89(s,1h),0.85(d,j=6.0hz,3h),0.78(d,j=6.4hz,3h),0.72(d,j=6.3hz,3h),0.39(d,j=5.6hz,3h);13cnmr(100mhz,dmso)δ171.0,170.9,169.3,168.6,147.3,139.6,137.7,133.5,130.9,129.7,129.3,128.3,127.5,125.4,125.0,121.6,84.1,77.2,61.4,59.2,58.0,55.1,52.9,41.6,37.5,31.0,30.9,30.7,29.7,24.3,19.3,16.5,14.9,14.6,10.6,10.1,9.4;hrms–maldi(m/z):[m+na]+calcdforc42h55cl2n3o8na+,822.3258;found:822.3263.
实施例2:合成了nannocystin衍生物1b(r1=br,r2=h)
化合物1b的相关数据:[α]d26=-36.02(c0.1,chcl3);ir(kbr)νmax:3337,2963,1741,1663,1498,1414,1261,1096,1021,800cm-1;1hnmr(400mhz,dmso)δ9.89(s,1h),8.56(d,j=9.6hz,1h),7.89(d,j=9.1hz,1h),7.46(s,1h),7.36(dt,j=17.4,8.0hz,5h),7.10(d,j=8.1hz,1h),6.75(d,j=8.3hz,1h),6.43–6.33(m,1h),6.11(dd,j=16.5,11.5hz,3h),4.78–4.63(m,2h),4.47(d,j=11.1hz,1h),3.61(d,j=10.1hz,1h),3.08(s,3h),2.97(s,3h),2.82(d,j=12.5hz,1h),2.70(s,1h),2.63(d,j=10.3hz,1h),2.56(d,j=12.3hz,1h),2.32(s,1h),2.12(t,j=12.3hz,1h),1.75(d,j=28.0hz,1h),1.69(s,3h),1.41(d,j=17.0hz,4h),1.24(s,1h),0.97(d,j=6.2hz,3h),0.85(d,j=6.4hz,4h),0.78(t,j=7.1hz,3h),0.73(d,j=6.4hz,3h),0.39(d,j=6.0hz,3h);13cnmr(100mhz,dmso)δ171.2,170.9,169.4,168.6,152.3,139.6,137.6,133.6,133.4,129.9,129.1,128.3,127.4,125.5,125.1,115.6,108.7,84.03,77.2,61.3,59.2,58.0,55.2,55.1,52.9,41.6,37.7,31.0,30.9,30.7,29.7,24.2,19.2,16.6,14.9,14.8,10.6,10.1,9.5;hrms–maldi(m/z):[m+na]+calcdforc42h56brn3o8na+,832.3143;found:832.3148.
实施例3:分子对接模拟计算
为了探究nannocystin系列化合物的结合模式,我们将合成的衍生物1a、1b与ef-1α结合蛋白进行对接模拟。正如之前的报道,化合物nannocystins可以和ef-1α的表面空腔结合。对接结果表明所有含有二甲基基团化合物的二甲基部分都是位于氨基酸残基ala397附近的疏水空腔中,但是具有羟基缬氨酸残基天然产物nannocystina和nannocystin6(结构见附图1)的结合方式却不同于去羟基衍生物1a和1b。nannocystina和nannocystin6的羟基可与氨基酸残基arg379形成距离为2.61å的氢键,然而在1a和1b中与arg379形成氢键的是其酚羟基部分(见附图2)。这些对接结果与我们的生测数据是吻合的。
实施例4:nannocystin衍生物1a、1b药理作用
hct-116细胞株培养在含10%胎牛血清的dmem培养基中,在37度,5%二氧化碳的培养箱中生长。对数期细胞种在96孔不透光板上,每孔100ul新鲜培养基,过夜生长。一系列化合物稀释后加入细胞孔中终浓度100-0.005nm。72小时后96孔板从培养箱取出,室温平衡30分钟。每孔加入100ulcglk(promega)试剂,并在恒温摇床震荡2分钟,室温10分钟孵育后,用酶标仪测量荧光信号,数据用graphpad5统计分析。结果显示化合物1a、1b对hct-116有良好的抑制活性,其ic50分别为7.0±4.8nm和3.3±0.5nm。
- 还没有人留言评论。精彩留言会获得点赞!
- 用于生产化学品及其衍生物的组合物和方法与制造工艺
- 7‑OH‑8‑[(1‑胺基‑1‑苯基衍生物)‑次甲基]‑黄酮化合物及其制备方法及其应用与制造工艺
- 联苯胺衍生物、其制造方法和电子照相感光体与制造工艺
- 包含环糊精衍生物的可注射美法仑组合物及其制备和使用方法与制造工艺
- 含D型非天然氨基酸的抗菌肽类似物及其合成与应用的制造方法与工艺
- 一种黄芪甲苷衍生物及其制备方法和应用与制造工艺
- (Z,E)5‑OH‑3‑(苯基衍生物‑次甲基)‑二氢黄酮‑7‑O‑糖苷及其制备及其应用的制造方法与工艺
- 喹唑啉衍生物的制造方法与工艺
- 一种白杨素氨基酸衍生物的制备方法与制造工艺
- Harrisotone A衍生物的组合物在防治肝脏损伤药物中的应用的制造方法与工艺
- 联苯胺衍生物、其制造方法和电子照相感光体与制造工艺
- 包含环糊精衍生物的可注射美法仑组合物及其制备和使用方法与制造工艺
- 一种黄芪甲苷衍生物及其制备方法和应用与制造工艺
- (Z,E)5‑OH‑3‑(苯基衍生物‑次甲基)‑二氢黄酮‑7‑O‑糖苷及其制备及其应用的制造方法与工艺
- 喹唑啉衍生物的制造方法与工艺
- 吡唑衍生物及其作为大麻素受体介体的用途的制造方法与工艺
- Harrisotone A衍生物的组合物在防治肝脏损伤药物中的应用的制造方法与工艺
- 水生态处理中淤泥及衍生物的再利用处理系统的制造方法与工艺
- Schiglautone A衍生物的组合物用于制备抗缺氧药物的制作方法
- Schiglautone A衍生物的组合物用于制备抗红细胞低下性贫血药物的制作方法