犬瘟热病毒弱毒疫苗株及其应用的制作方法
本发明涉及一株由犬瘟热病毒(caninedistempervirus,cdv)强毒株传代致弱的弱毒疫苗株hba株,本发明还涉及该弱毒疫苗株在制备预防由犬瘟热病毒所致疾病的药物中的用途,以及该弱毒疫苗株在在制备治疗、诊断或检测犬瘟热病毒所致疾病中的用途,属于犬瘟热病毒的防治领域。
背景技术:
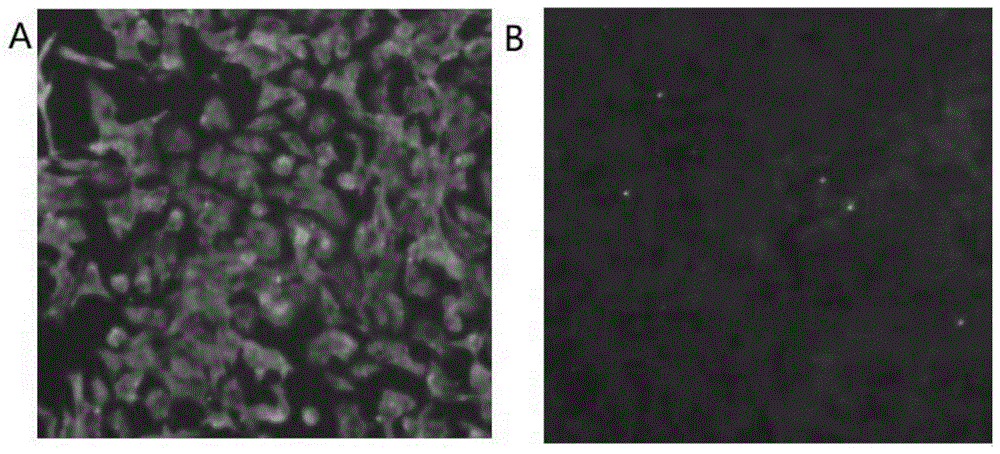
:犬瘟热病毒是引起犬科、鼬科及一部分浣熊科或其它食肉目动物犬瘟热的病原。幼龄未免疫动物感染犬瘟热病毒后多表现为急性致死性经过,临床上以双相热型、结膜炎、严重的呼吸系统和消化系统炎症,以及后期出现神经症状为主要特征,成年动物可耐过或呈慢性持续性感染。目前犬瘟热病毒在世界范围内呈广泛性流行,感染宿主的范围不断扩大,多种动物都能感染和传播该病原。目前对于本病尚无特效疗法,防制本病的最有效措施是定期接种犬瘟热疫苗。自20世纪50~60年代基于鸡胚或vero细胞传代致弱的onderstepoort株等犬瘟热弱毒苗在全世界得到广泛应用以来,犬瘟热在全球的暴发得到了有效的控制。但近二十年来,某些地区免疫动物,感染犬瘟热病毒的病例时有报道。因此研制新型高效的犬瘟热疫苗尤为重要。技术实现要素:本发明目的之一是提供一株由犬瘟热病毒强毒株传代致弱的弱毒疫苗株(hba株)。本发明目的之二是将上述弱毒疫苗株应用于制备治疗、预防或诊断犬瘟热病毒所致疾病药物或试剂中。本发明目的是通过以下技术方案来实现:犬瘟热病毒强毒株的分离与鉴定:取河北某水貂养殖场疑似犬瘟热发病水貂脾脏、淋巴结等组织研磨后接种vero细胞分离病毒,经免疫荧光试验、rt-pcr鉴定、序列分析、纯净性检验和动物回归试验,确定分离株为犬瘟热病毒强毒株,命名为犬瘟热病毒hbv株。犬瘟热病毒传代致弱:将犬瘟热病毒hbv株接种vero细胞连续传代至100代,测定不同代次病毒液对水貂的致病性和免疫原性,结果经vero细胞传代后对水貂的致病力逐渐减弱,传代至第60代对水貂已没有致病力;测定第60、80、100代病毒液对水貂的免疫原性,结果均5/5保护,免疫原性良好。测定100代病毒液对犬的致病性和免疫原性,结果100代病毒液对犬无致病性,免疫犬强毒攻击后,5/5保护。毒力返强试验表明,100代病毒液接种水貂并在水貂体内继代5次,接种水貂均无犬瘟热临床症状,未出现毒力返强。将100代及其以后的代次命名为犬瘟热病毒弱毒疫苗株(hba株)。本发明将所涉及犬瘟热病毒(caninedistemper)弱毒疫苗株(hba株)提交专利认可机构保藏,微生物保藏号为:cgmccno.15036;保藏时间是:2018年11月13日;保藏单位是:中国微生物菌种保藏管理委员会普通微生物中心;保藏地址是:北京市朝阳区北辰西路1号院3号,中国科学院微生物研究所。本发明弱毒疫苗株制备的活疫苗具有遗传性稳定,免疫持久,效果好,安全可靠、保存期长等优点,与现有上市产品相比,具有免疫产生期更早,免疫持续期更长。本发明弱毒疫苗株使用范围广泛,例如,可应用于制备治疗、诊断或检测犬瘟热病毒所致疾病试剂或试剂盒,还可应用于制备活疫苗或灭活疫苗单苗或联苗等。本发明目的之三是采用上述弱毒疫苗株制备抗犬瘟热免疫球蛋白,应用于制备预防、治疗或诊断犬瘟热病毒所致疾病试剂或试剂盒。本发明目的是通过以下技术方案来实现:1)免疫原采用所述的犬瘟热弱毒疫苗株;2)免疫原免疫健康动物制备犬瘟热病毒高免血清;3)从犬瘟热病毒高免血清中提取免疫球蛋白igg;任选地,4)纯化igg。抗犬瘟热免疫球蛋白可用于制备免疫球蛋白制剂,可有效的预防和治疗犬、狐、水貂的犬瘟热,按照每kg体重皮下注射1ml用量连续注射3天,无不良反应,血液中犬瘟热病毒中和抗体效价不低于1:64,且持续时间不低于15日。抗犬瘟热免疫球蛋白还可用于制备检测犬瘟热病原的试剂盒,例如elisa试剂盒或胶体金试纸条,特异性、灵敏性均佳。附图说明图1所示为犬瘟热病毒hbv株免疫荧光染色图(a:犬瘟热病毒hbv株;b:阴性对照)。图2所示为犬瘟热病毒hbv株n基因引物pcr产物电泳图(m:dl2000;s:犬瘟热病毒hbv株;p:水貂犬瘟热活疫苗(cdv3-cl株);c:双蒸水)。具体实施方式以下实施例用于说明本发明,但不用来限制本发明的范围。实施例1犬瘟热病毒强毒株hbv株的分离与鉴定试验用水貂购自犬瘟热病毒抗体阴性的健康水貂。病毒分离培养河北某水貂养殖场疑似犬瘟热发病水貂脾、淋巴结制备的组织上清液接种vero细胞盲传至第4代时,细胞出现犬瘟热病毒特有的融合性细胞病变,接毒细胞胞浆内颗粒变性,融合成合胞体。免疫荧光试验采用犬瘟热病毒单克隆荧光抗体进行第5代病毒液免疫染色,细胞对照孔无特异性绿色荧光,分离株接种孔出现弥漫型的特异性绿色荧光,为阳性。见图1。pcr鉴定采用n基因引物进行扩增,使用引物见表1,反应条件见表2,扩增产物经1%琼脂糖凝胶电泳,溴化乙锭染色,紫外灯下观察,分离株扩增到特异目的片段(图2)。表1犬瘟热病毒n基因扩增引物引物名称引物序列cdvn-f5’-gttagctagtttcatcct-3’seqidno.1cdvn-r5’-ggtcctctgttgtcttgg-3’seqidno.2表2犬瘟热病毒n基因扩增pcr反应条件序列分析犬瘟热病毒n基因序列不同毒株间高度保守,分离株与犬瘟热病毒参考株onderstepoort株序列同源性达99.6%。纯净性检验按照现行《中国兽药典》进行检验,分离株无菌生长,无支原体和外源病毒污染。动物回归试验将分离株病毒液接种水貂3只,皮下注射5.0ml/只,同时设对照水貂3只。接种后隔离饲养,逐日观察临床症状。接种组水貂2/3出现体温高达40℃以上,3/3出现出现眼鼻分泌物,2/3眼鼻分泌物安捷犬瘟热病毒抗原快速检验试纸检测出现阳性,对照水貂均为健活,眼鼻分泌物用安捷犬瘟热病毒抗原快速检验试纸检测均为阴性。实施例2犬瘟热病毒传代致弱犬瘟热病毒连续传代将犬瘟热病毒hbv株接种vero细胞单层,置37℃、5%co2条件下培养,融合性细胞病变达到80%左右后冻融收获病毒液,记为f1代。如此连续传代至f100代。病毒含量测定取f20、f40、f60、f80、f100代病毒液进行病毒含量测定,结果见表3。表3犬瘟热病毒hbv株不同代次病毒含量对水貂的致病性试验将f20、f40、f60、f80、f100代病毒液分别接种2月龄水貂5只,传代至第60代对水貂已没有致病力,结果见表4。表4犬瘟热病毒hbv株不同代次对水貂的致病性代次f20f40f60f80f100发病率60%20%000水貂免疫原性试验取f60、f80、f100代病毒液稀释成104.0tcid50/ml,皮下接种水貂5只,1ml/只,同时设对照水貂5只,免疫后21日对所有水貂进行攻毒,每只滴鼻接种1ml、皮下注射4ml犬瘟热病毒sd04株组织毒,连续临床观察21日。结果对照组水貂5/5发病,免疫组水貂均5/5保护。对犬的致病性试验将f100代病毒液分别接种2月龄健康比格犬5只,同时设对照犬3只,连续临床观察21日。接种犬与对照犬无明显差异,均健活。犬免疫原性试验取f100代病毒液稀释成104.0tcid50/ml,皮下接种2月龄比格犬5只,1ml/只,同时设对照犬5只,免疫后21日对所有犬进行攻毒,每只滴鼻接种1ml、皮下注射4ml犬瘟热病毒sd04株组织毒,连续临床观察21日。结果对照组犬4/5发病,免疫组犬5/5保护。纯净性检验犬瘟热病毒hbv株100代病毒液按照现行《中国兽药典》进行检验,无菌生长,无支原体和外源病毒污染。毒力返强试验取f100代病毒液接种水貂并在水貂体内继代5次,接种水貂均无犬瘟热临床症状,未出现毒力返强。菌种保藏根据免疫原性及致病性试验结果表明,犬瘟热病毒hbv株接种vero细胞连续传代至100代,对水貂和犬均无致病性,且对水貂和犬的免疫原性均良好,确定犬瘟热病毒hbv株f100代及其以后的代次作为犬瘟热病毒弱毒疫苗株毒种,命名为犬瘟热病毒hba株,微生物保藏号为:cgmccno.15036。实施例3犬瘟热活疫苗的制备犬瘟热病毒抗原的制备犬瘟热病毒毒种按2%比例接种vero细胞单层,33℃培养,当细胞病变达到80%以上冻融收获病毒液,病毒含量达到104.5tcid50/ml,纯净性检验合格后可用于犬瘟热活疫苗的制备。犬瘟热活疫苗的制备和检验将犬瘟热病毒抗原与适宜冻干保护剂(蔗糖明胶冻干保护剂)按照5:1的体积比混匀后,定量分装疫苗瓶中冻干,病毒含量达到104.0tcid50/头份,剩余水分、真空度、无菌、支原体、外源病毒检验合格即为合格疫苗。实施例4犬瘟热活疫苗与水貂犬瘟热活疫苗(cdv3-cl株)比较试验试验用疫苗按照实施例方法3制备3批犬瘟热活疫苗(hba株),批号分别为201401、201402、201403。安全性试验30只犬瘟热病毒抗体阴性的健康2月龄水貂随机分为6组,3批犬瘟热活疫苗(hba株)和1批水貂犬瘟热活疫苗(cdv3-cl株)分别分两点皮下注射水貂各5只,每只各2ml(含10头份),设不接种对照水貂。疫苗接种后每日检测体温,观察体温、精神、食欲、眼鼻泌物等生理指标,所有疫苗超剂量接种水貂后均无异常反应,精神状态良好,行为活动正常,无眼鼻分泌物,采食饮水正常,排便正常,体温均在正常范围,与对照水貂无显著差异,注射部位均无硬结、红肿或压痛,无过敏、应激等全身反应。免疫持续期试验30只犬瘟热病毒抗体阴性的健康2月龄水貂随机分为6组,3批犬瘟热活疫苗(hba株)和1批水貂犬瘟热活疫苗(cdv3-cl株)分别皮下注射水貂各5只,每只各1ml(含1头份),设不接种对照水貂,分别于免疫后7日、14日、21日、28日、2个月、3个月、4个月、5个月、6个月、7个月、8个月采血,分离血清,检测犬瘟热病毒中和抗体效价。结果3批犬瘟热活疫苗(hba株)免疫水貂犬瘟热病毒中和抗体效价几何平均值均高于水貂犬瘟热活疫苗(cdv3-cl株)免疫水貂,犬瘟热活疫苗(hba株)免疫水貂免疫后14日~6个月100%抗体效价≥1:45,免疫后8个月80%(27/30)抗体效价≥1:45,水貂犬瘟热活疫苗(cdv3-cl株)免疫水貂免疫后14日80%抗体效价≥1:45,免疫后21日~4个月100%抗体效价≥1:45,免疫后6个月60%抗体效价≥1:45。具体结果见表5。表5水貂免疫不同疫苗犬瘟热病毒中和抗体效价检测结果1:x(gmt)实施例5犬瘟热活疫苗的保存期试验试验用疫苗按照实施例方法3制备3批犬瘟热活疫苗(hba株),批号分别为201401、201402、201403。3批犬瘟热活疫苗(hba株)置于2~8℃保存,于12个月、18个月、24个月取样,进行性状、真空度、剩余水分含量、病毒含量检测。结果表明3批犬瘟热活疫苗(hba株)置于2~8℃保存24个月,性状、真空度、剩余水分均合格,病毒含量均不低于104.0tcid50/头份。免疫攻毒保存12个月的3批犬瘟热活疫苗(hba株)皮下接种2月龄健康水貂5只,1头份/只,同时设对照犬5只,免疫后21日对进行攻毒,对照组水貂4/5发病,免疫组水貂5/5保护。保存24个月的3批犬瘟热活疫苗(hba株)皮下接种2月龄健康水貂5只,1头份/只,同时设对照犬5只,免疫后21日对进行攻毒,对照组水貂5/5发病,免疫组水貂4/5保护。实施例6抗犬瘟热免疫球蛋白的制备和应用免疫原的制备按照前述方法制备的犬瘟热病毒液按1/50比例加入1mol/l的zn(ac)2,4℃静置沉淀60分钟,10000r/min离心30分钟,弃上清,沉淀以饱和edta4℃溶解即为病毒浓缩液。取病毒浓缩液以蔗糖密度梯度离心进行纯化21000r/min4℃离心90分钟,收集可见病毒条带,30000r/min4℃离心90分钟,沉淀用pbs缓冲液悬浮,即为纯化抗原。纯化抗原与弗氏佐剂等量混合制备免疫原。高免血清制备取健康犬(检验犬细小病毒、犬腺病毒、犬副流感病毒、犬冠状病毒、狂犬病毒抗体阴性)皮下注射免疫原,2.0ml/只,7日后二免,21日后三免,二免、三免4.0ml/只,三免后一周采血测定犬瘟热病毒中和抗体效价,达到1:1024后经无菌采血,分离血清,过滤除菌。纯化免疫球蛋白将血清先与等体积的pbs(20mmol/l,ph值7.0)混合,然后边摇边缓慢加入2倍血清体积的饱和硫酸铵,混匀后4℃作用30分钟,3000r/min离心30分钟,沉淀以2倍血清体积的pbs进行重悬,缓慢加入1倍血清体积的饱和硫酸铵,混匀后4℃作用30分钟,3000r/min离心30分钟,沉淀再以1倍血清体积的pbs进行重悬,置pbs中4℃透析24小时获得粗提igg。然后经蛋白g亲和层析纯化igg。纯度和效价检验进行sds-page,扫描电泳图谱,通过bandscan软件分析蛋白纯度,纯度不低于90.0%。测定犬瘟热病毒中和抗体效价不低于1:1024。以上所述仅是本发明的优选实施方式,应当指出,对于本
技术领域:
的普通技术人员来说,在不脱离本发明技术原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。序列表<110>北京大北农科技集团股份有限公司动物医学研究中心北京大北农科技集团股份有限公司<120>犬瘟热病毒弱毒疫苗株及其应用<160>2<170>siposequencelisting1.0<210>1<211>18<212>dna<213>犬瘟热病毒(caninedistempervirus)<400>1gttagctagtttcatcct18<210>2<211>18<212>dna<213>犬瘟热病毒(caninedistempervirus)<400>2ggtcctctgttgtcttgg18当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1