生物合成3、4-二羟基苯乙酸的方法与流程
本发明涉及生物技术和代谢工程领域,更确切的说,本发明涉及异源生物合成3、4-二羟基苯乙酸(3,4-dhpa)的代谢途径及基因调控的方法,选择来源于细菌,真菌或蛋白质工程改造的外源酶,选用原始或改造过的细菌,真菌,植物细胞或动物细胞作为宿主细胞,并通过red重组基因编辑手段进行基因调控,最终提高了3、4-二羟基苯乙酸的产量以及碳源收率。
背景技术:
酚酸因其抗氧化,抗菌和其他生物活性而广泛用于食品,化妆品和制药工业。3,4-二羟基苯乙酸是天然存在的酚酸,其表现出强大的自由基清除活性。它可以减少脂质过氧化,并且可以潜在地用作天然抗氧化剂来代替丁基化羟基甲苯(bht)和丁基化羟基苯甲醚(bha)以稳定食用油。3,4-dhpa还显示了几种对健康有益的活性。它是饮食中槲皮素糖苷和黄酮类的主要生物活性分解代谢物,也是水果和蔬菜中最丰富的酚酸之一,并且对细胞凋亡,线粒体功能障碍和氧化应激等具有保护作用,能诱导胱氨酸转运酶、谷胱甘肽转运酶、血红素氧合酶、细胞色素酶等的的表达。在前列腺癌和结肠癌细胞中,3,4-dhpa还表现出强烈的抗增殖活性。此外,3,4-dhpa还可以抑制脂多糖刺激的外周血单核细胞中促炎细胞因子的分泌和静息血小板中p-选择蛋白的表达。
尽管3,4-dhpa有着的显著的健康益处,但迄今为止还缺乏经济又环保的3,4-dhpa的生产方法。因此,有必要建立有效的合成策略,以提供足够量的3,4-dhpa化合物以用于探索和应用其多种功能。从天然来源提取3,4-dhpa受到低纯度、低效率、高成本的限制。对于化学合成,苯环上的区域选择性邻羟基化一直是具有挑战性的,并且化学合成也将面对高污染、低收率、高成本、耗时长等问题。以前的研究使用苯乙酸(paa)的电化学转化生产3,4-dhpa,但形成了二羟基化paa的混合物,使产物难以分离。因此,采用绿色又高效的生物合成方法就成为了生产3,4-dhpa最好的选择。
本发明主要目的在于实现3,4-dhpa的生物学方法的高效合成。筛选了催化效率较高的4-羟基苯乙酸3-单加氧酶hpabc来实现从4-羟基苯乙酸到3,4-dhpa的生物转化。同样人工设计了新的代谢途径实现了3,4-dhpa的从头合成,另外本发明还公开了一种敲除宿主基因组中编码丙酮酸激酶的基因pyka和pykf的基因调控策略,以及一种分别采用纯葡萄糖、纯甘油、葡萄糖与甘油混合为碳源来实现产量与生长协调的动态调控策略。实验结果表明,在优化发酵条件下,4-羟基苯乙酸到3,4-dhpa的生物转化在48h能达到100%的转化率;而通过从头合成,3,4-dhpa能达到1856±67mg/l的最大产量以及0.1741%的最大碳源收率。
技术实现要素:
本发明的目的是提供了高产3,4-dhpa的宿主,通过向原始或改造过的细菌,真菌,植物细胞或动物细胞中导入一条高效生产3,4-dhpa的途径,选择来源于细菌,真菌或蛋白质工程改造的4-羟基苯乙酸3-单加氧酶hpabc,通过hpabc在宿主中的高效表达,实现3,4-dhpa从4-羟基苯乙酸的生物合成。
一种生物合成3、4-二羟基苯乙酸的方法,其特征在于:在30-37℃和ph为6-8下,4-羟基苯乙酸3-单加氧酶hpabc催化3到60小时,将催化4-羟基苯乙酸生成3、4-二羟基苯乙酸。
筛选来源于细菌,真菌或经过蛋白质工程改造的编码4-羟基苯乙酸3-单加氧酶的基因hpabc。3、4-二羟基苯乙酸生产途径的宿主包括细菌,真菌,植物细胞或动物细胞,也包括改造过的细菌,真菌,植物细胞或动物细胞。
将宿主基因组中编码丙酮酸激酶的基因pyka、pykf或pyka和pykf都敲除,提高3、4-二羟基苯乙酸产量。
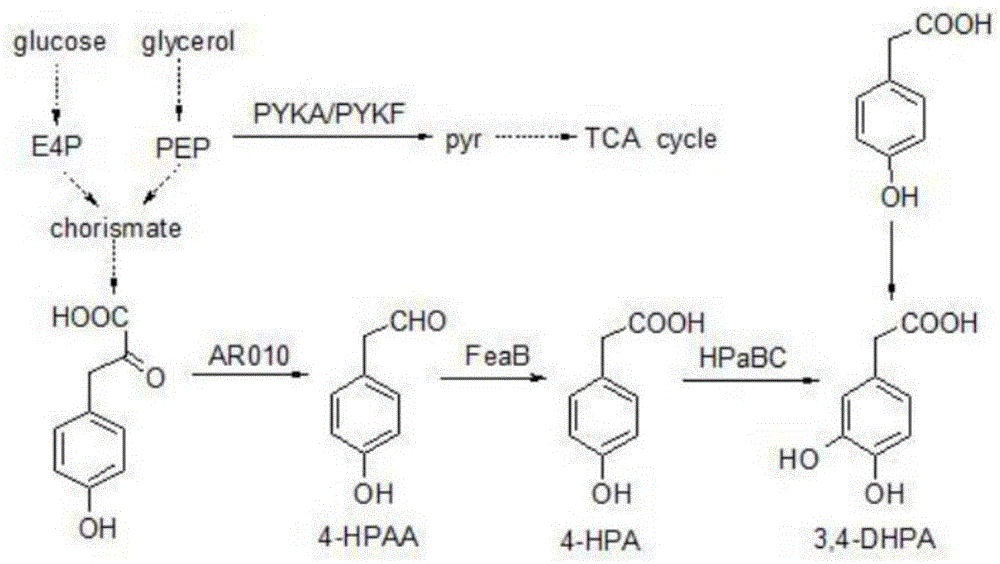
本发明还提供了微生物产3,4-dhpa的方法:第一种方法是体外添加底物4-羟基苯乙酸,向原始或改造过的细菌,真菌,植物细胞或动物细胞中导入4-羟基苯乙酸3-单加氧酶hpabc,并将其构建到中拷贝的载体上表达。然后,将此产3,4-dhpa的宿主在lb试管培养基中过夜培养,之后转接1%-4%体积的菌液到添加了3g/l的4-羟基苯乙酸的m9培养基中,在37℃培养48h。添加诱导剂后每隔12h取样测od,并用高效液相色谱测定3,4-dhpa的浓度。第二种方法是从头合成,向原始或改造过的细菌,真菌,植物细胞或动物细胞中导入预苯酸脱氢酶tyra,磷酸烯醇丙酮酸合酶ppsa,转酮酶tkta,3-脱氧-d-阿拉伯糖-庚糖酸-7-磷酸合成酶arog,氨基转移酶at,酮酸脱羧酶aro10,苯乙醛脱氢酶feab,4-羟基苯乙酸3-单加氧酶hpabc,分别在高拷贝质粒中表达aro10、feab和中拷贝质粒中表达hpabc、tyra、ppsa、tkta、arog。然后在37℃下,将此菌株接种到以葡萄糖(glucose)或甘油(glycerol)为碳源的m9培养基中进行发酵,并从发酵液中取样,利用高效液相色谱对12h、24h、36h、48h的发酵液产物的浓度进行分析。
本发明还提供了微生物高产3,4-dhpa的方法,具体有以下几种:第一是优化了表达模块,将hpabc从高拷贝表达优化为中拷贝表达,使上下游酶量表达平衡。第二是引入了基因调控策略,敲除了编码丙酮酸激酶的基因pyka、pykf减少了副产物的产生,增加了产物的形成。第三是引入了产量与生长协调的动态调控策略,选择以葡萄糖为单一碳源实现宿主的快速生长,选择以甘油为单一碳源实现3,4-dhpa的高效生产,选择以葡萄糖与甘油的混合碳源(2:1)实现产量与生长的动态调控。最终,在体外添加实验中,在48h,3g/l的4-羟基苯乙酸被100%转化为3,4-dhpa;在从头合成中,从甘油和葡萄糖的混合碳源出发,3,4-dhpa能达到1856±67mg/l的最大产量以及0.1714%的碳源收率;从甘油出发,3,4-dhpa能达到1750±73mg/l的产量以及0.1741%的最大碳源收率。
如上文所述,本发明涉及3,4-dhpa的有效生产方法和高产宿主,所述方法和宿主的特征在于:通过筛选活性高及高效表达的酶,构建生物合成3,4-dhpa的人工途径,设计基因调控策略、产量与生长协调的动态调控策略的方法,并且优化发酵过程中的培养基及培养条件,从而实现3,4-dhpa的高效合成。
附图说明
图1从头合成与添加实验产3,4-dhpa的路径;
图2导入4-羟基苯乙酸3-单加氧酶(hpabc)基因的原始或改造过的细菌,真菌,植物细胞或动物细胞生物转化4-hpa为3,4-dhpa的发酵结果;
图3导入氨基转移酶(at),酮酸脱羧酶(aro10),苯乙醛脱氢酶(feab),4-羟基苯乙酸3-单加氧酶(hpabc),莽草酸途径tyrafbr,ppsa,tkta和arogfbr酶基因的原始或改造过的细菌,真菌,植物细胞或动物细胞,从葡萄糖,甘油出发头合成3,4-dhpa的发酵结果;
图4将宿主基因组中编码丙酮酸激酶的基因pyka、pykf或pyka和pykf分别敲除,有效阻止pep大量转化为丙酮酸后,从葡萄糖,甘油出发头合成3,4-dhpa的发酵结果;
具体实施方式
具体实施例1
通过体外添加4-羟基苯乙酸产3,4-dhpa
通过序列比对(https://blast.ncbi.nlm.nih.gov)与modeller软件同源建模分析,筛选来源于细菌,真菌或蛋白质工程改造的4-羟基苯乙酸3-单加氧酶hpabc。其中hpabc的改造包括f101a、s112g、a128n、e144t、p152y。通过pcr技术从质粒或微生物基因组中获得4-羟基苯乙酸3-单加氧酶(hpabc)的基因片段,接着,利用限制性核酸内切酶对基因片段和质粒载体进行酶切,将酶切后的片段进行胶回收或柱回收,然后将4-羟基苯乙酸3-单加氧酶(hpabc)目的基因插入到质粒pcs27(中拷贝)上,获得pcs-hpabc重组质粒,并利用pcr、酶切进行质粒验证。
利用电转法制备大肠杆菌bw25113(原始大肠杆菌中敲除了laczwj16、hsdr514、arabadah33、rhabadld78)的感受态细胞,并吸取100μl于1.5ml的ep管中与4μl已经构建好的质粒pcs-hpabc充分混合,并置于冰上10min预冷。接着将混合充分的菌液与质粒加入电击杯中,并利用电转仪将质粒电转进入感受态细胞。电转完成后,加入700μllb培养基,混合均匀,并将混合物转移到1.5ml离心管中,在37℃下复苏30min。之后取100μl菌液涂到含有卡那霉素抗生素的平板上,37℃过夜培养。构建成生物转化4-羟基苯乙酸到3,4-dhpa的菌株bw(pcs-hpabc)。
在菌株bw(pcs-hpabc)的平板上挑取平行的三个单菌落,接到4ml的带有卡那霉素抗性的液体lb中,37℃下培养12h,之后将lb中1ml(2%体积比)的菌液接种到50ml的带有卡那霉素抗性的m9培养基(培养基成分包括7g/lna2hpo4,3g/lkh2po4,0.5g/lnacl,1g/lnh4cl,2.5g/l葡萄糖,5g/l酵母粉,2g/l3-吗啉丙磺酸(mops)中,并直接添加终浓度为3g/l的4-羟基苯乙酸,然后在37℃、200r/min的摇床中培养3小时,3小时后加入诱导剂iptg进行诱导,其浓度为1mm。之后分别在12小时,24小时,36小时和48小时的时候取样,用紫外分光光度计测定其生长情况,并用高效液相色谱测定3,4-dhpa的浓度以及底物的消耗情况。通过添加实验,在48h,3g/l是4-羟基苯乙酸将被完全转化为3,4-dhpa,转化率100%。(图2)
具体实施例2
从简单碳源从头合成3,4-dhpa
通过序列比对(https://blast.ncbi.nlm.nih.gov)分析以及文献中所报道的酶活性对比,筛选来源于细菌,真菌或蛋白质工程改造的预苯酸脱氢酶tyra,磷酸烯醇丙酮酸合酶ppsa,转酮酶tkta,3-脱氧-d-阿拉伯糖-庚糖酸-7-磷酸合成酶arog,氨基转移酶at,酮酸脱羧酶aro10,苯乙醛脱氢酶feab,4-羟基苯乙酸3-单加氧酶hpabc,可将葡萄糖和甘油分别转化为4-磷酸赤藓酮(e4p)和磷酸烯醇式丙酮酸(pep),然后通过莽草酸途径催化为分支酸(chorismate)、对羟基苯丙酮酸、对羟基苯乙醛(4-hpaa)、对羟基苯乙酸(4-hpa),继而转化为3,4-dhpa。其中hpabc的改造包括f101a、s112g、a128n、e144t、p152y,tyra改造为tyrafbr,arog改造为arogfbr。然后用pcr获得氨基转移酶(at),酮酸脱羧酶(aro10),苯乙醛脱氢酶feab,4-羟基苯乙酸3-单加氧酶(hpabc)和增强莽草酸途径的tyrafbr,ppsa,tkta和arogfbr酶的基因片段,之后将目的基因片段插入到质粒pze12-luc(高拷贝)和pcs27(中拷贝)上,获得质粒pze-aro10-feab-hpabc、pze-aro10-feab、pcs-tpta与pcs-tpta-hpabc。
取构建好的质粒pze-aro10-feab-hpabc2μl与pcs-tpta2μl混合,取pze-aro10-feab2μl与pcs-tpta-hpabc2μl混合,分别电转到已经被制成感受态的100μl大肠杆菌中,电转完成后,加入700μllb培养基,并将混合物转移到1.5ml离心管中,在37℃下复苏30min。之后取100μl菌液涂到含有氨苄霉素,卡那霉素抗生素的平板上,37℃过夜培养。形成从头合成3,4-dhpa的菌株bw(pze-aro10-feab-hpabc,pcs-tpta),bw(pze-aro10-feab、pcs-tpta-hpabc)。
在大肠杆菌菌株bw(pze-aro10-feab-hpabc,pcs-tpta),bw(pze-aro10-feab、pcs-tpta-hpabc)的平板上挑取三个平行的单菌落,接到4ml的带有氨苄霉素,卡那霉素抗性的液体lb中,37℃培养12h,之后分别将1ml(体积比2%)的菌液接种到50ml的带有氨苄霉素,卡那霉素抗性的m9培养基,然后在37℃、200r/min的摇床中培养3小时后加入1mmiptg进行诱导。每隔12h进行取样,并用高效液相色谱测定3,4-dhpa的浓度。最终,发现模块优化的菌株bw(pze-aro10-feab、pcs-tpta-hpabc)3,4-dhpa的产量比bw(pze-aro10-feab-hpabc,pcs-tpta)高600mg/l,达916±48mg/l。(图3)
具体实施例3
通过基因调控策略提高3,4-dhpa产量
在产3,4-dhpa的途径之中,中间体磷酸烯醇式丙酮酸(pep)将大量被转化为丙酮酸(pyr),并进入三羧酸循环(tcacycle)。因此在宿主菌bw25113的基础上,将宿主基因组中编码丙酮酸激酶的基因pyka、pykf或pyka和pykf敲除,将有效阻止pep大量转化为丙酮酸(pyr),为3,4-dhpa的生物合成提供了大量前体,也减少了副产物的产生。通过red基因编辑技术,获得菌株δpykabw、δpykkbw和δpykapykfbw。接下来,分别将质粒pze-aro10-feab和pcs-tpta-hpabc一同电转进入三种工程菌株中,获得菌株δpykabw(pze-aro10-feab、pcs-tpta-hpabc)、δpykkbw(pze-aro10-feab、pcs-tpta-hpabc)和δpykapykfbw(pze-aro10-feab、pcs-tpta-hpabc)。
在平板上分别挑取上述三种菌株的三个平行的单菌落,接到4ml的带有氨苄霉素,卡那霉素抗性的液体lb中,并在37℃培养12h后分别转接到m9培养基中进行发酵。分别在12h、24h、36h、48h进行取样,并用高效液相色谱测定3,4-dhpa的浓度。最终,菌株δpykapykfbw(pze-aro10-feab、pcs-tpta-hpabc)达到了1856±67mg/l的最高产量(图4)。
- 还没有人留言评论。精彩留言会获得点赞!