一种SAA蛋白免疫原及其制备方法和抗人血清淀粉样蛋白A多克隆抗体与流程
本发明涉及免疫领域,具体而言,涉及一种saa蛋白免疫原及其制备方法和抗人血清淀粉样蛋白a多克隆抗体。
背景技术:
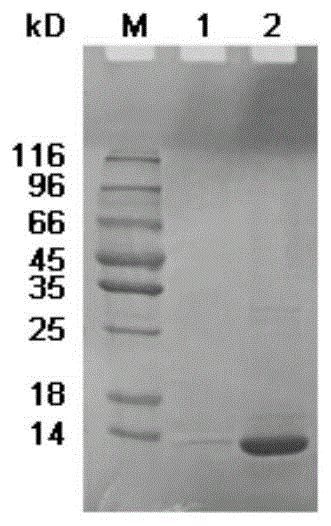
:抗原通常是由多个抗原决定簇组成。由一种抗原决定簇刺激机体,由一个b淋巴细胞接受该抗原刺激所产生的抗体称之为单克隆抗体(moncloneantibody)。由多种抗原决定簇刺激机体,相应地就产生各种各样的单克隆抗体,这些单克隆抗体混杂在一起就是多克隆抗体(polyclonalantibody)。人血清淀粉样蛋白a(serumamyloidaprotein,saa),属于载脂蛋白家族中的异质类蛋白质,相对分子量约12000da。saa是一个多态性蛋白的总称,由几个相关但各具独立基因的蛋白(saa1、saa2、saa3和saa4)组成。其中人saa1和人saa2蛋白只有5个氨基酸的差别,它们均编码急性期saa蛋白,在炎症反应中作用相近。人saa3是一个假基因,人saa4(组成型蛋白,c-saa4)在急性期反应中变化不大,是一个在动态平衡中与高密度脂蛋白胆固醇一起出现的异形物。正常情况下,c-saa占体内总量的90%,是载脂蛋白总量的1%—2%,急性实相反应时,机体产生的促炎因子合成大量saa1-saa2(即a-saa),a-saa释放入血,而促炎因子并不刺激c-saa的表达升高,其仍呈低水平表达并结合于hdl3上,不受a-saa表达升高的影响,因此主要是a-saa在体内参与机体的各种生理、病理反应。与c反应蛋白(c-reactiveprotein,crp)类似,saa蛋白的浓度是反映感染性疾病早期炎症的敏感指标,有助于诊断炎症、评估其活性、监控其活动及治疗。但是,saa蛋白的检测在诊断发生病毒感染、肾移植排斥反应的患者(特别是进行免疫抑制治疗的患者)以及用肾上腺皮质激素治疗的囊性纤维化患者方面,比crp蛋白更确凿。联合检测crp和saa蛋白能够有效区分感染性疾病的类型。鉴于saa在临床治疗及诊断中的重要性,目前国内外对saa的研究越来越重视。目前普遍用大肠杆菌表达系统,表达saa-6his及hsaa蛋白。saa的体外重组表达及纯化具有一定的优点,如其表达量较高,在不同表达条件下,在上清和包涵体中均有表达,纯化方法简单等。但另一方面,重组表达的saa蛋白非常容易形成聚集与降解,在体外的稳定性非常不好,并且不容易获得具有天然结构的saa蛋白,这些缺点大大地限制了saa的应用。有鉴于此,特提出本发明。技术实现要素:本发明的第一目的在于提供一种saa免疫原及其制备方法,通过蛋白交联剂溶液对saa蛋白处理,形成saa聚合体,得到的saa免疫原的免疫原性以及稳定性提升显著。本发明的第二目的在于提供一种抗人血清淀粉样蛋白a多克隆抗体,采用上述的saa免疫原对宿主免疫,得到的多克隆抗体。为了实现本发明的上述目的,特采用以下技术方案:一种saa免疫原的制备方法,所述saa蛋白采用蛋白交联剂溶液处理形成saa聚合体,得到saa免疫原。现有的saa蛋白稳定性较差,并且原核表达的saa蛋白免疫原性差,本发明发现,对saa蛋白采用蛋白交联剂溶液处理形成saa聚合体,获得跟天然结构类似的saa蛋白,免疫原性强,稳定性显著提高。蛋白质交联剂是一类小分子化合物,具有2个或者更多的针对特殊基团(-nh2、-cooh、-hs等)的反应性末端,可以和2个或者更多的分子分别偶联,从而使这些分子结合在一起。人血清淀粉样蛋白a(serumamyloidaprotein,saa),属于载脂蛋白家族中的异质类蛋白质,相对分子量约12000da。其蛋白家族包含4个成员,分别是saa1、saa2、saa3和saa4,其中saa1与saa2蛋白极其相似,它们只有5个氨基酸的差别,且这两种均与炎症相关。saa3是假基因,不编码蛋白,而saa4是组成型蛋白。并且,saa1蛋白占a-saa总组成成分的百分之八十以上,因此,本发明选择saa1基因对应的蛋白制备。进一步地,所述saa蛋白为saa1基因对应表达的蛋白。在一些实施例中,所述蛋白交联剂选自1-乙基-3(3-二甲氨丙基)碳二亚胺、n-羟基琥珀酰亚胺、戊二醛、琥珀酸酐中的任一种。在一些实施例中,所述蛋白交联剂为戊二醛,所述处理采用的戊二醛溶液的质量浓度为0.3%-1.2%,优选为0.6%-1%,更优选为0.6%-0.8%。在一些实施例中,所述戊二醛溶液处理为:4±2℃反应2-3h;优选为2-4℃反应2.5h。在一些实施例中,所述戊二醛溶液处理后还包括终止步骤。在一些实施例中,所述终止采用加入nahb4进行。在一些实施例中,加入终浓度为50mmtris-hcl(ph8.8)和10mmnahb4,终止反应8-15h。在一些实施例中,所述saa蛋白采用蛋白交联剂溶液处理时,所述saa蛋白处于含有nacl的pb中;其中,所述pb的浓度为20mm,ph8.0;nacl的浓度为100mm。在一些实施例中,终止完成后,聚合后的蛋白样透析至含有nacl的tris-hcl溶液中;其中,tris-hcl的浓度为25mm,ph8.0;nacl的浓度为100mm。在一些实施例中,终止完成后,聚合后的蛋白样透析的透析比大于10000:1。在一些实施例中,所述saa蛋白为人血清淀粉样蛋白a的saa1基因进行原核表达的蛋白,所述saa1基因的核苷酸序列为seqidno.1所示。在一些实施例中,所述原核表达所用的菌为大肠杆菌或枯草杆菌。进一步地,所述大肠杆菌选自e.colibl21(de3)、e.colibl21(de3)plys、blr(de3)、b834、dh5α、hb101或jm109。在一些实施例中,所述原核表达所用的原核表达载体选自pet28a、pet28b、pet28c、pet32、pmal、pkk、pbad或pbv22。进一步地,所述原核表达所用的表达载体为融合型原核表达载体,包括:启动子、纯化标签基因、蛋白酶切割位点、多克隆位点和终止子;在纯化标签基因和蛋白酶切割位点之间连接有saa1基因;多克隆位点位于蛋白酶切割位点和终止子之间。在一些实施例中,所述纯化标签基因位于启动子的下游;进一步地,所述启动子包括lac启动子、trp启动子、p1启动子、由lac启动子-10区和trp启动子-35区融合形成的tac启动子、tn5启动子中的任一种;进一步地,所述纯化标签包括his标签、avidin标签、t7标签、trx标签和myc标签中的任一种或多种。进一步地,所述蛋白酶切割位点的蛋白酶包括psp酶、肠激酶或凝血酶中的任一种。在一些实施例中,所述原核表达的蛋白采用以下方法制备:含有saa1基因的载体的原核生物诱导表达,裂解,得到重组saa蛋白;所述重组saa蛋白经沉淀、复溶、柱分离,得到的洗脱液,所述洗脱液进行透析,得到含有目的蛋白的透析液;对所述目的蛋白进行酶切,酶切后的蛋白进行反亲和处理、再生处理和柱分离,即得。本发明还提供了上述的方法制得的saa免疫原。经检测,得到的saa免疫原与天然saa蛋白具有类似的结构,并且稳定性明显增强。本发明还提供了一种抗人血清淀粉样蛋白a多克隆抗体,采用上述的saa免疫原对宿主免疫得到。进一步地,所述宿主包括为兔、大鼠、小鼠。本发明提供的多克隆抗体与其他蛋白不存在交叉反应,说明该多抗具有更好的识别特异性,还反应出该saa免疫原性优良。与现有技术相比,本发明的有益效果为:(1)本发明解决了saa蛋白免疫原的稳定性问题。(2)本发明提供的saa蛋白免疫原经处理后,具有类似天然结构的saa免疫原的结构,免疫原性强。(3)本发明提供的多克隆抗体与其他蛋白不存在交叉反应,说明该多抗具有更好的识别特异性,还反应出该saa免疫原性优良。(4)本发明提供的抗人血清淀粉样蛋白a多克隆抗体,检测临床标本,相关性达到0.985以上,能准确检测人血清中saa蛋白含量。附图说明为了更清楚地说明本发明实施例或现有技术中的技术方案,以下将对实施例或现有技术描述中所需要使用的附图作简单地介绍。图1为本发明实施例1中未经戊二醛聚合的saa蛋白不同处理后的电泳图;图2为本发明实施例1中经戊二醛聚合的saa蛋白不同处理后的电泳图;图3为本发明实施例1中hplc检测的saa蛋白峰图。具体实施方式下面将结合实施例对本发明的实施方案进行详细描述,但是本领域技术人员将会理解,下列实施例仅用于说明本发明,而不应视为限制本发明的范围。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。实施例1制备抗原人血清淀粉样蛋白a(serumamyloidaprotein,saa),属于载脂蛋白家族中的异质类蛋白质,相对分子量约12000。其蛋白家族包含4个成员,分别是saa1、saa2、saa3和saa4,其中saa1与saa2蛋白极其相似,它们只有5个氨基酸的差别,这两种均与炎症相关,其中,saa1占总组成成分的80%以上,且其为急性期炎症反应和慢性炎症反应的重要标志物。saa3是假基因,不编码蛋白,而saa4是组成型蛋白。因此,选择saa1基因进行克隆,将其克隆至pet32b载体上(pet32b载体含有trx标签蛋白),得到pet32b-saa1克隆。将pet32b-saa1克隆转化至e.coli大肠杆菌中进行原核表达。在37℃条件下培养菌体,使od600达到0.4-0.6之间,进行诱导。诱导条件为:温度:28℃,iptg浓度:0.5mm,转速:220rpm,诱导6h后收集菌体。用适量50mmtris-hcl缓冲液将菌体重悬,然后用高压匀浆仪将菌体裂解以释放出其中的重组saa蛋白。将破碎液进行离心,13500rpm离心20min。收集上清液,加入饱和硫酸铵至终浓度为20%,混匀后室温静置30min,使重组saa蛋白有效沉淀。后进行离心处理,13500rpm离心10min,收集沉淀,并用25mmtris-hcl+150mmnacl,ph8.0的缓冲液将沉淀复溶,在室温条件下搅拌30min使其溶解充分。溶解后再次13500rpm离心10min,上清液作为ni-nta上样液。镍填料选用中科森辉ni-nta,先用0.5mnaoh再生2个柱体积,后用buffera:25mmtris-hcl+150mmnacl,ph8.0平衡三个柱体积,之后上样。上样完成后再用buffera平衡,待紫外吸收值低于40mau后进行梯度洗脱。洗脱缓冲液bufferb为buffera+500mm咪唑,洗脱条件为:5%b洗脱5个柱体积;20%b洗脱5个柱体积;100%b洗脱3个柱体积,分别收集洗脱液。其中,目的蛋白主要在100%b的洗脱条件下被洗脱。将洗脱液透析至25mmtris-hcl+1mmcacl2,ph8.0中,透析比大于10000:1。透析完成后用肠激酶进行酶切,以切除trx标签蛋白。需根据肠激酶的酶切效果调整酶的用量。本发明酶切条件为:酶与目的蛋白的比例为1mg目的蛋白加2μl酶,28℃酶切过夜。之后通过sds-page检测酶切效果。对酶切后的pet32b-saa蛋白进行ni-nta反亲和处理,以去除目的蛋白中的trx标签蛋白。先用0.5mnaoh对ni-nta进行再生处理,后用25mmtris-hcl+150mmnacl,ph8.0进行平衡,之后上样。因目的蛋白不含his标签,故其在流穿中。收集流穿,并及时补加100mmnacl以稳定saa蛋白(实验中观察到,若不加入一定浓度的nacl,saa蛋白样很快就会变浑浊并沉淀)。将上述得到的saa蛋白样品,透析至20mmpb+100mmnacl,ph8.0中,使透析比大于10000:1。待透析完成后,离心收样。向经过透析后的saa蛋白样品中加入25%的戊二醛,至终浓度为0.6%,以将saa蛋白聚合。聚合反应条件:4℃反应2.5h,之后加入终浓度为50mmtris-hcl(ph8.8)和10mmnahb4终止过夜。终止完成后,将聚合后的蛋白样透析至25mmtris-hcl+100mmnacl,ph8.0中,使透析比大于10000:1。待透析完成后,离心收样。(一)、saa蛋白稳定性检测-sds-page检测saa单体及聚合后蛋白稳定性,步骤如下:(1)制备样品,取实施例1制得的saa免疫原20μl作为待检测样品(浓度为3mg/ml),加入5μl5xsds-pageloadingbuffer,沸水煮10min,12000rpm离心30s;(2)按一定顺序点样,上样量为10μl;(3)电泳:先90v恒压电泳,待样品进入分离胶后150v恒压电泳;(4)待溴酚蓝刚刚跑至底部时停止电泳,取出凝胶;(5)考马斯亮蓝染色5-10min,倒掉染色液用ddh2o冲洗后换成脱色液,脱色直至背景呈透明状。结果如图1和图2所示。图1中,1号样品为未经戊二醛聚合的saa蛋白在37℃放置7天后跑胶,2号样品为-20℃冻存saa蛋白(对saa蛋白进行-20℃反复冻融5次处理,saa蛋白完全沉淀)。从图1可以看出,未经戊二醛聚合的saa蛋白容易降解,说明saa单体蛋白非常不稳定。图2中,三者均为用0.6%戊二醛聚合的saa蛋白,其中,1号样品在4℃放置7天,2号样品在37℃放置7天,3号样品为-20℃反复冻融5次。说明聚合后saa蛋白非常稳定。并且通过酶免检测saa蛋白的活性,发现不同处理方式saa蛋白的活性一致。(二)、检测聚合后样品的结构目前的研究表明,saa蛋白在人血清中主要以6聚体形式存在,而通过0.6%戊二醛聚合的saa蛋白同样具备多聚体结构(图2所示)。通过hplc发现,聚合后的saa蛋白存在着聚体结构(图3)。注:主要以多聚体形式存在,同时也含有少量的单体saa蛋白。因此,经过0.6%戊二醛聚合后的saa蛋白,得到与天然saa蛋白类似的结构。上述内容可知,聚合后的saa蛋白稳定性得到显著提升。(三)、酶免检测saa聚合后蛋白稳定性实验方法:酶免间接法。1.包被取96孔酶免板,使用50mmcb(ph9.51)作为包被液,将待包被抗原稀释到工作浓度,每孔加入100μl,4℃包被12h-16h,具体待包被抗原如下:saa1,20180614(4℃),4.89mg/ml;saa1,20180614(37℃7天),4.85mg/ml;saa1,20180614(冻融5次-20℃),4.91mg/ml。2.封闭取出包被板平衡置室温,用洗涤液洗板2次,每孔加120μl20%诊断用小牛血清(小牛血清用1×pbs稀释)37℃封闭2小时(或4℃封闭过夜),甩干置于湿度小于30%的干燥房或者是电子干燥箱中干燥后待用;3.一抗saa兔抗血清(菲鹏,批号20180523),20%诊断用小牛血清1:20000稀释,每孔100μl;4.二抗酶羊抗兔-hrp,使用20%诊断用小牛血清1:4000稀释,每孔加100μl。5.反应模式和反应时间100μl一抗37℃恒温箱反应30min,洗板5次,拍干后加入100μl二抗酶,37℃反应30min,洗板5次,加显色剂a和b各50μl,显色30min,加入终止液50μl,用450nm~630nm双波长读值,读值要求在10min之内读完。结果如表1所示。表1酶免间接法检测结果从表1可以看出:saa蛋白放置4℃7天,37℃7天,反复冻融5次后od值基本无明显变化,说明聚合后saa蛋白非常稳定。上述得到的样品,将透析后的样品进行检测,以保证用于免疫的每一批次样品批间差小于10%。检测合格的样品即为saa免疫原,可免疫兔子。实施例2采用实施例1制得的saa免疫原对兔子免疫,步骤如下:一、选择实验动物成年、健康雄性家兔。二、动物免疫采用皮下注射的方法。首次免疫采用弗氏完全佐剂,每只兔子注射2mg免疫原,间隔21天后进行第二次免疫。从第二次免疫开始,免疫均采用不完全佐剂,注射2mg免疫原/只/次,间隔15天。至产生的抗体稳定后,免疫时间间隔调整为30天/次,同时监测抗体的活性及得率。三、试取血进行测试,检测是否成功免疫静脉取血检测抗体的效价及亲和力。通过酶联免疫吸附法和胶乳增强比浊法,并与对照试剂(西门子公司的saa检测试剂盒)进行对比,对临床样品进行测定。结果发现我们的兔多抗性能达到对照试剂盒的检测水平,说明成功免疫。四、采集血清对兔子进行连续采血,并检测抗体的活性。最终将兔子杀死以获取血清。五、纯化抗体采用抗原柱亲和纯化的方式纯化saa兔多抗。将纯化后的saa蛋白偶联至nhs-活化的琼脂糖柱上,制备成saa抗原柱,用于saa兔多抗的纯化。通过此法纯化得到的兔多抗特异性强且活性高,适用于多平台的临床检测。(一)、制得的saa兔多抗进行特异性检测-酶免间接法,步骤如下:1.包被取96孔酶免板,使用50mmcb(ph9.51)作为包被液,将待包被抗原稀释到工作浓度,每孔加入100μl,4℃包被12h-16h小时具体包被条件如下:saa蛋白,批号:20180321,浓度:0.44mg/ml,包被浓度:1μg/ml;crp蛋白,批号:2037-30,浓度:3.11mg/ml,包被浓度:2μg/ml;apob蛋白,批号:20171129,浓度:0.89mg/ml,包被浓度:2μg/ml;alb蛋白,批号:161205,浓度:2.8mg/ml,包被浓度:2μg/ml;apoa1蛋白,批号:20180129,浓度:11.95mg/ml,包被浓度:2μg/ml;2.封闭取出包被板平衡置室温,用洗涤液洗板2次,每孔加120μl20%诊断用小牛血清(小牛血清用1xpbs稀释)37℃封闭2小时(或4℃封闭过夜),甩干置于湿度小于30%的干燥房或者是电子干燥箱中干燥后待用;3.一抗saa抗体,批号:20180730,浓度5.64mg/ml,使用20%诊断用小牛血清1:20k稀释(小牛血清用1xpbs稀释),每孔加100μl。4.二抗酶羊抗兔-hrp,使用20%诊断用小牛血清1:4k稀释,每孔加100μl。5.反应模式和反应时间100μl一抗37℃恒温箱反应30min,洗板5次,拍干后加入100μl二抗酶,37℃反应30min,洗板5次,加显色剂a和b各50μl,显色30min,加入终止液50μl,用450nm~630nm双波长读值,读值要求在10min之内读完。检测结果如表2所示。表2特异性检测结果一抗稀释倍数saacrpalbapoa1apob90002.4930.060.0480.0080.051270002.5160.0370.0060.0370.017810001.9990.0190.0040.0180.0072430000.9540.0250.0040.0090.0057290000.290.0170.0070.0080.00521870000.1350.0240.0040.0070.004说明:0.1为cutoff值,即大于0.1说明saa多抗与此蛋白有交叉反应,小于0.1说明saa多抗与此蛋白无交叉反应。由以上数据可以得出,本发明得到的saa兔多抗与crp、apob、alb和apoa1等蛋白均不存在交叉反应。另外,上述提供的抗人血清淀粉样蛋白a多克隆抗体,检测临床标本,相关性达到0.985以上,说明其能准确检测人血清中saa蛋白含量。尽管已用具体实施例来说明和描述了本发明,然而应意识到,在不背离本发明的精神和范围的情况下可以作出许多其它的更改和修改。因此,这意味着在所附权利要求中包括属于本发明范围内的所有这些变化和修改。sequencelisting<110>广东菲鹏生物有限公司<120>一种saa蛋白免疫原及其制备方法和抗人血清淀粉样蛋白a多克隆抗体<130>2018<160>1<170>patentinversion3.3<210>1<211>369<212>dna<213>人工序列<400>1atgaagcttctcacgggcctggttttctgctccttggtcctgggtgtcagcagccgaagc60ttcttttcgttccttggcgaggcttttgatggggctcgggacatgtggagagcctactct120gacatgagagaagccaattacatcggctcagacaaatacttccatgctcgggggaactat180gatgctgccaaaaggggacctgggggtgcctgggctgcagaagtgatcagcgatgccaga240gagaatatccagagattctttggccatggtgcggaggactcgctggctgatcaggctgcc300aatgaatggggcaggagtggcaaagaccccaatcacttccgacctgctggcctgcctgag360aaatactga369当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1