一种快速单反应管提取长片段基因组DNA的方法和试剂盒与流程
本发明涉及提取基因组dna的领域。具体地,本发明涉及一种快速单反应管提取长片段基因组dna的方法,以及适用于此方法的试剂盒。
背景技术:
长片段基因组dna分子的制备在生物学领域,特别是dna测序和基因组组装中有着广泛的需求。pacificbiosicences的smrt长读长测序技术对于单分子测序长度可达60-100kb1,而oxfordnanoporetechnology的纳米孔测序技术则可检测长达mb级别的单分子dna片段2。用于单体型拼接和基因组组装的10xgenomics3和cpt-seq4等linked-reads技术则需要制备长度为几十到几百kb的基因组分子片段。bionanogenomics公司的基于saphyr平台的单分子光学图谱技术可以辅助基因组组装、检测染色体结构变异和基因遗传病的检测,用于其标记的分子长度n50(≥150kb)约为300kb,最长单分子可达mb级别5。测序技术和光学图谱等技术的发展,对简单快速地提取长片段基因组dna分子有了更高的需求。
目前主流的提取基因组dna的方法有经典的酚氯仿抽提-乙醇/异丙醇沉淀法、硅胶膜柱或吸附磁珠纯化法。由于机械力和剪切力的作用,普通的硅胶膜柱或吸附磁珠纯化法得到的基因组dna长度都低于50kb。而经典的酚氯仿抽提-乙醇/异丙醇沉淀法需要使用剧毒的有机溶剂酚氯仿,而且由于细胞裂解后非常粘稠,在液相酚氯仿抽提时操作比较困难6。phase-lock凝胶的使用可以解决酚氯仿抽提分离的问题,但是整个操作过程仍然非常繁琐2。近年来,报道了一些新型的基于硅片或核酸探针的提取长片段基因组dna的方法,但是受到材料或操作的限制,均未得到推广使用7,8。此外,以上方法虽然可以提取长达几百kb的基因组dna片段,但是仍然无法达到mb级别。
目前最经典的用于提取高纯度长片段基因组dna的方法是基于低熔点琼脂糖凝胶包埋的固相基因组dna提取法。该方法可提取长达mb级别的高纯度基因组dna,但是包括将细胞包埋成琼脂糖胶块、蛋白酶k消化处理、胶块溶解、胶块酶解和基因组dna透析等步骤,操作过程非常繁琐,耗时超过24小时,不利于大规模应用。并且,上述提取基因组的方法都涉及到基因组dna在不同的反应管中转移,不仅操作繁琐,而且会导致基因组dna的损失,甚至造成基因组dna的污染。
鉴于此,本发明提供了一种新的提取长片段基因组dna的方法,该方法仅包含裂解细胞或组织、沉淀基因组dna、清洗基因组dna和溶解基因组dna四个步骤。该方法可快速地提取长达mb级别的基因组dna,大大缩短基因组dna提取时间,使得提取过程更为快速和简单。并且,本发明的方法可以在单个反应管中进行而不需要转管,节约时间的同时也避免了基因组dna的污染和损失。最后所沉淀的长片段基因组dna容易溶解,均一性高,满足各种长片段测序及光学图谱等技术对长片段基因组dna的要求。
技术实现要素:
本发明的目的在于解决现有长片段基因组dna提取时,耗时长、操作复杂的问题。通过在单反应管中直接裂解细胞、释放基因组dna、沉淀基因组dna、清洗基因组dna和溶解基因组dna,本发明实现了快速制备长片段基因组dna的目标。
因此,第一个方面,本发明提供一种提取长片段基因组dna的方法,包括以下步骤:
a)向样品中加入裂解液和蛋白酶k,使细胞裂解并释放基因组dna;
b)向步骤a)的反应体系中加入沉淀剂,获得基因组dna的沉淀;
c)用清洗液洗涤所得的基因组dna的沉淀;
d)用溶解液溶解基因组dna。
在一个实施方案中,本发明的方法由以上四个步骤a)-d)组成。
在本文中,“长片段基因组dna”是指平均长度大于200kb,且最长可达mb级别的基因组dna。
在一个实施方案中,样品可以是动物来源的任何组织或细胞,例如来自胚胎组织、肝脏组织、胸腺组织、脾脏组织、体液的细胞,或体外培养的细胞系等。体液的实例包括但不限于血液、血清、血浆、关节液、精液、尿液、汗液、唾液、粪便、脑脊液、腹水、胸水、胆汁、胰腺液等。
在一个实施方案中,裂解液包含nacl、tris-hcl(ph7.4-8.0)、edta(ph8.0)和sds。在另一个实施方案中,裂解液由nacl、tris-hcl(ph7.4-8.0)、edta(ph8.0)和sds组成。裂解液中nacl、tris-hcl(ph7.4-8.0)和edta(ph8.0)的浓度可以根据具体实验要求通过常规实验进行调整和确定,例如,nacl的浓度为0.1m-0.5m,tris-hcl(ph7.4-8.0)的浓度为10mm-200mm,edta(ph8.0)的浓度为10mm-100mm。但是,sds的浓度对提取的基因组dna的质量非常关键。具体而言,sds的浓度过低,例如低于0.1%,则会导致细胞裂解不充分;sds的浓度过高,例如高于8%,则过量的sds会随着基因组dna沉淀,影响后续实验。因此,在本发明中,sds的浓度优选为0.1%-8%,更优选0.1%-5%。
在一个实施方案中,裂解液还可以包含rnasea,其作用是除去系统中的rna杂质。rnasea的含量可以由本领域技术人员根据需要确定,例如为20μg/ml。
在一个实施方案中,蛋白酶k的终浓度为0.005-4mg/ml,优选0.005-2.5mg/ml。蛋白酶k的作用在于降解膜蛋白和与基因组dna结合的蛋白质,从而使基因组dna充分游离。当蛋白酶k的含量过低,例如低于0.005mg/ml,则不能充分降解膜蛋白和基因组dna结合的蛋白质,可能会影响基因组dna后续应用,例如影响基因组dna的bionano光学图谱标记;当蛋白酶k的含量过高,例如高于4mg/ml,则过量的蛋白酶k随着基因组dna沉淀,会降解后续应用中的酶切体系,例如影响基因组dna的bionano光学图谱标记。
在一个实施方案中,蛋白酶k和裂解液可以依次加入,也可以同时加入。
上述步骤a)的处理时间和温度可以由本领域技术人员根据实验需求进行调整和确定。例如,可以在30-65℃的温度下处理1-2小时。
在一个实施方案中,本发明的沉淀剂包含至少一种无机盐和至少一种醇类。在另一个实施方案中,本发明的沉淀剂由无机盐和醇类组成。在本发明的方法中,无机盐的实例包括但不限于醋酸铵、醋酸钠、氯化钠、氯化锂等;醇类的实例包括但不限于无水乙醇、异丙醇等。在本发明中适用于沉淀基因组dna的无机盐的浓度为300-500mm,优选350-450mm,更优选约450mm,醇类的浓度为50-80%,更优选60-70%,更优选约65%。
上述步骤b)的沉淀时间可以由本领域技术人员根据实验需求进行调整和确定。
在一个实施方案中,清洗液包含70%-80%乙醇。在另一个实施方案中,清洗液由70%-80%乙醇组成。
在一个实施方案中,溶解液选自去离子水、tris-hcl、te缓冲液等。其他已知的可以用于溶解基因组dna的溶液也适用于本发明。
第二个方面,本发明提供一种提取长片段基因组dna的试剂盒,包含:裂解液、蛋白酶k、任选的rnasea、沉淀剂、清洗液和溶解液。
在一个实施方案中,裂解液包含nacl、tris-hcl(ph7.4-8.0)、edta(ph8.0)和sds。在另一个实施方案中,裂解液由nacl、tris-hcl(ph7.4-8.0)、edta(ph8.0)和sds组成。裂解液中nacl、tris-hc(ph7.4-8.0)和edta(ph8.0)的浓度可以根据具体实验要求通过常规实验进行调整和确定,例如,nacl的浓度为0.1m-0.5m,tris-hcl(ph7.4-8.0)的浓度为10mm-200mm,edta(ph8.0)的浓度为10mm-100mm。在本发明中,优选的sds浓度为0.1%-8%,更优选0.1-5%。
优选地,蛋白酶k的浓度为0.005-4mg/ml,更优选0.005-2.5mg/ml。当存在rnasea时,其含量为20μg/ml。
在一个实施方案中,沉淀剂包含至少一种无机盐和至少一种醇类。在另一个实施方案中,本发明的沉淀剂由无机盐和醇类组成。在本发明的方法中,无机盐的实例包括但不限于醋酸铵、醋酸钠、氯化钠等;醇类的实例包括但不限于无水乙醇、异丙醇等。在本发明中适用于沉淀基因组dna的无机盐的浓度为300-500mm,优选350-450mm,更优选约450mm。醇类的浓度为50-80%,更优选60-70%,更优选约65%。
在一个实施方案中,清洗液包含70%-80%乙醇。在另一个实施方案中,清洗液由70%-80%乙醇组成。
在一个实施方案中,溶解液选自去离子水、tris-hcl、te缓冲液等。
本发明所述的方法和试剂盒可快速、简单和精确地在单反应管中实现长片段基因组dna的提取。本方明所述方法和试剂盒的优异技术效果主要体现在以下几个方面:
(1)所有操作均在单个反应管中完成,不涉及到基因组dna在不同反应管中的转移,从而节省时间和成本的同时,还避免了基因组dna的损失和可能的污染。
(2)整个实验流程简单快速。整个基因组dna的提取过程只包含裂解、沉淀、清洗和溶解四个步骤,耗时1-2小时。
(3)本发明的提取方法比较安全,不会对操作人员的身体健康产生危害。本发明的提取方法使用的试剂均安全无毒,同时还避免使用传统基因组dna沉淀方法中所用的剧毒有机溶剂如酚氯仿。
(4)提取的基因组dna长度和质量可靠,重复性强。相对于传统的硅胶膜柱和磁珠纯化方法,本发明避免了基因组dna的机械损伤。相对于经典的基于低熔点琼脂糖凝胶包埋的方法提取长片段基因组dna,本发明在实验的可操作性和重复性上有了显著的提高。
本发明提取基因组dna的方法适用于多个长片段测序和光学图谱等技术平台。
下面将结合附图和实施例进一步阐述本发明。应当理解,以下实施例仅仅是说明性的,而不意欲限制本发明的范围。
附图说明
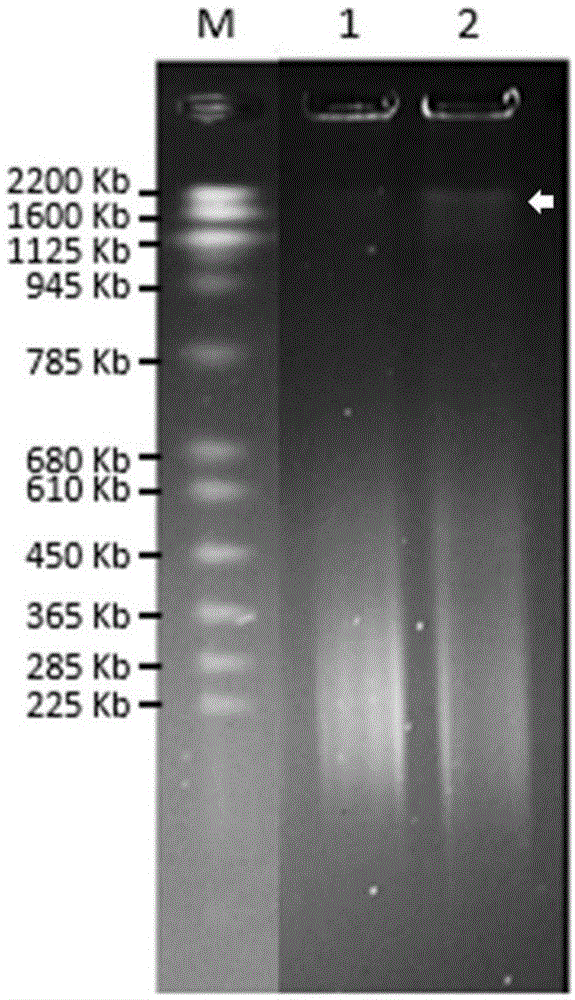
图1:实施例3中基因组dna的脉冲场电泳图。m:marker;1:实施例2提取的基因组dna;2:实施例1提取的基因组dna;其中白色箭头示出2号泳道中长度为约2200kb的dna片段。
图2:使用不同蛋白酶k浓度提取的长片段基因组dna的dls标记结果。
图3:使用不同sds浓度提取的长片段基因组dna的dls标记结果。
具体实施方式
实施例1.根据本发明的方法提取长片段基因组dna
使用本发明的方法根据以下步骤提取白细胞的基因组dna:
(1)取0.3x106个白细胞,室温2000g离心2分钟,去除上清;
(2)加入30μl裂解液(100mmnacl,10mmtris-hcl(ph8.0),25mmedta(ph8.0),0.50%sds)重悬细胞,再加入2μl2mg/ml蛋白酶k混匀;
(3)置于金属浴,于50℃处理1小时;
(4)然后加入12μl5m醋酸铵和90μl无水乙醇,颠倒10次后,置于摇床室温20rpm缓慢混匀5-10分钟,以便使dna完全沉淀并形成小团;
(5)用200μl70%乙醇洗涤dna2次;
(6)用42μlte缓冲液(10mmol/ltris-hcl(ph8.0);1mmol/ledta(ph8.0))溶解dna,获得长片段基因组dna。
实施例2.根据低熔点琼脂糖包埋的方法提取长片段基因组dna
使用传统的低熔点琼脂糖包埋的方法根据以下步骤提取白细胞的基因组dna:
步骤1:制备琼脂糖凝胶块
(1)取0.3x106个白细胞,2000g离心2分钟,去除上清。
(2)用65μl的pbs重悬细胞,置于43℃金属浴中平衡10分钟。
(3)加入39μl的2%agarose混合,加入置胶孔。
(4)将胶块于4℃冰箱放置45分钟进行凝胶。
步骤2:凝胶块消化处理
(5)在50ml离心管中加入2.5ml蛋白酶k溶液。将胶块转移到50ml离心管中,置于恒温混匀器50℃混匀2小时。
(6)加上筛孔盖,倒掉蛋白酶k溶液,换上新的蛋白酶k溶液置于恒温混匀器50℃混匀过夜。
步骤3:凝胶块清洗
(7)加上筛孔盖,倒掉过夜的蛋白酶k溶液。加入10ml的清洗缓冲液(10mmtris-hcl,50mmedta),然后置于水平摇床上缓慢晃动5分钟,加上筛孔盖,倒掉清洗缓冲液。重复,总共清洗4次。
(8)换用1xte缓冲液清洗5次,步骤同上。
步骤4:凝胶块熔解
(9)将胶块用小勺取出,用kimwipe吸干水分后转移到1.5ml离心管,瞬离胶块至管底,若有残留液体用小枪头吸掉。
(10)金属浴70℃处理2分钟熔胶。
(11)快速转移到43℃金属浴放置5分钟,然后加入2μl的agarose,43℃金属浴继续放置45分钟。
(12)将0.1μm的滤膜放到装有10-15ml的1xte缓冲液的6cm的培养皿,使其漂浮在液面上。将样品加到滤膜上,透析45分钟。
(13)吸取透析后的样品与1.5ml离心管中,用枪头缓缓吹打均匀,获得长片段基因组dna。
实施例3.长片段基因组dna的质量检测
将实施例1和2获得的长片段基因组dna进行脉冲场电泳,以检测其质量,结果如图1所示。这些结果表示,通过本发明的方法,能够有效获得平均长度为200kb以上,且最长可达mb级别的长片段基因组dna。
实施例4.检测不同浓度的蛋白酶k和sds裂解对提取的长片段基因组dna质量的影响
为了检测不同浓度的蛋白酶k和sds裂解对提取的长片段基因组dna质量的影响,根据实施例1所述的方法,使用不同浓度的蛋白酶k和sds提取白细胞的长片段基因组dna。然后利用bionanogenomics公司的dlsdna标记试剂盒,根据制造商的说明,对提取的基因组dna进行标记,并在bionanogenomics公司的saphyr平台上进行数据收集。
如图2所示,当蛋白酶k浓度过高,例如为5mg/ml时,提取的长片段dna的标记密度和比对率均太低,假阴性标记比例太高,达不到理想的标记要求(根据参考范围确定)。而当蛋白酶k浓度过低,例如为0.003125mg/ml时,提取的长片段dna的标记密度和比对率仍然太低,同样达不到理想的标记要求。
如图3所示,当sds浓度过高,例如为10%时,提取的长片段dna的标记密度和比对率均极低,假阴性标记比例太高,达不到理想的标记要求(根据参考范围确定)。而当sds浓度过低,例如为0.05%时,提取的长片段dna的标记密度和比对率仍然太低,并且分子长度n50也远远超过参考范围,同样达不到理想的标记要求。
因此,为使提取的长片段dna的质量足够高从而满足后续对其直接进行测序和组装的要求(例如在bionano的单分子光学图谱技术的情况下,长片段dna的质量要足够高以达到理想的标记要求,之后才能有效进行基因组组装而不影响其完成度和精确度),在提取长片段dna时应将蛋白酶k浓度和sds浓度控制在一定的范围内。例如,蛋白酶浓度优选0.005-4mg/ml,更优选0.005-2.5mg/ml;sds浓度优选0.1-8%,更优选0.1-5%。
需要说明的是,虽然已通过以上实施例阐明了本发明的一些特征,但不能用于限制本发明,本发明阐述的快速单反应管提取长片段基因组dna方法和试剂盒可以有多种应用场景。对于本领域的技术人员来说,本发明可以有各种更改和变化。因此对于本领域技术人员来说,在不脱离本发明的构思和原则之内,还可做出若干简单替换,这些均应包含在本发明的保护范围之内。
参考文献
[1]robertsrj,etal.theadvantagesofsmrtsequencing.genomebiol.2013jul3;14(7):405.erratumin:genomebiol.2017aug16;18(1):156.
[2]jainm,etal.nanoporesequencingandassemblyofahumangenomewithultra-longreads.natbiotechnol.2018apr;36(4):338-345.
[3]zhenggx,etal.haplotypinggermlineandcancergenomeswithhigh-throughputlinked-readsequencing.natbiotechnol.2016mar;34(3):303-11.
[4]zhangf,etal.haplotypephasingofwholehumangenomesusingbead-basedbarcodepartitioninginasingletube.natbiotechnol.2017sep;35(9):852-857.
[5]lamet,etal.genomemappingonnanochannelarraysforstructuralvariationanalysisandsequenceassembly.natbiotechnol.2012aug;30(8):771-6.
[6]goldenbergerd,etal.asimple″universal″dnaextractionprocedureusingsdsandproteinasekiscompatiblewithdirectpcramplification.pcrmethodsappl.1995jun;4(6):368-70.
[7]zhangy,etal.asimplethermoplasticsubstratecontaininghierarchicalsilicalamellaeforhigh-molecular-weightdnaextraction.advmater.2016dec;28(48):10630-10636.
[8]murphynm,etal.highmolecularweightdnaenrichmentwithpeptidenucleicacidprobes.methodsmolbiol.2017;1551:73-85.
- 还没有人留言评论。精彩留言会获得点赞!