扩增造血干细胞的培养体系、方法及其用途与流程
本发明涉及细胞培养
技术领域:
,尤其涉及扩增造血干细胞的培养体系、方法及其用途。
背景技术:
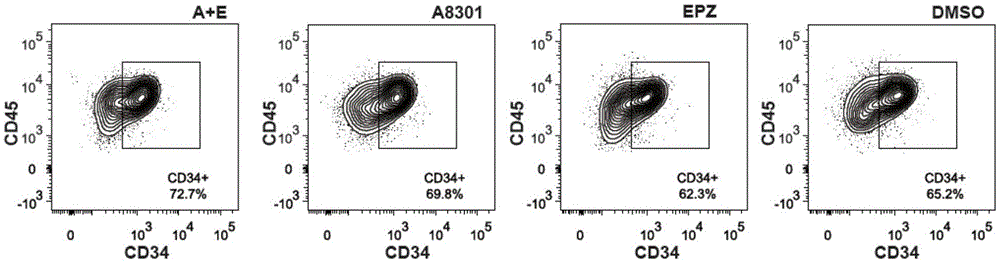
:造血干细胞移植技术是临床上治疗白血病、淋巴瘤、再生障碍性贫血、地中海贫血等多种血液类疾病和免疫系统疾病的常用且有效治疗手段。造血干细胞通常有三个来源:骨髓、外周血和脐带血。与骨髓和外周血造血干细胞相比,脐带血造血干细胞获取方便、来源丰富、对供者无损伤无副作用,因此成为造血干细胞移植供体的一大重要来源。目前,脐带血造血干细胞移植技术的瓶颈在于其细胞含量少,一份脐带血中所含的造血干细胞及祖细胞数量不足以快速恢复成人患者的免疫系统,造成机会性感染致死率的增高。目前暂行的策略是双份脐带血移植,即一位患者清髓后先后接受两份脐带血的移植,但这增加了供体的hla配型匹配难度,因此,亟需扩增脐带血造血干细胞的方法,以获得足量的可供移植的造血干细胞。人们对于脐带血造血干细胞的体外扩增进行了大量尝试,但都没有取得理想效果。早期人们利用血液中的细胞因子来培养造血干细胞,结果导致细胞分化,而移植功能减弱。后来,人们发现骨髓造血干细胞微环境中的wnt信号分子、notch配体、视黄酸拮抗因子等能够有效扩增cd34+造血干/祖细胞。利用chir99021或者bio激活wnt信号通路维持体外培养的造血干细胞的移植能力;而在造血干细胞的培养体系中添加dll1,dsl1等,能够通过激活notch信号而适度扩增造血干细胞。另有研究发现,骨髓内皮基质细胞分泌的ptn也能够轻微扩增造血干细胞。生理状态下造血干细胞处在低氧条件下,而体外培养产生的氧胁迫会通过增高ros水平损害造血干细胞的自我更新和移植功能;人们发现,抗氧化剂的添加以及mtor的抑制能够抵消这些损害。然而,上述技术并没能够显著扩增脐带血造血干细胞。偶然的发现,铜离子螯合剂tepa,sirt抑制剂nicotinamide能够显著提高造血干细胞移植水平,且在临床实验中显示初步疗效,但扩增后的细胞体内存活时间不够长,且分化谱系不够完整。近几年的高通量筛选化学小分子发现一类氮杂环化合物sr1和吲哚类似物um171能够更有效的扩增具备长期移植能力的造血干细胞。临床实验表明,sr1扩增的造血干细胞具备重建患者免疫系统的能力,但其依然没有摆脱对双份脐带血移植的依赖。总的来说,hsc最佳的体外扩增条件至今尚没有明确的共识。a8301(cas:909910-43-6化学式:c25h19n5s)是i型tgfβ受体alk5激酶、i型activin/nodal受体alk4激酶和i型nodal受体alk7激酶的选择性抑制剂,能通过阻断smad2蛋白的磷酸化而抑制tgfβ诱导的上皮-间质转变。a8301作用专一,仅在高浓度下对alk-1/2/3/6和mapk活性存在微弱抑制。据报道,a8301促进人诱导多能干细胞(ipsc)的产生。epz6438(化学式为c34h44n4o4,cas号为1403254-99-8)是组蛋白甲基转移酶ezh2的特异抑制剂。在临床治疗领域,epz6438又名tazemetostat,是一种试验性抗癌药物,其用于治疗淋巴瘤、非小细胞肺癌、子宫内膜癌已经进入i期和ii期临床试验。目前,a8301、epz6438对人造血干细胞的维持和扩增作用皆无报道。技术实现要素:有鉴于此,本发明要解决的技术问题在于提供组合物及其应用与扩增造血干细胞的方法,本发明研究表明,a8301与epz6438联用能够显著提高造血干细胞体外扩增所得的细胞总量。本发明首先提供了由a8301和epz6438组成的组合物。本发明提供的组合物中,所述a8301与epz6438的摩尔比为(0.1~10):(0.1~10)。一些实施例中,所述a8301与epz6438的摩尔比为0.5:0.2。本发明研究表明,添加a8301和epz6438显著提高了脐带血造血干细胞体外扩增所得的细胞总量,在二者的摩尔比为0.5:0.2时效果更好,产生显著的增效协同作用。而当a8301、epz6438与tpo、scf和flt3l共同使用时,能够产生增效协同作用,从而更好的促进造血干细胞的体外扩增。本发明还提供了促进造血干细胞扩增的组合物,其由a8301、epz6438、tpo、scf和flt3l组成。本发明提供的促进造血干细胞扩增的组合物中,所述a8301、epz6438、tpo、scf和flt3l的质量比为(42.15~4215):(57.2~5720):(30~70):(80~120):(90~110)。一些实施例中,所述组合物中a8301、epz6438、tpo、scf和flt3l的质量比为210.75:114.4:30:80:90。一些实施例中,所述组合物中a8301、epz6438、tpo、scf和flt3l的质量比为210.75:114.4:50:100:100。一些实施例中,所述组合物中a8301、epz6438、tpo、scf和flt3l的质量比为210.75:114.4:70:120:110。本发明提供的组合物中的各组分可以各自独立存在,也可相互混合,本发明对此不做限定。各组分可以为溶液也可为粉末。在本发明中,各组分以溶液形式存在,各组分相互独立。其中,epz6438的溶液以dmso配置,母液浓度为100mmol/l。a8301的溶液以dmso配置,母液浓度为100mmol/l。本发明提供的组合物作为培养基的添加剂,用于促进造血干细胞的体外扩增。本发明还提供了扩增造血干细胞的培养基,其包括基础培养基和本发明所述的组合物。即本发明提供的扩增造血干细胞的培养基中包括基础培养基、a8301和epz6438。本发明提供的扩增造血干细胞培养基中,所述a8301的浓度为0.1μmol/l~10μmol/l;epz6438的浓度为0.1μmol/l~10μmol/l。一些具体实施例中,所述a8301的浓度为0.5μmol/l;epz6438的浓度为0.2μmol/l。本发明提供的扩增造血干细胞的培养基中还包括tpo、scf和flt3l。本发明中,所述tpo的浓度为30ng/ml~70ng/ml;所述scf的浓度为80ng/ml~120ng/ml;所述flt3l的浓度为90ng/ml~110ng/ml。一些实施例中,所述tpo的浓度为30ng/ml;所述scf的浓度为80ng/ml;所述flt3l的浓度为90ng/ml。一些实施例中,所述tpo的浓度为50ng/ml;所述scf的浓度为100ng/ml;所述flt3l的浓度为100ng/ml。一些实施例中,所述tpo的浓度为70ng/ml;所述scf的浓度为120ng/ml;所述flt3l的浓度为110ng/ml。本发明中,所述基础培养基为stempro、rpmi1640、imdm、α-mem或stemspansfemii。一些实施例中,所述基础培养基为stemspansfemii。一些实施例中,所述培养基中:所述a8301的浓度为42.15ng/ml~4215ng/ml;所述epz6438的浓度为57.2ng/ml~5720ng/ml;所述tpo的浓度为30ng/ml~70ng/ml;所述scf的浓度为80ng/ml~120ng/ml;所述flt3l的浓度为90ng/ml~110ng/ml。一些具体实施例中,本发明提供的培养基包括stemspansfemii培养基、0.5μmol/la8301、epz6438的浓度为0.2μmol/l、50ng/mltpo、100ng/mlscf和100ng/mlflt3l。一些具体实施例中,本发明提供的培养基包括stemspansfemii培养基、0.5μmol/la8301、epz6438的浓度为0.2μmol/l、30ng/mltpo、80ng/mlscf和90ng/mlflt3l。一些具体实施例中,本发明提供的培养基包括stemspansfemii培养基、0.5μmol/la8301、epz6438的浓度为0.2μmol/l、70ng/mltpo、120ng/mlscf和110ng/mlflt3l。本发明所述的培养基可于使用前现配现用,也可制成成品长期储存。其制备方法为,在stemspansfemii培养基中,加入本发明提供的组合物直至各组分的浓度为本发明所述的浓度。本发明所述组合物可为干粉,其可为各组分的混合物或各组分分别单独存在。所述组合物亦可为溶液,或称为母液。所述母液中包括组合物的全部或部分组分。所述母液的溶剂为dmso。本发明提供的扩增造血干细胞的方法,其以本发明所述的培养基对造血干细胞进行培养。本发明所述的方法中,所述造血干细胞为脐带血造血干细胞;接种的密度为2×104cells/ml。所述培养的条件为37℃,5%co2。每隔2天补加新鲜的本发明提供的培养基。培养5~10天扩增倍数为4~20倍。本发明提供了a8301和epz6438组成的组合物,并提供了其在促进造血干细胞扩增中的应用。研究表明,在脐带血造血干细胞扩增培养过程中,加入细胞因子的同时加入a8301和epz6438,达到了既增加造血干细胞数量同时又提高造血干细胞cfu集落形成能力的效果,使得造血干细胞能够处于增殖不分化的状态,进而达到临床移植需求。本发明的操作简便,成本低廉,得到的造血干细胞数量更多,解决了现有技术中造血干细胞扩增率低、易分化等缺陷。附图说明图1示组1和组4~6的造血干细胞在第5天的表面抗原cd45、cd34表达情况;图2示组1和组4~6的造血干细胞在第5天的表面抗原cd90、cd34表达情况图3示倒置显微镜下各谱系集落形成代表图,其中(a)示cfu-e,(b)示bfu-e,(c)示cfu-g,(d)示cfu-m,(e)示cfu-gm,(f)示cfu-gemm。具体实施方式本发明提供了组合物及其应用与扩增造血干细胞的方法,本领域技术人员可以借鉴本文内容,适当改进工艺参数实现。特别需要指出的是,所有类似的替换和改动对本领域技术人员来说是显而易见的,它们都被视为包括在本发明。本发明的方法及应用已经通过较佳实施例进行了描述,相关人员明显能在不脱离本
发明内容、精神和范围内对本文的方法和应用进行改动或适当变更与组合,来实现和应用本发明技术。本发明采用的试材、试剂或实验器材皆为普通市售品,皆可于市场购得。所述脐血造血干细胞的制备包括:将脐带血以生理盐水稀释2~3倍后加入淋巴细胞分离液,经1500~2000rpm/min离心20min取单个核细胞层(pbmc),生理盐水洗涤并重悬得到pbmc细胞团块;然后以磁珠法分离cd34+细胞。stemspansfemii是无血清培养基,生产厂商为stemcelltechnologies,货号为09655;重组人干细胞因子rhscf(recombinedhumanstemcellfactor),生产厂商为stemimmunellc,货号为hhm-sf-1000;重组人血小板生成素rhtpo(recombinedhumanthrombopoietin),生产厂商为stemimmunellc,货号为hhm-tp-0100;重组人fms样酪氨酸激酶3配体rhflt3l(recombinedhumanfms-liketyrosinekinase3ligand),生产厂商为stemimmunellc,货号为hhm-ft-1000;a8301,生产厂商为sigma-aldrich;epz6438,生产厂商为sigma-aldrich;外周血单个核细胞pbmc(peripheralbloodmononuclearcell)macs:磁珠分选;dmso:二甲亚砜;pbs:磷酸盐缓冲液;methoculttmgfh4435,是半固体培养基;cfu-e全称colonyformingunitoferythrocyte,中文名为红细胞集落形成单位;bfu-e全称burstformingunitoferythrocyte,中文名为爆发式红细胞集落形成单位;cfu-g全称colonyformingunitofgranulocyte,中文名为粒细胞集落形成单位;cfu-m全称colonyformingunitofmacrophage,中文名为巨噬细胞集落形成单位;cfu-gm全称colonyformingunitofgranulocyte-macrophage,中文名为粒细胞-巨噬细胞集落形成单位;cfu-gemm全称colonyformingunitofgranulocyte,erythrocyte,macrophage/monocyte,megakaryocyte,混合集落,其中文名为粒细胞,红细胞,巨噬/单核细胞,巨核细胞集落形成单位;本发明提供的组合物或培养基能够适用于造血干细胞的体外扩增,所述造血干细胞可来源于实验动物(例如小鼠等)或人类。人类造血干细胞可来源于骨髓、外周血、脐带血和胎盘血,在本发明实施例中,以脐带血造血干细胞为例,其中,脐带血经检测乙型肝炎、丙型肝炎、梅毒、艾滋病、巨细胞病毒、torch检测、支原体、衣原体、g-6pd和地贫均为阴性,经检测,分离的人脐带血造血干细胞表达如下几种膜分子:白细胞分化抗原cd45、白细胞分化抗原cd34、白细胞分化抗原cd90、白细胞分化抗原cd49f。下面结合实施例,进一步阐述本发明:实施例11、获取脐带血单个核细胞;(1)将脐带血加生理盐水稀释2~3倍,混匀后逐滴加入0.4倍体积淋巴细胞分离液中,注意不要破坏界面;(2)使用1500~2000rpm/min离心20min,因密度不同离心管中由上到下分为四层:第一层为血浆层、第二层为环状乳白色单个核细胞层(pbmc)、第三层为透明分离液层、第四层为红细胞层;(3)用吸管小心吸取第二层环状乳白色单个核细胞层(pbmc)到另一50ml离心管中,补加生理盐水,再次使用1500~2000rpm/min离心5~10min;(4)弃上清加生理盐水重悬,最后使用1500~2000rpm/min离心5~10min,再次弃上清,得到pbmc细胞团块。2、利用macs从上述pbmc中获得cd34+脐带血造血干细胞;(1)每份脐带血pbmc采用50μl人cd34+磁珠和50μlfcrblockerreagent及150μl0.5%bsa的混合液重悬,4℃孵育30min;(2)与此同时,将磁铁和磁力架至于超净台中紫外线照射30min;(3)加入10ml无菌pbs,混匀后,使用1500~2000rpm/min离心5~10min后弃上清;(4)将macs专用吸附柱放进磁铁中,加入500ul0.5%bsa润洗,流出的液体用15mltube接住;(5)500μl0.5%bsa重悬获取脐带血单个核细胞的步骤3)中pbmc团块,混匀后转移到macs专用吸附柱中,待液体完全流出;(6)500μl0.5%bsa洗涤3次,取下吸附柱,置于15mltube中;(7)加入1ml0.5%bsa,用活塞把液体推入15mltube中,所得液体即含cd34+脐带血造血干细胞。实施例2各组培养基中因子的含量如表1:表1各组培养基中因子的含量a8301epz6438scftpoflt3组10.5μm0.2μm80ng/ml30ng/ml90ng/ml组20.5μm0.2μm100ng/ml50ng/ml100ng/ml组30.5μm0.2μm120ng/ml70ng/ml110ng/ml组40.5μm080ng/ml30ng/ml90ng/ml组500.2μm80ng/ml30ng/ml90ng/ml组60080ng/ml30ng/ml90ng/ml将各物质以表1浓度添加入stemspansfemii无血清培养基。将实施例1制得的cd34+脐带血造血干细胞悬浮接种于各组细胞培养基中进行培养。24孔板中细胞接种密度为1×104cells/孔,置于37℃,5%co2培养箱培养。根据细胞培养状态,每隔2天补加各组新鲜的细胞培养基500μl,5~10天可获得数量较多的造血干细胞,扩增倍数约为4~20倍。效果检测对实施例2各组培养的脐带血造血干细胞进行细胞计数、表型鉴定及集落形成单位分析。1、细胞计数分别对第5天的组1~3或4~6培养的细胞进行计数,并计算相比第0天的细胞数目扩增倍数。各组培养基培养结果如表2:表2:各组条件细胞数目扩增倍数统计表结果表明:添加a8301和epz6438的组1~3相对于组4~6,获得的cd34+cd90+细胞数量更多,扩增倍数更大,经统计学分析,组1~3的扩增效果与组4~6存在显著性差异,p<0.05。组1~3中,组2的扩增效果更佳。2、细胞流式分析分别对第0天、第5天的a8301、epz6438或dmso培养的cd34+细胞进行流式分析。采用bd公司facsverse流式检测仪,取细胞悬液20μl,加入溶解于0.5%bsa中的fitc标记的cd34,pe标记的cd38,apc-cy7标记的cd45ra,apc标记的cd90。各管涡旋后室温下避光孵育15min,加入适量pbs,1600rpm室温水平离心5min,弃上清液,加入pbs200μl,然后上机分析。组2和组4~6的检测结果如图1~2。结果表明,相对于未添加a8301和epz6438组合的组4~6,组2扩增获得的cd34+cd90+细胞比例更高,这说明表明组2扩增获得的这些造血干细胞更加原始,具有更强的重建血液系统的分化潜能,可以更有效地支持临床治疗需要。组1、3扩增获得的细胞中,cd34+cd90+细胞比例与组2相似。3、集落形成单位分析分别对第0天、第5天的组1~6培养的cd34+细胞进行集落形成单位分析。采用methoculttmgfh4435半固体培养基,在六孔板中加入培养基1ml/孔,cd34+细胞接种密度为500细胞/孔,置于37℃5%co2培养箱培养14天后,计算各谱系集落数目,并拍摄照片。倒置显微镜下各谱系集落形成代表图如3,集落形成数目统计如表3:表3各组培养后集落形成数目如表3所示,添加组1~3相对于组4~6,获得的细胞集落数目更多,经统计学分析,组1~3的集落数目与组4~6存在显著性差异,p<0.05。组1~3中,组2的群落数目最多。以上仅是本发明的优选实施方式,应当指出,对于本
技术领域:
的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1