改良超滤离心法制备富含α2巨球蛋白血清的装置的制作方法
本实用新型涉及血液制品制备的技术领域,特别是一种改良超滤离心法制备富含α2巨球蛋白血清的装置。
背景技术:
创伤性关节炎(Post-traumatic Osteoarthritis,PTOA)作为骨关节炎(osteoarthritis,OA)的一种主要类型,主要由创伤引起的以关节软骨退化和继发软骨骨化为主要病理变化,以关节疼痛、活动功能障碍为主要临床表现的一种疾病。前交叉韧带(anterior cruciate ligament, ACL)损伤在青壮年中是最常见的膝关节韧带损伤之一,其在美国的发病率约为0.1%。国内有学者报道,我国现役集训运动员ACL损伤的总发病率为0.47%。大量研究表明,ACL损伤患者发生PTOA的风险明显增高。
目前,临床上ACL重建手术为ACL损伤患者早期治疗的主要技术方法。美国每年行ACL重建手术的数量超过50万例。中国虽没有具体统计数字,但鉴于中国人口数量巨大,临床实践中也是非常多见。ACL重建手术可重建ACL损伤患者膝关节的稳定性,成为目前ACL损伤后最佳的治疗方法。但是,最新的一些研究发现,ACL重建术并不能降低ACL损伤患者继发PTOA的风险和进程,其主要原因为在关节创伤后1周内关节腔局部出现大量的炎症因子,如MMP家族、肿瘤坏死因子(tumor necrosis factor,TNF)、IL、整合素样金属蛋白酶(a disintegrin and metallo-proteinase with thrombospondin motifs,ADAMTSs)及氧自由基等,促使大量的软骨细胞凋亡,成为启动关节软骨退变和损伤的关键环节。因此,ACL损伤后1周内成为早期防治PTOA的“黄金时间”。
α2巨球蛋白(α2-macroglobulin, α2-M)是血浆中含量丰富的大分子糖蛋白,是一种广谱的蛋白酶抑制剂,血浆蛋白浓度为60-80mg/ml, 而α2-M在血浆中的浓度为2.2-2.3mg/ml,占血浆蛋白总量的2.5-3.7%。α2巨球蛋白的功能主要通过调节内源或外源性蛋白酶广泛参与许多重要的生理病理过程。其相对分子质量为725000,由大小为180000的四个相同亚基组成,其中两个亚基通过二硫键连接成二聚体,两个二聚体再通过非共价键形成四聚体,每一个亚基上均含有5个功能区,分别是诱饵区、内部硫酯键、受体结合位点、谷氨酰胺转移酶反应位点以及锌离子结合位点。α2-M还通过与细胞因子、生长因子和激素等分子结合调节它们在体内的分布、半衰期和生物学活性。
通过体内外研究发现,200nm的α2-M可有效地抑制IL-1诱导的体外培养软骨细胞MMP-3、9、13和多种炎症因子的活性,如IL-1β、6、8, TNF-a和粒-巨噬细胞集落刺激因子(granulocyte macrophage-colony stimulating factor,GM-CSF)。同时在大鼠前交叉韧带切断模拟PTOA的大鼠模型中,在关节内定时注射补充α2-M可以有效的减少关节液中MMP-13的浓度,组织学上也证实α2-M可以有效的延缓PTOA的病理进程,并且存在剂量依赖性。同时我们的研究也发现α2-M对PTOA相关正性基因的表达具有上调作用,对负性基因具有下调作用。因此,关节内早期补充外源性α2-M对前交叉韧带损伤后导致的创伤性关节炎(PTOA)大鼠的软骨损伤具有积极的正性保护作用。
然而目前国内尚无α2-M的生产,进口的α2-M不仅价格较高,产品量也非常有限;而且α2-M为大分子量蛋白质,免疫原性强,异种α2-M长期关节腔注射极有可能引起免疫反应,且属于高度的商业机密,这在很大程度上限制了本研究的顺利开展。国内最早见于彭启明等在1984发表于生物化学与生物物理进展的“人血浆α2巨球蛋白的分离纯化”有较为详细的血浆α2-M的提取过程,它采用的是用聚乙二醇6000分段沉淀法将血浆中的血浆α2-M富集于血浆中,再通过亲和层析法最终制成血浆α2-M纯化物,它的纯化倍数达到72倍,但活力回收仅仅31%左右。具体方法如下:
1. α2M粗提物的获取(乙二醇分段沉淀)
①取健康人全血100ml,加入0.13M枸橼酸钠10ml,大豆胰蛋白酶抑制剂10mg,聚凝胺(polybrene)40mg,抗凝。
②4℃,2000r/min,离心15min,获取血浆,可-70℃保存。
③4℃条件下,取(18ml)血浆,加入两倍血浆容积的缓冲液(0.02M NaH2PO4,0.1M NaCl,PH=7.4),缓慢加入50%的聚乙二醇(polyethylene glycol 6000,PEG),使PEG最终浓度为4%。磁力搅拌 15-30 min后,4℃, 15000 r/min 离心30-60 min,弃去沉淀。
④于上清液中再加入50%的PEG,使其最终浓度为12%,再充分搅拌15-30min,离心(同第3步),尽量吸去全部上清液。所得沉淀部分即为富含α2-M的粗提物。
2.A2M的提纯(层析法)
1)锌螯合琼脂糖(Zn-chelate sepharose 6B)层析柱分离
①用0.02M NaH2PO4,0.5M NaCl,PH=6.4缓冲液平衡层析柱后,将所得血浆PEG沉淀用7.5ml此缓冲液溶解,上样。同一缓冲液洗脱下第一蛋白峰。(以1ml/min的速度洗脱;每1ml收集一管)
②然后换成0.1M Na2EDTA,PH7.0洗脱液洗下第二蛋白峰。检测每管中α2-M的比活性,比活较高的几管(在第二蛋白峰),共10ml供下部分离使用。
2)蓝色琼脂糖凝胶(Blue sepharose CL6B)层析柱分离
①用0.05M Tris-HCL,PH 8.0缓冲液平衡层析柱后,取第二步中所得10ml样品,用2M Tris-HCL,PH 9.0缓冲液调PH至8.0后上样。
②用0.05M Tris-HCL,PH 8.6缓冲液洗下第一峰,然后加大离子强度用0.05M Tris-HCL,0.5M NaCL ,PH 8.0缓冲液洗脱下第二蛋白峰。
③收集A2M比活较高的几管(在第一蛋白峰),体积10ml,供下步分离使用。
3)锌螯合琼脂糖(Zn-chelate sepharose 6B)层析柱分离
①将第三步分离所得的10 ml 样品用2M NaH2PO4,pH 5.5缓冲液调pH 至6.4后上样,条件与第二步分离相同。
②第一峰杂蛋白质较少,测得α2-M 活力部分在第二蛋白峰,收集比活最高的几管,体积4ml,即为α2M纯化产品。
但是这种方法提取步骤繁琐,在提纯的过程中蛋白的活性逐步降低,且有较多的化学添加剂,而对于这些化学添加剂的剂量,国家有着非常严格的标准,这也阻碍了产品的临床应用价值。
α2巨球蛋白作为广谱蛋白酶抑制剂在我们前期研究中已经证实具有缓解创伤性关节炎关节软骨退化的治疗作用,但目前它的生产工艺采用的是用聚乙二醇6000分段沉淀法将血浆中的血浆α2巨球蛋白富集于血浆中,再通过亲和层析法最终制成血浆α2巨球蛋白纯化物,现有的文献报道通过这种提纯方法生产的α2巨球蛋白的纯化倍数虽然可以达到72倍,但活力回收仅仅31%左右。然而上述方法存在α2巨球蛋白提取步骤繁琐,提取的过程中存在蛋白活性逐步降低的问题,并且在复杂的提取过程也加大了血液制品污染的概率。
中国专利CN 105153297A讲述了从Cohn组分IV沉淀中分离纯化α2-巨球蛋白的方法。但具体方法依次经过硫酸铵盐析、锌离子亲和层析、凝胶过滤和超滤浓缩过程,由于使用了化学添加成分,同样在一定程度上存在二次污染的可能性。
技术实现要素:
本实用新型为了解决现有的α2巨球蛋白的提纯方法存在提取步骤繁琐,提取的过程中存在蛋白活性逐步降低并且在复杂的提取过程也加大了血液制品污染概率的问题,提供了一种改良超滤离心法制备富含α2巨球蛋白血清的装置。
本实用新型所要解决的技术问题是通过以下技术方案实现的:
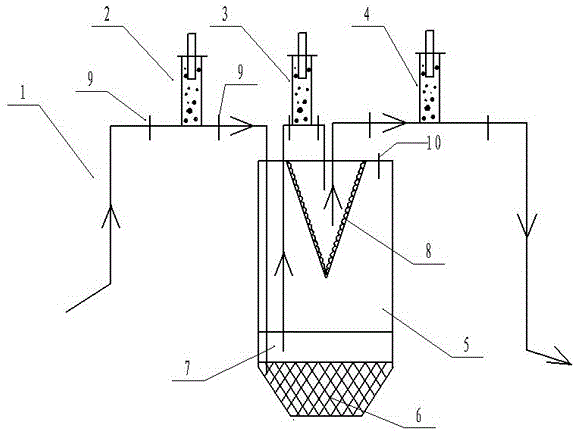
一种改良超滤离心法制备富含α2巨球蛋白血清的装置,包括离心管和抽吸装置,所述的离心管包括普通离心管和超滤离心管,所述的抽吸装置包括第一抽吸装置、第二抽吸装置和第三抽吸装置;所述的第一抽吸装置的两端分别通过导管连接目标血液和普通离心管的底部,所述的第二抽吸装置的两端分别通过导管连接普通离心管容置上清液的部位和超滤离心管的底部,所述的第三抽吸装置的两端分别通过导管连接超滤离心管容置上清液的部位和富含α2巨球蛋白血清收集器。
所述的普通离心管和超滤离心管同轴设置,超滤离心管设置于普通离心管管内上方,两管同用一个管盖,普通离心管和超滤离心管管壁有刻度。
所述的第一抽吸装置、第二抽吸装置和第三抽吸装置两端的导管上分别装有两个单向阀门。
所述的超滤离心管内部具有垂直结构滤膜。
所述的普通离心管上有纳米级气孔。
所述的普通离心管的规格为15-200ml,所述的超滤离心管为20kD-500kD截留分子量的超滤管,超滤管的截留分子量为需截留蛋白分子量的1/3-1/2。
改良超滤离心法制备富含α2巨球蛋白血清的方法,基于改良超滤离心法制备富含α2巨球蛋白血清的装置完成,具体步骤如下:
S1、打开第一抽吸装置两端两个单向阀门,通过第一抽吸装置将目标血液抽入普通离心管,在2000g离心力作用下,持续20分钟,将血细胞和血清分离;
S2、打开第二抽吸装置两端两个单向阀门,通过第二抽吸装置将S1所得血清抽入超滤离心管;
S3、在4摄氏度、5000g离心力作用下,将超滤离心管中的血清离心分离,持续90分钟;
S4、打开第三抽吸装置两端两个单向阀门,通过第三抽吸装置将所得的富含α2巨球蛋白血清浓缩液(α2-MRS)收集或利用。
本实用新型所述的抽吸装置为活塞式,普通离心管为常见的管状试样容器,带密封盖。
超滤离心法是依据需截留的蛋白质分子量选择不同孔径的超滤膜,利用高压力或离心力等简单物理方法将水和其它小的溶质分子滤过半透膜,而将所截留蛋白质留在超滤膜上或制备成相关蛋白的浓缩液。超滤离心法具有设备简单,无复杂操作过程,分离速度快,高效节能;所用超滤离心管内部具有垂直结构滤膜,这种结构的滤膜与离心力的方向平行,可降低浓差极化现象;普通离心管和超滤离心管外壁带有刻度,便于观察被分离物质体积的变化;使用样品少,便于检测需要;分离过程不会对生物分子的活性造成破坏,回收率高,重现性好。
目前针对于α2-M的超滤离心法需要将全血首先进行一次离心以去除血细胞,再将上清液(血清)加入超滤离心管内进行二次超滤离心。整个步骤较为繁琐,需要多步骤进行,对于血液制品的制作过程增加了污染的几率。本发明提供了使用样品少,便于检测需要;分离过程不会对生物分子的活性造成破坏,回收率高,重现性好。
本实用新型所述的改良超滤离心法制备富含α2-巨球蛋白血清(α2M-Rich Serum, α2-MRS)的装置采用简单物理超滤离心的方法,通过一次抽血将患者全血注入,通过第一次离心将血细胞去除,形成的上清液经过抽吸的方式注入普通离心管5内,经过二次离心将α-2M截留在超滤膜上形成富含α2巨球蛋白血清浓缩液(α2-MRS),并通过专有吸管抽取。经过这种方法制备的α2-MRS中α2-M经ELISA检测达到正常血清中α2-M浓度的8-10倍,α2-MRS中α2-M的蛋白活性也较正常血清中α2-M蛋白提高2.2倍。这将为下一步通过简单物理加工方法制备自体富含α2巨球蛋白血清(α2-MRS)进而注射膝关节腔治疗骨性关节炎提供技术支持。本实用新型所制备的富含α2巨球蛋白血清可应用于早、中期骨性关节炎或创伤性关节炎;早、中期的类风湿关节炎、膝关节疼痛、腰痛、肩周炎、腱鞘炎、 网球肘等疾病的治疗。
附图说明
图1为本实用新型改良超滤离心法制备富含α2巨球蛋白血清的装置示意图;
图2为富含α2巨球蛋白血清(α2-MRS)中α2巨球蛋白浓度的测定;
图3为富含α2M的血清(α2MRS)中α2M活性的检测;
图4为考马斯亮蓝染色;
图5为α2MRS的蛋白免疫印迹(Western Blot)检测。
图中标号:1- 导管,2-第一抽吸装置,3-第二抽吸装置,4-第三抽吸装置,5-普通离心管,6-血细胞,7-血清,8-超滤离心管,9-单向阀门,10-纳米级气孔。
具体实施方式
下面结合附图1对实用新型做进一步的详细说明。
改良超滤离心法制备富含α2巨球蛋白血清的装置,包括离心管和抽吸装置,所述的离心管包括普通离心管5和超滤离心管8,所述的抽吸装置包括第一抽吸装置2、第二抽吸装置3和第三抽吸装置4;所述的第一抽吸装置2的两端分别通过导管1连接目标血液和普通离心管5的底部,所述的第二抽吸装置3的两端分别通过导管连接普通离心管5容置上清液的部位和超滤离心管8的底部,所述的第三抽吸装置4的两端分别通过导管1连接超滤离心管8容置上清液的部位和富含α2巨球蛋白血清收集器。
所述的普通离心管5和超滤离心管8同轴设置,超滤离心管设置于普通离心管管内上方,两管同用一个管盖,普通离心管和超滤离心管管壁有刻度。所述的超滤离心管8内部具有垂直结构滤膜。所述的普通离心管5上有纳米级气孔10。所述的普通离心管的规格为15-200ml,所述的超滤离心管为20kD-500kD截留分子量的超滤管,超滤管的截留分子量为需截留蛋白分子量的1/3-1/2。
第一抽吸装置2、第二抽吸装置3和第三抽吸装置4两端的导管上分别装有两个单向阀门。
改良超滤离心法制备富含α2巨球蛋白血清的方法,基于改良超滤离心法制备富含α2巨球蛋白血清的装置完成,具体步骤如下:
S1、打开第一抽吸装置2两端两个单向阀门,通过第一抽吸装置2将目标血液抽入普通离心管5,在2000g离心力作用下,持续20分钟,将血细胞6和血清7分离;
S2、打开第二抽吸装置3两端两个单向阀门,通过第二抽吸装置3将S1所得血清7抽入超滤离心管8;
S3、在4摄氏度、5000g离心力作用下,将超滤离心管8中的血清7离心分离,持续90分钟;
S4、打开第三抽吸装置4两端两个单向阀门,通过第三抽吸装置4将所得的富含α2巨球蛋白血清浓缩液(α2-MRS)收集或利用。
实施例:临床上,符合治疗条件的患者经肘静脉采血,然后通过第一抽吸装置2抽取50ml静脉血,注入50ml普通离心管内5,离心力2000g下离心20min;
通过第二抽吸装置3经过收集上清液(血清)7注入超滤离心管8内,然后于4度低温、离心力5000g,离心时间90min;然后通过第三抽吸装置4,收集富含α2-M血清,并注射入患者自体关节腔内。
试验例:
1.富含α2巨球蛋白血清(α2-MRS)中α2巨球蛋白浓度的测定
Elisa结果表明:人的正常血清中α2-M的浓度为2.432±0.6648mg/ml, 经过本发明装置制备的α2-MRS中α2-M浓度为19.52±4.366mg/ml,滤过液中α2-M浓度仅为1.275±0.3874mg/ml。α2-MRS中α2-M的浓度为正常血清中α2-M浓度的8.02倍(见图2)。
2.富含α2-M的血清(α2-MRS)中α2-M活性的检测(见图3)
通过改良Ellis和Gollas-Galvan法检测结果表明:空白对照组的OD值为0.020±0.0008,标准品的OD值为0.081±0.0007,正常血清的OD值为0.047±0.0040,α2-MRS的OD值为0.100±0.0286。α2-MRS的α2M蛋白活性较正常血清提高了2.13倍。
3. α2-MRS的蛋白免疫印迹(Western Blot)检测(见图4、图5)
如图4所示,SDS-PAGE凝胶的考马斯亮蓝染色显示:在180kD处富含α2-M血清相比较正常血清处有非常明显的染色,而滤过液处则几乎看不到条带。SDS-PAGE凝胶的蛋白免疫印迹(Western Blot)结果显示富含α2-M血清在180kD处有非常显著的条带,正常血清处仅有非常轻微条带,而滤过液处则看不到任何条带(见图5)。
- 还没有人留言评论。精彩留言会获得点赞!