重新靶向病毒或VLP的制作方法
本发明涉及一种产生多瘤病毒或多瘤病毒衍生的病毒样颗粒(vlp)的方法,所述多瘤病毒或多瘤病毒衍生的vlp在其表面上携带至少一种与感兴趣的细胞结合的靶向分子,该方法包括使多瘤病毒或多瘤病毒衍生的vlp与以下接触的步骤:(i)靶向分子,其中用至少一种被多瘤病毒或多瘤病毒衍生的vlp识别的糖基残基使至少一种靶向分子糖基化;或(ii)第一相互作用分子,其中用至少一种被多瘤病毒或多瘤病毒衍生的vlp识别的糖基残基使所述第一相互作用分子糖基化;以及至少一种靶向分子,其中所述至少一种靶向分子与能够与第一相互作用分子相互作用的第二相互作用分子缀合。本发明进一步涉及多瘤病毒或多瘤病毒衍生的病毒样颗粒(vlp),其中病毒或vlp在其表面上携带至少一种与感兴趣的细胞结合的靶向分子,并且涉及通过本发明的方法获得或可获得的多瘤病毒或多瘤病毒衍生的vlp。此外,本发明涉及包含所述多瘤病毒或多瘤病毒衍生的vlp的组合物,并且涉及本发明的多瘤病毒或多瘤病毒衍生的vlp或本发明的组合物用作药物的用途。本发明进一步涉及包含本发明的多瘤病毒或多瘤病毒衍生的vlp或组合物的试剂盒。
在本说明书中,引用了许多文献包括专利申请和制造商手册。这些文献的公开内容(当不认为与本发明的专利性相关时)以其整体援引加入本文。更具体的地,所有引用的文献都以这样的程度援引加入,也即如同每个单独的文献都是特别并且单独指定援引加入的。
基于病毒载体的基因治疗有望成为大量遗传疾病的治愈方法。关于各种治疗工具(包括crispr/cas9基因组编辑系统、基因替代或rna干扰治疗)的不断发展,病毒载体再次成为遗传研究的焦点[1-5]。然而,用于临床使用的病毒载体存在局限性,包括载体产生的高成本,特异性靶向所需细胞类型从而避免对非靶向细胞的损害,以及将遗传物质有效掺入靶细胞[6]。大多数这些瓶颈也适用于非病毒递送工具,特别是用于药物和基因递送的快速扩展的纳米颗粒领域[7]。
只有当病毒向性与针对细胞类型的易感性相匹配时,才能实现特异性靶向所需细胞类型。例如,描述了jc多瘤病毒(jcv)感染带有5-ht2血清素受体并具有细胞表面暴露的乳糖四糖c(lactoseriestetrasaccharidec,lstc)聚糖上的α2,6-连接的唾液酸的靶细胞,这定义了jcv的天然向性[8-11]。jcv的向性由主要衣壳蛋白vp1中的几个弹性环定义,其位于成熟衣壳的外表面上。这些环被描述为负责lstc在靶细胞表面的结合[10]。在第二步中,募集5-ht2血清素受体,促进网格蛋白依赖性过程中的病毒进入。
密切相关的bk多瘤病毒(bkv)和多瘤病毒猿猴病毒40(sv40)显示出靶细胞识别和感染的相当但不同的特征。bkv和sv40使用不同的含α2,3-和α2,8-连接的唾液酸的神经节苷脂作为初始细胞表面标记物:例如bkv识别gd2、gd3、gd1b和gt1b,而sv40识别gm1[10、12、13]。一旦病毒检测到它们的靶细胞并通过其特异性神经节苷脂或lstc建立接触,就会发生细胞进入,而jcv、bkv和sv40使用不同的途径。bkv和sv40通过胞膜窖介导的机制进入细胞,而jcv需要网格蛋白依赖性内吞作用[14]。据推测,神经节苷脂识别差异的组合是这些病毒不同细胞进入机制的基础,并进一步决定了它们针对不同细胞类型的向性。
已经进行了大量研究以改变用于基因治疗的天然病毒向性,其目的是安全且特异性地将遗传物质递送到治疗相关细胞中。通常这些重新靶向方法基于将靶蛋白掺入病毒包膜中或通过将它们直接融合到病毒衣壳上[6]。
利用密切相关的小鼠多瘤病毒(mupyv)的vp1,例如证明用抗体结合基序(z-蛋白)修饰这些环(hi-loop)之一可以作为改变病毒向性的平台[15]。基于这种方法,可以将人源化抗体赫赛汀(herceptin)融合到vlp表面上,从而将它们重新靶向人表皮生长因子受体2(her2/neu)阳性细胞[16]。
还描述了重新靶向其他多瘤病毒方法。在多瘤病毒猿猴病毒40(sv40)的情况下,例如,已经描述了一种利用化学交联剂(sm[peg])2的重新靶向的方法。为此目的,将半胱氨酸残基引入病毒衣壳的外表面,并将该残基用于将人上皮生长因子化学交联到vlp上。利用这些重新靶向的vlp,作者成功转导了a431细胞[17]。
已经描述了另一种改变衍生自非多瘤病毒hpv16的vlp向性的可能方式[18],并且其基于在hpv16l1衣壳蛋白中引入生物素化位点。然而,将生物素化序列引入病毒衣壳代表了病毒衣壳的显著变化。此外,vlp的生物素化需要用另一种酶(生物素-连接酶)一起孵育,所述酶必须在孵育后除去,因此需要引入进一步的预备步骤。
这些目前可用的将病毒载体重新靶向特定靶细胞的方法的一个主要缺点是它们都需要直接修饰病毒或vlp,通常通过掺入或附着抗体或肽配体。在大多数情况下,这些修饰是共价修饰。制备这种重新靶向病毒载体通常伴随有各种问题,例如鉴定合适的接头以及要求复杂的纯化程序,这通常涉及限制其用于人类的实用性和适用性的几个纯化步骤。
此外,尽管已经描述了对于不同多瘤病毒的许多尝试[15、19、20],这些用相当大的蛋白质的直接修饰仍然与适当病毒衣壳组装、转导效率和稳定性方面的问题相关联。
在ep1270586a2中,已经描述了基于使用阳离子聚合物作为靶细胞特异性配体的锚定分子来重新靶向vlp的方法。作为合适的阳离子聚合物,氨基酸基聚合物(例如聚赖氨酸)或聚烯烃基亚胺(poly-alkylen-imine)(例如聚乙烯亚胺)被描述为结合jcvvp1vlp的相互作用配偶体。然后将靶细胞特异性配体与阳离子聚合物结合。重要的是,所述阳离子聚合物与vlp表面的相互作用既不是特异性的也不是受控的相互作用,而是仅依赖于vlp和阳离子聚合物的不同电荷。
因此,尽管目前正在投入大量努力来开发用于靶向转染特定细胞的合适载体系统,但这些系统通常经历复杂的处理以及耗费成本和耗费时间的制备方法,以及装配、效率和稳定性或缺乏特异性的潜在问题。因此,仍然需要提供制备病毒载体的新方法,所述病毒载体可以以简单且有效的方式靶向特定细胞,并且所述病毒载体基于对病毒衣壳组装、转导效率和稳定性的影响尽可能小的重新靶向分子。这些方法将代表有价值的研究和治疗工具,并将为该领域提供巨大的价值。
通过提供在权利要求中表征的实施方案来解决这种需要。
因此,本发明涉及一种产生多瘤病毒或多瘤病毒衍生的病毒样颗粒(vlp)的方法,所述多瘤病毒或多瘤病毒衍生的vlp在其表面上携带至少一种与感兴趣的细胞结合的靶向分子,该方法包括使多瘤病毒或多瘤病毒衍生的vlp与以下接触的步骤:(i)至少一种靶向分子,其中用至少一种被多瘤病毒或多瘤病毒衍生的vlp识别的糖基残基使所述至少一种靶向分子糖基化;或(ii)第一相互作用分子,其中用至少一种被多瘤病毒或多瘤病毒衍生的vlp识别的糖基残基使所述第一相互作用分子糖基化;以及至少一种靶向分子,其中所述至少一种靶向分子与能够与第一相互作用分子相互作用的第二相互作用分子缀合。
多瘤病毒是一病毒科,其天然宿主主要是哺乳动物和鸟类。它们是无包膜的双链dna病毒,具有环状基因组,包装在直径约40-50纳米的二十面体病毒衣壳中。所述衣壳由72个vp1蛋白的五聚体组成,并且每个vp1分子与一个vp2或vp3分子相连。目前,该科有76种公认的物种。多瘤病毒的非限制性实例包括例如以下人多瘤病毒:bk多瘤病毒、jc多瘤病毒、merkel细胞多瘤病毒、trichodysplasiaspinulosa多瘤病毒、人多瘤病毒9、人多瘤病毒12、newjersey多瘤病毒、ki多瘤病毒、wu多瘤病毒、人多瘤病毒6、人多瘤病毒7、mw多瘤病毒和stl多瘤病毒。多瘤病毒的另一主要实例是sv40,它指猿猴空泡病毒40或猿猴病毒40,这是一种在猴子和人类中都发现的多瘤病毒。
许多多瘤病毒在所研究的大多数人群中通常是无症状的。然而,一些多瘤病毒与人类疾病有关,特别是在免疫受损的个体中。例如,bk病毒与肾移植和非肾实体器官移植患者中的肾病相关,jc病毒与进行性多灶性脑白质病相关,而merkel细胞病毒与merkel细胞癌相关。
病毒样颗粒在本领域中是熟知的,并且已描述于例如tegerstedt等人[21]。vlp的一个主要优点是当活减毒病毒用作病毒载体时,它们与任何再组装风险无关。vlp生产具有额外的优点,即一旦感兴趣的特定病毒株的基因序列变得可得,它可以比传统疫苗生产更早开始。
取决于所用的蛋白质,大多数vlp可以在各自的病毒结构蛋白表达时自组装,例如,包膜的结构蛋白或衣壳中的结构蛋白。例如,对于得自jcv的vlp,本领域熟知的它们在仅主要衣壳蛋白vp1表达时自发形成。合适的vp1序列以及促进vlp形成的适当条件是本领域已知的,并且已描述于例如chang等人(1997)和goldmann等人(1999)[22、23]。在使用不具有自组装成vlp的固有特性的衣壳蛋白的情况下,可以添加额外的辅助因子,例如病毒蛋白vp2、vp3以及核细胞提取物,以在其他的解离条件下实现组装成vlp,如关于sv40所描述的[24]。优选地,vlp由在体内和/或体外合适条件下具有自组装的固有性质的蛋白质组成,使得vlp的形成不需要额外的辅助因子。
根据本发明,vlp衍生自多瘤病毒。在本文中使用的术语“衍生的”是指vlp由多瘤病毒蛋白(例如多瘤病毒的衣壳蛋白vp1,如人多瘤jc病毒的衣壳蛋白vp1)的病毒蛋白组装而成。
vlp可以由一种类型的蛋白质或几种不同类型的蛋白质组成。优选地,vlp由一种类型的蛋白质组成,优选由一种类型的衣壳蛋白组成。
应当理解,多瘤病毒衍生的vlp可以得自病毒,但也可以通过本领域熟知的方法重组产生。重组产生可以在多种细胞培养系统中进行,包括哺乳动物细胞系、昆虫细胞系、酵母、原核细胞和植物细胞。
到目前为止,已经产生了来自不同病毒科的vlp,包括多瘤病毒病毒、细小病毒科(例如腺相关病毒)、逆转录病毒科(例如hiv)和黄病毒科(例如丙型肝炎病毒)。取决于所选择的宿主/载体系统,可以直接从宿主细胞中进行重组vlp的分离,也可以从细胞培养上清液中进行重组vlp的分离。重组制备vlp的一个优点是它们可以以高纯度和大量获得。用于重组合成vp1的常用表达系统依赖于昆虫细胞,例如昆虫细胞系sf158,以及通过使用杆状病毒将编码vp1的dna引入所述细胞中。
根据本发明的方法,产生病毒或vlp,其在其表面上携带至少一种靶向分子。
如本文所用,术语“在其表面上”表示靶向分子的位置,使得其暴露于病毒或vlp周围的环境,即它位于病毒或vlp颗粒的外面。
根据本发明,术语“靶向分子”是指能够与感兴趣的部分(例如感兴趣的细胞上的(表面)蛋白)相互作用的分子。由于这种能力,靶向分子可以向导病毒或vlp到所述感兴趣的部分并且该部分存在于细胞上,即它将病毒或vlp“靶向”所述细胞。例如,如果特定的癌细胞(例如her2/neu阳性乳腺癌细胞和结肠直肠癌细胞)代表感兴趣的细胞,则可以选择所述癌细胞的表面标记物(例如her2/neu)作为感兴趣的部分。根据本发明,靶向分子将是能够与所述标记物(例如her2/neu)相互作用的任何分子,例如抗体、配体等,如下文更详细讨论的。
根据本发明,术语“至少一种靶向分子”是指可以存在多于一种的单一靶向分子。它还意味着可以存在多于一种分子类型的靶向分子(即不同类型的靶向分子)。换句话说,术语“在其表面上携带至少一种靶向分子”明确地涵盖根据本发明存在多于一种分子的靶向分子,并且它还明确地涵盖可以存在多于一种分子类型的靶向分子(即一种或多种靶向分子)。
根据本发明,靶向分子是与所述感兴趣的细胞(即“靶细胞”)结合的分子。优选地,靶向分子是与所述感兴趣的细胞特异性结合的分子。如本文所用,术语“特异性结合的分子”(在本文中也称为“特异性相互作用的分子”)是指与相应的感兴趣的细胞结合但不与或基本上不与不同类型的细胞交叉反应的分子。这种特异性可以例如通过选择仅存在于靶细胞上但在所有其他细胞上不存在的感兴趣的部分来实现。可以测试一组正在研究的分子的交叉反应性,例如,通过评估所述分子组在常规条件下与感兴趣的细胞的结合,以及与一些(结构上和/或功能上)或多或少密切相关的细胞的结合。只有那些与感兴趣的细胞结合但不与或基本上不与任何其他细胞结合的分子才被认为对感兴趣的细胞是特异的。
在病毒或vlp表面上存在多于一种分子类型的靶向分子的情况下,优选所述不同类型的靶向分子对于相同的感兴趣的细胞都是特异性的。
如本文所用,术语“基本上不交叉反应的分子”是指与感兴趣的细胞(即靶细胞)结合的分子,其亲和力比与不同细胞结合高至少5倍,更优选亲和力高至少10倍,例如亲和力高至少50倍,更优选亲和力高至少100倍,例如亲和力高至少250倍。甚至更优选地,它与感兴趣的细胞结合的亲和力比与不同的细胞结合的亲和力高至少500倍,最优选亲和力高至少1000倍。
本发明的方法在第一备选方案(即,备选方案(i))中包括使多瘤病毒或多瘤病毒衍生的vlp与至少一种靶向分子接触的步骤,其中用至少一种被多瘤病毒或多瘤病毒衍生的vlp识别的糖蛋白或糖脂使所述至少一种靶向分子糖基化。
如本文所用,术语“包含”表示除了所列举的组分和/或步骤之外还可包括其他组分和/或步骤。然而,该术语也涵盖所要求保护的主题确切地由所列举的组分和/或步骤组成。
如本文所用,术语“接触”和“使……接触”不受特别限制并且包括使病毒/vlp与靶向分子接触的所有方式,例如将靶向分子添加至例如悬浮液中的病毒/vlp。本文还设想,一旦使靶向分子与病毒/vlp接触,就包括纯化步骤以除去未结合的靶向分子。如何进行除去未结合的靶向分子的非限制性实例是例如尺寸排阻色谱法。
根据本发明,使至少一种靶向分子糖基化。为此,可以用所需的糖基残基直接使任何靶向分子糖基化,或者它可以与至少一种包含所需糖基残基的糖蛋白或糖脂融合。“糖基残基”可以是通过糖苷键与靶向分子或与糖蛋白或糖脂稳定连接的任何糖基基团,只要选择糖基残基以使其被与至少一种靶向分子结合的多瘤病毒或多瘤病毒衍生的vlp识别。在本文中,术语“识别”是指相应的病毒或vlp对所述糖基残基具有天然向性,因此识别并结合所述糖基残基。应当理解,不要求所述糖基残基仅被这一种病毒/vlp识别;实际上,糖基残基可以介导多种病毒/vlp的向性。然而,还设想选择仅被一种特定类型的病毒/vlp识别(即特异性识别)的糖基残基,例如仅被jcv而不被其他病毒例如bk病毒或sv40识别。在使用多于一种类型的靶向分子的那些情况下,特别优选用相同的糖基残基使所有靶向分子糖基化。这可以通过相同或不同的糖基化方式进行,包括如本文所述的直接和间接糖基化。更优选地,通过相同的糖基化方法用相同的糖基残基使所有不同类型的靶向分子糖基化。
本文所用的术语“至少”,例如术语“至少一种糖基残基”或“至少一种”是指具体列举的数字(即“一”),但也指多于具体列举的数字。例如,术语“至少一种糖基残基”还涵盖至少两种、至少三种、至少四种、至少五种不同的糖基残基等。此外,该术语还涵盖正好一种、正好两种、正好三种、正好四种、正好五种不同的糖基残基等。
如上所述,已知病毒对某些细胞类型具有天然向性。例如,已描述jcv感染带有5-ht2血清素受体家族成员并具有细胞表面暴露的乳糖四糖c(lstc)聚糖上的α2,6-连接的唾液酸的靶细胞,这定义了jcv的天然向性[8-11]。另外,已经描述了衍生自不同jcv病毒株的vlp不仅与lstc相互作用,而且与不同的糖脂和糖蛋白、与含有α2,3-α2,8-α2,6-sa的寡糖相互作用。例如,已显示衍生自基因型3病毒株(wt3)的vlp与具有α2,3-和α2,8-saasialo的神经节苷脂-gm1、gm1、gm2、gd1a、gd1b、gd2、gt1a和gt1b结合[25]。此外,已显示mad-1病毒株vlp与α2,3-α2,8-和α2,6-sa结合,包括神经节苷脂gm3、gd2、gd3、gd1b,gt1b和gq1b[26]。
已经公布了关于其他多瘤病毒(例如bk病毒或sv40)的类似观察结果。例如,已经描述了分子gd2、gd3、gd1b和gt1b介导bk病毒对其表面上携带所述神经节苷脂的靶细胞的天然向性。目前认为细胞类型例如人成纤维细胞、人上皮细胞和人胚肾细胞因此可能是bk病毒的靶细胞[27]。此外,已经描述了分子gm1介导sv40病毒对携带该分子的细胞的天然向性。因此有人提出,细胞类型例如人类胎儿和新生儿组织可能是sv40病毒的靶[27]。
因此,用这样的(一种或多种)糖基残基使至少一种靶向分子糖基化能够使(一种或多种)所述靶向分子与对所述(一种或多种)糖基残基具有天然向性的病毒或vlp结合。因为糖基残基和vp1之间的相互作用通常形成直接或间接氢键,包括水介导的氢键,或者与确定的vp1残基形成范德华联系,特别优选(一种或多种)糖基残基能够通过直接或间接氢键或通过范德华联系使(一种或多种)所述靶向分子与病毒或vlp结合。例如,通过用lstc使靶向分子糖基化,通过末端neunac和邻近lstc的gal的α2,6-唾液酸发生相互作用[10]。
因此,所述靶向分子可以被jcv结合,而不需要进一步对病毒或vlp表面进行共价修饰以附着(一个或多个)靶向分子。
用糖基残基使感兴趣的蛋白质(例如本发明的靶向分子)糖基化的手段和方法是本领域熟知的。例如,通过选择合适的表达系统,可以直接或通过与糖蛋白或糖脂融合,获得携带所需糖基化模式的重组产生的靶向分子。必要时,可以修饰表达系统,例如通过遗传改变用于重组生产的宿主细胞,例如巴斯德毕赤氏酵母(pichiapastoris)或哺乳动物细胞。例如在ahmad等人2014[28]中已经详细描述了这些方法。或者,相关的糖基残基也可以通过已建立的交联方法附着至(一种或多种)靶向分子,例如通过使用化学接头,包括但不限于nhs-马来酰亚胺、羧基-胺接头例如edc(1-乙基-3-(3-二甲氨基丙基)碳二亚胺盐酸盐)。同样,这种附着可以是直接将糖基残基附着至(一种或多种)靶向分子,或者通过将各个糖基残基(间接)附着至(一种或多种)靶向分子,例如通过使用涵盖各个糖基残基的糖蛋白或糖脂。同样在至少一种靶向分子是碳水化合物的那些情况下,糖基化可以通过本领域熟知的方法进行。例如,可以通过糖部分之间的缩合反应将糖基残基添加到(一种或多种)靶向分子上。将糖基残基(直接或间接)附着至至少一种感兴趣的靶向分子的其他手段和方法是本领域已知的,并且已在例如komagome等人[26]中描述。
根据本发明,优选通过在合适的宿主系统中表达获得至少一种糖基化的靶向分子。这种重组表达糖基化的靶向分子不需要任何额外的修饰步骤,因此工作强度较较低。
在另一个备选方案(即,备选方案(ii))中,本发明的方法包括使两个相互作用分子彼此接触的步骤,其中所述两个相互作用分子能够彼此相互作用。用至少一种被多瘤病毒或多瘤病毒衍生的vlp识别的糖基残基使第一相互作用分子糖基化。第二相互作用分子与至少一种靶向分子缀合。优选地,所述缀合是第二相互作用分子与至少一种靶向分子的共价结合。
以上提供的关于第一备选方案的定义,特别是关于接触和用至少一种被多瘤病毒或多瘤病毒衍生的vlp识别的糖基残基来糖基化的定义,经适当修改后适用于该第二备选方案。
根据该备选方案,不直接用糖基残基使所述至少一种靶向分子糖基化。相反,靶向分子与一相互作用分子缀合,优选共价结合,并且用相应糖基残基的糖基化存在于另一相互作用分子上。选择两种相互作用分子使得它们彼此相互作用。在相互作用时,靶向分子间接连接糖基残基,并因此被糖基化。
合适的相互作用分子是本领域熟知的。非限制性实例包括抗生物素蛋白-生物素系统,包括例如抗生物素蛋白-生物素、链霉抗生物素蛋白-生物素和neutravidin-生物素,以及包含抗体及其相应配体、谷胱甘肽和谷胱甘肽s-转移酶(gst)、麦芽糖-结合蛋白、fitc和抗fitc、不可逆蛋白质附着系统(ipas)的系统,以及标签如flag-、myc-、ha-、1d4-、polyarg-、钙调蛋白、几丁质-结合-、纤维素-结合、s-蛋白-、strep-和his-标签及其相应的相互作用配偶体[29]。进一步的非限制性实例包括点击化学方法,以及uv-、热-和ph-依赖性交联[30]。额外的非限制性方法包括分裂蛋白质方法以融合靶向蛋白和lstc-糖基化蛋白,或包括能够实现例如vp1-结合碳水化合物和靶细胞结构的稳定相互作用的双功能抗体[31-36]。
在两种备选方案中,本发明的方法涵盖(直接或间接)使糖基化的靶向分子与多瘤病毒或多瘤病毒衍生的vlp接触。这种接触导致(一种或多种)靶向分子通过糖基残基与病毒或vlp结合。因此,病毒或vlp不再靶向细胞表面上的相应糖基残基,而是重新靶向至少一种靶向分子能够结合的感兴趣的细胞。
因此,本发明提供了一种将病毒和病毒样颗粒靶向感兴趣的细胞的新方法。该方法依赖于对某些糖基残基(其通常用作靶细胞上的表面标记物)具有天然向性的病毒/vlp。这些糖基残基现在用于介导不同靶向分子的结合,所述靶向分子可以靶向任何感兴趣的细胞,完全独立于所述病毒或vlp的天然靶细胞。甚至,靶向分子的结合可另外用于“掩蔽”病毒或vlp上其天然靶细胞的结合位点。
先前的方法,例如[15]中描述的利用抗体结合基序修饰主要衣壳蛋白vp1中的一个弹性环的修饰具有以下缺点:在第一步中需要修饰病毒/vlp。此外,靶向分子与病毒或vlp表面的共价偶联需要在第一步中对病毒或vlp进行这种修饰。这些初始步骤意味着必须进行额外繁琐的程序步骤,这不仅耗费时间,而且耗费成本。由于制备用于治疗方法的病毒和vlp的过程已经是相当苛刻的过程,其需要高度精炼的过程条件和分析监测,因此除非绝对必要,否则优选避免任何额外的方法步骤。此外,包括这些修饰步骤还意味着需要额外费力的纯化步骤,这进一步增加了制备过程的复杂性。过去这些技术限制严重限制了新的重新靶向系统的开发。
另一方面,本发明提供了产生可靶向多种不同的感兴趣的细胞的病毒或vlp的方法,而无需现有技术方法所需的病毒或vlp的初始繁琐的修饰和纯化步骤。由此获得的病毒和vlp在许多不同领域中具有适用性,例如作为运载体用感兴趣的核酸分子转导靶细胞,例如用于基因治疗,或用于将物质靶向递送至靶细胞,例如将细胞毒性化合物递送癌细胞。
在本发明方法的优选实施方案中,多瘤病毒是人多瘤jc病毒或衍生自人多瘤jc病毒的vlp。
jc病毒(也称为johncunningham病毒)缩写为jcv,并且是与bk病毒和sv40在遗传上相似的人多瘤病毒。它引起进行性多灶性脑白质病(pml)和其他疾病,但仅限于免疫缺陷病例,如艾滋病或在免疫抑制药物治疗期间(例如器官移植患者)。识别14种亚型或基因型,每种亚型或基因型与特定地理区域相关联。在另一种编号方案中,基因型编号为1至8并附加字母。jcv的天然宿主谱包括神经和相关组织的细胞,例如少突胶质细胞、星形胶质细胞、和神经胶质细胞。
以上提供的关于多瘤病毒或多瘤病毒衍生的vlp的所有定义和优选实施方案经适当修改后适用于该优选实施方案。
在本发明方法的另一优选实施方案中,vlp包含人多瘤jc病毒的衣壳蛋白vp1。
就vlp包含人多瘤jc病毒的衣壳蛋白vp1(而不是由人多瘤jc病毒的衣壳蛋白vp1组成)而言,特别优选vlp不含真实(authentic)病毒的其他组分,例如真实的病毒核酸。甚至更优选地,vlp“由人多瘤jc病毒的衣壳蛋白vp1”组成,即不存在其他病毒衣壳蛋白。应当理解,根据本发明,即使在vlp“由衣壳蛋白vp1组成”的情况下,该vlp仍包含附着于vlp表面的(一种或多种)靶向分子。此外,任选地设想“由衣壳蛋白vp1组成”的vlp可任选地含有额外的货物分子或额外的靶向部分(假设所述额外的靶向部分不是病毒衣壳蛋白),如下文更详细地定义。换句话说,vlp“由人多瘤jc病毒的衣壳蛋白vp1组成”的定义意味着构建vlp的分子,即运载体(不涉及其货物分子或附着分子)仅由vp1蛋白组成。
如本文所用,术语“衣壳蛋白vp1”涉及人多瘤jc病毒的野生型病毒株的衣壳蛋白vp1,并涉及该衣壳蛋白的修饰形式,即通过突变(例如取代、插入和/或缺失)不同于野生型-衣壳蛋白的蛋白质。人多瘤jc病毒的野生型病毒株的衣壳蛋白vp1是本领域已知的,并由geneid:1489518(2016年8月20日在ncbi数据库上更新)或uniprotidp03089(2016年9月14日可得)表示。vp1的编码序列也显示在seqidno:1中,而其氨基酸序列显示在seqidno:2中。
在更优选的实施方案中,vlp由重组产生的衣壳蛋白组成。为了产生重组vp1,优选使用包含以下并优选由以下组成的核酸分子:
(i)seqidno:1的核酸分子,
(ii)seqidno:1序列的核酸分子,其中每个胸腺嘧啶被尿嘧啶置换;
(iii)在严格条件下与(i)或(ii)的核酸分子的互补链杂交的核酸分子;
(iv)与(i)的核酸分子具有至少85%序列相同性的核酸分子;或
(v)相对于(i)至(iii)的核酸分子简并的核酸分子。
由核酸分子产生重组蛋白的手段和方法是本领域熟知的。例如,所述核酸分子或含有该核酸分子的(重组)载体可被引入到合适的宿主细胞,然后在使相应的核酸分子表达的条件下培养所述宿主细胞,并且从细胞或细胞上清液分离蛋白质。
如本文所用,“严格条件”是指杂交条件,在该条件下,能够在感兴趣的核酸分子的整个长度上与感兴趣的核酸分子杂交的核酸分子不与不相关的核酸分子交叉杂交。严格条件是序列依赖性的,并且在不同情况下会有所不同。本领域技术人员可以根据熟知的参数(例如温度、核酸分子的组成、盐条件等)建立每种核酸序列的适当严格杂交条件。参见,例如,sambrook等人,"molecularcloning,alaboratorymanual";cshpress,coldspringharbor,1989或higginsandhames(eds.),同前文献,特别参见britten&davidson的"hybridizationstrategy"章,3-15。
根据上面引用的选项(iv),特别优选的是,对于vp1-多肽的重组产生,使用与seqidno:1的核酸序列至少85%、优选至少90%、特别优选至少95%、最优选至少98%相同的核酸分子,其中在seqidno:1的整个长度上确定相同性。
由seqidno:1的核酸分子编码的氨基酸序列显示在seqidno:2中。如上所述,vp1蛋白也可以是修饰的vp1蛋白。在前述段落中列举的核酸分子序列相同性的优选程度经适当修改后适用于衣壳蛋白vp1的这些修饰的形式,即优选修饰的vp1蛋白至少85%、优选至少90%、更优选至少95%、最优选至少98%与由seqidno:2的氨基酸序列组成的vp1蛋白相同,其中在seqidno:2的整个长度上确定相同性。
优选地,修饰的vp1蛋白质是这样的蛋白质,其中氨基酸序列在n-末端区域被修饰,例如在n-末端25个氨基酸的区域内。特别优选的修饰是引入异源核定位信号。优选的核定位信号含有氨基酸序列cpgaap(seqidno:5)或氨基酸序列x1x2p,其中x1和x2分别表示任意氨基酸,优选k,并且其基于例如sv40或bkv的核定位信号的氨基酸序列。编码这种优选的修饰的vp1蛋白(vp1-mut2)的核酸序列显示在seqidno:3中。相应的氨基酸序列显示在seqidno:4中。
在本发明方法的另一优选实施方案中,糖基残基含有α2,3-α2,8-或α2,6-sa,并且优选选自乳糖四糖c(lstc)、gm1、asialo-gm1、gm2、gd1a、gd1b、gd2、gt1a、gt1b、gm3、gd3和gq1b。
如本文所用,术语“乳糖四糖c”,在本文中也缩写为lstc,是指具有uipac名称(2r,4s,5r,6r)-5-acetamido-2-[[(3r,4s,5r,6s)-6-[(2r,3s,4r,5r,6s)-5-acetamido-6-[(2r,3s,4s,5r,6s)-3,5-dihydroxy-2-(hydroxymethyl)-6-[(2r,3r,4r,5r)-1,2,4,5-tetrahydroxy-6-oxohexan-3-yl]oxyoxan-4-yl]oxy-4-hydroxy-2-(hydroxymethyl)oxan-3-yl]oxy-3,4,5-trihydroxyoxan-2-yl]methoxy]-4-hydroxy-6-[(1r,2r)-1,2,3-trihydroxypropyl]oxane-2-carboxylicacid并具有pubchemcid53477861(2016年10月18日可得)的sialyllacto-n-neotetraosec。
根据本发明,术语“gm1”涉及具有uipac名称(2s,4s,5r,6r)-5-acetamido-2-[(2s,3r,4r,5s,6r)-5-[(2s,3r,4r,5r,6r)-3-acetamido-5-hydroxy-6-(hydroxymethyl)-4-[(2r,3r,4s,5r,6r)-3,4,5-trihydroxy-6-(hydroxymethyl)oxan-2-yl]oxyoxan-2-yl]oxy-2-[(2r,3s,4r,5r,6r)-4,5-dihydroxy-6-[(e,2r,3s)-3-hydroxy-2-(icosanoylamino)icos-4-enoxy]-2-(hydroxy-methyl)oxan-3-yl]oxy-3-hydroxy-6-(hydroxymethyl)oxan-4-yl]oxy-4-hydroxy-6-[(1r,2r)-1,2,3-trihydroxypropyl]oxane-2-carboxylicacid并具有pubchemcid9963963(2016年10月14日可得)的神经节苷脂单唾液酸四己糖神经节苷脂。
根据本发明,术语“asialo-gm1”涉及具有uipac名称n-[(e)-1-[(3r,4r,5s,6r)-5-[(2s,3r,4r,5r,6r)-5-[(2s,3r,4r,5r,6r)-3-acetamido-5-hydroxy-6-(hydroxymethyl)-4-[(2r,3r,4s,5r,6r)-3,4,5-trihydroxy-6-(hydroxymethyl)oxan-2-yl]oxyoxan-2-yl]oxy-3,4-dihydroxy-6-(hydroxymethyl)oxan-2-yl]oxy-3,4-dihydroxy-6-(hydroxymethyl)oxan-2-yl]oxy-3-hydroxyoctadec-4-en-2-yl]octadecanamide并具有pubchemcid6450363(2016年10月18日可得)的神经节苷脂ganglio-n-tetraosylceramide。
根据本发明,术语“gm2”涉及具有iupac名称5-acetamido-2-[[5-[3-acetamido-4,5-dihydroxy-6-(hydroxymethyl)oxan-2-yl]oxy-2-[4,5-dihydroxy-2-(hydroxymethyl)-6-[3-hydroxy-2-(octadecanoylamino)octadec-4-enoxy]oxan-3-yl]oxy-3-hydroxy-6-(hydroxymethyl)oxan-4-yl]oxymethyl]-4-hydroxy-6-(1,2,3-trihydroxypropyl)oxane-2-carboxylicacid并具有pubchemcid92039511(2016年10月18日可得)的神经节苷脂gm2。
根据本发明,术语“gm3”涉及具有iupac名称(2s,4s,5r)-5-acetamido-2-[(2s,3r,4s,5s,6r)-2-[(2r,3s,4r,5r,6r)-6-[(e,2s,3r)-2-[[(z)-docos-13-enoyl]amino]-3-hydroxyoctadec-4-enoxy]-4,5-dihydroxy-2-(hydroxymethyl)oxan-3-yl]oxy-3,5-dihydroxy-6-(hydroxymethyl)oxan-4-yl]oxy-4-hydroxy-6-[(1r,2r)-1,2,3-trihydroxypropyl]oxane-2-carboxylicacid并具有pubchemcid53481206(2016年10月18日可得)的神经节苷脂gm3。
根据本发明,术语“gd1a”涉及具有iupac名称(2r,4s,5r,6r)-2-[[(2r,3s,4s,5r,6s)-4-[(2s,4s,5r,6r)-5-acetamido-2-carboxy-4-hydroxy-6-[(1r,2r)-1,2,3-trihydroxypropyl]oxan-2-yl]oxy-6-[(2r,3r,4r,5r,6s)-5-acetamido-6-[(2r,3r,4r,5r,6s)-6-[(2r,3s,4r,5r,6r)-4,5-dihydroxy-2-(hydroxymethyl)-6-[(e,2s,3r)-3-hydroxy-2-(octadecanoylamino)octadec-4-enoxy]oxan-3-yl]oxy-4,5-dihydroxy-2-(hydroxymethyl)oxan-3-yl]oxy-4-hydroxy-2-(hydroxymethyl)oxan-3-yl]oxy-3,5-dihydroxyoxan-2-yl]methoxy]-4-hydroxy-5-[(2-hydroxyacetyl)amino]-6-[(1r,2r)-1,2,3-trihydroxypropyl]oxane-2-carboxylicacid;azane并具有pubchemcid102601600(2016年10月18日可得)的神经节苷脂gd1a。
如本文所用,术语“gd1b”是指具有iupac名称(2s,4s,5r,6r)-5-acetamido-2-[(2s,3r,4r,5s,6r)-5-[(2s,3r,4r,5r,6r)-3-acetamido-5-hydroxy-6-(hydroxymethyl)-4-[(2r,3r,4s,5r,6r)-3,4,5-trihydroxy-6-(hydroxymethyl)oxan-2-yl]oxyoxan-2-yl]oxy-2-[(2r,3s,4r,5r,6r)-4,5-dihydroxy-2-(hydroxymethyl)-6-[(e)-3-hydroxy-2-(octadecanoylamino)octadec-4-enoxy]oxan-3-yl]oxy-3-hydroxy-6-(hydroxymethyl)oxan-4-yl]oxy-6-[(1s,2r)-2-[(2s,4s,5r,6r)-2-carboxy-4-hydroxy-5-[(2-hydroxyacetyl)amino]-6-[(1r,2r)-1,2,3-trihydroxypropyl]oxan-2-yl]oxy-1,3-dihydroxypropyl]-4-hydroxyoxane-2-carboxylicacid并具有pubchemcid92132037(2016年10月18日可得)的gd1b-神经节苷脂。
根据本发明,术语“gd2”涉及具有iupac名称(2r,4r,5s,6s)-2-[3-[(2s,3s,4r,6s)-6-[(2s,3r,4r,5s,6r)-5-[(2s,3r,4r,5r,6r)-3-acetamido-4,5-dihydroxy-6-(hydroxymethyl)oxan-2-yl]oxy-2-[(2r,3s,4r,5r,6r)-4,5-dihydroxy-2-(hydroxymethyl)-6-[(e)-3-hydroxy-2-(octadecanoylamino)octadec-4-enoxy]oxan-3-yl]oxy-3-hydroxy-6-(hydroxymethyl)oxan-4-yl]oxy-3-amino-6-carboxy-4-hydroxyoxan-2-yl]-2,3-dihydroxypropoxy]-5-amino-4-hydroxy-6-(1,2,3-trihydroxypropyl)oxane-2-carboxylicacid并具有pubchemcid6450346(2016年10月18日可得)的gd2-神经节苷脂。
根据本发明,术语“gd3”涉及具有iupac名称5-acetamido-6-[(1s,2r)-2-[5-acetamido-2-carboxylato-4-hydroxy-6-[(1r,2r)-1,2,3-trihydroxypropyl]oxan-2-yl]oxy-1,3-dihydroxypropyl]-2-[2-[4,5-dihydroxy-2-(hydroxymethyl)-6-[(e,2s,3r)-3-hydroxy-2-(tricosanoylamino)octadec-4-enoxy]oxan-3-yl]oxy-3,5-dihydroxy-6-(hydroxymethyl)oxan-4-yl]oxy-4-hydroxyoxane-2-carboxylate并具有pubchemcid16760459(2016年10月18日可得)的神经节苷脂gd3。
根据本发明,术语“gt1a”涉及具有iupac名称(2r,4s,5r,6r)-2-[(2s,3s,4r,5r,6s)-2-[(2r,3s,4s,5s,6s)-3-acetamido-2-[(2s,3r,4s,5s,6r)-4-[(2r,4s,5r,6r)-5-amino-2-carboxy-4-hydroxy-6-(1,2,3-trihydroxypropyl)oxan-2-yl]oxy-6-[(2r,3s,4r,5r,6r)-4,5-dihydroxy-2-(hydroxymethyl)-6-[(e)-3-hydroxy-1-(octadecanoylamino)octadec-4-en-2-yl]oxyoxan-3-yl]oxy-5-hydroxy-2-(hydroxymethyl)oxan-3-yl]oxy-5-hydroxy-6-(hydroxymethyl)oxan-4-yl]oxy-3,5-dihydroxy-6-(hydroxymethyl)oxan-4-yl]oxy-5-amino-6-[2-[(2r,4s,5r,6r)-5-amino-2-carboxy-4-hydroxy-6-(1,2,3-trihydroxypropyl)oxan-2-yl]oxy-1,2-dihydroxyethyl]-4-hydroxyoxane-2-carboxylicacid并具有pubchemcid6450319(2016年10月18日可得)的多聚唾液酸神经节苷脂。
根据本发明,术语“gt1b”涉及具有iupac名称(2s,4s,5r,6r)-5-acetamido-2-[(2r,3r,4s,5s,6r)-2-[(2s,3r,4r,5r,6r)-3-acetamido-2-[(2r,3s,4r,5r,6s)-4-[(2s,4s,5r,6r)-5-acetamido-6-[(1s,2r)-2-[(2s,4s,5r,6r)-5-acetamido-2-carboxy-4-hydroxy-6-[(1r,2r)-1,2,3-trihydroxypropyl]oxan-2-yl]oxy-1,3-dihydroxypropyl]-2-carboxy-4-hydroxyoxan-2-yl]oxy-6-[(2r,3s,4r,5r,6r)-4,5-dihydroxy-2-(hydroxymethyl)-6-[(e,2s,3r)-3-hydroxy-2-(octadecanoylamino)octadec-4-enoxy]oxan-3-yl]oxy-5-hydroxy-2-(hydroxymethyl)oxan-3-yl]oxy-5-hydroxy-6-(hydroxymethyl)oxan-4-yl]oxy-3,5-dihydroxy-6-(hydroxymethyl)oxan-4-yl]oxy-4-hydroxy-6-[(1r,2r)-1,2,3-trihydroxypropyl]oxane-2-carboxylicacid并具有pubchemcid14181654(2016年10月18日可得)的gt1b神经节苷脂(c36)。
在本发明方法的特别优选的实施方案中,糖基残基是乳糖四糖c(lstc)。
在本发明方法的另一优选实施方案中,至少一种靶向分子选自蛋白质、肽或碳水化合物。应当理解,在使用多于一种靶向分子的那些情况下,所述靶向分子可以独立地选自蛋白质、肽和碳水化合物,即它们可以彼此不同。
如本文所用,术语“肽”描述了由最多30种氨基酸组成的一组分子,而“蛋白质”由多于30种氨基酸组成。肽和蛋白质可以进一步形成二聚体、三聚体和更高级寡聚体,即由可以相同或不相同的多于一个的分子组成。因此,相应的更高级结构称为同二聚体或异二聚体,同三聚体或异三聚体等。术语“肽”和“蛋白质”(其中“蛋白质”可与“多肽”互换使用)也指天然修饰的肽/蛋白质,其中所述修饰例如通过糖基化、乙酰化、磷酸化等实现。这些修饰在本领域中是熟知的。此外,本文还涵盖了这样的肽和蛋白质的假肽(peptidomimetic),其中(一种或多种)氨基酸和/或(一个或多个)肽键已经被功能类似物置换。这些功能类似物包括除20种基因编码的氨基酸之外的所有已知氨基酸,例如硒代半胱氨酸。下文详细描述了合适的蛋白质或肽的具体、优选的实例。
如本文所用,术语“碳水化合物”是指任何类型的碳水化合物。该术语涵盖天然存在的碳水化合物以及化学修饰的碳水化合物。碳水化合物通常分为四个化学类别:单糖、二糖、寡糖和多糖。优选地,根据本发明的碳水化合物是任何二糖或寡糖以及其醇。二糖和寡糖的优选组分包括但不限于葡萄糖、甘露糖、岩藻糖、半乳糖、n-乙酰半乳糖胺和出芽短梗霉聚糖。
几种细胞表面分子能够结合碳水化合物,特别是二糖或寡糖。例如,凝集素能够识别不同的碳水化合物部分,导致摄取相应的分子。此外,肝细胞如肝实质细胞表达脱唾液酸糖蛋白受体(asgp-r),它可以识别多种脱唾液酸化的糖蛋白和含有末端β-d-半乳糖或n-乙酰半乳糖胺残基的新糖蛋白,它还可以识别其他糖残基。例如甘露糖、乳糖或果糖和由其衍生的酸,例如乳糖酸[37-39]。
通过选择合适的碳水化合物作为靶向分子,可以靶向携带相应受体的靶细胞,例如人肝细胞癌细胞。
在本发明方法的更优选的实施方案中,至少一种靶向分子是选自抗体、转铁蛋白、表皮生长因子(egf)家族成员、细胞因子、部分病毒糖蛋白、cd9、var2csa、胰岛素或gaba配体的蛋白质。同样,应当理解,在使用多于一种靶向分子的那些情况下,所述靶向分子可以独立地选自所列举的蛋白质,即它们可以彼此不同。
根据本发明的抗体可以是,例如,多克隆或单克隆抗体。如本文所用,术语“抗体”还包括以下实施方案,例如嵌合抗体(人恒定结构域,非人可变结构域)、单链和人源化(除了非人cdr之外的人抗体)抗体以及抗体片段,尤其是例如fab、fab'、fd、f(ab')2、fv或scfv片段或纳米抗体,即单个单体可变抗体结构域;参见,例如,harlowandlane"antibodies,alaboratorymanual",coldspringharborlaboratorypress,1988和harlowandlane“usingantibodies:alaboratorymanual”coldspringharborlaboratorypress,1999。产生抗体的技术使本领域熟知的,并且描述于例如harlowandlane(1988)和(1999),同前文献。
优选地,抗体是能够结合癌细胞标记物(例如her2/neu、致癌胚(carcinoembryogenic)抗原、cd33、cd34或硫酸软骨素a)的抗体。
如本文所用,术语“转铁蛋白”涉及糖蛋白,其结合铁作为血浆蛋白,因此参与细胞铁离子递送。已经描述了两种人类转铁蛋白受体,转铁蛋白受体1(tfr1)(uniprotkb-p02786)和转铁蛋白受体2(tfr2)(uniprotkb-q9up52)。两种受体都是跨膜糖蛋白,其中tfr1是普遍表达的受体,tfr2限于肝细胞和红细胞[40]。
如本文所用,术语“表皮生长因子(egf)家族成员”涉及与表皮生长因子受体相互作用的人表皮生长因子蛋白家族。家族成员的非限制性实例包括例如egf(uniprotkbp01133)、转化生长因子α(uniprotkb-p01135)或肝素结合egf样生长因子(uniprotkb-q99075)。
如本文所用,术语“细胞因子”涉及控制细胞增殖和分化的肽。细胞因子的非限制性实例包括白细胞介素(例如il-2、il-6、il-10)、干扰素(例如ifn-α、ifn-β和ifn-γ)、集落刺激因子(csf)和肿瘤坏死-因子(tnf)。
根据本发明,术语“部分病毒糖蛋白”是指病毒糖蛋白的表位识别序列,而没有它们各自的膜-锚或衣壳-锚。部分病毒糖蛋白的非限制性实例包括enva、vsv-g或hiv-1gp160。
如本文所用,术语“enva”涉及禽白血病病毒的包膜糖蛋白gp95,并且由uniprotkb-p03397(2016年10月14日可得)表示。
如本文所用,术语“vsv-g”涉及水泡性口炎病毒的刺突糖蛋白g,并且由uniprotkb-p04882(2016年10月14日可得)表示。
如本文所用,术语“hiv-1gp160”涉及人免疫缺陷病毒1型的包膜糖蛋白gp160,并且由uniprotkb-p03375(2016年10月14日可得)表示。
如本文所用,术语“cd9”涉及跨膜四蛋白(tetraspanin)家族成员cd9。cd9的登记号为uniprotkb-p21926(2016年10月14日可得)。
根据本发明,术语“var2csa”是指恶性疟原虫(plasmodiumfalciparum)var2基因家族成员pfemp1(uniprotkb-o96108,2016年10月14日可得),其基因产物能够结合硫酸软骨素a。
如本文所用,术语“胰岛素”涉及人胰岛素,并且由uniprotkb-p01308(2016年10月14日可得)表示。
如本文所用,术语“gaba配体”涉及可用作一种(或多种)gaba受体家族成员即gabaa-ρ或gabab的配体的任何分子。gaba的合适配体的非限制性实例包括咪唑-4-乙酸、蝇蕈醇、异去甲基槟榔次碱(isoguvacine)和thip[41]。
通过使用上述靶向分子,可以将病毒或vlp重新靶向疾病相关的靶细胞。例如,抗体的使用适于将病毒或vlp靶向表达所述抗体的抗原的任何细胞,例如当使用抗-her2/neu抗体时,靶向表达her2/neu的癌细胞。类似地,使用egf家族成员(例如表皮生长因子(egf)本身)作为靶向分子使得vlp靶向表达egf受体的癌细胞。转铁蛋白使vlp靶向表达转铁蛋白受体的细胞,因此允许靶向极其广泛的靶细胞和组织。利用完整或部分胰岛素使vlp靶向β细胞和暴露胰岛素受体的其他细胞类型。细胞因子非常适合与它们相应的受体相互作用,并且当用作(一种或多种)靶向分子时,它们可以介导摄取到多种细胞类型的骨髓或淋巴谱系中。gaba配体可介导vlp特异性靶向外周或中枢神经系统内的细胞。最后,通过使用部分病毒糖蛋白,可以将病毒或vlp重新靶向相应的受体,使得对应的病毒用于宿主感染,因此,可以使用这种重新靶向的vlp来治疗或预防病毒感染。总之,由此重新靶向的病毒或vlp提供广泛的用途,包括治疗和研究应用。例如,并且如下面更详细讨论的,通过使用携带例如针对基因治疗方法、rna干扰方法、以及基于dna的肿瘤疫苗接种方法的相关货物分子的这些病毒或vlp,研究人员可以研究各种疾病和/或临床医生治疗各种疾病。
在本发明方法的另一更优选的实施方案中,至少一种靶向分子是选自p物质、阿片样物质或细胞穿透肽的肽。同样,应当理解,在使用多于一种靶向分子的那些情况下,所述靶向分子可以独立地选自这些肽,即它们可以彼此不同。
如本文所用,术语“p物质”涉及具有序列rpkpqqffglm(seqidno:6)的神经激肽寡肽家族成员。p物质特别适合于帮助货物传送至暴露神经激肽1型受体(nk1r)的细胞,包括神经元组织和某些类型的癌症,包括结肠直肠癌[42、43]。因此,设想p物质用作靶向分子能够治疗与外周或中枢神经系统细胞有关的病症和治疗暴露nk1r的癌症类型。
如本文所用,术语“阿片样物质”涉及作用于阿片受体的任何物质,例如δ阿片受体(dor)、κ阿片受体(kor)、μ阿片受体(mor)、痛敏肽受体(nor)或zetta阿片受体(zor)。阿片样物质包括衍生自鸦片的化合物,包括例如吗啡,以及半合成和合成化合物例如氢可酮、羟考酮和芬太尼,拮抗化合物例如纳洛酮,或内源肽例如内啡肽。阿片受体广泛分布于大脑中,但也存在于脊髓和消化道中。
因此,通过选择合适的阿片类物质作为靶向分子,可以靶向携带阿片受体的靶细胞,例如外周感觉神经元(dor、mor、kor的靶细胞)、基底神经节和大脑的新皮层区域(dor的靶细胞)[44]、脊髓(kor、mor、nor的靶细胞)或心脏、骨骼肌和肝脏细胞(的zor靶细胞)[45、46]。
如本文所用,术语“细胞穿透肽”(cpp)涉及短阳离子肽如触角足、tat、transportan和聚精氨酸,其已在本领域中描述为用于肽递送的工具[47]。cpp可以介导附着的货物穿过细胞膜的易位,因此特别适合作为vlp和病毒的靶向和/或进入分子。
在本发明方法的另一优选实施方案中,第一和第二相互作用分子是抗生物素蛋白和生物素、链霉抗生物素蛋白和生物素或neutravidin和生物素。
相互作用分子的抗生物素蛋白-链霉抗生物素蛋白系统,包括变体链霉抗生物素蛋白-生物素和neutravidin-生物素,在本领域中是熟知的,并且已描述于例如dundas等人,2013。链霉抗生物素蛋白以高选择性和nm范围的kd.结合其相互作用配偶体生物素。此外,链霉抗生物素蛋白在高温和宽ph内稳定。最新的改进产生了单结构域链霉抗生物素蛋白-蛋白质,在结合-化学计量方面允许更加可控的方法[48]。
根据该优选实施方案,第一和第二相互作用分子的选择不限于所列举的顺序。换句话说,如果第一和第二相互作用分子是抗生物素蛋白和生物素,则设想(i)抗生物素蛋白是第一相互作用分子,生物素是第二相互作用分子;或(ii)生物素是第一相互作用分子,抗生物素蛋白是第二相互作用分子。这经适当修改后同样适用于相互作用分子的其他列举的组合,即链霉抗生物素蛋白和生物素以及neutravidin和生物素。
在本发明方法的另一优选实施方案中,病毒或vlp还在病毒或vlp内包含一种或多种货物分子。
如本文所用,术语“一种或多种”涵盖正好一种以及一种以上的任何数字,例如两种、三种、四种、五种、六种、七种、八种、九种、十种等。优选地,病毒或vlp包含至多400种货物分子,在sirna的情况下,优选至多300种分子。
根据本发明,术语“货物分子”涉及由本发明的病毒或vlp转运的分子。货物分子的非限制性实例包括核酸分子,特别是调节核酸分子、毒素、蛋白质例如酶、肽以及其他小分子例如碘化丙锭。优选地,所述货物分子是用于治疗或研究目的的药物化合物或药物。
将货物分子包括在病毒或vlp中的手段和方法是本领域熟知的,并且已描述于例如teunissen等人,2013[49]中。更具体地,已经在例如wo2009/036933中详细描述了vlp作为核酸分子的药物递送系统的用途。例如在abbing等人,2004[50]中已经描述了通过vlp递送蛋白质和低分子物质。如该参考文献中所述,有利的是将货物分子偶联到vlp的内表面,例如通过确保货物分子与vp2的相互作用。这些方法是本领域技术人员熟知的,例如从abbing等人,2004[50]。
在优选的实施方案中,货物分子是核酸分子。合适的核酸分子的非限制性实例包括用于疫苗接种目的的核酸分子以及调节核酸分子,例如rna干扰诱导分子。
优选地,rna干扰诱导分子是rna,例如dsrna(包括例如sirna)、mirna、shrna或其前体,和/或rna类似物。或者,优选rna干扰诱导分子是dna和/或dna类似物,其编码dsrna(包括例如sirna)、mirna、shrna或其前体。应当理解,这种dna分子可以包含其他调节元件,以确保rna干扰诱导分子在靶细胞中的表达。
适合作为货物分子的此类核酸分子是本领域熟知的,并且已描述于例如wo2009036933中。还如wo2009036933中所述,特别优选vlp与rna干扰诱导分子的质量比率在1:100至100:1之间,更优选1:50至50:1,甚至更优选1:20至20:1,最优选在1:1至20:1的范围内。相同的比率经适当修改后适用于病毒与rna干扰诱导分子的质量比率。
在另一更优选的实施方案中,货物分子是酶,例如能够释放或激活已被带入靶向组织附近的细胞毒性剂的酶,例如用于前药激活的酶,例如选自羧肽酶、葡糖醛酸酶和葡糖苷酶的酶(bagshawe,k.d.[2009]curr.drugtargets10:152-157;chen,k.-c.[2011]bioconjugatechem.22:938–948)。货物分子也可以是适于用作成像剂的酶,例如能够催化显色、化学发光或荧光反应的酶,如例如辣根过氧化物酶(hrp)、荧光素酶、β-半乳糖苷β和碱性磷酸酶(ap)。
用于成像目的的货物分子的进一步非限制性实例包括荧光蛋白例如绿色荧光蛋白(gfp)、黄色荧光蛋白(yfp)、红色荧光蛋白(rfp)、青色荧光蛋白(cfp)或红外荧光蛋白(ifp),以及荧光染料例如荧光素、alexafluor或cy染料。此类货物分子尤其可用作荧光示踪剂,例如用于荧光图像引导手术(figs),这是用于在手术期间检测荧光标记结构的医学成像技术(vandam,g.m.etal.[2011]nat.med.17:1315-1319;mondal,s.b.eta.[2014]adv.cancerres.124:171-211)。
放射性部分可另外附着于货物分子用于成像,包括体内诊断。这种放射性部分包括例如γ-发射同位素组例如99mtc、123i、125i、111in,和正电子发射体组例如18f、64cu、68ga、86y、124i、89zr。除了体内或体外成像或检测,β-发射体组例如131i、90y、177lu、67cu,以及α-发射体组例如213bi、211at额外适用于放射免疫治疗(rit)中的应用。
此外,货物分子可以是光敏剂,例如双(三乙醇胺)sn(iv)二氢卟吩e6(snche6)。此外,货物分子也可以是碘化丙锭,其可以用作对照以确保货物递送至病毒或vlp。
货物分子本身也可以是毒性化合物,优选小的有机化合物或多肽。毒性化合物的非限制性实例包括选自加利车霉素、新制癌菌素、esperamicin、dynemicin、kedarcidin、maduropeptin、多柔比星、柔红霉素、auristatin、maitansine、蓖麻毒素-a链、modeccin、截短的假单胞菌外毒素a、白喉毒素和gelonin的化合物。
如上所述,根据本发明的一个实施方案,特别优选vlp由人多瘤jc病毒的衣壳蛋白vp1组成,即不存在形成vlp的其他蛋白质。根据该优选实施方案,本发明的方法因此涉及产生vlp的方法,所述vlp由人多瘤jc病毒的衣壳蛋白vp1组成,在其表面上携带至少一种(特异性)与感兴趣的细胞结合的靶向分子,并进一步携带一种或多种货物分子。
在本发明方法的另一优选实施方案中,病毒或vlp还在病毒或vlp的表面上包含额外的异源分子。
如本文所用,术语“异源分子”涉及存在于病毒或vlp表面上的蛋白质,其通常不存在于所述病毒的表面上。例如,病毒或vlp可在其表面上携带分子,其充当进一步的靶向部分或在施用病毒或vlp后增强宿主中的免疫应答。
增强宿主中免疫应答的分子的非限制性实例包括脂多糖(lps),以及与toll样受体相互作用的肽,例如模仿与lps结合的tlr-4相互作用肽。此类肽是本领域熟知的,并且已描述于例如shanmugametal.2012,synthetictolllikereceptor-4(tlr-4)agonistpeptidesasanovelclassofadjuvants;plosone7(2):e30839中。其中描述的肽包括作为示例性肽的以下肽:具有序列gln-glu-ile-asn-ser-ser-tyr(seqidno:7)的rs01,具有序列ser-his-pro-arg-leu-ser-ala(seqidno:8)的rs02,具有序列ser-met-pro-asn-pro-met-val(seqidno:9)的rs03,具有序列gly-leu-gln-gln-val-leu-leu(seqidno:10)的rs04,具有序列his-glu-leu-ser-val-leu-leu(seqidno:11)的rs05,具有序列tyr-ala-pro-gln-arg-leu-pro(seqidno:12)的rs06,具有序列thr-pro-arg-thr-leu-pro-thr(seqidno:13)的rs07,具有序列ala-pro-val-his-ser-ser-ile(seqidno:14)的rs08,具有序列ala-pro-pro-his-ala-leu-ser(seqidno:15)的rs09,具有序列thr-phe-ser-asn-arg-phe-ile(seqidno:16)的rs10,具有序列val-val-pro-thr-pro-pro-tyr(seqidno:16)的rs11,和具有序列glu-leu-ala-pro-asp-ser-pro(seqidno:18)的rs12。进一步设想的是例如用于直接刺激t细胞的b7(cd86)片段[51]。
此类额外的靶向部分可包括,例如,通过本领域已知的常规方法结合的靶向部分,例如掺入病毒包膜中或直接融合到病毒衣壳上的靶向部分,如例如在verheijeandrottier2012中所述。此外,这些异源分子也可以通过与靶向分子相同的方法与病毒或vlp结合,即通过(i)用至少一种被多瘤病毒或多瘤病毒衍生的vlp识别的糖基残基使异源分子糖基化;或通过(ii)使用如上所述的相互作用系统,即其中用至少一种被多瘤病毒或多瘤病毒衍生的vlp识别的糖基残基使第一相互作用分子糖基化,并且第二相互作用分子与所述异源分子缀合且其中第二相互作用分子能够与第一相互作用分子相互作用。
优选地,在本发明方法中使用已经携带这种(一种)异源分子的病毒或vlp,从而避免了进一步修饰病毒/vlp的需要。
因此,根据本发明的一个优选实施方案,vlp可以由人多瘤jc病毒的衣壳蛋白vp1组成,在其表面上携带至少一种与感兴趣的细胞结合的靶向分子,并且任选地在其表面上携带(一种或多种)额外的异源分子,其中所述额外的异源分子不是病毒衣壳蛋白。
本发明进一步涉及多瘤病毒或多瘤病毒衍生的vlp,其中病毒或vlp在其表面上携带至少一种与感兴趣的细胞结合的靶向分子,并且其中至少一种靶向分子已通过以下方式与病毒或vlp表面结合:
(i)用至少一种糖基残基使至少一种靶向分子糖基化,其中所述至少一种糖基残基被多瘤病毒或多瘤病毒衍生的vlp识别并结合;或
(ii)至少两种相互作用分子之间的相互作用,其中用至少一种糖基残基使第一相互作用分子糖基化,其中所述至少一种糖基残基被多瘤病毒或多瘤病毒衍生的vlp识别和结合;并且其中所述至少一种靶向分子与能够与第一相互作用分子相互作用的第二相互作用分子缀合。
换句话说,所述实施方案涉及多瘤病毒或多瘤病毒衍生的病毒样颗粒(vlp),其中病毒或vlp在其表面上携带至少一种与感兴趣的细胞结合的靶向分子,并且其中至少一种靶向分子通过以下方式与病毒或vlp表面结合:
(i)至少一种靶向分子的至少一种糖基残基,其中所述至少一种糖基残基被多瘤病毒或多瘤病毒衍生的vlp识别并结合;或
(ii)至少两种相互作用分子之间的相互作用,其中用至少一种糖基残基使第一相互作用分子糖基化,其中所述至少一种糖基残基被多瘤病毒或多瘤病毒衍生的vlp识别和结合;并且其中所述至少一种靶向分子与能够与第一相互作用分子相互作用的第二相互作用分子缀合。
以上关于本发明方法提供的定义和优选实施方案经适当修改后适用于该多瘤病毒或多瘤病毒衍生的vlp。例如,如上所述,明确设想本发明的这种多瘤病毒或多瘤病毒衍生的vlp可以进一步包含一种或多种货物分子,和/或可以在其表面上进一步包含额外的异源分子。
本发明的这种多瘤病毒或多瘤病毒衍生的vlp特别用于研究和临床前应用,特别是需要将特定分子(例如上述货物)靶向递送至靶细胞的应用以及医学应用,如下文中更详细讨论。研究和临床前应用的非限制性实例包括例如细胞的转染、原代细胞的处理、混合细胞培养物中的选择性转导、离体材料的测试、器官型切片培养的测试、动物测试等。进一步的非限制性临床前应用包括用于靶向验证和化合物测试的筛选测定。此外,重新靶向的病毒或vlp也可以被固定化,例如通过嵌入基质或与珠子结合,并且可以用于pull-down靶细胞或用于相互作用研究。
在本发明的多瘤病毒或多瘤病毒衍生的vlp的优选实施方案中,通过本发明的方法获得或可获得病毒或vlp。
本发明进一步涉及包含本发明的多瘤病毒或多瘤病毒衍生的vlp的组合物。
根据本发明使用的术语“组合物”涉及至少包含本发明的多瘤病毒或多瘤病毒衍生的vlp以及其他化合物(例如能够改变本发明的多瘤病毒或多瘤病毒衍生的vlp特征的分子,由此例如稳定、延迟、调节和/或激活其功能)的组合物,或者可选地,包含至少一个容器。该组合物可以是固体、液体或气体形式,尤其可以是粉末、片剂、溶液或气溶胶的形式。
该组合物可进一步包含多于一种的根据本发明的多瘤病毒或多瘤病毒衍生的vlp。在这种情况下,特别优选包含在组合物中的多瘤病毒或多瘤病毒衍生的vlp包含如上定义的不同的靶向分子、在病毒或vlp表面上的不同的额外的异源分子和/或不同的货物分子。
在一个优选的实施方案中,该组合物是药物组合物。
根据本发明,术语“药物组合物”涉及用于施用给患者、优选人患者的组合物。本发明的药物组合物包含上述列举的(一种或多种)化合物。任选地和另外地,本发明的药物组合物可包含药学上可接受的载体。“药学上可接受的载体”是指无毒的固体、半固体或液体填充剂、稀释剂、包封材料或任何类型的配制助剂。合适的药学上可接受的载体的实例是本领域熟知的,包括氯化钠溶液例如磷酸盐缓冲的氯化钠溶液、水、乳液例如油/水乳液、各种类型的润湿剂、无菌溶液、有机溶剂等。这样的药学上可接受的载体通常含有少量添加剂,如增强等渗性和化学稳定性的物质。这些物质在所用剂量和浓度下对接受者无毒,并且包括缓冲剂如磷酸盐、柠檬酸盐、琥珀酸盐、乙酸和其他有机酸或其盐;抗氧化剂如抗坏血酸;低分子量(少于约10个残基)肽例如聚精氨酸或三肽;蛋白质如血清白蛋白、明胶或其他免疫球蛋白;亲水性聚合物如聚乙烯吡咯烷酮;氨基酸如甘氨酸、谷氨酸、天冬氨酸或精氨酸;单糖、二糖和其他碳水化合物包括纤维素或其衍生物、葡萄糖、甘露糖或糊精;糖醇如甘露糖醇或山梨糖醇;抗衡离子例如钠;和/或非离子表面活性剂例如聚山梨醇酯、泊洛沙姆或peg。壳聚糖也可以包含在药物组合物中,例如用于在给药时延迟病毒或vlp的释放。
取决于药物组合物的预期用途,药物组合物可包含其他药剂,例如用于治疗肿瘤的抗肿瘤剂。
施用本发明药物组合物可以通过不同方式进行,例如通过静脉内、腹膜内、皮下、肌肉内、皮内、鼻内或支气管内施用。因此,优选药学上可接受的载体是适合于这些施用方式的载体。最优选地,载体是与接受者的血液或组织液等渗的溶液。包含此类载体的组合物可通过熟知的常规方法配制。通常,通过使药物组合物的组分与液体载体或细碎的固体载体或两者均匀且紧密地接触来制备制剂。然后,如果需要,将产品成形为所需的制剂。本发明药物组合物的优选施用方式是通过静脉内、肌肉内或腹膜内注射,以及通过气溶胶或水凝胶(例如基于壳聚糖的水凝胶)递送。
药物组合物可以以合适的剂量施用于对象。剂量方案将由主治医师和临床因素确定。如在医学领域中熟知的,任何一个患者的剂量取决于许多因素,包括患者的尺寸、体表面积、年龄、要施用的特定化合物、性别、施用的时间和途径、一般健康状况和同时施用的其他药物。对于给定情况的治疗有效量将容易通过常规实验确定,并且在普通临床医生或医师的技能和判断范围内。药物组合物可以用于一次施用或在延长的时间段内定期施用。通常,对于单次剂量,药物组合物的施用应该在例如1μg/kg体重至50mg/kg体重的范围内,优选约0.5mg/kg体重。然而,对于单次剂量,更优选的剂量可以在10μg/kg至20mg/kg体重的范围内,甚至更优选100μg/kg至10mg/kg体重,甚至更优选500μg/kg至5μg/kg体重。
用于治疗性施用的药物组合物的组分必须是无菌的。例如,通过无菌过滤膜(例如,0.2μm膜)过滤可以容易地实现无菌。
如下所述,药物组合物可特别用于治疗肿瘤和/或服从基因治疗方法治疗的疾病。
在另一优选的实施方案中,本发明的组合物是诊断组合物。
根据本发明,术语“诊断组合物”涉及用于诊断患者是否患有特定疾病(例如癌症)的组合物。例如,通过用可检测部分(例如如上所述)标记病毒或vlp并将其靶向癌细胞特异性标记分子,可以检测患者体内癌细胞的存在和位置。本发明的诊断组合物可用于本领域熟知的体内以及体外或离体诊断实验设计中。本发明的诊断组合物至少包含根据本发明的多瘤病毒或多瘤病毒衍生的vlp。诊断组合物可进一步包含适当的(一种或多种)缓冲剂等。
药物或诊断组合物的组分可以包装在容器或多个容器中,例如密封的安瓿或小瓶,以水溶液或用于重构的冻干制剂。优选地,组合物的组分与使用说明书一起包装。作为冻干制剂的实例,向10ml小瓶中灌入5ml1%(w/v)或10%(w/v)水溶液,并将得到的混合物冻干。通过使用例如用于治疗用途的注射用水或用于诊断目的的另一种所需溶剂(例如缓冲剂)重构冻干的(一种或多种)化合物来制备使用溶液。还可以存在防腐剂和其他添加剂,例如抗微生物剂、抗氧化剂、螯合剂和惰性气体等。
本发明还涉及本发明的多瘤病毒或多瘤病毒衍生的vlp或本发明的组合物,其用作药物。
例如,本发明的病毒或vlp可用于将货物分子(例如上文所述的调节性或免疫原性核酸)递送至感兴趣的靶细胞。此类货物分子可以例如用于基因治疗方法,用于rna干扰方法,以及用于基于dna的肿瘤疫苗接种方法。
基因治疗基于引入治疗性核酸构建体,通常是dna构建体,用于通过离体或体内技术将遗传缺陷校正为生殖谱系细胞。因此,基因治疗目前是基因转移最重要的应用之一。用于体外或体内基因治疗的合适方法描述于文献中并且是本领域技术人员已知的[6、52-54]。适合用基因治疗治疗的疾病的非限制性实例包括遗传性疾病,如严重联合免疫缺陷(ada-scid)、慢性肉芽肿性疾病(cgd)或血友病。此外,可通过基因治疗治疗的获得性疾病包括但不限于癌症(例如肺癌、乳腺癌、结肠直肠癌)、神经退行性疾病(例如帕金森氏病或亨廷顿病)和其他获得性疾病例如病毒感染、心脏病和糖尿病。
rna干扰方法特别适用于治疗由表达病原生物体核酸引起的疾病,或由异常表达内源核酸引起的疾病,即其表达量增加或其表达不需要。rna干扰可用于下调此类核酸的表达,如例如wo2009036933中所述。例如,vlp或病毒可以递送抑制病毒(包括但不限于hiv-1(人免疫缺陷病毒)、肝炎、kshv(kaposi肉瘤相关疱疹病毒)、ebv(epstein-barr病毒)以及多瘤jc病毒)基因表达的rnai效应子。
基于dna的肿瘤疫苗接种方法也是本领域熟知的,并且已在例如fioretti等人,2010[55]中描述。dna疫苗接种通常用于诱导宿主针对外来遗传物质例如病毒、细菌和寄生虫的免疫应答。为了使副免疫效应最小化,必须将抗性-盒和用于质粒微生物扩增的ori序列减少到最小。一种特别适合的方法涵盖使用midge载体,它是最小化的dna盒,其末端已被发夹封闭,产生线性化的单分子dna[56]。除了如上所述在基因治疗设置中利用这种最小化载体外,它们特别适用于例如dna驱动的肿瘤疫苗接种方法。
本发明进一步涉及包含本发明的多瘤病毒或多瘤病毒衍生的病毒样颗粒(vlp)或本发明的组合物的试剂盒。
鉴于在其最广泛的意义上,术语“试剂盒”不需要存在除所列举组分之外的任何其他化合物,但在本发明的试剂盒的情况中,术语“包含”表示其他组分可存在于所述组合物中。这些其他组分的非限制性实例包括防腐剂、缓冲剂、酶等。
当试剂盒中包含几种组分时,试剂盒的各种组分可以包装在一个或多个容器中,例如一个或多个小瓶中。因此,试剂盒的各种组分可以单独或组合存在。除组分外,容器或小瓶可包含用于储存的防腐剂或缓冲剂和用于组装的缓冲剂。此外,该试剂盒还包含使用说明。
如上所述,发现了该试剂盒的许多应用,特别是在研究和医学中。特别优选的是,试剂盒是用于将货物分子递送至靶细胞的试剂盒。
除非另外定义,否则本文使用的所有技术和科学术语具有与本发明所属领域的普通技术人员通常理解的含义相同的含义。如有冲突,以专利说明书(包括定义)为准。
通过本文引用的数据库登录号可访问的所有序列都在本发明的范围内,并且还包括数据库中可能的未来更新,以便考虑将来由于科学的不断进步可能发生的针对各个数据库的条目的更正和修改。
本文提供的所有氨基酸序列大多数以n-末端残基开始,大多数以c-末端残基结束(n→c),如本领域通常所做的,并且在整个发明中用于标识氨基酸的单字母或三字母代码缩写对应于通常用于氨基酸的那些。
关于在本说明书中表征的实施方案,特别是在权利要求中,旨在将从属权利要求中提到的每个实施方案与实施从属权利要求所从属的每个权利要求(独立的或从属的)的每个实施方案组合。例如,假设独立权利要求1列举3个备选方案a、b和c,从属权利要求2列举3个备选方案d、e和f,并且从属于权利要求1和权利要求2的权利要求3列举3个备选方案g、h和i,除非另有说明,应理解,该说明书明确地公开了对应于以下组合的实施方案:a、d、g;a、d、h;a、d、i;a、e、g;a、e、h;a、e、i;a、f、g;a、f、h;a、f、i;b、d、g;b、d、h;b、d、i;b、e、g;b、e、h;b、e、i;b、f、g;b、f、h;b、f、i;c、d、g;c、d、h;c、d、i;c、e、g;c、e、h;c、e、i;c、f、g;c、f、h;c、f、i。
类似地,同样在独立和/或从属权利要求未列举备选方案的那些情况下,应理解,如果从属权利要求引用多个在前权利要求,则认为明确公开了由此涵盖的主题的任何组合。例如,假设独立权利要求1,从属权利要求2引用权利要求1,并且从属权利要求3引用权利要求2和权利要求1,其结果是清楚且明确地公开了权利要求3和权利要求1的主题的组合,如同与权利要求3、2和1的主题的组合一样。假设存在另外的从属权利要求4,其引用权利要求1至3中的任一项,其结果是清楚且明确地公开了权利要求4和1,权利要求4、2和1,权利要求4、3和1,以及权利要求4、3、2和1的主题的组合。
上述考虑因素经适当修改后适用于所有所附权利要求。为了给出非限制性实例,鉴于权利要求结构,清楚且明确地设想了权利要求10、9和6的组合。这同样适用于权利要求12、9和7的组合,或权利要求12、9和4的组合等。
附图说明
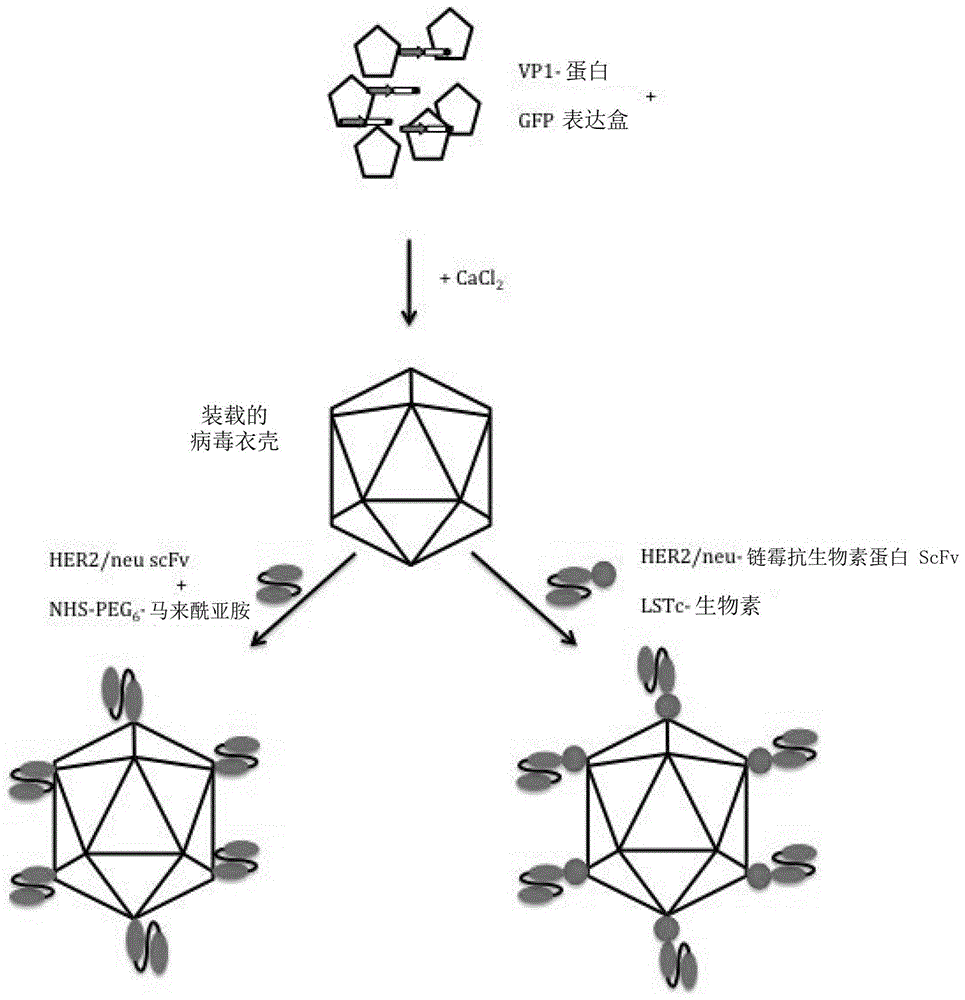
图1:jcvvlp的一般结构和靶向蛋白的附着。
加入egta和dtt(各15mm)后,vp1蛋白解离成寡聚体部分。在存在cag-gfp表达盒的情况下,通过透析除去egta和dtt,同时向vp1中加入cacl2,导致衣壳形成和掺入dna。在左下方的示意图中,her2/neuscfv片段通过已建立的方法通过多接头(nhs-peg6-马来酰亚胺)交联到衣壳上,产生共价的巯基键和异肽键。在右下方的示意图中,her2/neu-链霉抗生物素蛋白scfv通过lstc-生物素结合到病毒衣壳上。
图2:spr(表面等离子共振)设置的示意图,用于研究lstc对vlp表面的亲和力。
a)spr测量的一般设置:测定1描述了一种设置,其中lstc-生物素被固定并且vp1-vlp存在于流动相中,并且仅在vp1-vlp结合到固定的lstc上后才被固定。测定2显示了一种设置,其中vp1-vlp被固定并且neutravidin::lstc-生物素存在于流动相中,并在在lstc结合到固定的vp1-vlp上后才被固定。b)将neutravidin::lstc-生物素复合物注射到固定的vp1中;使用的最高浓度为5μm。获得的结合模式是高亲合力相互作用的特征。c)neutravidin::peg的对照实验。生物素作为流动相分析物,其显示没有检测到与固定的vp1的相互作用。
图3:spr测量以证明lstc对重组vlp和jcv病毒壳粒的亲和力。
a)具有高和低装载密度的neutravidin::lstc-生物素基质-表面。用高达32nm的浓度监测装载sirna的vlp的结合。信号模式和稳定性表现出指数行为,支持强烈的亲合力效应。b)具有高和低装载密度的neutravidin::lstc-生物素基质-表面。用高达98nm的浓度监测装载sirna的vlp的结合。信号模式和稳定性再次表现出指数行为,支持强烈的亲合力效应。
图4:对人细胞系进行5ht2r(血清素受体)表达分析,以研究相关人细胞系上的ht2r亚型(a、b或c)的表达。
条形图显示了使用细胞系(hela、sw480和skbr3)获得的qrt-pcr分析结果,并描绘了5-ht2血清素受体同种型a、b和c的相对表达以及her2/neu的相对表达。
图5:skbr3细胞的转导。
a)用装载cag-gfp表达盒的天然vlp(在左侧描述为“无重新靶向”或“未重新靶向”)转导后,以及用装载cag-gfp表达盒的重新靶向的vlp转导后,skbr3的gfp表达的相差和uv照片。用nhs-peg6-马来酰亚胺进行her2/neuscfv的交联,her2/neu-链霉抗生物素蛋白scfv通过lstc-生物素结合到vlp上(比例尺:200μm,暴露时间1秒)。b)skbr3的facs分析显示通过使用未重新靶向的vlp和重新靶向的vlp的不同的gfp阳性群体百分比(无重新靶向:50%,nhs-peg6-马来酰亚胺:55%,lstc-生物素:55%)。
图6:sw480细胞的转导。
a)用装载cag-gfp表达盒的天然vlp(在左侧描述为“无重新靶向”或“未重新靶向”)转导后,以及用装载cag-gfp表达盒的重新靶向的vlp转导后,sw480的gfp表达的相差和uv照片。用nhs-peg6-马来酰亚胺进行her2/neuscfv的交联,her2/neu-链霉抗生物素蛋白scfv通过lstc-生物素结合到vlp上(比例尺:200μm,暴露时间1秒)。b)sw480的facs分析显示通过使用未重新靶向的vlp和重新靶向的vlp的不同的gfp阳性群体百分比(无重新靶向:20%,nhs-peg6-马来酰亚胺:55%,lstc-生物素:65%)。
以下实施例说明了本发明:
实施例1:材料和方法
gfp表达盒生成
从paav-cag-gfp质粒(addgene#28014)扩增cag-gfp表达构建体(正向5′-3′gatcgtaccattgacgtcaataatg(seqidno:19),反向5′-3′tctccccctgaacctgaaac(seqidno:20))。通过ta克隆将扩增子转移到
vlp产生和装载
如其他地方所述产生jc多瘤病毒样颗粒[57]。为了转导,将所需量的vlp在解组装缓冲剂(10mmhepes[ph7.4],含有150mmnacl和各15mmegta和dtt)中在室温(rt)孵育30分钟。加入每25μg的vlp,共500ng线性化的gfp表达构建体,并在室温再孵育30分钟。通过在4℃不断搅拌用5l重新组装缓冲剂(10mmhepes[ph7.4],含有150mmnacl和1mmcacl2)透析过夜来重新组装vlp。
scfv产生和交联
基于其他地方公布的序列[58、59],从geneart订购her2/neuscfv的dna作为在巴斯德毕赤氏酵母中表达的密码子优化构建体,并且以xbai/xhoi扩增子转移到ppiczαa-载体(invitrogen)。通过重叠延伸pcr将链霉抗生物素蛋白从ptsa-c质粒(addgene#17329)融合至scfv的c-末端。将线性化的质粒转化到人源化的巴斯德毕赤氏酵母superman5菌株(his+)中并在标准条件下生长。简而言之,构建体的表达在bmmh全培养基中、在28℃和160rpm进行,且每24小时补料甲醇至终浓度为1%。3天后,通过离心(30分钟,10000×g,rt)收获上清液,并通过0.45μm过滤器过滤。通过固定化金属离子亲和层析(imac)从上清液中富集her2/neuscfv和her2/neu-链霉抗生物素蛋白scfv。将含scfv的洗脱液级分在4℃、在不断搅拌下用重新组装缓冲剂透析过夜,随后通过使用vivaspin柱(mwco5kda)在4℃浓缩至所需浓度0.5-1mg/ml。
为了与her2/neuscfv交联,将所需量的her2/neuscfv在室温与dtt一起孵育1小时至终浓度为5mm以还原其n-末端半胱氨酸用于交联。通过凝胶过滤(pd10脱盐柱)除去过量的dtt,并通过vivaspin柱(mwco5kda)浓缩her2/neuscfv。
根据制造商的方案,将所需量的装载cag-gfp的vlp与nhs-peg6-马来酰亚胺(invitrogen,dreieich,germany)一起孵育。在室温孵育1小时后,通过凝胶过滤(用重新组装缓冲剂平衡的pd10脱盐柱)除去剩余的nhs-peg6-马来酰亚胺,并通过使用vivaspin柱(mwco30kda)浓缩包被的vlp。
然后将包被的vlp与还原的her2/neuscfv以1:5的最终比率(10μgvlp/50μgscfv)在室温孵育1小时,然后将它们用于转导。
对于通过本发明的方法交联her2/neu-链霉抗生物素蛋白,将300μgher2/neuscfv(0.5mg/ml)在室温与乳糖四糖c(lstc)-生物素一起孵育1小时,最终浓度为160μm。通过凝胶过滤(pd10脱盐柱)除去过量的lstc-生物素,并通过vivaspin柱(mwco5kda)浓缩lstc-生物素缀合的her2/neu-链霉抗生物素蛋白scfv。将vlp与该lstc-生物素缀合的her2/neu-链霉抗生物素蛋白scfv以最终比率1:2(10μgvlp/20μgscfv)在室温孵育1小时,然后将它们用于转导。
转导实验
对于vlp转导实验,将细胞系skbr3和sw480接种在含有fcs(10%)和pen/strep(1%)的dmem培养基的24孔板中,密度为25000个细胞/孔,在标准培养条件下生长过夜。在转导之前,将培养基更换为含有pen/strep(1%)的不含fcs的dmem。每孔加入包装有500ngcag-gfp表达盒的25μgwt、nhs-peg6-马来酰亚胺her2/neuscfv、或lstc-生物素her2/neu-链霉抗生物素蛋白scfv包被的vlp,并孵育24小时。然后,除去培养基并加入含有fcs的dmem,将细胞再孵育48小时。转导后3天,通过显微镜和facs分析细胞的gfp表达。
定量pcr分析
根据制造方案(trizol,thermofisherscientific,walthamma,usa)通过苯酚/氯仿提取来分离总rna。通过协同系统(biotek,winooskivt,usa)测量rna,使用sensifastcdnasynthesiskit(bioline,london,uk)逆转录1000ng总rna,并将1μl获得的cdna用于abisteponeplus系统(appliedbiosystems,walthamma,usa)的定量分析。5-ht2a、5-ht2b和5-ht2c的相对表达使用β2m作为管家基因通过δδctt方法计算。对5-ht2a同种型的分析,使用hela细胞进行归一化,因为该亚型在skbr3-和sw480细胞的表达低。
流式细胞术
将细胞用胰蛋白酶消化并在4℃用含2%pfa的pbs固定20分钟。使用bdlsrii仪器(bdbiosciences)进行流式细胞术,使用488nm激光、用gfp的过滤器(505lp-bp530/30)。使用流式软件、流式corebioconductor包和graphpad软件(graphpadprismversion7.00forwindows,graphpadsoftware,lajolla,ca,usa)进行数据分析。对于直方图,从流式软件中提取门控和分级数据,通过%max(箱值/来自所有分级数据的最大值)归一化并使用graphpad绘制。
实施例2:重新靶向vlp
如别处所述,将人jc多瘤病毒的重组表达vp1纯化至均一。纯化后,将vlp进行体外dna包装过程。已知vlp在还原剂和螯合剂(dtt和egta)存在下解离成较小的单体和寡聚体(图1)。可以在cacl2存在下将这些级分重新组装成功能性vlp,同时通过透析移除添加的dtt和egta。在此过程中,可以添加货物分子如核酸,从而产生装载的vlp。在本实验中,使用装载有cag-gfp表达盒的vlp。
为了改变vlp的向性,采用本发明的重新靶向方法,其基于vlp结合lstc的能力。通过lstc与生物素的融合,可以将scfv-链霉抗生物素蛋白融合构建体附着到vlp上。
在对比实验中,scfv共价连接到颗粒表面上。对于该方法,使用位于vlp外表面的弹性环中的两个赖氨酸残基(k60和k164)。此外,scfv携带c-末端半胱氨酸,其能够使用在每个末端具有两个不同官能团的多接头(sm-peg6-马来酰亚胺)以将赖氨酸残基与scfv连接。
然后将这样重新靶向的vlp用于转导her2/neu阳性哺乳动物乳腺癌和结肠直肠癌细胞系(skbr3和sw480)。
实施例3:5-ht2血清素受体表达和her2/neu表达的分析
因为未包被的vlp需要5-ht2血清素受体来转导细胞,所以最初分析了本文所用细胞skbr3和sw480中三种5-ht2同种型a、b和c的表达(图4)。hela细胞用作5-ht2a同种型的对照,因为skbr3和sw480仅显示该同种型的低表达(hela的五分之一至十分之一)。与hela细胞相比,5-ht2b同种型在skbr3细胞中显示出数百倍的过表达。因此,选择skbr3将所述数据归一化。hela、sw480和raji细胞中5-ht2b同种型的表达率的相应归一化导致相对值接近背景水平。使用5-ht2c同种型获得相同的结果。
对sw480和skbr3细胞中her2/neu表达的分析另外证实了该受体存在于本文所用的细胞上。skbr3和sw480均显示受体的高表达,而skbr3显示出高两倍的表达率。
实施例4:用vlp转导her2/neu阳性细胞系skbr3和sw480
使用没有重新靶向(即“未重新靶向的vlp”)但装载cag-gfp表达盒的vlp,可以转导skbr3和sw480细胞(图5、6,左图)。facs分析支持该结果,同时揭示测试细胞系的不同gfp阳性细胞值(skbr3:50%,sw48020%)。
为了更有效地转导her2/neu阳性细胞系,改变了jcv衍生的vlp的血清素向性。使用如实施例2中所述重新靶向的vlp,同时采用两种重新靶向方法,可以用所用的cag-gfp表达盒转导sw480和skbr3细胞(图5、6,中间图和右图)。通过facs分析支持这些发现(nhs-peg6-马来酰亚胺:skbr3:55%,sw480:55%;lstc-生物素:skbr3:55%,sw480:65%)。
由于skbr3细胞不仅表达her2/neu,而且还表达天然jcv受体,所以jcv的未重新靶向的vlp和重新靶向的vlp都可以转导这些细胞。然而,sw480细胞仅表达her2/neu,因此,在上述实验中观察到转导效率的显著提高。此外,本发明的重新靶向方法不仅代表了不那么繁琐且耗时较少的重新靶向方法,而且还导致效率的进一步提高(即在sw480细胞中从20%增加至65%)。
参考文献
[1]y.p.liu,j.t.westerink,o.terbrake,b.berkhout,rnai-inducinglentiviralvectorsforanti-hiv-1genetherapy,methodsinmolecularbiology,721(2011)293-311.
[2]s.weinstein,i.a.toker,r.emmanuel,s.ramishetti,i.hazan-halevy,d.rosenblum,m.goldsmith,a.abraham,o.benjamini,o.bairey,p.raanani,a.nagler,j.lieberman,d.peer,harnessingrnai-basednanomedicinesfortherapeuticgenesilencinginb-cellmalignancies,proceedingsofthenationalacademyofsciencesoftheunitedstatesofamerica,113(2016)e16-22.
[3]j.l.gori,p.d.hsu,m.l.maeder,s.shen,g.g.welstead,d.bumcrot,deliveryandspecificityofcrispr-cas9genomeeditingtechnologiesforhumangenetherapy,humangenetherapy,26(2015)443-451.
[4]l.naldini,genetherapyreturnstocentrestage,nature,526(2015)351-360.
[5]r.sharma,x.m.anguela,y.doyon,t.wechsler,r.c.dekelver,s.sproul,d.e.paschon,j.c.miller,r.j.davidson,d.shivak,s.zhou,j.rieders,p.d.gregory,m.c.holmes,e.j.rebar,k.a.high,invivogenomeeditingofthealbuminlocusasaplatformforproteinreplacementtherapy,blood,126(2015)1777-1784.
[6]r.waehler,s.j.russell,d.t.curiel,engineeringtargetedviralvectorsforgenetherapy,naturereviews.genetics,8(2007)573-587.
[7]e.blanco,h.shen,m.ferrari,principlesofnanoparticledesignforovercomingbiologicalbarrierstodrugdelivery,naturebiotechnology,33(2015)941-951.
[8]b.assetta,m.s.maginnis,i.graciaahufinger,s.a.haley,g.v.gee,c.d.nelson,b.a.o'hara,s.a.allenramdial,w.j.atwood,5-ht2receptorsfacilitatejcpolyomavirusentry,journalofvirology,87(2013)13490-13498.
[9]g.f.elphick,w.querbes,j.a.jordan,g.v.gee,s.eash,k.manley,a.dugan,m.stanifer,a.bhatnagar,w.k.kroeze,b.l.roth,w.j.atwood,thehumanpolyomavirus,jcv,usesserotoninreceptorstoinfectcells,science,306(2004)1380-1383.
[10]u.neu,m.s.maginnis,a.s.palma,l.j.stroh,c.d.nelson,t.feizi,w.j.atwood,t.stehle,structure-functionanalysisofthehumanjcpolyomavirusestablishesthelstcpentasaccharideasafunctionalreceptormotif,cellhostµbe,8(2010)309-319.
[11]l.j.stroh,m.s.maginnis,b.s.blaum,c.d.nelson,u.neu,g.v.gee,b.a.o'hara,n.motamedi,d.dimaio,w.j.atwood,t.stehle,thegreateraffinityofjcpolyomaviruscapsidforalpha2,6-linkedlactoseriestetrasaccharidecthanforothersialylatedglycansisamajordeterminantofinfectivity,journalofvirology,89(2015)6364-6375.
[12]b.tsai,j.m.gilbert,t.stehle,w.lencer,t.l.benjamin,t.a.rapoport,gangliosidesarereceptorsformurinepolyomavirusandsv40,theembojournal,22(2003)4346-4355.
[13]u.neu,s.a.allen,b.s.blaum,y.liu,m.frank,a.s.palma,l.j.stroh,t.feizi,t.peters,w.j.atwood,t.stehle,astructure-guidedmutationinthemajorcapsidproteinretargetsbkpolyomavirus,plospathogens,9(2013)e1003688.
[14]s.eash,k.manley,m.gasparovic,w.querbes,w.j.atwood,thehumanpolyomaviruses,cellularandmolecularlifesciences:cmls,63(2006)865-876.
[15]s.gleiter,h.lilie,couplingofantibodiesviaproteinzonmodifiedpolyomavirus-likeparticles,proteinscience:apublicationoftheproteinsociety,10(2001)434-444.
[16]s.gleiter,h.lilie,cell-typespecifictargetingandgeneexpressionusingavariantofpolyomavp1virus-likeparticles,biologicalchemistry,384(2003)247-255.
[17]y.kitai,h.fukuda,t.enomoto,y.asakawa,t.suzuki,s.inouye,h.handa,cellselectivetargetingofasimianvirus40virus-likeparticleconjugatedtoepidermalgrowthfactor,journalofbiotechnology,155(2011)251-256.
[18]s.thrane,c.m.janitzek,m.o.agerbaek,s.b.ditlev,m.resende,m.a.nielsen,t.g.theander,a.salanti,a.f.sander,anovelvirus-likeparticlebasedvaccineplatformdisplayingtheplacentalmalariaantigenvar2csa,plosone,10(2015)e0143071.
[19]s.gleiter,k.stubenrauch,h.lilie,changingthesurfaceofavirusshellfusionofanenzymetopolyomavp1,proteinscience:apublicationoftheproteinsociety,8(1999)2562-2569.
[20]u.schmidt,r.rudolph,g.bohm,bindingofexternalligandsontoanengineeredviruscapsid,proteinengineering,14(2001)769-774.
[21]k.tegerstedt,a.v.franzen,k.andreasson,j.joneberg,s.heidari,t.ramqvist,t.dalianis,murinepolyomavirusvirus-likeparticles(vlps)asvectorsforgeneandimmunetherapyandvaccinesagainstviralinfectionsandcancer,anticancerresearch,25(2005)2601-2608.
[22]d.chang,c.y.fung,w.c.ou,p.c.chao,s.y.li,m.wang,y.l.huang,t.y.tzeng,r.t.tsai,self-assemblyofthejcvirusmajorcapsidprotein,vp1,expressedininsectcells,thejournalofgeneralvirology,78(pt6)(1997)1435-1439.
[23]c.goldmann,h.petry,s.frye,o.ast,s.ebitsch,k.d.jentsch,f.j.kaup,f.weber,c.trebst,t.nisslein,g.hunsmann,t.weber,w.luke,molecularcloningandexpressionofmajorstructuralproteinvp1ofthehumanpolyomavirusjcvirus:formationofvirus-likeparticlesusefulforimmunologicalandtherapeuticstudies,journalofvirology,73(1999)4465-4469.
[24]m.a.kawano,t.inoue,h.tsukamoto,t.takaya,t.enomoto,r.u.takahashi,n.yokoyama,n.yamamoto,a.nakanishi,t.imai,t.wada,k.kataoka,h.handa,thevp2/vp3minorcapsidproteinofsimianvirus40promotestheinvitroassemblyofthemajorcapsidproteinvp1intoparticles,thejournalofbiologicalchemistry,281(2006)10164-10173.
[25]l.gorelik,c.reid,m.testa,m.brickelmaier,s.bossolasco,a.pazzi,a.bestetti,p.carmillo,e.wilson,m.mcauliffe,c.tonkin,j.p.carulli,a.lugovskoy,a.lazzarin,s.sunyaev,k.simon,p.cinque,progressivemultifocalleukoencephalopathy(pml)developmentisassociatedwithmutationsinjcviruscapsidproteinvp1thatchangeitsreceptorspecificity,thejournalofinfectiousdiseases,204(2011)103-114.
[26]r.komagome,h.sawa,t.suzuki,y.suzuki,s.tanaka,w.j.atwood,k.nagashima,oligosaccharidesasreceptorsforjcvirus,journalofvirology,76(2002)12992-13000.
[27]a.ashok,w.j.atwood,virusreceptorsandtropism,advancesinexperimentalmedicineandbiology,577(2006)60-72.
[28]m.ahmad,m.hirz,h.pichler,h.schwab,proteinexpressioninpichiapastoris:recentachievementsandperspectivesforheterologousproteinproduction,appliedmicrobiologyandbiotechnology,98(2014)5301-5317.
[29]c.l.young,z.t.britton,a.s.robinson,recombinantproteinexpressionandpurification:acomprehensivereviewofaffinitytagsandmicrobialapplications,biotechnologyjournal,7(2012)620-634.
[30]s.maschauer,j.einsiedel,r.haubner,c.hocke,m.ocker,h.hubner,t.kuwert,p.gmeiner,o.prante,labelingandglycosylationofpeptidesusingclickchemistry:ageneralapproachto(18)f-glycopeptidesaseffectiveimagingprobesforpositronemissiontomography,angewandtechemie,49(2010)976-979.
[31]s.s.shekhawat,i.ghosh,split-proteinsystems:beyondbinaryprotein-proteininteractions,currentopinioninchemicalbiology,15(2011)789-797.
[32]d.russell,n.j.oldham,b.g.davis,site-selectivechemicalproteinglycosylationprotectsfromautolysisandproteolyticdegradation,carbohydrateresearch,344(2009)1508-1514.
[33]a.dondoni,a.massi,p.nanni,a.roda,anewligationstrategyforpeptideandproteinglycosylation:photoinducedthiol-enecoupling,chemistry,15(2009)11444-11449.
[34]d.crich,mechanismofachemicalglycosylationreaction,accountsofchemicalresearch,43(2010)1144-1153.
[35]l.bohe,d.crich,aproposofglycosylcationsandthemechanismofchemicalglycosylation;thecurrentstateoftheart,carbohydrateresearch,403(2015)48-59.
[36]z.l.wu,x.huang,a.j.burton,k.a.swift,glycoproteinlabelingwithclickchemistry(glcc)andcarbohydratedetection,carbohydrateresearch,412(2015)1-6.
[37]w.j.lin,w.y.hsu,pegylationeffectofchitosanbasedpolyplexondnatransfection,carbohydratepolymers,120(2015)7-14.
[38]s.n.wang,y.h.deng,h.xu,h.b.wu,y.k.qiu,d.w.chen,synthesisofanovelgalactosylatedlipidanditsapplicationtothehepatocyte-selectivetargetingofliposomaldoxorubicin,europeanjournalofpharmaceuticsandbiopharmaceutics:officialjournalofarbeitsgemeinschaftfurpharmazeutischeverfahrenstechnike.v,62(2006)32-38.
[39]h.zhang,y.xiao,s.cui,y.zhou,k.zeng,m.yan,c.zhao,novelgalactosylatedpoly(ethyleneglycol)-cholesterolforliposomesasadrugcarrierforhepatocyte-targeting,journalofnanoscienceandnanotechnology,15(2015)4058-4069.
[40]a.pagani,m.vieillevoye,a.nai,m.rausa,m.ladli,c.lacombe,p.mayeux,f.verdier,c.camaschella,l.silvestri,regulationofcellsurfacetransferrinreceptor-2byiron-dependentcleavageandreleaseofasolubleform,haematologica,100(2015)458-465.
[41]b.frolund,b.ebert,u.kristiansen,t.liljefors,p.krogsgaard-larsen,gaba(a)receptorligandsandtheirtherapeuticpotentials,currenttopicsinmedicinalchemistry,2(2002)817-832.
[42]x.y.chen,g.q.ru,y.y.ma,j.xie,w.y.chen,h.j.wang,s.b.wang,l.li,k.t.jin,x.l.he,x.z.mou,highexpressionofsubstancepanditsreceptorneurokinin-1receptorincolorectalcancerisassociatedwithtumorprogressionandprognosis,oncotargetsandtherapy,9(2016)3595-3602.
[43]s.s.rizk,a.misiura,m.paduch,a.a.kossiakoff,substancepderivativesasversatiletoolsforspecificdeliveryofvarioustypesofbiomolecularcargo,bioconjugatechemistry,23(2012)42-46.[44]j.f.peppin,r.b.raffa,deltaopioidagonists:aconciseupdateonpotentialtherapeuticapplications,journalofclinicalpharmacyandtherapeutics,40(2015)155-166.
[45]i.s.zagon,y.wu,p.j.mclaughlin,opioidgrowthfactorandorgandevelopmentinratandhumanembryos,brainresearch,839(1999)313-322.
[46]p.j.mclaughlin,i.s.zagon,j.skitzki,humanneuroblastomacellgrowthintissuecultureisregulatedbyopioidgrowthfactor,internationaljournalofoncology,14(1999)373-380.
[47]s.w.jones,r.christison,k.bundell,c.j.voyce,s.m.brockbank,p.newham,m.a.lindsay,characterisationofcell-penetratingpeptide-mediatedpeptidedelivery,britishjournalofpharmacology,145(2005)1093-1102.
[48]c.m.dundas,d.demonte,s.park,streptavidin-biotintechnology:improvementsandinnovationsinchemicalandbiologicalapplications,appliedmicrobiologyandbiotechnology,97(2013)9343-9353.
[49]e.a.teunissen,m.deraad,e.mastrobattista,productionandbiomedicalapplicationsofvirus-likeparticlesderivedfrompolyomaviruses,journalofcontrolledrelease:officialjournalofthecontrolledreleasesociety,172(2013)305-321.
[50]a.abbing,u.k.blaschke,s.grein,m.kretschmar,c.m.stark,m.j.thies,j.walter,m.weigand,d.c.woith,j.hess,c.o.reiser,efficientintracellulardeliveryofaproteinandalowmolecularweightsubstanceviarecombinantpolyomavirus-likeparticles,thejournalofbiologicalchemistry,279(2004)27410-27421.
[51]l.chen,d.b.flies,molecularmechanismsoftcellco-stimulationandco-inhibition,naturereviews.immunology,13(2013)227-242.
[52]p.b.davis,m.j.cooper,vectorsforairwaygenedelivery,theaapsjournal,9(2007)e11-17.
[53]s.li,z.ma,nonviralgenetherapy,currentgenetherapy,1(2001)201-226.
[54]h.yin,r.l.kanasty,a.a.eltoukhy,a.j.vegas,j.r.dorkin,d.g.anderson,non-viralvectorsforgene-basedtherapy,naturereviews.genetics,15(2014)541-555.
[55]d.fioretti,s.iurescia,v.m.fazio,m.rinaldi,dnavaccines:developingnewstrategiesagainstcancer,journalofbiomedicine&biotechnology,2010(2010)174378.
[56]b.volz,m.schmidt,k.heinrich,k.kapp,m.schroff,b.wittig,designandcharacterizationofthetumorvaccinemgn1601,allogeneicfourfoldgene-modifiedvaccinecellscombinedwithatlr-9agonist,moleculartherapyoncolytics,3(2016)15023.
[57]d.b.hoffmann,k.o.boker,s.schneider,e.eckermann-felkl,a.schuder,m.komrakova,s.sehmisch,j.gruber,invivosirnadeliveryusingjcvirus-likeparticlesdecreasestheexpressionofranklinrats,moleculartherapy.nucleicacids,5(2016)e298.
[58]x.li,p.stuckert,i.bosch,j.d.marks,w.a.marasco,single-chainantibody-mediatedgenedeliveryintoerbb2-positivehumanbreastcancercells,cancergenetherapy,8(2001)555-565.
[59]e.song,p.zhu,s.k.lee,d.chowdhury,s.kussman,d.m.dykxhoorn,y.feng,d.palliser,d.b.weiner,p.shankar,w.a.marasco,j.lieberman,antibodymediatedinvivodeliveryofsmallinterferingrnasviacell-surfacereceptors,naturebiotechnology,23(2005)709-717.
[60]f.nau,jr.,b.yu,d.martin,c.d.nichols,serotonin5-ht2areceptoractivationblockstnf-alphamediatedinflammationinvivo,plosone,8(2013)e75426.
[61]a.millson,a.suli,l.hartung,s.kunitake,a.bennett,m.c.nordberg,w.hanna,c.t.wittwer,a.seth,e.lyon,comparisonoftwoquantitativepolymerasechainreactionmethodsfordetectingher2/neuamplification,thejournalofmoleculardiagnostics:jmd,5(2003)184-190.
- 还没有人留言评论。精彩留言会获得点赞!