无预先免疫步骤的HIV免疫疗法的制作方法
相关申请的交叉引用
本申请要求2017年1月9日提交的名为“无预先免疫步骤的hiv免疫疗法(hivimmunotherapywithnopre-immunizationstep)”的美国专利申请号62/444,147的优先权,其公开内容通过引用纳入本文。
本发明一般涉及用于治疗和预防hiv的免疫疗法领域。具体地,所公开的治疗和预防方法涉及给予病毒载体和系统,用于在无预先免疫步骤的情况下递送基因,和其他治疗、诊断或研究用途。
背景技术:
联合抗逆转录病毒疗法(cart)(也称之为高活性抗逆转录病毒疗法或haart)限制了hiv-1复制并阻碍疾病进展,但是药物毒性和抗药性病毒的出现对于hiv感染者的长期控制而言是挑战。此外,传统的抗逆转录病毒疗法虽然成功地延迟了aids的发作或死亡,但是尚未实现功能性治愈(functionalcure)。需要其他的治疗策略。
表明免疫系统在限制hiv复制中具有主要(尽管通常是不足的)作用的数据促成了对hiv感染免疫疗法的浓厚兴趣。对于维持细胞溶解性t细胞(ctl)功能至关重要的病毒特异性t辅助细胞有可能起一定作用。病毒血症还受到中和抗体的影响,但它们在hiv感染中的量级通常较低,并且跟不上体内进化的病毒变体。
这些数据一起表明,通过所谓的hiv免疫疗法,增加hiv特异性细胞免疫应答的强度和广度可能具有临床益处。一些研究已经测试了针对hiv的疫苗,但迄今为止,成功是有限的。此外,人们一直有兴趣通过利用基因治疗技术来增强hiv免疫疗法,但与其他免疫治疗方法一样,成功受到限制。
由于特定的病毒包膜-宿主细胞受体相互作用和基因表达的病毒机制,病毒载体可用于将基因转导到靶细胞中。因此,病毒载体已被用作将基因转移到许多不同细胞类型中的载剂,所述细胞类型包括全t细胞或其他免疫细胞,以及胚胎、受精卵、分离的组织样品、原位组织靶标和培养的细胞。将外来或改变的基因导入细胞的能力能够用于治疗性干预,诸如基因治疗,诱导型多能干细胞的体细胞重编程和各种类型的免疫疗法。
基因疗法是生物医学研究最成熟的领域之一,有潜力产生可能涉及病毒载体使用的新治疗剂。鉴于能够用于治疗的潜在基因种类繁多,递送这些基因的有效方式需要实现基因治疗作为治疗感染性和非感染性疾病的手段的愿景。包括鼠逆转录病毒、腺病毒、细小病毒(腺相关病毒)、牛痘病毒和疱疹病毒的一些病毒系统已被开发作为治疗性基因传递载体。
开发病毒载体时必须要考虑许多因素,包括组织趋向性,病毒制剂稳定性、表达稳定性与控制,基因组包装能力和构建体依赖性载体稳定性。另外,病毒载体的体内应用常常受到针对病毒结构蛋白和/或转导的基因产物的宿主免疫应答的限制。
因此,对于待用于体内治疗对象的病毒载体,毒性和安全性是必需克服的主要障碍。有大量人类基因治疗应用的历史实例已经遇到与针对基因递送载剂或治疗性基因产物的宿主免疫应答相关的问题。将数个病毒基因和一个或多个治疗性基因共同转导的病毒载体(例如,腺病毒)尤其存在问题。
虽然慢病毒载体通常不诱导细胞毒性并且不引起强烈的宿主免疫应答,但携带数种免疫刺激基因产物的一些慢病毒载体如hiv-1有可能导致细胞毒性并诱导强烈的体内免疫应答。然而,对于在转导后不编码多个病毒基因的源自慢病毒的转导载体,这可能并不是一个问题。当然,情况可能并非总是如此,因为有时载体的目的是编码将激发临床有用的免疫应答的蛋白质。
与慢病毒载体使用相关的另一重要问题是在暴露于一些细胞毒性病毒蛋白质时可能具有细胞病原性。暴露于某些hiv-1蛋白可能引起t细胞中的细胞死亡或功能性无反应。同样,通过重组生成能够复制的剧毒性病毒的可能性也常常是一个问题。因此,需要改善hiv治疗。
发明概述
在本公开的一个方面,公开了治疗对象hiv感染的方法。该方法包括从所述对象移出白细胞并纯化外周血单核细胞(pbmc)。该方法进一步包括使pbmc与治疗有效量的刺激剂离体接触;使用编码至少一种遗传元件的病毒递送系统离体转导pbmc;和培养转导的pbmc至少1天。可以培养转导的pbmc约1天至约35天。该方法还涉及将转导的pbmc输注到对象中。对象可以是人。刺激剂可以包括肽或肽的混合物。在优选的实施方式中,刺激剂包括gag肽。刺激剂可以包括疫苗。疫苗可以是hiv疫苗,并且在优选的实施方式中,hiv疫苗是mva/hiv62b疫苗或其变体。在优选的实施方式中,病毒递送系统包括慢病毒颗粒。在一实施方式中,至少一种遗传元件可包括能够抑制趋化因子受体ccr5产生的小rna或能够靶向hivrna序列的至少一种小rna。在另一实施方式中,至少一种遗传元件可包括能够抑制趋化因子受体ccr5产生的小rna和能够靶向hivrna序列的至少一种小rna。hivrna序列可以包括hivvif序列、hivtat序列或其变体。至少一种遗传元件可以包括微小rna或shrna。在优选实施方式中,至少一种遗传元件包括微小rna簇。
在另一方面,至少一种遗传元件包括与
aggtatattgctgttgacagtgagcgactgtaaactgagcttgctctactgtgaagccacagatgggtagagcaagcacagtttaccgctgcctactgcctcggacttcaaggggctt(seqidno:1)具有至少80%,或至少85%,或至少90%或至少95%百分比相同性的微小rna。在优选实施方式中,至少一种遗传元件包括
aggtatattgctgttgacagtgagcgactgtaaactgagcttgctctactgtgaagccacagatgggtagagcaagcacagtttaccgctgcctactgcctcggacttcaaggggctt(seqidno:1)。
在另一方面,至少一种遗传元件包括微小rna,其与
catctccatggctgtaccaccttgtcgggggatgtgtacttctgaacttgtgttgaatctcatggagttcagaagaacacatccgcactgacattttggtatctttcatctgacca(seqidno:2)具有至少至少80%,或至少85%,或至少90%或至少95%百分比相同性;或与
gggcctggctcgagcagggggcgagggattccgcttcttcctgccatagcgtggtcccctcccctatggcaggcagaagcggcaccttccctcccaatgaccgcgtcttcgtcg(seqidno:3)具有至少至少80%,或至少85%,或至少90%或至少95%百分比相同性。在优选实施方式中,至少一种遗传元件包括
catctccatggctgtaccaccttgtcgggggatgtgtacttctgaacttgtgttgaatctcatggagttcagaagaacacatccgcactgacattttggtatctttcatctgacca(seqidno:2);或
gggcctggctcgagcagggggcgagggattccgcttcttcctgccatagcgtggtcccctcccctatggcaggcagaagcggcaccttccctcccaatgaccgcgtcttcgtcg(seqidno:3)。
在另一方面,微小rna簇包括与
aggtatattgctgttgacagtgagcgactgtaaactgagcttgctctactgtgaagccacagatgggtagagcaagcacagtttaccgctgcctactgcctcggacttcaaggggcttcccgggcatctccatggctgtaccaccttgtcgggggatgtgtacttctgaacttgtgttgaatctcatggagttcagaagaacacatccgcactgacattttggtatctttcatctgaccagctagcgggcctggctcgagcagggggcgagggattccgcttcttcctgccatagcgtggtcccctcccctatggcaggcagaagcggcaccttccctcccaatgaccgcgtcttcgtc(seqidno:31)具有至少80%、或至少85%、或至少90%或至少95%百分比相同性的序列。在优选实施方式中,微小rna簇包括aggtatattgctgttgacagtgagcgactgtaaactgagcttgctctactgtgaagccacagatgggtagagcaagcacagtttaccgctgcctactgcctcggacttcaaggggcttcccgggcatctccatggctgtaccaccttgtcgggggatgtgtacttctgaacttgtgttgaatctcatggagttcagaagaacacatccgcactgacattttggtatctttcatctgaccagctagcgggcctggctcgagcagggggcgagggattccgcttcttcctgccatagcgtggtcccctcccctatggcaggcagaagcggcaccttccctcccaatgaccgcgtcttcgtc(seqidno:31)。
在另一方面,提供了处理感染hiv的细胞的方法。该方法包括使分离自感染hiv的对象的外周血单核细胞(pbmc)与治疗有效量的刺激剂接触,其中所述接触离体进行;使用编码至少一种遗传元件的病毒递送系统离体转导pbmc;和培养转导的pbmc至少1天。可以培养转导的pbmc约1天至约35天。该方法还涉及将转导的pbmc输注到对象中。对象可以是人。刺激剂可以包括肽或肽的混合物,并且在优选的实施方式中包括gag肽。刺激剂可以包括疫苗。疫苗可以是hiv疫苗,并且在优选的实施方式中,hiv疫苗是mva/hiv62b疫苗或其变体。在优选的实施方式中,病毒递送系统包括慢病毒颗粒。在一实施方式中,至少一种遗传元件可包括能够抑制趋化因子受体ccr5产生的小rna或能够靶向hivrna序列的至少一种小rna。在另一实施方式中,至少一种遗传元件可包括能够抑制趋化因子受体ccr5产生的小rna和能够靶向hivrna序列的至少一种小rna。hivrna序列可以包括hivvif序列、hivtat序列或其变体。至少一种遗传元件可以包括微小rna或shrna。在优选实施方式中,至少一种遗传元件包括微小rna簇。
在另一方面,至少一种遗传元件包括与
aggtatattgctgttgacagtgagcgactgtaaactgagcttgctctactgtgaagccacagatgggtagagcaagcacagtttaccgctgcctactgcctcggacttcaaggggctt(seqidno:1)具有至少80%,或至少85%,或至少90%或至少95%百分比相同性的微小rna。在优选实施方式中,至少一种遗传元件包括
aggtatattgctgttgacagtgagcgactgtaaactgagcttgctctactgtgaagccacagatgggtagagcaagcacagtttaccgctgcctactgcctcggacttcaaggggctt(seqidno:1)。
在另一方面,至少一种遗传元件包括微小rna,其与
catctccatggctgtaccaccttgtcgggggatgtgtacttctgaacttgtgttgaatctcatggagttcagaagaacacatccgcactgacattttggtatctttcatctgacca(seqidno:2)具有至少至少80%,或至少85%,或至少90%或至少95%百分比相同性;或与
gggcctggctcgagcagggggcgagggattccgcttcttcctgccatagcgtggtcccctcccctatggcaggcagaagcggcaccttccctcccaatgaccgcgtcttcgtcg(seqidno:3)具有至少至少80%,或至少85%,或至少90%或至少95%百分比相同性。在优选实施方式中,至少一种遗传元件包括
catctccatggctgtaccaccttgtcgggggatgtgtacttctgaacttgtgttgaatctcatggagttcagaagaacacatccgcactgacattttggtatctttcatctgacca(seqidno:2);或
gggcctggctcgagcagggggcgagggattccgcttcttcctgccatagcgtggtcccctcccctatggcaggcagaagcggcaccttccctcccaatgaccgcgtcttcgtcg(seqidno:3)。
在另一方面,微小rna簇包括与
aggtatattgctgttgacagtgagcgactgtaaactgagcttgctctactgtgaagccacagatgggtagagcaagcacagtttaccgctgcctactgcctcggacttcaaggggcttcccgggcatctccatggctgtaccaccttgtcgggggatgtgtacttctgaacttgtgttgaatctcatggagttcagaagaacacatccgcactgacattttggtatctttcatctgaccagctagcgggcctggctcgagcagggggcgagggattccgcttcttcctgccatagcgtggtcccctcccctatggcaggcagaagcggcaccttccctcccaatgaccgcgtcttcgtc(seqidno:31)具有至少80%、或至少85%、或至少90%或至少95%百分比相同性的序列。在优选实施方式中,微小rna簇包括aggtatattgctgttgacagtgagcgactgtaaactgagcttgctctactgtgaagccacagatgggtagagcaagcacagtttaccgctgcctactgcctcggacttcaaggggcttcccgggcatctccatggctgtaccaccttgtcgggggatgtgtacttctgaacttgtgttgaatctcatggagttcagaagaacacatccgcactgacattttggtatctttcatctgaccagctagcgggcctggctcgagcagggggcgagggattccgcttcttcctgccatagcgtggtcccctcccctatggcaggcagaagcggcaccttccctcccaatgaccgcgtcttcgtc(seqidno:31)。
在另一方面,公开了慢病毒载体。慢病毒载体包括至少一种编码的遗传元件,其中该至少一种编码的遗传元件包括能够抑制趋化因子受体ccr5产生的小rna或能够靶向hivrna序列的至少一种小rna。在另一方面中,至少一种编码的遗传元件包括能够抑制趋化因子受体ccr5产生的小rna和能够靶向hivrna序列的至少一种小rna。hivrna序列可以包括hivvif序列、hivtat序列或其变体。至少一种编码的遗传元件可以包括微小rna或shrna。至少一种编码的遗传元件可以包括微小rna簇。
在另一方面,至少一种遗传元件包括与
aggtatattgctgttgacagtgagcgactgtaaactgagcttgctctactgtgaagccacagatgggtagagcaagcacagtttaccgctgcctactgcctcggacttcaaggggctt(seqidno:1)具有至少80%,或至少85%,或至少90%或至少95%百分比相同性的微小rna。在优选实施方式中,至少一种遗传元件包括
aggtatattgctgttgacagtgagcgactgtaaactgagcttgctctactgtgaagccacagatgggtagagcaagcacagtttaccgctgcctactgcctcggacttcaaggggctt(seqidno:1)。
在另一方面,至少一种遗传元件包括微小rna,其与
catctccatggctgtaccaccttgtcgggggatgtgtacttctgaacttgtgttgaatctcatggagttcagaagaacacatccgcactgacattttggtatctttcatctgacca(seqidno:2)具有至少至少80%,或至少85%,或至少90%或至少95%百分比相同性;或与
gggcctggctcgagcagggggcgagggattccgcttcttcctgccatagcgtggtcccctcccctatggcaggcagaagcggcaccttccctcccaatgaccgcgtcttcgtcg(seqidno:3)具有至少至少80%,或至少85%,或至少90%或至少95%百分比相同性。在优选实施方式中,至少一种遗传元件包括
catctccatggctgtaccaccttgtcgggggatgtgtacttctgaacttgtgttgaatctcatggagttcagaagaacacatccgcactgacattttggtatctttcatctgacca(seqidno:2);或
gggcctggctcgagcagggggcgagggattccgcttcttcctgccatagcgtggtcccctcccctatggcaggcagaagcggcaccttccctcccaatgaccgcgtcttcgtcg(seqidno:3)。
在另一方面,微小rna簇包括与
aggtatattgctgttgacagtgagcgactgtaaactgagcttgctctactgtgaagccacagatgggtagagcaagcacagtttaccgctgcctactgcctcggacttcaaggggcttcccgggcatctccatggctgtaccaccttgtcgggggatgtgtacttctgaacttgtgttgaatctcatggagttcagaagaacacatccgcactgacattttggtatctttcatctgaccagctagcgggcctggctcgagcagggggcgagggattccgcttcttcctgccatagcgtggtcccctcccctatggcaggcagaagcggcaccttccctcccaatgaccgcgtcttcgtc(seqidno:31)具有至少80%、或至少85%、或至少90%或至少95%百分比相同性的序列。在优选实施方式中,微小rna簇包括aggtatattgctgttgacagtgagcgactgtaaactgagcttgctctactgtgaagccacagatgggtagagcaagcacagtttaccgctgcctactgcctcggacttcaaggggcttcccgggcatctccatggctgtaccaccttgtcgggggatgtgtacttctgaacttgtgttgaatctcatggagttcagaagaacacatccgcactgacattttggtatctttcatctgaccagctagcgggcctggctcgagcagggggcgagggattccgcttcttcctgccatagcgtggtcccctcccctatggcaggcagaagcggcaccttccctcccaatgaccgcgtcttcgtc(seqidno:31)。
另一方面,公开了用于表达慢病毒颗粒的慢病毒载体系统。该系统包括如本文所述的慢病毒载体;用于表达经优化用于感染细胞的包膜蛋白的包膜质粒;和用于表达gag,pol和rev基因的至少一种辅助质粒,其中当慢病毒载体、包膜质粒和至少一种辅助质粒被转染到包装细胞系中时,慢病毒颗粒由包装细胞系产生,其中慢病毒颗粒能够抑制趋化因子受体ccr5的产生或能靶向hivrna序列。该系统可以还包括用于表达gag和pol基因的第一辅助质粒,和用于表达rev基因的第二辅助质粒。
在另一方面中,公开了能够感染细胞的慢病毒颗粒。慢病毒颗粒包括经优化用于感染细胞的包膜蛋白和如本文所述的慢病毒载体。包膜蛋白可以经优化用于感染t细胞。在优选的实施方式中,包膜蛋白经优化用于感染cd4+t细胞。
在另一方面中,公开了修饰细胞。修饰细胞包括cd4+t细胞,其中已经用如本文所述的慢病毒颗粒感染该cd4+t细胞。在优选的实施方式中,cd4+t细胞还识别hiv抗原。在其他优选的实施方式中,hiv抗原包括gag抗原。在其他优选实施方式中,cd4+t细胞在感染慢病毒颗粒后表达降低水平的ccr5。
在另一方面,公开了选择治疗性处理方案的对象的方法。该方法包括从该对象移出白细胞和纯化外周血单核细胞(pbmc),并确定与至少一种pbmc相关性因素(factor)相关的第一可定量测量值;使pbmc与治疗有效量的第二刺激剂离体接触,并确定与至少一种pbmc相关性因素相关的第二测量值,其中当第二可定量测量值高于第一可定量测量值时,选择该对象为该处理方案的对象。至少一种因素可以是t细胞增殖或ifnγ产量。
在另一方面中,本文所公开的方法包括从pbmc消耗(deplet)至少一个细胞亚组。该方法包括从pbmc消耗至少一个细胞亚组,其中至少一个细胞亚组包括cd8+t细胞、γδ细胞、nk细胞、b细胞、中性粒细胞、嗜碱性粒细胞、嗜酸性粒细胞、t调节性细胞、nkt细胞和红细胞的任一种或多种。在实施方式中,消耗在移出白细胞之后发生。在实施方式中,消耗在移出白细胞同时发生。
对附图和说明书的前述一般性描述和详述详细描述都是示例性的和解释性的,并且旨在提供对发明进一步解释。从以下对附图的简要描述和本发明的详述,其他目的、优点和特征对于本领域技术人员将是显而易见的。
附图说明
图1描述了特定临床疗法策略的流程图。
图2概括性地描述了使用基因疗法可以如何改变cd4+t细胞以防止其他细胞被感染和/或防止病毒复制。
图3描述了示例性的慢病毒载体系统,其包括治疗性载体、辅助质粒和包膜质粒。此处示出的治疗性载体是优选的治疗性载体,其在本文还被称为agt103,并且包括mir30ccr5-mir21vif-mir185-tat。
图4描述了环化形式的示例性3-载体慢病毒载体系统。
图5描述了环化形式的示例性4-载体慢病毒载体系统。
图6描述了示例性的载体序列。开发了启动子的正(基因组)链序列和mir簇用于抑制ccr5-热带(tropic)hiv株的传播。没有下划线的序列包括转录的ef-1α启动子,其作为针对该mir簇的最佳选择。标有下划线的序列显示了由mir30ccr5(重定向至ccr5mrna的天然人mir30的修饰)、mir21vif(重定向至vifrna序列)和mir185tat(重定向至tatrna序列)(在seqidno:33中合并显示)组成的mir簇。
图7描述了根据本公开某些方面的示例性慢病毒载体构建体。
图8显示了通过实验载体敲减ccr5预防actc120细胞中的r5-热带hiv感染。(a)显示了存在或不存在agt103慢病毒载体的情况下agtc120细胞中的ccr5表达。(b)显示了转导的agtc120细胞对由hivbal病毒储液感染的敏感性,所述hivbal病毒储液表达与hiv的nef基因融合的绿色荧光蛋白(gfp)。
图9描述了证明通过慢病毒载体中shrna抑制剂序列调节ccr5表达的数据。(a)显示了针对潜在的候选物的筛选数据。(b)显示了用ccr5shrna-1(seqidno:16)转导后的ccr5敲减数据。
图10描述了证明通过慢病毒载体中shrna抑制剂序列调节hiv组件的数据。(a)显示了针对rev/tat靶基因的敲减数据。(b)显示了针对gag靶基因的敲减数据。
图11描述了证明act103降低用本文所述hiv表达质粒转染的细胞中tat蛋白表达的数据。
图12描述了证明通过慢病毒载体中合成的微小rna序列调节hiv组件的数据。(a)显示了tat敲减数据。(b)显示了vif敲减数据。
图13描述了证明通过慢病毒载体中合成的微小rna序列调节ccr5表达的数据。
图14描述了证明通过含有长或短wpre序列的慢病毒载体中合成的微小rna序列调节ccr5表达的数据。
图15描述了证明通过具有或不具有wpre序列的慢病毒载体中合成的微小rna序列调节ccr5表达的数据。
图16描述了证明通过慢病毒载体中cd4启动子调节型合成微小rna序列调节ccr5表达的数据。
图17描述了证明hivgag特异性cd4t细胞的检测的数据。
图18描述了证明hiv特异性cd4t细胞扩增和慢病毒转导的数据。(a)显示了处理的安排。(b)显示了cd4-门选的t细胞中的ifn-γ产量,如本文所述。(c)显示了cd4-门选的t细胞中的ifn-γ产量和gfp表达,如本文所述。(d)显示了hiv-特异性cd4+t细胞的频率,如本文所述,以及重要地,疫苗接种前和后。(e)显示了疫苗接种后pbmc的ifn-γ产量,如本文所述。
图19描述了证明ccr5表达的抑制和增加agt103-gfp的剂量响应的功能性试验的数据。(a)显示了使agt103-gfp增量的剂量响应数据。(b)显示了关于ccr5表达的正常分布群。(c)显示了伴随agt103-gfp剂量增加的ccr5表达的抑制百分比。
图20描述了证明agt103有效地转导了原代人cd4+t细胞的数据。(a)通过facs显示转导细胞(gfp-阳性)的频率,如本文所述。(b)显示了每细胞载体拷贝的数量,如本文所述。
图21描述了证明agt103抑制原代cd4+t细胞中hiv复制的数据。
图22描述了证明agt103保护原代人cd4+t细胞免于hiv诱导的消耗的数据。
图23描述了证明生成了针对hiv特异性agt103转导的cd4t细胞高度富集的cd4+t细胞群的数据。(a)显示了细胞群的cd4和cd8表达概况,如本文所述。(b)显示了细胞群的cd4和cd8表达概况,如本文所述。(c)显示了细胞群的ifn-γ和cd4表达概况,如本文所述。(d)显示了细胞群的ifn-γ和gfp表达概况,如本文所述。
图24描述了cd8消耗方案的示意图。
图25描述了通过肽刺激、cd8消耗和il-7/il-15孵育的gag特异性t细胞的扩增。(a)、(b)和(c)描述了显示消耗cd8+细胞后显著改善的cd4+t细胞扩增的流式细胞术数据。除了改善的cd4+t细胞扩增,还存在(a)vδ1t细胞的过度生长和(c)nk细胞的过度生长。
图26描述了cd8/cd56/cd19/γδ消耗方案的示意图。
图27描述了通过肽刺激、cd8/γδ/nk/b细胞消耗和il-7/il-15孵育的gag特异性t细胞的扩增。(a)-(b)描述了显示cd8+、γδ或nk细胞的过度生长抑制cd4+t细胞生长或杀伤慢病毒转导的抗原特异性cd4+t细胞的流式细胞术数据。消耗cd8+、γδ或nk细胞后,cd4+t细胞扩增。
图28描述了通过肽刺激、cd8/γδ/nk/b细胞消耗和il-7/il-15孵育,gag特异性t细胞的扩增和转导。ifn-γ阳性抗原特异性cd4+t细胞相较于培养中的其他亚组产生更好的转导效率。
图29描述了转导细胞的百分比和载体拷贝数之间的关系。(a)描述了这样的图表,其中显示了随着转导细胞的百分比增加,载体拷贝数量也增加(n=4)。(b)显示了表格中所述相同样品的回归分析,其显示了转导细胞的百分比和载体拷贝数量之间的正相关性(n=4)。
发明详述
概述
本文所公开的是用于治疗和/或预防人免疫缺陷病毒(hiv)疾病以实现功能性治愈的方法和组合物。功能性治愈定义为由减少或消除对cart的需求并可能或可能不需要支持性辅助治疗的所公开的治疗和方法所导致的情况。本发明的方法包括通过整合慢病毒、非整合慢病毒和相关的病毒载体技术(如下所述)进行的基因递送。
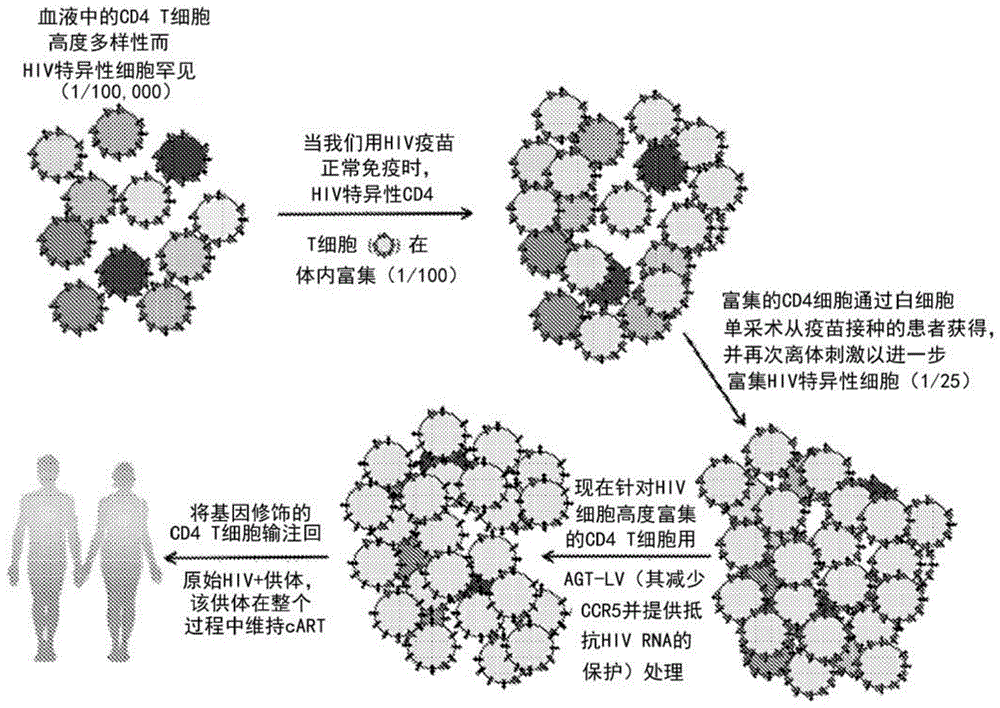
本文公开了治疗性病毒载体(例如,慢病毒载体)免疫疗法,以及其在实现对hiv感染功能性治愈的策略中的使用方法。如本文图1所述,用于治疗hiv的策略包括使用疫苗的第一治疗性免疫,旨在hiv感染患者中产生针对hiv的强免疫应答,同时稳定抑制病毒血症(因每日给予haart),目的在于富集hiv特异性cd4t细胞分数。然而,如本文所详述,该第一治疗性免疫可能并非必要。然后是(1)通过白细胞单采术分离外周白细胞并纯化静脉血的pbmc,(2)用hiv疫苗蛋白质离体再刺激cd4t细胞,(3)进行治疗性慢病毒转导,离体t细胞培养,和(4)再输注回原始供体中。
鉴于前述内容并参照本文图2,该方法可以用于防止新的细胞如cd4+t细胞被hiv感染。为了防止新的细胞被感染,可以靶向ccr5表达以防止病毒附着。此外,还可以靶向任何残留感染性病毒rna的破坏。鉴于前述内容并参照本文图2,该方法还可以用于使已经被hiv感染的细胞中的hiv病毒周期(viralcycle)停止。为了使hiv病毒周期停止,可以靶向由潜伏性感染细胞(如潜伏性感染cd4+t细胞)产生的病毒rna。
藉由提供能够抑制hiv的高效治疗性慢病毒,开发了用于实现hiv功能性治愈的新型策略。
定义和解释
除非另有说明,本方面所用的科技术语与本发明所属领域普通技术人员通常理解的含义相同。此外,除非另有说明,单数术语包括复数且复数术语包括单数。通常,本文所述的细胞和组织培养、分子生物学、免疫学、微生物学、遗传学和蛋白质和核酸化学及杂化中使用的命名和技术是本领域公知且普遍使用的。除非另有说明,本发明的方法和技术一般遵循本领域熟知的传统方法进行并如若干一般的或更特定的参考文献中所述,所述参考文献贯穿本说明书引用和讨论。参见例如:sambrookj.和russelld.《分子克隆:实验室手册》(molecularcloning:alaboratorymanual),第三版,纽约冷泉港的冷泉港实验室出版社(coldspringharborlaboratorypress,coldspringharbor,n.y.),(2000);ausubel等,《精编分子生物学方案:现行分子生物学方案的方法纲要》(shortprotocolsinmolecularbiology:acompendiumofmethodsfromcurrentprotocolsinmolecularbiology),wiley,john&sons出版公司(2002);harlow和lane,《使用抗体:实验室手册》(usingantibodies:alaboratorymanual);纽约冷泉港的冷泉港实验室出版社(1998);和coligan等,《精编蛋白质科学方案》(shortprotocolsinproteinscience),威利约翰父子出版公司(wiley,john&sons)(2003)。任何酶促反应和纯化技术根据生产商的说明书或本领域普遍使用或本文所述的方法进行。本文所述的分析化学、合成有机化学以及医学和药学化学中使用的命名以及实验室方法和技术是本领域公知且普遍使用的。
如本文所用,术语“约”将为本领域普通技术人员所理解,并且在某种程度上取决于其使用的上下文而变化。如果在使用该术语的文中该术语对于本领域普通技术人员来说是不明确的,则“约”将意味着高达特定术语的正负10%。
本文所用术语“给予”或“施用”活性剂表示为向此需要治疗的对象提供本发明的活性剂,其形式为可以治疗有用形式和治疗有效量导入该个体的形式。
本文所用术语“agt103”指包含如本文所述的mir30-ccr5/mir21-vif/mir185-tat微小rna簇序列的慢病毒载体的具体实施方式。
本文所用术语“agt103t”表示已经用包含agt103慢病毒载体的慢病毒或慢病毒颗粒转导的细胞。
在本说明书和权利要求书中,词语“包括”或其变化形式如“包含”或“含有”应理解为表示包括所述整数或整数组,但不排除任何其他整数或整数组。此外,本文所用术语“包括”表示包括但不限于。
术语“移植”表示本领域技术人员确定输注细胞源后对象中维持移植物的定量水平的能力(参见例如:rosenberg等,n.engl.j.med.323:570-578(1990);dudley等,j.immunother.24:363-373(2001);yee等,curr.opin.immunol.13:141-146(2001);rooney等,blood92:1549-1555(1998))。
术语“表达”、“表达的”或“编码”是指多核苷酸转录成mrna的过程和/或转录的mrna随后被翻译成肽,多肽或蛋白质的过程。表达可以包括在真核细胞中剪接mrna或其他形式的转录后修饰或翻译后修饰。
术语“功能性治愈(functionalcure)”指这样的状态或情况,其中之前需要cart或haart的hiv+个体可以低或检测不到的病毒复制存活,使用较低剂量、间歇剂量或停止给予cart或haart。个体可认为是已经“功能性治愈”的,但是仍需要辅助治疗以维持低水平病毒复制并减缓或消除疾病进展。功能性治愈的可能结果是彻底根除hiv以防止复发的所有可能性。
术语“hiv疫苗”涵盖免疫原加上载剂加上佐剂,旨在引起hiv特异性免疫应答。“hiv疫苗”可以包括纯化的或完全灭活的病毒颗粒,其可以是能够表达hiv蛋白、蛋白质片段或肽、糖蛋白片段或糖肽的hiv或重组病毒载体,还包括重组细菌载体,质粒dna或rna,其能够指导细胞产生能够引发特异性免疫的hiv蛋白、糖蛋白或蛋白质片段。或者,包括抗-cd3/cd28珠粒、t细胞受体特异性抗体、有丝分裂原、超抗原和其他化学或生物刺激物的免疫刺激的特定方法可以用于激活树突,t或b细胞,用于在转导前富集hiv特异性cd4t细胞或用于慢病毒转导的cd4t细胞的体外试验。激活性物质可以是可溶的,聚合的组装体,脂质体或基于核内体的或与珠连接的。可以添加包括白细胞介素-2、6、7、12、15、23等的细胞因子以改善对刺激物的细胞响应和/或改善整个培养和转导间隔中cd4t细胞的存活。或者且在不限制任何前述内容的情况下,术语“hiv疫苗”涵盖mva/hiv62b疫苗和其变体。mva/hiv62b疫苗是一种已知的高度减毒的双重组mva疫苗。mva/hiv62b疫苗通过将hiv-1gag-pol和env序列插入已知的mva载体构建(参见:例如:goepfert等(2014)j.infect.dis.210(1):99-110,并参见wo2006026667,其两者通过引用纳入本文)。术语“hiv疫苗”还包括下表1中所提供的一种或多种疫苗。
表1
*iavi是国际aids疫苗倡议,其临床试验数据库可在http://www.iavi.org/trials-database/trials上公众可及。
**本文所用术语“初免(prime)”指在本文表1中提及的给定临床试验中最初用作免疫接种物的组合物。
术语“体内”指代在生物体中发生的过程。术语“离体”指代在生物体外部发生的过程。
术语“mirna”指微小rna,并且也可称为“mir”。
术语“包装细胞系”是指可用于表达慢病毒颗粒的任何细胞系。
在述及两个或更多个核酸或多肽序列的内容中,术语“百分比相同性”是指,当进行比较并以最大对应性比对时,两个或更多个具有相同的核苷酸或氨基酸残基的特定百分比的序列或子序列,如使用下述的序列比较算法之一(例如,blastp和blastn或本领域技术人员可用的其他算法)或通过视觉检查所测量。取决于应用,“百分比相同性”可以存在于被比较的序列区域上,例如,在功能域上,或者,存在于待比较的两个序列的全长上。对于序列比较,一般将一条序列用作与测试序列比较的参比序列。使用序列比较算法时,将测试序列和参比序列输入计算机,如果必要则指定子序列坐标,并指定序列算法程序参数。然后,序列比较算法根据指定的程序参数计算测试序列相对参比序列的序列相同性百分数。
可进行最优序列比对以作比较,例如,通过smith和waterman的局部同源性算法,adv.appl.math.2:482(1981);通过needleman和wunsch的同源性比对算法,j.mol.biol.48:443(1970);通过pearson和lipman的相似性搜索法,proc.nat’l.acad.sci.usa85:2444(1988);通过计算机执行这些算法(遗传学计算组(geneticscomputergroup)的威斯康星遗传学软件包(wisconsingeneticssoftwarepackage)中的gap、bestfit、fasta和tfasta,575科学大道(sciencedr.),威斯康星州麦迪逊),或通过视觉检查。
适用于确定序列相同性百分比和序列相似性的算法的一个实例是blast算法,其在altschul等,j.mol.biol.215:403-410(1990)中描述。进行blast分析的软件可从国家生物技术信息中心(nationalcenterforbiotechnologyinformation)公开获得。
两个核苷酸序列之间的相同性百分比可以使用gcg软件包中(可从http://www.gcg.com获得)的gap程序,使用nwsgapdna.cmp矩阵和空位权重40、50、60、70或80,长度权重1、2、3、4、5或6。两个核苷酸或氨基酸序列之间的相同性百分比也可以使用e.meyers和w.miller(cabios,4:11-17(1989))的算法确定,该算法已被并入align程序(版本2.0),使用pam120权重残基表,空位长度罚分为12,空位罚分为4。另外,两个氨基酸序列之间的百分比相同性可以使用needleman和wunsch(j.mol.biol.(48):444-453(1970))算法确定,该算法已经结合到gcg软件包(可从http://www.gcg.com获得)中的gap程序中,使用blossum62矩阵或pam250矩阵,空位权重为16、14、12、10、8、6或4,长度权重为1、2、3、4、5或6。
本公开内容的核酸和蛋白质序列还可以用作“查询序列”以对公共数据库进行搜索,以例如鉴定相关序列。这类搜索可使用altschul等,1990,j.mol.biol.,215:403-10的nblast和xblast程序(2.0版本)来运行。可利用nblast程序进行blast核苷酸搜索(评分=100,字长=12),以获得与本发明的核酸分子同源的核苷酸序列。可利用xblast程序进行blast蛋白质搜索(评分=50,字长=3),以获得与本发明蛋白质分子同源的氨基酸序列。为了获得缺口比对以用于比较目的,可如altschul等,1997,nucleicacidsres.,25(17):3389-3402所述利用缺口blast。利用blast和缺口blast程序时,可使用各程序(如xblast和nblast)的默认参数。参见http://www.ncbi.nlm.nih.gov。
本文中所用的术语“药学上可接受的”是指合理医疗判断范围内的这些化合物、材料、组合物和/或剂型,其适用于接触人体和动物的组织、器官和/或体液而不会产生过度毒性、刺激性、过敏反应或与合理的效益/风险比相适应的其它问题或并发症。
如本文所用,“药学上可接受的运载体”表示并包括生理上相容的任何和所有溶剂,分散介质,包被,抗细菌剂和抗真菌剂,等渗剂和吸收延迟剂,等等。该组合物可包括药学上可接受的盐,例如酸加成盐或碱加成盐(参见例如berge等(1977)jpharmsci66:1-19)。
如本文所用,术语“seqidno”与术语“序列idno.”同义。
如本文所用,“小rna”是指非编码rna,其长度通常小于约200个核苷酸或更少并且具有沉默或干扰功能。在其他实施方式中,小rna长度为约175个核苷酸或更短,约150个核苷酸或更短,约125个核苷酸或更短,约100个核苷酸或更短,或约75个核苷酸或更短。此类rna包括微小rna(mirna)、小干扰rna(sirna)、双链rna(dsrna)和短发夹rna(shrna)。本公开的小“rna”应能够抑制或敲减靶基因的基因表达,通常通过会导致靶基因mrna破坏的途径。
本文所用术语“刺激剂”指可刺激白细胞的任何外源性试剂。
本文所用术语“对象”包括人患者,还包括其他哺乳动物。术语“对象”、“个体”、“宿主”和“患者”在本文中可互换使用。
本文所用术语“靶细胞”通常指这样的cd4+t细胞,所述cd4+t细胞响应由呈递hiv基因序列的蛋白质或肽片段的刺激,并且包括已经用本文详述的慢病毒载体转导使其对hiv敏感性降低的cd4+t细胞。
术语“治疗有效量”是指足够量的本发明的活性剂,以合适的组合物和合适的剂型来治疗或预防患有给定轻病、损伤、疾病或病症的患者中出现的症状、进展或并发症发作。“治疗有效量”取决于患者病症状态或其严重程度、所治疗对象的年龄、体重等。治疗有效量可以根据许多因素中的任何一种而变化,包括例如给药途径,对象的状况,以及本领域技术人员理解的其他因素。
本文所用术语“治疗性载体”与慢病毒载体如act103载体是同义词。
术语“治疗”或“处理”通常是指试图改变所治疗的对象的自然进程的干预,并且可以用于预防进行或在临床病理学过程中进行。理想的效果包括但不限于预防疾病的发生或复发,缓解症状,遏制,减少或抑制疾病的任何直接或间接病理后果,改善或缓解疾病状态,以及引起缓解或改善预后。
本公开多个方面的描述
如本文详述,在一个方面中,公开了治疗对象hiv感染的方法。该方法移出所述对象的白细胞并纯化外周血单核细胞(pbmc)。该方法进一步包括使pbmc与治疗有效量的刺激剂离体接触;使用编码至少一种遗传元件的病毒递送系统离体转导pbmc;和培养转导的pbmc至少1天。该方法可以还包括进一步富集pbmc,例如,通过,优选针对cd4+t细胞富集pbmc。可以培养转导的pbmc约1天至约35天。该方法还涉及将转导的pbmc输注到对象中。对象可以是人。刺激剂可以包括肽或肽的混合物。在优选的实施方式中,刺激剂包括gag肽。刺激剂可以包括疫苗。疫苗可以是hiv疫苗,并且在优选的实施方式中,hiv疫苗是mva/hiv62b疫苗或其变体。在优选的实施方式中,病毒递送系统包括慢病毒颗粒。在一实施方式中,至少一种遗传元件包括能够抑制趋化因子受体ccr5产生的小rna或能够靶向hivrna序列的至少一种小rna。在另一实施方式中,至少一种遗传元件包括能够抑制趋化因子受体ccr5产生的小rna和能够靶向hivrna序列的至少一种小rna。hivrna序列可以包括hivvif序列、hivtat序列或其变体。至少一种遗传元件可以包括微小rna或shrna。在优选实施方式中,至少一种遗传元件包括微小rna簇。
在另一方面中,至少一种遗传元件包括与
aggtatattgctgttgacagtgagcgactgtaaactgagcttgctctactgtgaagccacagatgggtagagcaagcacagtttaccgctgcctactgcctcggacttcaaggggctt(seqidno:1)具有至少80%、至少81%、至少82%、至少83%、至少84%、至少85%、至少86%、至少87%、至少88%、至少89%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%或更多百分比相同性的微小rna。在优选实施方式中,至少一种遗传元件包括aggtatattgctgttgacagtgagcgactgtaaactgagcttgctctactgtgaagccacagatgggtagagcaagcacagtttaccgctgcctactgcctcggacttcaaggggctt(seqidno:1)。
在另一方面中,至少一种遗传元件包括与
catctccatggctgtaccaccttgtcgggggatgtgtacttctgaacttgtgttgaatctcatggagttcagaagaacacatccgcactgacattttggtatctttcatctgacca(seqidno:2)具有至少80%、或至少85%、或至少90%或至少95%百分比相同性的微小rna;或与
gggcctggctcgagcagggggcgagggattccgcttcttcctgccatagcgtggtcccctcccctatggcaggcagaagcggcaccttccctcccaatgaccgcgtcttcgtcg(seqidno:3)具有至少80%、至少81%、至少82%、至少83%、至少84%、至少85%、至少86%、至少87%、至少88%、至少89%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%或更多百分比相同性的微小rna。在优选实施方式中,至少一种遗传元件包括
catctccatggctgtaccaccttgtcgggggatgtgtacttctgaacttgtgttgaatctcatggagttcagaagaacacatccgcactgacattttggtatctttcatctgacca(seqidno:2);或
gggcctggctcgagcagggggcgagggattccgcttcttcctgccatagcgtggtcccctcccctatggcaggcagaagcggcaccttccctcccaatgaccgcgtcttcgtcg(seqidno:3)。
在另一方面中,微小rna簇包括与
aggtatattgctgttgacagtgagcgactgtaaactgagcttgctctactgtgaagccacagatgggtagagcaagcacagtttaccgctgcctactgcctcggacttcaaggggcttcccgggcatctccatggctgtaccaccttgtcgggggatgtgtacttctgaacttgtgttgaatctcatggagttcagaagaacacatccgcactgacattttggtatctttcatctgaccagctagcgggcctggctcgagcagggggcgagggattccgcttcttcctgccatagcgtggtcccctcccctatggcaggcagaagcggcaccttccctcccaatgaccgcgtcttcgtc(seqidno:31)具有至少80%、至少81%、至少82%、至少83%、至少84%、至少85%、至少86%、至少87%、至少88%、至少89%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%或更多百分比相同性的序列。在优选实施方式中,微小rna簇包括
aggtatattgctgttgacagtgagcgactgtaaactgagcttgctctactgtgaagccacagatgggtagagcaagcacagtttaccgctgcctactgcctcggacttcaaggggcttcccgggcatctccatggctgtaccaccttgtcgggggatgtgtacttctgaacttgtgttgaatctcatggagttcagaagaacacatccgcactgacattttggtatctttcatctgaccagctagcgggcctggctcgagcagggggcgagggattccgcttcttcctgccatagcgtggtcccctcccctatggcaggcagaagcggcaccttccctcccaatgaccgcgtcttcgtc(seqidno:31)。
在另一方面,提供了处理感染hiv的细胞的方法。该方法进一步包括使分离自感染hiv的对象的外周血单核细胞(pbmc)与治疗有效量的刺激剂接触,其中所述接触离体进行;使用编码至少一种遗传元件的病毒递送系统离体转导pbmc;和培养转导的pbmc至少1天。可以培养转导的pbmc约1天至约35天。该方法还涉及将转导的pbmc输注到对象中。对象可以是人。刺激剂可以包括肽或肽的混合物,并且在优选的实施方式中包括gag肽。刺激剂可以包括疫苗。疫苗可以是hiv疫苗,并且在优选的实施方式中,hiv疫苗是mva/hiv62b疫苗或其变体。在优选的实施方式中,病毒递送系统包括慢病毒颗粒。在一实施方式中,至少一种遗传元件包括能够抑制趋化因子受体ccr5产生的小rna或能够靶向hivrna序列的至少一种小rna。在另一实施方式中,至少一种遗传元件包括能够抑制趋化因子受体ccr5产生的小rna和能够靶向hivrna序列的至少一种小rna。hivrna序列可以包括hivvif序列、hivtat序列或其变体。至少一种遗传元件可以包括微小rna或shrna。在优选实施方式中,至少一种遗传元件包括微小rna簇。
在另一方面中,至少一种遗传元件包括与
aggtatattgctgttgacagtgagcgactgtaaactgagcttgctctactgtgaagccacagatgggtagagcaagcacagtttaccgctgcctactgcctcggacttcaaggggctt(seqidno:1)具有至少80%、至少81%、至少82%、至少83%、至少84%、至少85%、至少86%、至少87%、至少88%、至少89%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%或更多百分比相同性的微小rna。在优选实施方式中,至少一种遗传元件包括
aggtatattgctgttgacagtgagcgactgtaaactgagcttgctctactgtgaagccacagatgggtagagcaagcacagtttaccgctgcctactgcctcggacttcaaggggctt(seqidno:1)。在另一方面,至少一个遗传元件包括这样的微小rna,所述微小rna与
catctccatggctgtaccaccttgtcgggggatgtgtacttctgaacttgtgttgaatctcatggagttcagaagaacacatccgcactgacattttggtatctttcatctgacca(seqidno:2)具有少80%、至少81%、至少82%、至少83%、至少84%、至少85%、至少86%、至少87%、至少88%、至少89%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%或更多百分比相同性;或与
gggcctggctcgagcagggggcgagggattccgcttcttcctgccatagcgtggtcccctcccctatggcaggcagaagcggcaccttccctcccaatgaccgcgtcttcgtcg(seqidno:3)具有少80%、至少81%、至少82%、至少83%、至少84%、至少85%、至少86%、至少87%、至少88%、至少89%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%或更多百分比相同性。在优选实施方式中,至少一种遗传元件包括
catctccatggctgtaccaccttgtcgggggatgtgtacttctgaacttgtgttgaatctcatggagttcagaagaacacatccgcactgacattttggtatctttcatctgacca(seqidno:2);或
gggcctggctcgagcagggggcgagggattccgcttcttcctgccatagcgtggtcccctcccctatggcaggcagaagcggcaccttccctcccaatgaccgcgtcttcgtcg(seqidno:3)。
在另一方面中,微小rna簇包括与
aggtatattgctgttgacagtgagcgactgtaaactgagcttgctctactgtgaagccacagatgggtagagcaagcacagtttaccgctgcctactgcctcggacttcaaggggcttcccgggcatctccatggctgtaccaccttgtcgggggatgtgtacttctgaacttgtgttgaatctcatggagttcagaagaacacatccgcactgacattttggtatctttcatctgaccagctagcgggcctggctcgagcagggggcgagggattccgcttcttcctgccatagcgtggtcccctcccctatggcaggcagaagcggcaccttccctcccaatgaccgcgtcttcgtc(seqidno:31)具有至少80%、至少81%、至少82%、至少83%、至少84%、至少85%、至少86%、至少87%、至少88%、至少89%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%或更多百分比相同性的序列。在优选实施方式中,微小rna簇包括
aggtatattgctgttgacagtgagcgactgtaaactgagcttgctctactgtgaagccacagatgggtagagcaagcacagtttaccgctgcctactgcctcggacttcaaggggcttcccgggcatctccatggctgtaccaccttgtcgggggatgtgtacttctgaacttgtgttgaatctcatggagttcagaagaacacatccgcactgacattttggtatctttcatctgaccagctagcgggcctggctcgagcagggggcgagggattccgcttcttcctgccatagcgtggtcccctcccctatggcaggcagaagcggcaccttccctcccaatgaccgcgtcttcgtc(seqidno:31)。
在另一方面,公开了慢病毒载体。慢病毒载体包括至少一种编码的遗传元件,其中该至少一种编码的遗传元件包括能够抑制趋化因子受体ccr5产生的小rna或能够靶向hivrna序列的至少一种小rna。在另一方面中,公开了慢病毒载体,其中至少一种编码的遗传元件包括能够抑制趋化因子受体ccr5产生的小rna和能够靶向hivrna序列的至少一种小rna。hivrna序列可以包括hivvif序列、hivtat序列或其变体。至少一种编码的遗传元件可以包括微小rna或shrna。至少一种编码的遗传元件可以包括微小rna簇。
在另一方面中,至少一种遗传元件包括与
aggtatattgctgttgacagtgagcgactgtaaactgagcttgctctactgtgaagccacagatgggtagagcaagcacagtttaccgctgcctactgcctcggacttcaaggggctt(seqidno:1)具有至少80%、至少81%、至少82%、至少83%、至少84%、至少85%、至少86%、至少87%、至少88%、至少89%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%或更多百分比相同性的微小rna。在优选实施方式中,至少一种遗传元件包括aggtatattgctgttgacagtgagcgactgtaaactgagcttgctctactgtgaagccacagatgggtagagcaagcacagtttaccgctgcctactgcctcggacttcaaggggctt(seqidno:1)。
在另一方面,至少一个遗传元件包括这样的微小rna,所述微小rna与catctccatggctgtaccaccttgtcgggggatgtgtacttctgaacttgtgttgaatctcatggagttcagaagaacacatccgcactgacattttggtatctttcatctgacca(seqidno:2)具有少80%、至少81%、至少82%、至少83%、至少84%、至少85%、至少86%、至少87%、至少88%、至少89%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%或更多百分比相同性;或与
gggcctggctcgagcagggggcgagggattccgcttcttcctgccatagcgtggtcccctcccctatggcaggcagaagcggcaccttccctcccaatgaccgcgtcttcgtcg(seqidno:3)具有少80%、至少81%、至少82%、至少83%、至少84%、至少85%、至少86%、至少87%、至少88%、至少89%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%或更多百分比相同性。在优选实施方式中,至少一种遗传元件包括
catctccatggctgtaccaccttgtcgggggatgtgtacttctgaacttgtgttgaatctcatggagttcagaagaacacatccgcactgacattttggtatctttcatctgacca(seqidno:2);或
gggcctggctcgagcagggggcgagggattccgcttcttcctgccatagcgtggtcccctcccctatggcaggcagaagcggcaccttccctcccaatgaccgcgtcttcgtcg(seqidno:3)。
在另一方面中,微小rna簇包括与
aggtatattgctgttgacagtgagcgactgtaaactgagcttgctctactgtgaagccacagatgggtagagcaagcacagtttaccgctgcctactgcctcggacttcaaggggcttcccgggcatctccatggctgtaccaccttgtcgggggatgtgtacttctgaacttgtgttgaatctcatggagttcagaagaacacatccgcactgacattttggtatctttcatctgaccagctagcgggcctggctcgagcagggggcgagggattccgcttcttcctgccatagcgtggtcccctcccctatggcaggcagaagcggcaccttccctcccaatgaccgcgtcttcgtc(seqidno:31)具有至少80%、至少81%、至少82%、至少83%、至少84%、至少85%、至少86%、至少87%、至少88%、至少89%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%或更多百分比相同性的序列。在优选实施方式中,微小rna簇包括
aggtatattgctgttgacagtgagcgactgtaaactgagcttgctctactgtgaagccacagatgggtagagcaagcacagtttaccgctgcctactgcctcggacttcaaggggcttcccgggcatctccatggctgtaccaccttgtcgggggatgtgtacttctgaacttgtgttgaatctcatggagttcagaagaacacatccgcactgacattttggtatctttcatctgaccagctagcgggcctggctcgagcagggggcgagggattccgcttcttcctgccatagcgtggtcccctcccctatggcaggcagaagcggcaccttccctcccaatgaccgcgtcttcgtc(seqidno:31)。
另一方面,公开了用于表达慢病毒颗粒的慢病毒载体系统。该系统包括如本文所述的慢病毒载体;用于表达经优化用于感染细胞的包膜蛋白的包膜质粒;和用于表达gag,pol和rev基因的至少一种辅助质粒,其中当慢病毒载体、包膜质粒和至少一种辅助质粒被转染到包装细胞系中时,慢病毒颗粒由包装细胞系产生,其中慢病毒颗粒能够抑制趋化因子受体ccr5的产生或能靶向hivrna序列。
在另一方面中,公开了能够感染细胞的慢病毒颗粒。慢病毒颗粒包括经优化用于感染细胞的包膜蛋白和如本文所述的慢病毒载体。包膜蛋白可以经优化用于感染t细胞。在优选的实施方式中,包膜蛋白经优化用于感染cd4+t细胞。
在另一方面中,公开了修饰细胞。修饰细胞包括cd4+t细胞,其中该cd4+t细胞已经用如本文所述的慢病毒颗粒感染。在优选的实施方式中,cd4+t细胞还识别hiv抗原。在其他优选的实施方式中,hiv抗原包括gag抗原。在其他优选实施方式中,cd4+t细胞在使用慢病毒颗粒感染后表达降低水平的ccr5。
在另一方面,公开了选择治疗性处理方案的对象的方法。该方法包括从对象移出白细胞和纯化外周血单核细胞(pbmc)并确定与至少一种pbmc相关性因素相关的第一可定量测量值;使pbmc与治疗有效量的第二刺激剂离体接触,并确定与至少一种pbmc相关性因素相关的第二测量值,其中当第二可定量测量值高于第一可定量测量值时,选择该对象为该处理方案的对象。至少一种因素可以是t细胞增殖或ifnγ产量。
在另一方面中,本文所述包括治疗hiv感染的细胞的任何方法还包括从pbmc消耗至少一个细胞亚组。在一些实施方式中,该方法包括从pbmc消耗至少一个细胞亚组,其中至少一个细胞亚组包括cd8+t细胞、γδ细胞、nk细胞、b细胞、中性粒细胞、嗜碱性粒细胞、嗜酸性粒细胞、t调节性细胞、nkt细胞和红细胞的任一种或多种。在实施方式中,消耗在移出白细胞之后发生。在实施方式中,消耗在移出白细胞同时发生。
在其他方面中,本文所述包括治疗对象中hiv的任何方法还包括从pbmc消耗至少一个细胞亚组。在一些实施方式中,该方法包括从pbmc消耗至少一个细胞亚组,其中至少一个细胞亚组包括cd8+t细胞、γδ细胞、nk细胞、b细胞、中性粒细胞、嗜碱性粒细胞、嗜酸性粒细胞、t调节性细胞、nkt细胞和红细胞的任一种或多种。在实施方式中,消耗在移出白细胞之后发生。在实施方式中,消耗在移出白细胞同时发生。
在其他方面中,本文所述包括选择治疗性方案的对象的任何方法还包括从pbmc消耗至少一个细胞亚组。在一些实施方式中,该方法包括从pbmc消耗至少一个细胞亚组,其中至少一个细胞亚组包括cd8+t细胞、γδ细胞、nk细胞、b细胞、中性粒细胞、嗜碱性粒细胞、嗜酸性粒细胞、t调节性细胞、nkt细胞和红细胞的任一种或多种。在实施方式中,消耗在移出白细胞之后发生。在实施方式中,消耗在移出白细胞同时发生。
在其他方面中,本文所述的任何方法还包括从pbmc消耗免疫细胞的至少一种亚组,其中,至少一个细胞亚组包括cd8+t细胞、γδ细胞、nk细胞、b细胞、中性粒细胞、嗜碱性粒细胞、嗜酸性粒细胞、t调节性细胞、nkt细胞和红细胞的任一种或多种。在一些实施方式中,从pbmc消耗的细胞是cd8+t细胞。在一些实施方式中,从pbmc消耗的细胞是γδ细胞。在一些实施方式中,从pbmc消耗的细胞是nk细胞。在一些实施方式中,从pbmc消耗的细胞是b细胞。在一些实施方式中,从pbmc消耗的细胞是t调节性细胞。在一些实施方式中,从pbmc消耗的细胞是nkt细胞。在一些实施方式中,从pbmc消耗的细胞是红细胞。在一些实施方式中,从pbmc消耗的细胞是cd8+t细胞和γδ细胞。在一些实施方式中,从pbmc消耗的细胞是cd8+t细胞、γδ细胞和nk细胞。在一些实施方式中,从pbmc消耗的细胞是cd8+t细胞、γδ细胞、nk细胞和b细胞。在一些实施方式中,从pbmc消耗的细胞是cd8+t细胞、γδ细胞、nk细胞、b细胞和t调节性细胞。在一些实施方式中,从pbmc消耗的细胞是cd8+t细胞、γδ细胞、nk细胞、b细胞、t调节性细胞和nkt细胞。在一些实施方式中,从pbmc消耗的细胞是cd8+t细胞、γδ细胞、nk细胞、b细胞、t调节性细胞、nkt细胞和红细胞。在一些实施方式中,从pbmc消耗的细胞是γδ细胞和nk细胞。在一些实施方式中,从pbmc消耗的细胞是γδ细胞、nk细胞和b细胞。在一些实施方式中,从pbmc消耗的细胞是γδ细胞、nk细胞、b细胞和t调节性细胞。在一些实施方式中,从pbmc消耗的细胞是γδ细胞、nk细胞、b细胞、t调节性细胞和nkt细胞。在一些实施方式中,从pbmc消耗的细胞是γδ细胞、nk细胞、b细胞、t调节性细胞、nkt细胞和红细胞。在一些实施方式中,从pbmc消耗的细胞是nk细胞和b细胞。在一些实施方式中,从pbmc消耗的细胞是nk细胞、b细胞和t调节性细胞。在一些实施方式中,从pbmc消耗的细胞是nk细胞、b细胞、t调节性细胞和nkt细胞。在一些实施方式中,从pbmc消耗的细胞是nk细胞、b细胞、t调节性细胞、nkt细胞和红细胞。在一些实施方式中,从pbmc消耗的细胞是b细胞和t调节性细胞。在一些实施方式中,从pbmc消耗的细胞是b细胞、t调节性细胞和nkt细胞。在一些实施方式中,从pbmc消耗的细胞是b细胞、t调节性细胞、nkt细胞和红细胞。在一些实施方式中,从pbmc消耗的细胞是t调节性细胞和nkt细胞。在一些实施方式中,从pbmc消耗的细胞是t调节性细胞、nkt细胞和红细胞。在一些实施方式中,从pbmc消耗的细胞是nkt细胞和红细胞。在一些实施方式中,从pbmc消耗的细胞是cd8+t细胞和nk细胞。在一些实施方式中,从pbmc消耗的细胞是cd8+t细胞、nk细胞和b细胞。在一些实施方式中,从pbmc消耗的细胞是cd8+t细胞、nk细胞、b细胞和t调节性细胞。在一些实施方式中,从pbmc消耗的细胞是cd8+t细胞、nk细胞、b细胞、t调节性细胞和nkt细胞。在一些实施方式中,从pbmc消耗的细胞是cd8+t细胞、nk细胞、b细胞、t调节性细胞、nkt细胞和红细胞。在一些实施方式中,从pbmc消耗的细胞是γδ和b细胞。在一些实施方式中,从pbmc消耗的细胞是γδ、b细胞和t调节性细胞。在一些实施方式中,从pbmc消耗的细胞是γδ、b细胞、t调节性细胞和nkt细胞。在一些实施方式中,从pbmc消耗的细胞是γδ、b细胞、t调节性细胞、nkt细胞和红细胞。在一些实施方式中,从pbmc消耗的细胞是nk细胞和t调节性细胞。在一些实施方式中,从pbmc消耗的细胞是nk细胞、t调节性细胞和nkt细胞。在一些实施方式中,从pbmc消耗的细胞是nk细胞、t调节性细胞、nkt细胞和红细胞。在一些实施方式中,从pbmc消耗的细胞是b细胞和nkt细胞。在一些实施方式中,从pbmc消耗的细胞是b细胞、nkt细胞和红细胞。在一些实施方式中,从pbmc消耗的细胞是t调节性细胞和红细胞。在一些实施方式中,本文所述从pbmc消耗的细胞包括中性粒细胞、嗜碱性粒细胞和嗜酸性粒细胞中的任一种或任意组合。
在另一方面中,在细胞扩增开始时消耗cd8+t细胞以改善cd4+t细胞扩增。在一些实施方式中,在肽刺激之后和慢病毒转导之前(此时细胞能够更好地耐受机械应力)进行细胞消耗。在一些实施方式中,cd8+t细胞消耗后,将细胞置于培养基大约24小时。在一些实施方式中,cd8+细胞消耗后,将细胞置于培养少于24小时,例如,少于20小时,少于16小时,少于8小时或少于4小时。在一些实施方式中,cd8+t细胞消耗后,将细胞置于培养多于24小时,例如,多于30小时,多于36小时,多于42小时或多于48小时。在一些实施方式中,培养基包含il-7。在一些实施方式中,培养基包含il-15。在一些实施方式中,培养基包含il-7和il-15。在一些实施方式中,在肽刺激之前,进行细胞消耗。在一些实施方式中,gag蛋白用于引起肽刺激。在一些实施方式中,hiv疫苗用于引起肽刺激。在一些实施方式中,用于引起肽刺激的疫苗是mva/hiv62b疫苗。在一些实施方式中,用pe抗-人cd8抗体和抗-pe微珠消耗cd8+t细胞。在一些实施方式中,cd8抗体是抗-大鼠抗体。在一些实施方式中,cd8抗体是抗-小鼠抗体。在一些实施方式中,cd8抗体是抗-兔抗体。在一些实施方式中,cd8抗体是抗-山羊抗体。在一些实施方式中,细胞消耗和肽刺激后,细胞被转导。在一些实施方式中,用慢病毒转导细胞。在一些实施方式中,慢病毒具有gfp。在一些实施方式中,慢病毒具有rfp。在一些实施方式中,慢病毒具有egfp。在一些实施方式中,转导后细胞被置于培养中。在一些实施方式中,培养基包含il-7。在一些实施方式中,培养基包含il-15。在一些实施方式中,培养基包含il-7和il-15。在一些实施方式中,培养细胞大约2天以使cd4+t细胞扩增。在一些实施方式中,培养细胞大约3天以使cd4+t细胞扩增。在一些实施方式中,培养细胞少于2天,例如,少于42小时,少于36小时,少于30小时,少于24小时,少于18小时,少于12小时或少于6小时。在一些实施方式中,培养细胞多于3天,例如,多于4天,多于5天,多于6天,多于7天,多于8天,多于9天或多于10天。在一些实施方式中,培养细胞2-3天,例如,大约30小时,大约36小时或大约42小时。
在另一方面中,消耗cd8+、γδ、nk或b细胞以改善cd4+t细胞扩增。在一些实施方式中,消耗cd8+、γδ、nk或b细胞中的任何两种或更多种以改善cd4+t细胞扩增。在另一方面中,消耗cd8+、γδ、nk、b、t调节性、nkt或红细胞以改善cd4+t细胞扩增。在一些实施方式中,消耗cd8+、γδ、nk、b、t调节性、nkt或红细胞中的任何两种或更多种以改善cd4+t细胞扩增。在一些实施方式中,在肽刺激后和慢病毒转导之前进行细胞消耗。在一些实施方式中,细胞消耗后,将细胞置于培养基大约24小时。在一些实施方式中,细胞消耗后,将细胞置于培养少于24小时,例如,少于20小时,少于16小时,少于8小时或少于4小时。在一些实施方式中,cd8+t细胞消耗后,将细胞置于培养多于24小时,例如,多于30小时,多于36小时,多于42小时或多于48小时。在一些实施方式中,培养基包含il-7。在一些实施方式中,培养基包含il-15。在一些实施方式中,培养基包含il-7和il-15。在一些实施方式中,在肽刺激之前,进行细胞消耗。在一些实施方式中,gag蛋白用于引起肽刺激。在一些实施方式中,hiv疫苗用于引起肽刺激。在一些实施方式中,mva/hiv62b疫苗用于引起肽刺激。在一些实施方式中,用pe标记的特异性抗体和抗-pe微珠消耗cd8+t、γδ、nk和/或b细胞。在一些实施方式中,使用的抗体是抗-人抗体。在一些实施方式中,使用的抗体是抗-大鼠抗体。在一些实施方式中,使用的抗体是抗-小鼠抗体。在一些实施方式中,使用的抗体是抗-山羊抗体。在一些实施方式中,细胞消耗和肽刺激后,细胞被转导。在一些实施方式中,用慢病毒转导细胞。在一些实施方式中,慢病毒具有gfp。在一些实施方式中,慢病毒具有rfp。在一些实施方式中,慢病毒具有egfp。在一些实施方式中,转导后细胞被置于培养中。在一些实施方式中,培养基包含il-7。在一些实施方式中,培养基包含il-15。在一些实施方式中,培养基包含il-7和il-15。在一些实施方式中,培养细胞大约2天以使cd4+t细胞扩增。在一些实施方式中,培养细胞大约3天以使cd4+t细胞扩增。在一些实施方式中,培养细胞少于2天,例如,少于42小时,少于36小时,少于30小时,少于24小时,少于18小时,少于12小时或少于6小时。在一些实施方式中,培养细胞多于3天,例如,多于4天,多于5天,多于6天,多于7天,多于8天,多于9天或多于10天。在一些实施方式中,培养细胞2-3天,例如,约30小时,约36小时或约42小时。
在其他方面中,慢病毒包括gfp,其被用于测量转导效率。在一些实施方式中,慢病毒包括rfp。在一些实施方式中,慢病毒具有egfp。在一些实施方式中,细胞因子捕获系统用于利用gfp阳性细胞鉴定抗原特异性cd4+t细胞。在一些实施方式中,gfp用于鉴定转导的细胞亚组。在一些实施方式中,rfp用于鉴定转导的细胞亚组。在一些实施方式中,egfp用于鉴定转导的细胞亚组。在一些实施方式中,本文所述的任何转导方法可以用于测量转导效率。在一些实施方式中,在慢病毒转导之前,本文所述的任何消耗方法可以用于消耗cd8+t、γδ、nk、b、中性粒细胞、嗜碱性粒细胞、嗜酸性粒细胞、t调节性、nkt和红细胞中的任何一种或多种。
在其他方面中,转导效率通过由qpcr检测载体拷贝数(vcn)来测量。在一些实施方式中,基于最终细胞产物中vcn的转导细胞的百分比可以通过建立转导细胞和vcn之间关系来估计。在一些实施方式中,具有gfp的慢病毒被用于确定转导细胞的百分比。在一些实施方式中,具有rfp的慢病毒被用于确定转导细胞的百分比。在一些实施方式中,具有erfp的慢病毒被用于确定转导细胞的百分比。在一些实施方式中,本文所述的任何转导方法可以用于测量转导效率。在一些实施方式中,在慢病毒转导之前,本文所述的任何消耗方法可以用于消耗cd8+t、γδ、nk、b细胞中的任何一种或多种。
人类免疫缺陷病毒(hiv)
人类免疫缺陷病毒通常也称为“hiv”,其是在人类中导致获得性免疫缺陷综合症(aids)的逆转录病毒。aids是这样一种症状,其中免疫系统的逐渐衰竭使得危及生命的机会性感染和癌症发展。如果没有治疗的情况下,感染hiv后的平均存活时间预计为9-11年,取决于hiv亚型。感染hiv过体液的转移发生,包括但不限于,血液,精液,阴道液,精前液(pre-ejaculate),唾液,泪液,淋巴或脑脊髓液或母乳。hiv可以游离的病毒颗粒和在感染的免疫细胞内的状态存在于感染的个体中。
hiv感染人类免疫系统中的重要细胞,如辅助t细胞,虽然在hiv亚型中的趋向性可能有所不同。对hiv感染特别敏感的免疫细胞包括但不限于cd4+t细胞、巨噬细胞和树突细胞。hiv感染通过一系列的机制导致低水平的cd4+t细胞,包括但不限于通过识别感染的细胞的cd8细胞毒性淋巴细胞杀伤感染的cd4+t细胞,直接病毒学杀伤感染的细胞和未感染的旁邻细胞的细胞凋亡。当cd4+t细胞数量降至低于临界水平时,细胞介导的免疫力缺失,身体变得越来越容易受到机会性感染和癌症的影响。
结构上,hiv与许多其他逆转录病毒不同。rna基因组包括至少7个结构标志(ltr、tar、rre、pe、slip、crs和ins)和至少9个基因(gag、pol、env、tat、rev、nef、vif、vpr、vpu,并且有时有第10个tev,其是tat、env和rev的融合体),编码19个蛋白质。这些基因中的3个,gag、pol和env包含产生新病毒颗粒结构蛋白所需的信息。
hiv主要在cd4t细胞中复制,并且导致细胞破坏或调节异常以降低宿主免疫力。因为hiv建立作为整合原病毒的感染并且可能进入潜伏状态,其中特定细胞中的病毒表达降低至低于影响该细胞或宿主免疫系统检测的细胞病理学水平,所以hiv难以治疗并且即使经长时间间隔的高效抗逆转录病毒治疗(haart)后也未能被根除。在绝大多数情况下,hiv感染导致致命的疾病,虽然存活可以通过haart延长。
对抗hiv的一个主要目标是研发用于治愈疾病的策略。延长的haart尚未实现该目标,所以研究人员已经转向其他方法。通过治疗性免疫(感染发生后使用疫苗)改善宿主免疫力的早期努力作用甚微或没有作用同样地,强化治疗有中度作用或没有作用。
使用基因疗法已经取得了一些进展,但阳性结果是零星的,并且仅存在于在编码ccr5(趋化因子受体)的基因的一个或两个等位基因中携带缺陷的罕见人类个体之中,所述ccr5在宿主细胞的病毒穿入中起关键作用。然而,许多研究人员乐观地认为,基因疗法最终有望实现hiv治愈。
本文所公开的本发明的方法和组合物能够实现这样的功能性治愈,所述功能性治愈可以或可以不包括从身体清除所有hiv。如上所述,功能性治愈(functionalcure)被定义为这样的状态或情况,其中之前需要haart的hiv+个体可以存活,具有低或检测不到的病毒复制并且使用较低或间歇剂量的haart,或者有可能能够将haart一并中断。本文所用“功能性治愈”可能仍需要辅助治疗以维持低水平病毒复制并减缓或消除疾病进展。功能性治愈的可能结果是彻底根除hiv以防止复发的所有可能性。
实现功能性治愈的主要障碍是hiv自身的基础生物学。病毒感染使得对于几乎所有免疫功能至关重要的cd4t细胞缺失。最重要的是,hiv感染以及cd4t细胞的消耗需要个体细胞的激活。激活是使用重排的t细胞受体识别病原体或其他分子的单个cd4t细胞克隆的特异性机制。
就hiv而言,感染激活了hiv特异性t细胞群,使其被感染并且因此在对病毒特异性较低的其他t细胞之前就被消耗,而这有效地削弱了免疫系统对病毒的防御能力。hiv特异性t细胞应答的能力在延长的haart期间重建;然而,当haart中断时,反弹的病毒感染重复上述过程并再次使病毒特异性细胞缺失,重置疾病进展的时钟。
明确地是,一旦haart中断时,只有当足够多的hiv特异性cd4t细胞被保护以使宿主的天然免疫力对抗和控制hiv时,功能性治愈是有可能的。在一个实施方式中,本公开的方面提供了用于在不需要预先免疫(priorimmunization)的情况下增强针对hiv的宿主免疫力以提供功能性治愈的方法和组合物。
基因疗法
采用病毒载体来递送基因构建体至宿主细胞用于疾病治疗和预防。
基因构建体可以包括但不限于,修正或补足现有缺陷的功能性基因或基因的部分,编码调节性蛋白的dna序列,编码调节性rna分子的dna序列,所述调节性rna分子包括反义,短同源rna,长非编码rna,小干扰rna等,以及编码旨在竞争重要的细胞因子以改变疾病状态的rna或蛋白质的诱饵序列(decoysequence)。基因疗法涉及递送这些治疗性基因构建体至靶细胞以提供特定疾病的治疗或缓解。
人们在hiv疾病的治疗中利用遗传疗法正在进行多种努力,但到目前为止,结果仍然很差。在携带ccr5基因(被称为ccr5δ32的等位基因)自发性缺失的罕见hiv患者中获得了少量治疗成功。
慢病毒递送的核酸酶或基因缺失/修饰的其他机制可以用于降低ccr5的整体表达和/或协助降低hiv复制。至少一项研究已经报道,当将慢病毒给予拥有ccr5δ32遗传背景的患者时,成功治疗了该疾病。然而,这是成功的唯一示例,并且没有ccr5δ32基因型的许多其他患者并没有被成功治疗。因此,在个别病毒载体构建体的性能以及通过用于实现功能性hiv治愈的策略改善载体的使用方面,存在对于改善针对hiv的遗传疗法效果的实质性需求。
例如,一些现有的疗法基于锌指核酸酶使ccr5的部分缺失,试图使细胞对hiv感染具有抗性。然而,即使在优化治疗后,一共只有30%的t细胞被核酸酶修饰,并且在经修饰的这些t细胞中,只有10%的总cd4t细胞群被以将预防hiv感染的形式修饰。相反,公开的方法导致几乎携带慢病毒转基因的每个细胞的ccr5表达减少,低于允许hiv感染所需的水平。这可以成功治疗hiv,甚至在不存在预先免疫步骤以增加初始cd4+t细胞库数量的情况下。
出于公开的方法的目的,基因疗法可以包括但不限于,亲和力增强的t细胞受体,cd4t细胞上(或者在cd8t细胞上)的嵌合抗原受体,修饰信号转导途径以避免由病毒蛋白导致的细胞死亡,增加hiv限制性元件的表达,包括rex、samhd1、mxa或mxb蛋白,apobec复合物,trim5-α复合物,束缚蛋白(tetherin)(bst2),和鉴定为能够减少哺乳动物细胞中hiv复制的相似蛋白质。
免疫疗法
从历史上看,疫苗已成为抵御致命传染病的首选武器,包括天花、脊髓灰质炎、麻疹和黄热病。可惜地是,当前还没有已经批准的hiv疫苗。hiv病毒具有逃避免疫系统的独特方式,并且人类身体似乎不能够具有针对其的有效免疫应答。因此,科学家们并不清楚地了解提供hiv防治所需的条件。
然而,免疫疗法可能提供之前并未通过常规疫苗途径解决的方案。免疫疗法也称之为生物疗法,是一种旨在增强身体自然防御能力对抗感染或癌症的治疗。其使用通过身体或在实验室中制备的材料来改善、靶向或恢复免疫系统功能。
在本公开的某些方面,出于增加宿主抗-hiv免疫力的目的,免疫治疗方法可以被用于富集hiv特异性cd4t细胞群。在本发明的其他方面中,整合型或非整合型慢病毒载体可以用于转导宿主的免疫细胞,用于增加宿主的抗-hiv免疫力。在本公开的其他方面中,包含hiv蛋白的疫苗可以用于富集抗体或病毒特异性t细胞群,所述hiv蛋白包括但不限于,杀灭颗粒,病毒样颗粒,hiv肽或肽片段,重组病毒载体,重组细菌载体,纯化的亚基或质粒dna,其与合适的载剂和/或生物或化学佐剂组合以增强宿主的免疫应答,并且这些方法可以通过使用慢病毒或其他病毒载体的hiv靶向遗传疗法的应用而被进一步增强。
方法
在一方面中,本公开提供了使用病毒载体实现hiv疾病功能性治愈的方法。该方法可以包括免疫疗法以富集hiv特异性cd4t细胞群,然后进行慢病毒转导以按需递送cxcr4和ccr5和hiv抑制剂。重要地是,即使没有预先免疫步骤,hiv特异性cd4t细胞的富集和慢病毒转导也可以是有效的。
在实施方式中,该方法包括治疗性免疫作为富集hiv特异性cd4t细胞群的方法,其中免疫与输注经刺激的细胞至对象同时发生或在其之后进行。治疗性免疫可以包括纯化的蛋白质,灭活的病毒,病毒载体化蛋白(virallyvectoredprotein),细菌载体化蛋白(bacteriallyvectoredprotein),肽或肽片段,病毒样颗粒(vlp),包含细胞因子和/或趋化因子的生物或化学佐剂,载剂,和用于免疫的方法。
治疗性疫苗可以包括具有代表治疗发生地理区域的主要病毒类型的序列的一种或多种hiv蛋白。治疗性疫苗将包括纯化的蛋白质,灭活的病毒,病毒载体化蛋白,细菌载体化蛋白,肽或肽片段,病毒样颗粒(vlp),包含细胞因子和/或趋化因子的生物或化学佐剂,载剂,和用于免疫的方法。疫苗接种可以根据本领域已知的标准方法给予,并且hiv患者在免疫和后续的离体淋巴细胞培养(包括慢病毒转导)的间隔期间可以继续进行抗逆转录病毒疗法。
在某些实施方式中,可以用hiv疫苗对hiv+患者进行免疫,使hiv特异性cd4t细胞的频率增加约2、约25、约250、约500、约750、约1000、约1250或约1500倍(或者这些值之间的任何数值)。疫苗可以是任何临床使用的或实验性的hiv疫苗,包括公开的用作疫苗递送系统的慢病毒,其他病毒载体或其他细菌载体。在其他实施方式中,载体可以编码病毒样颗粒(vlp)以诱导中和抗体的更高效价和更强的hiv特异性t细胞响应。在另一实施方式中,载体可以编码与hiv相关的肽或肽片段,包括但不限于gag,pol和env,tat,rev,nef,vif,vpr,vpu和tev,以及ltr,tar,rre,pe,slip,crs和ins。或者,用于所公开的方法的hiv疫苗可以包括纯化的蛋白质,灭活的病毒,病毒载体化蛋白,细菌载体化蛋白,肽或肽片段,病毒样颗粒(vlp),或包含细胞因子和/或趋化因子的生物或化学佐剂。
例如,外周血单核下表(pbmc)可以通过白细胞单采术获得并经离体处理以获得约1x1010的cd4t细胞,其中约0.1%、约1%、约5%或约10%或约30%的cd4t细胞就抗原应答而言是hiv特异性的,并且借由携带通过所公开的慢病毒载体递送的治疗性转基因而具有hiv抗性。或者,可以分离约1x107,约1x108,约1x109,约1x1010,约1x1011或约1x1012的cd4t细胞用于再刺激。重要地是,可以分离任何和适量的cd4t细胞用于离体再刺激。
分离的cd4t细胞可在采用hiv疫苗抗原进行再刺激期间于适当的培养基中培养,所述hiv疫苗抗原可以或可以不包括存在于先前治疗性疫苗中的抗原。可以添加包含逆转录酶、蛋白酶或整合酶的抑制剂的抗逆转录病毒治疗性药物,以防止延长的离体培养期间病毒再次出现。cd4t细胞再刺激可以用于在培养中富集hiv特异性cd4t细胞的部分。相同的方案还可以用于分析目的,其中通过纯化获得的具有外周血单核细胞的较少血液体积用于鉴定hiv特异性t细胞并检测该亚群频率。
通过将细胞与这样的hiv蛋白接触可以针对hiv特异性cd4t细胞对pbmc部分进行富集,所述hiv蛋白与之前用于体内免疫的疫苗的组分匹配或互补。离体再刺激可以增强hiv特异性cd4t细胞的相对频率约5、约10、约25、约50、约75、约100、约125、约150、约175或约200倍。离体再刺激可以增强hiv特异性cd4t细胞的相对频率,无论是否存在预先免疫步骤。
本文所详述的方法可以包括以离体慢病毒转导和培养离体再刺激cd4t细胞。本文所详述的方法还可以包括在无预先免疫步骤的情况下以离体慢病毒转导和培养离体再刺激cd4t细胞。
因此,在一实施方式中,可以用治疗性抗-hiv慢病毒或其他载剂转导已经针对hiv特异性cd4t细胞富集的再刺激的pbmc部分,并在培养中维持约1-约21天或长达约35天。或者,可以培养细胞约1至约18天,约1至约15天,约1至约12天,约1至约9天,或约3至约7天。因此,转导细胞可以培养约1,约2,约3,约4,约5,约6,约7,约8,约9,约10,约11,约12,约13,约14,约15,约16,约17,约18,约19,约20,约21,约22,约23,约24,约25,约26,约27,约28,约29,约30,约31,约32,约33,约34或约35天。
一旦转导细胞已经被充分培养,将转导的cd4t细胞输注回原始患者。输注可以使用本领已知的各种装置和方法进行。在一些实施方式中,输注可以伴随着使用环磷酰胺或相似化合物的预处理以增加再移植的效率。
在一些实施方式中,可以将ccr5靶向疗法添加到对象的抗逆转录病毒疗法方案中,其在整个治疗过程中持续。ccr5靶向疗法的示例包括但不限于,马拉维诺(maraviroc)(一种ccr5拮抗剂)或雷帕霉素(降低ccr5的免疫抑制剂)。在一些实施方式中,可以中止抗逆转录病毒疗法,并且可以测试对象的病毒反弹。如果没有发生反弹,还可以去除佐剂疗法,并且可以测试对象的病毒反弹。
以减少或不使用包括cart或haart在内的抗逆转录病毒疗法以及减少或不使用佐剂疗法约26周实现持续的病毒抑制可以被认为功能性治愈hiv。功能性治愈的其他定义如本文所述。
公开的方法中所用的慢病毒和其他载体可以编码至少一种,至少两种,至少三种,至少四种或至少五种感兴趣的基因,或至少六种感兴趣的基因,或至少七种感兴趣的基因,或至少八种感兴趣的基因,或至少九种感兴趣的基因,或至少十种感兴趣的基因,或至少十一种感兴趣的基因,或至少十二种感兴趣的基因。考虑到靶向hiv的基因疗法的通用性和治疗潜力,本发明的病毒载体可以编码包括但不限于下述的基因或核酸序列:(i)针对与感染性疾病相关的抗原或由感染性病原体产生的毒素的抗体,(ii)细胞因子,包括白细胞介素,其为免疫细胞生长或功能所需并可以是用于hiv和其他慢性或急性人病毒或细菌病原体情况的免疫失调的治疗剂,(iii)抑制hiv体内生长的因子,包括cd8抑制因子,(iv)趋化因子受体ccr5的突变或缺失,趋化因子受体cxcr4的突变或缺失,或趋化因子cxcr5的突变或缺失,(v)针对与hiv相关的特异性受体或肽或与hiv相关的宿主蛋白的反义dna或rna,(vi)针对与hiv相关的特异性受体或肽或与hiv相关的宿主蛋白的小干扰rna,或(vii)可以用于治疗hiv或aids的各种其他治疗有用的序列。
公开的方法中可以使用的靶向hiv的基因疗法的其他示例包括但不限于,亲和力增强的t细胞受体,cd4t细胞上(或者在cd8t细胞上)的嵌合抗原受体,修饰信号转导途径以避免由病毒蛋白导致的细胞死亡,增加hiv限制性元件的表达,包括rex、samhd1、mxa或mxb蛋白,apobec复合物,trim5-α复合物,束缚蛋白(tetherin)(bst2),和鉴定为能够减少哺乳动物细胞中hiv复制的相似蛋白质。
在一些实施方式中,患者在根据本发明的方法进行治疗的同时可以接受cart或haart。在一些实施方式中,患者在根据本发明的方法进行治疗的之前或之后可以接受cart或haart。在一些实施方式中,在根据本发明的方法的治疗全程维持cart或haart,并且可以监测患者血液中hiv病毒符合以及血液中慢病毒转导的cd4t细胞的频率。优选地,在根据本发明的方法进行治疗之前接受cart或haart的患者在根据本发明的方法的处理后能够中断或减少cart或haart。
出于评价功效的目的,可以确定转导的hiv特异性cd4t细胞(其是基因疗法效果的新型替代标志物)的频率。
组合物
在一个方面中,公开的方面提供了这样的慢病毒载体,所述慢病毒载体能够递送基因构建体以抑制hiv穿入易感细胞。例如,一种作用机制是降低ccr5和/或cxcr4趋化因子受体的mrna水平,并因此降低病毒进入易感细胞的比率。
或者,公开的慢病毒载体可通过降低进入的hiv基因组rna的稳定性而能够抑制感染hiv的细胞的形成。在另一实施方式中,公开的慢病毒载体能够防止潜伏感染细胞产生hiv,其中作用机制是通过包括短同源、小干扰或其他调节性rna种类的抑制性rna的作用导致病毒rna序列的不稳定。
该申请中公开的治疗性慢病毒通常包括两种类型的遗传被载物(cargo)中的至少一种。第一,慢病毒可以编码指导小rna表达的遗传元件,所述小rna能够抑制对于hiv穿入易感细胞十分重要的趋化因子受体ccr5和/或cxcr4的产生。遗传被载物的第二种类型包括能够表达小rna分子靶向hivrna序列的构建体,用于防止逆转录,rna剪接,rna翻译以产生蛋白质,或包装病毒基因组rna用于颗粒产生和传播感染。图3描述了示例性的结构。
如图3(顶图)所示,示例性的构建体可以包括许多部分或组件。例如,在一实施方式中,示例性的lv构建体可以包含下述部分或组件:
·rsv-劳斯氏肉瘤(roussarcoma)病毒长末端重复;
·5’ltr-hiv长末端重复的部分,其可以被截短以在染色体整合后防止载体复制;
·ψ-包装信号,其能够在包装期间将载体rna基因组纳入病毒颗粒;
·rre-rev反应元件可被添加以通过使rna从细胞核移出并进入细胞的胞质来改善来自转基因的表达;
·cppt-聚嘌呤区(tract),其在将转基因整合到宿主细胞染色体之前促进第二链dna合成;
·启动子-启动子从整合的转基因启动rna转录以表达微小-rna簇(或构建体的其他遗传元件),并且在一些是实施方式中,载体可以使用ef-1启动子;
·抗-ccr5-宿主细胞因子ccr5的微小rna靶向信使rna以减少其在细胞表明的表达;
·抗-rev/tat-hivrev和tat编码区之间接合处的微小rna靶向hiv基因组或信使rna,在本申请中有时称其mirnatat或给予相似的描述;
·抗-vif-vif编码区内的微小rna靶向hiv基因组或信使rna;
·wpre-土拨鼠肝炎病毒转录后条件元件,其是可以用于促进细胞核rna转运的其他载体组件;和
·δu33’ltr-hiv3’长末端重复的修饰形式,其中已经使u3区域部分缺失以改善载体的安全性。
本领域技术人员将意识到的是上述组件仅为示例,并且这些组件可以被重组,用其他元件取代或以其他方式改变,包括但不限于,进行核苷酸取代,缺失,添加或突变,只要该构建体能够阻止hiv基因表达并减少感染的扩散。
本发明的载体可以包括上述讨论的遗传载物中的任一种或两种(即,指导基因或小rna(如可以阻止翻译或转录的sirna、shrna或mirna)表达的遗传元件),并且本发明的载体还可以编码其他有用的产物,用于治疗或诊断hiv。例如,在一些实施方式中,这些载体还可以编码绿色荧光蛋白(gfp)用于追踪载体或抗生素抗性基因,从而选择性地维持体内遗传修饰的细胞。
纳入本公开载体的遗传元件的组合并不是受特别限制。例如,载体可以编码单个小rna,两个小rna,三个小rna,四个小rna,五个小rna,六个小rna,七个小rna,八个小rna,九个小rna或十个小rna或十一个小rna或十二个小rna。这类载体还可以编码其他遗传元件,以与小rna协调工作从而防止hiv的表达和感染。
本领域技术人员将理解的是,治疗性慢病毒可以替代启动子区域的选替序列,调节性rna的靶向和调节性rna的类型。此外,本公开的治疗性慢病毒可以包含用于包装慢病毒颗粒的质粒的变化;这些变化是提高体外生产水平所必需的。
慢病毒载体系统
慢病毒病毒体(颗粒)由编码必需病毒蛋白的载体系统表达,以产生病毒体(病毒颗粒)。存在至少一种载体,其含有编码逆转录和整合所必需的慢病毒pol蛋白的核酸序列,其与启动子操作性地连接。在另一个实施方式中,pol蛋白由多种载体表达。还存在含有编码慢病毒gag蛋白的核酸序列的载体,所述慢病毒gag蛋白是形成与启动子操作性连接的病毒衣壳所必需的。在一个实施方式中,该gag核酸序列位于与至少一些pol核酸序列不同的载体上。在另一个实施方式中,gag核酸位于与编码pol蛋白的所有pol核酸序列分开的载体上。
可以对载体进行许多修饰,其用于产生颗粒以使获得野生型回复体的机会进一步最小化。这些包括但不限于ltr的u3区缺失,tat缺失和基质(ma)缺失。
gag,poi和env载体不含有包装慢病毒rna的慢病毒基因组的核苷酸,称为慢病毒包装序列。
形成颗粒的载体优选不含有来自表达包膜蛋白的慢病毒基因组的核酸序列。优选地,使用含有编码与启动子操作性连接的包膜蛋白的核酸序列的单独载体。该env载体也不含慢病毒包装序列。在一个实施方式中,env核酸序列编码慢病毒包膜蛋白。
在另一个实施方式中,包膜蛋白不是来自慢病毒,而是来自不同的病毒。所得颗粒称为假型颗粒。通过适当选择包膜,可以“感染”几乎任何细胞。例如,可以使用编码靶向内吞区室的包膜蛋白的env基因,例如下述病毒的基因:流感病毒,vsv-g,α病毒(西门利克森林病毒,辛德毕斯病毒),沙粒病毒(淋巴细胞脉络丛脑膜炎病毒),黄病毒(蜱传脑炎病毒,登革热病毒,丙型肝炎病毒,gb病毒),弹状病毒(水疱性口炎病毒,狂犬病病毒),副粘病毒(腮腺炎或麻疹)和正粘病毒(流感病毒)。可以优选使用的其他包膜包括来自moloney白血病病毒例如mlv-e,mlv-a和galv的那些。当宿主细胞是原代细胞时,后者的包膜是特别优选的。可以根据所需的宿主细胞选择其他包膜蛋白。例如,靶向特定受体如多巴胺受体可用于脑递送。另一个靶标可以是血管内皮。可以使用丝状病毒包膜靶向这些细胞。例如,埃博拉(ebola)gp通过转录后修饰成为gp和gp2糖蛋白。在另一实施方式中,人们可以使用不同的慢病毒衣壳与假型化包膜。例如,fiv或shiv[美国专利号5,654,195]。shiv假型化载体可以容易地用于动物模型,例如猴子。
如本文详述的,慢病毒载体系统通常包括至少一种辅助质粒,其包含gag,pol或rev基因中的至少一种。可以在单独质粒上提供gag,pol和rev基因中的每一个,或者可以在同一质粒上一起提供一个或多个基因。在一个实施方式中,gag,pol和rev基因在相同质粒上提供(例如,图4)。在另一个实施方式中,gag和pol基因在第一质粒上提供,rev基因在第二质粒上提供(例如,图5)。因此,3-载体和4-载体系统均可用于产生慢病毒,如实施例部分和本文其他地方所述。将治疗性载体,包膜质粒和至少一种辅助质粒转染到包装细胞系中。包装细胞系的非限制性实例是293t/17hek细胞系。当将治疗性载体,包膜质粒和至少一种辅助质粒转染到包装细胞系中时,最终产生慢病毒颗粒。
另一方面,公开了用于表达慢病毒颗粒的慢病毒载体系统。该系统包括如本文所述的慢病毒载体;用于表达经优化用于感染细胞的包膜蛋白的包膜质粒;和用于表达gag,pol和rev基因的至少一种辅助质粒,其中当慢病毒载体、包膜质粒和至少一种辅助质粒被转染到包装细胞系中时,慢病毒颗粒由包装细胞系产生,其中慢病毒颗粒能够抑制趋化因子受体ccr5的产生或能靶向hivrna序列。
在另一方面中,并如本文所详述,在本文中也称之为治疗性载体的慢病毒载体可以包括下述元件:杂合5’长末端重复(rsv/5’ltr)(seqidno:34-35),ψ序列(rna包装位点)(seqidno:36),rre(rev-响应元件)(seqidno:37),cppt(多嘌呤区)(seqidno:38),ef-1α启动子(seqidno:4),mir30ccr5(seqidno:1),mir21vif(seqidno:2),mir185tat(seqidno:3),土拨鼠转录后调节性元件(wpre)(seqidnos:32和80)和δu33’ltr(seqidno:39)。在另一方面,通过取代、缺失或添加方式的序列变异可用于修饰上述序列。
另一方面,如本文所详述,辅助质粒已被设计为包括以下元件:cag启动子(seqidno:41);hiv组件gag(seqidno:43);hiv组件pol(seqidno:44);hivint(seqidno:45);hivrre(seqidno:46);和hivrev(seqidno:47)。另一方面,可以修饰辅助质粒以包括用于表达gag和pol基因的第一辅助质粒,和用于表达rev基因的第二和单独的质粒。在另一方面,通过取代、缺失或添加方式的序列变异可用于修饰上述序列。
另一方面,如本文所详述,包膜质粒被设计为包括从左到右的以下元件:rna聚合酶ii启动子(cmv)(seqidno:60)和水疱性口炎病毒g糖蛋白(vsv-g)(seqidno:62)。在另一方面,通过取代、缺失或添加方式的序列变异可用于修饰上述序列。
在另一个方面,用于慢病毒包装的质粒可以用相似的元件修饰,并且可以在不丧失载体功能的情况下去除内含子序列。例如,以下元件可以代替包含包装系统的质粒中的相似元件:延长因子-1(ef-1),磷酸甘油酸激酶(pgk)和泛素c(ubc)启动子可以取代cmv或cag启动子。sv40聚a和bgh聚a可以代替兔β球蛋白聚a。辅助质粒中的hiv序列可以由不同的hiv株或进化枝构建。vsv-g糖蛋白可被下述病毒的膜糖蛋白取代:猫内源性病毒(rd114),长臂猿白血病病毒(galv),狂犬病毒(fug),淋巴细胞脉络丛脑膜炎病毒(lcmv),甲型鸡瘟流感病毒(fpv),罗斯河甲病毒(rrv),鼠白血病病毒10a1(mlv)或埃博拉病毒(ebov)。
值得注意的是,慢病毒包装系统可以商业获得(例如,来自马里兰州罗克维尔的origene技术公司的lenti-vpak包装试剂盒),并且也可以如本文所述进行设计。此外,替代或修改慢病毒包装系统的各方面以改善任何数量的相关因素(包括慢病毒颗粒的生产效率)在本领域技术人员的技能范围内。
生物试验
在一个方面中,本发明包括用于确定实现功能性治愈的hiv治疗成功的生物试验。通过测量患者中转导的hiv特异性cd4t细胞的频率,这些试验将提供用于测量公开方法的功效的方法。hiv特异性cd4t细胞是可以识别的,因为它们增殖,改变细胞表面标志物的组合,诱导包括磷酸化在内的信号转导途径,或表达特定标志物蛋白,所述特定标志物蛋白可以是细胞因子、趋化因子、半胱天冬酶、磷酸化信号转导分子或其他细胞质和/或核组件。例如,使用标记的单克隆抗体或mrna序列的特定原位扩增识别特定的应答cd4t细胞,其能够使用流式细胞术分选、磁珠分离或抗原特异性cd4t细胞分离的其他公认的方法对hiv特异性细胞进行分选。测试分离的cd4t细胞以确定携带整合的治疗性慢病毒的细胞的频率。还可以使用单细胞测试方法,包括微流体分离与质谱、pcr、elisa或抗体染色结合的单个细胞,以确认对hiv的响应能力以及整合的治疗性慢病毒的存在。
因此,在某些实施方式中,应用根据本发明的治疗(例如,(a)无免疫,(b)离体淋巴细胞培养;(c)用纯化的蛋白质、灭活的病毒、病毒载体化蛋白、细菌载体化蛋白、包含细胞因子和/或趋化因子的生物或化学佐剂、载剂再刺激;和(d)输注富集的、转导的t细胞)后,随后可以对患者进行测试以确定治疗的功效。可以建立细胞产物中用于输注的靶标t细胞的阈值以测量,例如,含有来自治疗性慢病毒的遗传修饰的约1x108hiv特异性cd4t细胞的功能性治愈。或者,阈值可以是患者体内约1x105、约1x106、约1x107、约1x108、约1x109或约1x1010cd4t细胞。
可以使用任何方法确定含有来自治疗性慢病毒的遗传修饰的hiv特异性cd4t细胞,诸如但不限于,流式细胞术,细胞分选,facs分析,dna克隆,pcr,rt-pcr或q-pcr,elisa,fish,western印迹,southern印迹,高通量测序,rna测序,寡核苷酸引物延伸或本领域已知的其他方法。
本领域已知用于定义具有遗传修饰的抗原特异性t细胞的方法。然而,利用这类方法将鉴定hiv特异性t细胞与整合型或非整型基因治疗构建体结合作为功效的标准衡量标准是hiv治疗领域的一个新概念。
剂量和剂型
公开的方法和组合物可以用于在hiv+患者的各个阶段治疗hiv+患者。因此,给药方案可以根据所患者的病症和给药方法而变化。
在一个方面中,hiv特异性疫苗可以在输注的同时给予或者可以在将经刺激的细胞输注到对象后给予。在一个实施方式中,hiv特异性疫苗可以以不同剂量向需要的对象给予。通常,通过肌肉内注射递送的疫苗包括约10μg至约300μg,约25μg至约275μg,约50μg至约250μg,约75μg至约225或约100μg至约200μg的hiv蛋白质,其是由灭活的病毒颗粒、病毒样颗粒或来自重组系统的纯化病毒蛋白制备的或纯化自病毒制剂的完整病毒蛋白。重组病毒或细菌载体可以通过所述途径中的任一种或所有途径给予。肌肉内疫苗将包含约1μg至约100μg,约10μg至约90μg,约20μg至约80μg,约30μg至约70μg,约40μg至约60μg或约50μg的合适佐剂分子并悬浮于每注射剂量0.1-5ml的体积的油、盐水、缓冲液或水中,并且可以是可溶性或乳液制剂。口服、直肠、口腔、生殖器粘膜或鼻内给予的疫苗,包括一些病毒载体化或细菌载体化疫苗、融合蛋白、脂质体制剂或类似制备物,可以含有较高量的病毒蛋白和佐剂。皮肤、真皮下或皮下疫苗利用与口服、直肠或鼻内递送疫苗相似的蛋白质和佐剂量。取决于初次免疫接种的应答,可以使用相同或其他递送途径重复疫苗接种1-5次。间隔可以是免疫接种之间的2-24周。对疫苗注射的免疫应答通过使用elisa或相似的方法测试血清、血浆、阴道分泌物、直肠分泌物、唾液或支气管肺泡灌洗液中的hiv特异性抗体进行测量。这样测试细胞免疫应答,通过用疫苗抗原进行体外刺激,然后对细胞内细胞因子积累进行染色,然后进行流式细胞术或相似的方法,包括淋巴细胞增殖,磷酸化信号转导蛋白的表达或细胞表面活化标志物的变化。剂量的上限根据个体患者来确定,并且将取决于各单独产物或产物批次的毒性/安全性概况。
免疫接种可以进行一次、两次、三次或重复地。例如,用于hiv免疫接种的物质可以每周一次,每隔一周一次,每三周一次,每月一次,每隔一个月,每三个月,每六个月,每九个月,每年一次,每十八个月,每两年,每36个月或每三年一次给予有需要的对象。
离体扩增和富集cd4t细胞后,免疫接种可以在离体淋巴细胞培养/再刺激和注射后进行一次、两次、三次或多次。
在一个实施方式中,用于免疫接种的hiv疫苗以药物组合物给予。在一实施方式中,包含hiv疫苗的药物组合物可以配制成多种鼻、肺、口服、局部或肠胃外剂型用于临床应用。各剂型可包含各种崩解剂,表面活性剂,填充剂,增稠剂,粘合剂,稀释剂如润湿剂或其它药学上可接受的赋形剂。包含hiv疫苗的药物组合物也可以配制用于注射。
用于免疫目的的hiv疫苗组合物可以使用任何药学上可接受的方法给予,例如鼻内,口腔,舌下,口服,直肠,眼,肠胃外(静脉内,皮内,肌肉内,皮下,脑池内(intracisternally)腹膜内),经肺,阴道内,局部(locally)给予,局部(topically)给予,在划痕后局部给予,经粘膜给予,通过气溶胶,或通过口腔或鼻腔喷雾制剂。
此外,hiv疫苗组合物可以配制成任何药学上可接受的剂型,例如固体剂型,片剂,丸剂,锭剂,胶囊,液体分散体,凝胶,气溶胶,肺气雾剂,鼻气雾剂,软膏,乳膏,半-固体剂型和悬浮液。此外,组合物可以是控释制剂,持续释放制剂,速释制剂或其任何组合。此外,组合物可以是透皮递送系统。
在另一实施方式中,包含hiv疫苗的药物组合物可以配制成用于口服给药的固体剂型,并且固体剂型可以是粉末,颗粒,胶囊,片剂或丸剂。在另一实施方式中,固体剂型可包括一种或多种赋形剂,例如碳酸钙,淀粉,蔗糖,乳糖,微晶纤维素或明胶。此外,除赋形剂外,固体剂型还可包括润滑剂,例如滑石或硬脂酸镁。在一些实施方式中,口服剂型可以是立即释放或调节释放形式。调节释放剂型包括控释或延长释放,肠释放等。调节释放剂型中使用的赋形剂是本领域普通技术人员公知的。
在进一步的实施方式中,包含hiv疫苗的药物组合物可以配制成舌下或口含剂型。这样的剂型包括经舌下给予的舌下片剂或溶液组合物,和放置在脸颊和牙龈之间口腔片剂。
在进一步的实施方式中,包含hiv疫苗的药物组合物可以配制成鼻腔剂型。本发明的该剂型包含用于鼻腔递送的溶液,悬浮液和凝胶组合物。
在一实施方式中,药物组合物可以配制成用于口服给药的液体剂型,例如悬浮液,乳液或糖浆。在其他实施方式中,除常用的简单稀释剂如水和液体石蜡外,液体剂型还可包括各种赋形剂,如保湿剂,甜味剂,芳香剂或防腐剂。在具体实施方式中,可以将包含hiv疫苗或药学上可接受的盐的组合物配制成适合给予儿科患者。
在一实施方式中,药物组合物可以配制成用于肠胃外给药的剂型,例如无菌水溶液、悬浮液、乳液、非水溶液或栓剂。在其他实施方式中,非水性溶液或悬浮液可包括丙二醇、聚乙二醇、植物油如橄榄油或可注射的酯如油酸乙酯。对于栓剂的基质,可以使用合成脂肪酸酯(witepsol)、聚乙二醇(macrogol)、吐温61、可可脂、月桂油或甘油处理的明胶等。
药物组合物的剂量可以根据患者的体重、年龄、性别、给药时间和方式,排泄率和疾病的严重程度而变化。
出于再刺激的目的,移出患者的淋巴细胞、pbmc和/或cd4t细胞并对其进行分离用于刺激和培养。分离的细胞可以与相同的hiv疫苗或用于免疫接种的活化剂或不同的hiv疫苗或活化剂接触。在一实施方式中,分离的细胞接触约10ng至5μg的hiv疫苗或活化剂/培养的约106细胞(或任何其他合适的量)。更具体地,分离的细胞可以接触约50ng,约100ng,约200ng,约300ng,约400ng,约500ng,约600ng,约700ng,约800ng,约900ng,约1μg,约1.5μg,约2μg,约2.5μg,约3μg,约3.5μg,约4μg,约4.5μg或5μg的hiv疫苗或活化剂/培养的约106细胞。
活化剂或疫苗对于各体外细胞培养通常使用一次,但是可以在约15至约35天的间隔后重复。例如,可以在约15,约16,约17,约18,约19,约20,约21,约22,约23,约24,约25,约26,约27,约28,约29,约30,约31,约32,约33,约34或约35天进行重复给药。
为了转导富集的、再刺激的细胞,可以用慢病毒载体或如本文所述的其他已知的载体系统转导细胞。经转导的细胞可以接触约1-1,000个病毒基因组(通过含有慢病毒载体的培养液的rt-pcr试验测量)/培养的靶细胞(或任何其他合适的量)。可以使用相同范围的1-1,000病毒基因组/培养的靶细胞重复慢病毒转导1-5次。
细胞富集
在一种方法中,由感染hiv的患者获得诸如t细胞的细胞并在多孔板中含有条件培养基(“cm”)的培养基中培养。可以通过标准方法评估上清液p24gag(“p24”)的水平和病毒rna水平。其cm培养的细胞具有小于1ng/ml峰值p24上清液水平的患者可以是适合在使用或不使用其他抗病毒物质的cm中大规模t细胞扩增的患者。或者,可以向不同的孔中添加不同的药物或感兴趣的药物组合,并且可以通过标准方法评估对于样品中病毒水平的影响。提供适当病毒抑制的这些药物组合是能够用于治疗的组合。确定什么构成了对于特定对象的适当病毒抑制在合格技术人员的能力范围内。为了测试感兴趣药物在病毒扩增中的效果,可以向培养基中添加其他因子诸如抗-cd3抗体以刺激病毒产生。不同于本领域已知的用于感染hiv的细胞样品的培养方法,cm允许培养t细胞为期两个月以上,从而提供一种测定长期药物效果的有效系统。
通过在包含cm的培养基中培养细胞,该方法能够抑制细胞群中hivltr启动子区域驱动的基因表达。cm4中的培养通过改变转录介导蛋白和hiv基因表达调节性元件之间的一种或多种相互作用有可能抑制hivlrt驱动的基因表达。感兴趣的转录介导蛋白包括宿主细胞编码的蛋白质,如ap-1,nfκb,nf-at,irf,lef-1和sp1,和hiv编码的蛋白tat。感兴趣的hiv基因表达调节性元件包括ap-1、nfκb、nf-at、irf、lef-1和sp1的结合位点,以及与tat相互作用的反式作用应答元件(“tar”)。
在优选的实施方式中,感染hiv的细胞获自具有易感(susceptible)转录介导蛋白序列和易感hiv调节性元件序列的对象。在更优选的实施方式中,感染hiv的细胞获自具有野生型转录介导蛋白序列和野生型hiv调节性序列的对象。
富集t细胞的另一种方法利用基于免疫亲和力的选择。该方法可能涉及同时富集或选择第一和第二细胞群,如cd4+和cd8+细胞群。在孵育组合物中,于一定条件下,使包含原代人t细胞的细胞与特异性结合cd4的第一免疫亲和力试剂和特异性结合cd8的第二免疫亲和力试剂接触,由此,免疫亲和力试剂分别特异性地结合样品中细胞表面上的cd4和cd8分子。回收结合第一和/或第二免疫亲和力试剂的细胞,从而生成含有cd4+细胞和cd8+细胞的富集的组合物。该方法可以包括用次优产出浓度的第一和/或第二亲和力试剂孵育组合物。值得注意的是,在一些实施方式中,转导细胞是混合的t细胞群,并且在一些其他实施方式中,转导细胞不是混合的t细胞群。
在一些实施方式中,采用基于免疫亲和力的选择,其中固体支持物是球体,如珠,如微珠或纳米珠。在其他实施方式中,珠可以是磁珠。在另一实施方式中,抗体包含一种或多种结合伴侣,其能够与固定在固体表面(如球体或色谱基质)上的结合试剂形成可逆键,其中抗体被可逆地固定于固体表面。在一些实施方式中,通过破坏结合试剂和结合伴侣之间的可逆结合,能够从基质回收表达被所述基质上抗体特异性结合的细胞表面标志物的细胞。在一些实施方式中,结合试剂为链霉亲和素或链霉亲和素类似物或突变体。
造血系统的原代细胞和/或造血干细胞的稳定转导可以这样获得,通过使细胞表面与慢病毒载体和结合细胞表面的至少一种分子体外或离体接触。可以在包括两层或多层的通气容器中在有益于生长和/或增殖的条件下培养细胞。在一些实施方式中,该方法可以与非-cd4+t细胞消耗和/或广泛多克隆扩增联用。
在t细胞富集的另一方法中,用肽刺激pbmc并针对分泌细胞因子如干扰素-γ的细胞富集。该方法通常涉及用抗原刺激含有t细胞的细胞混合物,并根据抗原刺激的细胞被产品标记的程度影响抗原刺激的细胞的分离。抗原刺激通过在有效引发至少一种t细胞的抗原特异性刺激的条件下将细胞暴露于至少一种抗原实现。用产物进行标记这样实现:通过修饰细胞表面以包含至少一个捕获部分,在产物分泌、释放并特异性结合(“捕获”或“包埋”)所述捕获部分的条件下培养细胞;并用标签部分标记捕获的产物,其中标记的细胞不作为标记过程的一部分或作为分离过程的一部分裂解。捕获部分可以包括检测细胞表面糖蛋白cd3或cd4以改善富集步骤并增加特异性+t细胞中抗原特异性t细胞的比例。
给出以下实施例以说明本发明的方面。然而,应该理解的是,本发明不限于这些实施例中描述的具体病症或细节。本文引用的所有印刷出版物均通过引用具体纳入。
实施例
实施例1:慢病毒载体系统的开发
如图3(线性形式)和图4(环状形式)总结开发了慢病毒载体系统。首先参考图3的顶部,已经设计并产生了从左到右具有如下元件的代表性的治疗性载体:杂合5’长末端重复(rsv/5’ltr)(seqidno:34-35),ψ序列(rna包装位点)(seqidno:36),rre(rev-响应元件)(seqidno:37),cppt(多嘌呤道)(seqidno:38),ef-1α启动子(seqidno:4),mir30ccr5(seqidno:1),mir21vif(seqidno:2),mir185tat(seqidno:3),土拨鼠转录后调节性元件(wpre)(seqidnos:32或80)和δu33’ltr(seqidno:39)。图3中详述的治疗性载体在本文还被称为agt103。
然后参考图3的中部,已经设计并产生了从左到右具有如下元件的辅助质粒:cag启动子(seqidno:41);hiv组件gag(seqidno:43);hiv组件pol(seqidno:44);hivint(seqidno:45);hivrre(seqidno:46);和hivrev(seqidno:47)。
然后参考图3的下部,已经设计并产生了从左到右具有如下元件的包膜质粒:rna聚合酶ii启动子(cmv)(seqidno:60)和水疱性口炎病毒g糖蛋白(vsv-g)(seqidno:62)。
在用治疗性载体、包膜质粒和辅助质粒转染后,在293t/17hek细胞(购自弗吉尼亚州玛纳萨斯的美国典型培养物保藏中心(americantypeculturecollection))中产生慢病毒颗粒(如图3所示)。产生功能性病毒颗粒的293t/17hek细胞的转染使用试剂聚(乙烯亚胺)(pei)来提高质粒dna摄取的效率。最初将质粒和dna分别加入不含血清的培养基中,比例为3:1(pei与dna的质量比)。2-3天后,收集细胞培养基,通过高速离心和/或过滤然后阴离子交换色谱来纯化慢病毒颗粒。慢病毒颗粒的浓度可以用转导单位/ml(tu/ml)表示。通过测量培养液中的hivp24水平(p24蛋白掺入慢病毒颗粒),通过定量pcr测量每个细胞的病毒dna拷贝数,或通过感染细胞和使用光(如果载体编码荧光素酶或荧光蛋白标志物)来完成tu的测定。
如上所述,设计了3-载体系统(即2-载体慢病毒包装系统)用于生产慢病毒颗粒。3-载体系统的示意图如图4所示。图4的示意图是之前图3中所述线性系统的环状形式。简而言之,并且参考图4,最顶部的载体是辅助质粒,在该情况下,其包括rev。出现在图4中间的载体是包膜质粒。最底部的载体是前述的治疗性载体。
更具体地参考图4,辅助+rev质粒包括cag增强子(seqidno:40);cag启动子(seqidno:41);鸡β肌动蛋白内含子(seqidno:42);hivgag(seqidno:43);hivpol(seqidno:44);hivint(seqidno:45);hivrre(seqidno:46);hivrev(seqidno:47);和兔β球蛋白聚a(seqidno:48)。
包膜质粒包括cmv启动子(seqidno:60);β球蛋白内含子(seqidno:61);vsv-g(seqidno:62);和兔β球蛋白聚a(seqidno:63)。
合成包含辅助(+rev)和包膜质粒的2-载体慢病毒包装系统。
材料和方法:
辅助质粒的构建:通过对来自含有gag,pol和整合酶基因的pnl4-3hiv质粒(nihaids试剂项目)的dna片段进行初始pcr扩增来构建辅助质粒。设计引物以用ecori和noti限制性位点扩增片段,其可用于插入pcdna3质粒(英杰公司(invitrogen))中的相同位点。正向引物是(5’-taagcagaattcatgaatttgccaggaagat-3’)(seqidno:81),反向引物是(5’-ccatacaatgaatggacactaggcggccgcacgaat-3’)(seqidno:82)。gag,pol,整合酶片段的序列如下所示:
gaattcatgaatttgccaggaagatggaaaccaaaaatgatagggggaattggaggttttatcaaagtaagacagtatgatcagatactcatagaaatctgcggacataaagctataggtacagtattagtaggacctacacctgtcaacataattggaagaaatctgttgactcagattggctgcactttaaattttcccattagtcctattgagactgtaccagtaaaattaaagccaggaatggatggcccaaaagttaaacaatggccattgacagaagaaaaaataaaagcattagtagaaatttgtacagaaatggaaaaggaaggaaaaatttcaaaaattgggcctgaaaatccatacaatactccagtatttgccataaagaaaaaagacagtactaaatggagaaaattagtagatttcagagaacttaataagagaactcaagatttctgggaagttcaattaggaataccacatcctgcagggttaaaacagaaaaaatcagtaacagtactggatgtgggcgatgcatatttttcagttcccttagataaagacttcaggaagtatactgcatttaccatacctagtataaacaatgagacaccagggattagatatcagtacaatgtgcttccacagggatggaaaggatcaccagcaatattccagtgtagcatgacaaaaatcttagagccttttagaaaacaaaatccagacatagtcatctatcaatacatggatgatttgtatgtaggatctgacttagaaatagggcagcatagaacaaaaatagaggaactgagacaacatctgttgaggtggggatttaccacaccagacaaaaaacatcagaaagaacctccattcctttggatgggttatgaactccatcctgataaatggacagtacagcctatagtgctgccagaaaaggacagctggactgtcaatgacatacagaaattagtgggaaaattgaattgggcaagtcagatttatgcagggattaaagtaaggcaattatgtaaacttcttaggggaaccaaagcactaacagaagtagtaccactaacagaagaagcagagctagaactggcagaaaacagggagattctaaaagaaccggtacatggagtgtattatgacccatcaaaagacttaatagcagaaatacagaagcaggggcaaggccaatggacatatcaaatttatcaagagccatttaaaaatctgaaaacaggaaagtatgcaagaatgaagggtgcccacactaatgatgtgaaacaattaacagaggcagtacaaaaaatagccacagaaagcatagtaatatggggaaagactcctaaatttaaattacccatacaaaaggaaacatgggaagcatggtggacagagtattggcaagccacctggattcctgagtgggagtttgtcaatacccctcccttagtgaagttatggtaccagttagagaaagaacccataataggagcagaaactttctatgtagatggggcagccaatagggaaactaaattaggaaaagcaggatatgtaactgacagaggaagacaaaaagttgtccccctaacggacacaacaaatcagaagactgagttacaagcaattcatctagctttgcaggattcgggattagaagtaaacatagtgacagactcacaatatgcattgggaatcattcaagcacaaccagataagagtgaatcagagttagtcagtcaaataatagagcagttaataaaaaaggaaaaagtctacctggcatgggtaccagcacacaaaggaattggaggaaatgaacaagtagataaattggtcagtgctggaatcaggaaagtactatttttagatggaatagataaggcccaagaagaacatgagaaatatcacagtaattggagagcaatggctagtgattttaacctaccacctgtagtagcaaaagaaatagtagccagctgtgataaatgtcagctaaaaggggaagccatgcatggacaagtagactgtagcccaggaatatggcagctagattgtacacatttagaaggaaaagttatcttggtagcagttcatgtagccagtggatatatagaagcagaagtaattccagcagagacagggcaagaaacagcatacttcctcttaaaattagcaggaagatggccagtaaaaacagtacatacagacaatggcagcaatttcaccagtactacagttaaggccgcctgttggtgggcggggatcaagcaggaatttggcattccctacaatccccaaagtcaaggagtaatagaatctatgaataaagaattaaagaaaattataggacaggtaagagatcaggctgaacatcttaagacagcagtacaaatggcagtattcatccacaattttaaaagaaaaggggggattggggggtacagtgcaggggaaagaatagtagacataatagcaacagacatacaaactaaagaattacaaaaacaaattacaaaaattcaaaattttcgggtttattacagggacagcagagatccagtttggaaaggaccagcaaagctcctctggaaaggtgaaggggcagtagtaatacaagataatagtgacataaaagtagtgccaagaagaaaagcaaagatcatcagggattatggaaaacagatggcaggtgatgattgtgtggcaagtagacaggatgaggattaa(seqidno:83)。
接下来,通过mwg操纵子合成含有具有xbai和xmal侧翼限制性位点的rev、rre和兔β球蛋白聚a序列的dna片段。然后将dna片段在xbai和xmai限制性位点处插入质粒中。dna序列如下所示:
tctagaatggcaggaagaagcggagacagcgacgaagagctcatcagaacagtcagactcatcaagcttctctatcaaagcaacccacctcccaatcccgaggggacccgacaggcccgaaggaatagaagaagaaggtggagagagagacagagacagatccattcgattagtgaacggatccttggcacttatctgggacgatctgcggagcctgtgcctcttcagctaccaccgcttgagagacttactcttgattgtaacgaggattgtggaacttctgggacgcagggggtgggaagccctcaaatattggtggaatctcctacaatattggagtcaggagctaaagaatagaggagctttgttccttgggttcttgggagcagcaggaagcactatgggcgcagcgtcaatgacgctgacggtacaggccagacaattattgtctggtatagtgcagcagcagaacaatttgctgagggctattgaggcgcaacagcatctgttgcaactcacagtctggggcatcaagcagctccaggcaagaatcctggctgtggaaagatacctaaaggatcaacagctcctagatctttttccctctgccaaaaattatggggacatcatgaagccccttgagcatctgacttctggctaataaaggaaatttattttcattgcaatagtgtgttggaattttttgtgtctctcactcggaaggacatatgggagggcaaatcatttaaaacatcagaatgagtatttggtttagagtttggcaacatatgccatatgctggctgccatgaacaaaggtggctataaagaggtcatcagtatatgaaacagccccctgctgtccattccttattccatagaaaagccttgacttgaggttagattttttttatattttgttttgtgttatttttttctttaacatccctaaaattttccttacatgttttactagccagatttttcctcctctcctgactactcccagtcatagctgtccctcttctcttatgaagatccctcgacctgcagcccaagcttggcgtaatcatggtcatagctgtttcctgtgtgaaattgttatccgctcacaattccacacaacatacgagccggaagcataaagtgtaaagcctggggtgcctaatgagtgagctaactcacattaattgcgttgcgctcactgcccgctttccagtcgggaaacctgtcgtgccagcggatccgcatctcaattagtcagcaaccatagtcccgcccctaactccgcccatcccgcccctaactccgcccagttccgcccattctccgccccatggctgactaattttttttatttatgcagaggccgaggccgcctcggcctctgagctattccagaagtagtgaggaggcttttttggaggcctaggcttttgcaaaaagctaacttgtttattgcagcttataatggttacaaataaagcaatagcatcacaaatttcacaaataaagcatttttttcactgcattctagttgtggtttgtccaaactcatcaatgtatcttatcagcggccgccccggg(seqidno:84)。
最后,用cag增强子/启动子和鸡β肌动蛋白内含子序列替换pcdna3.1的cmv启动子。通过mwg操纵子合成含有具有mlui和ecori侧翼限制性位点的cag增强子/启动子/内含子序列的dna片段。然后将dna片段在mlui和ecori限制性位点处插入质粒中。dna序列如下:
acgcgttagttattaatagtaatcaattacggggtcattagttcatagcccatatatggagttccgcgttacataacttacggtaaatggcccgcctggctgaccgcccaacgacccccgcccattgacgtcaataatgacgtatgttcccatagtaacgccaatagggactttccattgacgtcaatgggtggactatttacggtaaactgcccacttggcagtacatcaagtgtatcatatgccaagtacgccccctattgacgtcaatgacggtaaatggcccgcctggcattatgcccagtacatgaccttatgggactttcctacttggcagtacatctacgtattagtcatcgctattaccatgggtcgaggtgagccccacgttctgcttcactctccccatctcccccccctccccacccccaattttgtatttatttattttttaattattttgtgcagcgatgggggcggggggggggggggcgcgcgccaggcggggcggggcggggcgaggggcggggcggggcgaggcggagaggtgcggcggcagccaatcagagcggcgcgctccgaaagtttccttttatggcgaggcggcggcggcggcggccctataaaaagcgaagcgcgcggcgggcgggagtcgctgcgttgccttcgccccgtgccccgctccgcgccgcctcgcgccgcccgccccggctctgactgaccgcgttactcccacaggtgagcgggcgggacggcccttctcctccgggctgtaattagcgcttggtttaatgacggctcgtttcttttctgtggctgcgtgaaagccttaaagggctccgggagggccctttgtgcgggggggagcggctcggggggtgcgtgcgtgtgtgtgtgcgtggggagcgccgcgtgcggcccgcgctgcccggcggctgtgagcgctgcgggcgcggcgcggggctttgtgcgctccgcgtgtgcgcgaggggagcgcggccgggggcggtgccccgcggtgcgggggggctgcgaggggaacaaaggctgcgtgcggggtgtgtgcgtgggggggtgagcagggggtgtgggcgcggcggtcgggctgtaacccccccctgcacccccctccccgagttgctgagcacggcccggcttcgggtgcggggctccgtgcggggcgtggcgcggggctcgccgtgccgggcggggggtggcggcaggtgggggtgccgggcggggcggggccgcctcgggccggggagggctcgggggaggggcgcggcggccccggagcgccggcggctgtcgaggcgcggcgagccgcagccattgccttttatggtaatcgtgcgagagggcgcagggacttcctttgtcccaaatctggcggagccgaaatctgggaggcgccgccgcaccccctctagcgggcgcgggcgaagcggtgcggcgccggcaggaaggaaatgggcggggagggccttcgtgcgtcgccgcgccgccgtccccttctccatctccagcctcggggctgccgcagggggacggctgccttcgggggggacggggcagggcggggttcggcttctggcgtgtgaccggcgggaattc(seqidno:85)。
构建vsv-g包膜质粒:
水泡性口炎印第安纳病毒糖蛋白(vsv-g)序列由mwg操纵子合成,具有侧翼ecori限制性位点。然后将dna片段在ecori限制性位点插入pcdna3.1质粒(英杰公司),并使用cmv特异性引物通过测序确定正确的方向。dna序列如下:
gaattcatgaagtgccttttgtacttagcctttttattcattggggtgaattgcaagttcaccatagtttttccacacaaccaaaaaggaaactggaaaaatgttccttctaattaccattattgcccgtcaagctcagatttaaattggcataatgacttaataggcacagccttacaagtcaaaatgcccaagagtcacaaggctattcaagcagacggttggatgtgtcatgcttccaaatgggtcactacttgtgatttccgctggtatggaccgaagtatataacacattccatccgatccttcactccatctgtagaacaatgcaaggaaagcattgaacaaacgaaacaaggaacttggctgaatccaggcttccctcctcaaagttgtggatatgcaactgtgacggatgccgaagcagtgattgtccaggtgactcctcaccatgtgctggttgatgaatacacaggagaatgggttgattcacagttcatcaacggaaaatgcagcaattacatatgccccactgtccataactctacaacctggcattctgactataaggtcaaagggctatgtgattctaacctcatttccatggacatcaccttcttctcagaggacggagagctatcatccctgggaaaggagggcacagggttcagaagtaactactttgcttatgaaactggaggcaaggcctgcaaaatgcaatactgcaagcattggggagtcagactcccatcaggtgtctggttcgagatggctgataaggatctctttgctgcagccagattccctgaatgcccagaagggtcaagtatctctgctccatctcagacctcagtggatgtaagtctaattcaggacgttgagaggatcttggattattccctctgccaagaaacctggagcaaaatcagagcgggtcttccaatctctccagtggatctcagctatcttgctcctaaaaacccaggaaccggtcctgctttcaccataatcaatggtaccctaaaatactttgagaccagatacatcagagtcgatattgctgctccaatcctctcaagaatggtcggaatgatcagtggaactaccacagaaagggaactgtgggatgactgggcaccatatgaagacgtggaaattggacccaatggagttctgaggaccagttcaggatataagtttcctttatacatgattggacatggtatgttggactccgatcttcatcttagctcaaaggctcaggtgttcgaacatcctcacattcaagacgctgcttcgcaacttcctgatgatgagagtttattttttggtgatactgggctatccaaaaatccaatcgagcttgtagaaggttggttcagtagttggaaaagctctattgcctcttttttctttatcatagggttaatcattggactattcttggttctccgagttggtatccatctttgcattaaattaaagcacaccaagaaaagacagatttatacagacatagagatgagaattc(seqidno:86)。
还使用本文所述的方法和材料设计和生产了4-载体系统(即,3-载体慢病毒包装系统)。4-载体系统的示意图如图5所示。简而言之,并且参考图5,最顶部的载体是辅助质粒,在该情况下,其不包括rev。上数第二个载体是单独的rev质粒。下数第二个载体是包膜质粒。最底部的载体是前述的治疗性载体。
部分地参考图5,辅助质粒包括cag增强子(seqidno:49);cag启动子(seqidno:50);鸡β肌动蛋白内含子(seqidno:51);hivgag(seqidno:52);hivpol(seqidno:53);hivint(seqidno:54);hivrre(seqidno:55);和兔β球蛋白聚a(seqidno:56)。
rev质粒包含rsv启动子(seqidno:57);hivrev(seqidno:58);和兔β球蛋白聚a(seqidno:59)。
包膜质粒包括cmv启动子(seqidno:60);β球蛋白内含子(seqidno:61);vsv-g(seqidno:62);和兔β球蛋白聚a(seqidno:63)。
合成包含辅助、rev和包膜质粒的3-载体慢病毒包装系统。
材料和方法:
无rev的辅助质粒的构建:
通过插入含有rre和兔β球蛋白聚a序列的dna片段构建不含rev的辅助质粒。该序列由mwg操纵子合成,具有侧翼xbai和xmai限制性位点。然后将rre/兔聚aβ球蛋白序列在xbai和xmai限制性位点插入辅助质粒中。
dna序列如下所示:
tctagaaggagctttgttccttgggttcttgggagcagcaggaagcactatgggcgcagcgtcaatgacgctgacggtacaggccagacaattattgtctggtatagtgcagcagcagaacaatttgctgagggctattgaggcgcaacagcatctgttgcaactcacagtctggggcatcaagcagctccaggcaagaatcctggctgtggaaagatacctaaaggatcaacagctcctagatctttttccctctgccaaaaattatggggacatcatgaagccccttgagcatctgacttctggctaataaaggaaatttattttcattgcaatagtgtgttggaattttttgtgtctctcactcggaaggacatatgggagggcaaatcatttaaaacatcagaatgagtatttggtttagagtttggcaacatatgccatatgctggctgccatgaacaaaggtggctataaagaggtcatcagtatatgaaacagccccctgctgtccattccttattccatagaaaagccttgacttgaggttagattttttttatattttgttttgtgttatttttttctttaacatccctaaaattttccttacatgttttactagccagatttttcctcctctcctgactactcccagtcatagctgtccctcttctcttatgaagatccctcgacctgcagcccaagcttggcgtaatcatggtcatagctgtttcctgtgtgaaattgttatccgctcacaattccacacaacatacgagccggaagcataaagtgtaaagcctggggtgcctaatgagtgagctaactcacattaattgcgttgcgctcactgcccgctttccagtcgggaaacctgtcgtgccagcggatccgcatctcaattagtcagcaaccatagtcccgcccctaactccgcccatcccgcccctaactccgcccagttccgcccattctccgccccatggctgactaattttttttatttatgcagaggccgaggccgcctcggcctctgagctattccagaagtagtgaggaggcttttttggaggcctaggcttttgcaaaaagctaacttgtttattgcagcttataatggttacaaataaagcaatagcatcacaaatttcacaaataaagcatttttttcactgcattctagttgtggtttgtccaaactcatcaatgtatcttatcacccggg(seqidno:87)。
rev质粒的构建:
rsv启动子和hivrev序列由mwg操纵子合成为单个dna片段,具有侧翼mfel和xbai限制性位点。然后将dna片段在mfe和xbai限制性位点插入pcdna3.1质粒(英杰公司)中,其中cmv启动子被rsv启动子取代。dna序列如下:
caattgcgatgtacgggccagatatacgcgtatctgaggggactagggtgtgtttaggcgaaaagcggggcttcggttgtacgcggttaggagtcccctcaggatatagtagtttcgcttttgcatagggagggggaaatgtagtcttatgcaatacacttgtagtcttgcaacatggtaacgatgagttagcaacatgccttacaaggagagaaaaagcaccgtgcatgccgattggtggaagtaaggtggtacgatcgtgccttattaggaaggcaacagacaggtctgacatggattggacgaaccactgaattccgcattgcagagataattgtatttaagtgcctagctcgatacaataaacgccatttgaccattcaccacattggtgtgcacctccaagctcgagctcgtttagtgaaccgtcagatcgcctggagacgccatccacgctgttttgacctccatagaagacaccgggaccgatccagcctcccctcgaagctagcgattaggcatctcctatggcaggaagaagcggagacagcgacgaagaactcctcaaggcagtcagactcatcaagtttctctatcaaagcaacccacctcccaatcccgaggggacccgacaggcccgaaggaatagaagaagaaggtggagagagagacagagacagatccattcgattagtgaacggatccttagcacttatctgggacgatctgcggagcctgtgcctcttcagctaccaccgcttgagagacttactcttgattgtaacgaggattgtggaacttctgggacgcagggggtgggaagccctcaaatattggtggaatctcctacaatattggagtcaggagctaaagaatagtctaga(seqidno:88)。
可以用相似的元件修饰用于2-载体和3-载体包装系统的质粒,并且可以在不损失载体功能的情况下去除内含子序列。例如,以下元件可以替换2载体和3载体包装系统中的类似元件:
启动子:延长因子-1(ef-1)(seqidno:64),磷酸甘油酸激酶(pgk)(seqidno:65)和泛素c(ubc)(seqidno:66)可以替代cmv(seqidno:60)或cag启动子(seqidno:100)。
聚a序列:sv40聚a(seqidno:67)和bgh聚a(seqidno:68)可以替代兔β球蛋白聚a(seqidno:48)。
hivgag,pol和整合酶序列:辅助质粒中的hiv序列可以由不同的hiv株或进化枝构建。例如,来自bal株的hivint(seqidno:71);hivgag(seqidno:69);hivpol(seqidno:70)可以与本文所述的辅助质粒/辅助+rev质粒中包含的gag,pol和int序列互换。
包膜:vsv-g糖蛋白可以被来自下述病毒的膜糖蛋白取代:猫内源病毒(rd114)(seqidno:72)、长臂猿白血病病毒(galv)(seqidno:73)、狂犬病毒(fug)(seqidno:74),淋巴细胞脉络丛脑膜炎病毒(lcmv)(seqidno:75),甲型鸡瘟流感病毒(fpv)(seqidno:76),罗斯河甲病毒(rrv)(seqidno:77),小鼠白血病病毒10a1(mlv)(seqidno:78),或埃博拉病毒(ebov)(seqidno:79)。这些包膜的序列在本文的序列部分中标识。
总之,可以对3-载体对比4-载体系统进行比较和对比。3-载体慢病毒载体系统包含:1.辅助质粒:hivgag,pol,整合酶和rev/tat;2.包膜质粒:vsv-g/fug包膜;和3.治疗性载体:rsv5'ltr,ψ包装信号,gag片段,rre,env片段,cppt,wpre和3'δltr。4-载体慢病毒载体系统包含:1.辅助质粒:hivgag,pol,和整合酶;2.rev质粒:rev;3.包膜质粒:vsv-g/fug包膜;和4.治疗性载体:rsv5'ltr,ψ包装信号,gag片段,rre,env片段,cppt,wpre和3'δltr。与上述元件相对应的序列在本文的序列表部分中标识。
实施例2:抗-hiv慢病毒载体的开发
该实施例的目的是开发抗-hiv慢病毒载体。
抑制性rna设计:使用智人(homosapiens)趋化因子c-c基序受体5(ccr5)(gc03p046377)mrna的序列来检索潜在的sirna或shrna候选物以敲减人细胞中的ccr5水平。潜在的rna干扰序列选自sirna或shrna设计程序选择的候选物,如来自broad研究所或来自赛默飞世尔科技公司(thermoscientific)的block-itrnai设计器。将单独选择的shrna序列插入慢病毒载体,紧邻rna聚合酶iii启动子如h1、u6或7sk的3',以调节shrna表达。将这些慢病毒shrna构建体用于转导细胞并测量特定mrna水平的变化。将最有效降低mrna水平的shrna单独包埋在微小rna骨架内,以允许通过cmv或ef-1αrna聚合酶ii启动子表达。微小rna骨架选自mirbase.org。还将rna序列合成为合成的sirna寡核苷酸,并在不使用慢病毒载体的情况下直接导入细胞。
使用人免疫缺陷病毒1型的bal株的基因组序列(hiv-185us_bal,访问号ay713409)来检索潜在的sirna或shrna候选物以敲减人细胞中的hiv复制水平。基于序列同源性和经验,该研究的重点是hivtat和vife基因区域,虽然本领域技术人员将理解的是使用这些区域的使用是非限制性的并且可以选择其他潜在的靶标。重要的是,gag或聚合酶基因高度保守区域不可能被shrna靶向,因为这些相同序列存在于载体制造所需的包装系统互补质粒。至于ccr5(nm000579.3,nm001100168.1特异性)rna,潜在的hiv特异性rna干扰序列选自sirna或shrna设计程序选择的候选物,如来自broad研究所设立的gene-e软件包(broadinstitute.org/mai/public)或来自赛默飞世尔科技公司的block-itrnai设计器(rnadesigner.thermofisher.com/rnaiexpress/setoption.do?designoption=shrna&pid=6712627360706061801)。将单独选择的shrna序列插入慢病毒载体,紧邻rna聚合酶iii启动子如h1、u6或7sk的3',以调节shrna表达。将这些慢病毒shrna构建体用于转导细胞并测量特定mrna水平的变化。将最有效降低mrna水平的shrna单独包埋在微小rna骨架内,以允许通过cmv或ef-1αrna聚合酶ii启动子表达。
载体构建。对于ccr5、tat或vifshrna,通过eurofinsmwg操纵子(eurofinsmwgoperon)有限公司合成含有bamhi和ecori限制性位点的寡核苷酸序列。将重叠的有义和反义寡核苷酸序列混合并在从70摄氏度冷却至室温的过程中退火。用限制酶bamhi和ecori在37摄氏度下消化慢病毒载体1小时。通过琼脂糖凝胶电泳纯化消化的慢病毒载体,并使用英杰公司的dna凝胶提取试剂盒从凝胶中提取。确定dna浓度,并混合载体与寡核苷酸(3:1比例),使其退火,并连接。用t4dna连接酶在室温下进行连接反应30分钟。将2.5微升的连接混合物加入到25微升stbl3感受态细菌细胞中。在42摄氏度的热激后实现转化。将细菌细胞涂布在含有氨苄青霉素的琼脂平板上并回收抗药性菌落(表明存在氨苄青霉素抗性质粒),并在lb肉汤中纯化和扩增。为了检查寡核苷酸序列的插入,用英杰公司dna小制备试剂盒从收获的细菌培养物中提取质粒dna。慢病毒载体中shrna序列的插入通过这样的dna测序验证,所述dna测序使用用于调节shrna表达的启动子的特异性引物。确定限制hiv复制的示例性载体序列可见于图6。例如,然后将对ccr5、tat或vif基因表达具有最高获悉的shrna序列在ef-1α启动子的控制下组装到微小rna(mir)簇中。启动子和mir如图6所示。
然后,使用标准分子生物学技术(例如,sambrook;《分子克隆:实验室手册》(molecularcloning:alaboratorymanual),第4版)以及本文所述的技术,开发了一系列慢病毒载体,如本文图7所述。
开发了载体1,其从左到右包含:长末端重复(ltr)部分(seqidno:35);h1元件(seqidno:101);shccr5(seqidno:16、18、20、22或24);土拨鼠肝炎病毒(wpre)的转录后调节元件(seqidno:32、80);和长末端重复部分(seqidno:102)。
开发了载体2,其从左到右包含:长末端重复(ltr)部分(seqidno:35);h1元件(seqidno:101);shrev/tat(seqidno:10);h1元件(seqidno:101);shccr5(seqidno:16、18、20、22或24);土拨鼠肝炎病毒(wpre)的转录后调节元件(seqidno:32、80);和长末端重复部分(seqidno:102)。
开发了载体3,其从左到右包含:长末端重复(ltr)部分(seqidno:35);h1元件(seqidno:101);shgag(seqidno:12);h1元件(seqidno:101);shccr5(seqidno:16、18、20、22或24);土拨鼠肝炎病毒(wpre)的转录后调节元件(seqidno:32、80);和长末端重复部分(seqidno:102)。
开发了载体4,其从左到右包含:长末端重复(ltr)部分(seqidno:35);7sk元件(seqidno:103);shrev/tat(seqidno:10);h1元件(seqidno:101);shccr5(seqidno:16、18、20、22或24);土拨鼠肝炎病毒(wpre)的转录后调节元件(seqidno:32、80);和长末端重复部分(seqidno:102)。
开发了载体5并且其从左到右包含:长末端重复(ltr)部分(seqidno:35);ef1元件(seqidno:4);mir30ccr5(seqidno:1);mir21vif(seqidno:2);mir185tat(seqidno:3);土拨鼠肝炎病毒(wpre)的转录后调节元件(seqidno:32、80);和长末端重复部分(seqidno:102)。
开发了载体6,其从左到右包含:长末端重复(ltr)部分(seqidno:35);ef1元件(seqidno:4);mir30ccr5(seqidno:1);mir21vif(seqidno:2);mir155tat(seqidno:104);土拨鼠肝炎病毒(wpre)的转录后调节元件(seqidno:32、80);和长末端重复部分(seqidno:102)。
开发了载体7,其从左到右包含:长末端重复(ltr)部分(seqidno:35);ef1元件(seqidno:4);mir30ccr5(seqidno:1);mir21vif(seqidno:2);mir185tat(seqidno:3);土拨鼠肝炎病毒(wpre)的转录后调节元件(seqidno:32、80);和长末端重复部分(seqidno:102)。
开发了载体8,其从左到右包含:长末端重复(ltr)部分(seqidno:35);ef1元件(seqidno:4);mir30ccr5(seqidno:1);mir21vif(seqidno:2);mir185tat(seqidno:3);和长末端重复部分(seqidno:102)。
开发了载体9,其从左到右包含:长末端重复(ltr)部分(seqidno:35);cd4元件(seqidno:30);mir30ccr5(seqidno:1);mir21vif(seqidno:2);mir185tat(seqidno:3);土拨鼠肝炎病毒(wpre)的转录后调节元件(seqidno:32、80);和长末端重复部分(seqidno:102)。
载体的开发
应当注意的是,并非为这些实验开发的所有载体都必须按计划发挥作用。更具体地是,针对hiv的慢病毒载体可能包括3个主要组件:1)抑制性rna,以降低靶细胞表面上hiv结合蛋白(受体)的水平,从而阻碍最初的病毒附着和穿入;2)hivtar序列过表达,其将隔离病毒tat蛋白并降低其反式激活病毒基因表达的能力;和3)抑制性rna,其攻击hiv基因组内重要且保守的序列。
对于上述第一点,关键的细胞表面hiv结合蛋白是趋化因子受体ccr5。hiv颗粒通过与cd4和ccr5细胞表面蛋白结合附着于易感t细胞。因为cd4是细胞表面上必不可少的糖蛋白,其对t细胞免疫功能十分重要,所以并不将其选作靶标以操作其表达水平。然而,对于天生ccr5基因无突变纯合型并且完全缺乏受体表达的人而言,除了对少数感染性疾病以及发展出罕见自身免疫的易感性增加外,还能过正常的生活。安全性在该实施例中增强,因为相对较少的全身cd4+t细胞经遗传修饰以降低ccr5表达,并且病原体免疫或控制自身免疫所需的cd4+t细胞不太可能在修饰的细胞中。因此,调控ccr5被认为是相对安全的方式并且是抗-hiv慢病毒载体开发中的主要靶标。
对于上述第二点,病毒tar序列是与病毒tat蛋白紧密结合的hiv基因组rna的高度结构化区域。tat:tar复合物对于高效生成病毒rna十分重要。设想tar区的过表达作为诱饵分子,其将隔离tat蛋白并降低病毒rna的水平。然而,tar被证明对大多数哺乳动物细胞具有毒性,包括用于制造慢病毒颗粒的细胞。此外,tar在其他实验室中抑制病毒基因表达效率低,并且已经不再作为hiv基因疗法的可行组件。
对于第三点,已经确定病毒基因序列满足3个条件:i)在感兴趣地理区域中一系列代表流行病的hiv分离株中,序列是合理保守的;ii)由于病毒载体中抑制性rna的活性而导致的rna水平降低将使相应的蛋白质水平降低足以有意义地减少hiv复制的量;和iii)抑制性rna靶向的一个或多个病毒基因序列不存在于制造过程中包装和组装病毒载体颗粒所需的基因中。最后一点是最重要的,因为具有靶向病毒颗粒自身有效运转所必需的基因的抑制性rna将是完全不利的。在本实施方式中,hivtat和rev基因接合处的序列和hivvif基因内的第二序列已经被抑制性rna靶向。靶向tat/rev具有降低hiv包膜糖蛋白表达的额外益处,因为该区域与hiv基因组中的包膜基因重叠。
用于载体开发和测试的策略首先依赖于鉴定合适的靶标(如本文所述),然后构建表达单个或多个抑制性rna物质的质粒dna,用于在细胞模型中测试,并最终构建含有抑制性rna的慢病毒载体,所述抑制性rna具有已证实的抗hiv功能。测试慢病毒载体的毒性、在体外生产期间的产量和针对hiv降低ccr5表达水平或减少病毒基因产物以抑制病毒复制的效果。
下表2通过多种形式的抑制性构建体显示了直到达到临床候选物的进展。首先,由质粒dna构建体设计并表达shrna(短同源性rna)分子。
如下表2所详述的质粒1-4测试了针对hiv的gag、pol和rt基因的shrna序列。虽然各shrna在细胞模型中具有抑制病毒蛋白表达的活性,但存在两个阻碍进一步开发的重要问题。首先,序列被靶向hiv的实验室分离株,所述实验室分离株不代表目前在北美和欧洲流行的cladebhiv株。其次,这些shrna靶向慢病毒载体包装系统中的关键组件并且在生产期间严重降低载体产量。选择如下表2中详述的质粒5靶向ccr5并提供领导(lead)候选序列。如表2中详述的质粒6、7、8、9、10和11纳入tar序列,并且发现其对于哺乳动物细胞,包括用于慢病毒载体生产的细胞,产生不可接受的毒性。如表2详述的质粒2鉴定能够减少tatrna表达的领导shrna序列。如表2详述的质粒12证明慢病毒载体中表达为微小rna(mir)的shccr5的效力并确认其应当位于最终产物之中。如表2中详述的质粒13证明了慢病毒载体中表达为微小rna(mir)的shvif的效力并确认其应当在最终产物之中。如表2中详述的质粒14证明了慢病毒载体中表达为微小rna(mir)的shtat的效力并确认其应当在最终产物之中。如表2详述的质粒15包含单一启动子表达的mir簇形式的mirccr5、mirtat和mirvif。这些mir并不靶向慢病毒载体包装系统的关键组件,并且被证明对哺乳动物细胞具有可忽略的毒性。簇中的mir对之前经测试的单个mir同样有效,并且总体作用为ccr5-热带hivbal株的复制方面的显著减少。
表2:hiv载体的开发
功能性试验。测试包含ccr5、tat或vifshrna序列以及出于实验目的在cmv立即早期启动子的控制下表达绿色荧光蛋白(gfp)并命名为agt103/cmv-gfp的单个慢病毒载体敲减ccr5、tat或vif表达的能力。在聚凝胺(polybrene)存在或不存在的情况下用慢病毒颗粒转导哺乳动物细胞。在2-4天后收集细胞;分析蛋白质和rna的ccr5、tat或vif表达。这样测试蛋白质水平:通过western印迹试验或通过用特异性荧光抗体标记细胞(ccr5试验),然后进行分析型流式细胞术使用ccr5特异性或同种型对照抗体来比较修饰的和未修饰的细胞荧光。
开始测试慢病毒。t细胞培养基使用补充有10%fbs和1%盘尼西林-链霉素的rpmi1640制造。还提前制备il210,000单位/ml、il-121μg/ml、il-71μg/ml、il-151μg/ml的细胞因子储液。
在用慢病毒转导之前,确定感染性病毒效价并将其用于计算为了适当感染复数(moi)而添加的病毒量。
第0-12天:抗原特异性富集。在第0天,将冷冻保存的pbmc解冻,用10ml37℃培养基以1200rpm洗涤10分钟并以2x106/ml的浓度重悬于37℃培养基。将细胞以0.5ml/孔在24孔板中在37℃下5%co2中培养。为了定义最佳刺激条件,用如下表3所列试剂的组合刺激细胞。
表3
最终浓度:il-2=20单位/ml,il-12=10ng/ml,il-7=10ng/ml,il-15=10ng/ml,肽=5μg/ml单个肽,mvamoi=1。
在第4和8天,向经刺激的细胞添加0.5ml新鲜培养基和所列浓度的细胞因子(所有浓度表示培养中的最终浓度)。
第12-24天:非特异性扩增和慢病毒转导。在第12天,通过移液将经刺激的细胞从培养板移出并以浓度1x106/ml重悬于新鲜t细胞培养基。将重悬的细胞转移至t25培养瓶并按照生产商的说明用
在第14天,以moi20添加agt103/cmv-gfp,并将培养物重新置于孵育器2天。此时,细胞通过移液回收,通过1300rpm离心10分钟收集,重悬于相同体积的新鲜培养基,并再次离心以形成松散的细胞沉淀。使用与上述步骤使用的细胞因子相同的细胞因子将细胞沉淀重悬于新鲜培养基,其中细胞为0.5x106活细胞/ml。
从第14-23天,每隔2天评估细胞的数量并用新鲜培养基将细胞稀释至0.5x106/ml。每次添加细胞因子。
在第24天,收集细胞并将珠从细胞移出。为了移出珠,将细胞转移至合适的试管,将其置于分选磁体2分钟。将含有细胞的上清液转移至新的试管。然后将细胞在新鲜培养基中以1x106/ml培养1天。进行试验以确定抗原特异性t细胞和慢病毒转导的细胞的频率。
为了防止可能的病毒副产物(outgrowth),在刺激的第一天以及培养期间每隔一天向培养物添加安普那韦(amprenavir)(0.5ng/ml)或沙奎那韦(saquinavir)(0.5ng/ml)或其他合适的蛋白酶或整合酶抑制剂。
通过针对ifn-γ的细胞内细胞因子染色检验抗原特异性t细胞。用肽刺激之后或慢病毒转导之后的培养的细胞(1x106细胞/ml)用以下物质刺激:仅培养基(阴性对照)、gag肽(5μg/ml个体肽)或pha((5μg/ml,阳性对照)。4小时后,添加bdgolgiplugtm(1:1000,bd生物科学公司(bdbiosciences))以遏制高尔基体转运。8小时后,洗涤细胞并用胞外(cd3、cd4或cd8;bd生物科学公司)和胞内(ifn-γ;bd生物科学公司)抗体以bdcytofix/cytopermtm试剂盒按照生产商的说明染色。在bdfacscaliburtm流式细胞仪上分析样品。在各实验中包括用适当同种型匹配的抗体标记的对照样品。使用flowjo软件分析数据。
通过gfp+细胞的频率确定慢病毒转导率。转导的抗原特异性t细胞通过cd3+cd4+gfp+ifnγ+细胞的频率确定;包括针对cd3+cd8+gfp+ifnγ+细胞的测试作为对照。
这些结果表明cd4t细胞(靶标t细胞群)可以用这样的慢病毒转导,所述慢病毒被设计成特异性地敲减hiv特异性蛋白质的表达,因此产生对病毒免疫的t细胞的可扩增群体。该实施例作为表明公开的慢病毒构建体可以用于在hiv患者中产生功能性治愈的概念证明。
实施例4:采用实验性载体的ccr5敲减
agtc120是稳定表达大量cd4和ccr5的hela细胞系。agtc120经由或不经由lv-cmv-mcherry(cmv立即早期启动子的控制下表达的红色荧光蛋白)或agt103/cmv-mcherry转导。mcherry荧光蛋白的基因表达受控于cmv(巨细胞病毒立即早期启动子)表达盒。lv-cmv-mcherry载体缺少微小rna簇,宾且agt103/cmv-mcherry表达针对ccr5、vif和tat的治疗性mirna。
如图8a所示,转导效率>90%。7天后,收集细胞并用针对ccr5的荧光单克隆抗体染色,并进行分析性流式细胞术。同种型对照在描述ccr5apc的平均荧光强度(x轴)相对于标准化至模式的细胞数量(y轴)的这些直方图上以灰色示出。针对细胞表面ccr5的染色后,没有用慢病毒处理或用对照慢病毒(仅表达mcherry标志物)处理的细胞显示ccr5密度没有变化,而agt103(右侧)使ccr5染色强度降至几乎同种型对照的水平。在第7天,使用或不使用r5-热带hiv报告子病毒bal-gfp感染细胞。3天后,收集细胞并通过流式细胞术分析。多于90%的细胞被转导。相较于用对照载体感染的细胞,agt103-cmv/cmvmcherry在转导的agtc120细胞中降低ccr5表达并阻断r5-热带hiv感染。
图8b显示了转染的agtc120细胞对hiv感染的相对不敏感性。如上所述,慢病毒载体表达mcherry蛋白,并且同样感染了hiv的转导细胞(表达gfp)在伪彩色流式细胞术点图的右上象限中显示为双阳性细胞。在不存在hiv的情况下(上图),在任何条件下都不存在gfp+细胞。hiv感染后(下图),在不存在慢病毒转导的情况下,56%的细胞被感染,而在用lv-cmv-mcherry转导的agtc120中53.6%的细胞被感染。当用治疗性agt103/cmv-mcherry载体转导细胞时,仅有0.83%的细胞出现在指示其被转导且被感染的双阳性象限中。
将53.62(具有对照载体的双阳性细胞的比例)除以0.83(具有治疗性载体的双阳性细胞的比例)显示agt103在该实验系统中提供了大于65倍抗hiv的保护。
实施例5:通过慢病毒载体中shrna抑制剂序列调节ccr5表达
抑制性rna设计:使用智人(homosapiens)趋化因子受体ccr5(ccr5,nc000003.12)的序列来检索潜在的sirna或shrna候选物以敲减人细胞中的ccr5水平。潜在的rna干扰序列选自sirna或shrna设计程序选择的候选物,如来自broad研究所或来自赛默飞世尔科技公司(thermoscientific)的block-itrnai设计器。将shrna序列插入质粒,紧邻rna聚合酶iii启动子如h1、u6或7sk之后,以调节shrna表达。shrna序列还可以使用相似的启动子插入慢病毒载体或包埋于微小rna骨架内,以允许rna聚合酶ii启动子诸如cmv或ef-1α的表达。rna序列还可以被合成为sirna寡核苷酸并独立于质粒或慢病毒载体利用。
质粒构建:对于ccr5shrna,通过mwg操纵子合成含有bamhi和ecori限制性位点的寡核苷酸序列。寡核苷酸序列通过在70℃孵育然后冷却至室温退火。退火的寡核苷酸经限制性酶bamhi和ecori于37℃消耗1小时,然后将酶于70℃下20分钟灭活。平行地,用限制酶bamhi和ecori在37℃下消化质粒dna1小时。通过琼脂糖凝胶电泳纯化消化的质粒dna,并使用英杰公司的dna凝胶提取试剂盒从凝胶中提取。确定dna浓度,并将质粒与寡核苷酸序列以3:1插入物与载体的比例连接。用t4dna连接酶在室温下进行连接反应30分钟。将2.5μl的连接混合物加入到25μl的stbl3感受态细菌细胞中。转化需要在42℃的热激。将细胞涂布在含有氨苄青霉素的琼脂平板上并在l肉汤中扩增集落。为了检查寡聚体序列的插入,用英杰公司dnaminiprep试剂盒从收获的细菌培养物中提取质粒dna,并通过限制性酶消耗测试。质粒中shrna序列的插入通过dna测序验证,所述dna测序使用用于调节shrna表达的启动子的特异性引物。
ccr5mrna减少的功能性试验:抑制ccr5表达的试验需要共转染两种质粒。第一种质粒包含针对ccr5mrna的5个不同的shrna序列之一。第二种质粒包含人ccr5基因的cdna序列。将质粒共转染到293t细胞中。48小时后,将细胞裂解并使用凯杰公司(qiagen)的rneasy试剂盒提取rna。使用英杰公司的superscript试剂盒由rna合成cdna。然后通过定量rt-pcr使用应用生物系统公司(appliedbiosystems)steponepcr机器对样品进行分析。用来自英杰公司的sybr绿检测ccr5表达,使用正向引物(5’-aggaattgatggcgagaagg-3’)(seqidno:93)和反向引物(5’-ccccaaagaaggtcaaggtaatca-3’)(seqidno:94),采用聚合酶链式反应分析的标准条件。将样品标准化至β肌动蛋白基因表达的mrna,使用正向引物(5’-agcgcggctacagcttca-3’)(seqidno:95)和反向引物(5’-ggcgacgtagcacagcttct-3’)(seqidno:96),采用聚合酶链式反应分析的标准条件。ccr5mrna的相对表达通过其ct值确定,所述ct值被标准化至各样品肌动蛋白信使rna的水平。结果示于图9。
如图9a所示,通过共转染ccr5shrna构建体和表达ccr5的质粒,在293t细胞中测试ccr5敲减。用不靶向任何人基因的错义shrna和表达ccr5的质粒转染对照样品。转染后60小时后,收获样品,并通过定量pcr测量ccr5mrna水平。此外,如图9b所示,用表达ccr5shrna-1(seqidno:16)的慢病毒转导后的ccr5敲减。
实施例6:通过慢病毒载体中shrna抑制剂序列调节hiv组分
抑制性rna设计。
hiv1型rev/tat(5’-gcggagacagcgacgaagagc-3’)(seqidno:9)和gag(5’-gaagaaatgatgacagcat-3’)(seqidno:11)的序列被用于设计:
rev/tat:
(5’gcggagacagcgacgaagagcttcaagagagctcttcgtcgctgtctccgcttttt-3’)(seqidno:10)和
gag:
(5’gaagaaatgatgacagcatttcaagagaatgctgtcatcatttcttcttttt-3’)(seqidno:12)shrna经合成并克隆到质粒中,如上所述。
质粒构建:将rev/tat或gag靶序列插入萤火虫荧光素酶基因的3’utr(未翻译区域),所述萤火虫荧光素酶基因常用作细胞或组织中基因表达的报告物。此外,构建一个质粒以表达rev/tatshrna,并构建第二个质粒以表达gagshrna。质粒构建如上所述。
靶向rev/tat或gagmrna的shrna的功能性试验:使用质粒共转染,我们测试了shrna质粒是否能够降解荧光素酶信使rna并降低共转染细胞中的光发射的强度。shrna对照(错义序列)被用于确定来自荧光素酶转染的细胞的光的最大产量。当含有插入3’-utr(mrna的未翻译区域)的rev/tat靶序列的荧光素酶构建体与rev/tatshrna序列共转染时,光发射减少了将近90%,表明shrna序列的强功能。当在3’-utr中包含gag靶序列的荧光素酶构建体与gagshrna序列共转染时,获得相似的结果。这些结果表明shran序列的有力活性。
如图10a所示,通过293t细胞中的瞬时转染,rev/tat靶基因的敲减由荧光素酶活性的降低度量,所述荧光素酶与3’utr中的靶mrna序列融合。如图10b所示,敲减与荧光素酶基因融合的gag靶基因序列。结果以3个独立的转染实验,各自三个重复的平均值±sd显示。
实施例7:agt103降低tat和vif的表达
用示例性载体agt103/cmv-gfp转染细胞。agt103和其他示例性载体如下表2所限定。
表3
用agt103/cmv-gfp转导t类淋巴母细胞细胞系(cem;ccrf-cem;美国典型培养物保藏中心目录号ccl119)。48小时候后,用编码整个病毒序列的hiv表达质粒转染细胞。24小时候,从细胞提取rna并使用逆转录聚合酶链反应测试完整tat序列的水平。完整tatrna的相对表达水平从对照慢病毒载体存在情况下的大约850下降至agt103/cmv-gfp存在情况下的大约200,总减少>4倍,如图11所示。
实施例8:通过慢病毒载体中合成的微小rna序列调节hiv组分
抑制性rna设计。使用hiv-1tat和vif基因的序列来检索潜在的sirna或shrna候选物以敲减人细胞中的tat或vif水平。潜在的rna干扰序列选自sirna或shrna设计程序选择的候选物,如来自broad研究所或来自赛默飞世尔科技公司(thermoscientific)的block-itrnai设计器。将选定的对tat或vif敲减最有效shrna序列包埋于微小rna骨架内,以允许rna聚合酶ii启动子诸如cmv或ef-1α的表达。rna序列还可以被合成为sirna寡核苷酸并独立于质粒或慢病毒载体利用。
质粒构建:将tat靶序列(5’-tccgcttcttcctgccatag-3’)(seqidno:7)纳入mir185骨架以生成tatmirna
(5’-gggcctggctcgagcagggggcgagggattccgcttcttcctgccatagcgtggtcccctcccctatggcaggcagaagcggcaccttccctcccaatgaccgcgtcttcgtcg-3’)(seqidno:3),将其插入慢病毒载体并在ef-1α启动子的控制下表达。相似地,将vif靶序列
(5’-gggatgtgtacttctgaactt-3’)(seqidno:6)纳入mir21骨架以生成vifmirna
(5’-catctccatggctgtaccaccttgtcgggggatgtgtacttctgaacttgtgttgaatctcatggagttcagaagaacacatccgcactgacattttggtatctttcatctgacca-3’)(seqidno:2),将其插入慢病毒载体并在ef-1α启动子的控制下表达。使用慢病毒载体包装系统在293t细胞中产生获得的表达vif/tatmirna的慢病毒载体。将vif和tatmirna包埋于微小rna簇内,所述微小rna簇包含mirccr5、mirvif和mirtat,均在ef-1启动子控制下表达。
tatmrna累积的mir185tat抑制的功能性试验。将表达mir185tat(lv-ef1-mir-ccr5-vif-tat)的慢病毒载体以等于5的感染复数用于转导293t细胞。转导后24小时,使用lipofectamine2000在标准条件下用表达hiv株nl4-3(pnl4-3)的质粒转染细胞。24小时候,提取rna,并通过rt-pcr使用tat特异性引物测试tat信使rna的水平,并与对照的肌动蛋白mrna水平比较。
vif蛋白累积的mir21vif抑制的功能性试验。将表达mir21vif(lv-ef1-mir-ccr5-vif-tat)的慢病毒载体以等于5的感染复数用于转导293t细胞。转导后24小时,使用lipofectamine2000用表达hiv株nl4-3(pnl4-3)的质粒转染细胞。24小时后,细胞裂解,并测试全部可溶性蛋白以测量vif蛋白的含量。根据已建立的技术通过sds-page分离细胞裂解物。将分离的蛋白质转移至尼龙膜,并用vif特异性单克隆抗体或肌动蛋白对照抗体探测。
如图12a所示,在以对照慢病毒载体或表达合成的mir185tat或mir155tat微小rna的慢病毒载体转导的293t细胞中测试tat敲减。24小时后,用lipofectamine2000转染hiv载体pnl4-324小时,然后提取rna用于采用针对tat的引物的qpcr分析。如图12b所示,在以对照慢病毒载体或表达合成的mir21vif微小rna的慢病毒载体转导的293t细胞中测试vif敲减。24小时后,用lipofectamine2000转染hiv载体pnl4-324小时,然后提取蛋白质用于采用针对hivvif的抗体的免疫印迹分析。
实施例9:通过慢病毒载体中合成的微小rna序列调节ccr5表达
用这样的慢病毒载体转导cem-ccr5细胞,所述慢病毒载体包含针对ccr5的合成的mir30序列(agt103:tgtaaactgagcttgctcta(seqidno:97)、agt103-r5-1:tgtaaactgagcttgctcgc(seqidno:98)或agt103-r5-2:catagattggacttgacac(seqidno:99))。6天后,ccr5表达通过facs分析用偶联apc的ccr5抗体确定,并通过平均荧光强度(mfi)定量。ccr5水平表达为%ccr5,lv-对照设定为100%。agt103和agt103-r5-1的靶序列位于与ccr5靶序列#5相同的区域。agt103-r5-2的靶序列位于与ccr5靶序列#1相同的区域。相较于agt103-r5-1(39%总ccr5)和agt103-r5-2(不降低ccr5水平),agt103(2%总ccr5)在降低ccr5水平方面最为有效。数据在本文图13中显示。
实施例10:通过含有长或短wpre序列的慢病毒载体中的合成微小rna序列调节ccr5的表达
载体构建。慢病毒载体常常需要rna调节元件,用于治疗性基因或基因构建体的最佳表达。常规选择是使用土拨鼠肝炎病毒转录后调节元件(wpre)。我们将包含全长wpre的agt103与包含截短的wpre元件的修饰的agt103载体进行比较,所述全长wpre为:
(5’aatcaacctctgattacaaaatttgtgaaagattgactggtattcttaactatgttgctccttttacgctatgtggatacgctgctttaatgcctttgtatcatgctattgcttcccgtatggctttcattttctcctccttgtataaatcctggttgctgtctctttatgaggagttgtggcccgttgtcaggcaacgtggcgtggtgtgcactgtgtttgctgacgcaacccccactggttggggcattgccaccacctgtcagctcctttccgggactttcgctttccccctccctattgccacggcggaactcatcgccgcctgccttgcccgctgctggacaggggctcggctgttgggcactgacaattccgtggtgttgtcggggaaatcatcgtcctttccttggctgctcgcctgtgttgccacctggattctgcgcgggacgtccttctgctacgtcccttcggccctcaatccagcggaccttccttcccgcggcctgctgccggctctgcggcctcttccgcgtcttcgccttcgccctcagacgagtcggatctccctttgggccgcctccccgcct-3’)(seqidno:32),而截短的wpre元件为(5’aatcaacctctggattacaaaatttgtgaaagattgactgatattcttaactatgttgctccttttacgctgtgtggatatgctgctttaatgcctctgtatcatgctattgcttcccgtacggctttcgttttctcctccttgtataaatcctggttgctgtctctttatgaggagttgtggcccgttgtccgtcaacgtggcgtggtgtgctctgtgtttgctgacgcaacccccactggctggggcattgccaccacctgtcaactcctttctgggactttcgctttccccctcccgatcgccacggcagaactcatcgccgcctgccttgcccgctgctggacaggggctaggttgctgggcactgataattccgtggtgttgtc-3’)(seqidno:80)。
调节细胞表面ccr5表达与载体序列中长对比短wpre元件之关系的功能性试验。将含有长或短wpre元件的agt103用于转导cem-ccr5t细胞,感染复数等于5。转导后6天,收集细胞并用能够检测细胞表面ccr5蛋白的单克隆抗体染色。该抗体与荧光标志物偶联,并且染色的强度与细胞表面的ccr5水平直接成正比。对照慢病毒对细胞表面ccr5水平没有影响,产生具有73.6单位平均荧光强度的单个群体。具有长wpre元件的常规agt103降低ccr5表达至11单位平均荧光强度水平。经修饰纳入短wpre元件的agt103产生具有13单位平均荧光强度的单一细胞群。因此,取代短wpre元件对act103降低细胞表面ccr5表达能力的几乎没有或没有影响。
如图14所示,用含有长或短wpre序列的agt103转导cem-ccr5细胞。6天后,ccr5表达通过facs分析用偶联apc的ccr5抗体确定,并定量为平均荧光强度(mfi)。ccr5水平表达为%ccr5,lv-对照设定为100%。对于具有短(5.5%总ccr5)或长(2.3%总ccr5)wpre序列的agt103,ccr5水平的降低类似。
实施例11:通过具有或不具有wpre序列的慢病毒载体中的合成微小rna序列调节ccr5的表达
载体构建。为了测试agt103下调ccr5表达是否需要wpre,我们构建了不具有wpre元件序列的经修饰的载体。
调节细胞表面ccr5表达与在agt103载体中包含或不包含长wpre元件之关系的功能性试验。为了测试agt103调节ccr5表达水平是否需要wpre,我们用agt103或缺少wpre的经修饰的载体使用等于5的感染复数转导cem-ccr5t细胞。转导后6天,收集细胞并用能够识别细胞表面ccr5蛋白的单克隆抗体染色。该单克隆抗体与荧光标志物直接偶联,并且染色的强度与各细胞表面ccr5的数量直接成正比。慢病毒对照载体对细胞表面ccr5水平没有影响,产生具有164平均荧光强度的均一群体。慢病毒载体(具有长wpre并还表达gfp标志物蛋白的agt103)、缺少gfp但是包含长wpre元件的agt103、或缺少gfp和wpre的agt103对调节细胞表面ccr5表达具有相似的效果。去除gfp后,不能区分具有或不具有wpre元件的agt103调节细胞表面ccr5表达的能力。
用具有或不具有gfp和wpre的agt103转导cem-ccr5细胞。6天后,ccr5表达通过facs分析用偶联apc的ccr5抗体确定,并定量为平均荧光强度(mfi)。ccr5水平表达为%ccr5,lv-对照设定为100%。对于具有(0%总ccr5)或不具有(0%总ccr5)wpre序列的agt103,ccr5水平的降低类似。该数据述于图15。
实施例12:通过慢病毒载体中cd4启动子调节的合成微小rna序列调节ccr5表达
载体构建:构建agt103的修饰形式以测试取代其他启动子用于表达抑制ccr5、vif和tat基因表达的微小rna簇的作用。作为正常的ef-1启动子的替代,我们使用下述序列取代了用于cd4糖蛋白表达的t细胞特异性启动子:
(5’tgttggggttcaaatttgagccccagctgttagccctctgcaaagaaaaaaaaaaaaaaaaaagaacaaagggcctagatttcccttctgagccccaccctaagatgaagcctcttctttcaagggagtggggttggggtggaggcggatcctgtcagctttgctctctctgtggctggcagtttctccaaagggtaacaggtgtcagctggctgagcctaggctgaaccctgagacatgctacctctgtcttctcatggctggaggcagcctttgtaagtcacagaaagtagctgaggggctctggaaaaaagacagccagggtggaggtagattggtctttgactcctgatttaagcctgattctgcttaactttttcccttgactttggcattttcactttgacatgttccctgagagcctggggggtggggaacccagctccagctggtgacgtttggggccggcccaggcctagggtgtggaggagccttgccatcgggcttcctgtctctcttcatttaagcacgactctgcaga-3’)(seqidno:30)。
在降低细胞表面ccr5蛋白表达方面比较ef-1和cd4基因启动子的功能性试验。将通过用cd4基因启动子取代正常的ef-1启动子而修饰的agt103用于转导cem-ccr5t细胞。转导后6天,收集细胞并用能够识别细胞表面ccr5蛋白的单克隆抗体染色。该单克隆抗体与荧光标志物偶联,并且染色强度与细胞表面ccr5蛋白水平直接成正比。对照慢病毒转导导致经ccr5特异性单克隆抗体染色并产生81.7单位的平均荧光强度的cem-ccr5t细胞群。使用cd4基因启动子代替ef-1启动子用于表达微小rna的经修饰的agt103显示出染色的宽分布,平均荧光强度大约等于17.3单位。根据该结果,对于微小rna表达,ef-1启动子至少与cd4基因启动子相似,并且可能优于cd4基因启动子。取决于所需的靶细胞群,ef-1启动子在所有细胞类型中具有活性,而cd4启动子仅在t淋巴细胞中具有活性。
用包含cd4启动子慢病毒载体(agt103)转导cem-ccr5细胞,所述cd4启动子调节针对ccr5、vif和tat的合成微小rna。6天后,ccr5表达通过facs分析用偶联apc的ccr5抗体确定,并定量为平均荧光强度(mfi)。ccr5水平表达为%ccr5,lv-对照设定为100%。在用lv-cd4-agt103转导的细胞中,ccr5水平为总ccr5的11%。这与包含ef1启动子的lv-agt103的观察结果相当。该数据述于图16。
实施例13:检测hivgag特异性cd4t细胞
细胞和试剂。由疫苗公司获得活力冷冻外周血单核细胞(pbmc)。数据以来自参加测试候选hiv治疗性疫苗的早期临床试验(试验注册:clinicaltrials.govnct01378156)的hiv+个体的代表性样品获得。获得两份样品用于“疫苗接种前”和“疫苗接种后”研究。细胞培养产品、补充物和细胞因子来自商业供应商。测试细胞对来自geovax公司的重组修饰型牛痘病毒安卡拉株62b的应答,如thompson,m.,s.l.heath,b.sweeton,k.williams,p.cunningham,b.f.keele,s.sen,b.e.palmer,n.chomont,y.xu,r.basu,m.s.hellerstein,s.kwa和h.l.robinson(2016)."hiv-1感染参与者的dna/mva疫苗接种对抗逆转录病毒治疗具有病毒抑制作用,随后治疗中断:在不控制再发病毒的情况下诱导免疫应答(dna/mvavaccinationofhiv-1infectedparticipantswithviralsuppressiononantiretroviraltherapy,followedbytreatmentinterruption:elicitationofimmuneresponseswithoutcontrolofre-emergentvirus)."plosone11(10):e0163164所述。代表整个hiv-1gag多蛋白的合成肽从geovax获得,获自hiv(gag)ultra肽组从德国柏林的jpt肽科技有限公司(jptpeptidetechnologiesgmbh)(www.jpt.com)获得。hiv(gag)ultra含有150种肽,其各自的长度为15个氨基酸,并重叠11个氨基酸。将其化学合成,然后纯化,并通过液相色谱-质谱分析。这些肽共同代表hivgag多蛋白的主要免疫原性区域,并且设计为在已知hiv株中57.8%的平均覆盖率。肽序列基于来自洛斯阿拉莫斯国家实验室(losalamosnationallaboratory)(http://www.hiv.lanl.gov/content/sequence/newalign/align.html)的hiv序列数据。肽以干燥的三氟乙酸盐形式提供,25微克/肽,并溶于约40微升dmso中,然后用pbs稀释至终浓度。用于检测cd4和细胞质ifn-γ的单克隆抗体获自商业来源,并且用bd法敏进公司(bdpharmingen)细胞内染色试剂盒进行细胞内染色以获得干扰素-γ。将肽重悬于dmso中,并且我们包括仅dmso的对照条件。
检测hiv特异性cd4+t细胞的功能性试验。将冷冻的pbmc解冻,洗涤并重悬于含有10%胎牛血清、补充物和细胞因子的rpmi培养基中。疫苗接种之前或之后收集的培养的pbmc在高尔基体停止(golgistop)试剂存在的情况下,用dmso对照,mvageovax(感染复数等于1个噬斑形成单位/细胞),肽geovax(1微克/ml)或hiv(gag)ultra肽混合物(1微克/ml)处理20小时。收集细胞,洗涤,固定,透化并用对细胞表面cd4或细胞内干扰素-γ具有特异性的单克隆抗体染色。用facscalibur分析流式细胞仪分析染色细胞,并在cd4+t细胞亚组上对数据进行门选。位于加框区域内突出显示的细胞是基于mva或肽刺激后干扰素-γ表达的双阳性的和指定的hiv特异性cd4t细胞。加框区域内的数字显示被鉴定为hiv特异性的总cd4的百分比。我们没有检测到对dmso或mva的强应答。与来自jpt的hiv(gag)ultra肽混合物相比,来自geovax的肽引发更少的应答细胞,但差异小且不显著。
如图17所示,来自疫苗接种之前或之后hiv阳性患者的pbmc用以下物质刺激20小时:dmso(对照)、来自geovax的表达hivgag的重组mva(mvageovax)、来自geovax的gag肽(pepgeovax,在本文中也称为gag肽库1)或来自jpt的gag肽(hiv(gag)ultra肽混合物,在本文中也称为gag肽库2)。使用标准方案通过细胞内染色和流式细胞术检测ifng产生。流式细胞术数据在cd4t细胞上门选。框中捕获的数字是基于细胞因子对抗原特异性刺激的反应而被指定为“hiv特异性”的总cd4t细胞的百分比。
实施例14:hiv特异性cd4t细胞扩增和慢病毒转导
用于富集pbmc以增加hiv特异性cd4t细胞比例并用agt103转导这些细胞以产生细胞产物agt103t的设计和测试方法。该方案设计用于来自接受了治疗性hiv疫苗的hiv阳性患者的pbmc(外周血单核细胞)的体外培养物。在该实施例中,治疗性疫苗由以下部分组成:表达hivgag、pol和env基因的三个剂量的质粒dna,后跟表达相同hivgag、pol和env的两个剂量的mva62-b(改良的牛痘安卡拉株编号62-b)。该方案对疫苗产品不具有特异性,并且在免疫后仅需要足够水平的hiv特异性cd4+t细胞。收集静脉血并通过ficoll-paque密度梯度离心纯化pbmc。或者,可以通过使用抗体混合物和荧光激活的或磁性的珠分选进行的正选择或负选择方法制备pbmc或限定的细胞牵引(cellulartraction)。将纯化的pbmc洗涤并在含有补充物、抗生素和胎牛血清的标准培养基中培养。对于这些培养物,添加了合成肽的库,代表hivgag多蛋白内可能的t细胞表位。通过添加细胞因子白介素-2和白介素-12来补充培养物,所述白介素-2和白介素-12在测试白介素-2和白介素-12,白介素2和白介素-7,白介素2和白介素-15的组合后选择。肽刺激之后是大约12天的培养间隔。在12天培养期间,大约每四天添加一次新鲜培养基和新鲜细胞因子补充剂。
肽刺激间隔旨在增加pbmc培养物中hiv特异性cd4t细胞的频率。这些hiv特异性cd4t细胞通过预先治疗性免疫被激活,并且可以通过合成肽暴露被再次刺激并使其增殖。我们的目标是在肽刺激培养期结束时实现大于或等于1%的总cd4t细胞是hiv特异性的。
在培养的大约第12天,洗涤细胞以除去残留物质,然后用装饰有针对cd4t细胞表面蛋白cd3和cd28的抗体的合成珠刺激。对于t细胞多克隆刺激的这种成熟建立的方法将重新激活细胞并使其对agt103慢病毒转导更易感。慢病毒转导大约在培养的第13天进行,并使用1至5的感染复数。转导后,洗涤细胞以除去残留的慢病毒载体,并在含有白介素-2和白细胞介素-12的培养基中培养,大约每四天添加一次新鲜培养基和细胞因子,直至大约培养的第24天。
在整个培养间隔期间,以大约100nm的浓度添加抗逆转录病毒药物沙奎那韦,以抑制hiv任何可能的生长。
在培养的大约第24天,收获细胞,洗涤,取出样品用于效力和释放测定,然后将剩余的细胞悬浮在冷冻保存培养基中,然后以大约1×1010个细胞/剂量的单个等分物冷冻,各单个等分物将包含大约1×108个用agt103转导的hiv特异性cd4t细胞。
在两种替代效力测定之一中测试细胞产物(agt103t)的效力。效力测定1测试各cd4t细胞基因组拷贝的平均数(整合的agt103载体序列)。为了释放产物,最小效力是各cd4t细胞0.5个基因组拷贝。该试验如下进行:使用磁珠标记的单克隆抗体正选择cd3阳性/cd4阳性t细胞,提取总细胞dna并使用定量pcr反应以检测agt103载体所特有的序列。效力测定2测试hiv特异性cd4t细胞亚群内整合的agt103的基因组拷贝的平均数。该试验通过用代表hivgag蛋白的合成肽的库首先刺激pbmc来实现。然后用能够结合cd4t细胞并还能捕获分泌的干扰素-γ细胞因子的特异性抗体试剂对细胞进行染色。通过磁珠选择捕获cd4阳性/干扰素-γ阳性细胞,制备总细胞dna,并且通过定量pcr反应确定各细胞agt103基因组拷贝的数量。使用测定2的基于效力的释放标准要求agt103细胞产物中存在大于或等于0.5个基因组拷贝/hiv特异性cd4t细胞。
富集和转导来自接受治疗性hiv疫苗的hiv阳性患者的pbmc的hiv特异性cd4t细胞的功能测试。通过肽刺激测定测试治疗性疫苗接种对hiv特异性cd4t细胞频率的作用(图14组图b)。疫苗接种前,该代表性个体中hiv特异性cd4t细胞的频率为0.036%。疫苗接种后,hiv特异性cd4t细胞的频率增加大约2倍,达到0.076%的值。通过细胞质干扰素-γ的胞质积累所鉴定的应答细胞(hiv特异性)仅在特异性肽刺激后检测到。
我们还测试了肽刺激以富集hiv特异性cd4t细胞然后进行agt103转导是否达到我们的目标:在培养物中产生既是hiv特异性又被agt103转导的大约1%的总cd4t细胞。在这种情况中,我们使用了表达绿色荧光蛋白的agt103的实验形式(见gfp)在图14组图c中,肽刺激(hiv(gag)ultra)和agt103转导后的疫苗接种后的培养物证明,1.11%的总cd4t细胞是hiv特异性(基于响应肽刺激表达干扰素-γ)且agt103转导(基于gfp的表达)的。
对来自治疗性hiv疫苗研究的几名患者进行了测试,以评估对肽刺激应答的范围并开始确定在未来人体临床试验中收入基因治疗组的资格标准。图18组图d显示了4个疫苗试验参与者中hiv特异性cd4t细胞的频率,比较了他们在疫苗接种前和接种后的样品。重要的是,在三种情况中,疫苗接种后样品显示大于或等于0.076%的总cd4t细胞的hiv特异性cd4t细胞值。疫苗接种前样品没有预测到达到这个值的能力,因为患者001-004和患者001-006都以0.02%hiv特异性cd4t细胞的疫苗接种前值开始,但其中一个达到了0.12%hiv特异性cd4t细胞的疫苗接种后最终值,而其他人在疫苗接种后未能增加该值。就增加hiv特异性cd4t细胞的频率而言,对疫苗应答良好的相同3位患者在肽刺激和培养后还显示出hiv特异性cd4t细胞的大量富集。在图18组图e所示的3种情况中,肽刺激以及随后的培养生成样品,其中分别为2.07%,0.72%或1.54%的总cd4t细胞是hiv特异性的。这些值表明对治疗性hiv疫苗应答的大多数个体将对肽刺激具有足够大的离体应答,从而使我们的目标成为可能,即实现最终细胞产物中大约1%的总cd4t细胞是hiv特异性且被agt103转导的。
如图18所示,组图a描述了处理方案。组图b显示了用gag肽或dmso对照刺激pbmc20小时。通过经由facs的细胞内染色检测ifnγ产量。门选cd4+t细胞,用于分析。组图c显示cd4+t细胞经扩增并用agt103-gfp转导(使用如图a中所示的方法)。将扩增的cd4+t细胞在没有任何细胞因子的新鲜培养基中静置2天,并用gag肽或dmso对照再刺激20个小时。通过facs检测ifnγ产量和gfp表达。门选cd4+t细胞,用于分析。组图d显示了由如本文所讨论的4名患者检测的hiv特异性cd4+t细胞的频率(ifnγ阳性,疫苗接种前和疫苗接种后)。组图e显示了扩增来自4名患者的疫苗接种后pbmc,以及检查hiv特异性cd4+t细胞。
实施例15:剂量应答
载体构建:构建agt103的修饰形式以测试对于增加agt103的剂量应答及其对细胞表面ccr5水平的作用。修饰agt103以包括在cmv启动子控制下的绿色荧光蛋白(gfp)表达盒。转导细胞表达mir30ccr5mir21vifmir185tat微小rna簇并由于表达gfp而发出绿色光。
增加agt103-gfp的剂量应答和抑制ccr5表达的功能性试验。用agt103-gfp转导cem-ccr5t细胞,使用0至5的感染复数/细胞。用对细胞表面ccr5具有特异性的荧光偶联的(apc)单克隆抗体对转导细胞进行染色。染色强度与各细胞表面ccr5分子的数量成比例。绿色荧光的强度与各细胞整合的agt103-gfp拷贝的数量成比例。
如图19所示,组图a显示了增加agt103-gfp的剂量应答及其对细胞表面ccr5表达的作用。在感染复数等于0.4时,仅有1.04%的细胞既是绿色的(表明转导)并且显示出ccr5表达显著降低。在感染复数等于1时,ccr5低gfp+细胞的数量增加至68.1%/在感染复数等于5时,ccr5低gfp+细胞的数量增加至95.7%。这些数据在图19中以直方图形式呈现,组图b显示了ccr5染色的正态分布群体,其随着agt103-gfp的剂量增加向较低的平均荧光强度移动。agt103-gfp的效力在图19中以图例形式呈现,组图c显示了随着agt103-gfp剂量增加,ccr5表达的抑制百分比。在感染复数等于5时,ccr5表达水平降低超过99%。
实施例16:agt103有效转导原代人cd4+t细胞
用agt103慢病毒载体转导原代cd4t细胞。将含有绿色荧光蛋白标志物(gfp)的经修饰的agt103载体以0.2和5之间的感染复数用于转导纯化的原代人cd4t细胞。
原代人cd4t细胞中agt103转导效率的功能性试验。使用磁珠标记的抗体和标准程序从人pbmc(hiv阴性供体)分离cd4t细胞。用cd3/cd28珠离体刺激纯化的cd4t细胞,并在含有白介素-2的培养基中培养1天,然后进行agt103转导。慢病毒载体剂量(感染复数)与转导效率之间的关系如图20所示,组图a显示了等于0.2的感染复数导致9.27%的cd4阳性t细胞被agt103转导,并且当感染复数等于5时,被agt103转导的cd4阳性t细胞增加至63.1%。除了实现原代cd4阳性t细胞的有效转导外,还需要定量各细胞基因组拷贝的数量。在图20组图b中,通过定量pcr测试来自以多个感染复数转导的原代人cd4t细胞的总细胞dna,以确定各细胞基因组拷贝的数量。在等于0.2的感染复数中,我们测量到0.096个基因组拷贝/细胞,其与a组中9.27%gfp阳性cd4t细胞良好一致。等于1的感染复数产生0.691个基因组拷贝/细胞,而等于5的感染复数产生1.245个基因组拷贝/细胞。
如图20所示,分离自pbmc的cd4+t细胞用cd3/cd28珠加il-2刺激1天,并用各种浓度的agt103转导。2天后,移出珠,并收集cd4+t细胞。如组图a所示,通过facs检测转导细胞的频率(gfp阳性)。如组图b所示,每细胞的载体拷贝数通过qpcr确定。在感染复数(moi)为5时,63%的cd4+t细胞转导有平均1个载体拷贝/细胞。
实施例17:agt103抑制原代cd4+t细胞中的hiv复制
通过用agt103转导细胞保护原代人cd4阳性t细胞免受hiv感染。将治疗性慢病毒agt103以各细胞0.2至5的感染复数用于转导原代人cd4阳性t细胞。然后用不需要细胞表面ccr5穿入的cxcr4-热带hiv株nl4.3攻击转导细胞。该试验测试微小rna对hiv的vif和tat基因就预防原代cd4阳性t细胞中生产性感染方面的效力,但是使用了间接的方法以检测从感染的原代人cd4t细胞释放的hiv的量。
针对原代人cd4阳性t细胞cxcr4-热带hiv感染的agt103保护的功能测定。使用磁珠标记的抗体和标准程序从人pbmc(hiv阴性供体)分离cd4t细胞。用cd3/cd28珠离体刺激纯化的cd4t细胞,并在含有白介素-2的培养基中培养1天,然后使用0.2至5的感染复数进行agt103转导。转导后两天,用hiv株nl4.3攻击cd4阳性t细胞培养物,所述hiv株nl4.3经工程改造以表达绿色荧光蛋白(gfp)。将转导并hiv暴露的原代cd4t细胞培养物维持7天,然后收集含有hiv的无细胞培养液。使用无细胞培养液对高度许可t细胞系c8166进行2天感染。通过检测gfp荧光的流式细胞术测定感染hiv的c8166细胞的比例。对于模拟慢病毒感染,对于nl4.3hiv,0.1感染复数的剂量导致一定量的hiv被释放到培养液中,其能够在15.4%的c8166t细胞中建立生产性感染。对于agt103的0.2感染复数的剂量,该值对于c8166细胞的hiv感染降低至5.3%,并且对于agt103等于1的感染复数导致仅有3.19%的c8166t细胞被hiv感染。在使用等于5的感染复数进行agt103转导后,c8166感染进一步降低至0.62%。用于转导的agt103的量与释放到培养基中的hiv的量之间存在明显的剂量应答关系。
如图21所示,分离自pbmc的cd4+t细胞用cd3/cd28珠加il-2刺激1天,并用各种浓度(moi)的agt103转导。2天后,移出珠,用0.1moi的hivnl4.3-gfp感染cd4+t细胞。24小时后,用pbs洗涤细胞3次,并用il-2(30u/ml)培养7天。在培养结束时,收集上清液以对hiv宽容型细胞系c8166进行2天感染。通过facs检测感染hiv的c8166细胞(gfp阳性)。随着agt103的感染复数增加,存活的hiv减少,如通过c8166细胞较少的感染所观察到的,moi0.2=65.6%,moi1=79.3%,moi5=96%)。
实施例18:agt103保护原代人cd4+t细胞免于hiv诱导的消耗
agt103转导原代人cd4t细胞以保护免受hiv介导的细胞病理学和细胞消耗pbmc获自健康hiv阴性供体并用cd3/cd28珠刺激,然后在含有白介素-2的培养基中培养1天,然后使用0.2至5的感染复数进行agt103转导。
agt103保护原代人cd4t细胞免于hiv介导的细胞病理学的功能测定。用不需要ccr5用于细胞进入的hivnl4.3株(cxcr4-热带)感染agt103转导的原代人cd4t细胞。当使用cxcr4-热带nl4.3时,仅测试vif和tat微小rna对hiv复制的影响。hivnl4.3的剂量为0.1感染复数。感染hiv后一天,洗涤细胞以除去残留的病毒,并在培养基加白介素-2中培养。在14天的培养期间每三天收集一次细胞,然后用对cd4具有特异性的单克隆抗体染色并与荧光标志物偶联以允许测量pbmc中cd4阳性t细胞的比例。用对照慢病毒载体转导的未处理的cd4t细胞或cd4t细胞对hiv攻击高度易感,并且到第14天培养时,pbmc中cd4阳性t细胞的比例低于10%。相反,agt103对于预防由hiv攻击的细胞消耗具有剂量依赖性作用。对于0.2感染复数的agt103剂量,到第14天培养时,超过20%的pbmc是cd4t细胞,并且在以等于5的感染复数的agt103剂量培养到第14天时,该值增加到50%以上的pbmc是cd4阳性t细胞。同样,agt103对人pbmc中hiv细胞病原性存在明显的剂量应答作用。
如图22所示,pbmc用cd3/cd28珠加il-2刺激1天,并用各种浓度(moi)的agt103转导。2天后,移出珠,用0.1moi的hivnl4.3感染细胞。24小时后,细胞用pbs洗涤3次,并用il-2(30u/ml)培养。每3天收集一次细胞,并通过facs分析cd4+t细胞的频率。暴露于hiv14天后,用lv-对照转导的cd4+t细胞减少87%,采用agt103moi0.2的减少60%,采用agt103moi1的减少37%,采用agt103moi5的减少17%。
实施例19:产生针对hiv特异性富集并用agt103/cmv-gfp转导的cd4+t细胞群
针对hiv的治疗性疫苗接种对cd4+、cd8+和cd4+/cd8+t细胞的分布具有最小的影响。如图23a所示,cd4t细胞群在分析性流式细胞术点图的左上象限中显示,并且在疫苗接种系列后从总t细胞的52%变化到57%。这些是代表性数据。
来自hiv治疗性疫苗试验参与者的外周血单核细胞在培养基+/-白介素-2/白介素-12或+/-白介素-7/白介素-15中培养12天。用代表hiv-1整个p55gag蛋白(hiv(gag)ultra肽混合物)的重叠肽(作为t细胞刺激的表位肽来源)刺激一些培养物。这些肽的长度为10-20个氨基酸,并且重叠其长度的20-50%以代表来自hiv-1bal株的整个gag前体蛋白(p55)。可以调整个体肽的组成和序列以补偿主导循环hiv序列的区域变异或在对于接受该疗法的个体患者可获得详细的序列信息时进行上述调整。培养结束时,回收细胞并用抗-cd4或抗-cd8单克隆抗体染色,并在此时门选并显示cd3+群。疫苗接种前或接种后样品的hiv(gag)ultra肽混合物刺激与培养基对照相似,这表明hiv(gag)ultra肽混合物对细胞无毒性并且不作为多克隆有丝分裂原发挥作用。该分析的结果可见于图23b。
hiv(gag)ultra肽混合物和白介素-2/白介素-12提供了抗原特异性cd4t细胞的最佳扩增。如图23c的上组图所示,暴露于hiv(gag)ultra肽混合物的疫苗接种后样本中细胞因子(干扰素-γ)分泌细胞增加。在疫苗接种前样品中,由于暴露于抗原肽,细胞因子分泌细胞从0.43%增加到0.69%。相反,疫苗接种后样品显示,由于肽刺激的结果,细胞因子分泌细胞从总cd4t细胞的0.62%增加到1.76%。这些数据证明了疫苗接种对cd4t细胞对hiv抗原应答的强作用。
最后,agt103/cmv-gfp转导抗原扩增的cd4t细胞产生了hiv特异性和hiv抗性辅助cd4t细胞,这些细胞是输注到患者中作为hiv功能性治愈的一部分所需的(根据其他各方面和在实施方式中,单独使用agt103;例如,临床实施方式可能不包括cmv-gfp区段)。图23c的上组图显示了分析培养物中cd4+t细胞群的结果。图23c的x轴显示了绿色荧光蛋白(gfp)发射,表明个体细胞被agt103/cmv-gfp转导。在疫苗接种后样品中,回收了分泌细胞因子的1.11%的总cd4t细胞,表明所述细胞特异性响应hiv抗原,并且经agt103/cmv-gfp转导。这是目标细胞群和临床产品,旨在用于输注和功能性治愈hiv。藉由抗原刺激期间细胞扩增的效率以及离体培养随后的多克隆扩增阶段,可以产生4×108抗原特异性慢病毒转导的cd4t细胞。这比细胞生产的目标高出4倍,并且将允许实现大约40个细胞/微升血液的抗原特异性和hiv抗性的cd4t细胞计数或大约5.7%的总循环cd4t细胞。
下表4显示了使用所公开的载体和方法离体产生hiv特异性和hiv抗性的cd4t细胞的结果。
实施例20:处理无免疫接种的hiv阳性对象的临床研究
agt103t是一种遗传修饰的自体pbmc,含有≥5x107个hiv特异性cd4t细胞,其也可用agt103慢病毒载体转导。
i期临床试验将测试在这样的成人研究参与者中输注离体修饰的自体cd4t细胞(agt103t)的安全性和可行性,所述成人研究参与者已确认hiv感染,cd4+t细胞计数>600个细胞/mm3血液,并且在使用cart时具有低于200拷贝/毫升血浆的稳定病毒抑制。所有研究参与者将在整个i期临床试验中继续接受其标准的抗逆转录病毒药物治疗。通过提交用于体外测试的血液来筛选研究参与者,以测量响应用代表hiv-1gag多蛋白的重叠合成肽库的刺激的cd4+t细胞的频率。具有≥0.065%总cd4t细胞被指定为gag特异性cd4t细胞的对象参与基因治疗研究并进行白细胞单采术,然后纯化离体培养的pbmc(使用ficoll密度梯度离心或采用抗体的负选择)并用hivgag肽加白介素-2和白介素-12刺激12天,然后用修饰有cd3/cd28双特异性抗体的珠再次刺激。以100nm包含抗逆转录病毒药物沙奎那韦,以防止在离体培养期间出现自体hiv。cd3/cd28刺激后一天用agt103以1至10的感染复数转导细胞。将转导的细胞再培养7-14天,在此期间它们通过多克隆增殖而扩增。通过收获和洗涤细胞结束培养期,留下等分试样用于效力和安全释放试验,并将剩余细胞重悬于冷冻保存培养基中。单个剂量是≤1x1010自体pbmc。效力试验通过表达干扰素-γ来测量对肽刺激应答的cd4t细胞的频率。其他释放标准包括产品必须包括≥0.5x107个hiv特异性cd4t细胞,其也用agt103转导。另一个释放标准是每细胞agt103基因组拷贝的数量不得超过3个。在输注agt103t前5天,对象接受一剂量的布舒富满(busulfuram)(或癌得星(cytoxan)或氟达拉滨(fludarabine)或合适的药物组合)预处理方案,然后输注≤1x1010含有遗传修饰的cd4t细胞的pbmc。
ii期研究将评估agt103t细胞疗法的疗效。ii期研究参与者包括之前在我们i期研究中登记的个体,这些个体被判定已经成功且稳定地移植了遗传修饰的、自体的、hiv特异性的cd4t细胞,并且在如功效评估中所述监测的参数中临床反应被定义为积极变化(1.3)。研究参与者将被要求将马拉维诺添加到他们现有的抗逆转录病毒药物治疗方案中。马拉维诺是一种ccr5拮抗剂,其将增强针对降低ccr5水平的遗传疗法的有效性。一旦马拉维诺方案到位,对象将被要求中断先前的抗逆转录病毒药物治疗方案并仅维持马拉维诺单药治疗28天或直至2个连续每周抽血的血浆病毒rna水平超过10,000/ml。持续的高病毒血症要求参与者根据其hiv护理医师的建议回到其最初具有或不具有马拉维诺的抗逆转录病毒药物方案。
如果参与者在马拉维诺单药治疗中保持hiv抑制(低于2,000vrna拷贝/ml血浆)>28天,那么他们将被要求在4周内逐渐减少马拉维诺给药,然后再进行密集监测28天。通过马拉维诺单药治疗维持hiv抑制的对象被认为具有功能性治愈。即使在马拉维诺戒断后仍保持hiv抑制的受试者也具有功能性治愈。进行6个月的每月监测然后进行不太密集的监测将确定功能性治愈的持久性。
1.1患者选择
纳入标准:
·年龄在18至60岁之间。
·在进入研究之前已经记录了hiv感染。
·必须愿意遵守研究规定的评估;包括在研究期间不改变他们的抗逆转录病毒疗法(除非有医学指示)。
·cd4+t-细胞计数>600细胞/毫米立方(细胞/mm3)
·cd4+t-细胞最低点>400细胞/mm3
·hiv病毒载量>1,000拷贝/毫升(ml)
排除标准:
·任何病毒性肝炎
·急性hiv感染
·hiv病毒载量>1,000,000拷贝/ml
·活跃或近期(前6个月)艾滋病定义的并发症
·进入研究12周内hiv药物的任何变化
·除了成功治疗的皮肤基底细胞癌外,至少5年没有缓解的癌症或恶性肿瘤
·当前诊断为nyha3级或4级充血性心力衰竭或未控制的心绞痛或心律失常
·出血问题的病史
·过去30天内使用了慢性类固醇
·妊娠或哺乳
·积极滥用药物或酒精
·过去30天内病情严重
·当前参与另一临床试验或任何先前的基因治疗
1.2安全评估
·急性输注反应
·输注后安全回访
1.3功效评估–i期
·修饰的cd4t细胞的数量和频率。
·修饰的cd4t细胞的持久性。
·将对gag肽再刺激的体外应答(ics试验)作为记忆t细胞功能的测量。
·多功能抗-hivcd8t细胞应答与疫苗接种前和疫苗接种后时间点比较。
·体外刺激后cd4t细胞产生双重剪接的hivmrna的频率。
1.4功效评估–ii期
·遗传修饰的cd4t细胞的数量和频率。
·使用马拉维诺单药治疗对病毒抑制的维持(<2,000vrna拷贝/毫升,但2个连续周的抽取不超过5x104vrna拷贝/ml)。
·马拉维诺戒断期间和之后持续的病毒抑制。
·稳定的cd4t细胞计数。
实施例21:通过在肽刺激之前消耗cd8+t细胞来生成cd4+t细胞群因为cd8+t细胞过度生长将显著影响靶cd4+t细胞的扩增,所以在细胞扩增开始时消耗cd8+t细胞,以确定它是否会改善cd4+t细胞的扩增。当前的cd8+t细胞消耗方法要求细胞通过磁柱。为了避免该过程对抗原呈递细胞和cd4+t细胞可能的影响,在肽刺激后和慢病毒转导之前进行细胞消耗,此时细胞能够更好地承受机械应力。
更具体地,获得hiv阳性人外周血。用ficoll-paqueplus(ge医疗公司(gehealthcare),目录号17-1440-02)分离pbmc。用pepmixtmhiv(gag)ultra(目录号pm-hiv-gag,德国柏林的jpt肽科技公司(jptpeptidetechnologies))在24孔板中的1ml培养基中刺激新鲜分离的pbmc(1x107)18小时。用pe抗-人cd8抗体和抗-pe微珠消耗cd8+t细胞。将负选择的细胞以2x106/ml在texmacsgmp培养基(目录号:170-076-309,德国贝尔吉施格拉德巴赫的美天旎生物技术公司(miltenyibiotech))中培养,所述培养基包含中含有il-7(170-076-111,德国贝尔吉施格拉德巴赫的美天旎生物技术公司),il-15(170-076-114,德国贝尔吉施格拉德巴赫的美天旎生物技术公司)和沙奎那韦(目录号:4658,nihaids试剂项目,马里兰州德国镇)。24小时候以mo15添加慢病毒agt103。扩增期间,每2-3天添加包含il-7、il-15和沙奎那韦的新鲜培养基。il-7/il-15的最终浓度为10ng/ml。沙奎那韦的最终浓度为100nm。在第12-16天,收集2-3x106个细胞用于肽再刺激和胞内细胞因子染色(ics)分析。图24显示了该消耗方案的示意图。
当cd8+t细胞被消耗时,hiv特异性cd4t细胞扩增被显著改善(图25a-c)。然而,观察到vδ1t细胞(ptid01-006)(图25a)和nk细胞(ptid01-008)(图25c)的过度生长。
参照图25a,在第0天,对照的左下象限、右下象限、左上象限和右上象限的荧光强度分别为44.5%、55.5%、0.032%和0%。在第0天,gagpepmix的左下象限、右下象限、左上象限和右上象限的荧光强度分别为44.2%,55.3%,0.48%和0.053%。在第12天,没有消耗cd8时,对照的左下象限、右下象限、左上象限和右上象限的荧光强度分别为79.8%、20.1%、0.12%和0.018%。在第12天,没有消耗cd8时,gagpepmix的左下象限、右下象限、左上象限和右上象限的荧光强度分别为58.9%、19.2%、21.2%和0.69%。在第12天,消耗cd8时,对照的左下象限、右下象限、左上象限和右上象限的荧光强度分别为64.4%、35.0%、0.44%和0.14%%。在第12天,消耗cd8时,gagpepmix的左下象限、右下象限、左上象限和右上象限的荧光强度分别为61.9%、32.9%、3.47%和1.70%。
在第12天,消耗cd8时,还使用cd4和cd8作为变量产生门选数据。左下象限、右下象限、左上象限和右上象限的荧光强度分别为45.5%/45.3%、44.9%、9.26%和0.35%。此外,使用vδ1和vδ2作为变量产生门选数据。左下象限、右下象限、左上象限和右上象限的荧光强度分别为16.9%/82.8%、0.14%、0.12%和0.35%。
参照图25b,在第0天,对照的左下象限、右下象限、左上象限和右上象限的荧光强度分别为33.6%、66.4%、5.9e-4%和1.78e-3。在第0天,gagpepmix的左下象限、右下象限、左上象限和右上象限的荧光强度分别为33.7%、66.3%、0.011%和0.016%。在第16天,没有消耗cd8时,对照的左下象限、右下象限、左上象限和右上象限的荧光强度分别为78.4%、21.2%、0.30%和0.018%。在第16天,没有消耗cd8时,gagpepmix的左下象限、右下象限、左上象限和右上象限的荧光强度分别为76.3%、20.2%、2.95%和0.61%。在第16天,消耗cd8时,对照的左下象限、右下象限、左上象限和右上象限的荧光强度分别为50.9%、48.7%、0.36%和0.10%%。在第16天,消耗cd8时,gagpepmix的左下象限、右下象限、左上象限和右上象限的荧光强度分别为51.6%、44.4%、0.43%和3.60%。
参照图25c,在第0天,对照的左下象限、右下象限、左上象限和右上象限的荧光强度分别为65.4%、34.5%、0.096%和7.71e-4。在第0天,gagpepmix的左下象限、右下象限、左上象限和右上象限的荧光强度分别为65.4%、34.3%、0.20%和0.10%。在第16天,没有消耗cd8时,对照的左下象限、右下象限、左上象限和右上象限的荧光强度分别为87.9%、12.1%、0.028%和6.24e-3%。在第16天,没有消耗cd8时,gagpepmix的左下象限、右下象限、左上象限和右上象限的荧光强度分别为82.3%、12.1%、5.38%和0.23%。在第16天,消耗cd8时,对照的左下象限、右下象限、左上象限和右上象限的荧光强度分别为87.8%、12.0%、0.22%和0.013%。在第16天,消耗cd8时,gagpepmix的左下象限、右下象限、左上象限和右上象限的荧光强度分别为87.8%、11.1%、0.30%和0.78%。
在第16天,消耗cd8时,还使用变量cd3和cd4产生门选数据,其显示在所示区域中的荧光强度为83.1%。此外,使用变量cd56和cd4产生门选数据,其显示在所示区域中的荧光强度为65.7%。
实施例22:通过在肽刺激之前消耗cd8+、δγ、nk和b细胞来生成cd4+t细胞群
当cd8+t细胞被消耗时,在多个患者中观察到δγ或nk细胞过度生长。因此,将cd8、δγ、nk或b细胞消耗以测试其是否会改善cd4+t细胞扩增。在肽刺激后和慢病毒转导之前进行细胞消耗。
获得hiv阳性人外周血。用ficoll-paqueplus(ge医疗公司(gehealthcare),目录号17-1440-02)分离pbmc。用pepmixtmhiv(gag)ultra(目录号pm-hiv-gag,德国柏林的jpt肽科技公司)在24孔板中的1ml培养基中刺激新鲜分离的pbmc(1x107)18小时。用pe标记的特异性抗体和抗-pe微珠消耗cd8+t、γδ、nk或b细胞。将负选择的细胞以2x106/ml在texmacsgmp培养基(目录号:170-076-309,德国贝尔吉施格拉德巴赫的美天旎生物技术公司(miltenyibiotech))中培养,所述培养基包含中含有il-7(170-076-111,德国贝尔吉施格拉德巴赫的美天旎生物技术公司),il-15(170-076-114,德国贝尔吉施格拉德巴赫的美天旎生物技术公司)和沙奎那韦(目录号:4658,nihaids试剂项目,马里兰州德国镇)。24小时候以mo15添加慢病毒agt103。扩增期间,每2-3天添加包含il-7、il-15和沙奎那韦的新鲜培养基。il-7/il-15的最终浓度为10ng/ml。在第12-16天,收集2-3x106个细胞用于肽再刺激和胞内细胞因子染色(ics)分析。图26显示了该消耗方案的示意图。
当其他细胞亚组被消耗时,hivgag特异性cd4t细胞被扩增至较高水平(图27a-b)。cd8、γδ、nk细胞的过度生长似乎抑制cd4t细胞生长或杀死慢病毒转导的抗原特异性cd4t细胞。这种优化的方案适用于扩大规模和细胞制造。
参照图27a,在第0天,对照的左下象限、右下象限、左上象限和右上象限的荧光强度分别为56.4%、43.5%、0.034%和7.44e-4%。在第0天,gagpepmix的左下象限、右下象限、左上象限和右上象限的荧光强度分别为54.8%、44.8%、0.30%和0.055%。没有消耗18小时后,对照的左下象限、右下象限、左上象限和右上象限的荧光强度分别为83.9%、16.0%、0.061%和0.027%。没有消耗18小时后,gagpepmix的左下象限、右下象限、左上象限和右上象限的荧光强度分别为77.6%、15.4%、6.39%和0.54%。有cd8消耗的18小时后,对照的左下象限、右下象限、左上象限和右上象限的荧光强度分别为41.9%、57.9%、0.094%和0.099%。有cd8消耗的18小时后,gagpepmix的左下象限、右下象限、左上象限和右上象限的荧光强度分别为43.3%、50.7%、3.00%和2.98%。有cd8和γδ消耗的18小时后,对照的左下象限、右下象限、左上象限和右上象限的荧光强度分别为40.4%、59.3%、0.12%和0.13%。有cd8和γδ消耗的18小时后,gagpepmix的左下象限、右下象限、左上象限和右上象限的荧光强度分别为38.3%、54.7%、3.14%和3.86%。有cd8、γδ和b消耗的18小时后,对照的左下象限、右下象限、左上象限和右上象限的荧光强度分别为46.2%、53.6%、0.13%和0.080%。有cd8、γδ和b消耗的18小时后,gagpepmix的左下象限、右下象限、左上象限和右上象限的荧光强度分别为42.1%、48.5%、4.28%和5.06%。
参照图27b,在第0天,对照的左下象限、右下象限、左上象限和右上象限的荧光强度分别为42.6%、57.4%、2.71e-3%和0.0%。在第0天,gagpepmix的左下象限、右下象限、左上象限和右上象限的荧光强度分别为42.5%、57.4%、0.031%和0.048%。没有消耗18小时后,对照的左下象限、右下象限、左上象限和右上象限的荧光强度分别为79.5%、20.5%、0.017%和9.73e-3%。没有消耗18小时后,gagpepmix的左下象限、右下象限、左上象限和右上象限的荧光强度分别为78.9%、19.5%、0.93%和0.65%。有cd8消耗的18小时后,对照的左下象限、右下象限、左上象限和右上象限的荧光强度分别为51.4%、48.4%、0.11%和0.063%。有cd8消耗的18小时后,gagpepmix的左下象限、右下象限、左上象限和右上象限的荧光强度分别为51.7%、43.0%、0.22%和5.03%。有cd8、cd56、γδ和b消耗的18小时后,没有刺激的细胞的左下象限、右下象限、左上象限和右上象限的荧光强度分别为12.8%、87.0%、0.14%和0.10%。有cd8、cd56、γδ和b消耗的18小时后,gagpepmix的左下象限、右下象限、左上象限和右上象限的荧光强度分别为13.2%、79.4%、0.27%和7.17%。
实施例23:测量agt103慢病毒转导效率的方法
为了改善cd4+t细胞的扩增,靶细胞是慢病毒agt103转导的抗原特异性cd4+t细胞。携带gfp的慢病毒用于测量转导效率。因为胞内染色导致显著的gfp信号丢失,所以使用ccs鉴定抗原特异性cd4+t细胞并使用gfp阳性细胞鉴定转导细胞亚组。
用pepmixtmhiv(gag)ultra(目录号pm-hiv-gag,德国柏林的jpt肽科技有限公司)在24孔板中的1ml培养基中刺激来自hiv阳性患者的1x107pbmc。用pe标记的特异性抗体和抗-pe微珠消耗cd8+t、γδ、nk或b细胞。将负选择的细胞以2x106/ml在texmacsgmp培养基(目录号:170-076-309,德国贝尔吉施格拉德巴赫的美天旎生物技术公司(miltenyibiotech))中培养,所述培养基包含中含有il-7(170-076-111,德国贝尔吉施格拉德巴赫的美天旎生物技术公司),il-15(170-076-114,德国贝尔吉施格拉德巴赫的美天旎生物技术公司)和沙奎那韦(目录号:4658,nihaids试剂项目,马里兰州德国镇)。24小时候以mo15添加携带gfp的慢病毒。扩增期间,每3天添加包含il-7、il-15和沙奎那韦的新鲜培养基。il-7/il-15的最终浓度为10ng/ml。在第12-16天,收集2-3x106个细胞。进行肽再刺激和ccs试验以评估ifn-γ阳性抗原特异性cd4+t细胞和gfp信号传导的转导效率。所有实验都按照生产商的说明进行。
ifn-γ阳性抗原特异性cd4+t细胞相较于培养中的其他亚组显示出更好的转导效率(图28)。鉴于此,可以合理地认定,抗原特异性cd4+t接受tcr刺激,更快地增殖,并且更容易被慢病毒感染。如图28所示,右下象限(68.6%荧光)和右上象限(荧光12.6%)的gfp转导效率分别为41.5%和67.8%。这与左下象限(9.75%荧光)和左上象限(2.46%荧光)形成对比,其gfp转导效率分别为35.6%和43.3%。
实施例24:确定转导细胞百分比与载体拷贝数之间关系的方法
因为靶细胞是agt103慢病毒转导的hiv特异性cd4t细胞,所以知道最终细胞产物中包含多少靶细胞是很重要的。然而,临床级agt103慢病毒中并不包含可检测的标志物。因此,转导效率通过由qpcr检测载体拷贝数(vcn)测量。通过使用携带gfp的慢病毒建立转导细胞的百分比与vcn之间的关系,可以基于最终细胞产物中的vcn估计转导细胞的百分比。
用pepmixtmhiv(gag)ultra(目录号pm-hiv-gag,德国柏林的jpt肽科技有限公司)在24孔板中的1ml培养基中刺激来自hiv阳性患者的1x107pbmc。用pe标记的特异性抗体和抗-pe微珠消耗cd8+t、γδ、nk或b细胞。将负选择的细胞以2x106/ml在texmacsgmp培养基(目录号:170-076-309,德国贝尔吉施格拉德巴赫的美天旎生物技术公司(miltenyibiotech))中培养,所述培养基包含中含有il-7(170-076-111,德国贝尔吉施格拉德巴赫的美天旎生物技术公司),il-15(170-076-114,德国贝尔吉施格拉德巴赫的美天旎生物技术公司)和沙奎那韦(目录号:4658,nihaids试剂项目,马里兰州德国镇)。24小时后以mo15添加携带gfp的慢病毒。扩增期间,每3天添加包含il-7、il-15和沙奎那韦的新鲜培养基。il-7/il-15的最终浓度为10ng/ml。沙奎那韦的最终浓度为100nm。在第12-16天,收集2-3x106个细胞。进行肽再刺激和ccs试验以评估原特异性cd4+t细胞和转导效率(利用gfp信号传导)。进行qpcr以检测载体拷贝数。所有实验都按照生产商的说明进行。
测试4个样品后,观察到转导细胞的百分比与载体拷贝数之间的正相关(图29)。
序列
本文提及以下序列:
当上文中描述或特别示例了本发明的某些优选实施方式时,这并非旨在将本发明限于这些实施方式。在不脱离本发明的范围和精神的情况下,可以对其进行各种修改。
- 还没有人留言评论。精彩留言会获得点赞!