含肿瘤特异性溶瘤腺病毒和免疫检查点抑制剂的抗癌组合物的制作方法
本发明涉及包含肿瘤特异性溶瘤腺病毒和免疫检查点抑制剂的抗癌组合物。
背景技术:
尽管癌症治疗剂的研发速度很快,癌症仍然是全球范围内高死亡率的疾病之一。临床常规使用的主要癌症治疗方法是手术,放射治疗,和抗癌剂治疗方法,或者,作为与其并行的治疗,最大程度地从患者中除去癌细胞的方法。然而,这些治疗仅在相对早期癌症未转移的状态下完全去除癌症细胞时才表现出治疗效果,它们也杀死正在快速分裂的其他正常细胞,因此具有可能引起各种副作用的缺点。相应地,最近已有人利用身体的肿瘤特异性免疫活性作为免疫治疗方法对癌症的治疗进行了研究。
然而,很难进行免疫治疗,因为癌症不仅具有巧妙地逃避和破坏各种宿主免疫反应的能力,结果通过诱导免疫抑制性肿瘤微环境而不断地维持肿瘤的存活,而且即使免疫系统被激活,也能够逃避激活的抗肿瘤免疫反应。因此,为了通过改善免疫抑制性肿瘤微环境来增强针对癌细胞的免疫应答,已经在各个方向上用下列物质进行了研究:细胞因子基因如il-12,il-18,干扰素-γ(ifn-γ),粒细胞-巨噬细胞集落刺激因子(gm-csf)和肿瘤坏死因子-α(tnf-α),共刺激因子如b7分子,直接作为抗原呈递细胞(apc)的树突细胞(dc),由肿瘤抗原激活的t细胞,自然杀伤细胞(nkcs)等。具体地,il-12通常由单核细胞、巨噬细胞和dc等apc分泌,已知它直接作用于细胞毒性t淋巴细胞(ctl)和那些能够有效去除癌细胞的nk细胞,以激活那些细胞,诱导ifn-γ的分泌,增强杀死癌细胞的能力。此外,il-12通过作用于幼稚型cd4+淋巴细胞,在促进分化为t辅助1(th1)细胞中发挥重要作用,并因此通过诱导和增强细胞介导的免疫应答而激活抗癌免疫应答,这种细胞介导的免疫应答是抗癌免疫应答的一个关键因素。vegf是由促进血管新生和血管形成的细胞产生的信号蛋白,它影响骨髓中的t细胞前体,从而不仅抑制t细胞和树突细胞的增殖和成熟,还在血管形成中起重要作用,由此表现出被称为癌症转移的副作用。因此,vegf不仅是肿瘤生长的启动子,还充当抗癌免疫力中的抑制剂,预计通过vegfshrna下调vegf可恢复免疫应答并增加抗癌作用。gm-csf通过刺激dc以促进dc分化成apc来增强cd4+和cd8+t细胞的免疫应答,它还参与初始单核细胞中构成ii类主要组织相容性复合体(mhc)的分子的表达调控。据报道,由于gm-csf在肿瘤中表达,诱导了许多apc聚集在肿瘤周围以有效加工肿瘤抗原,由此诱导了强烈的抗癌免疫应答。
基于此,我们的实验室也报道了il-12的抗肿瘤作用,是用ykl-1(ad-e1b-55)作为e1b-55kda基因缺失的肿瘤选择性溶瘤腺病毒,还报道了gm-csf的抗肿瘤作用,是用rdb腺病毒,它比ykl-1具有更强的肿瘤选择性杀伤能力,这归因于e1b基因的缺失和e1a的rb结合位点的修饰。尽管免疫抑制性肿瘤微环境得到改善,但因使用免疫治疗方法时肿瘤的低免疫原性,在完全治疗癌症方面仍存在许多限制。
技术实现要素:
技术问题
在开发以克服肿瘤免疫监视逃避为目的的免疫疗法的深入研究中,本发明人不仅通过制备能同时表达它们的重组腺病毒,证实了il-12加靶向血管内皮生长因子(vegf)的短发卡核糖核酸(shvegf)、或者il-12加gm-csf-松弛素的体内优秀抗癌效应,还证实通过与免疫检查点抑制剂共同给药改进了所述重组腺病毒的抗癌作用,由此完成了本发明。
因此,本发明的一个目的是提供能同时表达il-12和shvegf,或il-12和gm-csf-松弛素的重组腺病毒。
本发明另一目的是提供所述重组腺病毒在预防或治疗癌症中的用途。
本发明另一目的是提供所述重组腺病毒在预防或治疗癌症中作为与免疫检查点抑制剂的组合制剂的药用用途。
然而,本发明要实现的技术问题不限于上述问题,本领域技术人员从以下描述中可以清楚地理解未提及的其他问题。
技术方案
为了实现上述的本发明目的,本发明提供了一种重组腺病毒,其包括:编码白细胞介素12(il-12)的基因;编码粒细胞-巨噬细胞集落刺激因子(gm-csf)的基因;和编码松弛素的基因,或者,所述重组腺病毒包括:编码白细胞介素12(il-12)的基因;和编码能抑制vegf表达的shrna的基因。
作为本发明的一个实施方案,重组腺病毒可以缺失一个或多个选自e1和e3区的区域。
作为本发明的另一个实施方案,编码il-12的基因可以包括il-12a(p35)基因序列,ires序列,和il-12b(p40)基因序列,并且可以插入到重组腺病毒的e1或e3区域。
作为本发明的另一个实施方案,编码gm-csf和松弛素的基因可以包括gm-csf基因序列,ires序列,和松弛素基因序列,并且可以插入到所述重组腺病毒的e1或e3区域。
作为本发明的另一个实施方案,编码抑制vegf表达的shrna的基因可以与vegf的mrna互补结合,并且可以插入重组腺病毒的e1或e3区。
此外,本发明提供用于预防或治疗癌症的药物组合物,该组合物包括:所述重组腺病毒;和药学上可接受的载体。
作为本发明的一个实施方案,所述组合物可与选自以下的任一种免疫检查点抑制剂共同施用:pd-1拮抗剂,pd-l1拮抗剂,pd-l2拮抗剂,cd27拮抗剂,acd28拮抗剂,cd70拮抗剂,cd80拮抗剂,cd86拮抗剂,cd137拮抗剂,cd276拮抗剂,kirs拮抗剂,lag3拮抗剂,tnfrsf4拮抗剂,gitr拮抗剂,gitrl拮抗剂,4-1bbl拮抗剂,ctla-4拮抗剂,a2ar拮抗剂,vtcn1拮抗剂,btla拮抗剂,ido拮抗剂,tim-3拮抗剂,vista拮抗剂,klra拮抗剂,及其组合。
作为本发明的另一个实施方案,该组合物可以增强抗肿瘤免疫力。
作为本发明的另一个实施方案,癌症可以选自胃癌,肺癌,非小细胞肺癌,乳腺癌,卵巢癌,肝癌,支气管癌,鼻咽癌,喉癌,胰腺癌,膀胱癌,结肠癌,宫颈癌,骨癌,非小细胞骨癌,血液系统恶性肿瘤,皮肤癌,头颈癌,子宫癌,结直肠癌,肛门癌,结肠癌,输卵管癌,子宫内膜癌,阴道癌,外阴癌,霍奇金病,食道癌,小肠癌,内分泌癌,甲状腺癌,甲状旁腺癌,肾上腺癌,软组织肉瘤,尿道癌,阴茎癌,前列腺癌,慢性或急性白血病,淋巴细胞性淋巴瘤,肾脏或输尿管癌,肾细胞癌,肾盂癌,唾液腺癌,肉瘤癌,腹膜假性粘液瘤(pseudomyxomaperitonei),肝母细胞瘤,睾丸癌,胶质母细胞瘤,唇癌(cheilocarcinoma),卵巢生殖细胞肿瘤,基底细胞癌,多发性骨髓瘤,胆囊癌,脉络膜黑色素瘤,vater壶腹癌,腹膜癌,舌癌,小细胞癌,小儿淋巴瘤,神经母细胞瘤,十二指肠癌,输尿管癌,星形细胞瘤,脑膜瘤,肾盂癌,阴部癌(pudendumcancer),胸腺癌,中枢神经系统肿瘤,原发性中枢神经系统淋巴瘤,脊髓肿瘤,脑干神经胶质瘤,和垂体腺瘤,癌症也可以是复发性癌症。
有益效果
插入了il-12和shvegf,或插入了il-12和gm-csf-松弛素的本发明重组腺病毒通过改善免疫功能而表现出优异的抗癌作用,已证实这种抗癌作用通过与免疫检查点抑制剂共同施用而被显著增强,因此,本发明可以用作癌症治疗领域中的关键技术。
附图描述
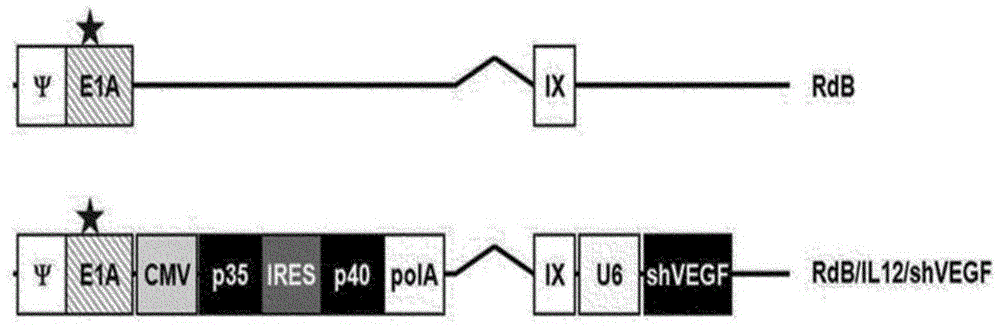
图1示例了能同时表达il-12和vegfshrna的溶瘤腺病毒的特征,还图示了rdb/il12/shvegfad的遗传结构。rdb包括修饰的e1a(星形-rb蛋白结合位点的突变),且e1b-19kda和e1b-55kda(e1b)、以及e3区(e3)都缺失;小鼠il-12和小鼠shvegf分别插入腺病毒基因组的e1或e3区。
图2示例了能同时表达il-12以及gm-csf和松弛素(gmcsf-松弛素)的溶瘤腺病毒的特征,还图示了rdb/il12/gmcsf-rlxad的遗传结构。il-12和gmcsf-松弛素分别插入腺病毒基因组的e1或e3区。gmcsf和松弛素也可以通过内部核糖体进入位点(ires)连接的表达系统来表达,在本发明中,ires是可见于数种病毒和细胞rna的调节序列。
图3确认,在黑素瘤小鼠中,给药rdb/il12/shvegfad,以及将rdb/il12/shvegfad和免疫检查点抑制剂(抗pd-l1抗体)共同给药,有抗癌作用,图3a显示肿瘤体积变化,图3b显示黑素瘤小鼠存活率变化。对于c57bl/6小鼠肿瘤,在第1、3和5天给药腺病毒的ad5x109个病毒颗粒(vp)(图3a;初始肿瘤体积:80~100mm3),并经腹膜内给药200μg抗pd-l1抗体。每天监测并记录肿瘤体积直至实验结束。红色箭头表示注射腺病毒的时间,黑色箭头表示注射抗体的时间。
图4确认,在黑素瘤小鼠中,给药rdb/il12/gmcsf-rlxad,以及将rdb/il12/gmcsf-rlxad和免疫检查点抑制剂(抗pd-l1抗体)共同给药,有抗癌作用,图4a显示肿瘤体积变化,图4b显示黑素瘤小鼠存活率变化。
图5确认,在黑素瘤小鼠中,给药rdb/il12/shvegfad,以及将rdb/il12/shvegfad和免疫检查点抑制剂(抗pd-l1抗体)共同给药,有抗癌作用,还确认当rdb/il12/shvegfad以1x109vp的相对低剂量给药时的肿瘤体积变化。
图6确认,在黑素瘤小鼠中,给药rdb/il12/gmcsf-rlxad,以及将rdb/il12/gmcsf-rlxad和免疫检查点抑制剂(抗pd-l1抗体)共同给药,有抗癌作用,还确认当rdb/il12/gmcsf-rlxad以1x109vp的相对低剂量给药时的肿瘤体积变化。
图7确认了将hmt-rd19-k35/il21ad,rdb/gmcsf/shvegfad,和ykl-1/gmcsf/b7.1ad,与免疫检查点抑制剂(抗pd-l1抗体)共同给药黑素瘤小鼠的抗癌作用。
图8确认,在黑素瘤小鼠中,给药rdb/il12/gmcsf-rlxad,以及将rdb/il12/gmcsf-rlxad和免疫检查点抑制剂(抗pd-l1抗体)共同给药,有抗癌作用,图8a显示肿瘤体积变化,图8b显示黑素瘤小鼠存活率变化。
图9确认,在黑素瘤小鼠中,给药rdb/il12/gmcsf-rlxad,以及将rdb/il12/gmcsf-rlxad和免疫检查点抑制剂(抗ctla-4抗体)共同给药,有抗癌作用,图9a显示肿瘤体积变化,图9b显示黑素瘤小鼠存活率变化。
图10确认,在黑素瘤小鼠中,给药rdb/il12/shvegf,以及将rdb/il12/shvegfad和免疫检查点抑制剂(抗pd-l1抗体)共同给药,有抗肿瘤的免疫记忆效果,图10a显示给药rdb/il12/shvegfad时继发肿瘤的体积变化,图10b显示将rdb/il12/shvegfad和免疫检查点抑制剂(抗pd-l1抗体)共同给药时的继发肿瘤的体积变化。
图11的酶联免疫吸附试验(elisa)结果显示,叙利亚仓鼠胰腺癌细胞系(hap-t1)被rdb/il12/gmcsf-rlxad感染后,以感染复数(moi)表示的il-12和gmcsf表达的变化。
图12的逆转录聚合酶链式反应(rt-pcr)结果显示,叙利亚仓鼠胰腺癌细胞系(hap-t1)被rdb/il12/gmcsf-rlxad感染后,以moi表示的松弛素表达的变化。
图13确认,在叙利亚仓鼠肿瘤动物模型中,将rdb/il12/gmcsf-rlxad和免疫检查点抑制剂(抗pd-1抗体)共同给药,肿瘤体积有变化。
图14的免疫组化结果显示,在叙利亚仓鼠肿瘤动物模型中,将rdb/il12/gmcsf-rlxad和免疫检查点抑制剂(抗pd-1抗体)共同给药,肿瘤组织有变化。
图15显示,将rdb/il12/gmcsf-rlxad和免疫检查点抑制剂(抗pd-1抗体)共同给药,在引流淋巴结(draininglymphnode,dln)中,表达干扰素(ifn)-γ的cd4+或cd8+t细胞的数量发生变化。
图16显示,将rdb/il12/gmcsf-rlxad和免疫检查点抑制剂(抗pd-1抗体)共同给药,在肿瘤浸润淋巴细胞中,表达干扰素(ifn)-γ的cd4+或cd8+t细胞的数量发生变化。
图17显示,将rdb/il12/gmcsf-rlxad和免疫检查点抑制剂(抗pd-1抗体)共同给药,肿瘤组织中的ifn-γ表达有变化。
图18显示,在耐受免疫检查点抑制剂(抗pd-1抗体)的情形中,rdb/il12/gmcsf-rlxad和该免疫检查点抑制剂共同给药也使得肿瘤体积有变化。
图19显示,在耐受免疫检查点抑制剂(抗pd-1抗体)的情形中,rdb/il12/gmcsf-rlxad和该免疫检查点抑制剂共同给药后第23天,肿瘤体积的变化。
图20确认给药rdb/il12/gmcsf-rlxad后肿瘤组织中免疫检查点抑制剂(抗pd-1抗体)浸润的变化,还通过免疫荧光分析定量了肿瘤组织中alexa488-αpd-1的积累。
图21确认给药rdb/il12/gmcsf-rlxad后肿瘤组织中免疫检查点抑制剂(抗pd-1抗体)浸润的变化,还通过免疫荧光确认了alexa488-αpd-1是否定位于cd4+或cd8+t细胞的表达位点。
图22确认系统性给药rdb/il12/gmcsf-rlxad后免疫检查点抑制剂(抗pd-1抗体)浸润的变化,还显示了免疫正电子发射断层扫描(pet)图像随时间变化的分析结果。
图23确认系统性给药rdb/il12/gmcsf-rlxad后免疫检查点抑制剂(抗pd-1抗体)浸润的变化,还显示了包括肿瘤组织在内的各种组织中,64cu-αpd-1分布或吸收的评估和比较结果,以%id/g表示。
具体实施方案
在下文中,将详细描述本发明。
本发明提供了一种重组腺病毒,包括:编码白细胞介素12(il-12)的基因;编码粒细胞-巨噬细胞集落刺激因子(gm-csf)的基因;和编码松弛素的基因,或该重组腺病毒包括:编码il-12的基因;和编码能抑制vegf表达的shrna的基因。
虽然针对癌症的免疫基因疗法已经发展成为一种更有前景的方法,但肿瘤也创造了许多避免免疫监视系统的策略。为了克服这些障碍并增强抗癌免疫力,构建了溶瘤腺病毒(rdb/il12/shvegfad,rdb/il12/gmcsf-rlxad)系统,其能同时表达il-12和血管内皮生长因子(vegf)短发夹rna(shrna),或il-12和gm-csf-松弛素,以此作为适于恢复免疫抑制和增加抗癌免疫力的辅助疗法。il-12通过诱导t辅助1细胞分化和激活细胞毒性t淋巴细胞和自然杀伤细胞的细胞毒性来增加抗肿瘤免疫力。已知shvegf和gm-csf通过促进t细胞和树突细胞的增殖和成熟、以及通过刺激dc来促进dc分化成apc而起到分别增强cd4+和cd8+t细胞的免疫应答的作用,这些效果预计进一步放大il-12的功能。因此,本发明人首次尝试使用在肿瘤中同时表达il-2和shvegf,或il-12和gm-csf-松弛素的腺病毒的技术特征进行免疫基因治疗。在本发明的一个实施例中,作为将重组腺病毒(rdb/il12/shvegfad,rdb/il12/gmcsf-rlxad)给予黑素瘤动物模型的结果,实验证实了肿瘤生长抑制率,完全缓解率,和小鼠存活率都增加。
此外,il-12作为抗癌免疫治疗的核心细胞因子备受关注,特别是对于体内免疫力受损患者的抗癌免疫治疗方法,经常考虑重复给予il-12以获得有效的治疗效果。然而,临床上已知il-12在全身,特别是肾脏中具有细胞因子相关毒性,因此具有技术限制,即il-12必须在有限剂量范围内用作癌症治疗剂。基于该技术背景,同时表达il-12基因和另外基因的本发明重组腺病毒具有另一技术特征,它即使在低病毒滴度下也诱导高溶瘤效应,以此来解决由于高剂量和重复施用il-12而导致的正常细胞毒性问题(已指明这是对相关领域抗癌免疫疗法的限制)。
因此,本发明重组腺病毒的特征在于包括编码il-12的基因,还包括以下任一种基因:编码gm-csf的基因、编码松弛素的基因、和编码抑制vegf表达的shrna的基因。
用于本发明的“编码il-12的基因”包括il-12a(p35)基因序列和il-12b(p40)基因序列,并且可以包括位于il-12a(p35)基因序列和il-12b(p40)基因序列之间、用于有效翻译病毒蛋白的ires序列。优选地,il-12a(p35)基因序列,il-12b(p40)基因序列和ires序列可分别由seqidno.1,seqidno.2和seqidno.3组成,但不限于此。
用于本发明的“编码gm-csf的基因”和“编码松弛素的基因”分别包括gm-csf基因序列和松弛素基因序列,并且还可以包括gm-csf基因序列和松弛素基因序列之间的ires序列。优选地,gm-csf基因序列,松弛素基因序列和ires序列可分别由seqidno.4,seqidno.5和seqidno.3组成,但不限于此。
用于本发明的“编码抑制vegf表达的shrna的基因”具有发夹结构,指能介导rna干扰或基因沉默的基因。所述基因包括与vegfmrna互补的序列,术语“互补”意味着不仅包括100%互补的情况,还包括足以通过rna干扰机制抑制vegf基因表达的不完全互补性,以及指优选90%互补,更优选98%互补,最优选100%互补。在本说明书中,100%互补特指完全互补。在本发明中,尽管该基因也被描述为shvegf,但不限于此,该基因可以与vegf的mrna(由seqidno.6或7表示)互补结合,以抑制vegf的表达。
据解释,基因序列还包括表现出基本同一性或基本相似性的基因序列。上述基本同一性是指,与本发明的序列不同,但与本发明序列比对以尽可能多地对应、且用本领域常用算法分析所述比对序列时,具有至少80%同源性,更优选90%同源性,最优选95%同源性的随机序列。上述基本相似性总体上是指基因序列中的所有变化,例如一个或多个碱基的缺失或插入,其不影响使重组腺病毒载体的同源重组最小化的本发明的目的。因此,本发明的基因序列不限于seqidnos.1-6所示例的序列,并且被解释为只要该序列基本上不影响本发明所需的最终产品的活性,即可包括在本发明权利的范围内。
同时,作为本发明的重组腺病毒,可以使用本领域公知的溶瘤腺病毒。在本发明的一个实例中,重组腺病毒包含活化的e1a基因和失活的e1b-19基因,失活的e1b-55基因,或失活的e1b-19/e1b-55基因。在本说明书中,术语失活与基因一起使用意味着通常不进行基因的转录和/或翻译,并且不显示由该基因编码的正常蛋白质的功能。例如,失活的e1b-19基因是不能通过基因修饰(取代,添加,部分或完全缺失)产生活化的e1b-19kda蛋白的基因。eib-19的缺失可以增加杀死细胞的能力,e1b-55基因的缺失使得重组腺病毒具有肿瘤特异性(参见韩国专利申请号2002-23760)。在本说明书中与病毒基因组序列一起使用的术语“缺失”具有包括相应序列的完全缺失和部分缺失的含义。
根据本发明的一个实施方案,重组腺病毒包括e1a区,具有e1b区即e1b-19kda和e1b-55kda(e1b)缺失,并且e3区(e3)缺失。包含e1a基因的重组腺病毒具有可复制的特征。编码il-12的基因插入到重组腺病毒的e1b缺失区,编码gm-csf和松弛素的基因或编码抑制vegf表达的shrna的基因插入到e3区。同时,在编码e1a基因序列中rb结合位点的核苷酸序列中,e1a位点具有两个修饰,一个是glu45残基被gly取代,另一手氨基酸121至127的序列完全被gly取代。
除了腺病毒以外的病毒也可用于本发明。可用于本发明的病毒可优选为痘苗病毒(puhlmannm.etal.,humangenetherapy10:649-657(1999)),慢病毒(wangg.etal.,j.clin.invest.104(11):r55-62(1999)),或单纯疱疹病毒(chamberr.,etal.,proc.natl.acad.sciusa92:1411-1415(1995)),但不限于此。
用于本发明的重组腺病毒包括动物细胞(优选哺乳动物细胞)中可操作的启动子。适用于本发明的启动子包括源自哺乳动物病毒的启动子和源自哺乳动物细胞基因组的启动子,包括例如巨细胞病毒(cmv)启动子,u6启动子和h1启动子,鼠白血病病毒(mlv)长末端重复序列(ltr)启动子,腺病毒早期启动子,腺病毒晚期启动子,疫苗病毒7.5k启动子,sv40启动子,hsvtk启动子,rsv启动子,ef1α启动子,金属硫蛋白启动子,β-肌动蛋白启动子,人il-2基因启动子,人ifn基因启动子,人il-4基因启动子,人淋巴毒素基因启动子,人gm-csf基因启动子,诱导型启动子,癌细胞特异性启动子(例如,tert启动子,修饰的tert启动子,psa启动子,psma启动子,cea启动子,幸存蛋白启动子,e2f启动子,修饰的e2f启动子,afp启动子,修饰的afp启动子,e2f-afp杂合启动子,以及e2f-tert杂合启动子),组织特异性启动子(例如白蛋白启动子),人磷酸甘油酸激酶(pgk)启动子,以及小鼠磷酸甘油酸激酶(pgk)启动子,但不限于此。最优选地,启动子是cmv启动子。优选地,在用于表达反式基因的表达构建体中,聚腺苷酸化序列结合所述反式基因的下游。聚腺苷酸化序列包括牛生长激素终止子(gimmi,e.r.,etal.,nucleicacidsres.17:6983-6998(1989)),sv40衍生的聚腺苷酸化序列(schek,n,etal.,mol.cellbiol.12:5386-5393(1992)),hiv-1polya(klasens,b.i.f.,etal.,nucleicacidsres.26:1870-1876(1998)),β-珠蛋白polya(gil,a.,etal,cell49:399-406(1987)),hsvtkpolya(cole,c.n.andt.p.stacy,mol.cell.biol.5:2104-2113(1985)),或多瘤病毒polya(batt,d.bandg.g.biol.15:4783-4790(1995)),但不限于此。
在用于本发明的重组腺病毒中,il-12基因序列、gm-csf-松弛素基因序列、或shvegf基因序列与启动子可操作地连接。如本文所用,术语“可操作地连接”是指核酸表达调控序列(例如:启动子、信号序列、和转录调节因子结合位点形成的阵列)与另一核酸序列之间的功能性结合,并因此,调节序列调节该另一核酸序列的转录和/或翻译。
本发明的重组腺病毒还可以包括抗生素抗性基因和报告基因(例如,绿色荧光蛋白(gfp),荧光素酶和β-葡糖醛酸糖苷酶)作为选择标记。抗生素抗性基因包括本领域常用的抗生素抗性基因,例如赋予氨苄青霉素、庆大霉素、羧苄青霉素、氯霉素、链霉素、卡那霉素、遗传霉素、新霉素和四环素抗性的基因,优选新霉素抗性基因。上述选择标记甚至可以在通过分开的启动子或内部核糖体进入位点(ires)连接的表达系统中表达,可以在本发明中使用的ires是在某些病毒和细胞的rna中发现的调节序列。
本发明的另一方面提供:用于预防或治疗癌症的药物组合物,该组合物包含重组腺病毒;和药学上可接受的载体;重组腺病毒的医学用途,用于预防或治疗癌症;和治疗癌症的方法,该方法包括给个体施用治疗有效量的重组腺病毒的步骤。
由于本发明的药物组合物使用上述重组腺病毒,因此为了避免本说明书的过度复杂,将省略对两者之间共同的内容的描述。
如本文所用,术语“预防”是指通过施用本发明的药物组合物来抑制癌症(肿瘤)或延迟癌症(肿瘤)发作的所有作用。
如本文所用,术语“治疗”是指通过施用本发明的药物组合物改善或有益地改变癌症(肿瘤)症状的所有作用。
在本发明中,“个体”是指需要治疗疾病的受试者,更具体地,是指哺乳动物,例如人或非人灵长类动物,啮齿类动物(大鼠,小鼠,豚鼠,等),小鼠,狗,猫,马,牛,绵羊,猪,山羊,骆驼,和羚羊。
“癌症”,作为由本发明的药物组合物预防或治疗的疾病,总体上指由具有激进性特征、侵入性特征和转移性特征的细胞引起的疾病,激进性特征是指细胞不顾正常生长限制而分裂和生长,侵入性特征是指浸润周围组织,转移性特征是指扩散到身体其他部位。在本发明中,癌症与恶性肿瘤的意义相同,可包括实体瘤和血源性肿瘤。例如,癌症可以是选自下组的任一种:胃癌,肺癌,非小细胞肺癌,乳腺癌,卵巢癌,肝癌,支气管癌,鼻咽癌,喉癌,胰腺癌,膀胱癌,结肠癌,宫颈癌,骨癌,非小细胞骨癌,血液系统恶性肿瘤,皮肤癌,头颈癌,子宫癌,结肠直肠癌,肛门癌,结肠癌,输卵管癌,子宫内膜癌,阴道癌,外阴癌,霍奇金病,食道癌,小肠癌,内分泌癌,甲状腺癌,甲状旁腺癌,肾上腺癌,软组织肉瘤,尿道癌,阴茎癌,前列腺癌,慢性或急性白血病,淋巴细胞性淋巴瘤,肾脏或输卵管癌,肾细胞癌,肾盂癌,唾液腺癌,肉瘤癌,腹膜假性粘液瘤(pseudomyxomaperitonei),肝母细胞瘤,睾丸癌,胶质母细胞瘤,唇癌(cheilocarcinoma),卵巢生殖细胞肿瘤,基底细胞癌,多发性骨髓瘤,胆囊癌,脉络膜黑色素瘤,vater壶腹癌,腹膜癌,舌癌,小细胞癌,小儿淋巴瘤,神经母细胞瘤,十二指肠癌,输尿管癌,星形细胞瘤,脑膜瘤,肾盂癌,阴部癌(pudendumcancer),胸腺癌,中枢神经系统(cns)肿瘤,原发性中枢神经系统淋巴瘤,脊髓肿瘤,脑干神经胶质瘤,和垂体腺瘤,也可以是复发性癌症,但不限于此。
同时,本发明的药物组合物可另外包含免疫检查点抑制剂。
如本文所用,术语“免疫检查点”总体上是指,参与引起免疫细胞表面免疫应答的刺激或抑制信号的蛋白,和癌细胞通过被操纵而逃避免疫系统的监视网络,使得不能经由该免疫检查点正确地进行免疫应答的刺激和对癌细胞的抑制。优选地,免疫检查点蛋白可以是pd-1拮抗剂,pd-l1拮抗剂,pd-l2拮抗剂,cd27拮抗剂,cd28拮抗剂,cd70拮抗剂,cd80拮抗剂,cd86拮抗剂,cd137拮抗剂,cd276拮抗剂,kirs拮抗剂,lag3拮抗剂,tnfrsf4拮抗剂,gitr拮抗剂,gitrl拮抗剂,4-1bbl拮抗剂,ctla-4拮抗剂,a2ar拮抗剂,vtcn1拮抗剂,btla拮抗剂,ido拮抗剂,tim-3拮抗剂,vista拮抗剂,klra拮抗剂及其组合,但不限于此。
免疫检查点抑制剂是一种拮抗剂或抗体,它靶向免疫检查点蛋白,并通过增强刺激免疫应答的蛋白、或阻断抑制免疫应答的蛋白,而表现出由免疫应答引起的抗癌作用。由于免疫检查点抑制剂使用具有优异记忆能力的免疫应答系统,除了具有比一般细胞毒性抗癌剂更少的副作用(例如呕吐或脱发)和明显治疗效果的优点之外,甚至在停药后,疗效也可以持续一段较长时间,但对于通过与重组腺病毒共同给药来增强抗癌作用不是已知的。因此,本发明人尝试与免疫检查点抑制剂共同给药以增强重组腺病毒的抗癌作用,还有另一技术特征,即以与免疫检查点抑制剂共同给药的形式提供重组腺病毒的医学用途以预防或治疗癌症。
除活性成分外,本发明的药物组合物可包含药学上可接受的载体。在这种情况下,药学上可接受的载体通常在制剂期间使用,包括乳糖,葡萄糖,蔗糖,山梨醇,甘露醇,淀粉,阿拉伯树胶,磷酸钙,藻酸盐,明胶,硅酸钙,微晶纤维素,聚乙烯吡咯烷酮,纤维素,水,糖浆,甲基纤维素,羟基苯甲酸甲酯,羟基苯甲酸丙酯,滑石,硬脂酸镁,矿物油等,但不限于此。此外,除了上述成分之外,药学上可接受的载体还可包含润滑剂,润湿剂,甜味剂,调味剂,乳化剂,悬浮剂,防腐剂等。合适的药学上可接受的载体和制剂详见remington'spharmaceuticalsciences(第19版,1995)。
本发明的药物组合物可以口服或肠胃外给药(例如,静脉内,皮下,腹膜内或局部施用),并且根据本发明的实施例,本发明的抗肿瘤免疫增强组合物可以优选直接在肿瘤内给药。剂量根据患者的病症和体重,疾病的严重程度,药物形式,给药途径和持续时间而变化,但可由本领域技术人员适当选择。
本发明的药物组合物以药学有效量给药。在本发明中,“药学有效量”是指足以以适用于医学治疗的合理的益处/风险比治疗疾病的量,有效剂量水平可以根据多种因素来确定,包括患者的疾病类型,疾病的严重程度,药物活性,药物敏感性,给药时间,给药途径,排泄率,治疗期,和同时使用的药物,以及医学领域众所周知的其他因素。根据本发明的另一种药物组合物可以作为单独的治疗剂施用或与其他治疗剂组合施用,可以与相关领域中的治疗剂顺序或同时施用,并且可以以单剂量或多剂量施用。考虑到所有上述因素,重要的是以获得最大效果而没有任何副作用的最小量施用所述组合物,该量可以由本领域技术人员容易地确定。
在下文中,将提出用于帮助理解本发明的优选实施例。然而,提供以下实施例仅为了更容易理解本发明,本发明的内容不受以下实施例的限制。
实施例
实验材料和实验方法
1.动物实验
6至8周龄雄性c57bl/6小鼠购自charlesriverlaboratoriesinternational,inc.(wilmington,ma),并在无病原体条件下在层流气流箱中繁殖。所有动物实验均在实验动物管理评估和认可协会(aaalac)的批准下进行,并根据汉阳大学动物护理和使用委员会制定的指南进行。
2.生产溶瘤腺病毒
制得腺病毒(ad),其中,将il-12和gm-csf-松弛素或shvegf分别引入e1区和e3区,见图1和2。
具体地,为了构建表达il-12的ade1穿梭载体,通过从pca14/il12切除小鼠il-12基因并将该基因亚克隆到pxc1rdbe1穿梭载体中来制备pxc1rdb/il12e1穿梭载体。此外,为了构建表达shvegf的e3穿梭载体,使用从骨髓来源的活性树突细胞获得的总rna,通过rt-pcr克隆全长小鼠shvegf互补dna。使用以下引物对制备shvegf互补dna(核苷酸53-982,nationalcenterforbiotechnologyinformationl15435):正义(5'-gatcccggaaggagagcagaagtcccatgttcaagagacatgggacttctgctctcctttttttttggaaa-3'),反义(5'-tttccaaaaaaaaaggagagcagaagtcccatgtctcttgaacatgggacttctgctctccttccgggatc-3')。pcr产物用bamhi/hindiii消化,然后克隆到bamhi/hindiii处理的psp72e3/cmv-polaade3穿梭载体中,从而制得psp72e3/shvegfe3穿梭载体。此外,通过在psp72e3/cmv-polaade3穿梭载体中克隆gmcsf-ires-松弛素基因,制得psp72e3/gmcsf-rlxe3穿梭载体。
为进行同源重组,将大肠杆菌bj5183用pxc1rdb/il12e1穿梭载体和pde1/shvegf或pde1/gmcsf-rlx同时转化,从而制得prdb/il12/shvegfad和prdb/il12/gmcsf-rlxad。所有病毒用293细胞产生,并根据现有技术进行腺病毒的纯化、滴定和质量分析。
3.用动物模型评估抗癌效果
将b16-f10细胞(5x105)皮下注射到6至7周龄雄性c57bl/6免疫活性小鼠的右胁腹中。当肿瘤体积达到约100mm3时,将小鼠分成具有相似肿瘤大小的组,并以5x109vp的浓度在第1、3和5天向肿瘤内施用溶瘤腺病毒(rdb/il12/shvegfad;rdb/il12/gmcsf-rlxad)。另外,为了确认与免疫检查点抑制剂共同给药的抗癌作用,将抗pd-l1抗体、抗pd-1抗体、和抗ctla-4抗体作为免疫检查点抑制剂,在第3、6和9天以200μg溶瘤腺病毒的浓度经腹膜内给予小鼠,并且,为了进一步评价与免疫检查点抑制剂共同给药的协同作用,用1x109vp溶瘤腺病毒再次进行与上述相同的实验,该剂量比先前实验使用的5x109vp低5倍。同时,在本实验中,以pbs处理组(pbs)和免疫检查点抑制剂单独处理组(抗pd-l1抗体,抗pd-1抗体,和抗ctla-4抗体)作为对照。
此后,使用动物模型评估抗癌效果,通过每天使用卡尺测量垂直肿瘤直径以监测肿瘤的生长,还确认存活率随时间的变化。同时,使用下式计算肿瘤体积:体积=0.523l(w)2,其中l表示长度,w表示宽度。
4.用免疫记忆评估抗癌效果
将原发性肿瘤注射到3个诱发了黑素瘤的动物模型中,之后第50天,将继发性肿瘤再注射(再攻击)到成功治疗的小鼠中(从原发性肿瘤不能被促进的时间点开始的第25天)。此后,以与上述相同的方式来评估抗肿瘤免疫记忆效应,方法是,每隔一天测量垂直肿瘤直径,以监测肿瘤的生长并计算平均肿瘤体积。在本实验中,使用在正常小鼠(正常)中诱发了黑素瘤的组作为对照。
5.统计分析
所有数据均表示为平均值±标准误差。使用statview软件(abacusconcepts,inc.,berkeley,ca)和mann-whitney检验(非参数秩和检验)进行比较。p值等于或小于0.05表示统计学显着性(*,p<0.05;**,p<0.01)。
实验结果
1.在黑素瘤小鼠中确认抗癌效果
本发明人旨在通过比较注射到黑素瘤小鼠中的肿瘤的体积,完全缓解的存在,以及小鼠的存活率,来证实重组腺病毒和/或免疫检查点抑制剂的抗癌作用。
结果证实,在用pbs或抗pd-l1抗体处理的对照中,肿瘤快速增殖,肿瘤体积分别在第11或15天达到3,000mm3或更多,从而表现出强势肿瘤生长,而在用rdb/il12/shvegfad或rdb/il12/gmcsf-rlxad处理的组中,作为在第22天与pbs处理组比较的结果,肿瘤生长分别被抑制了99.3%或99.5%(分别见图3a和4a)。此外,当腺病毒和抗pd-l1抗体共同给予时(rdb/il12/shvegfad+pd-l1,rdb/il12/gmcsf-rlxad+pd-l1),肿瘤体积比腺病毒单独或抗pd-l1抗体单独以上述相同方式处理的组显著减小。在抗pd-l1抗体共同施用组中,虽然类似于腺病毒单独处理组(rdb/il12/shvegfad,rdb/il12/gmcsf-rlxad)的抗癌作用直到第27天才出现,但从过完一个月开始,肿瘤生长就持续受到抑制,而在腺病毒单独处理组中,肿瘤生长随时间增加,可见在腺病毒单独处理组和腺病毒与抗体共同给药组之间,肿瘤体积有显著差异(图3a和4a)。此外,可以看出,在第50天,在用pbs或抗pd-l1抗体处理的对照中,无法确认完全缓解,而在rdb/il12/shvegfad或rdb/il12/gmcsf-rlxad组中,存活率分别为66%(4/6)和50%(3/6),当腺病毒和抗pd-l1抗体共同给予时,存活率为66%(4/6)和100%(6/6),后者是完全缓解。此外,证实rdb/il12/shvegfad+pd-l1或rdb/il12/gmcsf-rlxad+pd-l1组中的所有小鼠分别存活直至第44天或第50天,而在同样的时间点,rdb/il12/shvegfad或rdb/il12/gmcsf-rlxad组的存活率为66%(4/6),对照组中的所有小鼠均被肿瘤杀死(图3b和4b)。这些结果意味着,免疫检查点抑制剂抗pd-l1抗体单独处理的抗癌作用相对不显著,反而rdb/il12/shvegfad或rdb/il12/gmcsf-rlxad表现出优异的抗癌作用,并且,当与抗pd-l1抗体共同施用时,重组腺病毒的抗癌作用进一步增强。
2.与免疫检查点抑制剂共同施用的抗癌效果
本发明人比较了重组腺病毒单独给药和重组腺病毒与免疫检查点抑制剂共同给药的抗癌作用,使用了(1x109vp)剂量的溶瘤腺病毒,这比先前实验的5x109vp低5倍,以更详细地评估与免疫检查点抑制剂共同给药的协同效应。此外,基于这些结果,当使用抗pd-l1抗体、抗pd-1抗体、或抗ctla-4抗体作为免疫检查点抑制剂时,比较这些抗体的抗癌作用,在本实验中,用rdb/il12/gmcsf-rlxad作为重组腺病毒。
结果,在第18天,作为与pbs处理组的肿瘤体积比较的结果,rdb/il12/shvegfad组的肿瘤生长抑制率为92.9%,但与抗pd-1抗体共同给药使肿瘤生长抑制率增加至99.7%,rdb/il12/gmcsf-rlxad组的肿瘤生长抑制率(90.1%)也因与抗pd-1抗体共同给药而大大增加至98.9%(图5和6)。此外,rdb/il12/shvegfad组只有17%(1/6)完全缓解,而在rdb/il12/shvegfad+pd-1组,完全缓解率为83%(5/6),这是大大增加。
同时,为了确认其他类型的重组腺病毒是否也通过与免疫检查点抑制剂共同给药而显示出协同效应,将hmt-rd19-k35/il21ad,rdb/gmcsf/shvegfad,或ykl-1/gmcsf/b7.1ad与抗pd-1抗体共同施用,然后确认它们的抗癌作用。结果,如图7所示,大多数重组腺病毒通过与抗pd-1抗体共同给药,使肿瘤体积在一定程度上减小,但大多数重组腺病毒未能表现出与本发明的重组腺病毒(rdb/il12/shvegfad,rdb/il12/gmcsf-rlxad)一样的显著效果,特别是ykl-1/gmcsf/b7.1ad,与抗pd-1抗体单独处理组相比,整体效果并不优异。从这些结果可以看出,与免疫检查点抑制剂共同给药的协同作用不适用于所有重组腺病毒,是本发明重组腺病毒的独特作用。
此外,在证实不同类型免疫检查点抑制剂的抗癌时发现,经pbs、抗pd-l1抗体、抗pd-1抗体、或抗ctla-4抗体处理的对照小鼠,肿瘤体积迅速增加,分别在第11、15、18或11天达到3,000mm3或更高,表现出强势肿瘤生长,而在rdb/il12/gmcs-rlxad+抗pd-l1抗体处理组、rdb/il12/gmcsf-rlxad+抗pd-1抗体处理组、以及rdb/il12/gmcsf-rlxad+抗ctla-4抗体处理组,肿瘤生长被大大抑制,第21天时,分别比pbs处理组抑制了99.9%,99.9%或99.2%(图4a,8a和9a)。此外,在rdb/il12/gmcsf-rlxad组中,第50天时的完全缓解率为50%(3/6),而当抗pd-l1抗体、抗pd-1抗体、或抗ctla-4抗体共同给药时,完全缓解率分别为100%(6/6)、83%(5/6)、和83%(5/6),都提高了。此外,用rdb/il12/gmcsf-rlxad+抗pd-l1抗体、rdb/il12/gmcsf-rlxad+抗pd-1抗体、以及rdb/il12/gmcsf-rlxad+抗ctla-4抗体处理的小鼠分别存活直至第50天,第50天或第30天,而在这些相同时间点,rdb/il12/gmcsf-rlxad组的存活率分别为66%(4/6),66(4/6),83%(5/6)和83%(5/6)(图4b,8b和9b)。这些结果表明,尽管使用抗pd-l1抗体、抗pd-1抗体、或抗ctla-4抗体,都能使重组腺病毒的抗癌作用增强,但共同施用抗pd-l1抗体或抗pd-1抗体,与共同施用抗ctla-4抗体时相比,rdb/il12/gmcsf-rlxad的抗癌作用相关协同作用更为显著。
3.确认对复发癌症的免疫记忆效果
本发明人打算通过比较注射到黑素瘤小鼠或类似动物中的继发肿瘤的体积,来证实本发明重组腺病毒、或者该重组腺病毒与免疫检查点抑制剂共同施用的免疫记忆效应和对复发癌症的抗癌作用。
结果发现,在rdb/il12/shvegfad组中,继发肿瘤的生长被显著抑制(图10a),特别是,通过与免疫检查点抑制剂抗pd-1抗体共同给药,继发肿瘤的生长受到更显著的抑制(图10b)。这些结果意味着,本发明的重组腺病毒可以通过免疫记忆增强抗肿瘤免疫应答的效果,从而预先预防肿瘤的复发,还提示此效果因与免疫检查点抑制剂共同给药而增强,就像对上述抗癌效果的影响一样。
4.验证rdb/il12/gmcsf-rlxad的抗癌效果
(1)确认il-12,gm-csf,和松弛素的表达模式
为了验证il-12、gm-csf和松弛素(rlx)基因共表达的抗癌作用,如上述制得rdb/il12/gmcsf-rlxad,在该腺病毒中,il-12基因插入到e1区,gm-csf和松弛素基因插入到e3区。rdb/il12/gmcsf-rlxad是一种癌细胞特异性溶瘤腺病毒,其中e1b基因作为腺病毒的起始基因被删除,e1a基因被修饰,所得腺病毒的il-12、gm-csf、rlx表达水平得到确认。具体地,叙利亚仓鼠胰腺癌细胞系(hap-t1)被rdb/il12/gmcsf-rlx以0.2、0.5、1、2和5的感染复数(moi)感染,48小时后,收集其培养基。此后,通过酶联免疫吸附试验(elisa)确认il-12和gm-csf的表达水平,并通过逆转录聚合酶链反应(rt-pcr)确认松弛素的表达水平。
结果如图11和12所示,il-12、gm-csf、或松弛素的表达水平随腺病毒moi而增加,因此这些基因的共表达可以通过实验确认。
(2)叙利亚仓鼠肿瘤动物模型中,与αpd-1共同给药导致抗癌效果增强为了验证rdb/il12/gmcsf-rlxad和αpd-1共同给药所致的抗癌作用的增强,对皮下注射hap-t1胰腺癌细胞系所诱导的叙利亚仓鼠肿瘤动物模型,在肿瘤内给药7x107个病毒颗粒(vp)/30μl的rdb/il12/gmcsf-rlxad,同时腹膜内给药10mg/kg的αpd-1,然后观察肿瘤体积的变化。同时,以rdb/il12/gmcsf-rlxad单独给药组作为比较组。
结果如图13所示,在单独施用rdb/il12/gmcsf-rlxad的肿瘤组织中,肿瘤持续生长,因此在第一次施用病毒后第30天,肿瘤体积达到1.982±126mm3,而在rdb/il12/gmcsf-rlxad和αpd-1共同给药组中,肿瘤生长被抑制到第一次施用病毒后的第30天,使肿瘤生长的抑制达到单一给药组的约为79%。此外,在rdb/il12/gmcsf-rlxad和αpd-1共同给药组中,肿瘤的完全缓解率约为50%,而在rdb/il12/gmcsf-rlxad单独给药组中,完全缓解根本没有观察到(未示出)。也即,这些结果提示,rdb/il12/gmcsf-rlxad的抗癌疗效因与αpd-1共同给药而显著改善。
(3)叙利亚仓鼠肿瘤动物模型中因与αpd-1共同给药所致的肿瘤组织的变化
为了具体确认rdb/il12/gmcsf-rlxad和αpd-1共同给药所引起的肿瘤组织的变化,在如上述将7x107vp的rdb/il12/gmcsf-rlxad和10mg/kgαpd-1共同给药后如上所述共同施用,收集肿瘤组织进行免疫组织学评估。同时,分别用αpd-1单独给药组或rdb/il12/gmcsf-rlxad单独给药组和pbs给药组作为比较组和对照组。
结果发现,如图14所示,在施用pbs的肿瘤组织中,坏死部位几乎无法确认,而rdb/il12/gmcsf-rlxad和αpd-1共同给药组的大多数肿瘤组织则变得坏死。此外,所述共同给药与αpd-1单独给药或rdb/il12/gmcsf-rlxad单独给药相比,显著降低肿瘤细胞的增殖(pcna)、显著增加细胞坏死(tunel)。
(4)因与αpd-1共同给药所致的肿瘤组织中细胞群体和ifn-γ表达的变化
为了评估当rdb/il12/gmcsf-rlxad使αpd-1增加向肿瘤组织中的浸润时,是否可以诱导肿瘤组织中t细胞的浸润和活化,评估了引流淋巴结(dln)和肿瘤组织中表达干扰素(ifn)-γ的cd4+或cd8+t细胞数量的变化。结果如图15和16所示,在rdb/il12/gmcsf-rlxad或αpd-1单独给药组及rdb/il12/gmcsf-rlxad和αpd-1共同给药组中,表达ifn-γ的cd4+和cd8+t细胞群体的数目比pbs或αpd-1单独给药组的高(p<0.001或p<0.01)。特别是可证实,rdb/il12/gmcsf-rlxad和αpd-1共同给药组相比于rdb/il12/gmcsf-rlxad或αpd-1单独给药组,表达ifn-γ的cd4+和cd8+t细胞群也显著增加(p<0.001),该结果表明,rdb/il12/gmcsf-rlxad和αpd-1的共同给药诱导了表达干扰素(ifn)-γ的cd4+或cd8+t细胞在肿瘤中的浸润和活化。
另外,为了评价给予腺病毒的肿瘤组织中ifn-γ的表达水平,从施用腺病毒等的小鼠中提取肿瘤组织并精细研磨,然后进行ifn-γelisa分析。结果发现,如图17所示,pbs或αpd-1单独肿瘤内施用时根本未检测到ifn-γ,rdb/il12/gmcsf-rlxad单独给药组中每1g肿瘤组织仅检测到8.3pg/mgifn-γ,而在rdb/il12/gmcsf-rlxad和αpd-1共同给药组中,每1g肿瘤组织检测到18.7pg/mgifn-γ。这表明,上述共同给药通过增加肿瘤中ifn-γ的表达而增强了免疫细胞的活性,并最终有助于增强抗癌作用。
(5)确认对免疫检查点抑制剂耐受的情形下的抗癌效果
为了评估rdb/il12/gmcsf-rlxad和αpd-1的共同给药是否能够在对免疫检查点抑制剂耐受的条件下显示出有效的治疗效果,评估了所述共同给药对事先经αpd-1处理的肿瘤的生长抑制效果。具体地,当单独施用αpd-1未能有效抑制肿瘤生长时(在该抗体第一次处理后第9天),rdb/il12/gmcsf-rlxad以2天的间隔总共施用四次。同时,用αpd-1单独给药组作为比较组。
结果如图18所示,当肿瘤体积达到915±78mm3时开始施用rdb/il12/gmcsf-rlxad,从给药的第一天起就有效地抑制肿瘤生长,维持了10天。有趣的是,αpd-1单独给药组显示出肿瘤生长速率的快速增加,因此不能抑制肿瘤的生长,而共同给药组即使在上述期间也持续抑制肿瘤的生长。此外,作为比较肿瘤体积变化的结果(在给药后第23天),共同给药组中的生长抑制效果最显著。这是说,即使在对免疫检查点抑制剂耐受的条件下,上述共同给药也显示出有效的抗癌治疗效果。因此,建议上述共同给药可以成为有益于对免疫检查点抑制剂单一疗法具有耐受性的患者的疗法。
(6)因给药rdb/il12/gmcsf-rlxad所致的αpd-1向肿瘤组织中浸润的变化
据预测,rlx在肿瘤组织中的表达将通过促进αpd-1的肿瘤内浸润而表现出协同抗癌疗效。因此,打算评估rdb/il12/gmcsf-rlxad是否增加αpd-1瘤内浸润到促纤维增生性胰腺肿瘤组织中。在第0天或第2天将rdb/il12/gmcsf-rlxad直接施用于肿瘤组织,在第2天腹膜内施用αpd-1(c:rdb/il12/gmcsf-rlx+alexa488-抗pd-1),alexa488-偶联αpd-1单独给药组(b;alexa488-抗pd-1)和pbs单独给药组(a;pbs)分别作为比较组和对照。在第7天收集如上述处理的肿瘤组织,通过免疫荧光分析定量alexa488-αpd-1在肿瘤组织中的积累。作为定量单位组织区域内alexa488-αpd-1积累的结果,如图20所示,pbs单独给药组或αpd-1单独给药组分别显示14±2a.u./μm2or21±1a.u./μm2,而共同给药组显示32±6a.u./μm2。从该结果可以看出,rdb/il12/gmcsf-rlxad显着改善了αpd-1向肿瘤组织的浸润,并有助于改善αpd-1在肿瘤组织中的定位。此外,为了确认alexa488-αpd-1是否位于cd4+或cd8+t细胞的表达位点,对于pbs单独给药组(a:pbs)、或alexa488-偶联αpd-1单独给药组(b:alexa488-抗pd-1)、或rdb/il12/gmcsf-rlxad和alexa488-偶联αpd-1共同给药组(c:rdb/il12/gmcsf-rlx+alexa488-抗pd-1)的肿瘤组织,进行cd4+cd8+免疫染色。结果,如图21所示,在共同给药组中,观察到αpd-1和cd4或cd8的共定位水平高于alexa488-αpd-1单独给药组。
为了评估αpd-1在全身范围内的瘤内浸润,按上述方法,利用1,4,7,10-四氮杂环十二烷-1,4,7,10-四乙酸,将64cu-αpd-1(其中αpd-1和64cu偶联)与rdb/il12/gmcsf-rlxad一起施用于hap-ti移植的仓鼠,从而获得免疫-pet图像。在64cu-αpd-1给药后第2、12、36和60小时之时进行pet扫描,并且与ct一起进行主要pet成像用于解剖学描述。将一个64cu-αpd-1单独给药组作为比较组。结果,如图22所示,共同给药组和单独给药组以suv计的64cu-αpd-1瘤内吸收如下:在2小时之时为0.26±0.06和0.36±0.05(p=0.072);在12小时之时为0.90±0.22和1.68±0.45(p=0.018);在36小时之时为2.14±0.19和2.97±0.67(p=0.062);在60小时之时为3.37±0.57和4.50±1.02(p=0.043)。也就是说,观察到在上述所有时间点,共同给药组的64cu-αpd-1的瘤内吸收显著高于64cu-αpd-1单独给药组的瘤内吸收。此外,在64cu-αpd-1给药后第60小时之时,计算64cu-αpd-1在包括肿瘤组织在内的各种组织中的分布或吸收,表示为%id/g。结果如图23所示,单独给药组和共同给药组显示的吸收为:1.80±0.13%id/g,2.80±0.41%id/g(p<0.05),分别在肿瘤组织中;1.10±0.11%id/g,1.94±0.23%id/g(p<0.05),分别在脾脏,而在共同给药组中,64cu-αpd-1的吸收在肿瘤组织和脾脏中均得到改善。脾脏。除了这些组织之外,引流淋巴结(dln)作为t细胞富集部位,因感染rdb/il12/gmcsf-rlxad而肿大(结果未示出)。也就是说,将上述实验结果合在一起时,可以看出rdb/il12/gmcsf-rlxad的感染使肿瘤组织中的细胞外基质重塑或分解,通过增强il-12和gm-csf的免疫应答而改善了肿瘤组织中αpd-1的吸收,结果发生共同给药的协同作用。
提供本发明的上述描述是为了说明的目的,并且本发明所属领域的技术人员将理解,可以在不改变技术精神或基本特征的情况下容易地将本发明修改为其他特定形式。因此,应该理解,上述实施例在所有方面都仅仅是说明性的而非限制性的。
<110>基因药物株式会社
<120>含肿瘤特异性溶瘤腺病毒和免疫检查点抑制剂的抗癌组合物
<130>g19e10c0252p/cn
<150>kr10-2017-0026339
<151>2017-02-28
<160>9
<170>kopatentin3.0
<210>1
<211>648
<212>dna
<213>il-12a
<400>1
atgtgtcaatcacgctacctcctctttttggccacccttgccctcctaaaccacctcagt60
ttggccagggtcattccagtctctggacctgccaggtgtcttagccagtcccgaaacctg120
ctgaagaccacagatgacatggtgaagacggccagagaaaaactgaaacattattcctgc180
actgctgaagacatcgatcatgaagacatcacacgggaccaaaccagcacattgaagacc240
tgtttaccactggaactacacaagaacgagagttgcctggctactagagagacttcttcc300
acaacaagagggagctgcctgcccccacagaagacgtctttgatgatgaccctgtgcctt360
ggtagcatctatgaggacttgaagatgtaccagacagagttccaggccatcaacgcagca420
cttcagaatcacaaccatcagcagatcattctagacaagggcatgctggtggccatcgat480
gagctgatgcagtctctgaatcataatggcgagactctgcgccagaaacctcctgtggga540
gaagcagacccttacagagtgaaaatgaagctctgcatcctgcttcacgccttcagcacc600
cgcgtcgtgaccatcaacagggtgatgggctatctgagctccgcctga648
<210>2
<211>1008
<212>dna
<213>il-12b
<400>2
atgtgtcctcagaagctaaccatctcctggtttgccatcgttttgctggtgtctccactc60
atggccatgtgggagctggagaaagacgtttatgttgtagaggtggactggactcccgat120
gcccctggagaaacagtgaacctcacctgtgacacgcctgaagaagatgacatcacctgg180
acctcagaccagagacatggagtcataggctctggaaagaccctgaccatcactgtcaaa240
gagtttctagatgctggccagtacacctgccacaaaggaggcgagactctgagccactca300
catctgctgctccacaagaaggaaaatggaatttggtccactgaaattttaaaaaatttc360
aaaaacaagactttcctgaagtgtgaagcaccaaattactccggacggttcacgtgctca420
tggctggtgcaaagaaacatggacttgaagttcaacatcaagagcagtagcagttcccct480
gactctcgggcagtgacatgtggaatggcgtctctgtctgcagagaaggtcacactggac540
caaagggactatgagaagtattcagtgtcctgccaggaggatgtcacctgcccaactgcc600
gaggagaccctgcccattgaactggcgttggaagcacggcagcagaataaatatgagaac660
tacagcaccagcttcttcatcagggacatcatcaaaccagacccgcccaagaacttgcag720
atgaagcctttgaagaactcacaggtggaggtcagctgggagtaccctgactcctggagc780
actccccattcctacttctccctcaagttctttgttcgaatccagcgcaagaaagaaaag840
atgaaggagacagaggaggggtgtaaccagaaaggtgcgttcctcgtagagaagacatct900
accgaagtccaatgcaaaggcgggaatgtctgcgtgcaagctcaggatcgctattacaat960
tcctcatgcagcaagtgggcatgtgttccctgcagggtccgatcctag1008
<210>3
<211>597
<212>dna
<213>ires
<400>3
tagcgatccgcccctctccctcccccccccctaacgttactggccgaagccgcttggaat60
aaggccggtgtgcgtttgtctatatgttattttccaccatattgccgtcttttggcaatg120
tgagggcccggaaacctggccctgtcttcttgacgagcattcctaggggtctttcccctc180
tcgccaaaggaatgcaaggtctgttgaatgtcgtgaaggaagcagttcctctggaagctt240
cttgaagacaaacaacgtctgtagcgaccctttgcaggcagcggaaccccccacctggcg300
acaggtgcctctgcggccaaaagccacgtgtataagatacacctgcaaaggcggcacaac360
cccagtgccacgttgtgagttggatagttgtggaaagagtcaaatggctctcctcaagcg420
tattcaacaaggggctgaaggatgcccagaaggtaccccattgtatgggatctgatctgg480
ggcctcggtacacatgctttacatgtgtttagtcgaggttaaaaaaacgtctaggccccc540
gaaccacggggacgtggttttccttttgaaaaacacgatgataatatggccacaacc597
<210>4
<211>426
<212>dna
<213>gm-csf
<400>4
atgtggctgcagaatttacttttcctgggcattgtggtctacagcctctcagcacccacc60
cgctcacccatcactgtcacccggccttggaagcatgtagaggccatcaaagaagccctg120
aacctcctggatgacatgcctgtcacattgaatgaagaggtagaagtcgtctctaacgag180
ttctccttcaagaagctaacatgtgtgcagacccgcctgaagatattcgagcagggtcta240
cggggcaatttcaccaaactcaagggcgccttgaacatgacagccagctactaccagaca300
tactgccccccaactccggaaacggactgtgaaacacaagttaccacctatgcggatttc360
atagacagccttaaaacctttctgactgatatcccctttgaatgcaaaaaaccagtccaa420
aaatga426
<210>5
<211>558
<212>dna
<213>relaxin
<400>5
atgcctcgcctgttcttgttccacctgctagaattctgtttactactgaaccaattttcc60
agagcagtcgcggccaaatggaaggacgatgttattaaattatgcggccgcgaattagtt120
cgcgcgcagattgccatttgcggcatgagcacctggagcaaaaggtctctgagccaggaa180
gatgctcctcagacacctagaccagtggcagaaattgtaccatccttcatcaacaaagat240
acagaaactataattatcatgttggaattcattgctaatttgccaccggagctgaaggca300
gccctatctgagaggcaaccatcattaccagagctacagcagtatgtacctgcattaaag360
gattccaatcttagctttgaagaatttaagaaacttattcgcaataggcaaagtgaagcc420
gcagacagcaatccttcagaattaaaatacttaggcttggatactcattctcaaaaaaag480
agacgaccctacgtggcactgtttgagaaatgttgcctaattggttgtaccaaaaggtct540
cttgctaaatattgctga558
<210>6
<211>441
<212>dna
<213>murinevegfmrnasequence
<400>6
atgaactttctgctctcttgggtgcactggaccctggctttactgctgtacctccaccat60
gccaagtggtcccaggctgcacccacgacagaaggagagcagaagtcccatgaagtgatc120
aagttcatggatgtctaccagcgaagctactgccgtccgattgagaccctggtggacatc180
ttccaggagtaccccgacgagatagagtacatcttcaagccgtcctgtgtgccgctgatg240
cgctgtgcaggctgctgtaacgatgaagccctggagtgcgtgcccacgtcagagagcaac300
atcaccatgcagatcatgcggatcaaacctcaccaaagccagcacataggagagatgagc360
ttcctacagcacagcagatgtgaatgcagaccaaagaaagacagaacaaagccagaaaaa420
tgtgacaagccaaggcggtga441
<210>7
<211>576
<212>dna
<213>homosapiensvegfmrna
<400>7
atgaactttctgctgtcttgggtgcattggagccttgccttgctgctctacctccaccat60
gccaagtggtcccaggctgcacccatggcagaaggaggggggcagaatcatcacgaagtg120
gtgaagttcatggatgtctatcagcgcagctactgccatccaatcgagaccctggtggac180
atcttccaggagtaccctgatgagatcgagtacatcttcaagccatcctgtgtgcccctg240
atgcgatgcgggggctgctgcaatgacgagggcctggagtgtgtgcccactgaggagtcc300
aacatcaccatgcagattatgcggatcaaacctcaccaaggccagcacataggagagatg360
agcttcctacagcacaacaaatgtgaatgcagaccaaagaaagatagagcaagacaagaa420
aatccctgtgggccttgctcagagcggagaaagcatttgtttgtacaagatccgcagacg480
tgtaaatgttcctgcaaaaacacagactcgcgttgcaaggcgaggcagcttgagttaaac540
gaacgtacttgcagatgtgacaagccgaggcggtga576
<210>8
<211>71
<212>dna
<213>artificialsequence
<220>
<223>shvegfsense
<400>8
gatcccggaaggagagcagaagtcccatgttcaagagacatgggacttctgctctccttt60
ttttttggaaa71
<210>9
<211>71
<212>dna
<213>artificialsequence
<220>
<223>shvegfanti-sense
<400>9
tttccaaaaaaaaaggagagcagaagtcccatgtctcttgaacatgggacttctgctctc60
cttccgggatc71
- 还没有人留言评论。精彩留言会获得点赞!