抗因子D抗体及其用途的制作方法
相关申请的引证
本申请要求2017年2月10日提交的美国临时专利申请号62/457,477的优先权,该专利以其全部内容通过引证结合于本文中。
关于联邦政府资助的研究或开发的声明
本发明是在美国国立卫生研究院(nationalinstitutesofhealth)(nih)授予的nihai085596和nihai117410的政府支持下完成的。政府拥有本发明的某些权利。
背景技术:
补体系统针对入侵病的原体提供了第一道宿主防御。补体还在人炎性疾病中起致病作用。补体系统的激活通过三种不同途径发生,即:经典途径(cp),凝集素途径(lp)和旁路途径(ap)。cp由抗原-抗体结合引发。当甘露糖结合凝集素(mbl)与微生物上的表面糖分子相互作用时,lp被触发。两种途径的激活都导致cpc3转化酶c4b2a的组装,尽管也可以出现mbl相关的丝氨酸蛋白酶对c3的直接切割。ap是由apc3转化酶c3bbb驱动的自扩增循环。ap激活可以在cp或lp激活之后发生,或独立启动。在后一种情况下,低水平自发性c3“空转(tick-over)”会产生初始c3bbb,其在缺乏足够的调节的情况下会快速传播ap。因此,一般假设在没有或不充分的负调节的非自身表面上的ap活化被认为是默认过程,而自体细胞通常在多种膜结合和液相补体抑制蛋白的帮助下会避免这种结果。在某些条件下,改变的、受损的或应激的自体细胞和组织也可以激活ap并引起炎性损伤。
因子d(fd)是ap补体激活的必需酶。其在后者与c3b结合后切割因子b而产生活性c3转化酶c3bbb。因子d是大小约24kda的丝氨酸蛋白酶,并且在通过甘露糖结合凝集素相关丝氨酸蛋白酶-3(masp-3)的酶促作用由前因子d产生之后作为组成型活性酶循环于血液中。与血液中的其他补体蛋白相比,血液中的因子d的浓度相当低(约2μg/ml)。虽然后一事实可以表明血液中d因子活性的治疗性抑制是可能的并且可能容易实现,但先前的研究显示d因子具有快速转换,并且因此补体研究领域的共识是,系统性地阻断因子d不是可行的。本领域需要可以系统性抑制ap补体活性而由此治疗ap补体依赖性病理的抗人因子dmab,并且本领域需要合适的动物模型对这种人抗因子dmabs进行测试和验证。本发明解决和满足这些和其他需求。
技术实现要素:
本发明涉及抗因子d抗体和使用抗因子d抗体抑制补体的旁路途径(ap)的方法。
在一个实施方式中,本发明是包含特异性结合因子d的抗体的组合物。在一些实施方式中,因子d是人因子d。在一些实施方式中,本发明的抗体是单克隆抗体。在一些实施方式中,本发明的抗体是人源化抗体。在一些实施方式中,本发明的抗体是嵌合抗体。在一些实施方式中,抗体是全长抗体。在一些实施方式中,抗体是抗体片段,其包括但不限于,fab,fab',f(ab)2,f(ab')2和scfv。在一些实施方式中,抗体是构建体的一部分,例如,包含抗体和靶向部分或效应子部分的融合构建体。在一些实施方式中,抗体是缀合物构建体的一部分,如抗体药物缀合物构建体。
在一个实施方式中,本发明的抗体包含至少一个选自由vh-cdr1:seqidno:3;vh-cdr2:seqidno:4;vh-cdr3:seqidno:5;vl-cdr1:seqidno:8;vl-cdr2:seqidno:9;和vl-cdr3:seqidno:10或其一种或多种变体组成的组的cdr。在另一个实施方式中,本发明的抗体包含含有seqidno:2的氨基酸序列的重链或其变体。在一个实施方式中,本发明的抗体包含含有seqidno:7的氨基酸序列的轻链或其变体。在另一个实施方式中,本发明的抗体包含含有seqidno:2的氨基酸序列的重链和包含seqidno:7的氨基酸序列的轻链,或其一种或多种变体。
在一个实施方式中,本发明的抗体包含至少一个选自由vh-cdr1:seqidno:13;vh-cdr2:seqidno:14;vh-cdr3:seqidno:15;vl-cdr1:seqidno:18;vl-cdr2:seqidno:19;和vl-cdr3:seqidno:20组成的组的cdr,或其一种或多种变体。在另一个实施方式中,本发明的抗体是包含含有seqidno:12的氨基酸序列的重链或其变体的抗体。在一个实施方式中,本发明的抗体包含含有seqidno:17的氨基酸序列的轻链或其变体。在另一个实施方式中,本发明的抗体是包含含有seqidno:12的氨基酸序列的重链和包含seqidno:17的氨基酸序列的轻链,或其一种或多种变体的抗体。
在一个实施方式中,本发明的抗体是mab11-8a1或mab1f10-5。在一个实施方式中,本发明的抗体是结合因子d并与至少一种其他抗因子d抗体的结合竞争的抗体。在一个实施方式中,本发明的抗体是结合因子d且与本文描述的至少一种抗因子d抗体的结合竞争的抗体。在另一个实施方式中,本发明的抗体是结合因子d并与命名为mab11-8a1的抗体与因子d的结合竞争的抗体。在另一个实施方式中,本发明的抗体是结合因子d并与命名为mab1f10-5的抗体与因子d的结合竞争的抗体。
在另一个实施方式中,本发明是一种治疗个体中的旁路途径(ap)介导的疾病或病症的方法,包括向所述个体给予至少一种抗因子d抗体的步骤。在各种实施方式中,旁路途径(ap)介导的疾病或病症至少选自由以下组成的组:黄斑变性(md),年龄相关性黄斑变性(amd),缺血再灌注损伤,关节炎,类风湿性关节炎,哮喘,过敏性哮喘,阵发性睡眠性血红蛋白尿症(pnh)综合征,非典型溶血性尿毒症(ahus)综合征,大疱性表皮松解症,败血症,器官移植,炎症(包括但不限于与心肺转流手术和肾透析相关的炎症),c3肾小球病,膜性肾病,肾小球肾炎(包括,但不限于抗中性粒细胞胞浆抗体(anca)介导的肾小球肾炎,狼疮,及其组合),anca介导的血管炎,志贺毒素诱导的hus和抗磷脂抗体诱导的妊娠丢失,及它们的组合。在一些实施方式中,抗因子d抗体抑制旁路途径,但不抑制经典途径和凝集素途径的激活。在一些实施方式中,抗因子d抗体抑制c3bbb蛋白的生成。在一些实施方式中,抗因子d抗体抑制ap对下游补体信号传导的贡献。在一些实施方式中,ap介导得疾病是c3肾小球病。在一些实施方式中,ap介导疾病是黄斑变性,如年龄相关性黄斑变性。
在一个实施方式中,本发明是一种降低个体的补体系统的旁路途径活性的方法,包括经由包括肠内给予,肠胃外给予及其组合的给予途径向个体给予抗体,并且其中该抗体包含具有以下氨基酸序列的六个互补决定区:seqidno:3,seqidno:4,seqidno:5,seqidno:8,seqidno:9和seqidno:10,或其一种或多种变体。在另一个实施方式中,抗体是选自由fab、fab'、f(ab)2、f(ab')2和scfv及其组合组成的组的抗体片段。
在一个实施方式中,本发明是一种降低个体的补体系统的旁路途径的活性的方法,包括经由包括肠内给予,肠胃外给予及其组合的给予途径向个体给予抗体,并且其中该抗体包含具有以下氨基酸序列的六个互补决定区:seqidno:13,seqidno:14,seqidno:15,seqidno:18,seqidno:19和seqidno:20,或其一种或多种变体。在另一个实施方式中,抗体是包括fab、fab'、f(ab)2、f(ab')2、scfv及其组合的抗体片段。
在一个实施方式中,本发明是一种结合人因子d的分离抗体,抗体可替换地结合因子d的第一表位和第二表位中的任一个,第一表位和第二表位两者具有在其二级结构中呈现卷绕构象的部分,并且其中因子d在其二级结构中呈现β-链构象的一部分处于第一表位和第二表位之间。在另一个实施方式中,第一表位具有包含seqidno:21的氨基酸序列,且第二表位具有包含seqidno:22的氨基酸序列。在另一个实施方式中,第一表位具有包含seqidno:23的氨基酸序列且第二表位具有包含seqidno:24的氨基酸序列。在另一个实施方式中,抗体是选自由fab、fab'、f(ab)2、f(ab')2、scfv及其组合组成的组的抗体片段。在另一个实施方式中,抗体结合因子d的表位,并且其中该表位具有包含seqidno:21的氨基酸序列。在另一个实施方式中,抗体是选自由fab、fab'、f(ab)2、f(ab')2、scfv及其组合组成的组的抗体片段。
在一个实施方式中,本发明是结合人因子d的分离抗体,其中该抗体结合因子d的表位,并且其中该表位具有包含seqidno:22的氨基酸序列。在另一个实施方式中,抗体是选自由fab、fab'、f(ab)2、f(ab')2、scfv及其组合组成的组的抗体片段。
在一个实施方式中,本发明是结合人因子d的分离抗体,其中该抗体会结合因子d的表位,并且其中该表位具有包含seqidno:23的氨基酸序列。在另一个实施方式中,抗体是选自由fab、fab'、f(ab)2、f(ab')2、scfv及其组合组成的组的抗体片段。
在一个实施方式中,本发明是结合人因子d的分离抗体,其中抗体可替换地结合因子d的第一表位和第二表位中的任一个,其中第一表位具有包含seqidno:21的氨基酸序列,且其中第二表位具有包含seqidno:22的氨基酸序列。在另一个实施方式中,抗体由fab、fab'、f(ab)2、f(ab')2、scfv及其组合组成。
在一个实施方式中,本发明是结合人因子d的分离多肽,其中该多肽结合因子d的表位,该表位具有包含seqidno:21或seqidno:22的氨基酸序列,且该多肽包括至少一个选自由seqidno:3,seqidno:4,seqidno:5,seqidno:8,seqidno:9和seqidno:10组成的组的氨基酸序列,或其一种或多种变体。
在一个实施方式中,本发明是结合人因子d的分离多肽,其中该多肽结合因子d的表位,该表位具有包含seqidno:24的氨基酸序列,并且多肽包含至少一个选自由seqidno:13,seqidno:14,seqidno:15,seqidno:18,seqidno:19和seqidno:20组成的组的氨基酸序列,或其一种或多种变体。
在一个实施方式中,本发明是抗人因子d的抗体,其中该抗体具有的重链可变(vh)区域具有与seqidno:2大于90%(如大于91%,92%,93%,94%,95%,96%,97%,98%,或99%中的任一个)同一性的氨基酸序列。在另一个实施方式中,抗体是选自由fab、fab'、f(ab)2、f(ab')2、scfv及其组合组成的组的抗体片段。
在一个实施方式中,本发明是针对人因子d的抗体,其中该抗体具有的轻链可变(vl)区域具有与seqidno:7大于90%(如大于91%,92%,93%,94%,95%,96%,97%,98%,或99%中的任一个)同一性的氨基酸序列。在另一个实施方式中,抗体是选自由fab、fab'、f(ab)2、f(ab')2、scfv及其组合组成的组的抗体片段。
在一个实施方式中,本发明是抗人因子d的抗体,其中该抗体具有重链可变(vh)区和轻链可变(vl)区,其中vh区具有与seqidno:2的大于90%(如大于91%,92%,93%,94%,95%,96%,97%,98%或99%中的任一个)同一性的氨基酸序列,并且其中vl区域具有与seqidno:7大于90%(如大于91%,92%,93%,94%,95%,96%,97%,98%,或99%中的任何一个)同一性的氨基酸序列。在另一个实施方式中,抗体是选自由fab、fab'、f(ab)2、f(ab')2、scfv及其组合组成的组的抗体片段。
在一个实施方式中,本发明是产生抗体的细胞,其中抗体靶向因子d。在一个实施方式中,细胞是杂交瘤。在另一个实施方式中,细胞是细胞系。
在另一个实施方式中,本发明是表达人因子d的遗传修改的非人动物。在一些实施方式中,非人动物是啮齿动物,如大鼠或小鼠。在一个实施方式中,本发明是表达人因子d的遗传修改的小鼠。在一个实施方式中,本发明是表达人因子d但不表达鼠因子d的遗传修改的小鼠。在另一个实施方式中,本发明是由小鼠调节元件表达人因子d而不表达鼠因子d的遗传修改的小鼠。
附图说明
当结合附图阅读时,将会更好地理解前述发明内容以及本发明的示例性实施方式的以下详细描述。然而,应该理解的是,本发明不限于附图中所示的实施方式的精确排布设置和手段。在附图中:
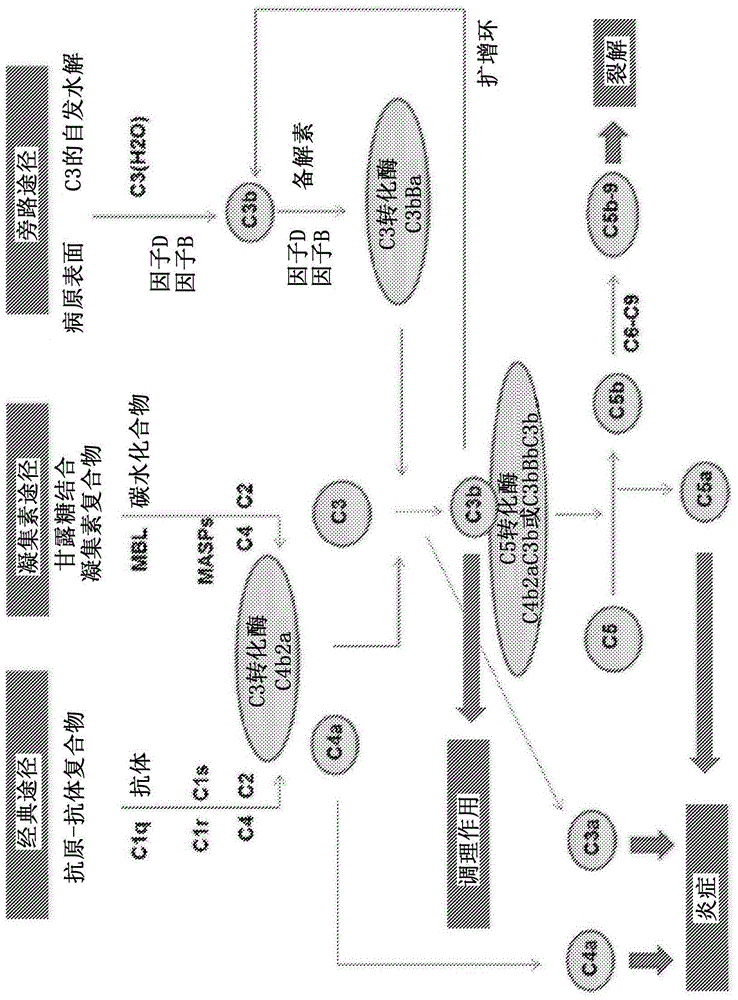
图1是补体途径的示意图。补体系统可以取决于起始刺激经由三种不同的途径激活:经典途径(cp),凝集素途径(lp)和旁路途径(ap)(图1)。cp主要由抗原和特异性抗体构成的免疫复合物激活。c1q与抗原附接的抗体的结合,其激活clr和cls。激活的cls会切割c4和c2。当甘露糖结合凝集素(mbl)与微生物碳水化合物的甘露糖基团结合,激活mbl相关的丝氨酸蛋白酶(masp)并再次切割c4和c2时,lp被激活。c4和c2切割产物形成cp和lpc3转化酶c4bc2a,其将c3切割成c3b和c3a。第二分子的c3b可以与c4bc2a结合而形成cp和lp的c5转化酶。当c3经历自发水解并在因子b和d存在下形成初始apc3转化酶c3(h2o)bb时,ap被激活,导致另外的c3切割并最终形成apc3转化酶(c3bbb)和apc5转化酶(c3bbbc3b)。备解素(properdin)通过稳定ap转化酶而促进ap活化。所有三种途径最终都形成转化酶,其由此产生补体系统的主要效应子:过敏毒素(anaphylatoxin)(c4a/c3a/c5a),膜攻击复合物(mac)和调理素(opsonins)(例如,c3b)。过敏毒素是有效的促炎分子,并分别通过c4、c3和c5的切割产生。c5b通过蛋白c6-c9的连续结合形成复合物,最终形成可以直接裂解靶向的表面的mac(c5b-9)。c3b诱导调理素作用的靶标的吞噬,并还用于通过ap扩增补体激活。
图2描绘了显示抗人因子dmab11-8a1和1f10-5对lps诱导的ap补体激活的剂量依赖性抑制的实验结果。当以5μg/ml或更高的终浓度加入到50%标准人血清(nhs)中时,两种mab均有效抑制ap补体活化。添加edta的样品用作阴性对照(edta阻断补体激活)。未添加mab的样品(0ab)用作基线ap补体激活。实验在gvb-egta-mg++缓冲液中进行。elisa板用lps在37℃下涂覆1小时。在加入至板之前,将nhs与mab预温育。ap补体激活通过测量板上c3沉积的量(od450)来检测。
图3描绘了mab11-8a1的重链(seqidno:1;seqidno:2)和轻链(seqidno:6;seqidno:7)的可变区序列的核苷酸和氨基酸序列。包括mab11-8a1的cdr(vh-cdr1:seqidno:3;vh-cdr2:seqidno:4;vh-cdr3:seqidno:5;vl-cdr1:seqidno:8;vl-cdr2:seqidno:9;vl-cdr3:seqidno:10)。
图4描绘了mab1f10-5的重链(seqidno:11;seqidno:12)和轻链(seqidno:16;seqidno:17)的可变区序列的核苷酸和氨基酸序列,包括mab1f10-5的cdr(vh-cdr1:seqidno:13;vh-cdr2:seqidno:14;vh-cdr3:seqidno:15;vl-cdr1:seqidno:18;vl-cdr2:seqidno:19;vl-cdr3:seqidno:20)。
图5描绘了评价11-8a1和1f10-5mab在阻断lps诱导的人、猴、豚鼠和小鼠ap补体激活中的相对活性的实验结果。使用lps-ap试验测试了mab11a8-1和1f10-5抑制来自不同哺乳动物物种的血清中的旁路途径活性的能力。elisa板用lps在37℃下涂覆1小时,加入用gvb-mg++-egta稀释的50%标准人、猴、豚鼠或小鼠血清,并在37℃下温育1小时,然后使用抗人c3抗体或抗鼠c3抗体检测c3沉积。对于11-8a1mab,5-20μg/ml的浓度足以抑制人ap补体激活,而11-8a1mab不能抑制小鼠、豚鼠、猴(恒河猴和食蟹猴)ap补体激活。对于if10-5mab,5-20μg/ml的浓度足以抑制人ap补体激活,而1f10-5mab不能抑制小鼠和豚鼠ap补体激活。10或20μg/ml的1f10-5mab有效抑制食蟹猴ap补体激活。另一方面,50μg/ml的1f10-5mab导致恒河猴ap补体激活的部分抑制。
图6描绘了比较源自杂交瘤的鼠11-8a1和重组嵌合11-8a1(11-8a1的可变区+人igg4的恒定区)在阻断lps诱导的人ap补体激活中的活性的实验结果。elisa板用lps在37℃涂覆1小时,并加入用gvb-mg++-egta稀释的50%标准人血清(nhs)并在37℃下温育1小时,然后使用抗人c3抗体检测c3沉积。添加edta的nhs用作阴性对照(edta)。以1.25-10μg/ml的浓度,两种形式的11-8a1mab都足以抑制人ap补体激活,并且没有观察到活性差异。
图7描绘了使用biacore比较源自杂交瘤的鼠11-8a1和重组嵌合11-8a1mab的抗原结合亲和力的实验结果。使用胺连接法将纯化的人因子d连接至cm4芯片上。biacore分析在biacore-2000仪上进行。使用50mmnaoh在每次结合之间再生芯片。两种形式的11-8a1mab显示出相似的亲和力。
图8描绘了使用biacore对if10-5mab的抗原结合亲和力测量的结果。使用胺连接方法将纯化的人因子d连接于cm4芯片上。biacore分析在biacore-2000仪上进行。使用50mmnaoh在每次结合之间再生芯片。1f10-5的kd据测定为1.5e-10m。
图9,包括图9a至9d,描绘了使用缺失构建体对mab11-8a1的表位绘图的结果。(图9a)显示的序列(228个氨基酸)是无前肽的人因子d的成熟形式。氨基酸107-110(seqidno:21)、130-134、148-151(seqidno:22)和178-184标有下划线。(图9b)用于表位绘图的人因子d的完整形式和9个缺失突变体的示意图。这些蛋白质表达于cho细胞中。(图9c)蛋白质表达的确证。用山羊抗人因子d抗体对来自cho细胞的上清液(sup)或细胞裂解物(cl)的人因子d的重组完整和缺失突变体进行免疫蛋白印迹。+和-分别表示阳性和阴性检测。(图9d)通过用山羊抗人因子d多克隆抗体法免疫蛋白印迹(western-blotting)(wb)接着用11-8a1mab的免疫沉淀(ip)评价mab11-8a1对完整和缺失突变蛋白的反应活性。+和-分别表示阳性和阴性检测。nt:未测试。
为了绘制人因子d中对mab结合重要的区域或位点,我们测试了mab11-8a1的与全长(完整)人因子d中的一系列缺失突变体的反应活性。使用多克隆山羊抗人因子d抗体的免疫蛋白印迹证实了预期分子量下大多数缺失突变体的表达。然而,几次尝试未能产生缺失-6和9的重组蛋白。如图9所示,mab11-8a1识别了全长、缺失-2和4,但未能识别缺失-1、3、5、7和8。这些结果表明,107-110(seqidno:21)处的四个氨基酸plpw的缺失或148-151(seqidno:22)处的四个氨基酸vldr的缺失破坏了通过mab11-8a1的结合。
图10描绘了通过定点诱变对mab11-8a1表位绘图的结果。进行定点诱变研究以确证人因子d中影响mab11-8a1识别的两个结合位点(107-110和148-151)。我们引入了用丙氨酸残基(aaaa)替换107-110处的四个氨基酸plpw或148-151处四个氨基酸vldr。用载体转染cho细胞用于突变蛋白。通过使用多克隆山羊抗人因子d抗体的免疫蛋白印迹确证上清液和细胞裂解物中的突变蛋白质表达(转染后48小时)。如预期的,两种突变都破坏了ip中mab11-8a1对蛋白质的识别,然后用山羊抗人因子d抗体进行免疫蛋白印迹。缺失突变体和诱变研究(plpw至aaaa和vldr至aaaa)的结果表明位于人因子d的plpw107-110和vldr148-151中的四个氨基酸对于11-8a1结合和功能性阻断活性是重要的。
图11,包括图11a至11d,描绘了人因子d敲入小鼠的生成的概况。(图11a)表示人因子d靶向构建体、鼠因子d基因座、靶向等位基因和新缺失的等位基因的示意图(从上到下)。人因子dcdna会编码253个氨基酸的完整蛋白质,包括信号肽、前肽和成熟肽。虚线表示鼠因子d基因中人因子dcdna的整合位点。用于es细胞筛选的探针的位置指示于图下方。缩写:限制性位点bamhi(b),hindiii(h),noti(n)和xhoi(x)。frt,翻转酶识别靶点。loxp,p1中的交换(crossover)的位点。(图11b)人因子d的编码序列侧接靶向构建体中的鼠因子d的5'和3'非编码序列。人因子d的核酸序列加下划线(seqidno:25),且限制酶xhoi位点为粗体,并且鼠因子d的5'和3'非翻译区的核酸序列分别用大写和小写字母表示。(图11c)显示阳性es细胞克隆的dna印迹(southernblotting)数据产生两个bamhi限制片段(5kb和4.5kb),而代表性的非靶向es细胞克隆仅产生5kb带。(图11d)使用特异于人因子d(靶尺寸:450bp)5'-gtcagggtgccatgcaggag-3'(seqidno:26)和5'-cccaggagaacctgcaccttc-3'(seqidno:27),和特异于鼠因子d(靶尺寸:292bp)5'-cctcccacccttagctatcc-3'(seqidno:28)和5'-acccagactgtgtccctcac-3'(seqidno:29)的野生型(wt)、杂合(het)和纯合(homo)人因子d敲入小鼠的pcr基因分型。
图12,包括图12a和12b,描绘了评价人因子d敲入小鼠血清中的人因子d表达的实验结果。进行免疫蛋白印迹和elisa以证实人因子d敲入小鼠的血清中人因子d蛋白的存在。血清样品由具有3种不同基因型(野生型,杂合型和纯合型)的小鼠制备。鼠因子d敲除小鼠(fdko)的nhs和血清用于试验对照。(图12a)通过使用抗人因子d多克隆抗体的免疫蛋白印迹,在正常人血清(nhs)以及杂合和纯合的人因子d敲入(hdki)小鼠中检测到代表人因子d的24kda蛋白条带,而野生型(-/-)和杂合hdki小鼠血清中检测到代表小鼠因子d的约40~45kda条带。(图12b)人因子d蛋白表达可以通过纯合hdki小鼠中的夹心elisa(sandwichelisa)确证。将板用抗人因子d的多克隆抗体(r&d,af1824)涂覆。在用稀释的血清(1/2或1/5)温育后,通过使用生物素缀合的山羊抗人因子d抗体接着用hrp-缀合的链霉抗生物素蛋白检测人因子d。如所预期,在nhs、重组人因子d对照孔井和纯合人因子d敲入而不是野生型小鼠的血清中检测到人因子d。
图13描绘了评价人因子d敲入小鼠血清中lps诱导的ap补体活性的实验结果。即使在无鼠因子d的情况下,也检测到纯合人因子d敲入小鼠中的ap补体活性,表明在这些小鼠中表达的人因子d在体内是功能性的。如所示,lps诱导的ap补体激活试验表明,纯合人因子d敲入小鼠以及野生型小鼠具有血清ap补体活性。另一方面,在该试验中,在鼠因子d敲除小鼠的血清中没有检测到ap补体活性,在用edta处理的wt或纯合敲入小鼠血清中也没有。这些观察结果证实,人因子d的表达能够恢复小鼠ap补体活性,并且敲入小鼠可以用作用于研究ap补体介导的疾病和病症中的因子d靶向疗法的实验动物模型。
图14描绘了评价人因子d敲入小鼠中mab11-81a的体内活性和动力学的实验结果。向纯合人因子d敲入小鼠注射1mg(i.p.)mab11-8a1。在注射前(0小时)收集血清样品,并随后在注射后的不同时间点收集血清样品并测试lps诱导的ap补体激活。如所示,在因子d敲除小鼠血清或用edta处理的nhs中不存在ap补体活性。相反,在0小时时(mab处理前)在nhs和纯合人因子d敲入小鼠的血清中检测到ap补体活性。在mab11-8a1处理后6小时和第1-5天,纯合人因子d敲入小鼠中的ap补体活性受到抑制。ap补体活性在第7天恢复正常。这些结果表明,在1mg/小鼠的剂量下,mab11-8a1可以在体内抑制ap补体活性至多达3-5天。
图15描绘了评价人因子d敲入小鼠中mab1f10-5和无关对照mab(mopc)的体内活性和动力学的实验结果。向纯合人因子d敲入(hdki)小鼠注射1mg(i.p.)mab1f10-5或同种型对照mab(mopc,小鼠igg1)。在注射前(0小时)收集血清样品,并随后在注射后的不同时间点收集血清样品并测试lps诱导的ap补体激活。通过使用山羊抗人因子d多克隆抗体的免疫蛋白印迹评价治疗前和治疗后血清样品中循环人因子d水平的变化。如所示,在因子d敲除小鼠(dko)血清或用edta处理的wt血清中不存在ap补体活性。相反,在0小时(mab处理前)在wt血清和纯合hdki小鼠的血清中检测到ap补体活性。在1f10-5mab处理后,纯合hdki小鼠中的ap补体活性在6h至5天受到不同程度的抑制。它在第7天恢复正常。这些结果表明,当全身给予时,mabif10-5可以引起ap补体活性的持续抑制。免疫蛋白印迹数据显示出由于因子d/抗因子d复合物形成的人因子d在血液中的积累。游离人因子d从肾脏排出并存在于hdki小鼠的尿液中。hdki小鼠中人因子d的血液水平的增加表明,因子d/抗因子d复合物被阻止通过肾脏排泄。同种型对照mab(mopc)不抑制纯合hdki小鼠中的ap补体活性,也不会引起血液中的人因子d积累。
图16描绘了在长期治疗期间评价人因子d敲入小鼠中mab11-8a1的体内活性和动力学的实验结果。将11a8-1mab连续给予于两只纯合人因子d敲入(hdki)小鼠(小鼠id#3和#21,每4天以1mg/小鼠给予mab)在4周期间内引起ap补体活性的持续抑制。如在先前的单剂量实验,mab118a-1引起血液中人因子d的积累,但通过免疫蛋白印迹分析测定,在两只处理的小鼠中,因子d最终达到稳态水平。总之,这些数据证实,通过以适当的剂量和频率向受试者给予抗因子dmab,引起对全身ap补体活性的持续抑制是可行的。
图17,包括图17a和17b,描绘了评价mab11-8a1在预防k/bxn小鼠igg诱导的关节炎中的治疗功效的实验结果。(图17a)纯合人因子d敲入(hdki)小鼠对k/bxn关节炎的易感性。在该模型中,来自关节炎k/bxn小鼠的血清或纯化igg过继性地转移至c57bl/6小鼠中以高度可重复的方式诱导关节炎。该疾病显示出人类风湿性关节炎的许多标志,包括踝部增厚,肿胀和进行性关节破坏。如图a中所示,如同野生型c57bl/6小鼠,hdki小鼠也对k/bxn关节炎易感,这通过接受过继性转移的k/bxn小鼠igg之后的踝厚度和临床评分的增加证明。该数据证实,在ap补体介导的疾病情况下,人因子d在小鼠中是完全功能性的。(图17b)mab11-8a1对hdki小鼠中k/bxn关节炎的治疗功效。给予mab11-8a1(1mg/小鼠,在k/bxn小鼠igg转移之前开始,每4天给予)显著改善关节炎,如通过与用对照mab(mopc)处理的小鼠相比的踝厚度和临床评分减少表示。这些结果证实,通过系统靶向因子d改善局部补体损伤是可行的。
图18描绘了使用人因子d敲入小鼠作为模型评价mab11-8a1在预防血管外溶血(evh)中的治疗功效的实验的结果。用来自野生型和crry/daf/c3三重敲除(tko)小鼠的红血细胞(rbc)输注纯合人因子d敲入(hdki)小鼠。受体hdki小鼠在rbc转移之前24小时用mab118a-1(2mg/小鼠,i.p.)或pbs处理。将ddao-se标记的wt和cfse标记的tko红血细胞(rbc)的1:1混合物通过尾静脉注射到受体小鼠中。在rbc输注后5分钟和第1、2和3天,对受体小鼠放血并分析rbc以确定循环中剩余的输注rbc的百分比。在每个时间点将每个受体小鼠中cfse标记tkorbc的数量归一化(以%表示)至ddao-se标记wtrbc。在没有mab治疗的受体hdki小鼠中,tkorbc通过evh快速消除,与先前的发现一致(miwaetal.,2002,blood99:3707-3716)。然而,在用抗人因子dmab11-8a1处理的受体hdki小鼠中,没有出现evh,并且输注的tkorbc持续存在。这些结果表明,抗人因子dmab在预防evh方面是有效的。
图19,包括图19a至图19d,描绘了使用缺失构建体对mab1f10-5的表位绘图。图19a突出显示了人因子d成熟序列中的氨基酸132-135、155-159(seqidno:23)、173-176(seqidno:24)和202-208。图19b描绘了用于表位绘图的人因子d的四缺失突变体的示意图。这些蛋白由哺乳动物细胞产生。图19c描绘了证实蛋白表达的结果。完整和缺失突变体的上清液(sup)和细胞裂解物(cl)用山羊抗人因子d抗体进行免疫蛋白印迹测试。图19d描绘了通过elisa评价的mab1f10-5对完整和缺失突变蛋白的反应性。这些结果表明,155-159(seqidno:23)处的氨基酸缺失nrrth或173-176(seqidno:24)处的氨基酸缺失snrr破坏了通过mab1f10-5的结合。
图20描绘了评价人因子d敲入小鼠中mab11-8a1、1f10-5和166-32的体内活性的示例性实验的结果。为了评价166-32(参见tanox美国专利号8,124,090)、11-8a1和1f10-5mab在体内阻断旁路途径(ap)补体活性的功效,通过重复给药(1mg/小鼠,每3天,s.c.给予)处理因子d人源化小鼠。在mab处理之前(时间0)和mab处理之后6小时、1、3、6和9天采集血浆样品,并测试lps诱导的ap补体活性。将在不同时间点的ap补体活性归一化于时间0时获得的值的100%。数据表明,与mab166-32相比,mab11-8a1和1f10-5在体内具有优异的药效动力学活性。具体地,mab11-8a1在mab给予后的所有时间都一致地抑制80%至90%的ap补体活性,而mab166-32仅在mab给予后6小时和第1天达到相当的抑制。mabif10-5在第9天显示出50%的ap补体抑制,而几乎全部的mab166-32ap的补体活性的抑制在第9天观察到。
图21描绘了评价嵌合11-8a1mab和嵌合afd在人因子d敲入小鼠中的体内活性的示例性实验的结果。为了评价11-8a1/人igg4嵌合mab和afd/人igg4嵌合mab在体内阻断旁路途径(ap)补体活性中的功效,通过重复给药(1mg/小鼠,每3天,s.c.给予)处理因子d人源化小鼠。在mab处理之前(时间0)和mab处理之后6小时、1、3、6、9、12和15天采集血浆样品,并测试lps诱导的ap补体活性。不同时间点的ap补体活性归一化为时间0时获得的值的100%。afd是mab166-32的人源化形式(参见katschkeetal.,jbiolchem.2012年4月13日;287:12886-12892,wo/2008/055206,美国专利号8,372,403,美国专利号8,273,352,美国专利申请号2014/0212433)。数据表明,11-8a1/人igg4嵌合mab比afd/人igg4嵌合mab中表现出更好的药效动力学分布。具体地,尽管两种mab在mab给予后6小时和第1天导致90%至100%抑制,但是11-8a1/人igg4嵌合体mab,而不是afd/人igg4嵌合mab,在6-15天时引起大于75%的ap补体活性抑制。
具体实施方式
本发明涉及使用抗因子d抗体抑制补体的旁路途径(ap)。在各个实施方式中,本发明涉及通过使个体与抗因子d抗体接触而治疗个体中ap介导的疾病或ap介导的病症的组合物和方法。采用本发明的组合物和方法可以治疗的ap介导的病理和病症包括但不限于黄斑变性(md),年龄相关性黄斑变性(amd),缺血再灌注损伤,关节炎,类风湿性关节炎,哮喘,过敏性哮喘,阵发性睡眠性血红蛋白尿症(pnh)综合征,非典型溶血性尿毒症(ahus)综合征,大疱性表皮松解症,败血症,器官移植,炎症(包括但不限于与心肺旁路手术和肾透析相关的炎症),c3肾小球病、膜性肾病,肾小球肾炎(包括但不限于抗中性粒细胞胞浆抗体(anca)介导的肾小球肾炎,狼疮,及其组合),anca介导的血管炎,志贺毒素诱导的hus和抗磷脂抗体诱导的妊娠丢失,或其任何组合。
定义
除非另外定义,否则本文使用的所有技术和科学术语具有与本发明所属领域的普通技术人员通常理解的含义相同的含义。尽管与本文描述的那些类似或等同的任何方法和材料可以用于本发明的实践或试验,但仍描述示例性方法和材料。
如本文使用的,每个以下术语具有本节中与其相关的含义。
本文中使用的冠词“一个”和“一种”是指该冠词的语法对象的一个或多于一个(即,至少一个)。举例而言,“一个元件”是指一个元件或多于一个元件。
本文所用的术语“抑制(inhibit)”和“抑制(inhibition)”是指相对于对照值,降低、抑制、减少或阻断活性或功能至少约10%。在一些实施方式中,与对照值相比,活性受抑制或阻断50%,或75%,或95%。
术语“有效量”和“药学有效量”是指足以提供期望的生物学效果的药剂的量。效果可以是疾病或病症的体征、症状或原因的减少和/或减轻,或生物系统的任何其他期望的改变。本领域普通技术人员使用常规实验就可以确定任何个体病例的合适有效量。
术语“患者”、“受试者”、“个体”等在本文中可互换使用,并是指任何动物,在一些实施方式中,是指哺乳动物,并且在一些实施方式中,是指人,具有补体系统,包括对病症或其后遗症需要治疗或对病症或其后遗症易感的人。个体可以包括,例如,狗,猫,猪,牛,绵羊,山羊,马,大鼠,猴,小鼠和人。
当在生物体、组织、细胞或其组分的背景中使用时,术语“异常”是指在至少一种可观察或可检测的特征(例如,年龄,治疗,时间等)上与显示“正常”(预期/稳态)的各自特征的那些生物、组织、细胞或其组件不同的那些生物、组织、细胞或其组件。对于一种细胞、组织类型或受试者而言是正常或预期的特征可能对于不同细胞或组织类型则是异常的。
“疾病”是受试者不能维持体内平衡并且如果疾病未得到改善则受试者健康会继续恶化的受试者的健康状态。
相反,受试者中的“病症”是受试者可以维持体内平衡而受试者的健康状况却不如在无病症时有利的的健康状态。如果不治疗,则病症并不一定会导致受试者的健康状况进一步下降。
如果疾病或病症的体征或症状的严重程度、患者经历这种体征或症状的频率或这两者降低,则疾病或病症被“缓解”。
化合物的“有效量”或“治疗有效量”是足以对给予化合物的受试者提供有益效果的化合物的量。
如本文所用,“说明材料”包括出版物、记录、图表或任何其他可以用于传达实现本文引述的各种疾病或病症的缓解的试剂盒中的本发明化合物、组合物、载体或递送系统的有用性的表达介质。可选地或替代地,说明材料可以描述一种或多种减轻哺乳动物细胞或组织中的疾病或病症的方法。本发明的试剂盒的说明材料可以,例如,固定于含有本发明描述的化合物、组合物、载体或递送系统的容器上,或与含有描述的化合物、组合物、载体或递送系统的容器一起运输。可替换地,说明材料可以与容器分开运输,旨在使说明材料和化合物由接受者共同使用。
如本文所用,“可操作地连接”或“操作地连接”可以是指基因的表达处于与其空间上连接的启动子的控制之下。启动子可以位于其控制之下的基因的5'(上游)或3'(下游)。启动子和基因之间的距离可以与该启动子与启动子源自的基因中启动子控制的基因之间的距离大致相同。如本领域已知的,可以调节该距离的变化而不丧失启动子功能。
“治疗性处理”是对表现出疾病或病症的体征的受试者施加的旨在减少或消除这些体征的处理。
如本文所用,“治疗疾病或病症”是指降低患者经历的疾病或病症的体征和/或症状的频率和/或严重性。
本文所用的短语“生物样品”、“样品”或“样本”旨在包括任何包含其中可检测核酸或多肽的表达的细胞、组织或体液的样品。生物样品可以包含适于检测期望的生物标记的任何生物材料,并可以包括从个体获得的细胞和/或非细胞材料。此类生物样品的实例包括但不限于血液,淋巴,骨髓,活检样品和涂片。性质上是液体的样品在本文中称为“体液”。生物样品可以通过多种技术从患者获得,包括例如通过刮擦或擦拭某区域或通过使用针而获得体液。用于收集各种身体样品的方法在本领域中是公知的。
如本文所用,术语“抗体”是指可以特异性结合抗原的特异性表位的免疫球蛋白分子。抗体可以是源自天然来源或源自重组来源的完整的免疫球蛋白,并可以是完整的免疫球蛋白的免疫反应性部分。本发明中的抗体可以以多种形式存在,包括,例如,多克隆抗体,单克隆抗体,细胞内抗体(“胞内抗体”),fv,fab,fab',f(ab)2和f(ab')2,以及单链抗体(scfv),重链抗体,如骆驼抗体,和人源化抗体(harlowetal.,1999,usingantibodies:alaboratorymanual,coldspringharborlaboratorypress,ny;harlowetal.,1989,antibodies:alaboratorymanual,coldspringharbor,newyork;houstonetal.,1988,proc.natl.acad.sci.usa85:5879-5883;birdetal.,1988,science242:423-426)。
本文所用术语“合成抗体”,是指使用重组dna技术产生的抗体,例如,由噬菌体表达的抗体。该术语还应该解释为是指通过合成编码抗体的dna分子并且该dna分子表达抗体蛋白的抗体,或指定抗体的氨基酸序列,其中dna或氨基酸序列使用本领域公知或可用的合成dna或氨基酸序列技术而获得。
如本文所用,术语“重链抗体”或“多个重链抗体”包括通过用肽免疫并随后分离血清,或通过克隆和表达编码此类抗体的核酸序列的衍生自骆驼科物种的免疫球蛋白分子。术语“重链抗体”或“多个重链抗体”进一步包括从患有重链疾病的受试者中分离的免疫球蛋白分子,或通过克隆和表达来自受试者的vh(可变重链免疫球蛋白)基因制备的免疫球蛋白分子。
“嵌合抗体”是指一类工程化抗体,其含有与衍生自受体抗体的轻链和重链恒定区结合的衍生自供体抗体的天然存在的可变区(轻链和重链)。
“人源化抗体”是指一类其cdr源自非人供体免疫球蛋白的工程化抗体,该分子的其余的源自免疫球蛋白的部分源自一种(或多种)人免疫球蛋白。另外,可以改变框架支撑残基以保持结合亲和力(参见,例如,1989,queenetal.,proc.natl.acadsciusa,86:10029-10032;1991,hodgsonetal.,bio/technology,9:421)。合适的人受体抗体可以是选自常规数据库,例如,kabat数据库、losalamos数据库和swissprotein数据库的与供体抗体的核苷酸和氨基酸序列同源的抗体。以与供体抗体的框架区同源性(基于氨基酸)为特征的人抗体可以适合于提供用于插入供体cdr的重链恒定区和/或重链可变框架区。按照类似的方式可以选择出可以提供轻链恒定或可变框架区的合适受体抗体。应该注意的是,受体抗体重链和轻链不需要源自相同的受体抗体。现有技术描述了几种产生这种人源化抗体的方法(参见,例如,ep-a-0239400和ep-a-054951)。
术语“供体抗体”是指将其可变区cdr或其他功能片段或类似物的氨基酸序列贡献于第一免疫球蛋白配偶体(partner)的抗体(单克隆和/或重组),使得提供改变的免疫球蛋白编码区,并导致具有抗原特异性的表达的改变的抗体和中和供体抗体的活性特征。
术语“受体抗体”是指与供体抗体异源的抗体(单克隆和/或重组),其贡献编码其重链和/或轻链框架区和/或其重链和/或轻链恒定区的所有(或任何部分,但在一些实施方式中为全部)氨基酸序列于第一免疫球蛋白配偶体。在某些实施方式中,人抗体是受体抗体。
“cdr”定义为抗体的互补决定区氨基酸序列,其是免疫球蛋白重链和轻链的高变区。参见,例如,kabatetal.,sequencesofproteinsofimmunologicalinterest,4thed,u.s.departmentofhealthandhumanservices,nationalinstitutesofhealth(1987)。在免疫球蛋白的可变部分中存在三个重链和三个轻链cdr(或cdr区)。因此,如本文所用,“cdr”是指所有三个重链cdr,或全部三个轻链cdr(或者,如果合适,是指所有重链和所有轻链cdr)。抗体的结构和蛋白折叠可以是指其他残基被认为是抗原结合区域的部分,并且技术人员将会理解为如此。参见,例如,chothiaetal.,(1989)conformationsofimmunoglobulinhypervariableregions;nature342,p877-883。
如本文所用,“免疫试验”是指使用能够特异性结合靶分子的抗体检测和定量靶分子的任何结合试验。
本文关于抗体使用的术语“特异性结合”是指识别并结合特异性靶分子而基本上不识别或结合样品中的其他分子的抗体。在一些情况下,术语“特异性结合”或“特异性地结合”用于表示识别和结合取决于靶分子上特定结构(例如,抗原决定基或表位)的存在。例如,如果抗体特异性结合表位“a”,则在含有标记的“a”的反应和抗体中含有表位a(或游离的,未标记的a)的未标记分子的存在将会减少结合至抗体的标记a的量。
“crispr/cas”系统是指用于防御外来核酸的广泛种类的细菌系统。crispr/cas系统存在于宽范围的真细菌(eubacterial)和古细菌(archaeal)生物体中。crispr/cas系统包括i型、ii型和iii型亚型。野生型ii型crispr/cas系统利用复合物中的rna介导的核酸酶cas9,指导和激活rna以识别和切割外源核酸。cas9同系物存在于多种真细菌中,包括,但不限于,以下分类群的细菌:放线菌门(actinobacteria),产水菌门(aquificae),拟杆菌门(bacteroidetes)-氯菌门(chlorobi),衣原体门(chlamydiae)-疣微菌门(verrucomicrobia),绿弯菌门(chlroflexi),蓝细菌门(cyanobacteria),厚壁菌门(firmicutes),变形菌门(proteobacteria),螺旋体门(spirochaetes)和热袍菌门(thermotogae)。示例性的cas9蛋白是酿脓链球菌cas9蛋白。另外的cas9蛋白及其同源物描述于,例如,chylinksietal.,rnabiol.2013年5月1日;10(5):726-737;nat.rev.microbiol.2011年6月;9(6):467-477;hou,etal.,procnatlacadsciusa.2013年9月24日;110(39):15644-9;sampsonetal.,nature.2013年5月9日;497(7448):254-7;和jinek,etal.,science.2012年8月17日;337(6096):816-21中。
基因的“编码区”由基因编码链的核苷酸残基和基因的非编码链的核苷酸构成,其分别与通过基因的转录产生的mrna分子的编码区同源或互补。
mrna分子的“编码区”也由与mrna分子翻译期间的转移rna分子的反密码子区域匹配或编码终止密码子的mrna分子的核苷酸残基构成。因此,编码区可以包括包含不存在于由mrna分子编码的成熟蛋白中的氨基酸残基(例如,蛋白输出信号序列中的氨基酸残基)的密码子的核苷酸残基。
“差异性减少的表达”或“下调”是指比对照低至少10%或更多,例如,20%,30%,40%,或50%,60%,70%,80%,90%或更少,和/或低2.0倍,1.8倍,1.6倍,1.4倍,1.2倍,1.1倍或更少的生物标志物产物水平,及其之间的任何和所有的全部或部分增量。
“差异性增加的表达”或“上调”是指比对照高至少10%或更多,例如,20%,30%,40%或50%,60%,70%,80%,90%或更多,和/或高1.1倍,1.2倍,1.4倍,1.6倍,1.8倍,2.0倍或更多的生物标志物产物水平,及其之间的任何和所有全部或部分增量。
如本文所用,“互补的”是指核酸,是指两条核酸链的区域之间或相同核酸链的两个区域之间的序列互补性的广义概念。已知第一核酸区域的腺嘌呤残基能够与第二核酸区域的残基形成特异性氢键(“碱基配对”),如果残基是胸腺嘧啶或尿嘧啶,则第二核酸区域的残基与第一区域反平行。类似地,已知第一核酸链的胞嘧啶残基可以与第二核酸链的残基碱基配对,如果残基是鸟嘌呤,则第二核酸链与第一链反平行。如果当两个区域以反平行方式排列时,第一区域的至少一个核苷酸残基能够与第二区域的残基碱基配对,则核酸的第一区域与相同或不同核酸的第二区域互补。在一些实施方式中,第一区域包含第一部分,且第二区域包含第二部分,由此,当第一和第二部分以反平行方式排列时,第一部分至少约50%,或至少约75%,或至少约90%,或至少约95%的核苷酸残基能够与第二部分中的核苷酸残基碱基配对。在一些实施方式中,第一部分的所有核苷酸残基可以与第二部分中的核苷酸残基碱基配对。
本文所用的术语“dna”定义为脱氧核糖核酸。
“编码”是指用作在生物过程中合成其他聚合物和大分子的模板,具有定义的核苷酸(即,rrna,trna和mrna)序列或定义的氨基酸序列的多核苷酸如基因、cdna或mrna中的特定核苷酸序列的固有特性和由此产生的生物学特性。因此,如果对应于该基因的mrna的转录和翻译在细胞或其他生物系统中生产蛋白,则基因编码蛋白。其核苷酸序列与mrna序列相同并通常提供于序列表中的编码链和用作基因或cdna转录的模板的非编码链二者可以称为编码蛋白质或该基因或cdna的其他产物。
除非另有说明,否则“编码氨基酸序列的核苷酸序列”包括彼此的简并形式且编码相同氨基酸序列的所有核苷酸序列。短语“编码蛋白的核苷酸序列或rna”也可以以编码蛋白的核苷酸序列可以在某些形式中包含内含子的程度包括内含子。
“分离的”是指从天然状态改变或移除的。例如,以其正常环境天然存在于活体受试者中的核酸或肽并非是“分离的”,而与其天然环境的共存材料部分或完全分离的相同核酸或肽是“分离的”。分离的核酸或蛋白可以以基本上纯化的形式存在,或可以存在于非天然环境,例如,宿主细胞中。
本文所用的术语“杂交瘤”是指由b淋巴细胞和融合配偶体如骨髓瘤细胞融合而产生的细胞。杂交瘤可以无限克隆和维持于细胞培养物中,并可以产生单克隆抗体。杂交瘤也可以当作杂交细胞。
“分离的核酸”是指已经与天然存在状态下与其侧接的序列分离的核酸片段或片段,即已经从通常与片段相邻的序列(即在其天然产生的基因组中与片段相邻的序列)中移除的dna片段。该术语也适用于从天然伴随核酸的其他组分(即,在细胞中天然伴随其的rna或dna或蛋白)中基本纯化的核酸。因此,该术语包括例如并入到载体中,并入到自主复制的质粒或病毒中,或并入到原核生物或真核生物的基因组dna中,或作为独立于其他序列的单独分子(即,作为由pcr或限制酶消化产生的cdna或基因组或cdna片段)存在的重组dna。其还包括编码另外的多肽序列的杂合基因的一部分的重组dna。
在本发明的上下文中,使用了以下对常见核酸碱基的缩写。“a”是指腺苷,“c”是指胞嘧啶,“g”是指鸟苷,“t”是指胸苷,“u”是指尿苷。
如本文使用的术语“多核苷酸”定义为核苷酸的链。此外,核酸是核苷酸的聚合物。因此,核酸和本文使用的多核苷酸是可互换的。本领域技术人员通常知道核酸是多核苷酸,其可以水解成单体“核苷酸”。单体核苷酸可以水解成核苷。如本文使用的,多核苷酸包括但不限于通过本领域可以使用的任何方法,包括但不限于重组方法,即从重组库或细胞基因组,使用普通克隆技术和pcr等,并通过合成方法克隆核酸序列而获得的所有核酸序列。
如本文使用的术语“肽”、“多肽”和“蛋白”可以互换使用,并且是指由通过肽键共价连接的氨基酸残基构成的化合物。蛋白或肽必须含有至少两个氨基酸,并且可以包含蛋白或肽的序列的氨基酸最大数量没有限制。多肽包括通过肽键彼此连接的包含两个或更多个氨基酸的任何肽或蛋白。如本文使用,该术语既是指,例如,在本领域中通常也称为肽、寡肽和寡聚体的短链,也是指通常在本领域中称为蛋白的长链,其存在很多类型。“多肽”包括,例如,生物活性片段,基本同源的多肽,寡肽,同源二聚体,异源二聚体,多肽变体,改性多肽,衍生物,类似物,融合蛋白等。多肽包括天然肽,重组肽,合成肽,或其组合。
如本文使用的术语“后代(progeny)”是指后裔(descentdent)或子孙(offspring)并包括哺乳动物的子孙,并且还包括源自亲本细胞的分化或未分化的后代细胞。在一种用法中,术语后代是指与亲本在遗传上相同的后代细胞。在另一种用途中,术语后代是指在遗传上和表型上与亲本相同的后代细胞。在还有的另一种用法中,术语后代是指由亲本细胞分化而成的后代细胞。
如本文使用的术语“rna”定义为核糖核酸。
如本文使用的术语“重组dna”定义为通过连接来自不同来源的dna片段而产生的dna。
如本文使用的术语“重组多肽”定义为通过使用重组dna方法产生的多肽。
如本文使用,“缀合的”是指一个分子与第二分子的共价连接。
本文使用的术语“变体”是分别与参考核酸序列或肽序列不同,但保留参考分子的基本生物学特性的核酸序列或肽序列。核酸变体的序列变化可以不改变由参考核酸编码的肽的氨基酸序列,或可以导致氨基酸取代、添加、缺失、融合和截短。肽变体序列的变化通常是有限的或保守的,使得参考肽和变体的序列总体上非常相似,并且在许多区域中是相同的。变体和参考肽可以因为以任何组合的一个或多个取代、添加、缺失而在氨基酸序列上不同。核酸或肽的变体可以是天然存在的,如等位基因变体,或可以是未知天然存在的变体。核酸和肽的非天然变体可以通过诱变技术或通过直接合成而制备。在各种实施方式中,变体序列与参考序列具有至少99%,至少98%,至少97%,至少96%,至少95%,至少94%,至少93%,至少92%,至少92%,至少91%,至少90%,至少89%,至少88%,至少87%,至少86%,至少85%的同一性。
如本文使用的术语“调节”可以是指任何改变底物水平或活性的方法。关于蛋白的调节的非限制性实例包括影响表达(包括转录和/或翻译),影响折叠,影响降解或蛋白转换,以及影响蛋白定位。关于酶的调节的非限制性实例进一步包括影响酶活性。“调节剂”是指其活性包括影响底物水平或活性的分子。调节剂可以是是直接的或间接的。调节剂的功能可以是激活或抑制或以其他方式调节其底物。
如本文使用,“扫描窗口”是指多个连续位置的片段,其中可以独立评价任何侧接序列的序列。扫描窗口通常沿着要评价的序列的长度递增地移位,且每个新的片段独立评价。增量移位可以是1个或多于一个位置。
如本文使用的“载体”可以指含有复制起点的核酸序列。载体可以是质粒,噬菌体,细菌人工染色体或酵母人工染色体。载体可以是dna或rna载体。载体可以是自我复制的染色体外载体或整合到宿主基因组中的载体。
术语“育种”本文中用于表示物种的繁殖,其结果是产生至少一个后代。
术语“天然育种”本文中用于表示通过性结合而繁殖物种。
术语“近交动物”在本文中用于表示与相同物种的其他类似动物杂交而保持和固定某些特征,或防止其他特征被引入育种群体的动物。
术语“远交动物”在本文中用于表示与任何其他动物或同一物种的受试者繁育而不考虑某些特征的保持的动物。
范围:整个本公开中,本发明的各个方面可以以范围形式呈现。应该理解的是,范围形式的描述仅仅是为了方便和简洁,而不应该解释为对本发明范围的不可改变的限制。因此,范围的描述应该当作已经具体公开了所有可能的子范围以及该范围内的各个数值。例如,诸如1至6的范围的描述应该认为具有专门公开的子范围,如1至3,1至4,1至5,2至4,2至6,3至6等,以及该范围内的各个数字,例如,1,2,2.7,3,4,5,5.3和6。无论范围的广度如何,这都适用。
描述
本发明涉及使用抗人因子d抗体抑制补体的旁路途径(ap)。在一个实施方式中,本发明涉及治疗和预防由不希望的、失控的、过量的ap补体激活介导的炎症和自身免疫疾病的方法。在一个实施方式中,本发明涉及通过使个体与抗因子d抗体接触而治疗个体中ap介导疾病或ap介导病症。
在一个实施方式中,本发明是一种治疗个体中ap介导的疾病或病症的方法,包括向个体给予抗因子d抗体从而抑制c3bbb蛋白复合物产生的步骤。使用本发明的方法可以治疗的补体介导的病理的实例包括,但不限于,黄斑变性(md),年龄相关性黄斑变性(amd),缺血再灌注损伤,关节炎,类风湿性关节炎,哮喘,过敏性哮喘,阵发性睡眠性血红蛋白尿症(pnh)综合征,非典型溶血性尿毒症(ahus)综合征,大疱性表皮松解症,败血症,器官移植,炎症(包括,但不限于,与心肺旁路手术和肾透析相关的炎症),c3肾小球病,膜性肾病,肾小球肾炎(包括,但不限于,抗中性粒细胞胞质抗体(anca)介导的肾小球肾炎,狼疮,及其组合),anca介导的血管炎,志贺毒素诱导的hus和抗磷脂抗体诱导的妊娠丢失,或其组合。
免疫系统区分“自身”和“非自身”抗原的能力对免疫系统作为特异性防御入侵微生物的功能是重要的。“非自身”抗原是进入或存在于体内,与受试者的自身组分可检测出不同或相对其是外来的物质上的抗原,而“自身”抗原是在健康受试者中与其自身组分不可检测出不同或相对其不是外来的那些。在方法的各实施方式中,受抑制的ap活化是由微生物抗原、非生物外来表面、改变的自身组织或其组合中至少一种触发的活化。非生物异物表面的一个实例是血管导管,如用于心肺旁路手术或肾透析的那些。改变的自身组织的实例包括凋亡的、坏死的和局部缺血应激的组织和细胞,或其组合。
在一些实施方式中,本发明的抗因子d抗体抑制ap,但不抑制经典途径(cp)或凝集素途径(lp)的活化。通常,cp由抗原-抗体复合物引发,lp通过凝集素与微生物表面上的糖分子结合而活化,而ap在低水平上具有组成活性,但可以在细菌、病毒和寄生细胞表面上由于缺乏调节蛋白而快速扩增。通常通过调节蛋白保护宿主细胞免受ap补体激活。但在某些情况下,如当调节蛋白缺陷或缺失时,ap也可以在宿主细胞上失控激活,导致补体介导的疾病或病症。cp由组分c1、c2、c4构成,并在c3激活步骤时与ap聚集。lp由甘露糖结合的凝集素(mbl)和mbl相关的丝氨酸蛋白酶(masps)组成,并与cp共享组分c4和c2。ap由组分c3和若干因子如因子b、因子d和流体相调节因子h组成。补体激活包括三个阶段:(a)识别,(b)酶促激活,和(c)膜攻击导致细胞死亡。cp补体激活的第一阶段以c1开始。c1由三种不同的蛋白组成:识别亚基clq,和丝氨酸蛋白酶亚组分c1r和c1s,其在钙依赖性四聚体复合物c1r2s2中结合至一起。完整c1复合物对于c1的生理激活成功是必需的。当完整c1复合物结合于与抗原复合的免疫球蛋白时发生激活。该种结合会激活c1s,随后c1s既切割c4蛋白又切割c2蛋白而产生c4a和c4b,以及c2a和c2b。c4b和c2a片段化合形成c3转化酶c4b2a,其由此切割c3而形成c3a和c3b。通过mbl与靶表面上的某些糖结合启动lp的激活,并且这会触发masps的激活,其随后以类似于cp的c1s活性的方式切割c4和c2,导致c3转化酶c4b2a的产生。因此,cp和lp通过不同的机制激活,但它们共享相同组分c4和c2,并且两种途径都导致相同的c3转化酶c4b2a的产生。由于两个原因,c4b2a将c3切割成c3b和c3a是补体途径的中心事件。其会启动ap扩增循环,因为表面沉积的c3b是ap的中心中间体。c3a和c3b都是生物学上重要的。c3a是促炎性的,并与c5a一起被称为过敏毒素。c3b及其进一步的切割产物还与存在于嗜中性粒细胞、嗜酸性粒细胞、单核细胞和巨噬细胞上的补体受体结合,从而促进c3b调理作用的颗粒的吞噬和清除。最后,c3b可以与c4b2a缔合而形成cp和lp的c5转化酶,以激活末端补体序列,从而产生c5a,这种有效的促炎介质,和裂解膜攻击复合物(mac)c5-c9的组装。
由于c3自发水解形成c3(h2o),认为ap在低水平上具有组成活性。c3(h2o)行为如同c3b,因为其可以与fb结合,这使fb易受fd切割和激活。然后,产生的c3(h2o)bb会切割c3而产生c3b和c3a,通过形成ap的c3转化酶c3bbb启动ap级联。随着初始c3转化酶产生含量渐增的c3b,建立扩增循环。应当注意的是,因为cp和lp也会产生c3b,其中c3b可以结合因子b并与ap结合,一旦这些途径被激活,则ap扩增循环也参与在cp和lp中。因此,ap由两个功能实体构成:与cp或lp无关的独立补体激活途径,和参与并有助于cp和lp的完全显现的扩增过程。因此,在一些实施方式中,本发明的抗因子d抗体会抑制扩增过程或扩增循环。
在一个实施方式中,使用本发明的方法抑制的ap的活性是由选自脂多糖(lps)、脂寡糖(los)、病原体相关分子模式(pamp)和危险相关的分子模式(damps)的组中的至少一种诱导的ap活化。在另一个实施方式中,使用本发明方法抑制的ap的活性是c3bbb蛋白复合物的产生。在另一个实施方式中,使用本发明方法抑制的ap的活性是因子d依赖性的。
在一些实施方式中,本发明的方法保留了个体通过cp和lp对抗感染的能力。在一个实施方式中,本发明是抑制个体中细菌脂寡糖(los)诱导的ap活化的方法,包括向个体给予抗因子d抗体并由此抑制细菌los诱导的ap活化的步骤。在另一个实施方式中,本文提供了抑制细菌lps诱导的ap活化的方法。在某些实施方式中,ap活化是由伤寒沙门氏菌(s.typhosa)lps诱导的,且本文提供的方法中使用的抑制剂并不抑制由明尼苏达沙门氏菌(s.minnesota)lps或大肠杆菌lps诱导的ap活性。在各种实施方式中,本发明的抗因子d抗体会抑制ap,而不抑制cp触发的补体激活、lp触发的补体激活、酵母聚糖诱导的激活或眼镜蛇毒因子诱导的激活。
在一个实施方式中,本文提供了抑制个体中病原体相关的分子模式介导的ap活化的方法,包括向个体给予抗因子d抗体并由此抑制pamp介导的ap活化的步骤。通过本发明的方法可以抑制其ap活化的pamp的实例包括但不限于胞壁酰二肽(mdp),来自细菌dna的cpg基序,双链病毒rna,肽聚糖,脂磷壁酸,来自伯氏疏螺旋体(borreliaburgdorferi)的外表面蛋白a,合成支原体巨噬细胞活化的脂蛋白-2,三棕榈酰基-半胱氨酰-丝氨酰-(赖氨酰)3-赖氨酸(p3csk4),二棕榈酰-csk4(p2-csk4),单棕榈酰-csk4(pcsk4),两性霉素b,三酰化或二酰化细菌多肽,及它们的组合。
在一个实施方式中,本发明是抑制个体中ap活化的起始的方法,包括向个体给予抗因子d抗体从而抑制个体中ap活化的起始的步骤。在另一个实施方式中,本文提供了抑制个体中ap活化的扩增的方法,包括向个体给予ap的抑制剂从而抑制个体中ap活化的扩增的步骤。这些实施方式的实例是患有ap补体介导的溶血症的pnh患者和患有ap补体介导的ahus、哮喘、缺血/再灌注损伤、类风湿性关节炎和anca介导的肾病的个体。在本发明的各种实施方式中,使用本发明的组合物和方法可以治疗的疾病和病症包括但不限于ap补体介导的溶血症,ap补体介导的ahus,哮喘,缺血/再灌注损伤,类风湿关节炎和anca介导的肾脏疾病或病症。
在各种实施方式中,本文提供了识别对ap具有抑制作用的潜在抗体的方法,包括以下步骤:a)将抗因子d抗体给予个体;b)测量个体的产生的表型;和c)将产生的个体表型与因子d-/-敲除动物的表型比较。在另一个实施方式中,通过使用因子d-/-敲除动物选择潜在治疗化合物的方法识别出本文提供的方法中使用的抗因子d抗体。
在各种其他实施方式中,本文提供了识别对ap具有抑制作用的潜在抗因子d抗体的方法。一种这样的方法包括以下步骤:a)用脂多糖(lps)涂覆板;b)洗涤板以除去未结合的lps;c)在磷酸盐缓冲盐水(pbs)中加入牛血清白蛋白(bsa);d)洗涤板以除去未结合的bsa;e)向标准人血清中加入并混合已经与血清预温育的候选抗因子d抗体化合物的混合物;f)洗涤板;g)加入hrp缀合的抗人c3抗体;h)洗涤板以除去未结合的抗体;i)加入hrp底物试剂;j)加入硫酸以终止反应;k)测量450nm下的光学密度;l)将含有候选抗因子d抗体化合物的板的光学密度与阳性比较对照和阴性比较对照的光学密度进行比较;其中当与阳性比较对照相比光学密度减小时,识别出抗因子d抗体。
抗因子d抗体
在一些实施方式中,本发明包括含有特异性结合因子d的抗体的组合物。在一个实施方式中,抗因子d抗体是多克隆抗体。在另一个实施方式中,抗因子d抗体是单克隆抗体。在一些实施方式中,抗因子d抗体是嵌合抗体。在进一步的实施方式中,抗因子d抗体是人源化抗体。在一些实施方式中,抗体是抗体片段。在一些实施方式中,因子d是人因子d。
在一些实施方式中,抗体或抗体片段与人因子d的结合与完整生物体中补体激活途径中c3bbb的产生减少相关。在一些实施方式中,本发明是能够结合人因子d的蛋白或多肽。在一些实施方式中,抗体或抗体片段;蛋白或多肽与人因子d的相关部分或片段或表位结合;并且抗体或其抗体片段,或蛋白或多肽与人因子d的相关部分的结合与完整生物体中c3bbb的产生减少有关。
在一些实施方式中,抗因子d结合抗体或其因子d结合抗体片段与蛋白、肽或其他化合物缀合。在一些实施方式中,与抗因子d抗体或其抗体片段缀合的蛋白、肽或其他化合物是靶向部分(即,靶向部分特异性结合除因子d之外的分子)。在一些实施方式中,与抗因子d抗体或其抗体片段缀合的蛋白、肽或其他化合物是效应剂分子(例如,细胞毒性分子)。
在一个实施方式中,抗因子d抗体或其抗原结合片段包含选自由以下组成的组的至少一种cdr:vh-cdr1:seqidno:3;vh-cdr2:seqidno:4;vh-cdr3:seqidno:5;vl-cdr1:seqidno:8;vl-cdr2:seqidno:9;和vl-cdr3:seqidno:10,或其一种或多种变体。在另一个实施方式中,抗因子d抗体包含由以下组成的组的所有cdr:vh-cdr1:seqidno:3;vh-cdr2:seqidno:4;vh-cdr3:seqidno:5;vl-cdr1:seqidno:8;vl-cdr2:seqidno:9;和vl-cdr3:seqidno:10,或其一种或多种变体。
在一些实施方式中,抗因子d抗体或其抗原结合片段包含:vh-cdr1,含有seqidno:3的氨基酸序列,或其包含至多达约3个(如约1、2或3个中的任一种)氨基酸取代的变体;和vl-cdr1:seqidno:8,或其包含至多达约3个(如约1、2或3个中的任一种)氨基酸取代的变体。在一些实施方式中,抗因子d抗体或其抗原结合片段包含:vh-cdr1,包含seqidno:3的氨基酸序列;和vl-cdr1:seqidno:8。
在一些实施方式中,抗因子d抗体或其抗原结合片段包含:vh-cdr2,含有seqidno:4的氨基酸序列,或其包含至多达约3个(如约1、2或3个中的任一种)氨基酸取代的变体;和vl-cdr2:seqidno:9,或其包含至多达约3个(如约1、2或3个中的任一种)氨基酸取代的变体。在一些实施方式中,抗因子d抗体或其抗原结合片段包含:vh-cdr2,包含seqidno:4的氨基酸序列;和vl-cdr2:seqidno:9。
在一些实施方式中,抗因子d抗体或其抗原结合片段包含:vh-cdr3,含有seqidno:5的氨基酸序列,或包含至多达约3个(如约1、2或3个中的任一种)氨基酸取代的变体;和vl-cdr3:seqidno:10,或其包含至多达约3个(如约1、2或3个中的任一种)氨基酸取代的变体。在一些实施方式中,抗因子d抗体或其抗原结合片段包含:vh-cdr3,含有seqidno:5的氨基酸序列;和vl-cdr3:seqidno:10。
在一些实施方式中,抗因子d抗体或其抗原结合片段包含:vh-cdr1,含有seqidno:3的氨基酸序列,或其包含至多达约3个(如约1、2或3个中的任一种)氨基酸取代的变体;vh-cdr2,包含seqidno:4的氨基酸序列,或其包含至多达约3个(如约1、2或3个中的任一种)氨基酸取代的变体;vh-cdr3,含有seqidno:5的氨基酸序列,或其包含至多达约3个(如约1、2或3个中的任一种)氨基酸取代的变体;vl-cdr1,包含seqidno:8的氨基酸序列,或其包含至多达约3个(如约1、2或3个中的任一种)氨基酸取代的变体;vl-cdr2,含有seqidno:9的氨基酸序列,或其包含至多达约3个(如约1、2或3个中的任一种)氨基酸取代的变体;vl-cdr3,含有seqidno:10的氨基酸序列,或其包含至多达约3个(如约1、2或3个中的任一种)氨基酸取代的变体。
在一些实施方式中,抗因子d抗体或其抗原结合片段包含:vh-cdr1,含有seqidno:3的氨基酸序列,或其包含至多达约3个(如约1、2或3个中的任一种)氨基酸取个的变体;vh-cdr2,含有seqidno:4的氨基酸序列,或其包含至多达约3个(如约1、2或3个中的任一种)氨基酸取代的变体;vh-cdr3,含有seqidno:5的氨基酸序列;vl-cdr1,含有seqidno:8的氨基酸序列,或其包含至多达约3个(如约1、2或3个中的任一种)氨基酸取代的变体;vl-cdr2,含有seqidno:9的氨基酸序列,或其包含至多达约3个(如约1、2或3个中的任一种)氨基酸取代的变体;和vl-cdr3,含有seqidno:10的氨基酸序列。
在一些实施方式中,抗因子d抗体或其抗原结合片段包含:vh-cdr1,含有seqidno:3的氨基酸序列;vh-cdr2,含有seqidno:4的氨基酸序列;vh-cdr3,含有seqidno:5的氨基酸序列;vl-cdr1,含有seqidno:8的氨基酸序列;vl-cdr2,含有seqidno:9的氨基酸序列;和vl-cdr3,含有seqidno:10的氨基酸序列。
在一些实施方式中,抗因子d抗体或其抗原结合片段包含含有seqidno:2的氨基酸序列的重链或其变体。在其他实施方式中,抗因子d抗体包含含有seqidno:7的氨基酸序列的轻链或其变体。在另一个实施方式中,抗因子d抗体是命名为mab11-8a1的单克隆抗体。命名为mab11-8a1的单克隆抗因子d抗体包含含有seqidno:2的氨基酸序列的重链或其变体,和含有seqidno:7的氨基酸序列的轻链,或其变体。在一些实施方式中,单克隆抗因子d抗体是人源化的。在一些实施方式中,命名为mab11-8a1的单克隆抗因子d抗体是嵌合抗体。
在一个实施方式中,抗因子d抗体或其抗原结合片段包含选自由以下组成的组的cdr中的至少一种:vh-cdr1:seqidno:13;vh-cdr2:seqidno:14;vh-cdr3:seqidno:15;vl-cdr1:seqidno:18;vl-cdr2:seqidno:19;和vl-cdr3:seqidno:20,或其一种或多种变体。在另一个实施方式中,抗因子d抗体包含由以下组成的组的所有cdr:vh-cdr1:seqidno:13;vh-cdr2:seqidno:14;vh-cdr3:seqidno:15;vl-cdr1:seqidno:18;vl-cdr2:seqidno:19;和vl-cdr3:seqidno:20,或其一种或多种变体。
在一些实施方式中,抗因子d抗体或其抗原结合片段包含:vh-cdr1,含有seqidno:13的氨基酸序列,或其包含至多达约3个(如约1、2或3个中的任一种)氨基酸取代的变体;和vl-cdr1:seqidno:18,或其包含至多达约3个(如约1、2或3个中的任一种)氨基酸取代的变体。在一些实施方式中,抗因子d抗体或其抗原结合片段包含:vh-cdr1,含有seqidno:13的氨基酸序列;和vl-cdr1:seqidno:18。
在一些实施方式中,抗因子d抗体或其抗原结合片段包含:vh-cdr2,含有seqidno:14的氨基酸序列,或其包含至多达约3个(如约1、2或3个中的任一种)氨基酸取代的变体;和vl-cdr2:seqidno:19,或其包含至多达约3个(如约1、2或3个中的任一种)氨基酸取代的变体。在一些实施方式中,抗因子d抗体或其抗原结合片段包含:vh-cdr2,含有seqidno:14的氨基酸序列;和vl-cdr2:seqidno:19。
在一些实施方式中,抗因子d抗体或其抗原结合片段包含:vh-cdr3,含有seqidno:15的氨基酸序列,或其包含至多达约3个(如约1、2或3个中的任一种)氨基酸取代的变体;和vl-cdr3:seqidno:20,或其包含至多达约3个(如约1、2或3个中的任一种)氨基酸取代的变体。在一些实施方式中,抗因子d抗体或其抗原结合片段包含:vh-cdr3,含有seqidno:15的氨基酸序列;和vl-cdr3:seqidno:20。
在一些实施方式中,抗因子d抗体或其抗原结合片段包含:vh-cdr1,含有seqidno:13的氨基酸序列,或其包含至多达约3个(如约1、2或3个中的任一种)氨基酸取代的变体;vh-cdr2,含有seqidno:14的氨基酸序列,或其包含至多达约3个(如约1、2或3个中的任一种)氨基酸取代的变体;vh-cdr3,含有seqidno:15的氨基酸序列,或其包含至多达约3个(如约1、2或3个中的任一种)氨基酸取代的变体;vl-cdr1,含有seqidno:18的氨基酸序列,或其包含至多达约3个(如约1、2或3个中的任一种)氨基酸取代的变体;vl-cdr2,含有seqidno:19的氨基酸序列,或其包含至多达约3个(如约1、2或3个中的任一种)氨基酸取代的变体;vl-cdr3,包含seqidno:20的氨基酸序列,或其包含至多达约3个(如约1、2或3个中的任一种)氨基酸取代的变体。
在一些实施方式中,抗因子d抗体或其抗原结合片段包含:vh-cdr1,含有seqidno:13的氨基酸序列,或其包含至多达约3个(如约1、2或3个中的任一种)氨基酸取代的变体;vh-cdr2,含有seqidno:14的氨基酸序列,或其包含至多达约3个(如约1、2或3个中的任一种)氨基酸取代的变体;vh-cdr3,含有seqidno:15的氨基酸序列;vl-cdr1,含有seqidno:18的氨基酸序列,或其包含至多达约3个(如约1、2或3个中的任一种)氨基酸取代的变体;vl-cdr2,含有seqidno:19的氨基酸序列,或其包含至多达约3个(如约1、2或3个中的任一种)氨基酸取代的变体;和vl-cdr3,含有seqidno:20的氨基酸序列。
在一些实施方式中,抗因子d抗体或其抗原结合片段包含:vh-cdr1,含有seqidno:13的氨基酸序列;vh-cdr2,含有seqidno:14的氨基酸序列;vh-cdr3,含有seqidno:15的氨基酸序列;vl-cdr1,含有seqidno:18的氨基酸序列;vl-cdr2,含有seqidno:19的氨基酸序列;和vl-cdr3,含有seqidno:20的氨基酸序列。
在一些实施方式中,抗因子d抗体包含含有seqidno:12的氨基酸序列的重链,或其变体。在其他实施方式中,抗因子d抗体包含含有seqidno:17的氨基酸序列的轻链,或其变体。在另一个实施方式中,抗因子d抗体是命名为mab1f10-5的单克隆抗体。命名为mab1f10-5的单克隆抗因子d抗体包含含有seqidno:12的氨基酸序列的重链或其变体,和含有seqidno:17的氨基酸序列的轻链或其变体。在一些实施方式中,单克隆抗因子d抗体是人源化的。在一些实施方式中,单克隆抗因子d抗体是嵌合抗体。
在一些实施方式中,分离的抗体结合人因子d,其中抗体可替代地结合因子d的第一表位和第二表位中的任一个,其中第一表位和第二表位均具有在其二级结构中呈现卷绕构象的部分,并且其中因子d在其二级结构中呈现β-链构象的部分位于第一表位和第二表位之间。
在一些实施方式中,本发明的抗因子d抗体是结合因子d的特异性表位的抗体。在一个实施方式中,seqidno:21的至少一个(如至少1、2、3或4个)氨基酸位于抗因子d抗体的表位中。seqidno:21的氨基酸对应于因子d氨基酸序列的氨基酸107-110。在一个实施方式中,seqidno:22的至少一个(如至少1、2、3或4个)氨基酸位于抗因子d抗体的表位中。seqidno:22的氨基酸对应于因子d氨基酸序列的氨基酸148-151。在一个实施方式中,seqidno:23的至少一个(如至少1、2、3、4或5个)氨基酸位于抗因子d抗体的表位中。seqidno:23的氨基酸对应于因子d氨基酸序列的氨基酸155-159。在一个实施方式中,seqidno:24的至少一个(如至少1、2、3或4个)氨基酸位于抗因子d抗体的表位中。seqidno:24的氨基酸对应于因子d氨基酸序列的氨基酸173-176。
在一个实施方式中,抗因子d抗体是结合seqidno:21的至少一个(如至少1、2、3或4个)氨基酸的抗体。在一个实施方式中,抗因子d抗体是结合seqidno:22的至少一个(如至少1、2、3或4个)氨基酸的抗体。在一个实施方式中,抗因子d抗体是结合seqidno:23的至少一个(如至少1、2、3、4或5个)氨基酸的抗体。在一个实施方式中,抗因子d抗体是结合seqidno:24的至少一个(如至少1、2、3或4个)氨基酸的抗体。
在另一个实施方式中,抗因子d抗体是与结合至seqidno:21的至少一个(例如至少1、2、3或4个)氨基酸的抗体竞争结合的抗体。在另一个实施方式中,抗因子d抗体是与结合至seqidno:22的至少一个(如至少1、2、3或4个)氨基酸的抗体竞争结合的抗体。在一个实施方式中,抗因子d抗体是与结合至seqidno:23的至少一个(如至少1、2、3、4或5个)氨基酸的抗体竞争结合的抗体。在另一个实施方式中,抗因子d抗体是与结合至seqidno:24的至少一个(如至少1、2、3或4个)氨基酸的抗体竞争结合的抗体。
在一些实施方式中,抗人因子d抗体或其抗原结合片段与选自人因子d的seqidno:21、22、23和24的至少任何一个(如至少1、2、3、4或5个)氨基酸序列在活生物体内的结合与生物体的c3bbb生成的减少有关。在一些实施方式中,生物体是人。在一些实施方式中,抗因子d抗体是mab11-8a1或mabif10-5。在一些实施方式中,向生物体全身给予治疗有效量的mab11-8a1或mabif10-5,减少生物体中补体激活途径中的c3bbb的生成。在一些实施方式中,生物体是人。在一些实施方式中,本发明涉及可以结合选自人因子d的seqidno:21、22、23和24的至少一个(如至少1、2、3、4或5个)氨基酸序列,并且其在以治疗有效剂量给予于生物体时可以减少生物体的旁路补体激活途径中c3bbb的生成的蛋白质、抗体、抗体片段或肽。在一些实施方式中,生物体是人。在一些实施方式中,本发明涉及可以结合选自人因子d的seqidno:21、22、23和24的至少一个(如至少1、2、3、4或5个)氨基酸序列的蛋白、抗体、抗体片段或肽,其阻止ap因子b催化裂解成ba和bb。在一些实施方式中,本申请包括可以结合至具有位于人因子d的位置107-110的plpw序列的四个氨基酸或具有位于人因子d的位置148-151的vldr序列的四个氨基酸并表现出人因子d阻断活性的抗体或其片段、蛋白或肽。
在一些实施方式中,抗体是嵌合抗体。在一些实施方式中,抗人因子d抗体可以包含人轻链和人重链恒定区结合本说明书中别处描述的可变区cdr序列或其变体。本领域技术人员将可以使用已知的交换感兴趣的特异性抗体的相关结构域的技术制备和获得嵌合抗体。通过移植异源抗体结构域,引入本申请中描述的一个或多个cdr序列,容易制备这种抗体。使用已知的重组技术,可以获得并制备包含由人重链和轻链恒定区的核酸序列编码的重链和轻链恒定区;和包含由对应于本公开中阐述的cdr序列的核酸序列编码的cdr的重链和轻链可变区的重组抗体。本领域技术人员可以制备包含本公开中描述的一个或多个cdr序列的抗人因子d抗体,其中单独的轻链部分或单独的重链部分被来自属于另一物种如人类的抗体的区域替代。包含具有一个或多个选自seqidno:3-5、8-10、13-15和18-20的cdr序列的可变区以及cdr区外的鼠或非鼠抗体结构元件的人类抗人d因子抗体,或其一种或多种变体可以通过本领域已知的常规方法制备。在一些实施方式中,抗体或抗体片段使用本领域已知技术进行进一步人源化。
在一些实施方式中,抗因子d抗体包含与seqidno:3-5、8-10、13-15和18-20中列出的一个或多个本文描述的cdr序列具有至少约85%(如至少约85%,86%,87%,88%,89%,90%,91%,92%,93%,94%,95%,96%,97%,98%,99%或100%中的任一种)的氨基酸同一性的抗体。
在一个实施方式中,本公开涵盖具有与本文描述的cdr序列具有约85%的同一性的cdr序列的抗因子d抗体。本公开涵盖具有与本文描述的cdr序列具有至少约85%,86%,87%,88%,89%,90%,91%,92%,93%,94%,95%,96%,97%和99%的同一性的cdr序列的抗因子d抗体或其抗原结合片段。在一个实施方式中,针对人因子d的抗体具有重链可变(vh)区和轻链可变(vl)区,其中vh区具有与seqidno:2具有至少约85%的同一性的氨基酸序列,而其中vl区具有与seqidno:7具有至少约85%同一性的氨基酸序列。
在一些实施方式中,抗体或抗体片段是修饰的。在一些实施方式中,修饰包括抗体或其抗原结合片段与另一蛋白或蛋白片段的部分的融合。在一些实施方式中,本发明的抗体或其抗体片段修饰为提高其在体内的循环半衰期。例如,片段的抗体可以与也称为新生fc受体的fcrn分子融合,以体内稳定抗体。(naturereviewsimmunology7:715-725)。在一些实施方式中,抗体或其抗原结合片段与效应剂分子和/或另一种靶向部分(如识别不同分子、不同抗原或不同表位的抗体或抗体片段)缀合(例如,融合)。
本领域技术人员应能够制备包含选自seqidno:3-5、8-9、13-15和18-20中的至少一个特异性cdr序列的人因子d结合单链可变片段(scfv),或其一种或多种变体。scfv可以包含seqidno:3-5中指定的重链可变区序列或其一种或多种变体,和seqidno:8-10中指定的轻链可变区或其一种或多种变体。scfv可以包含seqidno13-15中指定的重链可变区序列,或其变体或变体,和称为seqidno18-20的轻链可变区,或其一种或多种变体。引入scfv内的具有与本公开中描述的cdr序列至少约85%,86%,87%,88%,89%,90%,91%,92%,93%,94%,95%,96%,97%,98%和99%的氨基酸序列同一性的cdr序列包含于本公开的范围内。scfv会结合人因子d,如由seqidno:21,seqidno:22,seqidno:23和seqidno:24组成的组列出的至少一个氨基酸序列内的表位。
筛选试验
本发明应用于各种筛选试验,包括确定候选抗因子d抗体是否可以抑制ap。
在一些实施方式中,候选抗因子d抗体存在下的ap活性水平与阳性比较物对照中检测到的ap活性比较。阳性比较物对照包括在不存在添加的测试化合物的情况下的ap激活。在一些实施方式中,当候选抗因子d抗体存在下的ap活性小于阳性比较物对照中检测到的ap活性的约70%时(这对应于在测试化合物存在下大于约30%的ap活性的抑制),候选抗因子d抗体被确定为ap的抑制剂。在其他实施方式中,当候选抗因子d抗体存在下的ap活性小于阳性比较物对照中检测到的ap活性的约80%时(这对应于在测试化合物存在下大于约20%的ap活性的抑制),候选抗因子d抗体被确定为ap的抑制剂。在还有的其他实施方式中,当在候选抗因子d抗体存在下的ap活性小于阳性比较物对照中检测到的ap活性的约90%时(这对应于在测试化合物存在下大于约10%的ap活性的抑制),候选抗因子d抗体被确定为ap的抑制剂。在一些实施方式中,将候选抗因子d抗体的ap抑制的水平与阴性比较物对照中检测的抑制水平比较。
多种免疫分析形式,包括竞争性和非竞争性免疫分析形式、抗原捕获试验、双抗体夹心试验和三抗体夹心试验,都是本发明的有用方法(selfetal.,1996,curr.opin.biotechnol.7:60-65)。本发明不应该解释为仅限于任何一种类型的已知或迄今未知的试验法,条件是试验法可以检测ap的抑制作用。
血管外溶血试验包括于本发明的方法中。在各种实施方式中,红细胞(rbc)获自正常(健康)个体或获自表现出疾病或病症如例如pnh的体征或症状的个体。在各种实施方式中,在动物模型如crry/daf/c3三重敲除(tko)小鼠中诱导疾病或病症。在一些实施方式中,输注的rbc的接受者在rbc转移前24小时用至少一种抗因子d抗体或对照溶液如pbs处理。使用如miwaetal.,2002,blood99:3707-3716描述的方法洗涤供体rbc并用cfse标记。在一些实施方式中,供体rbc从正常供体中收获,使用制造商描述的或本领域技术人员认为合适的技术洗涤和用ddao-se标记。在一些实施方式中,正常rbc与tkorbc的1:1混合物经由技术人员认为最适合的静脉内方式,包括但不限于小鼠接受者的尾静脉,注射到接受者中。在一个实施方式中,在注射供体rbc后的不同时间点收集血液样品。在一个实施方式中,在输注后5分钟、6小时、24小时、48小时、72小时、96小时和120小时之时采集血液样品。分析所采集的血液以确定循环中剩余的cfse-或ddao-se标记的(即,输注的)rbc的百分比。在每个时间点将每个接受者中cfse标记tkorbc的数量归一化至ddao-se标记的正常rbc。
krn关节炎的治疗是本发明的有用方法。关节炎通过从k/bxn小鼠中被动转移纯化的总igg而在纯合的人因子d敲入小鼠中诱导。在一个实施方式中,通过卡尺测量踝部增厚,并使用如kimura等人(kimuraetal.,2010,jci;3545-3554)先前报道的标准记录临床评分。受试者用一定剂量的抗人因子d抗体治疗。在一些实施方式中,受试者在诱导关节炎后第1天、第3天、第7天和第11天以及第15天进行治疗。
酶联免疫吸附试验(elisa)法适用于本发明的方法。酶,诸如但不限于辣根过氧化物酶(hrp)、碱性磷酸酶、β-半乳糖苷酶或脲酶可以连接至例如抗c3抗体或二级抗体用于本发明的方法。辣根过氧化物酶检测系统可以与,例如,在过氧化氢存在下产生在450nm下可检测的可溶性产物的发色底物四甲基联苯胺(tmb)一起使用。其它方便的酶联系统包括,例如,碱性磷酸酶检测系统,其可以与发色底物对硝基苯基磷酸酯一起使用,产生在405nm下易检测的可溶性产物。类似地,β-半乳糖苷酶检测系统可以与发色底物邻硝基苯基-β-d-吡喃半乳糖苷(onpg)一起使用,而产生在410nm下可检测的可溶性产物。或者,脲酶检测系统可以与底物如脲-溴甲酚紫(sigmaimmunochemicals,st.louis,mo)一起使用。有用的酶联的一级和二级抗体都可以从许多商业来源获得。
化学发光检测也适用于检测ap的抑制。化学发光的二级抗体可以从许多商业来源获得。
荧光检测对于检测ap的抑制也是有用的。有用的荧光染料包括,但不限于,dapi,荧光素,hoechst33258,r-藻蓝蛋白(phycocyanin),b-藻红蛋白(phycoerythrin),r-藻红蛋白,罗丹明,德克萨斯红和丽丝胺(lissamine)-荧光素-或罗丹明标记的抗体。
放射免疫分析(ria)也适用于本发明的方法。此类分析在本领域内是众所周知的,并描述于,例如,brophyetal.(1990,biochem.biophys.res.comm.167:898-903)和guechotetal.(1996,clin.chem.42:558-563)。放射免疫分析使用例如碘-125标记的一级或二级抗体进行实施(harlowetal.,同上,1999)。
例如,使用分光光度计分析从可检测的抗体发射的信号以检测来自发色底物的颜色;使用辐射计数器,如用于检测碘-125的伽马计数器分析以检测辐射;或使用荧光计分析以在特定波长的光存在下检测荧光。在使用酶联试验的情况下,定量分析使用分光光度计进行。应当理解的是,本发明的试验可以手动进行,或如果需要,可以自动进行,并且从多个样品发出的信号可以在许多商用系统中同时检测。
本发明的方法还包括基于毛细管电泳的免疫分析(ceia)的使用,如果需要,其可以是自动化的。免疫分析也可以与激光诱导的荧光结合使用,如例如schmalzingetal.(1997,electrophoresis18:2184-2193)和bao(1997,j.chromatogr.b.biomed.sci.699:463-480)中描述的。根据本发明的方法也可以使用脂质体免疫分析如流动注射脂质体免疫分析和脂质体免疫传感器(rongenetal.,1997,j.immunol.methods204:105-133)。
定量免疫蛋白印迹也可以用于确定本发明方法中的ap抑制作用的水平。使用众所周知的方法如扫描光密度测定(parraetal.,1998,j.vase.surg.28:669-675)对免疫蛋白印迹进行定量。
给予方法
本发明的方法包括向确定为患有ap介导的疾病或病症的个体给予治疗有效量的至少一种抗因子d抗体或其结合片段(如本文其他地方描述的任何抗体或其片段)。在一个实施方式中,个体是具有ap系统的哺乳动物。在一个实施方式中,个体是人。在各个实施方式中,至少一种抗因子d抗体或其结合片段局部、区域或全身给予。在一些实施方式中,ap介导的疾病或病症是c3肾小球病。在一些实施方式中,ap介导的疾病或病症是黄斑变性(如amd)。
本发明的方法可以包括给予至少一种抗因子d抗体或其结合片段,但本发明决不应该解释为仅限于本文的抗因子d抗体,而相反应该解释为涵盖缩小和减少ap活化的任何已知和未知的抗因子d抗体。
本发明的方法包括向个体单独或与至少一种其他治疗剂组合给予治疗有效量的至少一种抗因子d抗体或其结合片段,其中本发明的组合物包含至少一种抗因子d抗体或其结合片段。本发明可以与其他治疗方式,例如抗炎疗法等组合使用。与本发明的方法可以组合使用的抗炎疗法的实例包括,例如,使用类固醇药物的疗法,以及使用非类固醇药物的疗法。
本发明的方法包括向受试者给予治疗有效量的抗因子d抗体或其抗原结合片段,抗体能够结合在选自seq.idno21、22、23、24的任何一个序列内。在一些实施方式中,本发明包括通过给予治疗有效量的本发明的抗体或治疗有效量的其抗体片段,使得c3bbb的减少在受试者中实现而治疗涉及ap补体途径的失调的因子d相关疾病的方法。在一些实施方式中,本发明包括通过给予治疗有效量的抗体或抗体片段治疗涉及ap补体途径的失调的因子d相关的疾病的方法,抗体或抗体片段能够结合人因子d内的某些特异性的一个或多个表位,如包含于选自seqidnos21-24的氨基酸序列中的表位。在一些实施方式中,本发明包括通过向受试者给予有效量的抗体、抗体片段、多肽、肽、缀合肽使得受试者中的ap补体激活途径激活减少而治疗涉及ap补体途径的失调的因子d相关疾病的方法,该抗体、多肽、肽、缀合肽能够结合人因子d内的某些特异性表位,其中表位包含在选自seqidnos21-24的氨基酸序列内。在一些实施方式中,治疗方法包括向受试者给予系统上有效剂量的抗体或抗体片段,由此在受试者中实现c3bbb的全身减少,该抗体或抗体片段能够结合在选自seqidnos21-24中列出的序列的氨基酸内。
药物组合物和疗法
使用本领域已知的方法,以多种不同方式实现本发明的治疗方法中抗因子d抗体或其结合片段的给予。因此,本发明的治疗和预防方法由此包括包含抗因子d抗体的药物组合物的使用。
可以给予适用于实施本发明的药物组合物以递送至少约1ng/kg、至少约5ng/kg、至少约10ng/kg、至少约25ng/kg、至少约50ng/kg、至少约100ng/kg、至少约500ng/kg、至少约1μg/kg、至少约5μg/kg、至少约10μg/kg、至少约25μg/kg、至少约50μg/kg、至少约100μg/kg、至少约500μg/kg、至少约1mg/kg、至少约5mg/kg、至少约10mg/kg、至少约25mg/kg、至少约50mg/kg、至少约100mg/kg、至少约200mg/kg、至少约300mg/kg、至少约400mg/kg和至少约500mg/kg受试者体重的剂量。在一个实施方式中,本发明给予的剂量导致本发明的抗因子d抗体在个体中的浓度为至少约1pm,至少约10pm,至少约100pm,至少约1nm,至少约10nm,至少约100nm,至少约1μm,至少约2μm,至少约3μm,至少约4μm,至少约5μm,至少约6μm,至少约7μm,至少约8μm,至少约9μm和至少约10μm。在另一个实施方式中,本发明设想给予的剂量导致本发明的抗因子d抗体在个体的血浆中的浓度为至少约1pm,至少约10pm,至少约100pm,至少约1nm,至少约10nm,至少约100nm,至少约1μm,至少约2μm,至少约3μm,至少约4μm,至少约5μm,至少约6μm,至少约7μm,至少约8μm,至少约9μm和至少约10μm。
在一些实施方式中,可以给予适用于实施本发明的药物组合物以递送不大于约1ng/kg、不大于约5ng/kg、不大于约10ng/kg、不大于约10ng/kg、约25ng/kg,不大于约50ng/kg、不大于约100ng/kg、不大于约500ng/kg、不大于约1μg/kg、不大于约5μg/kg、不大于约10μg/kg、不大于约25μg/kg、不大于约50μg/kg、不大于约100μg/kg、不大于约500μg/kg、不大于约1mg/kg、不大于约5mg/kg、不大于约10mg/kg、不大于约25mg/kg、不大于约50mg/kg、不大于约100mg/kg、不大于约200mg/kg、不大于约300mg/kg、不大于约400mg/kg和不大于约500mg/kg受试者体重的剂量。在一个实施方式中,本发明给予的剂量导致本发明的抗因子d抗体在个体中的浓度不大于约1pm,不大于约10pm,不大于约100pm,不大于约1nm,不大于约10nm,不大于约100nm,不大于约1μm,不大于约2μm,不大于约3μm,不大于约4μm,不大于约5μm,不大于约6μm,不大于约7μm,不大于约8μm,不大于约9μm和不大于约10μm。在另一个实施方式中,本发明设想给予的剂量导致本发明的抗因子d抗体在个体的血浆中的浓度不大于约1pm,不大于约10pm,不大于约100pm,不大于约1nm,不大于约10nm,不大于约100nm,不大于约1μm,不大于约2μm,不大于约3μm,不大于约4μm,不大于约5μm,不大于约6μm,不大于约7μm,不大于约8μm,不大于约9μm和不大于约10μm。本文还设想了本文中公开的任何剂量之间的剂量范围。
通常,本发明的方法中向受试者(在一些实施方式中为人)可以给予的剂量范围为每千克受试者体重0.5μg至约50mg。然而给予的精确剂量将根据任何数量的因素,包括但不限于受试者的类型和治疗的疾病状态的类型、受试者的年龄和给予途径而变化。在一些实施方式中,化合物的剂量将为每千克受试者体重约1μg至约10mg。在其他实施方式中,剂量将为每千克受试者体重约3μg至约1mg。
化合物可以以每天多次的频率给予于受试者,或可以较不频繁地给予,如每天一次,一天两次,一天三次,一周一次,一周两次,一周三次,每两周一次,每两周两次,每两周三次,每月一次,每月两次,每月三次,或更加不频繁,如每几个月一次或一年一次或几次或更少次数。给药的频率对于技术人员而言是显而易见的,并且取决于任何数量的因素,如但不限于治疗的疾病的类型和严重程度,受试者的类型和年龄等。药物组合物的制剂可以通过药理学领域中任何已知的或以后开发的方法制备。通常,这种制备方法包括将活性成分与载体或一种或多种其它辅助成分结合的步骤,并且然后,如果必要或需要,将产品成型或包装成所需的单剂量或多剂量单位。
尽管本文提供的药物组合物的描述主要涉及适合于对人的伦理给予的药物组合物,但本领域技术人员将会理解的是,此类组合物通常适合给予于所有分类的受试者。适合于对人给予的药物组合物修改为使其递送适于向各种受试者给予的药物组合物是很好理解的,并且普通技术的兽医药理学家可以仅通过普通的(如果有的话)实验进行设计和实施这种修改。所设想的要给予本发明药物组合物的个体包括,但不限于,人和其他灵长类动物,哺乳动物,包括商业上相关的哺乳动物如非人灵长类动物、牛、猪、马、绵羊、猫和狗。
适用于本发明方法的药物组合物可以以适于眼科、口服、直肠、阴道、肠胃外、局部、肺部、鼻内、口腔、眼内、玻璃体内、肌肉内、皮内和静脉内给予途径的制剂制备、包装或销售。其他设想的制剂包括预计的纳米颗粒,脂质体制剂,含有活性成分的重密封的红细胞和基于免疫学的制剂。
本发明的药物组合物可以作为单一单位剂量或作为多个单一单位剂量批量制备、包装或销售。单位剂量是离散量的包含预定量活性成分的药物组合物。活性成分的量通常等于将给予于个体的活性成分的剂量或这种剂量的方便的部分,例如这种剂量的一半或三分之一。
本发明的药物组合物中的活性成分、药用载体和任何其它成分的相对量将根据治疗的个体的特性、大小和状况而变化,并进一步取决于组合物要给予的途径。举例而言,组合物可以包含0.1%至100%(w/w)的活性成分。在各个实施方式中,组合物包含至少约1%,至少约2%,至少约3%,至少约4%,至少约5%,至少约6%,至少约7%,至少约8%,至少约9%,至少约10%,至少约11%,至少约12%,至少约13%,至少约14%,至少约15%,至少约16%,至少约17%,至少约18%,至少约19%,至少约20%,至少约21%,至少约22%,至少约23%,至少约24%,至少约25%,至少约26%,至少约27%,至少约28%,至少约29%,至少约30%,至少约31%,至少约32%,至少约33%,至少约34%,至少约35%,至少约36%,至少约37%,至少约38%,至少约39%,至少约40%,至少约41%,至少约42%,至少约43%,至少约44%,至少约45%,至少约46%,至少约47%,至少约48%,至少约49%,至少约50%,至少约51%,至少约52%,至少约53%,至少约54%,至少约55%,至少约56%,至少约57%,至少约58%,至少约59%,至少约60%,至少约61%,至少约62%,至少约63%,至少约64%,至少约65%,至少约66%,至少约67%,至少约68%,至少约69%,至少约70%,至少约71%,至少约72%,至少约73%,至少约74%,至少约75%,至少约76%,至少约77%,至少约78%,至少约79%,至少约80%,至少约81%,至少约82%,至少约83%,至少约84%,至少约85%,至少约86%,至少约87%,至少约88%,至少约89%,至少约90%,至少约91%,至少约92%,至少约93%,至少约94%,至少约95%,至少约96%,至少约97%,至少约98%,至少约99%,或至少约100%(w/w)的活性成分。
除活性成分外,本发明的药物组合物可以进一步包含一种或多种另外的药物活性剂。
使用常规技术,可以制备本发明的药物组合物的控释或缓释制剂。
肠胃外给予药物组合物包括其特征在于个体组织的物理突破和药物组合物通过突破至组织中给予的任何途径。肠胃外给予可以是局部的,区域的或全身的。因此,肠胃外给予包括但不限,通过注射组合物给予药物组合物,通过手术切口施用组合物,通过组织穿透性非手术伤口施用组合物等。具体地,设想肠胃外给予预期包括但不限于静脉内,眼内,玻璃体内,皮下,腹膜内,肌肉内,皮内,胸骨内注射和肿瘤内给予。
适于胃肠外给予的药物组合物的制剂包含活性成分,结合药用载体,如无菌水或无菌等渗盐水。这些制剂可以以适于推注给予或连续给予的形式制备、包装或销售。可注射制剂可以以单位剂量形式,如以安瓿或含有防腐剂的多剂量容器制备、包装或销售。用于肠胃外给予的制剂包括但不限于悬浮液,溶液,油性或水性载体中的乳液,糊剂和可植入缓释或可生物降解的制剂。此类制剂可以进一步包含一种或多种另外的成分,包括但不限于悬浮、稳定或分散剂。在用于肠胃外给予的制剂的一个实施方式中,活性成分以干燥(即,粉末或颗粒)形式提供用于在肠胃外给予重构的组合物之前用合适的载体(例如,无菌无热原水)重构。
药物组合物可以以无菌可注射水性或油性悬浮液或溶液的形式制备、包装或出售。这种悬浮液或溶液可以根据已知技术配制,并且除活性成分外,还可以包含其他成分,如分散剂,润湿剂或悬浮剂。这种无菌可注射制剂可以使用无毒的肠胃外可接受的稀释剂或溶剂,如水或1,3-丁二醇制备。其他可接受的稀释剂和溶剂包括但不限于林格氏液,等渗氯化钠溶液,和固定油,如合成的甘油单酯或甘油二酯。其它可用的可肠胃外给予制剂包括含有微晶形式、脂质体制剂或作为可生物降解的聚合物体系的组分的活性成分的那些制剂。用于缓释或植入的组合物可以包含药用的聚合物或疏水材料,如乳液,离子交换树脂,微溶聚合物或微溶盐。
本发明的药物组合物可以以适于经由口腔的肺部给予的制剂制备、包装或销售。这种制剂可以包括干燥颗粒,其包含活性成分并且其直径范围为约0.5至约7纳米,并且在一些实施方式中为约1至约6纳米。这样的组合物通常是干燥粉末形式,用于使用包括干燥粉末储存器的装置给予,可以向这种装置导入推进剂流以分散粉末或使用自推进的溶剂/粉末分配容器,如包含将活性成分溶解或悬浮于密封容器中的低沸点推进剂中的容器。在一些实施方式中,这种粉末包含其中至少98wt%的颗粒具有大于0.5纳米的直径,且至少95%的颗粒具有小于7纳米的直径的的颗粒。在一些实施方式中,至少95wt%的颗粒具有大于1纳米的直径,并且至少90%的颗粒具有小于6纳米的直径。在一些实施方式中,干燥粉末组合物包括固体细粉稀释剂如糖,并方便地以单位剂量形式提供。
低沸点推进剂通常包括在大气压下沸点低于65°f的液体推进剂。通常,推进剂可以占组合物的50%至99.9%(w/w),且活性成分可以占组合物的0.1%至20%(w/w)。推进剂可以进一步包含另外的成分如液体非离子或固体阴离子表面活性剂或固体稀释剂(在一些实施方式中,具有与包含活性成分的颗粒相同的粒径)。
配制用于肺部递送的本发明的药物组合物还可以以溶液或悬浮液液滴的形式提供活性成分。此类制剂可以作为包含活性成分的可选无菌的水性或稀释的醇溶液或悬浮液制备、包装或销售,并可以使用任何雾化或雾化装置方便地给予。此类制剂可以进一步包含一种或多种另外的成分,包括但不限于调味剂如糖精钠,挥发油,缓冲剂,表面活性剂,或防腐剂如羟基苯甲酸甲酯。在一些实施方式中,由该给予途径提供的液滴具有约0.1至约200nm的平均直径。
该制剂也适用于鼻内递送本发明的药物组合物。
适用于鼻内给予的另一种制剂是包含活性成分并具有约0.2至500μm的平均粒径的粗粉末。这种制剂以鼻吸的方式,即通过鼻腔通道从靠近鼻孔的粉末容器中快速吸入来给予。
适于鼻腔给予的制剂可以,例如,包含少至约0.1%(w/w)和至多达100%(w/w)的活性成分,并且可以进一步包含一种或多种另外的成分。
本发明的药物组合物可以以适于口腔给予的制剂制备、包装或销售。此类制剂可以是,例如,以使用常规方法制成的片剂或锭剂的形式,并且可以含有例如0.1%至20%(w/w)的活性成分,余量的口服可溶解或可降解的组合物,和可选的一种或多种另外的成分。可替换地,适于口腔给予的制剂可以包含粉末或含有活性成分的气溶胶化或雾化溶液或悬浮液。在一些实施方式中,此类粉末化、气溶胶化或雾化制剂在分散时具有范围约0.1至约200nm的平均颗粒或液滴尺寸,并且可以进一步包含一种或多种另外的成分。
如本文使用的“另外的成分”包括但不限于以下一种或多种:赋形剂;表面活性剂;分散剂;惰性稀释剂;造粒和崩解剂;粘合剂;润滑剂;甜味剂;调味剂;着色剂;防腐剂;生理可降解组合物,如明胶;水性载体和溶剂;油性载体和溶剂;悬浮剂;分散剂或湿润剂;乳化剂,缓和剂;缓冲剂;盐;增稠剂;填料;乳化剂;抗氧化剂;抗生素;抗真菌剂;稳定剂;和药用的聚合或疏水材料。本发明的药物组合物中可以包括的其他“其他成分”在本领域内是已知的,并且描述于,例如,remington'spharmaceuticalsciences(1985,genaro,ed.,mackpublishingco.,easton,pa)中,其通过引证结合于本文中。
产生抗体及其抗原结合片段的细胞
在一些实施方式中,本发明是产生本文描述的至少一种抗因子d抗体或抗原结合片段的细胞或细胞系(如宿主细胞)。在一个实施方式中,细胞或细胞系是产生本文描述的至少一种抗因子d抗体或抗原结合片段的遗传修改的细胞。在一个实施方式中,细胞或细胞系是产生本文描述的至少一种抗因子d抗体或抗原结合片段的杂交瘤。
杂交细胞(杂交瘤)通常由对b淋巴细胞高度富集的鼠脾细胞和骨髓瘤“融合伴侣细胞”之间的大量融合产生(albertsetal,molecularbiologyofthecell(garlandpublishing,inc.1994);harlowetal,antibodies.alaboratorymanual(coldspringharborlaboratory,coldspringharbor,1988)。随后,将融合中的细胞分配到可以分析具有期望的特异性的抗体的生产的池中。测试呈阳性的池可以进一步细分,直到识别出产生期望的特异性抗体的单细胞克隆。由这些克隆产生的抗体称为单克隆抗体。
本文还提供了编码本文公开的任何抗体或抗体片段的核酸,以及包含核酸的载体。因此,本发明的抗体和片段可以通过在细胞或细胞系,如通常用于表达重组或人源化的免疫球蛋白的细胞系中表达核酸而产生。因此,本发明的抗体和片段也可以通过将核酸克隆到一种或多种表达载体中,并将载体转化成细胞系,如通常用于表达重组或人源化免疫球蛋白的细胞系中而产生。
编码免疫球蛋白的重链和轻链的基因或其片段可以根据包括,但不限于,本领域已知的聚合酶链反应(pcr)(参见,例如,sambrooketal.,molecularcloning:alaboratorymanual,2nded.,coldspringharbor,ny,1989;berger&kimmel,methodsinenzymology,vol.152:guidetomolecularcloningtechniques,academicpress,inc.,sandiego,calif,1987;coetal.,1992,j.immunol.148:1149)的方法工程改造。例如,编码重链和轻链的基因或其片段可以由抗体分泌细胞的基因组dna克隆,或通过细胞rna的逆转录产生cdna。克隆通过常规技术完成,包括使用杂合于与待克隆的基因或基因区段侧接或重叠的序列的pcr引物。
编码本发明的抗体或其重链或轻链或其片段的核酸可以根据重组核酸技术获得并用于在多种宿主细胞中或在体外翻译系统中生产特异性免疫球蛋白、免疫球蛋白链或其片段或变体。例如,编码抗体的核酸或其片段可以置于合适的原核或真核载体,例如,表达载体中,并通过适当的方法,例如,转化、转染、电穿孔、感染而引入合适的宿主细胞中,而使核酸与一种或多种表达控制元件可操作地连接于,例如,载体中或整合到宿主细胞基因组中。
在一些实施方式中,重链和轻链或其片段可以组装于两种可以用于共转染受体细胞的不同表达载体中。在一些实施方式中,每种载体可以含有两种或更多种可选择的基因,一种用于在细菌系统中选择,且一种用于在真核系统中选择。这些载体允许在细菌系统中产生和扩增基因,并随后共转染真核细胞和选择共转染的细胞。选择步骤可以用于对在两种不同dna载体上引入的抗体核酸向真核细胞中的表达进行选择。
可替换地,编码重链和轻链的核酸或其片段可以由一种载体表达。尽管轻链和重链由独立的基因编码,但它们可以使用重组方法连接。例如,两个多肽可以通过合成连接子连接,该合成连接子使它们可以制成单个蛋白链,其中vl和vh域配对形成单价分子(称为单链fv(scfv);参见,例如,birdetal.,1988,science242:423-426;和hustonetal.,1988,proc.natl.acad.sci.usa85:5879-5883)。
本发明提供了包含编码重链和/或轻链的核酸序列的分离的核酸分子,及其片段。包含编码轻链和重链的序列的核酸分子或其片段可以工程化为含有用于在细胞中产生时分泌抗体或片段的合成信号序列。此外,核酸分子可以含有允许插入其他抗体序列并维持翻译阅读框使得不改变通常在抗体序列中发现的氨基酸的特异性dna连接。
根据本发明,编码抗体的核酸序列可以插入到合适的表达载体中。在各种实施方式中,表达载体包含用于转录和翻译插入的抗体编码核酸的必需元件,使得产生指导抗体序列表达以形成抗体的重组dna分子,或其片段。
编码抗体的核酸或其片段可以经受本领域技术人员已知的各种重组核酸技术如定点诱变。
多种方法可以用于在细胞中表达核酸。核酸可以克隆到许多类型的载体中。然而,本发明不应该解释为限于任何具体的载体。相反,本发明应该解释为包括本领域容易获得和/或已知的各种载体。例如,本发明的核酸可以克隆到载体中,载体包括但不限于质粒,噬菌体质粒,噬菌体衍生物,动物病毒和粘粒。特别感兴趣的载体包括表达载体,复制载体,探针生成载体和测序载体。
在具体的实施方式中,表达载体选自由病毒载体、细菌载体和哺乳动物细胞载体组成的组。存在的许多表达载体系统包含至少部分或全部的上述的组合物。基于原核生物和/或真核生物载体的系统可以用于与本发明一起使用以产生多核苷酸,或其同源多肽。许多这样的系统在商业上广泛可用。
病毒载体技术在本领域中是公知的,并且,例如,描述于sambrooketal.(2012),和ausubeletal.(1999)中,以及其他病毒学和分子生物学手册中。可用作载体的病毒包括但不限于逆转录病毒,腺病毒,腺相关病毒,疱疹病毒和慢病毒。在一些实施方式中,鼠干细胞病毒(mscv)载体用于表达期望的核酸。证实mscv载体在细胞中会有效表达期望的核酸。然而,本发明不应该仅限于使用mscv载体,而是任何逆转录病毒表达方法都包括于本发明中。病毒载体的其他实例是基于莫洛尼鼠白血病病毒(momulv)和hiv的那些。在一些实施方式中,合适的载体含有在至少一种生物中功能性的复制起点,启动子序列,方便的限制性内切核酸酶位点和一种或多种可选择的标记物(参见,例如,wo01/96584;wo01/29058;和美国专利号6,326,193)。
其他调节元件,例如,增强子,可以用于调节转录启动的频率。启动子可以是与基因或核酸序列天然缔合的启动子,这可以通过分离位于编码区和/或外显子上游的5'非编码序列获得。这种启动子可以称为“内源性的”。类似地,增强子可以是与核酸序列天然缔合的增强子,位于该序列的下游或上游。可替换地,某些优点通过将编码核酸区定位于重组或异源启动子的控制之下而获得,重组或异源启动子是指在其天然环境中通常不与核酸序列缔合的启动子。重组或异源增强子也是指在其天然环境中通常不与核酸序列缔合的增强子。此类启动子或增强子可以包括其他基因的启动子或增强子,和从任何其他原核、病毒或真核细胞中分离出来的启动子或增强子,以及非“天然存在的”,例如,含有不同转录调节区的不同元件,和/或改变表达的突变的启动子或增强子。除了合成产生启动子和增强子的核酸序列之外,序列可以使用重组克隆和/或核酸扩增技术,包括pcr,结合本文公开的组合物产生(美国专利号4,683,202,美国专利号5,928,906)。此外,设想也可以使用指导序列在非核细胞器如线粒体、叶绿体等中的转录和/或表达的控制序列。
自然地,使用有效指导dna片段在选择用于表达的细胞类型、细胞器和生物体中表达的启动子和/或增强子是重要的。分子生物学领域的技术人员通常知道如何使用启动子、增强子和细胞类型组合用于蛋白表达,例如,参见sambrooketal.(2012)。采用的启动子可以是组成型的、组织特异性的、可诱导的和/或在适当条件下可用于指导引入的dna片段高水平表达的,因此,这在大规模生产重组蛋白及其片段时是有利的。
启动子的实例是立即早期(immediateearly)巨细胞病毒(cmv)启动子序列。该启动子序列是强组成型启动子序列,其能够驱动与其可操作地连接的任何多核苷酸序列的高水平表达。然而,也可以使用其他组成型启动子序列,包括但不限于猿猴病毒40(sv40)早期启动子,小鼠乳腺肿瘤病毒(mmtv),人免疫缺陷病毒(hiv)长末端重复(ltr)启动子,莫罗尼(moloney)病毒启动子,禽白血病病毒启动子,爱泼斯坦-巴尔(epstein-barr)病毒立即早期启动子,劳氏肉瘤病毒启动子,以及人基因启动子如,但不限于,肌动蛋白启动子、肌球蛋白启动子、血红蛋白启动子和肌肉肌酸启动子。此外,本发明不应该限于组成型启动子的使用。诱导型启动子也应该设想为本发明的一部分。本发明中诱导型启动子的使用提供了一种分子开关,其能够在需要这种表达时启动可操作地连接的多核苷酸序列的表达,或在不需要表达时关闭表达。诱导型启动子的实例包括但不限于金属硫蛋白启动子,糖皮质激素启动子,孕酮启动子和四环素启动子。此外,本发明包括组织特异性启动子或细胞类型特异性启动子的使用,组织特异性启动子或细胞类型特异性启动子是仅在期望的组织或细胞中有活性的启动子。组织特异性启动子在本领域内是众所周知的,并且包括,但不限于,her-2启动子和psa相关启动子序列。
为了评价核酸的表达,待引入细胞中的表达载体还可以含有可选择的标记基因或报告基因或两者,以便于从寻求通过病毒载体转染或感染的细胞群中识别和选择表达细胞。在其他实施方式中,可选择的标记可以携带于单独的核酸上并用于共转染过程。可选择的标记和报告基因可以侧接合适的调节序列以使其可以在宿主细胞中表达。有用的可选择标记在本领域中是已知的,包括,例如,抗生素抗药性基因,如neo等。
报告基因适用于识别潜在转染的细胞和适用于评价调节序列的功能性。编码易于试验的蛋白的报道基因在本领域内是熟知的。通常而言,报告基因是不存在于受体生物体或组织中或由其表达的基因,并且这种基因编码的蛋白的表达通过一些易于可检测特性(例如,酶活性)表现出来。报告基因的表达在将dna引入受体细胞后的适当时间进行试验。
合适的报告基因可以包括编码荧光素酶、β-半乳糖苷酶、氯霉素乙酰转移酶、分泌型碱性磷酸酶或绿色荧光蛋白基因的基因(参见,例如,ui-teietal.,2000febslett.479:79-82)。合适的表达系统是众所周知的,并可以使用众所周知的技术制备或在商业上获得。通常,具有显示报告基因最高表达水平的最小5'侧翼区的构建体被识别为启动子。此类启动子区可以与报告基因连接,并用于评价试剂调节启动子驱动的转录的能力。
将核酸引入并表达于细胞中的方法在本领域内是已知的。在表达载体的背景下,载体可以通过本领域内的任何方法容易地引入宿主细胞,例如,哺乳动物,细菌,酵母或昆虫细胞中。例如,表达载体可以通过物理、化学或生物学方法转移到宿主细胞中。
用于将多核苷酸引入宿主细胞的物理方法包括磷酸钙沉淀,脂质转染,粒子轰击,显微注射,电穿孔,激光穿孔等。产生包含载体和/或外源核酸的细胞的方法在本领域内是熟知的。例如,参见sambrooketal.(2012)和ausubeletal.(1999)。
用于将所关注的核酸引入宿主细胞中的生物学方法包括dna和rna载体的使用。病毒载体,且尤其是逆转录病毒载体,已成为将基因插入哺乳动物例如人细胞中的最广泛使用的方法。其他病毒载体可以源自慢病毒,痘病毒,单纯疱疹病毒i,腺病毒和腺相关病毒等。参见,例如,美国专利号5,350,674和5,585,362。
用于将核酸引入宿主细胞的化学方法包括胶体分散系统,如大分子复合物,纳米胶囊,微球,珠和基于脂质的系统,包括水包油乳剂,胶束,混合胶束和脂质体。在体外和体内用作递送载体的优选胶体系统是脂质体(例如,人造膜囊泡)。这种系统的制备和使用在本领域中是公知的。
无论用于将外源核酸引入宿主细胞中的方法或以其他方式将细胞暴露于本发明的核酸,为了证实宿主细胞中存在重组dna序列,可以实施多种试验。此类试验包括例如“分子生物学”试验,这是本领域技术人员已知的,如dna和rna印迹法,rt-pcr和pcr;“生物化学”试验,如例如,通过免疫学手段(elisa和免疫蛋白印迹)或通过本文的试验法识别落入本发明范围内的试剂,检测特定肽的存在或不存在。
表达人因子d的非人类动物
本发明还包括表达人因子d的遗传修改的非人动物。在一些实施方式中,表达人因子d的遗传修改的非人动物不表达非人动物因子d。在一个实施方式中,本发明是由非人动物的内源调节元件表达人因子d而不表达非人动物因子d的遗传修改的非人动物。在一些实施方式中,非人动物是哺乳动物。在一些实施方式中,非人动物是啮齿动物。在一些实施方式中,非人动物是大鼠或小鼠。
为了产生遗传修改的非人动物,可以将编码人因子d蛋白的核酸以适于在宿主细胞中表达人因子d蛋白的形式引入重组表达载体中。术语“以适于在宿主细胞中表达融合蛋白的形式”旨在表示重组表达载体包括一种或多种以允许将核酸转录成mrna并将mrna翻译成人因子d蛋白的的方式与编码人因子d蛋白的核酸可操作地连接的调节序列。术语“调节序列”是本领域公认的并且旨在包括启动子、增强子和其他表达控制元件(例如,多腺苷酸化信号)。此类调节序列对于本领域技术人员是已知的,并描述于文献1990,goeddel,geneexpressiontechnology:methodsinenzymology185,academicpress,sandiego,ca中。应当理解的是,表达载体的设计可以取决于因素如待转染的宿主细胞的选择和/或待表达的人因子d蛋白的量。
例如,通过将编码人因子d蛋白的核酸(通常与合适的调节元件,如组成型或组织特异性增强子连接)引入卵母细胞中,例如,通过显微注射,并允许卵母细胞在雌性建立者小鼠(foundermouse)内发育,可以产生遗修改性的非人动物。内含子序列和多腺苷酸化信号也可以包括于转基因中以提高转基因的表达效率。用于产生遗传修改的动物(例如,小鼠)的方法在本领域中已成为常规方法,并描述于,例如,美国专利号4,522,517,美国专利号4,736,866和4,870,009,和1986,hoganetal.,alaboratorymanual,coldspringharbor,n.y.,coldspringharborlaboratory中。遗传修改的建立者动物可以用于培育携带转基因的其他受试者。携带编码本发明的因子d蛋白的转基因的遗传修改的动物可以进一步与携带其他转基因的其他遗传修改的动物或其他敲除动物,例如,不表达鼠因子d基因的敲除小鼠交配。应当理解的是,除了遗传修改的动物之外,系统还可以用于产生其他人d因子表达受试者。
在一个实施方式中,表达来自非人动物的调节元件的人因子d而不表达非人动物因子d的遗传修改的非人动物使用采用人因子d外显子序列(或外显子和内含子序列)代替非人动物的因子d外显子序列(或外显子和内含子序列)但保持一个、多个或所有的天然非人类动物的调节元件(例如,启动子,增强子,侧接区域,内含子等)序列不变的系统而产生。尽管可以使用任何合适的系统,但可以以这种方式产生遗传修改的非人动物的一个示例性系统是crispr/cas9系统。“crispr/cas”系统是指用于防御外来核酸的一类广泛的细菌系统。crispr/cas系统存在于广泛的真细菌和古细菌中。crispr/cas系统包括i型、ii型和iii型亚型。野生型ii型crispr/cas系统利用rna介导的核酸酶,cas9与指导和激活rna复合的复合物,而识别和切割外源核酸。cas9同系物存在于多种真细菌中,包括但不限于以下分类群的细菌:放线菌门,产水菌门,拟杆菌门-绿菌门,衣原体门-疣粒菌门,绿弯菌门,蓝细菌门,厚壁菌门,变形菌门,螺旋体门和热袍菌门。示例性的cas9蛋白是酿脓链球菌cas9蛋白。另外的cas9蛋白及其同源物描述于,例如,chylinksietal.,rnabiol.2013年5月1日;10(5):726-737;nat.rev.microbiol.2011年6月;9(6):467-477;hou,etal.,procnatlacadsciusa.2013年9月24日;110(39):15644-9;sampsonetal.,nature.2013年5月9日;497(7448):254-7;和jinek,etal.,science.2012年8月17日;337(6096):816-21中。
在一个实施方式中,本发明的遗传修改的非人动物用cvm-ie增强子由鸡β-肌动蛋白启动子表达人因子d,但技术人员应理解,本发明的遗传修改的非人动物包括由其他启动子和增强子对人因子d的表达。适用于本发明的启动子的实例包括,但不限于,天然小鼠启动子,dnapolii启动子,pgk启动子,泛素启动子,白蛋白启动子,珠蛋白启动子,卵清蛋白启动子,sv40早期启动子,劳氏肉瘤病毒(rsv)启动子,逆转录病毒ltr和慢病毒ltr。适用于本发明的启动子和增强子表达系统还包括诱导型和/或组织特异性表达系统。
本文描述的遗传修改的非人动物可以用于各种研究和临床用途。在一些实施方式中,本申请提供了筛选抗因子d化合物(如抗体)的方法。在一些实施方式中,本申请提供了验证抗因子d化合物(如抗体)的方法。在一些实施方式中,本申请提供了评价抗因子d化合物(如抗体)在多种补体介导疾病和病症中的治疗功效的方法,疾病和病症包括可以在人源化非人动物中诱导的疾病和病症,或可以在可以通过将人因子d非人类动物与另一种具有另一突变并可以发展补体相关的疾病或病症的突变非人动物交叉繁育而产生的双重突变非人类动物中自发发展的疾病或病症(参见,例如,lesher,2013,j.am.soc.nephrol.24:53-65;uedaetal.,2017,bloodmar2;129:1184-1196)。
试剂盒
本发明还包括试剂盒,其包含本发明的抗因子d抗体或其组合,以及描述例如向个体给予抗因子d抗体或其组合作为治疗性处理,或如本文其他地方描述的非治疗用途的说明材料。在一个实施方式中,这种试剂盒进一步包含例如在向个体给予抗体之前适于溶解或悬浮治疗性组合物的药用载体,治疗性组合物包含本发明的抗因子d抗体或其组合。可选地,试剂盒包含用于给予抗体的施用器。
实验实施例
现在参考以下实施例描述本发明。这些实施例提供仅用于举例说明的目的,并且本发明决不应该解释为仅限于这些实施例,而应该解释为包括由于本文提供的教导而变得显而易见的任何和所有变化。
无需进一步描述,认为本领域普通技术人员使用前述说明和以下举例说明性实施例可以制备和利用本发明的化合物并实施权利要求要求保护的方法。因此,以下工作实例不应该解释为以任何方式限制本公开的其余部分。
实施例1
使用kohleretal.(1975,nature,256:495)首次描述的杂交瘤方法以及一些修改产生抗人因子d单克隆抗体。balb/c雌性(jacksonlaboratory)小鼠用100μg用佐剂乳化的纯化人因子d(来自人血浆)免疫。在第21天和第35天,再次用100μg用佐剂乳化的纯化人因子d免疫小鼠。在融合前,用25μg纯化人因子d增强小鼠两次。然后,通过颈脱位处死小鼠,分离脾脏,通过机械破碎制备单细胞悬浮液。用hyb-sfm(invitrogen)+10%fbs培养基洗涤脾细胞悬浮液一次,计数细胞,并与x63-ag8.653骨髓瘤细胞(atcc)以2:1的比例混合。再次用hyb-sfm培养基洗涤细胞混合物,并通过离心(1000rpm×5min)制备细胞沉淀颗粒。轻轻地扰动细胞沉淀颗粒并使之松散,随后通过缓慢加入聚乙二醇(peg1500)(1.5mlpeg,3×108细胞)诱导细胞融合。细胞在37℃下放置1分钟,然后在3分钟内向细胞中加入20mlhyb-sfm培养基(第一分钟1ml,第二分钟3ml,第三分钟16ml)。将混合物以1000rpm离心5min,并将细胞接种于24孔板中的hat培养基(500mlhyb-sfm培养基中10mlhat[sigmah0262],5mlpen/strep,500μl庆大霉素和10%的fbs)中。2周后,提取具有可见菌落的孔中的上清液,通过elisa筛选与纯化人因子d的反应性,挑取阳性克隆并通过有限稀释法接种于96孔板中以通过elisa进行第二轮筛选后获得单克隆。在ht-培养基(500mlhyb-sfm培养基中10mlht,5mlpen/strep,500μl庆大霉素和10%的fbs)中扩增阳性克隆。在抗体收集之前,将杂交瘤细胞转换至无血清培养基(hyb-sfm)2至3天。收集细胞培养基用于通过蛋白g亲和层析的mab纯化。
实施例2
将微量滴定板用pbs(磷酸盐缓冲盐水)中的脂多糖(lps)(2μg/孔)在37℃下涂覆1小时。用pbst(磷酸盐缓冲盐水和0.05%吐温)洗涤板3次后,用pbs中的1%bsa在室温下封闭板1小时。将10%标准人血清(nhs)、标准食蟹猴血清、标准恒河猴血清、标准豚鼠血清、标准小鼠血清中的任一种用不同浓度的11a8-1mab或1f10-5mab或嵌合11a8-1在4℃下预温育1小时。mg++-egtagvb++缓冲液中的10%血清用作阳性对照,且gvb++edta缓冲液中的10%血清用作阴性对照。将板用nhs在37℃下温育1小时,并随后用冷的pbs中的10mmedta终止并洗涤3次。板用1:4000稀释于封闭缓冲液中的hrp缀合的山羊抗人c3多克隆或抗小鼠c3多克隆c3抗体在室温下温育1小时。将板洗涤3次并用hrp底物生长6至10min。反应用2nh2so4终止,并在微量板读数器中在450nm下读板。
实施例3
将聚苯乙烯微量滴定板用pbs中的纯化人因子d(50ng/孔)在37℃下涂覆1小时。吸出因子d溶液后,用在pbs中含有1%bsa的pbs在室温下封闭孔1小时。没有fd涂覆的孔用作背景对照。将不同浓度的11a8-1mab或1f10-5mab或嵌合11a8-1,50μl/孔的封闭溶液加入孔中。在室温下温育1小时后,用pbst彻底洗涤孔。通过添加在封闭溶液中1:4000稀释的抗小鼠igghrp,使其在室温下温育1小时以检测人因子d结合的mab。用pbst洗涤后,用hrp底物生长板6至10min。反应用2nh2so4终止,并在微量板读数器中在450nm下读板。
实施例4
使用表面等离子体激元共振分析使用biacore3000仪器(biacoreab,uppsala,sweden)测量人因子d与固定的11a8-1mab、1f10-5mab和嵌合体11a8-1结合的缔合和解离速率常数,并且所有biacore实验在25℃下进行。使用cm5传感器芯片的羧化葡聚糖基质通过胺连接化学连接纯化的抗体11a8-1mab、1f10-5mab和嵌合11a8-1,以获得400至500ru表面密度。人fd在hbset(具有吐温20的hepes缓冲盐水edta)缓冲液中稀释至100、50、25、12.5、6.25、3.12、2.56和0nm,并将样品以30μl/分钟(60μl注射)注射于11a8-1mab、1f10-5mab和嵌合体11a8-1表面上120秒,并使结合的分析物的解离进行900秒。数据通过假设二价结合模型的bia评价软件3.2分析。表面的再生用50mmnaoh的50μl注射(50μl/min)实现。
实施例5
为了克隆11a8-1和1f10-5的cdna,通过trizol试剂(sigma)由杂交瘤细胞分离总rna。第一链cdna使用oligo(dt)引物通过逆转录合成,以扩增重链cdna(对于igg1,igg2a/b),以下引物用于pcr反应:5'-gaggtgaagctggtggag(t/a)c(t/a)gg-3'(seqidno:68)和5'-ggggccagtggatagac-3'(seqidno:69)。为了扩增k轻链,使用以下引物:4种上游引物的混合物:5'-ccagttccgagctccagatgacccagactcca-3'(seqidno:70);5'-ccagttccgagctcgtgctcacccagtctcca-3'(seqidno:71);5'-ccagttccgagctccagatgacccagtctcca-3'(seqidno:72);5'-ccagttccgagctcgtgatgacacagtctcca-3'(seqidno:73);下游引物:5'-gttggtgcagcatcagc-3,(seqidno:74)。pcr扩增子克隆至pcrtopota2.1载体(invitrogen)中并测序。为了获得mab的信号肽(前导)序列,使用5'-race方法与来自invitrogen的试剂盒(generacer)。使用由5'-race和初始测序数据确定的特异性引物扩增完整的可变区cdna。
实施例6
我们使用pnd1质粒组装最终的靶向载体。对于短臂同源序列,我们使用5'-cccgggctgggttttggtttttgc-3'(正向;smal位点加下划线)和5'-cccgggtccttgacatgaacactttgc-3'(反向;smai位点加下划线)作为引物(smai位点加下划线)扩增含有小鼠因子d基因的3'区的4.2-kbsmai-smai片段。该片段在用钝化试剂处理的kpni位点处克隆于pnd1载体中。对于长臂同源序列,我们使用5'-atcgatactcagaaatctgcctgcctc-3'(正向;clal位点加下划线)和5'-gcggccgctcctaggaggaccagaactgccaggcgctcccagctgtgcattctgacagca-3'(反向;noti位点加下划线)作为引物扩增含有小鼠因子d基因的5'区的5.7-kb片段。我们还使用5'-ctcgagagagacacgtggctcacaata-3'(正向;xhoi位点加下划线)和5'-ctcgagaattatcgaagtactccaccg-3'(反向;xhoi位点加下划线)作为引物(smal位点加下划线)扩增含有小鼠因子d基因的3'区的1.2-kb片段。合成含有通过genscriptcorp的人因子d的编码序列的826bp片段,并通过用noti和xhoi消化以分离0.75kbnoti-xhoi片段。这三个片段,5.7kb的clai-noti片段,0.75kb的noti-xhoi片段和1.2kb的xhoi-xhoi片段,在clal-xhoi位点亚克隆于上述pnd1载体中。将靶向构建体线性化并电穿孔至c57bl/6es细胞中并针对新霉素抗药性选择。靶向的es克隆体在bamhi消化后通过dna印迹法使用3'探针在适当修饰的基因组区域中识别出5kb野生型片段和4.5kb片段而确定(图11c)。将正确靶向的es克隆体注射到胚泡中以产生嵌合小鼠。得到的雄性嵌合体与雌性c57bl/6小鼠杂交以确定靶向等位基因的种系传递。杂合的人因子d敲入小鼠与flpe遗传修改的小鼠(c57bl/6背景,jacksonlaboratory)杂交以从人因子d敲入等位基因中除去neo盒。缺乏neo盒的杂合人因子d敲入小鼠相互交叉以产生纯合人因子d敲入小鼠。我们使用特异于人因子d(靶尺寸:450bp)的5'-gtcagggtgccatgcaggag-3'(seqidno:26)和5'-cccaggagaacctgcaccttc-3'(seqidno:27),以及特异于小鼠因子d(靶尺寸:292bp)的5'-cctcccacccttagctatcc-3'(seqidno:28)和5'-acccagactgtgtccctcac-3'(seqidno:29)(图11d)通过尾部dnapcr基因分型确定野生型(wt)、杂合(het)和纯合(homo)的人因子d敲入小鼠。
实施例7
进行实验以检查纯合人因子d敲入小鼠中11a8-1和1f10-5mab的体内活性和动力学。给小鼠注射1mg(i.p.)11a8-1mab或1f10-5mab。在注射前(24小时)采集血液样品(50至75μl),并随后在注射后的不同时间点通过眶后放血采集血样和制备血清。对血清样品测试lps诱导的ap补体激活。对于该试验,用50μllps溶液(2μg/孔,在pbs中,37℃,1小时)涂覆elisa板(96孔,nunc)。板用含有0.05%吐温-20(pbs-t)的pbs洗涤3次,并将50μl系列稀释(由1:10开始)的小鼠血清加入每个孔中。小鼠血清用gvb-egta-mg++(含有10mmegta和2.5mmmg++终浓度)稀释。将孔在37℃下温育1小时,用pbs-t洗涤3次,并随后加入50μl的hrp缀合的山羊抗小鼠c3抗体(1:4000,cappel)并将板在室温下静置1小时。将板用pbs-t洗涤三次,然后使用bdpharmingena+b试剂显色。反应在6至10min后用2nh2so4终止。通过测量板上c3沉积的量(od450)检测ap补体激活。
实施例8
为了产生缺失突变体,设计引物(表1)使得采用正向和反向引物缺失接触位点。取代突变体通过在正向引物中引入期望的核苷酸而产生。使用
表1
实施例9
无内毒素的质粒用于转染。使中国仓鼠卵巢(cho)细胞在6孔板中生长至85-90%汇合。在opti-mem(thermofisherscientific)中以1:2比率用阳离子脂质体(lipofectamine)(invitrogen)转染阳性对照和缺失突变质粒。转染48小时后,收集上清液并储存于-20℃下直至使用。用冰冷pbs(invitrogen)洗涤细胞,并加入非变性ripa(放射免疫沉淀试验)缓冲液(20mmtrishclph8,137mmnacl,1%np-40,2mmedta)并伴随偶尔摇晃在冰上保持30min。离心后收集细胞裂解物,并将上清液储存于-20℃下。cho细胞上清液和细胞裂解物用作阴性对照。
实施例10
11a8-1的表位绘图通过免疫沉淀和免疫蛋白印迹法完成。使300mg的cnbr活化的琼脂糖凝胶珠4b(cat#17-0430-1gehealthcare)在1mmhcl中溶胀15min。然后将珠转移到烧结玻璃漏斗中并用200ml的1mmhcl洗涤。凝胶(珠)用ph9.0的结合缓冲液(0.1mnahco3-ph9.0,0.5mnacl)洗涤,并在5min内立即转移到含有1mg的11-8a1抗体的结合缓冲液的管中。将管保持于旋转平台上在40℃下过夜。通过测量结合前后抗体溶液的吸光度来检查抗体与cnbr珠的连接。通过用结合缓冲液洗涤3次来洗掉过量的配体,并用封闭缓冲液(1mtris碱,ph9.0)在室温下封闭剩余的活性位点2小时。为了在结合后除去过量的未结合的配体,将珠用低ph(0.1m乙酸,0.5mnacl)和高ph(结合缓冲液)洗涤缓冲液交替洗涤2次。将200μl的结合的珠与转染上清液和细胞裂解物一起在室温下在旋转平台上温育2小时。将珠用0.5mnacl的pbs溶液洗涤5次。蛋白质用抗体洗脱缓冲液(0.1m甘氨酸,ph2.0)洗脱,并用1.5mtris,ph9.0中和。50μl洗脱的样品用于免疫蛋白印迹。
实施例11
1f10-5的表位绘图通过elisa方法完成。将微量滴定板用pbs中的1f10-5(2μg/ml)在37℃下涂覆1小时。在吸出抗体溶液后,在室温下用在pbs中含有1%bsa的pbs封闭孔1小时。向孔中加入人因子d的全长或四个缺失的突变体(突变体-9、10、11或12)的瞬时cho转染物的细胞培养物上清液。空白是来自未转染的细胞的细胞培养基。在室温下温育1小时后,将孔充分洗涤。通过使用hrp-缀合的链霉抗生物素蛋白,随后使用生物素缀合的山羊抗人因子d抗体检测1f10-5结合的人因子d。洗涤后,将板用hrp底物生长6至10min。反应用2nh2so4终止,并在微量板读数器中在450nm下读板。
为了表位绘图,采用人因子d的全长和4个缺失的突变体测试mab1f10-5的反应性。免疫蛋白印迹证实了4个缺失突变体的蛋白表达。在elisa中,mab1f10-5结合全长、突变体-9和-12,但其与突变体-10和-11的结合大大降低。这些结果如图19所示,表明nrrth在155-159处的五个氨基酸(seqidno:23)或snrr在173-176处的四个氨基酸(seqidno:24)的缺失中断了由mab1f10-5的结合,并且mab1f-10的表位包括氨基酸snrr。
实施例12
用来自野生型和crry/daf/c3三重敲除(tko)小鼠的红细胞(rbc)输注纯合人因子d敲入小鼠。在rbc转移之前24小时用mab118a-1(2mg/小鼠,腹膜内)或pbs处理受体小鼠(纯合人因子d敲入小鼠)。从tko小鼠收获供体rbc,在pbs中洗涤,并根据先前报道的步骤用cfse标记(miwaetal.,2002,blood99;3707-3716)。类似地,还从野生型(c57bl/6j)小鼠收获供体rbc,在pbs中洗涤,并根据制造商说明书采用ddao-se(thermofisherscientific)标记。将相当于200μl血液的wt和tkorbc的1:1混合物通过尾静脉注射于受体小鼠中。在rbc输注后5分钟和6、24、48、72、96、120小时,对受体小鼠放血并分析rbc以确定循环中剩余的cfse或ddao-se标记的(即,输注的)rbc的百分比。在每个时间点将每个受体中的cfse标记的tkorbc的数量标准化(以%表示)于ddao-se标记的wtrbc。
实施例13
通过从k/bxn小鼠(2mg/小鼠,在第0天和第2天i.p.)被动转移纯化总igg来在纯合人因子d敲入小鼠中诱导关节炎。踝部增厚通过卡尺(mitutoyo)测量,并使用先前报道的标准记录临床评分(kimuraetal.,2010,jci;3545-3554)。小鼠在第1天,第3天,第7天,第11天和第15天用1mg11a8-1处理。
实施例14
在人因子d敲入小鼠中评价mab11-8a1、1f10-5和166-32的体内活性。为了评价166-32(参见tanoxus8124090)、11-8a1和1f10-5mab体内阻断旁路途径(ap)补体活性的功效,将因子d人源化小鼠通过重复剂量给予(1mg/小鼠,每隔3天,s.c.给予)处理。在mab处理之前(时间0)和mab处理后6小时和1、3、6和9天采集血浆样品,并测试lps诱导的ap补体活性。将在不同时间点的ap补体活性归一化至时间0时获得的值的100%。数据表明,与mab166-32相比,mab11-8a1和1f10-5具有体内优异的药效动力学活性(图20)。具体地,mab11-8a1在mab给予后的所有时间一致地抑制80%至90%的ap补体活性,而mab166-32仅在mab给予后6小时和第1天才达到相当的抑制。mab1f10-5在第9天显示出50%的ap补体抑制,且在第9天观察到mab166-32的几乎全部ap补体活性抑制(图20)。
嵌合11-8a1mab和嵌合afd的体内活性在人因子d敲入小鼠中评价。为了评价11-8a1/人igg4嵌合mab和afd/人igg4嵌合mab的体内阻断旁路途径(ap)补体活性的功效,将因子d人源化小鼠通过重复剂量给予(1mg/小鼠,每隔3天,s.c.给予)处理。在mab处理之前(时间0)和mab处理之后6小时和1、3、6、9、12和15天采集血浆样品,并测试lps诱导的ap补体活性。将不同时间点的ap补体活性归一化至时间0时获得的值的100%。afd是mab166-32的人源化形式(参见,katschkeetal.,jbiolchem.2012年4月13日;287:12886-12892,wo/2008/055206,美国专利号8,372,403,美国专利号8,273,352,美国专利申请号2014/0212433)。数据表明,11-8a1/人igg4嵌合mab有效得多,并展现出比afd/人igg4嵌合mab好得多的药效动力学分布特性(图21)。具体地,虽然两种mab在mab给予后6小时和第1天都引起90%至100%的抑制,但11-8a1/人igg4嵌合体mab而非afd/人igg4嵌合mab在第6-15天时导致了大于75%的ap补体活性抑制(图21)。
现在描述在该实施例中使用的材料和方法。
166-32mab的纯化
为了制备纯化的166-32mab,从atcc获取分泌与人因子d结合的单克隆抗体166-322的鼠杂交瘤细胞(hb124-76)(参见,tanox的美国专利号8,124,090)并培养。收集细胞培养物培养基用于通过蛋白g亲和色谱法的mab纯化。
11-8a1/人igg4嵌合mab的制备
为了克隆mab11-8a1的cdna,通过trizol试剂(sigma)从杂交瘤细胞中分离总rna。使用oligo(dt)引物通过逆转录合成第一链cdna。为了扩增重链cdna(对于igg1,igg2a/b),在pcr反应中使用了以下引物:5'-gaggtgaagctggtggag(t/a)c(t/a)gg-3'seqidno:72和5'-ggggccagtggatagac-3'seqidno:73。为了扩增k轻链,使用以下引物:4种上游引物的混合物:5'-ccagttccgagctccagatgacccagactcca-3'seqidno:74;5'-ccagttccgagctcgtgctcacccagtctcca-3'seqidno:75;5'-ccagttccgagctccagatgacccagtctcca-3'seqidno:76;5'-ccagttccgagctcgtgatgacacagtctcca-3'seqidno:77;下游引物:5'-gttggtgcagcatcagc-3'seqidno:78。pcr扩增子克隆到pcrtopota2.1载体(invitrogen)中并测序。为了获得mab的信号肽(前导)序列,采用来自invitrogen的试剂盒(generacer)使用5'-race方法。完整可变区cdna使用由5'-race和初始测序数据确定的特异性引物进行扩增。编码mab11-8a1的重链和轻链可变结构域的cdna分别亚克隆于pfuse-chig-hg4和pfuse2-clig-hk载体(invivogen,sandiego,ca)中。为了防止igg4分子的交换,将s228p突变引入11-8a1/人igg4嵌合mab的fc结构域中。重组11-1-8a1/人igg4嵌合体表达于expichoexpressionsystem(thermofisherscientific)中。收集细胞培养物培养基用于通过蛋白g亲和色谱法的嵌合mab纯化。
人源化166-32(afp)ab的制备
编码afd的重链和轻链可变结构域的cdna(参见,katschkeetal.,jbiolchem.2012年4月13日;287:12886-12892,wo/2008/055206,美国专利号8,372,403,美国专利号8,273,352,美国专利申请号2014/0212433)经过合成并克隆于pfuse-chig-hg4和pfuse2-clig-hk载体(invivogen,sandiego,ca)中。为了防止igg4分子的交换,将s228p突变引入afd/人igg4嵌合mab的fc结构域中。重组afd/人igg4mab表达于expichoexpressionsystem(thermofisherscientific)中。收集细胞培养物培养基用于通过蛋白g亲和色谱法的嵌合mab纯化。
纯合人因子d敲入小鼠中的mab药效动力学的评价
进行实验以检查和比较鼠11-8a1、1f10-5、166-32和11-8a1/人igg4嵌合体和afd/人igg4嵌合体mab在纯合人因子d敲入小鼠中的体内活性。每3天向小鼠(10至12周龄)注射1mg/小鼠(pbs中,s.c.)的mab。在注射之前(时间0)和在注射之后的不同时间点通过眶后放血采集来匹卢定(lepirudin)抗凝血浆样品(50至75μl),并制备血浆。血浆样品在-80℃下冷冻并储存直至在elisa-基的lps-诱导ap补体活化试验中进行测试。正如,ap补体活化通过测量孔板上活化的c3片段沉积(od450)的量进行评价(参见kimuraetal.,2008,blood111:732-40)。
本文引述的每个专利、专利申请和出版物的公开内容均通过引用而以其整体结合于本文中。
虽然本发明已经参考具体实施方式进行了公开,但显而易见的是,在不脱离本发明的真实精神和范围的情况下,本领域的其他技术人员可以设计出本发明的其他实施方式和变型。所附权利要求旨在解释为包括所有这样的实施方式和等同变型。
序列表
<110>宾夕法尼亚大学理事会
宋文超
周琳
佐藤纱也加
三轮隆史
达莫达·古尔莉帕利
马杜·戈拉
<120>抗因子d抗体及其用途
<130>046483-6155-00-wo.607243
<150>us62/457,477
<151>2017-02-10
<160>78
<170>patentinversion3.5
<210>1
<211>449
<212>dna
<213>智人
<400>1
ctcaaggtccttacaatgaaatgcagctgggttatcgtcttcctgatggcagtggttaca60
ggggtcaattcagaggttcagctgcagcagtctggggcagaccttgtgaggccaggggcc120
tcagtcaagttgtcctgcacaacttctggcttcaacattaaagacacctatgtgcactgg180
gtgaaacagaggcctgaacagggcctggaatggattggaaggattgatcctgcgaatggt240
cttactacatttgatccgaggttccaggccaaggccactataacagcagacacatcctcc300
aataccgcctacctgcagctcagcagcctgacatctgaggacactgccgtctattactgt360
acatatgctatggaatattggggtcaaggaacctcagtcaccgtctcctcagccaaaacg420
acacccccatctgtctatccactggcccc449
<210>2
<211>149
<212>prt
<213>智人
<400>2
leulysvalleuthrmetlyscyssertrpvalilevalpheleumet
151015
alavalvalthrglyvalasnsergluvalglnleuglnglnsergly
202530
alaaspleuvalargproglyalaservallysleusercysthrthr
354045
serglypheasnilelysaspthrtyrvalhistrpvallysglnarg
505560
progluglnglyleuglutrpileglyargileaspproalaasngly
65707580
leuthrthrpheaspproargpheglnalalysalathrilethrala
859095
aspthrserserasnthralatyrleuglnleuserserleuthrser
100105110
gluaspthralavaltyrtyrcysthrtyralametglutyrtrpgly
115120125
glnglythrservalthrvalserseralalysthrthrproproser
130135140
valtyrproleuala
145
<210>3
<211>8
<212>prt
<213>智人
<400>3
pheasnilelysaspthrtyrval
15
<210>4
<211>14
<212>prt
<213>智人
<400>4
trpileglyargileaspproalaasnglyleuthrthrphe
1510
<210>5
<211>6
<212>prt
<213>智人
<400>5
thrtyralametglutyr
15
<210>6
<211>428
<212>dna
<213>智人
<400>6
ggaccaaagttcaaagacaaaatggattttcaagtgcagattttcagcttcctgctaatc60
agtgcctcagtcatgctgtccagaggacaaattgttctcacccagtctccagcaatcatg120
tctgcatctccaggggagagggtcaccatgacctgcagtgccaggtcagatgtaagttac180
atgtattggtatcagcagaagccaggatcctcccccagactcctgatttatgacacatcc240
aacctggcttctggagtccctgttcgcttcagtgccagtgggtctgggacctcttactct300
ctcacaatcagccgaatggaggctgaagatgctgccacttattactgccagcagtggagt360
agttacccaccgtggacgttcggtggaggcaccaagctggaaatcaaacgggctgatgct420
gcaccaac428
<210>7
<211>142
<212>prt
<213>智人
<400>7
glyprolysphelysasplysmetasppheglnvalglnilepheser
151015
pheleuleuileseralaservalmetleuserargglyglnileval
202530
leuthrglnserproalailemetseralaserproglygluargval
354045
thrmetthrcysseralaargseraspvalsertyrmettyrtrptyr
505560
glnglnlysproglyserserproargleuleuiletyraspthrser
65707580
asnleualaserglyvalprovalargpheseralaserglysergly
859095
thrsertyrserleuthrileserargmetglualagluaspalaala
100105110
thrtyrtyrcysglnglntrpsersertyrproprotrpthrphegly
115120125
glyglythrlysleugluilelysargalaaspalaalapro
130135140
<210>8
<211>8
<212>prt
<213>智人
<400>8
argseraspvalsertyrmettyr
15
<210>9
<211>11
<212>prt
<213>智人
<400>9
leuleuiletyraspthrserasnleualaser
1510
<210>10
<211>9
<212>prt
<213>智人
<400>10
glnglntrpsersertyrproprotrp
15
<210>11
<211>431
<212>dna
<213>智人
<400>11
gcccaagtcttagacatcatggattggctgtggaacttgctattcctgatggcagctgcc60
caaagtgcccaagcacagatccagttggtgcagtctggacctgagctgaagaagcctgga120
gagacagtcaagatctcctgcaaggcttctgggtataccttcacaaactttgaaatgaac180
tgggtgaagcaggctccaggacagggtttaaactggatgggctgtataaacacctacact240
ggagacccaatatatgctgatgacttcaggggacggtttgccttctctttggaaacctct300
gccagcactgcctatttgcagatcaacaacctcaaaaatgaggacatggctacatatttc360
tgttcaagagagggagggggggactactggggccagggcaccactctcacggtctcctca420
gccaaaacgac431
<210>12
<211>143
<212>prt
<213>智人
<400>12
alaglnvalleuaspilemetasptrpleutrpasnleuleupheleu
151015
metalaalaalaglnseralaglnalaglnileglnleuvalglnser
202530
glyprogluleulyslysproglygluthrvallysilesercyslys
354045
alaserglytyrthrphethrasnpheglumetasntrpvallysgln
505560
alaproglyglnglyleuasntrpmetglycysileasnthrtyrthr
65707580
glyaspproiletyralaaspasppheargglyargphealapheser
859095
leugluthrseralaserthralatyrleuglnileasnasnleulys
100105110
asngluaspmetalathrtyrphecysserarggluglyglyglyasp
115120125
tyrtrpglyglnglythrthrleuthrvalserseralalysthr
130135140
<210>13
<211>10
<212>prt
<213>智人
<400>13
glytyrthrphethrasnpheglumetasn
1510
<210>14
<211>17
<212>prt
<213>智人
<400>14
cysileasnthrtyrthrglyaspproiletyralaaspaspphearg
151015
gly
<210>15
<211>6
<212>prt
<213>智人
<400>15
gluglyglyglyasptyr
15
<210>16
<211>432
<212>dna
<213>智人
<400>16
ggaaatacatcaggcaggcaagggcatcaagatgaagtcacagacccaggtcttcgtatt60
tctactgctctgtgtgtctggtgctcatgggagtattgtgatgacccagactcccaaatt120
cctgcttgtatcagcaggagacagggttaccataacctgcaaggccagtcagagtgtgac180
taatgatgtagcttggtaccaacagaagccagggcagtctcctagattgctgatatacca240
tgcatccaatcgctacactggagtccctgagcgcttcactggcagtggatatgggacgga300
tttcactttcaccatcaacactgtgcaggctgaagacctggcagtttatttctgtcagca360
ggattatagctctcctcggacgttcggtggaggcaccaagctggaaatcaaacgggctga420
tgctgcaccaac432
<210>17
<211>143
<212>prt
<213>智人
<400>17
gluilehisglnalaglylysglyilelysmetlysserglnthrgln
151015
valphevalpheleuleuleucysvalserglyalahisglyserile
202530
valmetthrglnthrprolyspheleuleuvalseralaglyasparg
354045
valthrilethrcyslysalaserglnservalthrasnaspvalala
505560
trptyrglnglnlysproglyglnserproargleuleuiletyrhis
65707580
alaserasnargtyrthrglyvalprogluargphethrglysergly
859095
tyrglythraspphethrphethrileasnthrvalglnalagluasp
100105110
leualavaltyrphecysglnglnasptyrserserproargthrphe
115120125
glyglyglythrlysleugluilelysargalaaspalaalapro
130135140
<210>18
<211>11
<212>prt
<213>智人
<400>18
lysalaserglnservalthrasnaspvalala
1510
<210>19
<211>7
<212>prt
<213>智人
<400>19
hisalaserasnargtyrthr
15
<210>20
<211>9
<212>prt
<213>智人
<400>20
glnglnasptyrserserproargthr
15
<210>21
<211>4
<212>prt
<213>智人
<400>21
proleuprotrp
1
<210>22
<211>4
<212>prt
<213>智人
<400>22
valleuasparg
1
<210>23
<211>5
<212>prt
<213>智人
<400>23
asnargargthrhis
15
<210>24
<211>4
<212>prt
<213>智人
<400>24
serasnargarg
1
<210>25
<211>783
<212>dna
<213>智人
<400>25
atgcacagctgggagcgcctggcagttctggtcctcctaggagcggccgcctgcggtgag60
gaggcctgggcctgggcggcgccgccccgtggtcggatcctgggcggcagagaggccgag120
gcgcacgcgcggccctacatggcgtcggtgcagctgaacggcgcgcacctgtgcggcggc180
gtcctggtggcggagcagtgggtgctgagcgcggcgcactgcctggaggacgcggccgac240
gggaaggtgcaggttctcctgggcgcgcactccctgtcgcagccggagccctccaagcgc300
ctgtacgacgtgctccgcgcagtgccccacccggacagccagcccgacaccatcgaccac360
gacctcctgctgctacagctgtcggagaaggccacactgggccctgctgtgcgccccctg420
ccctggcagcgcgtggaccgcgacgtggcaccgggaactctctgcgacgtggccggctgg480
ggcatagtcaaccacgcgggccgccgcccggacagcctgcagcacgtgctcttgccagtg540
ctggaccgcgccacctgcaaccggcgcacgcaccacgacggcgccatcaccgagcgcttg600
atgtgcgcggagagcaatcgccgggacagctgcaagggtgactccgggggcccgctggtg660
tgcgggggcgtgctcgagggcgtggtcacctcgggctcgcgcgtttgcggcaaccgcaag720
aagcccgggatctacacccgcgtggcgagctatgcggcctggatcgacagcgtcctggcc780
tag783
<210>26
<211>20
<212>dna
<213>智人
<400>26
gtcagggtgccatgcaggag20
<210>27
<211>21
<212>dna
<213>智人
<400>27
cccaggagaacctgcaccttc21
<210>28
<211>20
<212>dna
<213>智人
<400>28
cctcccacccttagctatcc20
<210>29
<211>20
<212>dna
<213>智人
<400>29
acccagactgtgtccctcac20
<210>30
<211>20
<212>dna
<213>智人
<400>30
cagcgcgtggaccgcgacgt20
<210>31
<211>20
<212>dna
<213>智人
<400>31
gcgcacagcagggcccagtg20
<210>32
<211>20
<212>dna
<213>智人
<400>32
ggccgccgcccggacagcct20
<210>33
<211>21
<212>dna
<213>智人
<400>33
gccccagccggccacgtcgca21
<210>34
<211>21
<212>dna
<213>智人
<400>34
gccacctgcaaccggcgcacg21
<210>35
<211>23
<212>dna
<213>智人
<400>35
tggcaagagcacgtgctgcaggc23
<210>36
<211>18
<212>dna
<213>智人
<400>36
ggcccgctggtgtgcggg18
<210>37
<211>21
<212>dna
<213>智人
<400>37
gtcccggcgattgctctccgc21
<210>38
<211>20
<212>dna
<213>智人
<400>38
ggccgccgcccggacagcct20
<210>39
<211>20
<212>dna
<213>智人
<400>39
gcgcacagcagggcccagtg20
<210>40
<211>21
<212>dna
<213>智人
<400>40
gccacctgcaaccggcgcacg21
<210>41
<211>20
<212>dna
<213>智人
<400>41
gcgcacagcagggcccagtg20
<210>42
<211>18
<212>dna
<213>智人
<400>42
ggcccgctggtgtgcggg18
<210>43
<211>20
<212>dna
<213>智人
<400>43
gcgcacagcagggcccagtg20
<210>44
<211>21
<212>dna
<213>智人
<400>44
gccacctgcaaccggcgcacg21
<210>45
<211>21
<212>dna
<213>智人
<400>45
gccccagccggccacgtcgca21
<210>46
<211>18
<212>dna
<213>智人
<400>46
ggcccgctggtgtgcggg18
<210>47
<211>21
<212>dna
<213>智人
<400>47
gtcccggcgattgctctccgc21
<210>48
<211>23
<212>dna
<213>智人
<400>48
tgctgtgcgcgccctgccctggc23
<210>49
<211>22
<212>dna
<213>智人
<400>49
gggcccagtgtggccttctccg22
<210>50
<211>24
<212>dna
<213>智人
<400>50
tgtgcgccccgccccctggcagcg24
<210>51
<211>18
<212>dna
<213>智人
<400>51
gcagggcccagtgtggcc18
<210>52
<211>23
<212>dna
<213>智人
<400>52
gcgccccctggcctggcagcgcg23
<210>53
<211>27
<212>dna
<213>智人
<400>53
acagcagggcccagtgtggccttctcc27
<210>54
<211>23
<212>dna
<213>智人
<400>54
ccccctgcccgcccagcgcgtgg23
<210>55
<211>18
<212>dna
<213>智人
<400>55
cgcacagcagggcccagt18
<210>56
<211>23
<212>dna
<213>智人
<400>56
gctcttgccagccctggaccgcg23
<210>57
<211>18
<212>dna
<213>智人
<400>57
acgtgctgcaggctgtcc18
<210>58
<211>25
<212>dna
<213>智人
<400>58
cttgccagtggccgaccgcgccacc25
<210>59
<211>18
<212>dna
<213>智人
<400>59
agcacgtgctgcaggctg18
<210>60
<211>23
<212>dna
<213>智人
<400>60
gccagtgctggcccgcgccacct23
<210>61
<211>23
<212>dna
<213>智人
<400>61
aagagcacgtgctgcaggctgtc23
<210>62
<211>25
<212>dna
<213>智人
<400>62
agtgctggacgccgccacctgcaac25
<210>63
<211>18
<212>dna
<213>智人
<400>63
ggcaagagcacgtgctgc18
<210>64
<211>24
<212>dna
<213>智人
<400>64
gccgcccagcgcgtggaccgcgac24
<210>65
<211>24
<212>dna
<213>智人
<400>65
ggcggcgcgcacagcagggcccag24
<210>66
<211>24
<212>dna
<213>智人
<400>66
gccgccgccacctgcaaccggcgc24
<210>67
<211>25
<212>dna
<213>智人
<400>67
ggcggctggcaagagcacgtgctgc25
<210>68
<211>23
<212>dna
<213>智人
<400>68
cctgcgcacgtaccacgacggcg23
<210>69
<211>21
<212>dna
<213>智人
<400>69
ttgcaggtggcgcggtccagc21
<210>70
<211>23
<212>dna
<213>智人
<400>70
caccgagcgcatgatgtgcgcgg23
<210>71
<211>18
<212>dna
<213>智人
<400>71
atggcgccgtcgtggtac18
<210>72
<211>23
<212>dna
<213>智人
<400>72
gaggtgaagctggtggagacagg23
<210>73
<211>17
<212>dna
<213>智人
<400>73
ggggccagtggatagac17
<210>74
<211>32
<212>dna
<213>智人
<400>74
ccagttccgagctccagatgacccagactcca32
<210>75
<211>32
<212>dna
<213>智人
<400>75
ccagttccgagctcgtgctcacccagtctcca32
<210>76
<211>32
<212>dna
<213>智人
<400>76
ccagttccgagctccagatgacccagtctcca32
<210>77
<211>32
<212>dna
<213>智人
<400>77
ccagttccgagctcgtgatgacacagtctcca32
<210>78
<211>17
<212>dna
<213>智人
<400>78
gttggtgcagcatcagc17
- 还没有人留言评论。精彩留言会获得点赞!