白蛋白结合结构域融合蛋白的制作方法
背景技术:
虽然生物制剂可用于治疗许多疾病,包含癌症,但此类分子的短循环半衰期表示主要障碍。
生物制剂可用于以各种方式治疗癌症。基于细胞因子的疗法可以通过干扰此类细胞如何生长和繁殖而直接对癌细胞起作用。细胞因子还可以通过促进杀伤t细胞和其它攻击癌细胞的细胞的生长来刺激免疫系统。进一步,细胞因子可以促进癌细胞发出吸引免疫系统细胞的化学物质。参见,例如,dranoff,《癌症自然评论(naturereviewscancer)》4:11-22(2004);以及zhang等人,《美国国家科学院院刊(procnatlacadsciu.s.a.)》106(18):7513-7518(2009)。抗体作为治疗剂是可期待的,因为它们识别具有特异性和高亲和力两者的靶标的能力。基于单克隆抗体的疗法,包含靶向肿瘤表面抗原和限制t细胞活化的抑制信号的那些疗法,已经成为20多年来癌症疗法的标准组分。参见,例如,weiner,《癌症自然评论(natrevcancer)》15(6):361-370(2015)。
短循环半衰期表示针对许多生物制剂的主要障碍。参见,例如,perdreau等人,《欧洲细胞因子网络(europeancytokinenetwork)》21:297-307(2010)。此类短效疗法需要频繁的剂量配置,这可能降低对于临床,特别是对于慢性病症的适用性。需要长的血清半衰期,因为它会减少对重复注射分子的需求,以达到在治疗上相关的血清浓度。延长治疗蛋白的半衰期的方法包含:聚乙二醇化、与人血清白蛋白(hsa)融合、与人免疫球蛋白igg的恒定片段(fc)融合、并且与如xten等非结构化多肽融合。参见,例如,stohl,《生物制药(biodrugs)》29(4):215-239(2015)。半衰期延长技术使新的和改进的生物疗法能够降低频繁给药的成本和负担。因此,仍然继续需要可用于延长蛋白质和肽基治疗剂的半衰期的新试剂和方法。
技术实现要素:
本文提供了包含白蛋白结合结构域(abd)的组合物。如本文所描述的,如与没有abd的生物制剂相比,包含受试者白蛋白结合结构域(即白蛋白结合结构域融合蛋白)的生物制剂有利地表现出延长的半衰期和更好的体内药代动力学。
白蛋白结合结构域融合蛋白
背景技术
虽然生物制剂可用于治疗许多疾病,包含癌症,但此类分子的短循环半衰期表示主要障碍。
生物制剂可用于以各种方式治疗癌症。基于细胞因子的疗法可以通过干扰此类细胞如何生长和繁殖而直接对癌细胞起作用。细胞因子还可以通过促进杀伤t细胞和其它攻击癌细胞的细胞的生长来刺激免疫系统。进一步,细胞因子可以促进癌细胞发出吸引免疫系统细胞的化学物质。参见,例如,dranoff,《癌症自然评论(naturereviewscancer)》4:11-22(2004);以及zhang等人,《美国国家科学院院刊(procnatlacadsciu.s.a.)》106(18):7513-7518(2009)。抗体作为治疗剂是可期待的,因为它们识别具有特异性和高亲和力两者的靶标的能力。基于单克隆抗体的疗法,包含靶向肿瘤表面抗原和限制t细胞活化的抑制信号的那些疗法,已经成为20多年来癌症疗法的标准组分。参见,例如,weiner,《癌症自然评论(natrevcancer)》15(6):361-370(2015)。
短循环半衰期表示针对许多生物制剂的主要障碍。参见,例如,perdreau等人,《欧洲细胞因子网络(europeancytokinenetwork)》21:297-307(2010)。此类短效疗法需要频繁的剂量配置,这可能降低对于临床,特别是对于慢性病症的适用性。需要长的血清半衰期,因为它会减少对重复注射分子的需求,以达到在治疗上相关的血清浓度。延长治疗蛋白的半衰期的方法包含:聚乙二醇化、与人血清白蛋白(hsa)融合、与人免疫球蛋白igg的恒定片段(fc)融合、并且与如xten等非结构化多肽融合。参见,例如,stohl,《生物制药(biodrugs)》29(4):215-239(2015)。半衰期延长技术使新的和改进的生物疗法能够降低频繁给药的成本和负担。因此,仍然继续需要可用于延长蛋白质和肽基治疗剂的半衰期的新试剂和方法。
发明内容
本文提供了包含白蛋白结合结构域(abd)的组合物。如本文所描述的,如与没有abd的生物制剂相比,包含受试者白蛋白结合结构域(即白蛋白结合结构域融合蛋白)的生物制剂有利地表现出延长的半衰期和更好的体内药代动力学。
一方面,本文提供了一种包含白蛋白结合结构域(abd)的组合物。所述abd包含:a)可变重链,所述可变重链包含图2中所描绘的可变重链中的任一个的vhcdr1、vhcdr2和vhcdr3;和b)可变轻链,所述可变轻链包含图2中所描绘的可变轻链中的任一个的vlcdr1、vlcdr2和vlcdr3。
在一些实施例中,所述vhcdr1包含根据图2中所描绘的所述vhcdr1、vhcdr2和vhcdr3序列中的任一个的vhcdr1序列,所述vhcdr2包括根据其中任一个的vhcdr2序列,并且所述vhcdr3包含根据其中任一个的vhcdr3序列。在一个实施例中,所述可变重链包含图2中所描绘的所述可变重链中的任一个的序列。在一些实施例中,所述vlcdr1包含根据图2中所描绘的所述vlcdr1、vlcdr2和vhcdr3序列中的任一个的vlcdr1序列,所述vlcdr2包含根据其中任一个的vlcdr2序列,并且所述vlcdr3包含根据其中任一个的vlcdr3序列。在一个实施例中,所述可变轻链包含图2中所描绘的所述可变轻链中的任一个的序列。在示例性实施例中,所述白蛋白结合结构域包括a10m3的可变重链和可变轻链(图2d)。
另一方面,本文提供了一种包含变体il-15的组合物。如与亲本il-15相比,所述变体il-15包含选自由以下组成的组的一个或多个氨基酸取代:k86a、k86r、n112a、n112s、n112q、k86a/n112a、k86r/n112a、k86a/n112s、k86r/n112s、k86a/n112q、k86r/n112q、k86a/n112a/n79a、k86r/n112a/n79a、k86a/n112a/n79d、k86r/n112a/n79d、k86a/n112a/n79q、k86r/n112a/n79q、k86a/n112a/n71d、k86r/n112a/n71d、k86a/n112a/n71q、k86r/n112a/n71q、k86a/n112a/n71d/n79a、k86a/n112a/n71d/n79d、k86a/n112a/n71q/n79a、k86a/n112a/n71q/n79d、k86r/n112a/n71d/n79a、k86r/n112a/n71d/n79d、k86r/n112a/n71d/n79q、k86r/n112a/n71q/n79a、k86r/n112a/n71q/n79d以及k86r/n112a/n71q/n79q。
在一些实施例中,所述变体il-15包含图3中所描绘的变体il-15中的任一个的氨基酸序列。在某些实施例中,所述变体il-15进一步包含连接到所述il-15的il-15受体α(il-15rα)。
一方面,本文提供了一种包含连接到融合配偶体的abd的白蛋白结合结构域(abd)融合蛋白。所述abd包含可变重链和可变轻链,所述可变重链包含图2中所描绘的可变重链中的任一个的vhcdr1、vhcdr2和vhcdr3,所述可变轻链包含图2中所描绘的可变轻链中的任一个的vlcdr1、vlcdr2和vlcdr3。
在一些实施例中,所述vhcdr1包含根据图2中所描绘的所述vhcdr1、vhcdr2和vhcdr3序列中的任一个的vhcdr1序列,所述vhcdr2包含根据其中任一个的vhcdr2序列,并且所述vhcdr3包含根据其中任一个的vhcdr3序列。在一些实施例中,所述可变重链包含图2中所描绘的所述可变重链序列中的任一个的序列。
在某些实施例中,所述vlcdr1包含根据图2中所描绘的所述vlcdr1、vlcdr2和vhcdr3序列中的任一个的vlcdr1序列,所述vlcdr2包含根据其中任一个的vlcdr2序列,并且所述vlcdr3包含根据其中任一个的vlcdr3序列。在某些实施例中,所述可变轻链包含图2中所描绘的所述可变轻链序列中的任一个的序列。
在示例性实施例中,所述可变重链和所述可变轻链分别包含a10m3的可变重链和可变轻链(图2d)。
在一些实施例中,所述融合配偶体是细胞因子。在某些实施例中,所述细胞因子选自:il-2、il-7、il-12、il-15、il-18、il-21、gm-csf和ifn-α。
在某些实施例中,所述融合配偶体是结合部分。在一些实施例中,所述结合部分是包含scfv可变重链和scfv可变轻链的scfv。在一些实施例中,所述scfv选自:抗tgfβscfv、抗pd-l1scfv以及抗tnfscfv。在一些实施例中,所述scfv是抗白细胞介素scfv。在示例性实施例中,所述scfv是抗il-1、il-6、il-8、il-17(a-f)或il-23scfv。
在一些实施例中,所述abd通过连接子连接到所述融合配偶体。在示例性实施例中,所述连接子是(ggggs)x,其中x是1-10的整数。
另一方面,本文提供了一种根据式(il-15)-l-(abd)的il15-白蛋白结合结构域(abd)融合蛋白。所述abd包含可变重链和可变轻链,所述可变重链包含图2中所描绘的可变重链中的任一个的vhcdr1、vhcdr2和vhcdr3,所述可变轻链包含图2中所描绘的可变轻链中的任一个的vlcdr1、vlcdr2和vlcdr3,并且l是连接子。
在一些实施例中,所述vhcdr1包含根据图2中所描绘的所述vhcdr1、vhcdr2和vhcdr3序列中的任一个的vhcdr1序列,所述vhcdr2包含根据其中任一个的vhcdr2序列,并且所述vhcdr3包含根据其中任一个的vhcdr3序列。在一些实施例中,所述可变重链包含图2中所描绘的所述可变重链序列中的任一个的序列。
在某些实施例中,所述vlcdr1包含根据图2中所描绘的所述vlcdr1、vlcdr2和vhcdr3序列中的任一个的vlcdr1序列,所述vlcdr2包含根据其中任一个的vlcdr2序列,并且所述vlcdr3包含根据其中任一个的vlcdr3序列。在某些实施例中,所述可变轻链包含图2中所描绘的所述可变轻链序列中的任一个的序列。
在示例性实施例中,所述可变重链和所述可变轻链分别包含a10m3的可变重链和可变轻链(图2d)。
28.一种根据权利要求22到27中任一项所述的il15-abd融合蛋白,其中所述il-15是变体il-15,如与亲本il-15相比,所述变体il-15包括选自由以下组成的组的一个或多个氨基酸取代:k86a、k86r、n112a、n112s、n112q、k86a/n112a、k86r/n112a、k86a/n112s、k86r/n112s、k86a/n112q、k86r/n112q、k86a/n112a/n79a、k86r/n112a/n79a、k86a/n112a/n79d、k86r/n112a/n79d、k86a/n112a/n79q、k86r/n112a/n79q、k86a/n112a/n71d、k86r/n112a/n71d、k86a/n112a/n71q、k86r/n112a/n71q、k86a/n112a/n71d/n79a、k86a/n112a/n71d/n79d、k86a/n112a/n71q/n79a、k86a/n112a/n71q/n79d、k86r/n112a/n71d/n79a、k86r/n112a/n71d/n79d、k86r/n112a/n71d/n79q、k86r/n112a/n71q/n79a、k86r/n112a/n71q/n79d以及k86r/n112a/n71q/n79q。在一些实施例中,所述变体il-15包含图3中所描绘的变体il-15中的任一个的氨基酸序列。在示例性实施例中,所述变体il-15包含il15k86r/n112a的氨基酸序列。
在某些实施例中,所述il-15是野生型il-15。在一些实施例中,所述il-15包括连接到il-15受体α(il-15rα)的野生型il-15。
在某些实施例中,所述连接子选自图48中所描绘的连接子中的任一个。在一些实施例中,所述连接子是(ggggs)x,其中x是1-10的整数。
在一个实施例中,所述il15-abd融合蛋白具有根据图4中所描绘的氨基酸序列中的任一个的氨基酸序列。
另一方面,本文提供了一种根据式(il-12)-l-(abd)的il12-白蛋白结合结构域(abd)融合蛋白。所述abd包含可变重链和可变轻链,所述可变重链包含图2中所描绘的可变重链中的任一个的vhcdr1、vhcdr2和vhcdr3,所述可变轻链包含图2中所描绘的可变轻链中的任一个的vlcdr1、vlcdr2和vlcdr3,并且l是连接子。
在一些实施例中,所述vhcdr1包含根据图2中所描绘的所述vhcdr1、vhcdr2和vhcdr3序列中的任一个的vhcdr1序列,所述vhcdr2包含根据其中任一个的vhcdr2序列,并且所述vhcdr3包含根据其中任一个的vhcdr3序列。在一些实施例中,所述可变重链包含图2中所描绘的所述可变重链序列中的任一个的序列。
在某些实施例中,所述vlcdr1包含根据图2中所描绘的所述vlcdr1、vlcdr2和vhcdr3序列中的任一个的vlcdr1序列,所述vlcdr2包含根据其中任一个的vlcdr2序列,并且所述vlcdr3包含根据其中任一个的vlcdr3序列。在某些实施例中,所述可变轻链包含图2中所描绘的所述可变轻链序列中的任一个的序列。
在示例性实施例中,所述可变重链和所述可变轻链分别包含a10m3的可变重链和可变轻链(图2d)。
在一个实施例中,所述il-12是单链il-12,所述单链il-12包含p35亚基、p40亚基和il-12连接子,并且所述il-12连接子共价地将所述p35亚基连接到所述p40亚基。在某些实施例中,所述连接子选自图48中所描绘的连接子中的任一个。在示例性实施例中,所述连接子是(ggggs)x,其中x是1-10的整数。
在示例性实施例中,所述il12-abd融合蛋白包含根据图20的氨基酸序列中的任一个的氨基酸序列。
另一方面,本文提供了一种白蛋白结合结构域(abd)融合蛋白,其从n端到c端具有选自以下的式:a)(il-12)-l1-(abd)-l2-(il-15);以及b)(il-15)-l1-(abd)-l2-(il-12)。所述abd包含可变重链和可变轻链,所述可变重链包含图2中所描绘的可变重链中的任一个的vhcdr1、vhcdr2和vhcdr3,所述可变轻链包含图2中所描绘的可变轻链中的任一个的vlcdr1、vlcdr2和vlcdr3,并且l1和l2分别是第一连接子和第二连接子。
在一些实施例中,所述vhcdr1包含根据图2中所描绘的所述vhcdr1、vhcdr2和vhcdr3序列中的任一个的vhcdr1序列,所述vhcdr2包含根据其中任一个的vhcdr2序列,并且所述vhcdr3包含根据其中任一个的vhcdr3序列。在一些实施例中,所述可变重链包含图2中所描绘的所述可变重链序列中的任一个的序列。
在某些实施例中,所述vlcdr1包含根据图2中所描绘的所述vlcdr1、vlcdr2和vhcdr3序列中的任一个的vlcdr1序列,所述vlcdr2包含根据其中任一个的vlcdr2序列,并且所述vlcdr3包含根据其中任一个的vlcdr3序列。在某些实施例中,所述可变轻链包含图2中所描绘的所述可变轻链序列中的任一个的序列。
在示例性实施例中,所述可变重链和所述可变轻链分别包含a10m3的可变重链和可变轻链(图2d)。
在一些实施例中,所述il-15包含野生型il-15多肽。在某些实施例中,野生型il-15连接到il-15受体α(il-15rα)。
在一个实施例中,所述il-15是变体il-15,如与亲本il-15相比,所述变体il-15包含选自以下的一个或多个氨基酸取代:k86a、k86r、n112a、n112s、n112q、k86a/n112a、k86r/n112a、k86a/n112s、k86r/n112s、k86a/n112q、k86r/n112q、k86a/n112a/n79a、k86r/n112a/n79a、k86a/n112a/n79d、k86r/n112a/n79d、k86a/n112a/n79q、k86r/n112a/n79q、k86a/n112a/n71d、k86r/n112a/n71d、k86a/n112a/n71q、k86r/n112a/n71q、k86a/n112a/n71d/n79a、k86a/n112a/n71d/n79d、k86a/n112a/n71q/n79a、k86a/n112a/n71q/n79d、k86r/n112a/n71d/n79a、k86r/n112a/n71d/n79d、k86r/n112a/n71d/n79q、k86r/n112a/n71q/n79a、k86r/n112a/n71q/n79d以及k86r/n112a/n71q/n79q。在一个实施例中,所述il-15包含根据图3中所描绘的氨基酸序列中的任一个的氨基酸序列。
在某些实施例中,所述il-12是单链il-12,所述单链il-12包含p35亚基、p40亚基和il-12连接子,并且其中所述il-12连接子将所述p35亚基连接到所述p40亚基。
在一些实施例中,所述第一连接子和第二连接子各自独立地选自图48中所描绘的连接子中的任一个。在示例性实施例中,所述连接子是(ggggs)x,其中x是1-10的整数。
另一方面,本文提供了一种abd融合蛋白,其根据式(细胞因子)-l-(abd)包含白蛋白结合结构域(abd)、细胞因子和连接子(l)。所述abd包含可变重链和可变轻链,所述可变重链包含图2中所描绘的可变重链中的任一个的vhcdr1、vhcdr2和vhcdr3,所述可变轻链包含图2中所描绘的可变轻链中的任一个的vlcdr1、vlcdr2和vlcdr3,并且l是连接子。所述细胞因子选自:il-2、il-7、il-12、il-15、il-18、il-21、gm-csf和ifn-α。
在一些实施例中,所述vhcdr1包含根据图2中所描绘的所述vhcdr1、vhcdr2和vhcdr3序列中的任一个的vhcdr1序列,所述vhcdr2包含根据其中任一个的vhcdr2序列,并且所述vhcdr3包含根据其中任一个的vhcdr3序列。在一些实施例中,所述可变重链包含图2中所描绘的所述可变重链序列中的任一个的序列。
在某些实施例中,所述vlcdr1包含根据图2中所描绘的所述vlcdr1、vlcdr2和vhcdr3序列中的任一个的vlcdr1序列,所述vlcdr2包含根据其中任一个的vlcdr2序列,并且所述vlcdr3包含根据其中任一个的vlcdr3序列。在某些实施例中,所述可变轻链包含图2中所描绘的所述可变轻链序列中的任一个的序列。
在示例性实施例中,所述可变重链和所述可变轻链分别包含a10m3的可变重链和可变轻链(图2d)。
在一些实施例中,所述连接子选自图48中所描绘的连接子中的任一个。在示例性实施例中,所述连接子是(ggggs)x,其中x是1-10的整数。
另一方面,本文提供了一种根据式:(fp1)-l1-(abd)-l2-(fp2)的abd融合蛋白,其中abd是包含可变重链和可变轻链的白蛋白结合结构域;其中fp1和fp2分别是第一融合蛋白和第二融合蛋白;并且其中l1和l2分别是第一连接子和第二连接子。所述abd包含可变重链和可变轻链,所述可变重链包含图2中所描绘的可变重链中的任一个的vhcdr1、vhcdr2和vhcdr3,所述可变轻链包含图2中所描绘的可变轻链中的任一个的vlcdr1、vlcdr2和vlcdr3。
在一些实施例中,所述vhcdr1包含根据图2中所描绘的所述vhcdr1、vhcdr2和vhcdr3序列中的任一个的vhcdr1序列,所述vhcdr2包含根据其中任一个的vhcdr2序列,并且所述vhcdr3包含根据其中任一个的vhcdr3序列。在一些实施例中,所述可变重链包含图2中所描绘的所述可变重链序列中的任一个的序列。
在某些实施例中,所述vlcdr1包含根据图2中所描绘的所述vlcdr1、vlcdr2和vhcdr3序列中的任一个的vlcdr1序列,所述vlcdr2包含根据其中任一个的vlcdr2序列,并且所述vlcdr3包含根据其中任一个的vlcdr3序列。在某些实施例中,所述可变轻链包含图2中所描绘的所述可变轻链序列中的任一个的序列。
在示例性实施例中,所述可变重链和所述可变轻链分别包含a10m3的可变重链和可变轻链(图2d)。
在一些实施例中,fp1和fp2分别是第一细胞因子和第二细胞因子。在示例性实施例中,所述第一细胞因子和所述第二细胞因子选自il-2和il-12;il-7和il-15;il-15和il-12;il-18和gm-csf;il-21和il-15;gm-csf和il-12;gm-csf和il-21;以及ifn-α和il-15。
在一些实施例中,所述第一融合配偶体和第二融合配偶体选自:抗pd-l1scfv和il-12;抗pd-l1scfv和il-15;抗pd-l1scfv和抗tgfβscfv;第一抗pd-l1scfv和第二pd-l1scfv;抗tgfβscfv和il-12;抗tgfβscfv和il-15;抗tgfβscfv和pd-l1scfv;以及第一抗tgfβscfv和第二抗tgfβscfv。
一种根据权利要求68所述的abd融合蛋白,其中fp1和fp2分别是第一结合部分和第二结合部分。在某些实施例中,所述第一结合部分和所述第二结合部分各自是scfv。在示例性实施例中,所述第一结合部分和所述第二结合部分选自:tnfscfv和il-1scfv;tnfscfv和il-6scfv;tnfscfv和il-8scfv;tnfscfv和il-17(同种型a-f)scfv;tnfscfv和il-23scfv;和第一tnfscfv和第二tnfscfv。
在一些实施例中,所述第一连接子和第二连接子各自独立地选自图48中所描绘的连接子中的任一个。在一个实施例中,所述第一连接子和第二连接子各自独立地是(ggggs)x,其中x是1-10的整数。
另一方面,本文提供了一种白蛋白结合结构域(abd)融合蛋白,其包含tgfβ结合结构域和白蛋白结合结构域。所述白蛋白结合结构域包含具有图2中可变重链和可变轻链中的任一个的氨基酸序列的abd可变重链和abd可变轻链。
在示例性实施例中,所述abd可变重链和所述abd可变轻链包括a10m3的可变重链和可变轻链的氨基酸序列。
在一个实施例中,所述tgfβ结合结构域是包含4d9的可变重链和可变轻链的scfv(图40b)。在一些实施例中,所述abd进一步包含il-12、il-15、pd-l1结合结构域或第二tgfβ结合结构域。
另一方面,本文提供了一种白蛋白结合结构域(abd)融合蛋白,其包含pd-l1结合结构域和白蛋白结合结构域。所述白蛋白结合结构域包含具有图2中可变重链和可变轻链中的任一个的氨基酸序列的abd可变重链和abd可变轻链。
在一些实施例中,所述abd可变重链和所述abd可变轻链包括a10m3的可变重链和可变轻链的氨基酸序列(图2d)。在某些实施例中,所述pd-l1结合结构域是包括10d12的可变重链和可变轻链的scfv(图50)。
在一些实施例中,所述abd进一步包含il-12、il-15、tgfβ结合结构域或第二pd-l1结合结构域。
另一方面,本文提供了一种编码本文所描述的白蛋白结合结构域、变体il-15或abd融合蛋白中的任一种的核酸、包含任何此类核酸的宿主细胞以及制备此类abd、变体il-15或abd融合蛋白的方法。
又另一方面,本文提供了一种抑制或减少有需要的受试者中的肿瘤的方法,所述方法包含向所述受试者施用abd融合蛋白。
附图说明
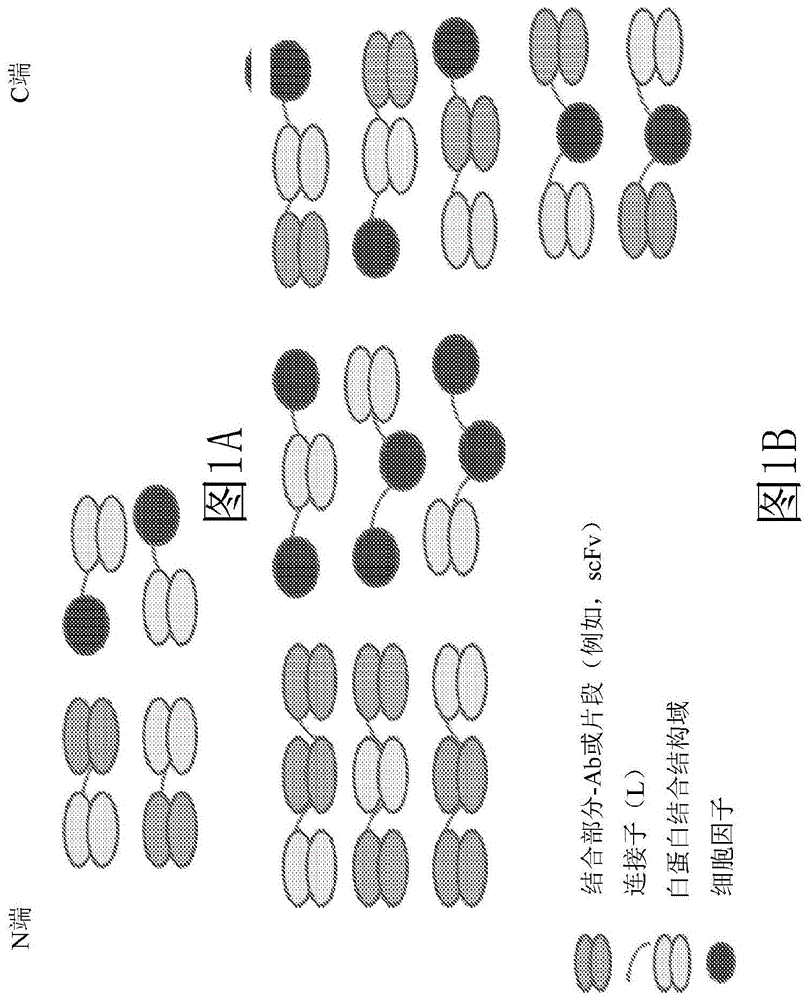
图1a-c展示了本文所公开的若干示例性白蛋白结合结构域融合蛋白,其包含其中白蛋白结合结构域连接到细胞因子(例如,il-12或il-15)的融合蛋白以及其中白蛋白结合结构域连接到1)两个细胞因子;2)两个结合部分(例如,scfv);3)一个结合部分和一个细胞因子的融合蛋白。
图2a-2z示出了包含在本文所描述的标的白蛋白结合结构域融合蛋白的某些实施例中的示例性白蛋白结合结构域的序列。这些图中包含的是可变重结构域和可变轻结构域序列,以及特定的vhcdr1-3和vlcdr1-3序列。
图3示出了本文所描述的示例性il-15变体的序列。
图4示出了本文所描述的il-15-abd融合蛋白的示例性实施例。图4中描绘的il-15-abd融合蛋白包含a10m3abd。
图5描绘了以下研究结果,其示出转录不能解释hek293t细胞中il-15-a10m3的低表达。转染细胞中il15-a10m3mrna的验证。a)hek293中il15-a10m3的表达不能通过使用抗his标签抗体的蛋白免疫印迹(左),或通过与msa结合的功能elisa(右)来检测。m:标志物,ck:作为对照的未转染的培养基,1-3:来自3个独立转染的细胞培养物的培养基(100、200和250分别=100、200、250ug/ml博莱霉素)。将10ug/ml大肠杆菌产生的il15-a10m3用作阳性对照。b)由4个独立il15-a10m3转染的细胞制备mrna,并且进行rt-pcr,以与管家基因gapdh的mrna水平相比,定量il15-a10m3mrna的mrna水平。泳道1)未转染的细胞对照;2-5)il15-a10m3mrna的转录在所有转染的细胞中似乎是正常的;6)gapdhmrna阳性对照。
图6描绘了潜在的il-15泛素化位点的识别,其通过il-15受体α(il-15rα)与il-15结合而被推定保护。(a)红色k86是推定的紧邻il-15rα结合位点(由星标记)的泛素化位点;(b)k86是来自在线泛素化位点数据库ubpred(www.ubpred.org)的泛素化命中点。
图7提供了具有本文所描述的改进的稳定性的各种il-15-abd融合蛋白的示意图,包含具有il-15ra/il15“sushi结构域”融合配偶体的il-15-abd(a)和包含在推定泛素化位点k86处具有氨基酸取代的il-15变体融合配偶体的il-15-abd融合蛋白(b)。
图8描绘了对hek293细胞产生的il-15-abdk86r和k86a变体和il-15rα/il-15-abd表达水平(图8a)以及其结合小鼠血清白蛋白(图8a)和il-15rα(图8b)的能力进行评估的研究。a)用于将il15-abd与12个wtil15-a10m3克隆(wt)、12个il-15rα/il-15-a10m3克隆(il15ra)、6个il-15k86a-a10m3突变体克隆(k86a)和6个il-15k86r-a10m3突变型克隆(k86r)的小鼠血清白蛋白(msa)进行结合的elisa读数。将来自24孔板的每个样品孔的培养基加入到涂有msa的elisa板中。b)将il-15与涂在板上的il-15受体α(il-15rα)结合的elisa用于证实k86a(克隆a3,黄星)和k86r(克隆r6,绿星)突变对il-15与il-15rα的结合活性没有影响。il-15rα-il-15-a10m3中的内部il-15rα(克隆α1,红星)可以结合内部il15,并且从而阻断其与涂在板上的il-15rα的结合。将10ug/ml大肠杆菌产生的wtil-15-a10m3用作阳性对照。
图9描绘了il15k86r-a10m3克隆#6的按比例放大的产生。a)通过尺寸排阻柱进行的il15k86r-a10m3的色谱;b)对14到42的sec级分进行的sds-page分析;c)最终产物(1:il15k86r-a10m3,2:il15ra-il15-a10m3)通过sds-page(左)和使用抗his标签抗体的蛋白免疫印迹(右)进行最终确认。
图10描绘了体外结合测定的结果,证实了il-15k86r-a10m3结合小鼠血清白蛋白(msa)的能力。
图11描绘了ctll2增殖测定的结果,示出与由大肠杆菌产生的野生型il-15和il-15-a10m3相比,由hek293t细胞产生的il-15k86r-a10m3多肽具有降低的生物活性。
图12描绘了以下研究结果,其示出hek细胞产生的il-15k86r-a10m3的生物活性降低至少部分地归因于其糖基化。
图13提供了以下研究结果,其示出引入到il15k86r-a10m3中的n112a突变可以使il-15生物活性恢复到与去糖基化的il-15r-a10m3在ctll2增殖测定中的生物活性相当(a)。(b)进一步示出具有il-15氨基酸取代n112a、n112q和n112s的il-15r-a10m3融合蛋白显示出所增加的生物活性与取代侧链的大小成反比。
图14描绘了用于评估il-15和il-15-abd对b16-f10小鼠黑素瘤模型中的肿瘤生长的体内影响的研究的实验装置。
图15的图示出治疗之后11天时,用il-15-abd融合蛋白处理的c57bl/6小鼠中b16-f10肿瘤生长抑制的量。
图16提供了以下facs分析,其描绘了il-15-abd处理对肿瘤浸润淋巴细胞群的影响。
图17和18提供了il-15-abd处理对脾脏和肿瘤中的淋巴细胞群的影响的总结。
图19a和b提供了以下研究结果,其示出如与对照il-15wt相比,标的il-15-abd在小鼠模型(a)和在人血清(b)中的稳定性。
图20描绘了本文所描述的以下示例性il-12-abds的序列:mil-12sc-a10m3和人il-12sc-a10m3。
图21和22是示出由hek293t细胞产生的标的il-12-abd在体外测定和基于细胞的测定中具有生物活性的研究。
图23描绘了用于评估il-12和il-12-abd对b16-f10小鼠黑素瘤模型中的肿瘤生长的体内影响的研究的实验装置。在三种不同浓度下使用类似摩尔浓度的il-12和il-12。例如,3μg的il-12与4.5μg的il-12-abd具有相同的摩尔浓度,10μg的il-12与15μg的il-12-abd具有相同的摩尔浓度,并且20μg的il-12与30μg的il-12-abd具有相同的摩尔浓度。il-12的分子量为70kd,并且il-12-abd的分子量为107kd。
图24的图描绘了体内il-12-abd/il-12研究中各组的肿瘤生长动力学。图24a示出了il-12和il-12-abd组中肿瘤大小评估的结果,图24b单独地示出了il-12治疗组,并且图24c单独地示出了il-12-abd治疗组。
图25的图描绘了体内il-12-abd/il-12研究的各组中的每个组中的各个动物的肿瘤生长动力学。
图26的图描绘了治疗后10天,体内il-12-abd/il-12研究中的各组的肿瘤体积。
图27描绘了在用il-12或il-12-abd治疗之后,在各个时间点,b16-f10荷瘤小鼠中的纵向体重(左)和体重%(右)测量结果。
图28提供了针对体内il-12-abd/il-12研究中各组的kalpan-meier伪生存曲线。
图29描绘了比较单剂量的il-12-abd与il-12在五天内对b16-f10荷瘤小鼠的药效学影响的研究的总结。示出了肿瘤重量、脾脏重量、血清ifn-γ和体重的比较。
图30示出了比较在10天内用il-12-abd(1.3μg)、il-12(30μg)或安慰剂注射的b16-f10荷瘤小鼠的肿瘤体积的研究结果。在此研究中,il-12-abd以比il-12低~30倍的摩尔剂量施用。
图31进一步描绘了il-12-abd和il-12在来自图32中所描绘的研究的小鼠中在第3天和第7天的造血作用。
图32描绘了研究,示出了使用具有抗pd-1抗体的il-12-abd或il-12的单剂量组合疗法对b16-f10荷瘤小鼠中肿瘤生长的影响。
图33描绘了血清分析的结果,显示il12-abd相对于il-12wt的pk增加。
图34描述了本文所描述的示例性标的il-15-abd-il-12的序列:1)hil-15(k86r/n112a)-a10m3-mil-12sc;2)mil-12sc-a10m3-hil-15(k86r);3)mil-12sc-a10m3-hil-15(k86r/n112a)。
图35示出了hil-15(k86r)-a10m3-mil-12sc和mil-12sc-a10m3-hil-15(k86r)两者与msa(a)、il-15受体α和il-12受体β2(b)的结合活性,如通过elisa所证实的。
图36描绘了本文所描述的附加的示例性标的il-15-abd-il-12的序列:1)hil-15(k86r)-a10m3-hil-12sc;2)hil-12sc-a10m3-hil-15(k86r);3)hil-12sc-a10m3-hil-15(k86r/n112a)。
图37和38描绘了实验结果,显示本文所描述的il-15-abd-il-12表现出il-12(图39)和il-15(图40)活性两者。
图39描绘了以下研究结果,其示出如单独与il-12-abd相比,本文所描述的il-15-abd-il-12表现出优异的活性。
图40a和b描绘了本文所描述的两个示例性tgfβ结合结构域的序列:4h7和4d9,包含可变重链、可变轻链和scfv形式序列。
图41描绘了以下研究结果,其示出本文所描述的tgfβscfv能够阻断tgfβ1诱导的treg(cd4+foxp3+)扩增。
图42和43示出tgf-β阻断逆转tgf-β1诱导的上皮向间质转化(图44)和迁移(图45)。(图42a)emt期间e-钙粘蛋白的丧失和波形蛋白的诱导表达的示意图。(图44b)将小鼠4t1细胞在仅补充有tgf-β1或补充有1d11(板3)或抗tgf-β1scfv(板4)的生长培养基中培养,然后固定,并且用e-钙粘蛋白抗体(绿色)和波形蛋白抗体(紫色)染色。核用dapi(蓝色)复染。用tgf-β1治疗诱导细胞-细胞连接处的e-钙粘蛋白的丧失和波形蛋白的表达增加。通过添加本文所描述的1d11或受试者抗tgf-β1scfv来逆转此作用。图43进一步示出本文所描述的受试者抗tgf-β1scfv阻断tgf-β1介导的癌细胞迁移。
图44提供了研究的总结,其显示本文所描述的受试者抗tgf-β1scfv能够抑制人(a)和小鼠细胞(b)中tgf-β介导的smad2磷酸化。在a中,受试者抗tgf-β1scfv能够以剂量依赖性方式抑制人细胞中人tgf-β1介导的smad2磷酸化。在b中,受试者抗tgf-β1scfv能够在小鼠细胞中抑制小鼠tgf-β1、-β2和-β3介导的smad2磷酸化。
图45a描绘了示例性tgf-β1scfv-abd构建体(4d9m-a6m和4h7-a6m)的序列。
图45b提供了研究的总结,显示抗tgfβ-1-abd延伸抗tgfβ-1scfv。
图46提供了研究的总结,显示在大肠杆菌或哺乳动物(hek)细胞中产生的各种抗tgf-β1scfv-abd(二价,用于tgf-β1)能够结合小鼠血清白蛋白。
图47提供了研究的总结,显示通过示例性tgf-β1scfv-abd构建体(4d9m-a6m和4h7-a6m)逆转tgfβ-1介导的t细胞增殖抑制(即,增加t细胞增殖)。
图48描绘了可以与受试者融合蛋白一起使用的示例性连接子。此类连接子可以用作用于abd可变重链和可变轻链的scfv连接子。此类连接子还可以用于将本文所描述的白蛋白结合结构域连接到il-12和il-15融合配偶体,或将il-12融合配偶体(p35和p40)或il-15融合配偶体(il-15和il-15α)的组分彼此连接。
图49a-g提供了可以包含在本文所描述的abd融合蛋白中的示例性细胞因子的氨基酸序列。图49a-g中还描绘了示例性细胞因子-abd融合蛋白,其中abd是a10m3。虽然用a10m3abd描绘了此类细胞因子-abd融合蛋白,但是本文所描述的包含abd的任何abd都可以包含在细胞因子-abd融合蛋白中。
图50提供了可以与本文所描述的abd融合蛋白一起使用的示例性抗pd-l1结合结构域10d12的氨基序列。10d12在低ph下与hpd-l1结合,并且与mpd-l1交叉反应。10d12不与hpd-l2或mpd-l2结合。进一步,10d12阻断pd-1/pd-l1相互作用,以及b71/pd-l1相互作用。
图51a和b描绘了几种有用的细胞因子-abd-细胞因子(a)和结合部分-abd-细胞因子/结合部分(b)组合。每种组合中的“a”和“b”可以切换到相反的取向。在这些图中还描绘了连接子-a10m3-连接子主链,其可以包含在细胞因子-abd-细胞因子和结合部分-abd-细胞因子/结合部分组合中。尽管描绘了a10m3abd,但是任何包含本文所描绘的那些的abd(例如,图2)都可以用于此类构建体中。
具体实施方式
a.概述
包含基于细胞因子和抗体的治疗剂的生物制剂可用于治疗癌症。
当前和潜在的基于细胞因子的治疗剂包含利用il-2、il-7、il-12、il-15、il-18、il-21gm-csf和ifn-α的那些。
il-12能够以与增强促炎、内源性抗肿瘤免疫应答相容的方式介导免疫效应功能。(参见,例如,boggio等人,《实验医学杂志(jexpmed)》188:589-96(1998);cavallo等人,《癌症研究(cancerres)》59:414-21(1999);yu等人,《国际免疫杂志(intimmunol)》8:855-65(1996);nastala等人,《免疫学杂志(jimmunol)》153:1697:706(1994);brunda等人,《实验医学杂志(jexpmed)》178:1223-30(1993)。已知il-12诱导炎性th1cd4+t细胞应答以及增强cd8+t细胞细胞毒性。研究还表明,由il-12介导的ifnγ的t细胞分泌可以逆转t细胞无反应性,并且赋予效应t细胞对免疫抑制性调节性t细胞的抗性。il-12不仅活化适应性和先天性免疫系统,而且还进一步调节另外的免疫敌对肿瘤微环境的能力使il-12成为肿瘤免疫治疗的理想候选。
il-15能够刺激肿瘤内的t细胞增殖(参见,例如,miecnik等人,《科学转化医学期刊(scitranslmed)》,6(228):228ra37(2014)以及延长效应记忆cd8+t细胞的存活率,并且对nk细胞的发育至关重要。因此,据信il-15可以增强检查点抑制剂和利用t细胞攻击癌细胞的其它免疫疗法的效力。然而,il-15单体在体内具有短于40分钟的短半衰期。对il-15单体的修饰可以改善其在癌症治疗中的体内药代动力学。这些修饰通常集中于用il-15受体、il-15rα的α亚基来改善il-15的反式呈递。此类修饰包含:1)il-15和其可溶性受体α亚基-fc融合的预结合以形成il-15:il-15rα-fc复合物(参见,例如,rubinstein等人,《美国国家科学院院刊(procnatlacadsciu.s.a.)》103:9166–71(2006));2)超激动剂il-15-sil-15rα-sushi蛋白的表达(参见,例如,bessard等人,《分子癌症治疗学(molecularcancertherapeutics)》8:2736-45(2009));和3)人il-15突变体il-15n72d与il-15rα-fcsushi-fc融合复合物的预结合(参见,例如,zhu等人,《免疫学杂志(journalofimmunology)》183:3598-6007(2009))。
基于单克隆抗体的疗法,包含靶向肿瘤表面抗原和限制t细胞活化的抑制信号的那些疗法,已经成为20多年来癌症疗法的标准组分。参见,例如,weiner,《癌症自然评论(natrevcancer)》15(6):361-370(2015)。
短循环半衰期表示包含基于细胞因子和抗体的治疗剂的许多生物制剂的主要障碍。参见,例如,herrington-symes等人,《生物科学和生物技术进展(advancesinbioscienceandbiotechnology)》4:689-698(2013)和perdreau等人,《欧洲细胞因子网络(europeancytokinenetwork)》21:297-307(2010)。此类短效疗法需要频繁的剂量配置,这可能降低对于临床,特别是对于慢性病症的适用性。需要长的血清半衰期,因为它会减少对重复注射分子的需求,以达到在治疗上相关的血清浓度。延长治疗蛋白的半衰期的方法包含:聚乙二醇化、与人血清白蛋白(hsa)融合、与人免疫球蛋白igg的恒定片段(fc)融合、并且与如xten等非结构化融合蛋白融合。参见,例如,stohl,《生物制药(biodrugs)》29(4):215-239(2015)。半衰期延长技术使改进的或新的生物疗法能够降低频繁给药的成本和负担。因此,仍然继续需要可以延长蛋白质和肽基治疗剂的半衰期的新试剂和方法。
本文提供了新的白蛋白结合结构域(abd)融合蛋白,其可用于延长生物制剂(例如,白细胞介素和抗体)的半衰期。由于通过新生儿fc受体(fcrn)再循环,血清白蛋白具有2-4周范围内的长半衰期。白蛋白被内皮细胞通过巨胞饮作用吸收,并且在早期内体的酸性环境中以依赖于ph的方式结合到fcrn。白蛋白-fcrn结合使白蛋白分子从溶酶体隔室中的降解转移,并且将白蛋白分子重定向到质膜,由于中性ph,它们被释放回血浆中。
本文所描述的白蛋白结合结构域(abd)不与fcrn竞争白蛋白结合,并且在允许abd结合到白蛋白时,也经历fcrn驱动的内体白蛋白再循环的ph范围内结合白蛋白。这样,包含受试者白蛋白结合结构域(abd)的生物制剂能够使用白蛋白-fcrn路径来逃避溶酶体降解,并且因此表现出比缺乏abd的对应物更长的血清半衰期。
此外,此类含有abd的治疗剂有利地定位于肿瘤,已知肿瘤含有高水平的血清白蛋白。因此,此类含有abd的治疗剂特别适用于治疗癌症。
b.白蛋白结合结构域
一方面,本文提供了包含白蛋白结合结构域的组合物。如本文所使用的,“血清白蛋白”是指由肝脏产生的球状蛋白家族的成员,其主要作为血液中的类固醇、脂肪酸和甲状腺激素的载体蛋白起作用。血清白蛋白还通过促进血浆的渗透压而在稳定细胞外液体积中起主要作用,并且包含但不限于人血清白蛋白(hsa,基因库登录号:nm_000477和np_000468)和小鼠血清白蛋白(msa,基因库登录号:nm_009654和np_0033784)。白蛋白的结构以若干长α螺旋为特征,并且含有十一个不同的用于疏水化合物的结合结构域。在人类中,血清白蛋白由alb基因编码。
包含受试者白蛋白结合结构域(abd)的融合蛋白可以结合血清白蛋白(sa),其允许融合蛋白被细胞通过巨胞饮作用吸收。在某些实施例中,本文所描述的abd在约ph5.5到约ph7.2的ph范围下结合。在早期内体中,此类sa结合的abd融合蛋白在酸性ph(例如,ph5.5)下通过sa与fcrn结合,其进而将sa结合的abd融合蛋白从细胞的溶酶体隔室转移并且返回质膜。在质膜处,由于中性ph(例如,ph7.1-7.5),sa与fcrn解离,并且sa和abd融合蛋白被释放回血流中。由于包含受试者abd的治疗剂能够在约ph5.5到约ph7.2的ph范围内与白蛋白结合,因此此类治疗剂还有利地经历fcrn驱动的内体白蛋白再循环,并且从而避免溶酶体降解。因此,包含此类abd的治疗剂有利地表现出比缺乏abd的对应物更长的血清半衰期。此类治疗剂特别适用于治疗癌症,已知癌症含有高水平的血清白蛋白。
在一些实施例中,白蛋白结合结构域在不干扰sa与新生儿fc受体(fcrn)结合的位点处结合白蛋白。如本文所使用的,“fcrn”或“新生儿fc受体”意指结合igg抗体fc区,并且至少部分地由fcrn基因编码的蛋白质。fcrn可以来自任何生物体,包含但不限于人、小鼠、大鼠、兔和猴。如本领域已知的,功能fcrn蛋白包括两种融合蛋白,常常被称为重链和轻链。轻链是β-2-微球蛋白,并且重链由fcrn基因编码。除非本文另外指出,否则fcrn或fcrn蛋白是指fcrn重链与β-2-微球蛋白的复合物。
在一些实施例中,本文所描述或所例示的白蛋白结合结构域优选地在血清白蛋白分子上不参与血清白蛋白分子与fcrn相互作用的表位上特异性结合血清白蛋白(例如,hsa)。因此,sa结合部分与血清白蛋白分子的结合优选地基本上不干扰、抑制、预防或以其它方式降低血清白蛋白分子(例如,hsa)与fcrn的结合。优选地,白蛋白结合结构域不与fcrn竞争结合血清白蛋白分子。优选地,白蛋白结合结构域不在空间上抑制血清白蛋白与fcrn的结合。优选地,sa结合部分不改变血清白蛋白分子的构象,使得白蛋白不能与fcrn相互作用。
在一些实施例中,白蛋白结合结构域在ph5.0±0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1.0、1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9、2.0、2.1、2.2、.2.3、.2.4、.2.5、2.6、2.7、2.8、2.9或3.0下结合sa(例如,hsa)。在一些实施例中,白蛋白结合结构域在约ph5.5-约ph7.2的ph范围内结合sa。在一些实施例中,sa结合部分在5.5的ph下结合sa。
在某些实施例中,白蛋白结合结构域是人血清白蛋白(hsa)结合结构域。hsa结合结构域包含但不限于可以结合hsa分子,如整个hsa分子或hsa的片段的白蛋白结合结构域。在一些实施例中,hsa结合结构域还结合小鼠血清白蛋白。在一些实施例中,hsa结合结构域还结合食蟹猴白蛋白。在某些实施例中,hsa结合结构域不结合牛血清白蛋白(bsa)。
本文所提供的白蛋白结合结构域可以包含单独的可变重链或与可变轻链结合的可变重链。在一些实施例中,白蛋白结合结构域包含可变重链。在某些实施例中,可变重链包含vhcdr1、vhcdr2和vhcdr3(可变重链互补决定区1-3)。在某些实施例中,抗原结合结构域还包含可变轻链。在某些实施例中,可变轻链包含vlcdr1、vlcdr2和vlcdr3(可变轻链互补决定区1-3)。
在一些实施例中,白蛋白结合结构域包含可变重链,所述可变重链包含图2中所描绘的可变重链中的任一个的vhcdr1、vhcdr2和vhcdr3。在一些实施例中,白蛋白结合结构域包含a10m3可变重链的vhcdr1、vhcdr2和vhcdr3,如图2d中所示出。在某些实施例中,白蛋白结合结构域包含如图2d中所示出的a10m3的vhcdr1、vhcdr2和vhcdr3。
在某些实施例中,白蛋白结合结构域还包含可变轻链。在示例性实施例中,白蛋白结合结构域包含可变轻链,所述可变轻链包含图2中所描绘的可变轻链中的任一个的vlcdr1、vlcdr2和vlcdr3。在一些实施例中,白蛋白结合结构域包含a10m3可变轻链的vlcdr1、vlcdr2和vlcdr3,如图2d中所示出。在某些实施例中,白蛋白结合结构域包含如图2d中所示出的a10m3的vlcdr1、vlcdr2和vlcdr3。
在某些实施例中,白蛋白结合结构域(例如,hsa结合结构域)是抗体或抗体片段。在一些实施例中,白蛋白结合结构域(例如,hsa结合结构域)是scfv。
在abd包含可变重链和可变轻链两者的一些实施例中,可变重链和可变轻链通过连接子(例如,scfv连接子)彼此连接。在某些实施例中,连接子在其c端与可变重链连接,并且在其n端与可变轻链连接。合适的连接子在本文和图48中描述。在一些实施例中,连接子是(gly4ser)x连接子,其中x是1、2、3、4、5、6、7或8。在某些实施例中,连接子是(gly4ser)5连接子。
在某些实施例中,白蛋白结合结构域还包含可变重链和可变轻链,所述可变重链包含a10m3的vhcdr1、vhcdr2和vhcdr3,所述可变轻链包含a10m3的vlcdr1、vlcdr2和vlcdr3(图2d)。在一个实施例中,白蛋白结合结构域包含图2d中所描绘的a10m3abd的可变重序列和可变轻序列。
c.白细胞介素-15变体
另一方面,本文提供了组合物,其包含与野生型il-15相比,具有改进的体内稳定性和/或生物活性的变体il-15。
如本文所使用的,“白细胞介素15”、“il-15”和“il15”均指白细胞介素,其通过由il-15特异性受体α链、il-2/il-15受体β链(cd122)和共同γ链(γ-c,cd132)构成的复合物结合并发出信号(基因库登录号:nm_00000585和np_000576(人类);以及nm_001254747和np_001241676(小鼠))。
已经示出il-15刺激肿瘤内的t细胞增殖(参见,例如,miecnik等人,《科学转化医学期刊(scitranslmed)》6(228):228ra37(2014))。il-15还能够延长效应记忆cd8+t细胞的存活率,并且对nk细胞的发育至关重要。据信il-15可以增强检查点抑制剂和利用t细胞攻击癌细胞的其它免疫疗法的效力。因此,不受任何特定操作理论的束缚,据信本文所描述的il-15可用于治疗癌症。
然而,il-15单体在体内具有短于40分钟的短半衰期。对il-15单体的修饰可以改善其在癌症治疗中的体内药代动力学。这些修饰通常集中于用il-15受体、il-15rα的α亚基来改善il-15的反式呈递。此类修饰包含:1)il-15和其可溶性受体α亚基-fc融合的预结合以形成il-15:il-15rα-fc复合物(参见,例如,rubinstein等人,《美国国家科学院院刊(procnatlacadsciu.s.a.)》103:9166–71(2006));2)超激动剂il-15-sil-15rα-sushi蛋白的表达(参见,例如,bessard等人,《分子癌症治疗学(molecularcancertherapeutics)》8:2736-45(2009));和3)人il-15突变体il-15n72d与il-15rα-fcsushi-fc融合复合物的预结合(参见,例如,zhu等人,《免疫学杂志(journalofimmunology)》183:3598-6007(2009))。
在一些实施例中,il-15是亲本il-15的变体,与野生型il-15相比具有增加的稳定性。在特定实施例中,变体il-15是野生型人il-15的变体。在示例性实施例中,变体il-15在图3中所示出的亲本il-15的位置k86处包含氨基酸取代。如本文所描述的,当使用特定细胞类型(例如,hek293t细胞)制备时,k86是泛素依赖性降解的推定位点(参见实例2)。因此,不受任何特定操作理论的束缚,据信通过氨基酸取代去除k86泛素化位点改善了il-15的稳定性(参见实例2和3)。
在某些实施例中,il-15是在位置n112处具有氨基酸取代的变体il-15。氨基酸位置n112是用于il-15生物活性的关键位点,因为它对于适当的il-15/il-15受体γ相互作用至关重要,特别是当il-15连接到abd时。因此,不受任何特定操作理论的束缚,据信位置n112处的突变可以增强il-15的一种或多种功能,包含但不限于促进肿瘤环境中的t细胞增殖、增强cd8+t细胞的存活率以及促进nk细胞发育。
可以改善il-15体内稳定性和/或生物活性的特定氨基酸取代包含但不限于:k86a、k86r、n112a、n112s、n112q、k86a/n112a、k86r/n112a、k86a/n112s、k86r/n112s、k86a/n112q、k86r/n112q、k86a/n112a/n79a、k86r/n112a/n79a、k86a/n112a/n79d、k86r/n112a/n79d、k86a/n112a/n79q、k86r/n112a/n79q、k86a/n112a/n71d、k86r/n112a/n71d、k86a/n112a/n71q、k86r/n112a/n71q、k86a/n112a/n71d/n79a、k86a/n112a/n71d/n79d、k86a/n112a/n71q/n79a、k86a/n112a/n71q/n79d、k86r/n112a/n71d/n79a、k86r/n112a/n71d/n79d、k86r/n112a/n71d/n79q、k86r/n112a/n71q/n79a、k86r/n112a/n71q/n79d和k86r/n112a/n71q/n79q。图3中描绘了包含此类氨基酸取代中的一个或多个的示例性变体il-15。在示例性实施例中,变体il-15包含氨基酸取代k86a和n112a。
在一个实施例中,本文所描述的il-15(野生型和变体il-15)连接到il-15rα。如单独与天然il-15相比,此类以反式呈现的il-15和其受体已经被证明具有延长的半衰期和更高的效力。参见,例如,wu,《分子和基因医学杂志(jmolgenetmed)》7,85(2013)。
d.il-12
另一方面,本文提供了包含il-12的组合物。如本文所使用的,“白细胞介素12”、“il-12”和“il12”均指白细胞介素,其是由il-12a和il-12b基因(基因库登录号:nm_000882(il-12a)和nm_002187(il-12b))编码的异二聚体细胞因子。il-12由一束四个α螺旋构成,并且参与天然t细胞到th1细胞的分化。il-12结合il-12受体,所述il-12受体是由il-12r-β1和il-12r-β2形成的异二聚体受体。il-12被称为t细胞刺激因子,其可以刺激t细胞的生长和功能。具体地,il-12可以刺激由t细胞和自然杀伤(nk)细胞产生干扰素γ(ifn-γ)和肿瘤坏死因子-α(tnf-α),并且减少il-4介导的ifn-γ的抑制。il-12可以进一步介导nk细胞和cd8+细胞毒性t淋巴细胞的细胞毒活性的增强。此外,il-12还可以通过增加干扰素γ的产生而具有抗血管生成活性,这进而增加趋化因子诱导蛋白-10(ip-10或cxcl10)的产生。然后ip-10介导这种抗血管生成作用。不受任何特定操作理论的束缚,据信il-12通过其诱导免疫应答的能力和其抗血管生成活性可以用于治疗癌症。
在一些实施例中,il-12是小鼠il-12。在其它实施例中,il-12是人il-12。
在某些实施例中,il-12是单链il-12多肽,其包括连接到il-12p40亚基的il-12p35亚基。此类il-12单链多肽有利地保留野生型il-12的生物学活性中的一种或多种。在一些实施例中,本文所描述的单链il-12多肽从n端到c端是根据式(p40)-(l)-(p35),其中“p40”是il-12p40亚基,“p35”是il-12p35亚基,并且l是连接子。在其它实施例中,单链il-12从n端到c端是根据式(p35)-(l)-(p40)。任何合适的连接子可以用于单链il-12多肽,包含本文所描述的和图49c中所公开的那些。合适的连接子可以包含,例如,具有氨基酸序列(ggggs)x的连接子,其中x是1-10的整数。其它合适的连接子包含例如氨基酸序列ggggggs。可以与受试者单链il-12多肽一起使用的示例性单链il-12连接子还描述于lieschke等人,《自然生物技术(naturebiotechnology)》15:35-40(1997)中,其通过引用以其整体并入本文,并且特别是对于il-12多肽连接子的教导。
在示例性实施例中,单链il-12多肽是单链人il-12多肽(即,其包含人p35和p40il-12亚基)。在某些实施例中,单链il-12多肽是单链小鼠il-12多肽。在图20(示出为具有abd的融合肽)和49c中描绘了示例性的单链人和小鼠il-12。
e.abd融合蛋白
一方面,本文提供了abd组合物,其包含通过连接子连接到一个或多个融合配偶体(例如,第一融合配偶体、第二融合配偶体等)的白蛋白结合结构域。如本文所讨论的,受试者abd融合蛋白能够进行fcrn介导的内体再循环,并且,因此,与不包含此类abd的对应物相比,有利地表现出延长的半衰期。
可用于此类abd融合蛋白的abd包含但不限于本文所描述的那些。例如,在图2中公开了包含vhcdr1-3、vlcdr1-3、可变重链和可变轻链序列的此类abd的氨基酸序列。在一些实施例中,abd融合蛋白包含可变重链和可变轻链,所述可变重链包含图2中abd可变重链中的任一个的vhcdr1、vhcdr2和vhcdr3,所述可变轻链包含图2中abd可变轻链中的任一个的vlcdr1、vlcdr2和vcdr3。在某些实施例中,abd包含可变重链和可变轻链,所述可变重链具有图2中所公开的abd的vhcdr1、vhcdr2和vhcdr3,所述可变轻链具有图2中所公开的abd的vhcdr1、vhcdr2和vhcdr3。在一些实施例中,abd融合蛋白包含图2中所公开的abd的可变重链和可变轻链。
在示例性实施例中,abd融合蛋白包含可变重链和可变轻链,所述可变重链包含a10m3可变重链的vhcdr1、vhcdr2和vhcdr3,所述可变轻链包含a10m3可变轻链的vlcdr1、vlcdr2和vcdr3(图2d)。在某些实施例中,abd包含可变重链和可变轻链,所述可变重链具有a10m3的vhcdr1、vhcdr2和vhcdr3,所述可变轻链具有a10m3的vhcdr1、vhcdr2和vhcdr3(图2d)。在一些实施例中,abd融合蛋白包含a10m3的可变重链和可变轻链(图2d)。
本文所描述的abd融合蛋白包含融合配偶体。在一些实施例中,融合配偶体包含两个融合配偶体(第一融合配偶体(fp1)和第二融合配偶体(fp2))。在包含两个融合配偶体的实施例中,融合配偶体可以以若干种取向连接到abd。在一些实施例中,abd融合蛋白从n端到c端是根据式:fp1-abd-fp2、fp1-pf2-abd或abd-fp1-fp2,其中fp1是第一融合配偶体,并且fp2是第二融合配偶体。
其中需要融合配偶体的半衰期延长的任何合适的融合配偶体可以包含在受试者abd融合蛋白中。融合配偶体可以包含例如细胞因子(例如,干扰素和白细胞介素)、生长因子、多肽、蛋白质和激素(例如,生长激素、甲状旁腺激素)。
在某些实施例中,融合配偶体是基于抗体的结合部分,其包含可变重链和可变轻链。此类结合部分可以结合任何感兴趣的靶标,包含例如肿瘤特异性靶标或细胞因子。在示例性实施例中,融合配偶体是单链可变片段(scfv)。基于抗体的融合配偶体还包含但不限于ds-scfv、单结构域抗体(sdab)、双抗体、dsfv、ds-scfv、fab和全长抗体。基于抗体的融合配偶体还包含多特异性(例如,双特异性)抗体和片段。
本文所描述的受试者abd融合蛋白利用组分(abd和融合配偶体)之间和组分内的连接子。例如,scfv融合配偶体利用通常基于甘氨酸和丝氨酸的标准肽连接子来连接变体重链和轻链,以形成scfv。进一步,利用标准肽连接子来将abd连接到融合配偶体(例如,细胞因子融合配偶体)。此外,使用连接子来连接特定部分的组分,例如具有il-15rα的il-12和il-15的p35和p40亚基。在一些实施例中,连接子是(gly4ser)x连接子,其中x是1、2、3、4、6、7或8。在特定实施例中,abd通过(gly4ser)5连接子连接到融合配偶体。
如本文所示出的,可以使用许多合适的连接子,包含通过重组技术生成的传统肽键。连接子肽可以主要包含以下氨基酸残基:gly、ser、ala或thr。连接子肽应当具有足够以此方式连接两个分子的长度:所述分子假设相对于彼此的正确构象使得其保留期望活性。在一个实施例中,连接子在长度上为约1个到50个氨基酸,在长度上优选地为约1个到30个氨基酸。在一个实施例中,可以使用长度为1个到20个氨基酸的连接子,在一些实施例中使用约5个到约10个氨基酸。有用的连接子包含甘氨酸-丝氨酸聚合物、甘氨酸-丙氨酸聚合物、丙氨酸-丝氨酸聚合物和其它柔性连接子,所述甘氨酸-丝氨酸聚合物包含例如(gs)n、(gsggs)n、(ggggs)n、和(gggs)n,其中n是至少为一(并且通常为3到4)的整数。替代性地,各种非蛋白质聚合物可以用作连接子,包含但不限于聚乙二醇(peg)、聚丙二醇、聚氧化烯、或聚乙二醇和聚丙二醇的共聚物。
其它连接子序列可以包含具有任何长度的cl/ch1结构域的任何序列,但并非cl/ch1结构域的所有残基;例如,cl/ch1结构域的前5-12个氨基酸残基。连接子可以衍生自免疫球蛋白轻链,例如cκ或cλ。连接子可以衍生自任何同种型的免疫球蛋白重链,包含例如,cγ1、cγ2、cγ3、cγ4、cα1、cα2、cδ、cε、和cμ。连接子序列还可以衍生自其它蛋白质,如类ig蛋白(例如,tcr、fcr、kir)、铰链区衍生序列以及来自其它蛋白质的其它天然序列。
通常,连接子对细胞外环境基本上不敏感。如本文所使用的,在连接子的上下文中,“对细胞外环境基本上不敏感”是指当抗体-药物缀合物化合物存在于细胞外环境(例如,血浆)中时,抗体-药物缀合物化合物样品中不超过约20%、15%、10%、5%、3%或不超过约1%的连接子被切割。
连接子是否对细胞外环境基本上不敏感可以通过以下来确定:例如将抗体-药物缀合物化合物与血浆一起孵育,持续预定时间段(例如2小时、4小时、8小时、16小时或24小时),并且然后定量血浆中存在的游离药物的量。
在其它非互斥的实施例中,连接子促进细胞内化。在某些实施例中,当与治疗剂缀合时(即,在如本文所描述的抗体-药物缀合物化合物的连接子-治疗剂部分的环境中),连接子促进细胞内化。在又其它实施例中,当与奥瑞斯他汀(auristatin)化合物和本发明的abd融合蛋白两者缀合时,连接子促进细胞内化。
wo2004-010957、美国公开第2006/0074008号、美国公开第20050238649号和美国公开第2006/0024317号中描述了可以与本组合物和方法一起使用的多种示例性连接子(所述参考文献中的每一个通过引用以其整体并入本文,并且用于任何目的)。
图48中进一步描绘了可以与受试者abd一起用作结构域连接子、scfv连接子以及特定融合配偶体的连接组分的示例性连接子。
在一些实施例中,连接子是“结构域连接子”,用于将本文所概述的任何两个结构域连接在一起(例如,细胞因子融合配偶体(例如,白细胞介素)和abd)。虽然可以使用任何合适的连接子,但是许多实施例利用甘氨酸-丝氨酸聚合物以及允许以足够允许每个结构域保持其生物学功能的长度和柔性来重组连接这两个结构域的任何肽序列,所述甘氨酸-丝氨酸聚合物包含例如(gs)n、(gsggs)n、(ggggs)n和(gggs)n,其中n是至少为一(并且通常为3到4到5)的整数。
在一些实施例中,融合配偶体是包含可变重链和可变轻链的scfv。在此类实施例中,abd可变重链用scfv连接子连接到可变轻链。
以下进一步讨论示例性abd融合蛋白。
1.细胞因子-abd融合蛋白
在一些实施例中,abd融合蛋白包含细胞因子融合配偶体,即细胞因子-白蛋白结合结构域(细胞因子-abd)融合蛋白(图1)。在一些实施例中,细胞因子-abd融合蛋白包含il-2、il-7、il-12、il-15、il-18、il-21、il-27、gm-csf或ifn-α。受试者细胞因子-abd融合蛋白可用于需要此类免疫调节作用的受试者的免疫调节作用(例如,治疗癌症或自身免疫疾病)。此外,如单独与白细胞介素治疗剂相比,受试者细胞因子-abd表现出更长的半衰期和改进的药代动力学性质。
任何abd可以与本文所描述的受试者细胞因子-abd融合蛋白一起使用。在一些实施例中,abd包含abd可变重链。在某些实施例中,abd包含abd可变轻链。在示例性实施例中,abd是scfv,其包含通过连接子(例如,本文和图48中所公开的连接子中的任一个)连接到可变轻链的可变重链。
在某些实施例中,可变重链包含本文所描述的abd可变重链中的任一个的vhcdr1-3,包含图2中所描绘的那些abd可变重链。在某些实施例中,abd可变重链包含a10m3可变重链的vhcdr1-3(图2d)。在一些实施例中,abd可变重链包含如图2d中所描绘的a10m3vhcdr1-3。在示例性实施例中,abd可变重链具有a10m3可变重链的氨基酸序列。
在某些实施例中,abd包含abd可变轻链。在一些实施例中,abd可变轻链包含本文所描述的abd可变轻链中的任一个的vlcdr1-3,包含图2中所描绘的那些abd可变轻链。在某些实施例中,abd可变轻链包含a10m3可变轻链的vlcdr1-3(图2d)。在一些实施例中,abd可变轻链包含如图2d中所描绘的a10m3vlcdr1-3。在示例性实施例中,abd可变轻链具有a10m3可变轻链的序列。
图49a-g中描绘了可以用于受试者细胞因子-abd融合的示例性细胞因子以及示例性细胞因子-abd融合蛋白的氨基酸序列,其中abd为a10m3。
在一些实施例中,il-abd从n端到c端是根据式:细胞因子-l-abd或abd-l-细胞因子,其中l是将细胞因子连接到abd的连接子(例如,肽连接子)。在某些实施例中,细胞因子-abd包含可变重链,并且细胞因子连接到abd可变重链的n端。在一些实施例中,细胞因子连接到abd可变重链的c端。在示例性实施例中,白细胞介素-abd包含abd,所述abd还包含可变轻链(例如,abdscfv)。在一些实施例中,细胞因子连接到可变轻链的c端。在某些实施例中,细胞因子的n端连接到abd。在其它实施例中,细胞因子的c端连接到abd。
在一些实施例中,细胞因子是选自以下的细胞因子:il-2、il-7、il-12、il-15、il-18、il-21、il-27、gm-csf和ifn-α。细胞因子分子包含,例如,全长细胞因子和细胞因子片段,例如,对特定细胞因子的功能重要的一部分(例如,与其受体结合的白细胞介素的一部分)。
在一些实施例中,细胞因子-abd包含il-2分子或其片段。如本文所使用的,“白细胞介素2”、“il-2”和“il2”是指具有四个α螺旋束和通过il-2受体的信号的细胞因子的成员(基因库登录号:nm_000586和np_000577(人)和nm_008366和np_032392(小鼠))。il-2主要通过其对t细胞的直接作用在免疫系统功能、耐受性和免疫中起关键作用。在胸腺中,il-2通过促进某些未成熟t细胞分化为调节性t细胞来预防自身免疫性疾病,所述调节性t细胞杀死其它致力于攻击体内正常健康细胞的t细胞。il-2已经以大间歇剂量用于治疗癌症(恶性黑素瘤、肾细胞癌),并且已经以连续剂量广泛使用。示例性il-2-abd示出在图49a中。
在一些实施例中,细胞因子-abd融合蛋白包含il-7分子或其片段。如本文所使用的,“白细胞介素7”、“il-7”和“il7”(基因库登录号:nm_000880和np_000871(人);和nm_008371和np_032397(小鼠))均指细胞因子的成员,其是由骨髓和胸腺中的基质细胞分泌的造血生长因子,并且结合il-7受体。白细胞介素-7(il-7)是在适应性免疫系统中起中心作用的非造血细胞衍生的细胞因子。它促进胸腺中淋巴细胞的发育,并且维持外周中的未成熟和记忆t细胞稳态的存活。此外,重要的是淋巴结(ln)的器官发生和维持募集到次级淋巴器官(slo)中的活化t细胞。il-7是通过促进外周t细胞扩增免疫重建免疫抑制癌症患者的理想解决方案。在动物模型中,il-7已经被证明延长荷瘤宿主的存活。示例性il-7-abd示出在图49b中。
在某些实施例中,细胞因子-abd包含il-12分子或其片段。在一些实施例中,il-12是如本文所描述的和如图20(示出为具有abd的融合肽)和49c中所描绘的单链il-12。
在某些实施例中,细胞因子-abd包含il-15分子或其片段。在一些实施例中,il-15-abd包含如本文和在图3和4处所描述的变体il-15。在一些实施例中,如图3中所示出的(例如,“亲本il-15”),il-15是野生型il-15。在某些实施例中,野生型il-15连接到il-15受体α(il-15rα)。
在某些实施例中,细胞因子-abd包含il-21分子或其片段。如本文所使用的,“白细胞介素21”、“il-21”和“il21”(基因库登录号:nm_001207006和np_001193935(人);和nm_0001291041和np_001277970(小鼠))均指细胞因子的成员,其结合il-21受体,并且对免疫系统的细胞,包含自然杀伤(nk)细胞和细胞毒性细胞具有有效调节作用,并且结合可以破坏病毒感染或癌细胞的il-21受体。因此,不受任何特定操作理论的束缚,据信具有il-21的受试者细胞因子-abd可用于治疗各种癌症。示例性il-21-abd示出在图49e中。
可以包含在受试者细胞因子-abd中的其它有用细胞因子包含但不限于il-27、ifn-α和gm-csf。在某些实施例中,白细胞介素-abd多肽还包含干扰素-α、干扰素-β或gm-csf分子。此类分子可用于递送到肿瘤中,并且降低毒性。
在一些实施例中,细胞因子-abd包含连接到选自以下的abd的两种细胞因子:il-2和il-12;il-7和il-15;il-15和il-12;il-18和gmcsf;il-21和il-15;gmc-sf和il-12;gmc-sf和il-21;以及ifn-α和il-15。图1描绘了若干示例性取向,其中两种细胞因子可以连接到abd。任何abd都可以用于此类融合蛋白中,包含包含在图2中所示出的abd可变重结构域和可变轻结构域中的任一个的那些。在一些实施例中,abd是a10m3。
可以使用任何连接子将每种细胞因子连接到abd,包含图48中所描绘的任何连接子。用于此类融合蛋白的示例性主链连接子-a10m3-连接子序列描绘于图50中。可以使用的示例性连接子包含(ggggs)x连接子,其中x为1-10。在某些实施例中,使用(ggggs)5将细胞因子连接到abd。
在一些实施例中,细胞因子-abd是根据选自以下的式:(从n端到c端):细胞因子1-l1-abd-l2-细胞因子2;细胞因子1-l1-细胞因子2-l2-abd;和abd-l1-细胞因子1-l2-细胞因子2,其中l1和l2是连接细胞因子和abd组分的连接子,并且细胞因子1和细胞因子2选自下列细胞因子对:il-2和il-12;il-7和il-15;il-15和il-12;il-18和gm-csf;il-21和il-15;gm-csf和il-12;gm-csf和il-21;以及ifn-α和il-15。在一些实施例中,abd是a10m3(图2d)。
在此类细胞因子-abd中,细胞因子可以是“细胞因子1”,并且另一种细胞因子可以是“细胞因子2”。例如,在il-2和il-12细胞因子对的一个实施例中,il-2是“细胞因子1”,并且il-12是“细胞因子2”。在il-2和il-12细胞因子对的另一个实施例中,il-12是“细胞因子1”,并且il-2是“细胞因子2”。
在一些实施例中,细胞因子-abd包含两种相同的白细胞介素。在其它实施例中,白细胞介素-abd多肽包含两种不同的白细胞介素(例如,il-12和il-15),如以上所描述的。包含特定细胞因子组合的abd融合蛋白公开于图51中。下面进一步详细讨论包含不同细胞因子的组合的示例性细胞因子-abd融合蛋白。
a.il-12和il-15
在某些实施例中,细胞因子-abd融合蛋白包含il-12和il-15。可以包含在此类实施例中的示例性il-12和il-15序列描绘于图3和49c中。据信包含il-12和il-15融合配偶体两者的细胞因子-abd表现出两个白细胞介素的抗肿瘤作用。如单独与任一个细胞因子相比,il-12和il-15的组合示出诱导增强的抗肿瘤活性。通过ifn-γ的协同诱导,此类增强的抗肿瘤活性与每种细胞因子受体的相互上调相关。il-12与il-15的组合进一步示出通过一氧化氮的合成促进腹膜巨噬细胞的抗肿瘤活性。不受任何特定操作理论的束缚,据信具有il-12和il-15融合配偶体两者的多肽能够快速地活化先天反应(il-12)以及有效刺激t细胞的增殖,并且维持记忆cd8+t细胞(il-15)。动物研究示出,在既定肿瘤的治疗环境中,il-12和il-15表达细胞的顺序递送也治愈了小鼠。耗尽cd8+细胞消除了对此疗法的保护,表明肿瘤ctl的克隆扩增。参见,例如,croce等人,《临床癌症研究(clincancerres)》11(2pt1):735–742(2005)。
在一些实施例中,细胞因子-abd从n端到c端是根据式:
a)(il-12)-l1-(abd)-l2-(il-15);或
b)(il-15)-l1-(abd)-l2-(il-12)。
可以使用任何合适的abd,包含例如具有abd可变重链的abd,其包含图2中列出的abd可变重链中的任一个的vhcdr1-3。在示例性实施例中,可变重链包含a10m3可变重链的vhcdr1-3(图2d)。在某些实施例中,abd包含abd可变轻链,所述abd可变轻链包含a10m3可变轻链的vlcdr1-3。在示例性实施例中,abd是a10m3scfv。
可以使用任何合适的il-12和il-15。在一些实施例中,il-15是如本文所描述的变体il-15(参见,例如,图3)。il-15还可以是野生型il-15或连接到il-15rα的野生型il-15。在一个实施例中,il-15是选自图3中所描绘的那些变体的变体il-15。在示例性实施例中,il-15是具有氨基酸取代k86r和n112a的变体il-15。
可以使用的il-12包含具有p35和p40结构域的那些il-12。在一些实施例中,il-12是如本文所描述的单链il-12(参见,例如,图20,如示出为il-12-abd融合多肽和图49c的一部分)。
在此类实施例中,l1和l2分别是第一连接子和第二连接子,l1和l2可以是适合将il-15和il-12结构域连接到abd结构域的任何连接子(例如,图48中列出的连接子)。可以使用的示例性连接子包含(ggggs)x连接子,其中x为1-10。在某些实施例中,l1和l2各自为(ggggs)5。
包含il-12和il-15的示例性abd多肽的序列示出于图34和36中。
b.il-2和il-12
在某些实施例中,细胞因子-abd包含il-2和il-12。
il-2和il-12相互上调彼此的受体,并且使用各自的信号传导路径诱导不同但互补的生物学效应。il-2和il-12两者均可以刺激有丝分裂原或cd3活化的t细胞增殖,并且产生ifn-γ。此外,研究表明,将il-2和il-12基因两者递送到患有b16黑素瘤的小鼠中引起肿瘤负荷的显著降低和总体存活的增强(参见,例如,dietrich等人,《外科学文献(archsurg)》387(34):177–182(2002))。因此,据信具有il-2和il-两者的细胞因子-abd融合蛋白可用于减少肿瘤和治疗癌症。
c.il-2和il-15
在某些实施例中,细胞因子-abd融合蛋白包含il-2和il-15。il-2和il-15两者均能够刺激nk细胞和活化的t细胞的增殖,以及支持效应t细胞的扩增。据信包含il-2和il-15两者的细胞因子-abd融合蛋白可用于减少肿瘤和治疗癌症。
d.il-7和il-12
在某些实施例中,细胞因子-abd融合蛋白包含il-7和il-12融合配偶体。
白细胞介素-7(il-7)是在适应性免疫系统中起中心作用的非造血细胞衍生的细胞因子。它促进胸腺中淋巴细胞的发育,并且维持外周中的未成熟和记忆t细胞稳态的存活。此外,重要的是淋巴结(ln)的器官发生和维持募集到次级淋巴器官(slo)中的活化t细胞。癌症患者的免疫能力受到抑制,并且其特征在于较低的t细胞计数、较少的效应免疫细胞浸润、较高水平的耗尽效应细胞和较高水平的免疫抑制细胞因子,如转化生长因子β(tgf-β)。il-7是通过促进外周t细胞扩增免疫重建免疫抑制癌症患者的理想解决方案。在动物模型中,il-7已经被证明延长荷瘤宿主的存活。参见,gao等人,《国际分子科学杂志(int.j.mol.sci.)》16:10267-10280(2015)。
il-12直接作用于cd8+t细胞,以增强其il-7介导的增殖。据信包含il-7和il-12结合结构域的细胞因子-abd融合蛋白有利地促进cd8+t细胞的增殖,并且增强针对肿瘤的细胞溶解活性。
e.il-7和il-15
在某些实施例中,细胞因子-abd融合蛋白包含il-7和il-15。如以上所提及的,白细胞介素7和15被认为是具有减少肿瘤发生能力的强效促炎细胞因子。据信包含il-7和il-15两者的细胞因子-abd融合蛋白可用于减少肿瘤和治疗癌症。
f.il-12和il-21
在某些实施例中,细胞因子-abd包含il-12和il-21。
如以上所提及的,il-12能够刺激nk细胞和活化的t细胞的增殖,并且支持效应t细胞的扩增。il-21是nk细胞和t细胞功能的调节剂,其桥接先天性免疫系统和适应性免疫系统。il-21促进来自骨髓祖细胞的nk细胞的成熟、活化人外周nk细胞、促进nk扩增和成熟、并且增强cd8+t细胞介导的效应功能。
据信包含il-12和il-21两者的细胞因子-abd融合蛋白可用于减少肿瘤和治疗癌症。
g.il-12和il-18
在某些实施例中,细胞因子-abd包含il-12和il-18。
已知il-18诱导ifn-γ产生,促进th1细胞发育和nk活化。已知il-12以ifn-γ依赖性方式诱导il-18受体的上调。向小鼠施用共表达il-18和il-12的sck鼠乳腺癌细胞减少肿瘤负荷,并且抑制血管生成(参见,例如,coughlin等人,《(临床研究杂志(jclininvest)》101(6):1441–1452(1998))。用于荷瘤小鼠的il-18与il-12的组合协同诱导ifn-γ的延长的血清水平,而单独用il-18或il-12治疗的荷瘤小鼠诱导快速减弱的最低血清ifn-γ(参见,例如,subleski等人,《癌症研究(cancerres)》66(22):11005–11012(2006))。示例性il-18-abd示出在图37中。
据信包含il-12和il-18融合配偶体两者的细胞因子-abd融合蛋白可用于减少肿瘤和治疗癌症。
h.gm-csf和il-12
在某些实施例中,细胞因子-abd包含gm-csf和il-18。gm-csf调节造血祖细胞分化和增殖。gm-csf还增强了apc处理和呈递抗原的能力,进而引起细胞毒性t细胞的活化、ifn-γ产生增加、并且最终导致肿瘤消退。gm-csf和il-12两者都能够在包含肝肿瘤模型和肺肿瘤模型的若干不同的临床前肿瘤模型中引发显著的抗肿瘤反应。(参见,例如,kilinc等人,《免疫学期刊(jimmunol)》177(10):6962–6973(2006))。
据信包含gm-csf和il-12融合配偶体两者的细胞因子-abd融合蛋白可用于减少肿瘤和治疗癌症。
i.ifnα和il-12
这两种细胞因子的协同性质延伸超过仅类似的生物效应。例如,众所周知,诱导ifn-γ产生的il-12可以导致产生增强ifn-α信号传导的附加可溶性因子。已知包含干扰素α的干扰素在恶性细胞中诱导细胞凋亡。参见,例如,thyrell等人,《致癌基因(oncogene)》21,1251–1262(2002)。
据信包含ifnα和il-12两者的细胞因子-abd融合蛋白可用于减少肿瘤和治疗癌症。
可以包含在受试者细胞因子-abd融合蛋白中的附加细胞因子-细胞因子组合描绘于图51a中。
2.结合部分-abd融合蛋白
在一些实施例中,abd融合蛋白包含结合部分(例如,scfv)融合配偶体,即bm-abd融合蛋白。在一些实施例中,bm-abd包含一个结合部分。在某些实施例中,bm-abd包含两个结合部分(例如,scfv)。在其它实施例中,bm-abd包含细胞因子和结合部分(图1b)。图1描绘了若干示例性取向,其中结合部分或结合部分-细胞因子/结合部分-结合部分组合可以连接到abd。
可用于与受试者bm-abd结合部分一起实践的结合部分基于抗体可变重结构域和可变轻结构域。在一些实施例中,结合部分包含可变重结构域和可变轻结构域。在一些实施例中,结合部分是单链可变片段(scfv)。
任何abd都可以用于此类融合蛋白中,包含包含在图2中所示出的abd可变重结构域和可变轻结构域中的任一个的那些。在某些实施例中,abd包含a10m3的可变重结构域和可变轻结构域。在一些实施例中,abd是a10m3scfv。
可以使用任何连接子将细胞因子和/或结合部分连接到abd,包含图48中所描绘的任何连接子。在示例性实施例中,连接子是(ggggs)5。用于此类融合蛋白的示例性主链连接子-a10m3-连接子序列描绘于图48中。
两种结合部分(例如,scfv)或细胞因子和可以是此类abd融合蛋白的结合部分的示例性组合描绘于图51b中。
在一些实施例中,bm-abd包含抗tgfβ结合结构域(例如,抗tgfβscfv)。示例性抗tgfβscfv序列描绘于图45中。在一些实施例中,抗tgfβscfv包含4d9抗tgfβscfv的可变重结构域和可变轻结构域。在一些实施例中,abd融合蛋白包含抗tgfβscfv和细胞因子或附加的结合部分,其中细胞因子或附加的结合部分是第二抗tgfβscfv、il-15、il-12或抗pd-l1结合结构域(10d12)。参见图51b。
在一些实施例中,bm-abd包含抗pd-l1结合结构域(例如,抗tpd-l1scfv)。在一些实施例中,抗pd-l1scfv包含4d9抗pd-l110d12scfv的可变重结构域和可变轻结构域。在一些实施例中,abd融合蛋白包含抗pd-l1scfv和细胞因子或附加的结合部分,其中细胞因子或附加的结合部分是第二抗抗pd-l1scfv、il-15、il-12或抗tgfβ结合结构域(4d9)。参见图51b。
a.tgf-β结合部分
在某些实施例中,本文提供的bm-abd包含tgf-β结合部分。如本文所使用的,“tgf-β”、“tgfβ”、“tgfb”和“转化生长因子β”均指所涉及的细胞因子家族中的一员,其控制大多数细胞的增殖、细胞分化和其它功能,并且以至少三种同种型存在:tgfβ1(基因库登录号:nm_000660和np_000651(人);和nm_011577和np_035707(小鼠))、tgfβ2(基因库登录号nm_001135599和np_001129071(人))和nm_009367和np_33393(小鼠))、和tgfβ3(基因库登录号:nm_003239)。tgfβ家族成员具有细胞分泌所需的20-30个氨基酸组成的n端信号肽、前区和112-113个氨基酸c端区,所述氨基酸c端区通过溶蛋白性裂解从前区释放后成为成熟的tgfβ分子。在某些实施例中,成熟的tgfβ蛋白可以二聚化,以产生具有许多保守结构基序的25kda活性分子,包含九个半胱氨酸残基,其中八个在tgfβ分子内形成二硫键,以创建半胱氨酸结结构。第九个保守的半胱氨酸与另一个tgfβ的第九个半胱氨酸形成键,以产生二聚体。
不受任何特定操作理论的束缚,据信结合tgfβ的受试者bm-abd可以用于治疗患有癌症(例如,晚期癌症)的受试者。在某些实施例中,bm-abd包含tgfβ1结合部分。在某些实施例中,bm-abd包含tgfβ2结合部分。在某些实施例中,bm-abd包含tgfβ3结合部分。在一些实施例中,多价结合多肽包含可以结合tgfβ1、tgfβ2和/或tgfβ3或其任何组合的结合部分(例如,结合tgfβ1和tgfβ2;结合tgfβ2和tgfβ3;结合tgfβ1和tgfβ3;或结合tgfβ1、tgfβ2和tgfβ3)。在一些实施例中,tgfβ结合部分结合tgfβ1、tgfβ2和tgfβ3。在一些实施例中,tgfβ结合部分包含图40中tgfβ结合部分的可变重结构域和可变轻结构域。在一个实施例中,tgfβ结合部分包含tgfβ结合部分4d9的可变重结构域和可变轻结构域(图40b)。在特定实施例中,tgfβ结合部分是4d9scfv。4d9已经示出防止cd4+foxp3+调节性t细胞的扩增、防止smad活化(例如,smad2磷酸化)以及防止细胞上皮向间质转化和/或癌细胞迁移。
在一些实施例中,tgfβ结合部分-abd融合蛋白进一步连接到另一种结合部分或细胞因子。在某些实施例中,其它结合部分是pd-l1结合部分或另一种tgfβ结合部分。在一些实施例中,细胞因子是il-15或il-12(参见图51b)。
b.pd-l1结合部分
在某些实施例中,本文提供的bm-abd包含程序性细胞死亡1配体1(pd-l1)结合部分。如本文所使用的,“程序性细胞死亡1配体1”、“程序性死亡配体1”、“pdl1”和“pd-l1”(基因库登录号nm_001267706和np_001254635(人)和nm_021893和np_068693(小鼠))均指在活化的t细胞、b细胞和骨髓细胞上发现的与pd1受体具有结合的40kda类型1跨膜蛋白的成员,以调节活化或抑制。pd-l1上调允许癌症逃避免疫系统。参见,例如,hamanishi等人,《美国国家科学院院刊(procnatlacadsciusa)104(9):3360-5(2007)。因此,据信包含pd-l1结合部分的受试者bm-abd可用于治疗癌症。
在一个实施例中,pd-l1结合部分包含pd-l1结合部分10d12的可变重结构域和可变轻结构域(图50)。在特定实施例中,pd-l1结合部分是10d12scfv(图50)。10d12在低ph下与hpd-l1结合,并且与mpd-l1交叉反应。10d12不与hpd-l2或mpd-l2结合。进一步,10d12阻断pd-1/pd-l1相互作用,以及b71/pd-l1相互作用。
在一些实施例中,pd-l1结合部分-abd融合蛋白进一步连接到另一种结合部分或细胞因子。在某些实施例中,其它结合部分是tgfβ结合部分或另一种pd-l1结合部分。在一些实施例中,细胞因子是il-15或il-12(参见图51b)。
c.tnf和其它结合部分
在一个实施例中,本文提供的abd融合蛋白包含肿瘤坏死因子(tnf)结合部分。不受任何特定操作理论的束缚,据信此类abd融合蛋白可用作抗炎和/或癌症治疗剂。在一些实施例中,tnf结合部分是scfv。在特定实施例中,tnf结合部分-abd融合蛋白进一步连接到另一种融合配偶体,所述融合配偶体是结合部分或抑制剂肽。在某些实施例中,第二结合部分是第二tnf结合部分、il-1结合部分、il-6结合部分、il-8结合部分、il-17(同种型a-f)结合部分或il-23结合部分。
在另一个实施例中,abd融合蛋白包含选自il-1、il-6、il-8、il-17(a-f)和il-23结合部分的结合部分。
在一些实施例中,此类tnf和白细胞介素结合部分-abd可用于治疗疾病,如类风湿性关节炎、克罗恩病(crohn'sdisease)、银屑病性关节炎、强直性脊柱炎、溃疡性结肠炎、慢性斑块状银屑病和基于tnf的疾病。
f.诊断用途
另一方面,本文提供了用于成像和/或检测肿瘤的方法。在一些方面,所述方法包括使肿瘤细胞、肿瘤细胞培养物、肿瘤脉管系统细胞、肿瘤脉管系统细胞培养物、肿瘤组织和其它组织和细胞与经过标记的本发明的受试者abd融合蛋白接触。
abd融合蛋白还用于肿瘤或与本文的abd融合蛋白的抗原结合配偶体相关联的自身免疫疾病状态的体外或体内成像。在一些实施例中,本文所描述的融合蛋白用于诊断和治疗两者,或单独用于诊断。在一些实施例中,标记了受试者abd融合蛋白。
诊断可以在体内通过施用如下所描述的允许全身成像的诊断蛋白进行,或在体外在从患者取出的样品上进行。在此上下文中的“样品”包含任何数量的物质,包含但不限于体液(包含但不限于血液、尿液、血清、淋巴液、唾液、肛门和阴道分泌物、汗液和精液),以及组织样本,如来自相关组织的活组织检查的样品。
本文中“经过标记的”是指本文所公开的abd融合蛋白连接了一种或多种元素、同位素或化学化合物,以在筛选或诊断过程中进行检测。通常,标记分成几类:a)免疫标记,其可以是作为由抗体识别的融合配偶体并入的表位;b)同位素标记,其可以是放射性同位素或重同位素;c)小分子标记,其可以包含荧光染料和比色染料,或能够实现其它标记方法的如生物素等分子;以及d)如颗粒(包含用于超声标记的气泡)或允许身体成像的顺磁标记等标记。标记可以在任何位置处并入蛋白质中(例如,通过本文所描述的连接子中的一个或多个连接子),并且可以在蛋白质表达期间体外或体内并入,如本领域已知的。具体标记包含光学染料,包含但不限于发色团、磷光体和荧光团,后者在许多情况下是特异性的。荧光团可以是“小分子”荧光或蛋白质荧光。
“荧光标记”是指可以通过其固有荧光特性检测到的任何分子。合适的荧光标记包含但不限于荧光素、罗丹明、四甲基罗丹明、曙红、赤藓红、香豆素、甲基香豆素、芘、孔雀绿、茋、荧光黄、瀑布蓝j、德克萨斯红、iaedans、精氨酸谷氨酸(edans)、bodipyfl、lc红640、cy5、cy5.5、lc红705、俄勒冈绿、荧光基团染料(荧光基团350、荧光基团430、荧光基团488、荧光基团546、荧光基团568、荧光基团594、荧光基团633、荧光基团660、荧光基团680)、瀑布蓝、瀑布黄和r-藻红蛋白(pe)(俄勒冈州,尤金(eugene),分子探针公司(molecularprobes))、fitc、罗丹明和德克萨斯红(伊利诺伊州,罗克福德,皮尔斯公司(pierce))、cy5、cy5.5、cy7(pa.,匹兹堡,阿默舍姆生命科学公司(amershamlifescience))。合适的光学染料,包含荧光团,描述于richardp.haugland的《分子探针手册(molecularprobeshandbook》中,所述文献通过引用整体并入。
合适的蛋白质荧光标记还包含但不限于绿色荧光蛋白,包含gfp的海肾(renilla)、ptilosarcus或多管水母属(aequorea)物种(chalfie等人,《科学(science)》263:802-805(1994));egfp(克隆技术实验室公司(clontechlaboratories,inc.),基因库登录号u55762);蓝色荧光蛋白(bfp,昆腾生物技术有限公司(quantumbiotechnologies,inc.),1801demaisonneuveblvd.west,8层,蒙特利尔,魁北克,加拿大h3h1j9;stauber,1998,《生物技术(biotechniques)》24:462-471;heim等人,1996,《当代生物(curr.biol.)》6:178-182);增强的黄色荧光蛋白(eyfp,克隆技术实验室公司(clontechlaboratories,inc));荧光素酶(ichiki等人,《免疫学杂志(j.immunol)》150:5408-5417(1993));β半乳糖苷酶(nolan等人,《美国国家科学院院刊(proc.natl.acad.sci.u.s.a.)85:2603-2607(1998))以及光素酶(wo92/15673、wo95/07463、wo98/14605、wo98/26277、wo99/49019、美国专利号5,292,658、5,418,155、5,683,888、5,741,668、5,777,079、5,804,387、5874304、5876995、5925558)。本段中的所有上述参考文献都通过引用明确地并入本文。
g.白蛋白结合结构域和融合蛋白的产生
如本领域技术人员所理解的,标准方案用于制备受试者abd。用于抗体分子生物学、表达、纯化和筛选的一般方法描述于由kontermann和dubel编辑的《抗体工程(antibodyengineering)》,海德堡的施普林格出版社(springer,heidelberg),2001;和hayhurst和georgiou,《化学生物学新见(curropinchembio)》5:683-689(2001);maynard和georgiou,《生物医学工程年评(annurevbiomedeng)2:339-76(2000)。
在本文公开的一个实施例中,产生编码abd融合蛋白,并且然后如果需要,可以克隆到宿主细胞中进行表达和测定的核酸。因此,可以制备编码每种蛋白质序列的核酸,并且特别是dna。这些实践使用众所周知的程序进行。例如,可用于生成abd融合蛋白,类似于抗体的产生的各种方法公开于本文,描述于《分子克隆-实验室手册(molecularcloning-alaboratorymanual)》,第3版(maniatis,冷泉港实验室出版社(coldspringharborlaboratorypress),纽约,2001),以及《分子生物学的当前协议(currentprotocolsinmolecularbiology)》(约翰威立国际出版公司(johnwiley和sons)),所述两个文献通过引用整体并入。有可以用于有效地生成编码本文所公开的abd的dna的多种技术。此类方法包含但不限于基因组装方法、基于pcr的方法和使用pcr变体的方法、基于连接酶链反应的方法、如用于合成改组中的那些的汇集寡核苷酸方法、易错扩增方法和使用具有随机突变的寡核苷酸的方法、经典的定点诱变方法、盒式诱变和其它扩增和基因合成方法。如本领域已知的,存在多种用于基因组装、诱变、载体亚克隆等的商业上可获得的试剂盒和方法,并且此类商业产品可用于生成编码abd融合蛋白的核酸。
本文公开的abd可以通过以下产生:在诱导或引起蛋白质表达的适当条件下,培养用核酸,例如表达载体,含有编码abd融合蛋白的核酸转化的宿主细胞。适于表达的条件将随表达载体和宿主细胞的选择而变化,并且本领域技术人员通过常规实验可以容易地确定。可以使用多种合适的宿主细胞,包含但不限于哺乳动物细胞、细菌、昆虫细胞、酵母和植物细胞。例如,可用于生成本文公开的abd融合蛋白的多种细胞系描述于
在一个实施例中,abd在哺乳动物表达系统中表达,包含使用如逆转录病毒或腺病毒等病毒将表达构建体引入到哺乳动物细胞中的系统。可以使用任何哺乳动物细胞,例如人、小鼠、大鼠、仓鼠和灵长类动物细胞。合适的细胞还包含已知的研究细胞,包含但不限于jurkatt细胞、nih3t3、cho、bhk、cos、hek293、perc.6、hela、sp2/0、ns0细胞和其变体。在替代性实施例中,文库蛋白在细菌细胞中表达。细菌表达系统是本领域公知的,并且包含大肠杆菌(e.coli)、枯草芽孢杆菌、乳脂链球菌和浅青紫链球菌(streptococcuslividans)。在替代性实施例中,abd融合蛋白产生于昆虫细胞(例如,sf21/sf9、粉纹夜蛾(trichoplusiani)bti-tn5b1-4)或酵母细胞(例如,酿酒酵母、毕赤酵母等)中。在替代性实施例中,abd多肽使用无细胞转译系统在体外表达。衍生自原核(例如,大肠杆菌)和真核(例如,小麦胚芽、兔网织红细胞)细胞的体外转译系统是可获得的,并且可以基于感兴趣的蛋白质的表达水平和功能特性来选择。例如,如本领域技术人员所理解的,一些显示技术例如,核糖体显示需要体外转译。另外,abd融合蛋白可以通过化学合成方法产生。abd融合蛋白也可以通过动物(例如,牛、绵羊或山羊奶、含胚鸡蛋、整个昆虫幼虫等)和植物(例如,玉米、烟草、浮萍等)两者的转基因表达系统产生。
编码本文公开的abd融合蛋白的核酸可以并入到表达载体中,以表达蛋白质。多种表达载体可以用于蛋白质表达。表达载体可以包括自我复制的染色体外载体或整合到宿主基因组中的载体。构建表达载体,以与宿主细胞类型相容。因此,可用于生成本文所公开的抗体的表达载体包含但不限于能够在哺乳动物细胞、细菌、昆虫细胞、酵母和体外系统中进行蛋白质表达的那些细胞。如本领域已知的,可商购或以其它方式获得可以用于表达本文所公开的抗体的多种表达载体。
所公开的abd融合蛋白可以由多种核酸分子编码。例如,可变重链和轻链可以独立地引入到宿主细胞中。尽管存在于单独的核酸上,但它们的表达产生单一多肽。
表达载体通常包括与对照或调节序列、选择标志物、任何融合配偶体和/或附加元素可操作地连接的蛋白质。本文“可操作地连接”是指将核酸放置于与另一个核酸序列的功能关系中。通常,这些表达载体包含可操作地连接到编码多价abd融合蛋白的核酸的转录和转译调节核酸,并且通常适合用于表达蛋白质的宿主细胞。通常,转录和转译调节序列可以包含启动子序列、核糖体结合位点、转录起始和终止序列、转译起始和终止序列以及增强子或活化子序列。还如本领域所知,表达载体通常含有选择基因或标志物,以允许选择含有表达载体的转化宿主细胞。选择基因是本领域熟知的,并且随所用的宿主细胞而变化。
在一个实施例中,在表达之后纯化或分离abd。可以以本领域技术人员已知的多种方式分离或纯化abd和abd融合蛋白。如本文所描述的,纯化对于从同型二聚体重链物种中分离异二聚体重链物种特别有用。标准纯化方法包含使用如fplc和hplc等系统在大气压或高压下进行的色谱技术,所述色谱技术包含离子交换、疏水相互作用、亲和力、施胶或凝胶过滤以及反相。纯化方法还包含电泳、等电聚焦、免疫学、沉淀、透析和色谱聚焦技术。超滤和渗滤技术与蛋白浓缩相结合还是有用的。如果使用his-标签,则使用融合、ni+2亲和层析,或如果使用flag-标签,则使用固定的抗flag抗体。关于合适的纯化技术的一般指导,参见,例如,通过引用整体并入的《蛋白质纯化:原理与实践(proteinpurification:principlesandpractice)》,第3版,scopes,纽约施普林格出版公司(springerverlag,ny),1994,通过引用整体并入。所需的纯化程度将根据抗体的筛选或使用而变化。在一些情况下,不需要纯化。
h.白蛋白结合结构域和abd融合蛋白的治疗用途
受试者abd和abd融合蛋白可用于如本文所述的各种治疗用途中。
一方面,本文提供了通过向受试者施用本文所描述的白蛋白结合结构域(abd)融合蛋白来抑制有需要的受试者的肿瘤生长的方法。有用的abd融合蛋白包含但不限于图4、20、34、36、40、45、50-51中公开的那些。
在一些实施例中,abd融合蛋白包含il-12或il-15(例如,il-12-abd或il-15-abd融合蛋白)。如本文所描述的,il-15abd融合蛋白能够以剂量依赖性方式抑制肿瘤生长。此类il-15介导的肿瘤生长抑制伴随着肿瘤浸润淋巴细胞的增加,包含细胞毒性t淋巴细胞(ctl)和活化的自然杀伤(nk)细胞。在某些实施例中,abd融合蛋白包含il-12分子。在一些实施例中,abd融合蛋白包含il-15。在又其它实施例中,细胞因子-abd包含il-12和il-15。在一些实施例中,il-15-abd包含如本文所描述的变体il-15(参见,例如,图3)。
本文还提供了通过向受试者施用白蛋白结合结构域(abd)融合蛋白来治疗患有癌症的受试者的方法。在一些实施例中,abd融合蛋白包含il-12或il-15(例如,il-12-abd或il-15-abd融合蛋白)。il-12和il-15是用于肿瘤微环境的免疫调节的细胞因子,因为它具有增殖和延长cd8+t细胞存活率的能力。其它有用的abd融合蛋白包含但不限于图4、20、34、36、40、45、50-51中公开的那些。
本文中待治疗的癌症的实例包含但不限于癌、胚细胞瘤、肉瘤、某些白血病或淋巴恶性肿瘤。此类癌症的更多特定实例包含鳞状细胞癌(例如,上皮鳞状细胞癌);肺癌,包含小细胞肺癌、非小细胞肺癌、肺腺癌和肺鳞状细胞癌;腹膜癌;肝细胞癌;胃(gastric)癌或胃(stomach)癌,包含胃肠癌;胰腺癌;胶质母细胞瘤;宫颈癌;卵巢癌;肝癌(livercancer);膀胱癌;肝癌(hepatoma);乳腺癌;结肠癌;直肠癌;结直肠癌;子宫内膜癌或子宫癌;唾液腺癌;肾或肾癌;前列腺癌;外阴癌;甲状腺癌;肝肿瘤;肛门癌;阴茎癌;皮肤癌/黑素瘤;以及与任何原发性肿瘤相关的头颈癌和肌肉痉挛。
另一方面,本文提供了增加cd8+t细胞的增殖和/或存活率的方法。在某些实施例中,所述方法包括使细胞与白蛋白结合结构域融合蛋白接触,所述白蛋白结合结构域融合蛋白包含il-12和/或il-15(例如,il-12-abd或il-15-abd融合蛋白)。在某些实施例中,abd融合蛋白包含il-12分子。在一些实施例中,abd融合蛋白包含il-15分子。在又其它实施例中,融合蛋白abd融合蛋白包含il-12和il-15。
i.药物调配物、施用和剂量
另一方面,本文提供了治疗组合物,所述治疗组合物包括任何受试者白蛋白结合结构域(abd)多肽和载剂。用于实施前述方法的受试者治疗组合物可以被调配成包括适于所需递送方法的载剂的药物组合物。合适的载剂包含当与治疗组合物组合时保留治疗组合物的抗肿瘤功能,并且通常不与患者的免疫系统反应的任何材料。实例包含但不限于许多标准药物载剂中的任一种,如无菌磷酸盐缓冲盐水溶液、抑菌水等(总体上参见《雷明顿氏药物科学(remington'spharmaceuticalsciences)》第16版,a.osal.编辑,1980)。
1.用于体内施用的组合物
通过将具有期望纯度的abd融合蛋白与任选的药学上可接受的载剂、赋形剂或稳定剂(《雷明顿氏药物科学(remington'spharmaceuticalsciences)》第16版,osol,a.编辑,[1980])进行混合来制备根据本发明使用的白蛋白结合结构域(abd)融合蛋白的调配物,以供以冻干调配物或水溶液的形式储存。可接受的载剂、赋形剂或稳定剂在所用剂量和浓度下对接受者无毒,并且包含缓冲剂,如磷酸盐、柠檬酸盐和其它有机酸;抗氧化剂,包含抗坏血酸和甲硫氨酸;防腐剂(如十八烷基二甲基苄基氯化铵;六甲氯铵;苯扎氯铵、苄索氯铵;苯酚、丁醇或苯甲醇;对羟基苯甲酸烷基酯如对羟基苯甲酸甲酯或对羟基苯甲酸丙酯;儿茶酚;间苯二酚;环己醇;3-戊醇;以及间甲酚);低分子量(少于约10个残基)的融合蛋白;蛋白质,如血清白蛋白、明胶或免疫球蛋白;亲水性聚合物,如聚乙烯吡咯烷酮;氨基酸,如甘氨酸、谷氨酰胺、天冬酰胺、组氨酸、精氨酸或赖氨酸;单糖、二糖和其它碳水化合物,包含葡萄糖、甘露糖或糊精;螯合剂,如edta或dpta;糖,如蔗糖、甘露醇、海藻糖或山梨醇;成盐反离子,如钠;金属复合物(例如,zn-蛋白复合物);和/或非离子表面活性剂,如各种分子量的tweentm、pluronicstm或聚乙二醇(peg)。
本文的调配物还可以含有一种以上的活性化合物,优选地具有彼此不会不利影响的互补活性的那些,这对于所治疗的特定适应症是必要的。例如,可能需要提供具有其它特异性的abd融合蛋白。替代性地,或另外,组合物可以包括细胞毒剂、细胞因子、生长抑制剂和/或小分子拮抗剂。此类分子以对预期目的有效的量适当地组合在一起存在。
活性成分还可以例如通过凝聚法技术或通过界面聚合反应包入制备的微胶囊中,所述微胶囊例如:分别在胶体药物递送系统(例如脂质体、白蛋白微球、微乳液、纳米颗粒以及纳米胶囊)或在粗乳液中的羟甲基纤维素或明胶-微胶囊以及聚-(甲基丙烯酸甲酯)微胶囊。此类技术公开于《雷明顿氏药物科学(remington'spharmaceuticalsciences)》第16版,osol,a.编辑,(1980)中。
用于体内施用的调配物应该是无菌的,或几乎是无菌的。这通过无菌过滤膜过滤而容易地完成。
可以制备缓释制剂。缓释制剂的适合的实例包含含有抗体的固体疏水性聚合物的半渗透基质,所述基质呈成型的物品例如薄膜或微胶囊的形式。缓释基质的实例包含聚酯、水凝胶(例如,聚(2-羟乙基-甲基丙烯酸酯)或聚(乙烯醇))、聚交酯(美国专利第3,773,919号)、l-谷氨酸和γ-乙基-l-谷氨酸的共聚物、不可降解的乙烯-乙酸乙烯酯、可降解的乳酸-乙醇酸共聚物,如luprondepottm(由乳酸-乙醇酸共聚物和醋酸亮丙瑞林组成的可注射微球)和聚-d-(-)-3-羟基丁酸。虽然如乙烯-乙酸乙烯酯和乳酸-乙醇酸等聚合物能够释放分子超过100天,但某些水凝胶释放蛋白质的时间较短。
当胶囊化的白蛋白结合结构域融合蛋白长时间保留在体内时,由于暴露在37℃的湿气中,它们可能变性或聚集,导致生物活性的丧失和免疫原性的可能变化。根据所涉及的机制,可以设计合理的策略以实现稳定化。例如,如果发现聚集机制是通过硫代-二硫化物交换形成分子间s-s键,则可以通过改变巯基残基,从酸性溶液中冻干,控制水分含量,使用适当的添加剂以及开发具体聚合物基质组合物来实现稳定化。
2.施用方式
根据已知方法,如作为大药丸静脉内施用、或通过一段时间的连续输注、通过肌肉内、腹膜内、脑脊髓内、皮下、关节内、滑膜内、鞘内、口服、局部或吸入途径,向受试者施用受试者白蛋白结合结构域融合蛋白和治疗剂。优选静脉内或皮下施用抗体。
3.治疗方式
在本文提供的方法中,用疗法来提供对疾病或病症的阳性治疗应答。“阳性治疗应答”旨在改善疾病或病症和/或改善与疾病或病症相关联的症状。例如,阳性治疗应答将指对疾病的以下改善中的一种或多种:(1)减少肿瘤细胞的数量;(2)增加肿瘤细胞死亡;(3)抑制肿瘤细胞存活;(5)抑制(即减慢到某种程度,优选地停止)肿瘤生长;(6)增加患者存活率;以及(7)与疾病或病症相关联的一个或多个症状的一些缓解。
可以通过对所述疾病或病症具有特异性的标准化应答标准来确定任何给定疾病或病症的阳性治疗应答。可以使用筛选技术,如磁共振成像(mri)扫描、x-射线照相术、计算机断层摄影术(ct)扫描、骨扫描成像、内窥镜检查和肿瘤活检取样,包含骨髓吸出(bma)和对循环中的肿瘤细胞计数来估计针对肿瘤形态(即总体肿瘤负荷、肿瘤大小等)改变的肿瘤应答。
除了这些阳性治疗应答之外,正经受疗法的受试者可能经历与疾病相关联的症状的改善的有益效果。
因此,对于b细胞肿瘤,例如,受试者可能经历所谓的b症状的减少,即盗汗、发烧、体重减轻和/或荨麻疹。对于恶化前病症,用多价治疗剂治疗可以阻断和/或延长相关恶性病症发展之前的时间,例如,患有意义未明的单克隆丙种球蛋白病(mgus)的受试者中多发性骨髓瘤的发展。
疾病的改善可以表征为完全应答。“完全应答”意指不存在临床上可检测的疾病,在骨髓瘤的情况下,任何先前异常的放射学研究、骨髓和脑脊髓液(csf)或异常单克隆蛋白的正常化。
根据受试者方法进行治疗后,此类应答可以持续至少4周到8周、或有时6周到8周。替代性地,疾病的改善可以归类为部分应答。“部分应答”意指在没有新损伤的情况下,所有可测量的肿瘤负荷(即,受试者中存在的恶性细胞的数量、或测量的肿瘤块的体积或异常单克隆蛋白的数量)减少至少约50%,这可以持续4周到8周,或6周到8周。
治疗包含所使用药物的“治疗有效量”。“治疗有效量”是指以剂量计,并且持续所需的时间段,以实现所希望的治疗结果的有效的量。
治疗有效量可以根据因素而变化,如个体的疾病状态、年龄、性别和体重以及药物在个体中引发希望的应答的能力。治疗有效量也指抗体或抗体部分的治疗有益效果超过其任何毒性或有害效果的量。
肿瘤疗法的“治疗有效量”还可以通过其稳定疾病的进展的能力测量。可以在预示人类肿瘤的功效的动物模型系统中评估化合物抑制癌症的能力。
替代性地,通过熟练的从业者已知的体外测定,组合物的这种特性可以通过检验化合物抑制肿瘤生长或诱导凋亡的能力来评估。治疗有效量的治疗化合物能减小肿瘤大小,或以其它方式减轻受试者的症状。本领域的普通技术人员将能够基于如受试者的大小、受试者症状的严重程度和特定的组合物或所选择的施用途径等此类因素确定此类量。
实例
实例1:人血清白蛋白结合结构域的筛选和识别
进行固相淘选和溶液淘选方法,以识别噬菌体scfv白蛋白结合结构域(abd)。随后使用标准elisa技术,筛选从人血清白蛋白结合结构域的初级筛选中选择的白蛋白结合结构域与小鼠血清白蛋白的交叉反应性。对使用筛选方法获得的初级白蛋白结合结构域候选物进行测序,并且随后测定靶浓度依赖性结合、ph稳定性、fcrn结合干扰和动力学结合。具体地,选择候选物abd,因为它们能够在低ph(ph5.5)和中性ph(ph7.7)下结合人血清白蛋白(kd~20-60nm)、小鼠血清白蛋白(kd~10-30nm)和cyno血清白蛋白(kd~20-60nm)。对候选物abd进行测定,以确保它们不会与结合血清白蛋白的fcrn竞争。如本文所解释的,在此类ph下结合并且不与fcrn结合竞争的abd能够经历fcrn介导的内体再循环。因此,包含此类abd的生物制剂(例如,细胞因子和基于抗体的生物制剂)还能够经历此类fcrn介导的再循环,并且因此与不包含此类abd的对应物相比,表现出更长的半衰期。
基于以下这些标准选择五个白蛋白结合克隆:a9、a10、a6、2b4、2h10。在这五个克隆中,基于高表达水平和最佳活性谱,选择a10。然后,使a10突变,以消除可能推定导致免疫原性的区域。从这些a10变体中,基于其对血清白蛋白的高亲和力,选择a10m3作为先导。
示例性人血清白蛋白结合结构域的序列示出在图2中,包含a10m3(图2d)。
实例2:变体il-15和il-15-abd
hek293t细胞对il15-a10m3蛋白的表达极差,这不能通过转录来解释
在三个独立地转染的细胞培养物中的hek293细胞中产生il-15-abd(il-15-a10m3)构建体,并且使用抗his标签抗体(图5a,左)或通过结合小鼠血清白蛋白的功能性elisa(图5a,右)通过蛋白免疫印迹进行评估。如图5a所示出的,il-15-a10m3的表达不能通过这些方法中的任一种来评估。为了评估hek293细胞中il-15-a10m3表达的缺乏是否是由于低转录水平,从四个独立il-15-a10m3转染的细胞制备mrna,并且进行rt-pcr以定量与其管家基因gapdh(图5b、泳道6)相比的il15-a10m3mrna的mrna水平(图5b,泳道2-5)。如图5b所示出的,相对于所述对照gapdh,在转染细胞中检测到显著量的il15-a10m3mrna,这表明在hek293细胞中产生的il15-a10m3的低表达水平不是由于转录,而是很可能与转译或转译后过程相关联。
识别il15中与il15受体α结合位点相邻的推定的泛素化位点
研究已经表明,il15蛋白在细胞中表达,但非常不稳定,半衰期短。il15rα与il15在同一细胞中的共表达极大地增加了il15rα以及il15的细胞表面量。进一步的研究证实il15α作为il15的伴侣,并且在细胞内结合il15,以在分泌之前保护和稳定il15。这些发现表明,转译可能无法解释il15的低生产率。而是,转译后修饰(ptm)可能在il15细胞内不稳定性方面起作用,并且il-15的细胞内不稳定性可以通过il15r阻断特异性α但未知的转译后修饰来克服。泛素化是允许细胞标记细胞内蛋白质降解的记录良好的机制。
鉴于il15是非常有效的表达受细胞严格控制的促炎细胞因子,细胞有可能利用泛素化来主动控制il15蛋白水平。识别了il-15上潜在的泛素化位点,所述泛素化位点在与il-15rα结合时被推定保护(图6)。具体地,氨基酸k86是位于il-15/il-15rα结合位点旁边的推定的泛素化位点(图6a),这表明il15rα与il15的结合阻断il15蛋白上泛素连接酶(例如,e3)与k86的可及性的可能性。使用ubpred,一种在线泛素化位点数据库(www.ubpred.org)图6b进一步将k86确认为泛素化位点。
il15上k86的突变通过hek293t细胞恢复il15-a10m3蛋白的表达
为了评估k86处的泛素化是否影响il-15的细胞内稳定性,制备了在k86处,包含k86a和k86r含有氨基酸取代的il-15变体。这些il-15变体中的若干种的序列示出于图3中。不受任何特定操作理论的束缚,据信在这些特定的泛素化位点处的氨基酸取代导致泛素化抗性il-15,其表现出比野生型il-15增加的稳定性。将此类il-15变体连接到abd(a10m3)以进一步延长半衰期(图4)。图7提供了此类il-15-abd融合蛋白的示意图,其包含具有il-15rα/il15“sushi结构域”(a)的il-15-abd和在泛素化位点k86(b)处包含具有氨基酸取代的il-15变体的il-15-abd融合蛋白。
对hek293细胞产生的il-15-abdk86r和k86a变体和il-15rα/il15-abd结合小鼠血清白蛋白(msa)和il-15rα的能力进行评估。如图8a所示出的,如与hek-293产生的野生型il-15-abd(12个克隆)相比,hek293产生的il-15-abdk86r和k86a变体(12个克隆)和il-15rα/il15-abd(12个克隆)表现出更高的表达。此类构建体还能够结合msa。此外,如图8b所示出的,k86r(克隆r6,绿色星)和k86a(克隆a3,黄色星)取代不干扰变体结合il-15rα的能力。有趣的是,il15rα-融合il15-a10m3未能显示出与il15rα的任何结合,这表明内部il15rαsushi结构域分子内地结合il15,并且从而阻断结合涂布在板上的外部il15rα。这与我们和其它人的发现一致,即il15与il15rαsushi结构域的结合增加了il15表达(图7b)。
对含有氨基酸取代k86r(il-15k86r-a10m3)的一种特定变体hek293细胞产生的il-15-abd进行了规模化生产,并且对il-15k86r-a10m3构建体进行体外血清白蛋白结合评价。如图9所示出的,具有k86突变(il-15k86r-a10m3)的il-15-abd和il-15rα/il15-abd(il-15rα/il15-a10m3)能够在hek293细胞中以放大的数量产生,如通过sds-page(图9c,左)和用抗his标签抗体(右)的蛋白免疫印迹所证实的。进一步,如图10所示出的,k86r-a10m3表现出与小鼠血清白蛋白(msa)的结合。
由hek293t细胞产生的il15k86r-a10m3的生物活性受损,其可以通过去糖基化来挽救。
使用ctll2增殖测定法,测试各种il-15-abd的生物活性。经过测试的il-15-abd包含野生型il-15-a10m3和在hek293t细胞中产生的三种不同的il-15k86r-a10m3。使用市售的il-15和内部生产的il-15-abd作为对照,两者均使用大肠杆菌制成。如图11所示出的,与大肠杆菌中产生的对照相比,包含商业野生型il-15(r&d)和内部生产的il-15-a10m3,由hek293t产生的il-15k86r-a10m3显示出显著降低的促进ctll2增殖的能力。鉴于来自hek293t的il15k86r-a10m3与来自大肠杆菌的il15-a10m3之间在ctll2增殖测定中的差异,假设由于大肠杆菌产生的il15-a10m3不像在哺乳动物细胞中那样经历经典的n-糖基化,所以hek293t细胞中il15k86r-a10m3的糖基化可能干扰il15k86r-a10m3与其受体的相互作用。
为了评估hek细胞产生的il-15k86r-a10m3的降低的生物活性是否是由于糖基化,使用png酶使il-15k86r-a10m3去糖基化,并且进行ctll2增殖测定,以评估去糖基化的il15k86r-a10m3的生物活性。在天然条件下对il-15k86r-a10m3进行png酶混合处理之后,聚糖被完全去除,并且通过sds-page可视化,随后进行聚糖染色(图12a,左)和考马斯蓝染色(图12a,右)。1)il-15r-a10m3+5ulpng酶混合物;2)蛋白质+10ulpng酶混合物;3)无酶对照。如图12b所示,与未处理的样品(紫色、黄色)相比,il-15k86r-a10m3(蓝色)的去糖基化几乎完全拯救了ctll2增殖测定中的活性。来自r&d系统的wtil-15(红色)和内部大肠杆菌产生的il-15-a10m3(黑色)用作阳性对照。
il-15k86r-a10m3的n112对其促进ctll2增殖的生物活性是至关重要的
il-15k86r-a10m3的氨基酸位置n112是il-15生物活性的关键位点,特别是在il-15-abd的上下文中,因为它对于在il-15与il15受体γ之间正确建立相互作用至关重要。变体il-15k86r在n112a处进一步突变,以确定此位点处的突变是否可以恢复il-15生物活性,类似于去糖基化的il-15。具体地,使il15k86r-a10m3突变,以进一步包含n112q、n112a或n112sil-15氨基酸取代,并且进行cttll2增殖测定,以测试生物活性。如图13a中所示出的,将氨基酸取代n112a引入到将其生物活性恢复到与ctll2增殖测定中去糖基化的il-15k86r-a10m3(绿色)的生物活性相当的il-15k86r-a10m3(蓝色)中,而n112q突变(红色)相对于亲本il-15r-a10m3,对生物活性无影响,无需进行去糖基化(黄色)。来自r&d系统的wtil-15(黑色)用作阳性对照。
测试在n112处具有不同侧链的突变,以进一步证明大小对生物活性的影响。如图13b所示出的,n112q(大,红色)、n112s(中,绿色)和n112a(小,蓝色)显示出与侧链的大小成反比的增加的生物活性。此外,由il-15的n112和il15受体γ的y103所建立的所建议的氢键对这种活性似乎并不重要,因为n112a不能形成此类键。来自r&d系统的wtil-15(黑色)和内部大肠杆菌产生的il-15-a10m3(紫色)用作阳性对照;未去糖基化的亲本il15k86r-a10m3(黄色)用作阴性对照。
实例3:变体il-15和il-15-abd的体内活性
使用b16-f10小鼠黑素瘤模型评估il-15和il-15-abd抑制肿瘤生长的能力。如图14中所总结的,在间隔48小时的四个不同时间点,通过iv注射用il-15、pbs安慰剂或各种剂量的il-15-abd治疗小鼠。如图16所示出的,il-15-abd以剂量依赖性方式抑制肿瘤生长。
进行facs分析,以进一步评估来自这些研究的经过il-15-abd治疗的小鼠中肿瘤浸润淋巴细胞群的概况。如图16所示出的,il-15-abd治疗的小鼠中的肿瘤表现出nk细胞群的增加。如以上所描述的,此数据与il-15-abd治疗的小鼠中增加的肿瘤蓄积和滞留的观察结果相结合,表明abd增强了il-15在肿瘤内的促炎作用。il-15-abd治疗对脾脏和肿瘤中淋巴细胞群的影响总结于图17和18中。如图17和18所示出的,淋巴细胞群的facs分析显示il-15abd治疗的小鼠的肿瘤中肿瘤浸润的ctl和nk细胞群增加3-6倍。在脾脏中没有观察到显著差异。总之,这些研究的结果显示了体内il-15-abd的肿瘤免疫调节能力。
为了评估abd融合蛋白增加il-15的半衰期的能力,c57b小鼠单独静脉注射5μg的il-15-abd或il-15,并且随后评估il-15-abd和il-15的血清浓度。如图20a所示出的,如与il-15wt相比,il-15-abd表现出更大的pk。il-15t1/2β=0.6小时,类似于公共域中报道的那些(~0.5小时)。研究结果显示abd将il-15t1/2β延长到~7.0小时,这是~10倍的增加。在人血清中还使用基于细胞的测定法,测定il-15-abd的稳定性。如图19b所示出的,与没有abd的商业il-15对照相比,il-15-abd在人血清中更稳定。
实例4:il-12-abd
在hek293t细胞中制备小鼠il-12单链-abd构建体,并且通过尺寸排阻色谱法纯化。由hek293t细胞产生的il-12-a10m3在体外测定和基于细胞的测定两者中都是完全活性的。如图21a所示出的,il12-a10m3能够结合小鼠血清白蛋白,平衡解离常数(kd)为2.1nm。由hek293t产生的il12-a10m3还能够刺激人pbmc增殖,与内部产生的小鼠il12和商业上可获得的小鼠il-12(r&d)相当(图21b)。此外,由hek293t产生的il12-a10m3刺激来自人pbmc的干扰素γ的分泌,与内部产生的小鼠il-12和商业上可获得的小鼠il-12(r&d)相当(图22)。
用il-12-abd治疗减少体内肿瘤体积。
使用b16-f10小鼠黑素瘤模型评估il-12和il-12-abd抑制肿瘤生长的能力。如图23中所总结的,在肿瘤接种(第0天)之后第7天,当肿瘤体积达到100mm3时,通过iv注射用三种类似剂量的il-12-abd或il-12治疗小鼠。治疗后每2天监测肿瘤生长,持续10天。pbs安慰剂充当对照。如图24-26和28所示出的,il-12和il-12-abd两者均能够以剂量依赖性方式减少肿瘤生长。此外,单独与类似浓度下的il-12相比,il-12-abd能够更有效地减小肿瘤体积(参见,例如,10天处的图26和50%肿瘤达到2000mm3的中值天数的图28)。来自这些研究的小鼠的纵向体重测量结果显示跨所有il-12-abd治疗组的体重的最小变化(图27)。没有观察到显著的质量变化,表明治疗组在治疗过程后12天内缺乏il-12-abd毒性。
5天之后对单剂量il-12-abd(4.5μgil-12-abd,与3μgil-12对照相同的摩尔剂量)在b16-f10荷瘤小鼠中药效作用的进一步表征表明,与类似摩尔剂量的il-12对照相比,il-12-abd表现出类似的更大的肿瘤生长抑制。与对照相比,如脾脏重量和ifn-γ的增加所示出的,il-12-abd治疗的小鼠还表现出对应的免疫活化增加,而对小鼠体重没有影响(图29)。
图30进一步示出了比较在10天内用il-12-abd(1.3μg)、il-12(30μg)或安慰剂注射的b16-f10荷瘤小鼠的肿瘤体积的研究结果。虽然il-12(1μg)和il-12-abd(1.3μg)是摩尔当量,并且在体外具有相同的生物活性,但是il-12-abd在体内的效力比il-12高~30+倍(图30中第10天的比较结果,1.3μgil-12-abd>30μgil-12)。图31进一步描绘了il-12-abd和il-12在来自图30中所描绘的研究的小鼠中在第3天和第7天的造血作用。如图31所示出的,如与il-12治疗的小鼠和安慰剂对照相比,用il-12-abd治疗的小鼠在第3天表现出wbc、嗜中性粒细胞和淋巴细胞的短暂降低。然而,此类细胞群在第7天恢复正常。进一步,如与用il-12治疗的小鼠和对照相比,用il-12-abd治疗的小鼠中的ifn-γ水平在第3天和第7天更高。
在体内评估il-12-abd或il-12与抗pd-1抗体的组合的抗肿瘤作用。
在8天时,在b16-f10荷瘤小鼠中评估使用il-12-abd或具有抗pd-1抗体的il-12单剂量组合疗法的效果(图32)。
在接种b16-f10肿瘤细胞(2x104个细胞/小鼠)之后10天,将动物(7-10周龄)分成8组(每组8只动物)。基于肿瘤体积分配动物。在分配时,每组的平均肿瘤体积为100mm3)。在第0天(当肿瘤达到100mm3时),给予每组iv单剂量的pbs(安慰剂)、il12-abd(1.5ug、5ug、15ug)或il15-abd-il12(1.7ug、6ug、17ug)。
检查组的体重、肿瘤体积和假存活率。在肿瘤接种之前和肿瘤测量时测量体重。使用卡尺在两维中每2天测量肿瘤大小,并且使用下式以mm3表达体积:v=0.5xaxb2,其中a和b是肿瘤的长径和短径。研究以伪生存方式进行;当小鼠肿瘤达到2000mm3或确定为垂死时,对每只小鼠实施安乐死。
如图33所示出的,il-12-abd比用抗pd-1或摩尔当量剂量的重组il-12治疗更有效。此外,il-12-abd与重组il-12和抗pd-1治疗的组合一样有效。有趣的是,向重组il-12中添加抗pd-1ab提高了单独治疗的疗效,而抗pd-1治疗对il-12-abd没有进一步的益处。
为了评估abd融合蛋白增加il-12的半衰期的能力,c57b小鼠单独静脉注射5μg的il-12-abd或il-12,并且评估il-12-abd和il-12的血清浓度。如图33所示出的,il-12-abd表现出比il-12wt更高的pk。il-12t1/2β=2.5小时,类似于公共域中报道的那些(~3.5小时)。研究结果显示abd将il-12t1/2β延长到9.5小时,增加~4x倍。
实例5:双特异性il-15-abd-il-12
在hek293t细胞中制备il-15-abd-il-12、hil15(k86r/n112a)-a10m3-mil-12sc和mil-12sc-a10m3-hil15(k86r/n112a)构建体,并且通过尺寸排阻色谱法纯化。这些构建体的序列描绘于图34中。通过elisa评估了hil15(k86r/n112a)-a10m3-mil-12sc和mil-12sc-a10m3-hil15(k86r/n112a)构建体结合msa、il12受体β2和il15受体α的能力。如图35所示出的,两种il-15-abd-il-12构建体都能够在细胞培养基中以剂量依赖性方式结合msa。进一步,两种双特异性构建体都能够在细胞培养基中以剂量依赖性方式结合il12受体β2和il15受体α。如图35所示出的,如与il-12-abd-il-15相比,n端到c端具有取向il-15-abd-il-12的il-12/il-15-abd表现出更好的抗原结合。包含il-15和il-12的其它双特异性制剂公开于图36中。
评估il-15-abd-il-12的il-12和il-15活性
进一步评估il-15-abd-il-12的il-12和il-15活性(图37和38)。
为了评估il-12活性,通过用pha-p治疗四天,并且在第三天用rhil-2治疗来触发来自pbmc的淋巴细胞,以进行爆炸形成。基于淋巴母细胞增殖和ifn-γ分泌,然后用il-15-abd-il-12或il-12对照治疗淋巴母细胞,持续两天,并且评估il-12活性(图37a)。使用ctll-2细胞毒性t淋巴细胞增殖测定评估il-15活性(图38a)。
如图37所示出的,il-15-abd-il-12表现出il-12活性,如通过淋巴母细胞增殖(图37b)和ifn-γ分泌(图37c)所评估的。此外,il-15-abd-il-12在ctll-2增殖测定中表现出il-15(图38b)。因此,标的il-15-abd-il-12表现出il-12和il-15生物活性两者。
il-15-abd-il-12在b16-f10小鼠黑素瘤模型中的抗肿瘤作用
不受任何特定操作理论的束缚,据信il-15/il-12abd提供协同生物活性。具体地,il-12增加il-15α受体ifn-γ。nk/t细胞和th1免疫,同时下调treg细胞。il-15增加il-12β1受体和nk细胞,同时减少cd8细胞记忆丧失。
使用b16-f10小鼠黑素瘤模型评估il-12-abd对il15-abd-il12的抗肿瘤作用和假存活率(图39)。
在接种b16-f10肿瘤细胞(2x-104个细胞/小鼠)之后10天,将动物(7-10周龄)分成8组(每组8只动物)。基于肿瘤体积分配动物。在分配时,每组的平均肿瘤体积为100mm3)。在第0天(当肿瘤达到100mm3时),给予每组i.v.单剂量的pbs(安慰剂)、或摩尔剂量当量的il12-abd(1.5ug、5ug、15ug)或il15-abd-il12(1.7ug、6ug、17ug)。
如图39所示出的,如与相等摩尔浓度下的b16-f10小鼠模型中的il-12-abd相比,il-15-abd-il-12在抗肿瘤活性方面优越。其它类似的体内研究表明游离il-12(5ug)与i-15(1ug)组合的效力小于il-15-abd-il-12(6ug)的50%(数据未示出)。
实例6:抗tgfβ-abd
在使用表面等离子共振技术进行生物淘选和筛选之后,识别出抗htgfβ1结合结构域:1a10、1f11、2h6、4b9、4c10、4d9、4g3、4g6、4h4、4h7和6h11。这些克隆显示出对htgfβ2、3和mtgfβ1的交叉反应性,并且可能抑制htgfβ1与其受体ii的结合。随后选择克隆作为scfv进行纯化,并且进一步表征。
使用标准elisa技术,筛选scfv与小鼠和人tgfβ-1的交叉反应性。结合elisa示出,2h6、4g3、4h7、4b9、4d9和6h11对mtgfβ-1和htgfβ-1两者均具有良好的交叉反应性。
执行结合和阻断elisa,以确定抗tgfβ-1scfv是否能够结合tgfβ-1,并且阻断其与tgfβr-ii的相互作用。2h6、4g3、4h7、4b9和4d9均显示出良好的阻断功效和对mtgfβ和mtgfβr-ii相互作用的抑制。
对这些抗tgfβ-1scfv中的几个进行了干扰tgfβ-1生物活性的能力的测试。抗tgfβ-1scfv4h7和4d9的序列示出在图40a和b中。
阻断tgfβ1诱导的cd4+foxp3+调节性t细胞的扩增
调节性t细胞(treg)能够影响免疫系统的稳态。此类treg对于维持自身耐受性至关重要,因为缺陷可能导致严重的自身免疫疾病。在癌症中,肿瘤细胞能够分泌影响免疫系统稳态的细胞因子。具体地,肿瘤细胞可以分泌tgfβ,然后其可以影响循环treg的数量。先前已经证明暴露于tgfβ1导致来自cd4+foxp3-t细胞的cd4+foxp3+treg亚群扩增。然后,这些诱导的treg能够通过抑制肿瘤抗原特异性细胞毒性cd8+t细胞的活化而促进t细胞无反应性的诱导。
如图41所示出的,重组tgfβ1能够刺激来自分离自健康人供体pbmc的混合t细胞群的cd4+foxp3+treg的扩增。然而,使用抗tgfβ1d11抗体或tgf-β1scfv2h6、4h7和4d9的tgfβ阻断还以剂量依赖性方式显著抑制tgfβ诱导的cd4+foxp3+treg的扩增。因此,此类tgfβ1scfv可用于减少癌症中的treg扩增。
阻断tgfβ1诱导的上皮-间质转化(emt)
已知暴露于tgfβ诱导上皮-间质转化。在此过程中,上皮细胞从具有鹅卵石形态的有组织的、极化的和紧密连接的上皮细胞片转分化为无组织和能动的细胞,所述细胞在形态上表现为间质。在emt期间,细胞的侵入能力被活化,并且从而增强细胞的致瘤能力。e-钙粘蛋白是上皮细胞的常用标志物,并且定位于上皮细胞之间的粘附连接。e-钙粘蛋白的缺失是指示转分化过程的emt的强烈标志物。(图42a)。另外,波形蛋白与高度能动的细胞相关联。因此,细胞中波形蛋白表达的诱导还表明体内运动性增强和局部侵袭增加。
如图42和43所示出的,通过抗tgfβ1d11抗体或tgf-β1scfv的tgf-β阻断逆转tgf-β1诱导的上皮-间质转化(图42)和迁移(图43)。在补充有tgf-β1(板2);tgf-β1和1d11(板3);或tgf-β1和抗tgf-β1scfv(板4)的生长培养基中培养小鼠4t1细胞,然后固定,并且用e-钙粘蛋白抗体(绿色)和波形蛋白抗体(紫色)染色。核用dapi(蓝色)复染。用tgf-β1治疗诱导细胞-细胞连接处的e-钙粘蛋白的丧失和波形蛋白的表达增加。通过添加本文所描述的1d11或受试者抗tgf-β1scfv来逆转此作用(图42,板3和4)。此外,本文所描述的抗tgf-β1scfv能够阻断tgf-β1介导的癌细胞迁移(图43)。
中和tgfβ1诱导的smad活化
tgfβ超家族由多效细胞因子组成,其调节各种生物过程,包含细胞增殖、分化、迁移、细胞存活、血管生成、伤口愈合和免疫监视。在人中,主要的同种型是以各种组织类型表达的tgfβ1。tgfβ抑制大多数正常上皮细胞的增殖。另外,在上皮来源的癌症的早期阶段期间,tgfβ起细胞生长抑制剂的作用。因此,在癌症起始期间,tgfβ充当肿瘤抑制剂。然而,在癌症进展的后期阶段期间,肿瘤细胞变得对tgfβ的生长抑制作用具有抗性,并且tgfβ具有肿瘤启动子的作用。实际上,tgfβ1已经示出在各种肿瘤中过表达。tgfβ路径的活化通过tgfβ配体与类型iitgfβ受体(tβrii)的结合而发生,其然后诱导tβrii与tβri之间的结合和寡聚化。当形成此寡聚体时,smad2和smad3被募集,并且被tβri磷酸化。然后磷酸化的smad2或smad3结合细胞质中的smad4,并且此复合物易位到细胞核,其中它与启动子区域相互作用,并且活化靶基因的转录。因此,tgfβ路径的活化可通过在向血清饥饿细胞中加入tgfβ之后,smad2的快速磷酸化来测量。然而,tgfβ的有效阻断将抑制smad2磷酸化。此处,smad2磷酸化的缺失可以用作受试者抗tgfβscfv构建体有效阻断tgfβ的措施。
使用血清饥饿的人(图44a)或小鼠细胞(图44b),确定添加人重组tgfβ1(图44a)或小鼠tgf-β1、-β2和-β3(图44b)诱导smad2磷酸化。当tgfβ与对照抗tgfβ1d11抗体或tgf-β1scfv构建体2h6、4h7和4d9预培育时,此类磷酸化以剂量依赖性方式降低。这些数据表明,2h6、4h7和4d9scfv构建体能够隔离tgfβ1,并且抑制其与tβrii/tβri的相互作用,从而在晚期癌症期间抑制tgfβ活化级联。
4d9抗tgfβ-1-abd
示例性tgf-β1scfv-abd构建体的序列(4d9m-a6m和4h7-a6m)示出在图45a中。如图45b所示出的,抗tgfβ-1-abd将抗tgfβ-1scfvt1/2β从106分钟延长到10.6小时。
评估在大肠杆菌和hek细胞中产生的抗tgf-β1scfv-abd(用于tgf-β1的二价),以结合小鼠血清白蛋白(图47)。评估构建体的三种不同取向:两个抗tgf-β1scfv连接到abd的n端(“bin端”);两个抗tgf-β1scfv连接到abd的c端(“bic端”);或一个抗tgf-β1scfv连接到abd的n端和c端中的每一个(“bimid”)。如图46所示出的,所有构建体都显示出与小鼠血清白蛋白的结合。关于在大肠杆菌中产生的构建体,bimid表现出比n端取向更好的与msa的结合。关于在hek细胞中产生的构建体,bin端取向显示出比bimid或bic端取向更好的与msa的结合。
如图47所示出的,通过此类构建体逆转tgfβ-1介导的t细胞增殖抑制(即,增加t细胞增殖)(图46b)。进一步,4d9m-abd已经示出阻断人tgfβ-1和人tgfβ-3与同源受体的结合(数据未示出)。
所有引用的参考文献通过引用以其整体明确地并入本文。
尽管出于说明的目的已经在上文描述了本发明的具体实施例,但是本领域技术人员将了解的是,在不脱离如所附权利要求所描述的本发明的情况下可以做出许多细节变化。
- 还没有人留言评论。精彩留言会获得点赞!