成纤维细胞活化蛋白(FAP)识别的底物及其使用方法与流程
背景技术:
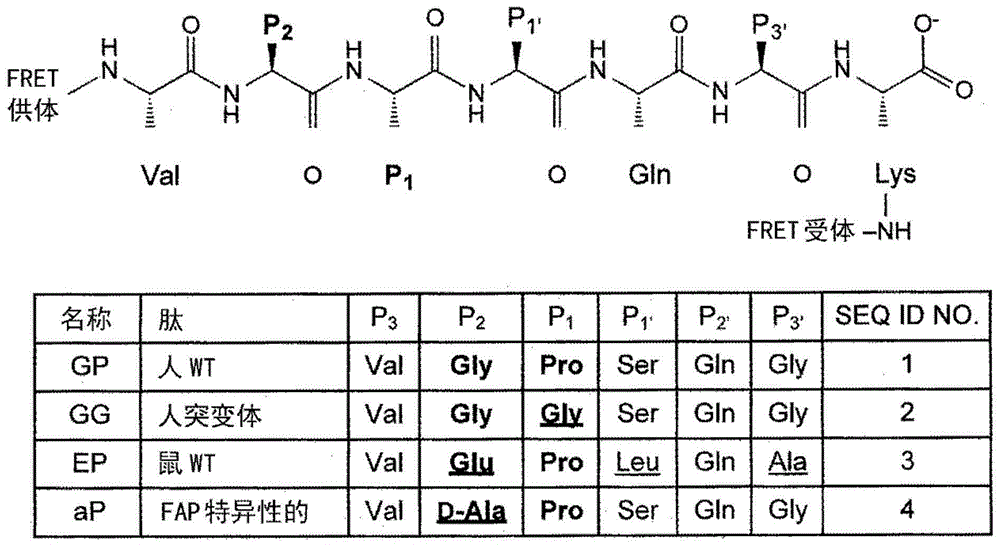
:人成纤维细胞活化蛋白(fap;genbank登录号aac51668;ec3.4.21.b28),也称为fapα,seprase或循环抗纤溶酶切割酶(circulatingantiplasmin-cleavingenzyme),是170kda,ii型跨膜丝氨酸蛋白酶和脯氨酸特异性蛋白酶的s9家族的成员,脯氨酸特异性蛋白酶的s9家族包括二肽基肽酶iv(dppiv)、dpp8、dpp9、脯氨酰内肽酶(prep,也称为pop)。fap是含有两个n-糖基化亚基的同型二聚体,具有大的c-末端细胞外结构域,其中酶的催化结构域位于其中。在其糖基化形式中,fap具有后脯氨酰二肽基肽酶和后脯氨酰内肽酶活性。人fap最初在培养的成纤维细胞中被鉴定,并且在包括小鼠的几个物种中发现了该蛋白质的同源物。尽管进行了深入的研究,但fap的生理学底物的身份仍然难以捉摸。fap与其最接近的亲属dppiv一样,表现出二肽基肽酶活性,在从各种分泌蛋白和肽激素中n末端的第二个位置存在的脯氨酸后切割。此外,fap,但不是dppiv,具有内肽酶活性,优先将羧基末端切割成gly-pro序列。虽然胶原蛋白具有重复的gly-pro基序,但除非是以变性或部分加工的形式(例如明胶),否则它们对fap的降解具有抗性。与fap在调节胶原蛋白周转中的作用一致,fapko小鼠在致病条件下显示升高的胶原蛋白水平。还提出fap在α2-抗纤溶酶(α2ap)的n-末端附近的特定位点切割以增强其活性。另外,本发明人发现fap在c-末端附近的特定位点切割成纤维细胞生长因子21(fgf21),从而使该代谢激素失活。在α2ap和fgf21中,fap靶向的特异性切割位点在p2-p1位置具有共有的gly-pro序列,并且这些氨基酸残基对于通过fap的切割是必需的。虽然fap是作为膜结合蛋白产生的,但是编码此活性酶的细胞外结构域可以从细胞表面脱落,因此通过标准夹心elisa可以容易地在血清和血浆中检测到可溶性fap蛋白。已经显示fap蛋白的水平在一些病理条件下升高。fap具有独特的组织分布:发现其表达在肝硬化患者中和超过90%的所有原发性和转移性上皮肿瘤(包括肺癌,结肠直肠癌,膀胱癌,卵巢癌和乳腺癌)中的反应性基质成纤维细胞上被高度上调,而它通常不存在于正常成人组织中。随后的报道显示fap不仅在基质成纤维细胞中表达,而且在某些类型的上皮来源的恶性细胞中表达,并且fap表达与恶性表型直接相关。由于其在肝硬化和许多常见癌症中的表达,以及其在正常组织中的限制性表达,fap可能是用于各种哺乳动物疾病的成像、诊断和治疗的有希望的靶标。因此,已经针对fap提出了许多单克隆抗体。为了研究、诊断和治疗目的,需要测量fap蛋白质水平和酶活性的备选的且不太繁重的方法。发明概述本发明人已经制备了用于循环成纤维细胞活化蛋白(fap)内肽酶活性的均相荧光强度测定,其利用基于fgf21的内肽酶切割位点的修饰的肽底物——fap的新鉴定的天然底物,其对fap具有选择性。因此,该测定依赖于酶活性来测量fap蛋白水平,与活性非依赖性elisa相反。在一个方面,本公开因此提供了分子荧光共振能量转移(fret)构建体,其包含接头肽、供体荧光团部分和受体荧光团部分,其中所述接头肽是fap的底物,并且不是另一个人s9肽酶、人s28肽酶或二肽基肽酶iv(dppiv)、dpp8或dpp9中的任一种的底物。具体地,本公开的fret构建体不是脯氨酰内肽酶(prep)的底物。这些fret构建体的接头肽将供体和受体荧光团分开不超过10nm的距离,并且供体荧光团部分的吸收光谱与受体荧光团部分的激发光谱重叠,使得fap的特异性切割导致供体和受体荧光团的充分分离以产生可检测的荧光变化。因此,本公开的fret构建体可以是猝灭的fret构建体或正常的fret构建体,在通过fap酶活性切割接头肽后,分别导致荧光的减少或增加。本公开的优选荧光团对是fret供体hylitefluor488和fret受体qxl520。这些fret构建体的接头肽可包含至少约6个氨基酸残基和选自由seqidno:1-4组成的组的氨基酸序列。这些接头肽可包含至少约8个,或至少约9个,或至少约10个,或至少约11个,或至少约12个,或至少约13个,或至少约14个,或至少约15个,或至少约16个,或至少约17,或至少约18个,或至少约19个,或至少约20,或至少约21,或至少约22个氨基酸残基,包括选自由seqidno:1-4组成的组的序列。这些接头肽还可包含更长的氨基酸序列,包括至少约30个氨基酸残基,或至少约40个氨基酸残基,或至少约45个氨基酸残基,或至少约50个氨基酸残基的序列,或至少约55个氨基酸残基,或至少约65个氨基酸残基,包括选自由seqidno:1-4组成的组的序列。本公开还提供了编码如上所述的接头肽的分离的多核苷酸分子。该构建体优选是表达载体,其包含与启动子可操作地连接的多核苷酸分子。这些表达载体的优选启动子是诱导型启动子。本公开还提供了包含一种或多种这些分离的多核苷酸分子的细胞。细胞可选自cho细胞、大肠杆菌(e.coli)细胞或酵母细胞。本公开还提供了在合适的容器中包含本公开的fret构建体的试剂盒。本公开还提供了检测fap内肽酶和/或fap酶活性的方法,其包括提供上述fret构建体,其中接头是fap底物,将构建体在fap酶切割fap底物的条件下暴露于怀疑含有fap酶活性的样品,并检测和比较构建体暴露于样品之前和之后的fret信号,其中荧光的增加指示样品中存在活性fap蛋白。在这些方法中,fret构建体的接头肽可包含seqidno:4的氨基酸序列。在这些方法中,fret可以通过选自以下的方法检测:测量在受体发射波长和供体发射波长发射的荧光,并且通过各个发射幅度的比率测定能量转移;测量供体的荧光寿命;测量供体的光漂白率;测量供体和受体的各向异性;和测量斯托克斯位移单体/受激子荧光。本公开还提供了用于筛选fap内肽酶活性的抑制剂的方法,所述方法包括提供含有如上所述的fret构建体的细胞,其中构建体中的接头是fap的肽底物;将细胞暴露于候选抑制剂化合物;在暴露于抑制剂化合物之前和之后检测细胞的fret信号,其中在候选抑制剂存在下观察到fret的实质性降低或消除指示候选抑制剂能够抑制fap。优选地,候选化合物属于化合物库,并且该方法是高通量方法。类似地,本公开提供了用于筛选fap内肽酶活性抑制剂的方法,所述方法包括提供基本上不含细胞组分的分离的fret构建体,如上所述,其中构建体中的接头是fap的肽底物;将fret构建体暴露于候选抑制剂化合物;在暴露于抑制剂化合物之前和之后检测fret信号,其中在候选抑制剂存在下观察到fret的实质性降低或消除指示候选抑制剂能够抑制fap。在这些方法中,分离的fret构建体可以与固相支持体联合(即,共价或非共价连接),所述固相支持体不会干扰荧光活性或fap对接头肽的切割。优选地,候选化合物属于化合物库,并且该方法是高通量方法。本公开还提供了用于检测fap酶活性的方法,所述方法包括a)提供如上所述的fret构建体,b)将构建体在fap酶切割fret构建体的接头部分的条件下暴露于怀疑含有fap内肽酶的样品,和c)检测供体和受体荧光团的荧光信号的空间分离,其中空间分离的发生指示样品中存在fap酶活性。优选地,构建体位于活细胞或组织内,接头肽是与fret供体hylitefluor488和fret受体qxl520连接的seqidno:4,其中荧光的检测指示样品中存在fap酶活性。本公开还提供了检测或成像受试者中的fret构建体的方法。在一种方法中,当通过向受试者施用本公开的fret构建体并通过体内成像检测来自分子构建体的荧光来使fap表达组织在受试者中成像时,进行体内成像。在这些方法中,fret构建体可包含近红外荧光(nirf)荧光团。体内成像可选自nirf成像、荧光反射成像(fri)、荧光介导的断层摄影(fmt)及其组合。在另一种方法中,当通过从受试者获得组织样品;使组织样品与本公开的fret构建体接触,并通过离体成像检测来自分子构建体的荧光而对fap表达组织成像时,进行离体成像。离体成像可包括具有切除组织的低分辨率成像。离体成像可以包括从受试者获得的组织切片的原位酶谱。这些方法可以进一步包括从受试者中移除组织(即,切除组织),所述组织是在受试者的体内成像之后检测或成像了的,诸如癌组织、实体肿瘤、器官内的纤维化组织或器官的另一部分。手术切除可以通过本领域已知的任何技术进行。在一些实施方案中,该方法可以进一步包括在切除后施用fret构建体以测量组织切除的完整性。本公开还提供了诊断、检测或监测受试者中的纤维化或癌症的方法,所述方法包括使取自受试者的测试样品与本公开的fret构建体接触,测量测试样品中的荧光的量;并且将结果针对来自对照样品的荧光归一化,使得测试样品中荧光的检测可以诊断从中获得样品的受试者中的纤维化或相关病症,诸如癌症。这些方法可以包括向受试者施用本公开的fret构建体,然后从受试者获得测试样品,测量测试样品中的荧光量;并且将结果针对来自对照样品的荧光归一化,使得测试样品中荧光的检测可以诊断从中获得样品的受试者中的纤维化或相关病症,诸如癌症。本公开还提供了用于诊断、检测或监测纤维化或相关病症(诸如癌症)的试剂盒。这些试剂盒可包括本公开的fret构建体及其使用说明。下面借助于附图和实施例更详细地描述本发明,这些附图和实施例不应解释为限制本公开的范围。附图说明图1.设计含有n-末端荧光供体的荧光猝灭肽,然后是人fgf21的显性fap内肽酶切割位点侧翼区域的六个氨基酸残基,以与荧光受体偶联的额外的c-末端赖氨酸结束。变体(表)包括用甘氨酸置换p1脯氨酸,用d-丙氨酸或用鼠fgf21的整个同源区域置换p2甘氨酸。图2a-2d显示荧光猝灭肽的血浆切割。图2a显示了从fap+/+、fap+/-和fap-/-小鼠,如所指示的(每个基因型n=3只小鼠),分离的血浆样品中人wt(gp)、人突变体(gg)和鼠(ep)fgf21基肽的切割速率。作为对照,用1nm重组小鼠fap进行切割反应。在该实验中肽底物的浓度为3μm。图2b显示重组人fap或prep蛋白在1nm酶浓度下对gp肽的切割速率。图2c显示重组人fap(左,蓝)或prep(右,红)在fap特异性抑制剂cpd60和/或prep特异性抑制剂kyp-2047(kyp)存在的情况下对gp肽的切割速率。图2d显示在cpd60和/或kyp(每组n=3)存在的情况下来自fap+/+(蓝色)、fap+/-(红色)和fap-/-(黑色)小鼠的血浆中gp肽的切割速率。图3a-3d显示了通过重组fap对gp和ap底物的切割动力学。图3a和3b显示(图3a)gp或(图3b)ap肽的人(黑色)或小鼠(蓝色)重组fap切割的michaelis-menten饱和曲线。图3c是使用gp肽对于重组小鼠或人fap与cpd60,将分数速度作为cpd60浓度的函数的图。发现小鼠和人fap制剂分别为74%和57%活性。图3d显示了使用gp和ap底物,人和小鼠fap酶动力学常数,其是针对图3c中测定的实验测定的活性酶浓度而校正的。误差是sem,由三个实验重复测定。fap摩尔浓度基于用于活性位点滴定和动力学计算的单体。图4a-4f显示了ap肽切割的特异性。图4a显示1nm重组人fap或prep对ap或gg肽的切割速率。图4b显示一组重组人脯氨酰肽酶对ap肽的切割速率。每种重组肽酶以2.5μg/ml使用。图4c和4d显示10nm重组人fap或prep对anpfap(c)或apnirf(d)的切割速率。图4e显示来自fap+/+、fap+/-和fap-/-小鼠的血浆中ap肽的切割速率。将血浆稀释10倍。图4f显示了在抗-fap或对照igg-免疫耗竭的人血清中ap肽的切割速率。将血清稀释2.5倍。先前通过免疫印迹显示了抗fap免疫耗竭后的完全fap去除(dunshee,等人(2016)jbiolchem291:5986-96)。图5a-5c显示血清中的fap活性与肝病和fap水平相关。图5a是散点图,其显示通过使用ap肽(x轴)测定的fap活性水平和通过elisa测定的健康个体(n=16,黑色圆圈)或之前诊断为肝硬化的个体(n=17,红色圆圈)的血清样品(y轴)中的fap蛋白水平。r2值在图表中指示。图5b和5c显示与图5a相同的表示为平均值±sem的数据。指示的p值由斯氏t检验计算。图6显示在饲喂具有cpd60的食物的小鼠中血浆fap活性被完全抑制。将10至18周龄的c57/bl6背景小鼠随意饲喂对照食物或含有100ppm的化合物60的饮食。从在指示时间点回收的血液中分离血浆,并使用ap肽测定fap活性水平。每组n=6只动物(针对对照组为2只雄性和4只雌性,针对cpd60饮食组为3只雌性和3只雄性)。通过斯氏t检验计算指示的p值(****:p<0.0001;**:p<0.002)。图7a显示三个胰腺的离体图像。总体形态显示在左侧面板中,apnirf探针成像信号强度的热图表现显示在右侧面板中。图7b显示了归一化至成像区域的相对荧光强度的定量,指示在kpp胰腺中的荧光更强。发明详述本公开提供了基于通过肽接头连接的荧光团之间的荧光共振能量转移(fret)的新型组合物和方法,所述肽接头是成纤维细胞活化蛋白(fap)的底物并被其切割,以检测和监测fap酶活性。这些方法和组合物允许检测皮摩尔水平的fap,并且可用于高通量测定系统,用于大规模筛选fap抑制剂。这些组合物和方法也可用于成像在活细胞、组织和器官中的fap活性,以及这些组织的离体成像。荧光共振能量转移(fret)是一种工具,其允许评估一个分子与另一个分子(例如蛋白质或核酸)之间或同一分子上两个位置之间的距离。fret在本领域中是已知的(关于综述,参见matyus,(1992)j.photochem.photobiol.b:biol.,12:323;和olympusmicro.com/primer/techniques/fluorescence/fret/fretintro.html)。fret是一种无辐射过程,在其中能量从受激发的供体分子转移到受体分子。无辐射能量转移是量子力学过程,通过该过程,一个荧光团的激发态的能量在没有实际光子发射的情况下被转移到第二荧光团。简而言之,荧光团吸收特征波长的光能。该波长也称为激发波长。由荧光染料吸收的能量随后通过各种途径释放,一种是光子的发射以产生荧光。被发射的光的波长被称为发射波长,并且是特定荧光团的固有特征。在fret中,该能量在第二荧光团的发射波长处释放。第一荧光团通常称为供体,并且具有比第二荧光团更高能量的激发态,称为受体。该过程的必要特征是供体的发射光谱与受体的激发光谱重叠,并且供体和受体足够接近。供体和受体之间的距离必须足够小,以允许荧光团之间无辐射的能量转移。因为能量转移速率与供体和受体之间的距离的六次方成反比,所以能量转移效率对距离变化极其敏感。据说能量转移在1-10nm距离范围内以可检测的效率发生,但为了获得最佳结果,通常为4-6nm。无辐射能量转移有效的距离范围也取决于许多其他因素,包括供体的荧光量子效率、受体的消光系数、它们各自光谱的重叠程度、介质的折射率以及两个荧光团的跃迁矩的相对取向。本公开的fret构建体本公开提供了构建体(“fret构建体”),其包含荧光团fret供体和通过fap可切割的接头肽(“底物肽”)连接的受体。在存在fap酶活性的情况下,接头肽被切割,从而导致能量转移的减少和供体荧光团的光的发射增加或受体的光的发射减少。以这种方式,可以检测、监测和定量fap的蛋白水解活性。在这些fret构建体中,接头肽优选不是人s9肽酶或人s28肽酶的底物。类似地,接头肽优选不是二肽基肽酶iv(dppiv),dpp8或dpp9中的任何一种的底物。甚至更优选地,接头肽不是脯氨酰内肽酶(prep)的底物。在这些fret构建体中,接头肽将供体和受体荧光团分开不超过10nm的距离,并且供体荧光团部分的发射光谱与受体荧光团部分的吸收光谱重叠。本公开的示例性fret构建体包括包含以下序列的分子构建体:p3p2p1p1’p2’p3’xaa1-xaa2-xaa3-xaa4-xaa5-xaa6-(seqidno:1)其中xaa1是:天然或非天然氨基酸残基或衍生物;xaa2是:选自天然存在的氨基酸或氨基酸类似物的d-对映体残基;xaa3是:脯氨酸(pro)或其衍生物;xaa4是:天然或非天然氨基酸残基或衍生物;xaa5是:天然或非天然氨基酸残基或衍生物;和,xaa6是:天然或非天然氨基酸残基或衍生物。在这些示例性fret构建体中,xaa2可以选自d-丙氨酸、d-丝氨酸和d-苏氨酸,或xaa2可以是具有式-nh-(ch2)n-coo-的氨基酸类似物,其中n=2-10。xaa2因此可以是选自β-丙氨酸(bala)、γ-氨基丁酸(4abu)、5-氨基戊酸和6-氨基己酸的氨基酸类似物。在这些示例性fret构建体中,xaa3可以是卤化脯氨酸残基。权利要求11的分子构建体,诸如xaa3,氟化脯氨酸残基。xaa3也可以是选自脱氢脯氨酸、4,4-二氟脯氨酸、3-氟脯氨酸、4-氟脯氨酸、3-羟基脯氨酸(3hyp)和4-羟基脯氨酸(4hyp)的脯氨酸衍生物。在这些示例性fret构建体中,xaa1可以与供体荧光团部分或受体荧光团部分共价连接。类似地,在这些构建体中,xaa6可以与供体荧光团部分或受体荧光团部分共价连接。供体荧光团部分和受体荧光团部分中的至少一个可以通过接头与接头肽共价连接。如果接头存在,则该接头可包含选自赖氨酸(lys)、精氨酸(arg)、谷氨酰胺(gln)和天冬酰胺(asn)的至少一种氨基酸。在示例性构建体中,该接头是赖氨酸(lys)残基。供体荧光团部分或受体荧光团部分可以与接头肽的氨基末端连接。备选地或额外地,供体荧光团部分或受体荧光团部分可连接至所述肽的羧基末端。因此,在一种构型中,供体荧光团部分与肽的羧基末端连接,且受体荧光团部分与肽的氨基末端连接。在另一种构型中,供体荧光团部分与肽的氨基末端连接,且受体荧光团部分与肽的羧基末端连接。本公开的示例性接头肽包含或组成为具有序列val-(d-ala)-pro-ser-gln-gly(seqidno:2)的肽或包含与seqidno:2的氨基酸序列具有至少80%氨基酸序列同一性的多肽,而仍然是fap的底物而不是另一种人s9或s28肽酶的底物。类似地,接头肽可以是与seqidno:2的氨基酸序列具有至少80%氨基酸序列同一性的肽,而仍然是fap的底物而不是人s9或s28肽酶的底物。本公开的示例性接头肽可包含或组成为与seqidno:2的氨基酸序列相比具有1至3个保守氨基酸置换的肽,而仍然是fap的底物而不是人s9或s28肽酶的底物。类似地,接头肽可以是与seqidno:2的氨基酸序列相比包含一个保守氨基酸置换的肽,而仍然是fap的底物而不是人s9或s28肽酶的底物。在本公开的发明方法和组合物的上下文中还考虑了通过化学或遗传手段对任何接头肽的修饰。此类修饰的实例包括以具有l-或d-对映体形式的非天然氨基酸和/或天然氨基酸的部分或完整序列的肽的构建体。例如,本文公开的任何接头肽及其任何变体可以全d形式产生。此外,可以修饰多肽以含有碳水化合物或脂质部分,诸如糖或脂肪酸,所述碳水化合物或脂质部分与氨基酸的侧链或n-或c-末端共价连接。此外,本公开的接头肽还可包含选自磷酸化和糖基化的修饰。另外,可以修饰本公开的接头肽以在施用时增强溶解度和/或半衰期。例如,聚乙二醇(peg)和相关聚合物已用于增强蛋白质治疗剂在血液中的溶解度和半衰期。因此,本公开的接头肽可通过peg聚合物等进行修饰。peg或peg聚合物是指含有聚(乙二醇)作为必要部分的残基。这种peg能够含有其他化学基团,这些化学基团是本公开的接头肽的治疗活性所必需的;其由分子的化学合成产生的;或者是用于使分子部分彼此最佳距离的间隔物。另外,这种peg可以由一个或更多个连接在一起的peg侧链组成。具有一个以上peg链的peg基团称为多臂或支链peg。支链peg可以通过例如向各种多元醇(包括甘油,季戊四醇和山梨糖醇)中加入聚环氧乙烷来制备。例如,可以由季戊四醇和环氧乙烷制备四臂支链peg。支链peg通常具有2至8个臂,并且描述于例如美国专利no.5,932,462中。特别优选的是具有通过赖氨酸的伯氨基连接的两个peg侧链(peg2)的peg(monfardini,c,等人,bioconjugatechem.6(1995)62-69)。术语“peg”广泛用于涵盖任何聚乙二醇分子,其中乙二醇(eg)单元的数目为至少460,优选460至2300,特别优选460至1840(230eg单元是指分子量为大约10kda)。eg单元的上限数量仅受本公开的peg化接头肽的溶解度限制。通常不使用比含有2300单元的peg大的peg。优选地,本发明中使用的peg在一端以羟基或甲氧基(甲氧基peg,mpeg)终止,并且在另一端通过醚氧键共价附接至接头部分。聚合物是直链或支链的。支链peg例如是在veronese,f.m.,等人,journalofbioactiveandcompatiblepolymers12(1997)196-207中描述。用于产生本公开的peg化的接头肽和变体的合适方法和优选试剂描述于美国专利公布no.2006/0154865。应当理解,例如,基于veronese,f.m.,biomaterials22(2001)405-417描述的方法的修饰可以在该程序中进行,只要该方法产生本公开的peg化的接头肽即可。用于制备本公开的peg化接头肽的特别优选的方法描述于us2008/0119409中,其通过引用并入本文。本公开的示例性接头肽可以与聚乙二醇(peg)分子(例如包含75至2000个之间的乙二醇(eg)单元的peg分子)连接。另外地或备选地,本公开的接头肽可以与人igg的fc区的一个或更多个结构域融合。抗体包含两个功能独立的部分,称为“fab”的可变结构域,其结合抗原,和称为“fc”的恒定结构域,其涉及效应子功能,诸如补体激活和吞噬细胞的攻击。fc具有长的血清半衰期,而fab是短寿命的(capon等,1989,nature337:525-31)。当与本公开的治疗性蛋白质一起构建时,fc结构域可以提供更长的半衰期或并入这样的功能:fc受体结合、蛋白a结合、补体结合,甚至可能血脑屏障或胎盘转移。在一个实例中,可以使用本领域技术人员已知的方法将人igg铰链、ch2和ch3区融合在本公开的接头肽的氨基末端或羧基末端。得到的融合多肽可以通过使用蛋白a亲和柱纯化。已发现与fc区融合的肽和蛋白质显示出比未融合的对应物显著更长的体内半衰期。而且,与fc区的融合允许融合多肽的二聚化/多聚化。fc区可以是天然存在的fc区,或者可以被改变以改善某些性质,诸如治疗性质、循环时间或减少的聚集。示例性接头肽可以与人igg分子的fc区的一个或更多个结构域连接,例如人igg铰链、ch2和/或ch3区,所述结构域与所述肽的氨基末端或羧基末端的至少一个融合。也可以将接头肽修饰为含有硫、磷、卤素、金属等。氨基酸模拟物可以用于产生多肽,因此,本公开的接头肽可以包括具有增强特性,例如抗降解的氨基酸模拟物。例如,接头肽可包括一种或多种(例如所有)肽单体。本公开的接头肽可包括“表位标记的”肽,其是指包含与“标签多肽”融合的本公开的接头肽的嵌合肽。标签多肽具有足够的残基以提供可以制备抗体的表位,但是足够短以使其不会干扰与其融合的抑制性多肽的活性。标签多肽优选地也是相当独特的,使得抗体基本上不与其他表位交叉反应。合适的标签多肽通常具有至少6个氨基酸残基,通常在约8至50个氨基酸残基之间(优选地,在约10至20个氨基酸残基之间)。本公开的接头肽还可以与“固相”或“固相支持体”连接或缔合,“固相”或“固相支持体”是本公开的肽能够粘附或附着的非水性基质。本文涵盖的固相的实例包括部分或全部由玻璃(例如,可控孔玻璃)、多糖(例如琼脂糖)、聚丙烯酰胺,聚苯乙烯,聚乙烯醇和硅酮形成的那些。取决于上下文,固相可包含测定板或纯化柱(例如亲和色谱柱)的孔。该术语还包括离散颗粒的不连续固相,例如在美国专利no.4,275,149中所描述的那些。因此,本公开的接头肽也可以与固相支持体(例如包含玻璃、多糖、聚丙烯酰胺、聚苯乙烯、聚乙烯醇和硅酮中的至少一种的固相支持体)连接。本公开还考虑本文所述的具有在seqidno:1-4,优选seqidno:4的末端或序列内的任何fret对的底物肽的任何一个。例如,用于生物学的常见荧光团对是青色荧光蛋白(cfp)-黄色荧光蛋白(yfp)对。在没有fap酶活性的情况下,报告子是完整的并且cfp和yfp部分非常接近。由于fret,cfp的激发导致能量转移到yfp。结果,cfp发射猝灭,而yfp由于fret而发出荧光。在fap酶活性存在的情况下,报告子由fap的蛋白水解活性切割。cfp和yfp部分是物理分离的,并且不再发生fret。cfp发射恢复并yfp发射减少。将fret标签添加到本文公开的肽底物中将会产生比市售fret底物更高的检测。本公开的肽底物有利地具有fap酶活性检测的下限。如本文关于供体和相应的受体荧光部分所用的,“相应的”是指具有与供体荧光部分的激发光谱重叠的发射光谱的受体荧光部分。受体荧光部分的发射光谱的波长最大值应比供体荧光部分的激发光谱的波长最大值大至少100nm。因此,可以产生有效的非放射性能量转移。如本文关于底物肽和fap所用的,“相应的”是指在特定切割位点切割接头肽的fap内肽酶。通常选择荧光供体和相应的受体部分用于(a)高效福斯特能量转移;(b)大的最终斯托克斯位移(>100纳米);(c)尽可能将发射转移到可见光谱的红色部分(>600nm);和(d)发射偏移到比在供体激发波长下通过激发产生的拉曼水荧光发射更高的波长。例如,供体荧光部分可以如下选择:具有其在激光线附近的其激发最大值(例如,氦-镉442nm或氩488nm)、高消光系数、高量子产率以及其荧光发射与相应受体荧光部分的激发光谱的良好重叠。相应的受体荧光部分可以如下选择:具有高消光系数、高量子产率、其激发与供体荧光部分的发射的良好重叠以及可见光谱的红色部分(>600nm)中的发射。技术人员将认识到许多荧光团分子适用于fret。荧光蛋白可以用作荧光团。可在fret技术中与各种受体荧光部分一起使用的代表性供体荧光部分包括荧光素,萤光黄,b-藻红蛋白,9-吖啶异硫氰酸酯,萤光黄vs,4-乙酰氨基-4'-异硫代-氰氧基芪-2,2'-二磺酸,7-二乙氨基-3-(4'-异硫氰氧基苯基)-4-甲基香豆素,1-芘丁酸琥珀酰亚胺酯和4-乙酰氨基-4'-异硫氰氧基芪-2-,2-'-二磺酸衍生物。代表性的受体荧光部分,取决于所用的供体荧光部分,包括lc-红640,lc-红705,cy5,cy5.5,丽丝胺罗丹明b磺酰氯,四甲基罗丹明异硫氰酸酯,罗丹明x异硫氰酸酯,异硫氰酸异赤藓红,荧光素,二亚乙基三胺五乙酸盐或其他镧系离子螯合物(例如铕或铽)。供体和受体荧光部分可以例如从molecularprobes(junctioncity,or)或sigmachemicalco.(st.louis,mo)获得。用于本公开的fret构建体的荧光标记的实例包括荧光素,6-famtm(appliedbiosystems,carlsbad,calif.),tettm(appliedbiosystems,carlsbad,calif.),victm(appliedbiosystems,carlsbad,calif.),max,hextm(appliedbiosystems,carlsbad,calif.),tyetm(thermofisherscientific,waltham,mass.),tye665,tye705,tex,joe,cytm(amershambiosciences,piscataway,n.j.)染料(cy2,cy3,cy3b,cy3.5,cy5,cy5.5,cy7),texas(molecularprobes,inc.,eugene,oreg.),texas红-x,(molecularprobes,inc.,eugene,oreg.)染料(alexafluor350,alexafluor405,alexafluor430,alexafluor488,alexafluor500,alexafluor532,alexafluor546,alexafluor568,alexafluor594,alexafluor610,alexafluor633,alexafluor647,alexafluor660,alexafluor680,alexafluor700,alexafluor750),dylighttm(thermofisherscientific,waltham,mass.)染料(dylight350,dylight405,dylight488,dylight549,dylight594,dylight633,dylight649,dylight755),attotm(atto-tecgmbh,siegen,germany)染料(atto390,atto425,atto465,atto488,atto495,atto520,atto532,atto550,atto565,attorho101,atto590,atto594,atto610,atto620,atto633,atto635,atto637,atto647,atto647n,atto655,atto665,atto680,atto700,atto725,atto740),(molecularprobes,inc.,eugene,oreg.)染料(bodipyfl,bodipyr6g,bodipytmr,bopdipy530/550,bodipy558/568,bodipy564/570,bodipy576/589,bodipy581/591,bodipy630/650,bodipy650/665),hilytefluortm(anaspec,fremont,calif.)染料(hilytefluor488,hilytefluor555,hilytefluor594,hilytefluor647,hilytefluor680,hilytefluor750),amca,amca-s,blue(molecularprobes,inc.,eugene,oreg.),级联黄,香豆素,羟基香豆素,罗丹明绿tm-x(molecularprobes,inc.,eugene,oreg.),罗丹明红tm-x(molecularprobes,inc.,eugene,oreg.),罗丹明6g,tmr,tamratm(appliedbiosystems,carlsbad,calif.),5-tamra,roxtm(appliedbiosystems,carlsbad,calif.),oregon(lifetechnologies,grandisland,n.y.),oregon绿500,700(li-corbiosciences,lincoln,nebr.),irdye800,wellredd2,wellredd3,wellredd4,和640(rochediagnosticsgmbh,mannheim,germany)。合适的受体包括blackhole(biosearchtechnologies,novato,calif.),bhq-2,dabcyl,iowafq(integrateddnatechnologies,coralville,iowa),iowablackrq,qxltm(anaspec,fremont,calif.),qsy7,qsy9,qsy21,qsy35,和irdyeqc。除了本文所述的接头肽(“底物肽”)之外,考虑可以制备接头肽变体。接头肽变体可通过将合适的核苷酸变化引入编码dna中和/或通过合成所需多肽来制备。例如,可以使用例如美国专利no.5,364,934中所示的保守和非保守突变的任何技术和准则来制备本文所述的接头肽的变异。变体可以是编码接头肽的一个或多个密码子的取代,缺失或插入,其导致与天然序列多肽相比氨基酸序列的变化。任选地,该变化是通过将至少一个氨基酸取代为任何其他氨基酸。通过比较接头肽的序列与同源已知蛋白质分子的序列并最小化在高度同源性的区域进行的氨基酸序列变化的数量,可以找到确定哪些氨基酸残基可以被插入、取代或缺失而不会对所需活性产生不利影响的指导。氨基酸取代可以是用具有相似结构和/或化学特性的另一种氨基酸取代一个氨基酸的结果,例如用丝氨酸取代亮氨酸,即保守氨基酸替换。插入或缺失可任选地在约1至5个氨基酸的范围内。允许的变化可以通过系统地进行在序列中氨基酸的插入、缺失或取代并测试所得变体的全长或成熟天然序列所显示的活性来确定。本文提供了接头肽片段。例如,当与全长天然肽比较时,此类片段可在n-末端或c-末端截短,或可缺少内部残基。某些片段缺少对于检测fap酶活性非必需的氨基酸残基。接头肽和片段可以通过许多常规技术中的任何一种制备。期望的肽片段可以化学合成。备选方法涉及通过酶消化产生多肽,例如通过用已知在特定氨基酸残基限定的位点切割蛋白质的酶处理蛋白质,或通过用合适的限制酶消化dna并分离所需片段。又另一种合适的技术包括通过聚合酶链式反应(pcr)分离和扩增编码所需肽或片段的dna片段。限定dna片段所需末端的寡核苷酸用于pcr中的5'和3'引物。接头肽片段与本文公开的天然接头肽共享至少部分fap底物特异性。保守氨基酸取代显示在表1中优选取代的标题下。如果这样的取代导致生物活性的改变,则引入表1中称为示例性取代的或如下文参考氨基酸类别进一步描述的更实质性变化,并筛选产物。表1原始残基示例性取代优选取代ala(a)val;leu;ilevalarg(r)lys;gln;asnlysasn(n)gln;his;asp,lys;argglnasp(d)glu;asnglucys(c)ser;alasergln(q)asn;gluasnglu(e)asp;glnaspgly(g)alaalahis(h)asn;gln;lys;argargile(i)leu;val;met;ala;phe;正亮氨酸leuleu(l)正亮氨酸;ile;val;met;ala;pheilelys(k)arg;gln;asnargmet(m)leu;phe;ileleuphe(f)trp;leu;val;ile;ala;tyrtyrpro(p)alaalaser(s)thrthrthr(t)val;sersertrp(w)tyr;phetyrtyr(y)trp;phe;thr;serpheval(v)ile;leu;met;phe;ala;正亮氨酸leu对接头肽的实质性修饰通过选择在维持以下各项的作用方面显著不同的取代而完成:(a)取代区域中肽骨架的结构,例如,片层或螺旋构象,(b)在特定位点上的分子的电荷和疏水性或(c)侧链的体积。天然存在的残基基于共同的侧链特性分为下组:(1)疏水性:正亮氨酸,met,ala,val,leu,ile;(2)中性亲水:cys,ser,thr;asn;gln(3)酸性:asp,glu;(4)碱性:his、lys、arg;(5)影响链取向的残基:gly、pro;和(6)芳香族:trp、tyr、phe。非保守取代会需要用这些类别之一的成员交换另一个类别的成员。这些取代的残基也可以引入保守的取代位点,或更优选引入剩余的(非保守的)位点。可以使用本领域已知的方法进行变化,例如寡核苷酸介导的(定点)诱变、丙氨酸扫描和pcr诱变。定点诱变(carter等人,nucl.acidsres.,13:4331(1986);zoller等人,nucl.acidsres.,10:6487(1987)),盒式诱变(wells等人,gene,34:315(1985)),限制性选择诱变(wells等人,philos.trans.r.soc.londonsera,317:415(1986))或其他能够对克隆的dna进行的已知的技术以产生接头肽变体dna。扫描氨基酸分析也可采用以鉴定沿着连续序列的一个或多个氨基酸。在优选的扫描氨基酸中是相对较小的中性氨基酸。这些氨基酸包括丙氨酸、甘氨酸、丝氨酸和半胱氨酸。丙氨酸通常是该组中优选的扫描氨基酸,因为它消除了β-碳以外的侧链,并且不太可能改变变体的主链构象(cunningham和wells,science,244:1081-85(1989))。丙氨酸通常也因为它是最常见的氨基酸而是优选的。此外,它经常在埋藏和暴露位置发现(creighton,theproteins,(w.h.freeman&co.,n.y.);chothia,j.mol.biol.,150:1(1976))。如果丙氨酸取代不能产生足够量的变体,则可以使用等构(isoteric)氨基酸。从以上关于最小切割位点和fret信号强度与接头长度之间的关系以及切割效率和接头长度之间的关系的讨论,本领域技术人员可以容易地选择合适的接头长度以实现fret信号强度和切割效率之间的最佳平衡。优选地,接头长度为约4个氨基酸至约100个氨基酸之间,6-50个氨基酸之间,7-30个氨基酸之间的任何值,这取决于fret构建体在检测或成像样品中的fap酶活性中的预期用途。可首先纯化这些接头肽或片段,或首先合成肽,然后通过化学反应将荧光团加到某些氨基酸上。荧光标记或者与接头多肽附接,或者,荧光蛋白与接头多肽框内融合,如下所述。因此,虽然短的底物片段对于fap酶活性检测特异性是合乎需要的,但是较长的片段可能是改善信号强度或切割特异性所需的,或者起到检测、成像或诊断技术的另一部分的作用。在使用较长的接头肽,尤其是全长底物蛋白的情况下,底物可以例如通过定点诱变或本领域技术人员公知的其他分子工程方法改造,使得它只含有一个fap肽酶识别位点。优选地,使用特异性改造和长度优化的组合来设计本公开的接头肽,以实现最佳信号强度、切割效率和肽酶特异性。荧光团是通过合适的底物肽连接的合适的荧光蛋白。然后fret构建体可以通过重组核酸分子的表达来产生,所述重组核酸分子包括在体外编码这种多肽和荧光蛋白标记的序列的框内融合(例如,使用无细胞转录/翻译系统,或者代之以使用本领域熟知的方法转化或转染的培养细胞)。编码本公开的接头肽的氨基酸序列的核酸分子或其变体通过本领域已知的多种方法制备。这些方法包括但不限于从天然来源分离(在天然存在的氨基酸序列变体的情况下)或通过寡核苷酸介导的(或定点)诱变、pcr诱变和盒式诱变早期制备的变体或非变体形式的接头肽来制备。可以将编码肽接头的核酸(例如cdna或基因组dna)插入可复制的载体中用于克隆(扩增dna)或用于表达。各种载体可公开获得。载体可以是,例如,质粒、粘粒、病毒颗粒或噬菌体的形式。可以通过多种方法将合适的核酸序列插入载体中。通常,使用本领域已知的技术将dna插入合适的限制性内切核酸酶位点。载体组分通常包括但不限于一种或更多种信号序列、复制起点、一种或更多种标记基因、增强子元件、启动子和转录终止序列。含有这些组分的一种或更多种的合适载体的构建采用本领域技术人员已知的标准连接技术。接头肽不仅可以直接重组产生,还可以作为与异源多肽的融合多肽产生,所述异源多肽可以是信号序列或在成熟蛋白质或多肽的n-末端具有特异性切割位点的其他多肽。通常,信号序列可以是载体的组分,或者它可以是插入表达载体的编码接头肽的dna的一部分。信号序列可以是原核信号序列,所述原核信号序列选自例如碱性磷酸酶、青霉素酶、lpp或热稳定肠毒素ii前导序列的组。对于酵母分泌,信号序列可以是例如酵母转化酶前导序列,α因子前导序列(包括酵母属和克鲁维酵母属α-因子前导序列,后者在美国专利no.5,010,182中描述),或酸性磷酸酶前导序列,白色念珠菌葡糖淀粉酶前导序列(ep362,179),或1990年11月15日公开的wo90/13646中描述的信号。在哺乳动物细胞表达中,哺乳动物信号序列可用于指导蛋白质的分泌,诸如来自相同或相关物种的分泌多肽的信号序列,以及病毒分泌前导序列。表达和克隆载体均含有使载体能够在一种或更多种所选的宿主细胞中复制的核酸序列。这些序列对于多种细菌、酵母和病毒是众所周知的。来自质粒pbr322的复制起点适用于大多数革兰氏阴性细菌、2μ质粒来源适用于酵母,并且各种病毒来源(sv40、多瘤、腺病毒、vsv或bpv)可用于在哺乳动物细胞中克隆载体。表达和克隆载体通常含有选择基因,也称为可选标记。典型的选择基因编码这样的蛋白质:其(a)赋予对抗生素或其他毒素(例如氨苄青霉素、新霉素、甲氨蝶呤或四环素)的抗性,(b)补充营养缺陷的不足,或(c)提供从复杂培养基无法获得的关键营养素,例如:用于芽孢杆菌的编码d-丙氨酸消旋酶的基因。用于哺乳动物细胞的合适可选标记的实例是能够鉴定能够摄取编码接头肽的核酸的细胞的那些,例如dhfr或胸苷激酶。当采用野生型dhfr时,合适的宿主细胞是dhfr活性缺陷的cho细胞系,该cho细胞系如urlaub等人,proc.natl.acad.sci.usa,77:4216(1980)所述制备和繁殖。适用于酵母的选择基因是存在于酵母质粒yrp7中的trp1基因(stinchcomb等人,nature,282:39(1979);kingsman等人,gene,7:141(1979);tschemper等人,gene,10:157(1980))。trp1基因为缺乏在色氨酸中生长能力的酵母突变株提供选择标记,例如atccno.44076或pep4-1(jones,genetics,85:12(1977))。表达和克隆载体通常含有与编码接头肽的核酸序列可操作地连接的启动子,以指导mrna合成。被各种潜在宿主细胞识别的启动子是众所周知的。适用于和原核宿主一起使用的启动子包括β-内酰胺酶和乳糖启动子系统(chang等人,nature,275:615(1978);goeddel等人,nature,281:544(1979)),碱性磷酸酶,色氨酸(trp)启动子系统((goeddel,nucleicacidsres.,8:4057(1980))和诸如tac启动子的杂合启动子(deboer等人,proc.natl.acad.sci.usa,80:21-25(1983))。用于细菌系统的启动子也将含有与编码接头肽的dna可操作连接的shine-dalgarno序列。用于与酵母宿主一起使用的合适启动子序列的实例包括针对3-磷酸甘油酸激酶的启动子(hitzeman等人,j.biol.chem.,255:2073(1980))或其他糖酵解酶的启动子(hess等人,j.adv.enzymereg.,7:149(1968);holland,biochemistry,17:4900(1978)),所述其他糖酵解酶诸如烯醇酶、甘油醛-3-磷酸脱氢酶、己糖激酶、丙酮酸脱羧酶、磷酸果糖激酶、葡萄糖-6-磷酸异构酶、3-磷酸甘油酸变位酶、丙酮酸激酶、磷酸丙糖异构酶、磷酸葡萄糖异构酶和葡萄糖激酶。其他酵母启动子,其是具有受生长条件控制的转录的额外优势的诱导型启动子,是醇脱氢酶2、异细胞色素c、酸性磷酸酶、与氮代谢相关的降解酶、金属硫蛋白、甘油醛-3-磷酸脱氢酶和负责麦芽糖和半乳糖利用的酶的启动子区。用于酵母表达的合适载体和启动子进一步描述于ep73,657中。哺乳动物宿主细胞中从载体的接头肽转录例如受启动子控制,所述启动子获自病毒,如多瘤病毒、禽痘病毒(uk2,211,504)、腺病毒(诸如腺病毒2)、牛乳头瘤病毒,禽肉瘤病毒、巨细胞病毒、逆转录病毒、乙型肝炎病毒和猿猴病毒40(sv40)的基因组,来自异源哺乳动物启动子,例如肌动蛋白启动子或免疫球蛋白启动子,和来自热休克启动子,只要这些启动子与宿主细胞系统相容。通过将增强子序列插入载体中,可以增加高等真核生物对编码接头肽的dna的转录。增强子是dna的顺式作用元件,通常约10至300bp,作用于启动子以增加其转录。现在已知许多增强子序列来自哺乳动物基因(珠蛋白、弹性蛋白酶、白蛋白、甲胎蛋白和胰岛素)。然而,通常,人们将使用来自真核细胞病毒的增强子。实例包括复制起点后侧(bp100-270)的sv40增强子,巨细胞病毒早期启动子增强子,复制起点后侧的多瘤增强子,和腺病毒增强子。增强子可以在接头肽编码序列的5'或3'位置,但优选位于启动子的5'位点,剪接到载体中。用于真核宿主细胞(酵母、真菌、昆虫、植物、动物、人或来自其他多细胞生物的有核细胞)的表达载体也将含有终止转录和稳定mrna所必需的序列。这些序列通常可从真核或病毒dna或cdna的5'和,偶尔地3',非翻译区获得。这些区域含有在编码接头肽的mrna的非翻译部分中转录为多腺苷酸化片段的核苷酸区段。尽管如此,在gething等人.,nature,293:620-25(1981);mantei等人,nature,281:40-46(1979);ep117,060;和ep117,058中描述了适合于重组脊椎动物细胞培养物中接头肽的合成的适应性的其他方法、载体和宿主细胞。用于产生fret构建体的合适细胞可以是细菌、真菌、植物或动物细胞。fret构建体也可以在体内产生,例如在转基因植物中,或在转基因动物(包括但不限于昆虫、两栖动物和哺乳动物)中产生。用于本发明的重组核酸分子可以通过本领域熟知的分子方法构建和表达,并且可以另外包含包括但不限于以下序列:编码标签(例如,组氨酸标签)使能够易于纯化的那些、接头、分泌信号、核定位信号或能够将构建体靶向特定细胞位置的其他一级序列信号,如果需要的话。宿主细胞用本文所述的表达或克隆载体转染或转化用于接头肽产生,并在修饰为适于诱导启动子的常规营养培养基中培养,选择转化子或扩增编码所需序列的基因。培养条件,诸如培养基、温度、ph等,可由技术人员选择而无需过多的实验。通常,用于使细胞培养物的生产率最大化的原理、方案和实用技术可以在mammaliancellbiotechnology:apracticalapproach,m.butler,编(irlpress,1991)和sambrook等,同上找到。真核细胞转染和原核细胞转化的方法是普通技术人员已知的,例如cacl2、capo4、脂质体介导的和电穿孔。取决于所使用的宿主细胞,使用适合于这些细胞的标准技术进行转化。使用氯化钙的钙处理(如sambrook等,同上中所述),或电穿孔通常用于原核生物。如shaw等,gene,23:315(1983)和1989年6月29日公开的wo89/05859所述,用根癌土壤杆菌的感染用于某些植物细胞的转化。对于没有这种细胞壁的哺乳动物细胞,可以使用graham和vandereb,virology,52:456-457(1978)的磷酸钙沉淀方法。哺乳动物细胞宿主系统转染的一般方面已在美国专利no.4,399,216中描述。转化至酵母中通常根据vansolingen等人,j.bact.,130:946(1977)和hsiao等人,proc.natl.acad.sci.(usa),76:3829(1979)的方法进行。然而,也可以使用其他用于将dna导入细胞的方法,诸如通过核显微注射,电穿孔,与完整细胞的细菌原生质体融合,或多聚阳离子,例如聚凝胺,聚鸟氨酸。对于转化哺乳动物细胞的各种技术,参见keown等人,methodsinenzymology,185:527-537(1990)和mansour等人,nature,336:348-352(1988)。用于克隆或表达本文载体中的dna的合适宿主细胞包括原核生物、酵母或高等真核细胞。合适的原核生物包括但不限于真细菌,例如革兰氏阴性或革兰氏阳性生物,例如诸如大肠杆菌的肠杆菌科。各种大肠杆菌菌株是公众可获得的,诸如大肠杆菌k12菌株mm294(atcc31,446);大肠杆菌x1776(atcc31,537);大肠杆菌菌株w3110(atcc27,325)和k5772(atcc53,635)。其他合适的原核宿主细胞包括肠杆菌科,例如埃希氏菌属(例如大肠杆菌),肠杆菌属,欧文氏菌属,克雷伯氏菌属,变形杆菌属,沙门氏菌属(例如鼠伤寒沙门氏菌,沙雷氏菌(例如serratiamarcescans),和志贺氏菌属,以及芽孢杆菌属,诸如枯草芽孢杆菌和地衣芽孢杆菌(例如1989年4月12日公开的dd266,710中公开的地衣芽孢杆菌41p),假单胞菌属,诸如铜绿假单胞菌,和链霉菌属。这些例子是说明性的而非限制性的。菌株w3110是一种特别优选的宿主或亲本宿主,因为它是用于重组dna产物发酵的常见宿主菌株。优选地,宿主细胞分泌最少量的蛋白水解酶。例如,可以修饰菌株w3110以在编码宿主内源蛋白质的基因中引起基因突变,这些宿主的实例包括大肠杆菌w3110菌株1a2,其具有完整基因型tona;大肠杆菌w3110菌株9e4,其具有完整的基因型tonaptr3;大肠杆菌w3110菌株27c7(atcc55,244),其具有完整的基因型tonaptr3phoae15(argf-lac)169degpomptkanr;大肠杆菌w3110菌株37d6,其具有完整的基因型tonaptr3phoae15(argf-lac)169degpomptrbs7ilvgkanr;大肠杆菌w3110菌株40b4,其是具有非卡那霉素抗性degp缺失突变的菌株37d6;和美国专利4,946,783中公开的具有突变周质蛋白酶的大肠杆菌菌株。备选地,克隆的体外方法,例如pcr或其他核酸聚合酶反应是合适的。全长接头肽,其片段或融合蛋白可以在细菌中产生,特别是当不希望或不需要接头肽的糖基化时。大肠杆菌的生产更快,更具成本效益。表达后,接头肽在可溶性级分中从大肠杆菌细胞糊中分离,并能够被纯化。最后的纯化可以类似于用于纯化例如在cho细胞中表达的肽的方法进行。除原核生物外,真核微生物如丝状真菌或酵母是接头肽编码载体的合适克隆或表达宿主。酿酒酵母(saccharomycescerevisiae)是常用的低等真核宿主微生物。其它包括粟酒裂殖酵母(schizosaccharomycespombe)(beach和nurse,nature,290:140(1981);ep139,383,1985年5月2日公开);克鲁维酵母宿主(kluyveromyceshosts)(美国专利no.4,943,529;fleer等,bio/technology,9:968-975(1991)),例如,乳酸克鲁维酵母(k.lactis)(mw98-8c,cbs683,cbs4574;louvencourt等,j.bacteriol.,154(2):737-742(1983)),脆壁克鲁维酵母(k.fragilis)(atcc12,424),保加利亚克鲁维酵母(k.bulgaricus)(atcc16,045),威克曼氏克鲁维酵母(k.wicheramii)(atcc24,178),沃尔提克克鲁维酵母(k.waltii)(atcc56,500),果蝇克鲁维酵母(drosophilarum)(atcc36,906;vandenberg等,bio/technology,8:135(1990)),耐热克鲁维酵母(k.thermotolerans),和马克斯克鲁维酵母(k.marxianus);耶式酵母属(yarrowia)(ep402,226);巴斯德毕赤酵母(pichiapastoris)(ep183,070;sreekrishna等人,j.basicmicrobiol.,28:265-278(1988));念珠菌属(candida);里氏木霉(trichodermareesia)(ep244,234);粗糙链孢霉(neurosporacrassa)(case等,proc.natl.acad.sci.usa,76:5259-5263(1979));许旺酵母属(schwanniomyces),例如西方许旺酵母(schwanniomycesoccidentalis)(ep394,5381990年10月31日公开);和丝状真菌,例如链孢霉属(neurospora)、青霉菌属(penicillium)、tolypocladium(wo91/00357,1991年1月10日公开),和曲霉属(aspergillus)宿主,例如构巢曲霉(a.nidulans)(ballance等人,biochem.biophys.res.commun.,112:284-289(1983);tilburn等人,gene,26:205-221(1983);yelton等人,proc.natl.acad.sci.usa,81:1470-1474(1984))和黑曲霉(a.niger)(kelly和hynes,emboj.,4:475-479(1985))。嗜甲基(methylotropic)酵母在本文中是合适的,包括但不限于能够在甲醇上生长的酵母,所述酵母选自由汉森酵母属、假丝酵母属,克勒克酵母属,毕赤酵母属,酵母属(saccharomyces),球拟酵母属和红酵母属组成的属。作为这类酵母的示例性的特定物种的列表可以在c.anthony,thebiochemistryofmethylotrophs,269(1982)中找到。用于表达糖基化肽的合适宿主细胞衍生自多细胞生物。无脊椎动物细胞的实例包括昆虫细胞,例如果蝇s2和草地夜蛾sf9,以及植物细胞,例如棉花、玉米、马铃薯、大豆、矮牵牛、番茄和烟草的细胞培养物。已经鉴定了许多杆状病毒株和变体以及来自宿主的相应的允许性昆虫宿主细胞,宿主例如草地夜蛾(spodopterafrugiperda)(毛虫),埃及伊蚊(蚊子),白纹伊蚊(蚊子),黑腹果蝇(果蝇)和家蚕。用于转染的多种病毒株是公众可获得的,例如,苜蓿银纹夜蛾npv的l-1变体和家蚕npv的bm-5株,并且根据本公开,此类病毒可用作本文的病毒,特别是用于转化草地夜蛾细胞。然而,对脊椎动物细胞的兴趣最大,并且脊椎动物细胞在培养物(组织培养物)中的繁殖已成为常规程序。有用的哺乳动物宿主细胞系的实例是由sv40转化的猴肾cv1系(cos-7,atcccrl1651);人胚肾细胞系(用于在悬浮培养中生长而亚克隆的293或293细胞,graham等,j.genvirol.36:59(1977));幼仓鼠肾细胞(bhk,atccccl10);中国仓鼠卵巢细胞/-dhfr(cho,urlaub等,proc.natl.acad.sci.usa77:4216(1980));小鼠支持细胞(tm4,mather,biol.reprod.23:243-251(1980));猴肾细胞(cv1atccccl70);非洲绿猴肾细胞(vero-76,atcccrl-1587);人宫颈癌细胞(hela,atccccl2);犬肾细胞(mdck,atccccl34);水牛鼠肝细胞(brl3a,atcccrl1442);人肺细胞(w138,atccccl75);人肝细胞(hepg2,hb8065);小鼠乳腺肿瘤(mmt060562,atccccl51);tri细胞(mather等人,annalsn.y.acad.sci.383:44-68(1982));mrc5细胞;fs4细胞;和人肝癌细胞系(hepg2)。宿主细胞用上述表达或克隆载体转化用于肽接头产生,并在常规营养培养基中培养,所述培养基被修饰为适于诱导启动子,选择转化子或扩增编码所需序列的基因。用于产生本公开的接头肽的宿主细胞可以在多种培养基中培养。可商购的培养基诸如ham'sf10(sigma),最低必需培养基((mem),(sigma),rpmi-1640(sigma)和dulbecco'smodifiedeagle'smedium((dmem),sigma)适合于培养宿主细胞。此外,ham等人,meth.enz.58:44(1979),barnes等人,anal.biochem.102:255(1980),美国专利nos.4,767,704;4,657,866;4,927,762;4,560,655;或5,122,469;wo90/03430;wo87/00195;或美国专利re.30,985中描述的任何一种培养基均可用作宿主细胞的培养基。任何这些培养基都可以根据需要补充激素和/或其他生长因子(如胰岛素,转铁蛋白或表皮生长因子),盐类(如氯化钠,钙,镁和磷酸盐),缓冲液(如hepes),核苷酸(如腺苷和胸苷),抗生素(如庆大霉素),微量元素(定义为通常以微摩尔范围内的最终浓度存在的无机化合物),以及葡萄糖或等效能源。还可以以本领域技术人员会了解的适当浓度包括任何其他必需的补充剂。培养条件,诸如温度、ph等,是先前与选择用于表达的宿主细胞一起使用的那些,并且对于普通技术人员是显而易见的。使用微孔板荧光分光光度计足以检测的荧光信号可以通过低至300nm的本公开的这些fret构建体产生。可以实时追踪荧光信号变化以反映fap酶活性。实时监测在反应进行时测量信号变化,并允许快速数据收集并在各种条件下产生关于反应动力学的信息。fret比率变化和切割程度可以是相关的,例如对于某些荧光分光光度计使用诸如hplc分析的方法以便将来自fret比率的动力学常数的单位与底物浓度相关联。本公开的方法是高度灵敏的,因此,可以直接用于检测环境样品中的痕量fap酶或fap酶活性。因此,本公开还提供了一种直接使用环境样品进行毒素检测和鉴定的方法。本公开还提供了使用上述体外系统筛选fap抑制剂的方法。由于其高灵敏度、快速读出和易于使用,基于本公开的体外系统也适用于筛选fap抑制剂。具体地,在候选抑制剂物质存在的情况下,将本公开的fret构建体暴露于fap,并监测fret信号的变化以确定候选物是否抑制fap的活性。在这些检测fap酶活性或筛选推定抑制剂的方法中,可以使用基于细胞的系统,其中本公开的fret构建体在细胞内或细胞表面上表达,然后将细胞暴露于怀疑含有fap酶活性的样品。然后监测fret信号的变化,作为fap酶活性的存在/不存在或浓度的指示。具体地,fret信号的增加指示样品含有fap酶活性。类似地,表达fret构建体的细胞可以在候选抑制剂物质存在的情况下暴露于fap,并且监测fret信号的变化以确定候选物是否抑制fap的酶活性。在这些方法中,荧光检测和分析可以使用例如光子计数落射荧光显微镜系统(包含适当的二向色镜和多个滤光片用于监测特定范围的荧光发射)、光子计数光电倍增器系统或荧光计来进行。可以用适当地过滤的用于在所需范围内激发的氩离子激光、高强度汞(hg)弧光灯、光纤光源或其它高强度光源进行激发以启动能量转移。对于本领域技术人员显而易见的是,可以通过结合光电倍增器装置来增强激发/检测装置以增强检测灵敏度。例如,双光子互相关方法可用于实现单分子量级的检测(见例如,kohl等人,proc.natl.acad.sci.,99:12161,2002)。本公开还提供了包含本公开的fret构建体和载体的组合物。出于成像、诊断和/或治疗纤维化或纤维化相关疾病或病症的目的,可以将这些组合物施用至需要这种治疗的患者,其中所述组合物可以包含本公开的一种或更多种fret构建体。在进一步的实施方案中,这些组合物可以包含fret构建体与其他治疗剂的组合。因此,该制剂是包含药学上可接受的载体的治疗制剂。可以通过将具有所需纯度的构建体与一种或多种任选的药学上可接受的载体混合(remington'spharmaceuticalsciences第16版,osol,a.ed.(1980)),以冻干制剂或水溶液的形式制备本公开的fret构建体的药物制剂。此类药物制剂可用于施用至受试者,用于诊断或成像具有fap酶活性的细胞或组织。一般地,药学上可接受的载体在所采用的剂量和浓度对接受者是无毒的,并且包括但不限于缓冲剂,诸如磷酸盐、柠檬酸盐、乙酸盐和其它有机酸;抗氧化剂,包括抗坏血酸和蛋氨酸;防腐剂(诸如十八烷基二甲基苄基氯化铵;氯化六甲双铵;苯扎氯铵;苄索氯铵;苯酚、丁醇或苯甲醇;对羟基苯甲酸烃基酯,诸如对羟基苯甲酸甲酯或丙酯;邻苯二酚;间苯二酚;环己醇;3-戊醇;和间甲酚);低分子量(少于约10个残基)多肽;蛋白质,诸如血清白蛋白、明胶或免疫球蛋白;亲水性聚合物,诸如聚乙烯吡咯烷酮;氨基酸,诸如甘氨酸、谷氨酰胺、天冬酰胺、组氨酸、精氨酸或赖氨酸;单糖、二糖和其它碳水化合物,包括葡萄糖、甘露糖或糊精;螯合剂,诸如edta;糖类,诸如蔗糖、甘露醇、海藻糖或山梨醇;成盐反离子,诸如钠;金属配合物(例如zn-蛋白质配合物);和/或非离子表面活性剂,诸如聚乙二醇(peg)。本文中的示例性的药学上可接受的载体进一步包括间质药物分散剂诸如可溶性中性-活性透明质酸酶糖蛋白(shasegp),例如人可溶性ph-20透明质酸酶糖蛋白,诸如rhuph20(baxterinternational,inc.)。某些示例性shasegp及使用方法,包括rhuph20,描述于美国专利公布no.2005/0260186和2006/0104968。在一个方面,将shasegp与一种或更多种另外的糖胺聚糖酶诸如软骨素酶组合。本公开还提供包含至少一种本公开的fret构建体的测定装置、试剂盒和制品。制品可包含可用于纤维化或纤维化相关疾病或病症的检测、成像、诊断或治疗的材料。侧向流动测定装置提供现场检测(point-of-caredetection)和/或诊断纤维化,特别是来自血液或血清样品的纤维化。制品包括容器和在容器上或与容器相联合的标签或包装插页。合适的容器包括例如瓶、小瓶、注射器等。所述容器可以由多种材料诸如玻璃或塑料形成。该容器容纳有效用于检测,成像或治疗纤维化的组合物,并且可具有无菌存取口(例如,容器可以是具有由皮下注射针可穿过的塞子的静脉内溶液袋或小瓶)。组合物中的至少一种活性剂是本公开的fret构建体。标签或包装说明书指示该组合物用于检测或治疗纤维化。标签或包装说明书可进一步包含,例如,在患者的测试或治疗中,使用该组合物的说明书。备选地,制品可以进一步包含第二容器,其包含药学上可接受的缓冲液,诸如抑菌性注射用水(bwfi)、磷酸盐缓冲盐水、林格氏(ringer's)溶液和葡萄糖溶液。它可以进一步包括从商业和用户观点看期望的其它材料,包括其它缓冲剂、稀释剂、过滤器、针头和注射器。还提供了可用于各种目的的试剂盒,例如用于纤维化细胞或肿瘤细胞杀伤试验、用于纯化或从细胞中免疫沉淀fap酶。为了分离和纯化fap蛋白,试剂盒可含有与珠子偶联的接头肽(例如琼脂糖珠)。可以提供包含本公开的fret构建体的试剂盒,用于体外检测和定量fap酶。与制品一样,该试剂盒包含容器和在容器上或与容器相联合的标签或包装插页。容器容纳包含至少一种本公开的fret构建体的组合物。可以包括额外的容器,其含有例如稀释剂和缓冲剂,或对照酶或肽构建体或fret构建体。标签或包装说明书可提供组合物的描述以及预期的诊断、成像、检测或治疗用途的说明。本公开的fret构建体也可以作为测定装置的一部分提供。这种测定装置包括侧向流动测定装置。常见类型的一次性侧向流动测定装置包括用于接收液体样品的区或区域、缀合区和反应区。这些测定装置通常称为侧向流动测试条。它们使用多孔材料,例如硝酸纤维素,限定了能够支持毛细管流动的流体流动路径。实例包括美国专利no.5,559,041,5,714,389,5,120,643和6,228,660描述的那些,这些专利都通过引用整体并入本文。本公开的接头肽或寡肽还可以与检测技术结合使用在侧向流动测定装置中,所述检测技术使用来自在一个便携式现场护理装置上测试的受试者或患者的单个生物样品。另一种类型的测定装置是无孔测定装置,其具有诱导毛细管流动的突起。此类测定装置的实例包括pct国际公布号wo2003/103835、wo2005/089082、wo2005/118139和wo2006/137785中公开的开放侧向流动装置,所有这些公开均通过引用以其整体并入本文。本文提供的fret构建体可用于检测生物样品中fap酶活性的存在。如本文所用的术语“检测”涵盖定量或定性检测。在某些实施方案中,生物样品包含细胞或组织,例如来自脑、乳腺、结肠、肾、肝、肺、卵巢、胰腺、前列腺、骨骼肌、皮肤、小肠、胃或子宫的细胞或组织,还包括这些器官的细胞或组织肿瘤。因此,本公开提供了用于治疗哺乳动物的纤维化或纤维化相关疾病或病症或减轻纤维化的一种或多种症状的方法,包括向哺乳动物施用治疗有效量的本公开的治疗组合物。治疗组合物可以按照医学专业人员的指示短期(急性地)或长期地或间歇地施用。还提供了抑制fap酶表达细胞生长和杀死fap酶表达细胞的方法。还考虑了本公开的fret构建体,其用于诊断或检测方法。在另一方面,提供了检测生物样品中fap酶活性的存在的方法。该方法可包括使来自受试者的生物样品,任选地与对照样品,与本文所述的本公开的fret构建体在允许fap酶切割接头肽的条件下接触,并检测fret构建体发出的荧光。这种方法可以是体外或体内方法。在一个实施方案中,本公开fret构建体用于选择适合用抗纤维化或抗癌疗法治疗的受试者,例如,其中fap酶活性是选择患者的生物标志物。可以使用本公开的fret构建体诊断的示例性病症包括与fap或fap酶活性的表达相关的病症,例如纤维化、癌症和某些炎性病况。在一个方面,提供了诊断受试者的疾病的方法,该方法包括向受试者施用有效量的诊断剂,该诊断剂包含允许检测fap酶活性的本公开的fret构建体。本公开的示例性诊断方法包括从哺乳动物受试者获得生物样品,通过使样品的一部分与本公开的fret构建体接触来检测样品中是否存在fap酶活性,照射样品,检测由fret构建体的fap切割产生的荧光;当在样品中检测到由fap酶活性产生的荧光时,诊断该受试者患有纤维化相关疾病或病症。包含本公开的fret构建体的任何fret构建体或药物制剂也可用于治疗方法。本公开的示例性治疗方法包括从人受试者获得生物样品;通过使样品的一部分与本公开的fret构建体接触来检测样品中是否存在fap酶活性,照射样品,检测由frap构建体的fap切割而产生的荧光,通过比较由所述分子构建体的fap切割而产生的荧光与所述纤维化相关疾病或病症中的fap酶活性的参考水平来诊断该受试者患有纤维化相关疾病或病症,其中与所述参照水平相比,所述样品中统计学上相等或更高水平的fap酶活性指示所述受试者中的纤维化相关疾病或病症;并且,对诊断的受试者施用有效的疗法。用于这些治疗方法的合适疗法可包括施用fap酶活性抑制剂,例如抗fap酶抗体,其可包括双特异性抗体和/或抗体药物缀合物(adc)。本公开的fret构建体可用于诊断、成像或治疗以fap表达为特征的疾病,特别是以与相同细胞类型的正常组织相比fap异常表达(例如,过表达,或在细胞或组织中以不同模式表达)为特征的疾病。与相同细胞类型的非肿瘤组织相比,fap在许多人肿瘤中异常表达(例如过表达)。因此,本公开的fret构建体在肿瘤的检测、成像和治疗中特别有用。本公开的fret构建体可用于治疗表达fap和具有fap酶活性的任何组织,包括肿瘤组织。可以使用本公开的fap构建体诊断并随后治疗的特定恶性肿瘤包括例如肺癌、结肠癌、胃癌、乳腺癌、头颈癌、皮肤癌、肝癌、肾癌、前列腺癌、胰腺癌、脑癌、骨骼肌癌。可以使用本公开的fret构建体检测或诊断的纤维化相关疾病或病症包括纤维化肝病,例如非酒精性脂肪性肝炎(nash)、酒精性脂肪性肝炎(ash)、病毒性肝炎(肝炎病毒)、酒精性肝病、脂肪肝病、原发性胆汁性肝硬化、原发性硬化性胆管炎、α-1抗胰蛋白酶缺乏症、血色素沉着症、威尔逊病、自身免疫性肝炎和肝硬化。另外,可以使用本公开的fret构建体检测或诊断的非肝纤维化疾病包括慢性胰腺炎、囊性纤维化、特发性肺纤维化、放射诱导的肺损伤、心房纤维化、心内膜心肌纤维化、心肌梗塞、神经胶质瘢痕、动脉僵硬、关节纤维化、克罗恩病、纵隔纤维化、骨髓纤维化、peyronie病、肾原性系统纤维化、进行性大量纤维化、腹膜后纤维化、硬皮病、系统性硬化、类风湿性关节炎、骨关节炎、动脉粥样硬化、系统性红斑狼疮、纤维肌痛、舍格伦综合征、抗磷脂综合征、重症肌无力、多发性硬化和肾小球硬化。这些纤维化相关疾病或病症可包括胰岛素抵抗相关疾病,诸如2型糖尿病或多囊卵巢综合征。纤维化相关疾病或病症也可以是实体肿瘤,例如肝细胞癌、胰腺导管癌、肾癌、胃肠癌、卵巢癌、乳腺癌、肺癌、结肠直肠癌、前列腺癌、子宫内膜癌、膀胱癌、肾癌或甲状腺癌。在这些方法中,从受试者收集的生物样品可以是全血、血清、血浆、滑液、来自脑、乳腺、结肠、肾、肝、肺、卵巢、胰腺、前列腺、骨骼肌、皮肤、小肠、胃或子宫的细胞或组织。使用本公开的fret构建体进行成像的示例性方法包括通过向受试者施用本公开的fret构建体并通过体内成像检测来自分子构建体的荧光,在受试者中成像fap表达组织。在这些成像方法中,fret构建体可包含近红外荧光(nirf)荧光团。在这些方法中,可以使用nirf成像、荧光反射成像(fri)、荧光介导的断层摄影(fmt)或其任何组合进行体内成像。在这些成像技术中,fap表达组织可以是实体肿瘤,并且该方法可以进一步包括在体内成像后切除肿瘤。类似地,fap表达组织可以是器官内的纤维化组织,并且该方法可以进一步包括在体内成像后切除器官的肿瘤纤维化部分。在本公开的相关成像方法中,通过向受试者施用本公开的fret构建体并通过离体成像检测来自fret构建体的荧光来将受试者中fap表达组织成像。离体成像可包括从受试者切除的组织的低分辨率成像。备选地或另外地,离体成像可包括来自受试者的组织切片的原位酶谱法。在另一方面,提供了本公开的fret构建体,其用作药物。在其他方面,提供了本公开的fret构建体,其用于治疗以fap表达或fap酶活性为特征的疾病。还提供了本公开的fret构建体,其用于治疗方法。在另一方面,本公开提供了本公开的fret构建体在制造或制备药物中的用途。该药物可用于检测或诊断以fap或fap酶活性表达为特征的疾病。本说明书中引用的所有专利和参考文献均通过引用整体并入本文。实施例a.实验程序除非另有说明,否则这些实施例中提及的市售试剂根据制造商的说明使用。某些试剂的来源如下所述:这些实施例中提到的重组蛋白-人脯氨酰寡肽酶(prep,4308-se),dppiv(1180-se),dpp9(5419-se)和dppii/dpp7(3438-se)蛋白购自r&dsystems。人dpp8(bml-se527)蛋白购自enzolifesciences。含有细胞外结构域(分别为残基l26-d760和l26-d761)的n-末端8his标记的人和小鼠fap蛋白通过固定化金属亲和层析(imac),然后进行尺寸排阻层析(sec),从瞬时转染的cho细胞的条件培养基中纯化。这些实施例中提到的抑制剂-fap特异性抑制剂(s)-n-(2-氰基-4,4-二氟吡咯烷-1-基)-2-氧代乙基)-喹啉-4-甲酰胺(化合物60或cpd60)根据jansen等(jmedchem57:3053-74)报道的实验方法合成。prep特异性抑制剂kyp-2047购自sigma-aldrich(st.louis,mo)。体内研究-除非另有说明,否则将小鼠在21℃下在标准12小时光照/12小时黑暗循环中维持在无病原体的动物设施中,可随意接近正常食物(labdiet5010)和水。先前描述了fapko小鼠的产生(dunshee,等人(2016)jbiolchem291:5986-96)。对于体内药理学fap抑制,c57bl/6背景小鼠自由采食对照食物(td.00588,envigo,madison,wi)(2016)jbiolchem291:5986-96)或含有100ppmcpd60的相同饮食。血浆和血清-小鼠血浆样品在k3-edtaminicollect管(greinerbio-one,450475)中制备,并在分析前立即在-80℃冷冻。人血清样品获自健康供体或购自discoverylifesciences,inc.(lososos,ca)。fapelisa-血清fap浓度使用人fapduosetelisa试剂盒(r&dsystems,dy3715)根据制造商的方案测量。荧光共振能量转移(fret)-猝灭测定-合成(anaspec,inc.)c-末端人fgf21切割位点(vgpsqg)侧翼区域的肽或在p2(vapsqg)上具有d-丙氨酸的变体,含有胺末端供体(用于apnirf的hylitefluor488或cy5.5)和与补充性c末端赖氨酸缀合的暗猝灭剂-受体(用于apnirf的qxl520或qsy21)。如上产生另外的肽,残基序列如图1所示。anpfap(bioconjugatechem23:1704-11)和apnirf由cpcscientific(sunnyvale,ca)合成。测定在37℃,50mmhepes(ph7.2),150mmnacl,1mmedta,0.1mg/mlbsa中进行。对于anpfap和apnirf,切割肽的激发/发射波长为490/520nm或675/695nm。在动态模式下在tecanm1000pro读板器上监测荧光。除非另有说明,否则用6μm的肽底物浓度和测定缓冲液中10倍稀释的血清或血浆进行血清或血浆fap活性的测量。酶动力学-使用5nm人或小鼠重组fap,使用一系列肽底物滴定进行michaelis-menten动力学测量。使用magellan软件在tecanm1000pro板读数器上测定底物水解的初始速率,并使用graphpadprism软件使用非线性回归分析对动力学参数进行建模。从三次实验重复计算标准差。活性位点滴定-将紧密结合的fap抑制剂cpd60滴定到使用100nm小鼠或人重组fap和6μm的gp的gp肽切割反应中。针对人和小鼠fap内肽酶活性的cpd60的ic50先前确定为<0.5nm(dunshee,etal.(2016)jbiolchem291:5986-96)。如copeland((2000)enzymes:apracticalintroductiontostructure,mechanism,anddataanalysis,2nded.,j.wiley,newyork)所述,活性酶浓度由x-截距确定。统计学-未配对斯氏t检验(双尾)用于统计分析以比较处理组。p值<0.05被认为是统计学显著的。除非另有说明,否则所有值均以平均值±sem表示。b.结果基于fgf21的猝灭荧光肽由fap和prep切割。合成含有围绕人fgf21的c-末端附近的fap切割位点的6个氨基酸残基的肽,称为“gp”探针(图1)用于监测fap内肽酶活性的目的。该肽的侧翼是fret供体(hylitefluor488)和暗猝灭剂(qxl520)。通过设计,荧光强度由于猝灭剂染料与供体荧光团的紧密接近而受到抑制,并且其通过肽的蛋白酶催化的切割而释放。作为对照,还生成了含有p1脯氨酸被甘氨酸取代的变体肽(“gg”探针)或鼠fgf21的同源区域(“ep”探针)。两种对照探针都缺乏基于fap的切割所必需的gly-pro共有序列,因此用作阴性对照(图1)。这三种肽用于评估野生型(wt),杂合的和fap缺陷的(ko)小鼠血浆中的fap内肽酶活性。我们先前已经通过免疫印迹分析证明,fap存在于wt小鼠的血浆中,在杂合子中较低程度,在ko小鼠中检测不到(dunshee,等人(2016)jbiolchem291:5986-96).。当使用gp探针时,来自wt小鼠的血浆产生强信号,表明探针的有效切割(图2a)。如所预期的,来自fap杂合小鼠的血浆显示出来自wt小鼠的血浆的大约一半的活性,并且来自纯合fapko小鼠的血浆显示甚至更低的但显著的活性。当使用gg和ep探针测试来自wt小鼠的血浆时,分别得到了无信号和非常小的信号。此外,纯化的重组小鼠fap蛋白切割gp但不切割gg或ep探针(图a2)。fapko小鼠血浆切割gp探针的能力以及程度要小得多的能力,ep探针,而非gg探针,表明血浆中存在其他脯氨酸特异性内肽酶。尽管脯氨酰内肽酶(prep)主要是细胞溶质酶,但其已知在血浆中以可变水平存在,并且似乎是通过ko血浆的残留探针切割的来源的可能候选者。实际上,当测试1nm的重组人fap或prep时,两种酶都容易切割gp肽,同时使突变gg肽保持完整(图2b)。为了进一步研究在gp探针的切割中prep的参与,我们使用了fap选择性抑制剂cpd60(dunshee,etal.(2016)jbiolchem291:5986-96)和prep选择性抑制剂kyp-2047(venalainen,等人,(2000)biochemicalpharmacology71:683-92)。以提供每种酶的选择性抑制的浓度测试两种抑制剂(图2c)。使用这些抑制剂,我们发现fapko样品中残留的gp探针切割活性对kyp是敏感的,但对cpd60不敏感(图2d)。同时,wt或杂合样品中的gp探针活性对cpd60明显敏感。总之,我们得出结论,fap是负责切割血浆中gp探针的主要酶,而prep具有较小但显著的贡献。p2d-ala取代对fap切割动力学的影响。先前已经显示fap耐受在基于α2ap的肽底物中在位置p2上的共有甘氨酸向d-丙氨酸的变化,尽管观察到由于kcat的大约8倍的减少,相对于亲本肽的较弱的催化效率。在fap抑制剂的背景下,据报道这种取代赋予fap优于prep的特异性(poplawski,等人(2013)jmedchem56,3467-377)。为了试图增加我们的测定的特异性,我们将这种取代掺入到基于fgf21的gp肽中以产生“ap”探针(图1)。对于用于诊断目的实际用途的活性探针,重要的是该变化不会对酶动力学产生强烈的负面影响。因此,我们使用人和小鼠fap蛋白比较了gp和ap肽的michaelis-menten动力学(图3a、3b和3d)。有趣的是,小鼠fap表现出比人fap更低的催化效率,主要是由于减少的kcat(图3a和3b)。仅从动力学数据来看,不清楚这是直向同源物之间的先天效率差异还是由于两种制剂之间活性酶浓度的差异。为了解决该问题,使用紧密结合抑制剂cpd60进行活性位点滴定(图3c)。我们发现小鼠fap的制备实际上具有较高的活性酶相对浓度,证实其本质上较弱的催化效率。因此,针对实验确定的活性酶浓度校正图3d中所示的动力学数据。km值在亲本(gp)和ap肽之间基本不变,并且我们观察到了ap切割的kcat中的预期的7至8倍的减少。p2d-ala取代提供fap特异性。受动力学数据的鼓舞,我们决定测试ap探针对prep和一组相关肽酶的特异性。使用1nm酶的浓度,可以清楚地检测到人fap对ap探针的切割,但不能检测到对gg探针的切割(图4a)。相反,人类prep无法消化任一探针。另外,人s9和s28肽酶的更广泛的组没有表现出切割ap探针的能力(图4b)。这与这些脯氨酰二肽基肽酶的内肽酶活性的普遍缺乏一致。已经报道了另一种针对fap的内部淬灭的fret肽底物(anpfap),并证明了其用作基于活性的体内成像工具(li,等人(2012)bioconjugatechem23,1704-1711)。肽序列含有两个对fap切割敏感内部gly-pro二肽基序,和cy5.5/qsy21(猝灭的fret对)。为了评估特异性,作者测试了anpfap在体外通过fap、dppiv和mmp-2进行的切割,但仅在fap存在下检测到切割。我们使用gp探针的经验使我们怀疑anpfap中的gly-pro基序也被prep识别。因此,合成了anpfap并测试通过重组人fap和prep的切割(图4c)。如所怀疑的,fap和prep均在体外有效切割anpfap。虽然目前尚不清楚在体内fap成像的背景下,prep或其他非特异性脯氨酰内肽酶活性有多少可能存在,但我们有兴趣看看如果用更适合体内成像的近红外荧光团(nirf)代替fret对,我们的ap探针是否会保留其特异性和fap可切割性。产生新的肽(apnirf),与ap相同,但fret供体和猝灭剂分别用cy5.5和qsy21替换。与anpfap相反,我们发现fap而非prep有效地切割apnirf(图4d)。最后,已经使用几种纯化的重组酶证明了特异性,我们回到如图2a所示的wt和fapko小鼠血浆的分析,但是使用ap探针。如所预期的,用wt血浆,用中间的杂合子血浆,ap探针显示清晰信号,并且令人满意地,用fapko血浆样品,ap探针显示没有切割(图4e)。此外,在从人血清中fap免疫耗竭后信号丢失,但在对照igg-免疫耗竭的血清中没有信号丢失(图4f)。ap探针在分析血液中fap活性中的诊断效用。以前,血清fap水平和活性已显示与肝纤维化相关。因此,我们决定确定我们是否可以通过基于ap探针的荧光测定来概括这些发现。我们从健康志愿者和已被诊断患有非病毒性肝硬化的个体获得血清样本。当比较这两组时,我们发现fap活性(通过使用ap探针的荧光强度测定)(图5a和5b)和fap水平(通过常规夹心elisa)(图5a和5c)的统计学显著增加。观察到的fap活性与fap蛋白水平良好相关(r2=0.76,p值<0.05),并且使用活性测定,我们能够容易地检测低至63ng/ml的水平(图5a)。我们接下来想确定新的基于ap的测定是否可用于确定体内fap抑制剂的药效学活性。为此,我们给小鼠饲喂含有fap抑制剂cpd60的食物或不含抑制剂的对照饮食(图6)。测定在cpd60饲喂开始后第4天和第7天分离的血浆中的fap活性。结果清楚地表明,cpd60饲喂可以完全抑制小鼠的循环fap活性。因此,我们得出结论,基于ap的测定法可用于选择性地评估fap抑制剂的药效学,而没有来自可能存在于血浆中的prep活性的干扰。nirf探针在分析组织中fap活性中的诊断效用。在遗传改造的胰腺癌小鼠模型,kraslsl.g12d/wt;p16/p19fl/fl;pdx1.cre,或缩写为“kpp”(singh,m.等人nat.biotechnol.28:585–593(2010);aguirre,a.j.等人genesdev.17:3112–26(2003))中研究了vapsqg-nirf探针用于组织fap活性成像的效用。已显示kpp小鼠品系自发地发展出超声可检测的胰腺肿瘤。已显示类似的小鼠品系(kraslsl.g12d/wt;tp53lsl.r172h/wt;pdx1.cre)在胰腺肿瘤基质中表达fap(feig,c.等人,procnatlacadsciusa.110:20212–17(2013))。vapsqg-nirf探针由cpcscientific(sunnyvale,ca)合成。在成像研究之前,基于体内超声扫描选择具有不同肿瘤体积的三只kpp小鼠(9.3周龄)。另外,还研究了三只健康的c57bl/6小鼠(8.3周龄)作为对照。在麻醉下通过尾静脉向每只小鼠静脉内施用在150微升pbs中稀释的1nmolvapsqg-nirf探针。在探针施用和安乐死之间未观察到与处理相关的副作用。4小时后,对小鼠实施安乐死并解剖胰腺组织。用pbs冲洗被解剖的组织,用卫生纸干燥,并放在黑纸上进行离体nirf成像。使用ccd相机(pearltrilogy,li-cor)获取近红外图像。在成功确认apnirf的体外的特异性后(图4d),研究了其用于离体成像的潜在用途。为此目的,我们使用kpp小鼠品系,其在胰腺肿瘤基质中表达fap,并且包括健康的c57bl/6小鼠作为对照。来自每组的3个胰酶的离体图像示于图7a,总形态示于左图,apnirf探针成像信号强度的热图表示示于右图。kpp组(下)相对于健康对照组具有增大的胰腺并且表现出强烈的荧光信号。归一化至成像区域的相对荧光强度的定量(图7b)显示kpp胰腺中更大的荧光(p<0.05),证明apnirf可成功地应用于fap的离体成像。c.讨论这些数据表明,本公开的新fret测定,基于含有d-ala-pro二肽的fgf21肽,提供了几个显著的进步。首先且是最主要的,该测定使得能够在没有免疫捕获或任何其他纯化步骤的情况下测量血清或血浆样品中的fap内肽酶活性,甚至对于含有相关s9蛋白酶(最值得注意的是prep)的样品。其次,由于其严格的特异性,fap的活性测定将替代更麻烦的夹心elisa,至少对于某些应用而言。实际上,我们观察到来自健康个体和肝硬化患者的人血清样品中fap活性和fap蛋白水平之间的非常好的相关性(图5)。这将为有兴趣确定不含fap抑制剂的样品中fap水平的研究人员节省时间和成本。最后,ap探针可以从常用的荧光染料和氨基酸合成而无需任何专门的方法。这意味着可以通过订制的合成需要从肽探针供应商处订购该探针。这增加了本公开的新测定方法的可及性、实践性和实用性。作为新测定的实际应用,我们证明了fap选择性抑制剂cpd60可以在体内使用来以在小鼠中以持续方式抑制循环fap的活性。我们先前通过推注p.o施用测试了这种化合物在食蟹猴中的作用并实现fap相关活性的短暂降低,这与该化合物从循环中快速清除一致(dunshee,等人(2016)jbiolchem291:5986-96)。因此,在这项研究中,我们测试了向小鼠饲喂含有cpd60的食物的策略,并使用ap探针追踪所得的药效学。结果表明,cpd60将小鼠的fap活性抑制至不可检测的水平。ap探针监测fap活性变化而不影响残留prep活性的能力使我们能够证明cpd60可以在我们测试的剂量下完全抑制fap。这种基于饲养的方法将促进fap在调节内肽底物(如α2ap和fgf21)中的作用,以及其在与fap有关的疾病中的作用的临床前研究总之,我们已经开发了一种fap内肽酶活性的独特的、可及的和特异性的同源测定。本文公开的测定法未来将促进fap生物学的临床前研究和fap抑制剂的临床开发或fap局部抗肿瘤治疗。本公开不限于本文描述的具体实施方案的范围,所述具体实施方案旨在作为本公开的个别方面的单独说明,并且功能上等同的方法和组分在本公开的范围内。实际上,除了本文所示和所述的那些之外,本公开的各种修改对于本领域技术人员而言将从前面的说明书和附图来看变得显而易见。这些修改旨在落入权利要求的范围内。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1