一种表达犬血清白蛋白融合干扰素γ的重组杆状病毒及其应用的制作方法
本发明涉及突变或遗传工程技术领域,具体是一种表达犬血清白蛋白融合干扰素γ的重组杆状病毒及其应用。
技术背景
干扰素(Interferon,IFN)是由病毒或者其他种类的干扰素诱导剂,刺激网状内皮系统、巨噬细胞、淋巴细胞以及体细胞所产生的一种糖蛋白。这种蛋白具有多种生物活性,包括抗增殖、免疫调节、抗病毒和诱导分化作用。根据特异性受体和序列同源性将干扰素分成I型和II型干扰素。IFN-γ是唯一的II型干扰素,也称为免疫干扰素。Young(1996)和Frucht(2001)提出,主要由CD4+Th1、CD8+细胞毒性T淋巴细胞和NK细胞分泌,有些B细胞、NKT细胞和APC细胞也可分泌IFN-γ。Cantin(1999)提出,虽然I型和II型干扰素在对病毒早期细胞应答都很重要,但是IFN-γ在免疫应答后期起关键作用并且建立了抗病毒的长效控制机制。综合来看,I型干扰素起到的抗病毒活性作用要优于它的免疫调节作用,II型干扰素-IFN-γ则被认为免疫调节作用要强于抗病毒作用。同时Chin(1996)提出,IFN-γ抗肿瘤活性要比I型干扰素强很多,通过刺激巨噬细胞、NK细胞、NKT细胞等先天免疫应答来发挥抗肿瘤作用,同时还可抑制肿瘤细胞的有丝分裂和增殖的作用。IFN-γ在抗病毒,抗肿瘤及免疫调节等方面发挥着重要作用,在临床有一定的应用价值。相对于人IFN-γ而言,动物IFN-γ的研究相对比较落后,基本停留在实验室的基因诱导与构建重组等阶段。尽管如此,郑仲金等(2007)研究表明IFN-γ作为疫苗佐剂或者治疗制剂表现出一定的效果。如对雏鸡急性新城疫、仔猪黄白痢、鸡传染性法氏囊等畜禽病毒性疾病效果明显;曹瑞兵等(2004)提出,猪重组IFN-γ能够对VSV起到有效 的抗病毒作用;许金俊(2004)提出,重组奶牛IFN-γ对试验性大肠埃希菌引起的乳房炎具有较好的预防和控制效果;Schijns(2002)提出,重组猫IFN-γ能增强猫疫苗抗体的产生;龙小海等(1999)提出,重组鸡IFN-γ能明显抵抗球虫的作用;龙小海等(1999)提出,重组的犬IFN-γ能作为佐剂辅助性治疗病毒性肠炎、乙肝、病毒性感冒等。各研究都表明IFN-γ对动物体疾病的预防和控制具有良好的应用前景。而且畜禽感染致病菌后主要依赖疫苗和抗生素。但抗生素的残留及引起细菌的耐药性等因素影响人类和动物的健康,而疫苗只是针对特定病原产生长期保护。所以汤一苇(1996)提出,干扰素制剂不仅能提高抗体对抗原的免疫应答水平,而且能诱导机体选择性的调节免疫系统,因此被称为免疫激素的细胞因子正逐渐作为佐剂用于研制。
随着干扰素类药物的广泛应用,其缺点不断暴露,半衰期短、稳定性差很大程度上限制干扰素的药用价值。长效干扰素的开发中采用了多种不同的方式,包括物理方法、化学方法和生物学方法。目前研究最为广泛的为生物学修饰法,其优势在于工业污染小、投入低、能够批量生产,并且有很大的优化改进空间。血清白蛋白融合技术是长效干扰素开发中最成熟的技术之一,Oborn(2002)首次采用人血清白蛋白制备融合干扰素蛋白,并以猴为试验动物,对其药效以及稳定性进行研究。目前该项技术已经在美国等国家被批准用于治疗丙型肝炎等慢性传染病。
犬类作为伴侣动物在人类生活中扮演的角色越来越重要,宠物医疗保健水平的也不断提高,病毒性疾病严重影响犬类健康。而干扰素蛋白与血清白蛋白融合表达的研究主要集中于人医临床,目前国内外尚未见到针对犬IFN-γ的相关研究。我们通过基因融合技术,将犬IFN-γ基因与犬血清白蛋白基因相融合,利用昆虫细胞杆状病毒表达系统,成功表达了CSA-IFNγ蛋白,并对其生物活性 性进行研究,为其在犬病毒性疾病的预防、免疫治疗及疫苗佐剂方面的应用奠定基础。
现有技术存在以下技术问题:
1.通过血清白蛋白与干扰素相融合来延长干扰素半衰期在人类医学研究较为深入,但兽医临床关于融合蛋白干扰素的研究及应用均比较少。目前临床上常用的犬免疫增强用干扰素为常规干扰素,多次反复注射会导致动物机体产生免疫耐受和其他不良反应,影响其治疗效果。
2.兽用干扰素制品大都采用原核表达方式,产物多为包涵体形式,制备方法复杂。纯化过程中需要变性、复性等过程,产物生物活性较差,药物疗效一般。
3.兽用干扰素制品在结构和功能上与天然蛋白差异大。
4.兽用干扰素制品的高水平表达蛋白质占细胞总蛋白量低。
5.兽用干扰素制品提纯困难。
技术实现要素:
本发明的目的是:
1)提供一种表达犬血清白蛋白融合干扰素γ的重组杆状病毒的基因片段,与现有技术不同的是,可翻译为如SEQ ID NO.1所示氨基酸序列,用于扩增其序列的上下游引物包含上游酶切位点EcoR I、上游酶切位点Hind III,具有如SEQ ID NO.2所示的犬血清白蛋白核苷酸序列、柔性linker序列和犬IFNγ成熟蛋白核苷酸序列;
2)提供一种利用所述的基因片段在构建表达犬血清白蛋白融合干扰素γ的重组杆状病毒的应用,与现有技术不同的是,本发明采用的载体质粒是pFastBacTM I,重组质粒是pF-CSA-IFNγ;
3)提供一种表达犬用血清白蛋白融合干扰素γ的重组杆状病毒及其应用,与现有技术不同的是,采用杆状病毒表达系统,表达出修饰合理、活性优、稳定性佳的犬血清白蛋白融合干扰素,为开发半衰期长、成本低、功效高的犬用血清白蛋白融合干扰素奠定基础;
4)提供了一种表达犬血清白蛋白融合干扰素γ的重组杆状病毒,与现有技术不同的是,可表达具有如SEQ ID NO.1所示氨基酸序列,以及所述的表达犬血清白蛋白融合干扰素γ的重组杆状病毒在制备增强免疫力药物中的应用,所述的免疫治疗药物为犬类免疫力增强的药物;
5)提供了一种含有表达犬血清白蛋白融合干扰素γ的重组杆状病毒的增强免疫力药物和一种含有表达犬血清白蛋白融合干扰素γ的重组杆状病毒的犬类免疫力增强的药物。
与现有技术相比,本发明具有以下优点:
1.本发明使用搭桥PCR技术,使基因的融合快捷方便,又可以避免酶切位点的引入干扰后续试验这个缺点;
2.本发明采用杆状病毒表达系统,该系统与细菌、酵母和哺乳动物细胞表达体系相比具有如下优点:
(1)重组蛋白具有完整的生物学功能,表达产物在结构及功能上更接近天然蛋白;
(2)能够进行翻译后加工修饰,使表达产物在结构上最大限度接近于天然蛋白;
(3)能够高水平表达蛋白质,可高水平获得重组蛋白,最高可达细胞总蛋白量的50%;
(4)能够使表达产物通过分泌形式进行表达,进一步简化了分离纯化工作。
与传统方法表达的犬干扰素相比较,本发明通过采用基因融合技术实现了犬血清白蛋白与犬γ干扰素的融合表达,且蛋白表达量高,活性好,为犬血清白蛋白融合干扰素的产品化创造了先决条件。犬γ干扰素具有抑制病毒复制、抗肿瘤、抗寄生虫及免疫调节等作用,作为一种重要的免疫增强剂,其在犬类病毒性疾病预防、免疫治疗及免疫佐剂方面应用前景广阔。
附图说明:
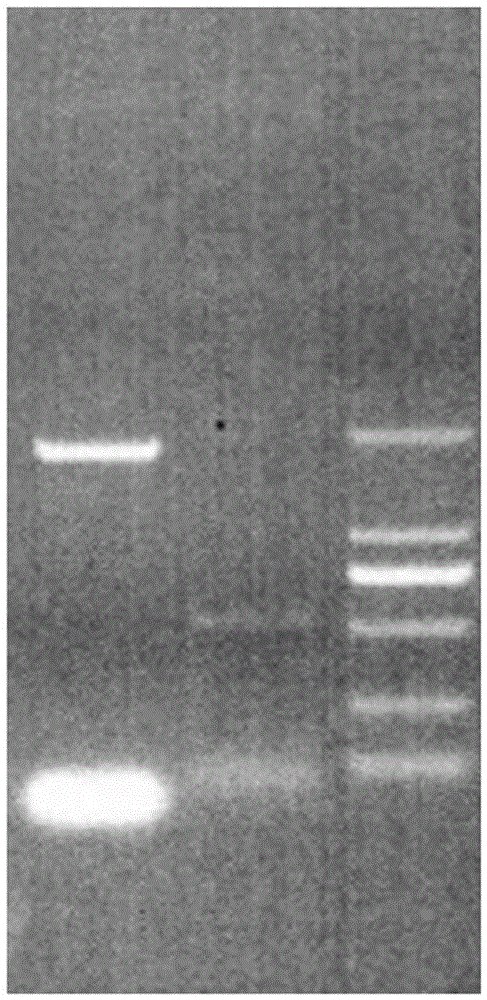
图1为犬血清白蛋白基因和犬γ基因PCR扩增图;
图2为犬血清白蛋白基因与犬IFNγ基因PCR融合图;
图3为pF-CSA-IFNγ重组质粒双酶切鉴定图;
图4为携带Bacmid-CSA-IFNγ重组杆状病毒质粒菌株的筛选;
图5为携带Bacmid-CSA-IFNγ重组杆状病毒质粒菌株的纯化;
图6为CSA-IFNγ融合蛋白表达情况监测;
图7为CSA-IFNγ融合蛋白纯化。
具体实施方式
下面结合附图,通过实施例对本发明内容作进一步详细说明,但不是对本发明的限制。
实施例
(一)犬CSA-IFNγ融合基因的制备:
根据犬血清白蛋白基因序列(GenBank登陆号为AB090854.1);以犬IFNγ基因序列(GenBank登陆号:EF095772.1)为原始序列,依据昆虫细胞表达系统密码子的偏嗜性,优化合成新的犬γ干扰素成熟肽核苷酸序列(该序列经南京金斯瑞生物科技有限公司优化合成),设计合成引物,引物序列见表1。
表1 PCR引物序列表
步骤一,犬血清白蛋白基因的扩增方法:
取0.5cm3的犬肝脏样品,十字研磨器冰浴研磨,将研磨液收集于1.5mL离心管,-20℃冻融3次后,12,000×g离心5min,收集上清液提取总RNA,操作步骤按照AxyPrep DNA/RNA提取制备试剂盒说明书进行。进行RT-PCR反应扩增犬血清白蛋白全基因序列:
1)取200μl犬肝脏研磨液,转入1.5mL离心管中;
2)加入200μl BufferV-L,漩涡振荡混合均匀,室温静置5min;
3)加入75μl BufferV-N,漩涡振荡混合均匀,12,000×g离心5min;
4)将上清转移到新的2mL离心管中,加250μl异丙醇(1%冰乙酸),上下倒置6-8次,混合均匀;
5)将制备管置于2mL离心管中,取步骤4中的混合液移入制备管中,6,000×g离心1min;
6)弃掉滤液,将制备管置回2mL离心管中,加500μl Buffer W1A,室温静置1min,12,000×g离心1min;
7)弃掉滤液,将制备管置回2mL离心管中,加800μl Buffer W2,12,000×g离心1min;
8)将制备管置回2mL离心管中,12,000×g离心1min;
9)将制备管置于洁净的1.5mL离心管中,在制备管中央加40-60μl Buffer TE(DNase&RNase-free),室温静置1min,12,000×g离心1min洗脱RNA。
反应体系见表2,反应条件如下:50℃ 30min;94℃ 3min;94℃ 30s,57.5℃ 30s,72℃ 2min,30cycles;72℃ 10min;4℃保存。
表2犬血清白蛋白(CSA)全基因序列RT-PCR反应体系
经1%琼脂糖凝胶电泳分析,获得大小为1827bp的目的片段,结果如图1所示。将目的片段切胶回收,具体方法参照DNA凝胶回收试剂盒(Omega)说明书进行。将目的片段连接至pMD18-T载体(方法按照Takara pMD18-T载体说明书进行)连接体系见表3。
表3犬血清白蛋白基因与pMD18-T载体连接体系
充分混匀后,16℃连接过夜。取30μl DH5α感受态细胞,冰浴融化,加入10μl连接产物,温和混匀,置于冰上30min,42℃热休克90s,冰浴2min,加入1ml无抗LB培养液,37℃ 220rpm/min培养50min,5000rpm/min室温离心5min收集菌体,将菌体涂布于LB氨苄抗性琼脂平板,37℃培养12h,挑取单菌落接种于LB氨苄抗性培养液37℃ 220rpm/min培养12h后,进行菌液PCR鉴定,筛选阳性菌株送北京睿博兴科生物技术有限公司测序鉴定。鉴定正确后采用AxyPrep质粒小量提取试剂盒制备重组质粒pMD-CSA。
步骤二,犬血清白蛋白基因(linker序列)与犬IFNγ成熟蛋白基因的融合:
分别利用自行设计的融合引物扩增CSA基因与IFNγ成熟蛋白基因,在PCR过程中成功引入上游酶切位点EcoR I、下游酶切位点Hind III、柔性linker序列(用于连接CSA基因与IFNγ成熟蛋白基因),并在基因序列末端加入6个组氨酸标签用于蛋白纯化,反应体系如表4和表5所示。
表4 CSA基因的扩增
CSA基因的扩增反应条件如下:94℃ 3min;94℃ 30s,57.5℃ 30s,72℃ 2min,15个循环。
表5 IFNγ成熟蛋白基因的扩增
CSA基因的扩增反应条件如下:94℃ 3min;94℃ 30s,57.5℃ 30s,72℃ 30s,15个循环。
将上述两个反应体系的反应体系的产物混合进行融合PCR,反应条件如下94℃ 3min;94℃ 30s,57.5℃ 30s,72℃ 3min,5个循环。取出后加入一定量的酶和引物,进行最终目的基因的扩增,体系如表6所示,反应条件如下94℃ 3min;94℃ 30s,57.5℃ 30s,72℃ 3min,15个循环;4℃保存。
表6 CSA-IFNγ基因的扩增
经1%凝胶电泳分析融合效果,电泳结果显示获得2316bp左右的目的片段,结果如图2所示。利用DNA凝胶回收试剂盒(Omega)回收目的片段,采用Mighty TA-cloning Kit试剂盒进行加A尾反应,反应体系如表7所示。
表7 CSA-IFNγ序列加“A”反应体系
65℃反应10min,反应液直接用于连接反应。取1μl加“A”后PCR产物至新的的1.5ml EP管中,加入1μl pMD20-T vector和3μl灭菌蒸馏水混匀,加入5μl Ligation Mighty Mix,轻轻混匀,16℃保温30min,加入50μl Competent Cells中进行转化,将菌体涂布于LB氨苄抗性琼脂平板,37℃培养12h,挑取单菌落接种于LB氨苄抗性培养液37℃ 220rpm/min培养12h后,进行菌液PCR鉴定,筛选阳性菌株送北京睿博兴科生物技术有限公司测序鉴定。鉴定正确后采用AxyPrep质粒小量提取试剂盒制备重组质粒pMD-CSA-IFNγ。
(二)表达CSA-IFNγ蛋白重组杆状病毒的构建:
步骤一,pF-CSA-IFNγ重组质粒的构建:
利用EcoR I和Hind III同时对pMD-CSA-IFNγ重组质粒和pFastBacTM I载体质粒进行处理,酶切体系如表8所示。
表8双酶切体系
酶切产物经1%琼脂糖凝胶电泳分析,结果显示分别获得4700bp左右的pFastBacTMI载体骨架和2300bp左右的CSA-IFNγ融合基因靶片段,结果如图3所示。采用DNA凝胶回收试剂盒(Omega)回收目的片段。利用T4 DNA连接酶将纯化回收的载体骨架与融合基因靶片段进行融合,连接体系见表9。
表9 CSA-IFNγ与pFastBacTMI连接
充分混匀后,16℃连接过夜。取30μl DH5α感受态细胞,冰浴融化,加入10μl连接产物,温和混匀,置于冰上30min,42℃热休克90s,冰浴2min,加入1ml无抗LB培养液,37℃ 220rpm/min培养50min,5000rpm/min室温离心5min收集菌体,将菌体涂布于LB氨苄抗性琼脂平板,37℃培养12h,挑取单菌落接种于LB氨苄抗性培养液37℃ 220rpm/min培养12h后,进行菌液PCR鉴定,筛选阳性菌株送北京睿博兴科生物技术有限公司测序鉴定。鉴定正确后采用AxyPrep质粒小量提取试剂盒制备重组质粒pF-CSA-IFNγ。
步骤二,表达CSA-IFNγ重组杆状病毒的构建:
将pF-CSA-IFNγ重组质粒转化至E.coli DH10Bac感受态细胞中,涂布于LB琼脂糖平板(含50μg/ml卡那霉素,7μg/ml庆大霉素,10μg/ml四环素,100μg/ml Bluo-gal,40μg/ml IPTG)进行DH10BacTM转化株的筛选。37℃培养 48h,进行蓝白斑筛选,结果如图4所示。挑取10个白色的单菌落,重新划线于新鲜LB琼脂糖平板(含50μg/ml卡那霉素,7μg/ml庆大霉素,10μg/ml四环素,100μg/ml Bluo-gal,40μg/ml IPTG),37℃过夜培养,结果如图5所示。挑取白色单菌落接种于LB液体培养基(含50μg/ml卡那霉素,7μg/ml庆大霉素,10μg/ml四环素),37℃220rpm/min培养24h,PCR鉴定出阳性菌株后,采用AxyPrep去内毒素质粒大量提取试剂盒制备Bacmid-CSA-IFNγ重组杆状病毒质粒。并将其转染至生长状态良好的SF9细胞中,转染步骤按照Invitrogen Cellfectin转染试剂盒说明书进行。
转染步骤按照Invitrogen Cellfectin转染试剂盒说明书进行,操作步骤如下:
1)将生长良好的SF9细胞接种于6孔细胞培养板中,27℃至少培养1h;
2)将1μg纯化的Bacmid-CSA-IFNγ重组杆状病毒质粒DNA加至100μl Grace培养基中,温和混匀;
3)完全混匀Cellfectin试剂,翻转混合5-10次,吸取6μl Cellfectin试剂加至100μl Grace培养基中,温和混匀;
4)将2)和3)中的液体温和混匀,室温孵育45min,在孵育过程中除去细胞中原有培养基并用Grace培养基清洗3次;
5)向孵育液中加入0.8ml Grace培养基,温和混匀后加至细胞培养板中,27℃培养5h。
6)弃去,向细胞中加入2ml SF900 II液(含双抗);
7)27℃潮湿条件培养72h或者直至能够看到病毒感染的现象,提取P1病毒株;
8)P1代病毒液中病毒粒子含量较低,需要将其接种于生长良好的SF9细胞进行P2代病毒扩增培养;
9)获得表达CSA-IFNγ重组蛋白的杆状病毒,命名为Baculovirus-C-γ
(三)CSA-IFNγ重组蛋白表达情况检测及蛋白纯化:
将重组病毒Baculovirus-C-γ接种于生长良好的SF9细胞,在感染后24h、48h、72h和96h收集细胞液,500×g离心5min去除细胞和较大的碎片,加入1/4体积5×SDS上样缓冲液,沸水浴煮沸10min,冰上放置5min,置于-20℃保存。对样品进行SDS-PAGE电泳分析,结果显示重组杆状病毒接种SF9细胞后24h目的蛋白开始表达,48h表达水平较高,72h开始出现较多的杂蛋白,结果如图6所示。结果表明重组蛋白可在杆状病毒系统中稳定的分泌表达,表达量较高,接毒后48h培养液中杂蛋白含量较少,故于接毒后48h收获表达产物更有利于CSA-IFNγ重组蛋白的纯化。
将SF9细胞悬浮培养于75cm2细胞培养瓶中并同时接种Baculovirus-C-γ,于接毒后48h收获细胞液,500×g4℃离心15min去除细胞和较大的碎片,采用BeyoGoldTM His-tag Purification Resin蛋白纯化试剂盒进行纯化,具体步骤按照产品说明书进行,结果如图7所示。
(四)重组干扰素蛋白的生物活性测定:
参考Wish-VSV法评价CSA-IFNγ的体外生物活性,但需要将Wish细胞替换为犬肾细胞MDCK。具体方法如下:将生长状态良好MDCK细胞培养于96孔细胞板中,37℃ 5%CO2恒温培养箱培养4~6h,直至细胞贴壁生长良好;将待测样品、标准品、对照分别培养基做4倍倍比稀释12个梯度,分别接种于培养在96孔板的细胞中,每孔100μl,37℃ 5%CO2恒温培养箱培养18~24h;弃掉96孔板中的上清液,用攻毒培养基稀释VSV病毒,攻毒剂量为100TCID50,每孔100μl,37℃ 5%CO2恒温培养箱培养24h后,倒置显微镜下观察病变情况。结果见表10。
表10干扰素体外活性测定结果
根据公式计算:IFN效价(IU/m1)=Pr×(其中Pr为标准品效价;Ds为待测样品的预稀释倍数;ES为待测样品相当于标准品半效价的稀释倍数;Dr为标准品预稀释倍数;Er为标准品半数稀释倍数)计算干扰素融合蛋白体外生物活性,结果为2.68IU/ml。
- 还没有人留言评论。精彩留言会获得点赞!