细胞层叠体的制造方法与流程
本发明涉及一种细胞层叠体的制造方法。
背景技术:
制造具有与活体内组织类似的结构的人工细胞组织的方法,例如在日本特开2002-335949号公报及日本专利第5113332号公报中公开。
在日本特开2002-335949号公报中公开了:在蜂窝结构体薄膜的两面培养细胞,得到了细胞的三维聚集体。即,在专利文献1中公开了:在蜂窝结构体薄膜的一个表面接种细胞并使其粘附于薄膜,接着,在另一表面接种细胞,在薄膜的两面培养了相同种类的细胞(肝细胞或心肌细胞)。
在日本专利第5113332号公报中公开了一种血脑屏障模型,其在被称为细胞培养插入物(cellcultureinsert)的过滤器器件的过滤器上表面配置了脑毛細血管内皮细胞层,在过滤器下表面配置了脑周细胞层,在培养板的底面配置了星形胶质细胞层。在本发明中,在将细胞培养插入物上下倒置的状态下,在过滤器上接种脑周细胞而进行培养之后,将细胞培养插入物设置于培养板内,并在细胞培养插入物内侧接种血管内皮细胞,由此在过滤器的两面形成有细胞层。
技术实现要素:
发明要解决的技术课题
为了得到替代动物实验的药物评价用或病情评价用的人工细胞组织,需要构建具有与活体内组织近似的结构及功能的细胞组织。从构建具有与活体内组织近似的结构及功能的细胞组织的观点出发,期望如专利文献1中的蜂窝结构体薄膜那样将开口率高的多孔膜设为细胞培养的脚手架,并在多孔膜的两面培养细胞。并且,也要求构建一种细胞层叠体,其根据人工细胞组织所模拟的活体组织,在多孔膜的两面分别培养不同种类的细胞,细胞的种类在两个细胞层中不同。
然而,在专利文献1中未具体地公开在蜂窝结构体薄膜的两面分别培养不同种类的细胞的方法。
另一方面,在专利文献2中公开了:在细胞培养插入物的过滤器的上表面及下表面分别培养不同种类的细胞的方法。然而,在该培养方法中使用的细胞培养插入物是transwell(注册商标)插入物,该过滤器是径迹蚀刻膜(tracketchedmembrane、te膜)。te膜通常开口率低(2%~20%左右),因此即使在te膜上放置细胞悬浮液,液体培养基也不易通过te膜而落下。从而,若是将具备te膜作为过滤器的细胞培养插入物,则能够在上下倒置的状态下在过滤器上接种细胞悬浮液而进行细胞培养。然而,在细胞培养插入物的过滤器中适用了如专利文献1中的蜂窝结构体薄膜那样开口率高的多孔膜的情况下,若在上下倒置的状态下在过滤器上接种细胞悬浮液,则导致液体培养基通过多孔膜的孔而落下,因此无法进行细胞培养。
本发明的实施方式根据上述情况而完成。
本发明的目的在于提供一种新型细胞层叠体的制造方法,并解决该问题作为课题。
用于解决技术课题的手段
用于解决上述课题的具体方法中包括以下方式。
[1]一种细胞层叠体的制造方法,其使用具有底部及从底部的外缘立起的侧壁部的容器、多孔膜、在与容器的内底面不接触的位置对置于内底面保持多孔膜的保持部件来制造在多孔膜的两面具备细胞层的细胞层叠体,该细胞层叠体的制造方法包括:多孔膜由保持部件保持为在与容器的内底面不接触的位置对置于内底面的状态,而且在重力方向上容器的底部在上方且多孔膜在下方的状态下,在与容器的内底面和多孔膜表面接触的液体培养基中培养第一细胞;及多孔膜由保持部件保持为在与容器的内底面不接触的位置对置于内底面的状态,而且在重力方向上容器的底部在下方且多孔膜在上方的状态下,在多孔膜的下侧表面上培养第一细胞,在多孔膜的上侧表面上培养第二细胞。
[2]根据[1]所述的细胞层叠体的制造方法,其中,在容器的内底面具有第一细胞不粘附的性质。
[3]根据[1]或[2]所述的细胞层叠体的制造方法,其中,保持部件具备:筒状部,其为在轴向的一端保持所述多孔膜的筒状部,并具有比容器的内径更小的外径,轴向的长度比容器的侧壁部的高度更短;及突出部,从筒状部的轴向的另一端向径向外侧突出,并悬挂在容器的所述侧壁部的边缘。
[4]根据[1]至[3]中任一项所述的细胞层叠体的制造方法,其中,多孔膜为具有蜂窝结构的多孔膜。
[5]根据[1]至[4]中任一项所述的细胞层叠体的制造方法,其中,多孔膜的材质为选自包括聚丁二烯、聚苯乙烯、聚碳酸酯、聚乳酸及聚乳酸-聚乙醇酸共聚物的组中的至少一种。
[6]根据[1]至[5]中任一项所述的细胞层叠体的制造方法,其中,多孔膜中至少培养细胞的表面由选自包括纤连蛋白、胶原蛋白、层粘蛋白、玻连蛋白、明胶、基底膜蛋白聚糖、巢蛋白、蛋白聚糖、骨桥蛋白、腱生蛋白、肾连蛋白、基底膜基质及聚赖氨酸的组中的至少一种包覆。
[7]根据[1]至[6]中任一项所述的细胞层叠体的制造方法,其中,第一细胞和第二细胞是不同种类的细胞,第一细胞和第二细胞两种细胞是选自包括实质细胞、间质细胞、肌细胞、成纤维细胞、神经细胞、内皮细胞、上皮细胞及分化为它们中的任一个的细胞的组中的两种细胞。
[8]根据[1]至[7]中任一项所述的细胞层叠体的制造方法,其中,第一细胞是平滑肌细胞或分化为平滑肌细胞的细胞,第二细胞是血管内皮细胞或分化为血管内皮细胞的细胞。
发明效果
根据本发明,提供一种新型细胞层叠体的制造方法。
附图说明
图1a是表示具有蜂窝结构的多孔膜的一例的立体图。
图1b是从上表面侧观察了图1a中的多孔膜的俯视图。
图1c是沿图1b中的多孔膜的c-c线的剖视图。
图2a是表示保持部件的一例的立体图。
图2b是表示将图2a中所示出的保持部件设置在培养容器中的状态的立体图。
图3是表示本发明的制造方法的一例的示意图。
图4是表示本发明的制造方法的一例的示意图。
图5是在实施例1中使用的多孔膜的显微镜图像。
图6是实施例1中的在多孔膜的两面形成的细胞层各自的荧光免疫染色图像。
图7是表示fitc-葡聚糖70的相对荧光强度的图。
图8是实施例2中的在多孔膜的两面形成的细胞层各自的荧光免疫染色图像。
图9是实施例2中的细胞层叠体的荧光免疫染色图像。
具体实施方式
以下,对本发明的实施方式进行说明。这些说明及实施例例示出实施方式,但并不限制本发明的范围。本发明中描述的作用机理包括推定,其正确与否并不限制本发明的范围。
在本发明中,使用“~”示出的数值范围表示将记载于“~”前后的数值分别作为下限值及上限值而包括的范围。
在本发明中提及组合物中的各成分的量的情况下,在组合物中存在多种相当于各成分的物质的情况下,除非另有说明,是指在组合物中存在的该多种物质的总量。
<细胞层叠体的制造方法>
本发明的细胞层叠体的制造方法是如下方法,即,在多孔膜的两面培养细胞而在多孔膜的两面形成细胞层,由此制造在多孔膜的两面具备细胞层的细胞层叠体的方法。
本发明的细胞层叠体的制造方法使用具有底部及从底部的外缘立起的侧壁部的容器、多孔膜、在与容器的内底面不接触的位置对置于内底面保持多孔膜的保持部件。以下,将上述容器称为“培养容器”。
本发明的细胞层叠体的制造方法使用培养容器、多孔膜及保持部件,在多孔膜的两面培养细胞,制造在多孔膜的两面具备细胞层的细胞层叠体。
首先,对本发明的制造方法中所使用的培养容器、多孔膜及保持部件进行说明。
[培养容器]
作为培养容器,例如可以举出培养皿、多培养皿或多孔板。培养容器的底部的形状例如是圆形、矩形或正方形。培养容器的材质例如是聚苯乙烯、聚碳酸酯、聚酯或玻璃。培养容器优选为透明性高。
培养容器的内底面优选为平坦。培养容器的内底面优选具有细胞不粘附的性质。从而,优选在培养容器的内底面上未实施电晕放电处理或蛋白质涂布处理。为了抑制细胞的粘附,培养容器的内底面可以由具有磷酸胆碱基的聚合物、聚乙二醇、水凝胶等包覆。培养容器的内侧面也优选与内底面相同地具有细胞不粘附的性质。
[多孔膜]
在本发明的制造方法中,多孔膜是细胞粘附并增殖的脚手架。本发明的制造方法中所使用的多孔膜在制造方法、材质、形状上并不受限制。
作为多孔膜的制造方法,可以举出:对树脂制膜实施蚀刻加工、喷砂加工或冲压加工而形成贯穿孔并作为多孔膜的制造方法;在日本专利第4734157号公报、日本专利第4945281号公报、日本专利第5405374号公报、日本专利第5422230号公报及日本特开2011-074140号公报中记载的、在含有聚合物及溶剂的涂膜中使水滴生长以形成贯穿孔的制造方法。
作为多孔膜的材质,可以举出聚丁二烯、聚苯乙烯、聚碳酸酯、聚酯(例如聚乳酸、聚己内酯、聚乙醇酸、聚乳酸-聚乙醇酸共聚物、聚乳酸-聚己内酯共聚物、聚对苯二甲酸乙二醇酯、聚萘二甲酸乙二醇酯、聚丁二酸乙二醇酯、聚丁二酸丁二醇酯、聚-3-羟基丁酸酯等)、聚丙烯酸酯、聚甲基丙烯酸酯、聚丙烯酰胺、聚甲基丙烯酰胺、聚氯乙烯、聚偏二氯乙烯、聚偏二氟乙烯、聚六氟丙烯、聚乙烯醚、聚乙烯咔唑、聚乙酸乙烯酯、聚四氟乙烯、聚内酯、聚酰胺、聚酰亚胺、聚氨酯、聚脲、多环芳烃、聚砜、聚醚砜、聚硅氧烷衍生物、纤维素酰化物(例如三乙酰纤维素、乙酸丙酸纤维素、乙酸丁酸纤维素)等聚合物。从通过在日本专利第4734157号公报等中记载的制造方法制造多孔膜的观点出发,优选为溶解于疏水性有机溶剂中的聚合物。从对溶剂的溶解性、光学物性、电物性、膜强度、弹性等观点出发,这些聚合物根据需要可以作为均聚物、共聚物、聚合物混合物或聚合物合金。这些聚合物可以单独使用一种,或者混合使用两种以上。
从自支撑性的观点出发,作为多孔膜的材质,优选为聚丁二烯、聚氨酯、聚苯乙烯、或聚碳酸酯,从容易维持细胞层的植入的观点出发,优选为聚乳酸、聚乳酸-聚乙醇酸共聚物或聚乳酸-聚己内酯共聚物。
从细胞的粘附性的观点出发,在多孔膜中至少被接种细胞的区域的表面优选由选自包括纤连蛋白、胶原蛋白(例如i型胶原蛋白、iv型胶原蛋白或v型胶原蛋白)、层粘蛋白、玻连蛋白、明胶、基底膜蛋白聚糖、巢蛋白、蛋白聚糖、骨桥蛋白、腱生蛋白、肾连蛋白、基底膜基质及聚赖氨酸的组中的至少一种包覆。作为基底膜基质,能够以市售品获得(例如matrigel(注册商标)、geltrex(注册商标))。在多孔膜中,孔内也优选由它们中的至少一种包覆。
多孔膜优选具有蜂窝结构。在本发明中蜂窝结构是指通过隔壁划分为多个贯穿孔的结构。
在本发明的多孔膜具有蜂窝结构的情况下,蜂窝结构的贯穿孔朝向多孔膜的主表面开口。在本发明的多孔膜具有蜂窝结构的情况下,可以层叠多个蜂窝结构。
在本发明中,蜂窝结构的贯穿孔的形状并不受限定。作为贯穿孔的形状,例如可以举出球体的一部分缺少的矢状面形状、料筒形状、圆柱形状或棱柱形状,多种形状可以混合存在。作为贯穿孔开口的形状,例如可以举出圆形、椭圆形或多边形,多种形状可以混合存在。在蜂窝结构中,相邻的贯穿孔彼此之间可以局部连通。
从提高形成于多孔膜上的细胞层的均质性的观点出发,在具有蜂窝结构的多孔膜中,贯穿孔优选规则地配置。规则的配置可以中断或存在偏离,但是优选在所有方向上无间隙地连续重复。
以下,参考附图对具有蜂窝结构的多孔膜的一实施方式进行说明。在各附图中,对相同或等同的构成要件及部分标注有相同的参考符号。在以下说明中,“长径”是指轮廓上的任意两点之间的距离中的最大长度,然而,在方向被确定的情况下,是指该方向的任意两点之间的距离中的最大长度。
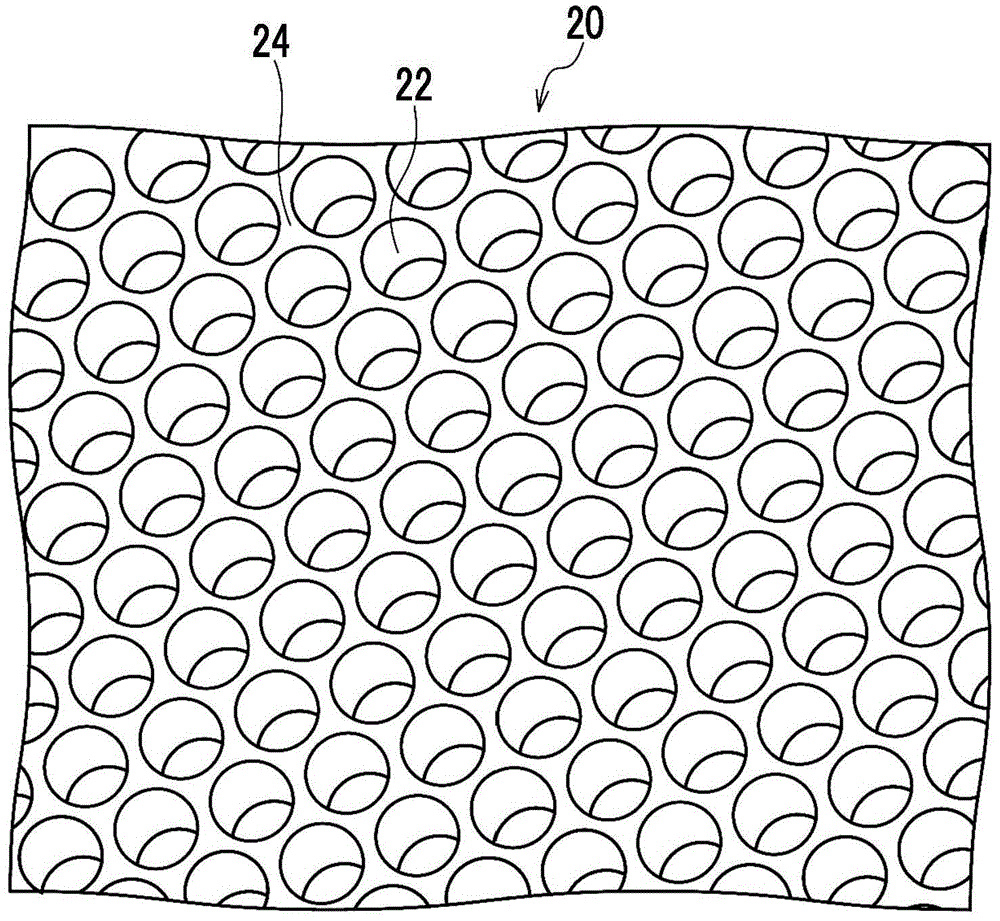
图1a~图1c中示出作为具有蜂窝结构的多孔膜的一例的多孔膜20。图1a是多孔膜20的立体图,图1b是从上表面侧观察了图1a中的多孔膜20的俯视图,图1c是沿图1b中的c-c线的多孔膜20的剖视图。
在多孔膜20中遍及主表面整个区域配置有贯穿孔22。然而,在多孔膜20中存在细胞不能接触的区域的情况下,在该区域可以不用配置贯穿孔22。在多孔膜20中,相邻的贯穿孔22彼此之间由隔壁24隔开。
贯穿孔22的配置是以平行六边形(优选为正六边形)或与其接近的形状作为单位,开口的中心位于这些图形的顶点及对角线的交点的配置。“开口的中心”是指主表面上的开口的二维图形的重心。
作为贯穿孔22的形状,例如可以举出球体的一部分缺少的矢状面形状、料筒形状、圆柱形状或棱柱形状。作为贯穿孔22的开口的形状,例如可以举出圆形、椭圆形或多边形。相邻的贯穿孔22彼此之间在多孔膜20的内部可以通过连通孔而连通。
以下,对多孔膜20的尺寸进行说明。
贯穿孔22的间距p1是相邻的开口的中心之间的距离。间距p1优选根据在多孔膜20上培养的细胞的大小而设定。间距p1例如为1μm~50μm。
开口直径da是贯穿孔22的开口的长径。开口直径da优选为被接种的细胞保留在多孔膜20上的大小。开口直径da相对于被接种的细胞的长径(例如10μm~50μm)例如为10%~150%。以进行红细胞的泄漏试验为目的,在构建血管壁模型的情况下,开口直径da优选为可以使红细胞通过的大小。从一个表面的细胞和另一表面的细胞接触(cell-cellcontact:细胞间接触)的观点出发,开口直径da优选不会过小。从多孔膜20的强度的观点出发,开口直径da优选不会过大。从这些观点出发,开口直径da优选为1μm~20μm,更优选为2μm~10μm,进一步优选为3μm~5μm。
开口直径da的变动系数优选为20%以下,越小越优选。开口直径da的变动系数越小,在多孔膜20上形成的细胞层的均质性越高。变动系数是关于某一组将标准偏差除以算术平均值的值,是表示该组的偏差程度的指标。在本发明中,用百分比来表示变动系数。
隔壁24的宽度w是在相邻的开口的中心之间测定的、隔壁24的宽度的长度。宽度w优选为被接种的细胞保留在多孔膜20上的宽度。
从物质渗透性和多孔膜的强度的观点出发,多孔膜20的开口率优选为30%~70%,更优选为35%~65%,进一步优选为40%~60%。多孔膜20的开口率是在俯视图中的主表面的面积(包括开口的面积)中所占的开口的总面积的比例,对一个表面及另个一表面分别进行计算。
从一个表面的细胞和另一表面的细胞接触(cell-cellcontact:细胞间接触)的观点出发,多孔膜20的膜厚优选不会过厚。从多孔膜20的强度的观点出发,多孔膜20的膜厚优选不会过薄。从这些观点出发,多孔膜20的膜厚优选为0.5μm~40μm,更优选为1μm~20μm,进一步优选为2μm~8μm。
多孔膜20的制造方法的详细内容例如记载于日本专利第4734157号公报、日本专利第4945281号公报、日本专利第5405374号公报、日本专利第5422230号公报及日本特开2011-074140号公报中。
在本发明的细胞层叠体的制造方法中,当多孔膜是细胞粘附而增殖的脚手架时,多孔膜的开口率越高,并且多孔膜的膜厚越薄,一个表面的细胞与另一表面的细胞之间的细胞间相互作用(cell-cellinteraction),即,由液性因子引起的信息传递及细胞间接触(cell-cellcontact)中的至少一种越激活。能够制造具有细胞培养时的细胞间相互作用越激活,与活体内组织越近似的功能的细胞层叠体。从该观点出发,作为在本发明的制造方法中使用的多孔膜,优选为具有蜂窝结构的多孔膜,多孔膜20为优选方式之一。
[保持部件]
保持部件是在与培养容器的内底面不接触的位置对置于内底面保持多孔膜的部件。
作为保持部件的材质,从透明性高、对液体培养基化学稳定、轻型等观点出发,优选为聚碳酸酯、聚苯乙烯、聚酯等树脂。
保持部件的形状并不受限制。保持部件例如具有保持多孔膜的部位和与培养容器接触的部位。作为保持部件,例如可以举出具备悬挂在培养容器的侧壁部的边缘的突出部的、线状部件、棒状部件及筒状部件等。
作为保持部件的方式例,可以举出如下部件,即,其具备在轴向的一端保持多孔膜的筒状部和从筒状部的轴向的另一端向径向外侧突出的突出部。以下,参考附图对本方式进行说明。
图2a中以具备多孔膜20(多孔膜的一例)的状态示出作为保持部件的一例的保持部件40。图2a是保持部件40的立体图。图2b是表示将具备多孔膜20的保持部件40设置于培养容器60(培养容器的一例)的状态的立体图。
保持部件40具备筒状部42和突出部44。在筒状部42的轴向的一端配置有多孔膜20。多孔膜20只要是至少堵塞筒状部42的一端的开口的大小即可。多孔膜20通过热压接、超声波焊接、激光焊接、粘附剂或双面胶带粘附于筒状部42的一端。或者,多孔膜20通过嵌入筒状部42的外表面的环状固定部件固定于筒状部42的一端。
筒状部42具有比培养容器60的内径更小的外径,并能够插入到培养容器60的内部(即,由底部62和侧壁部64限定的空间)。筒状部42的轴向长度比培养容器60的侧壁部64的高度更短,从而,多孔膜20不会与培养容器60的底部62接触。
筒状部42中壁在周向及轴向上连续。由此,在由多孔膜20和筒状部42限定的空间内能够容纳液体。然而,在突出部44的附近,在筒状部42的壁上可以设置有狭缝。筒状部42的内表面形状例如是圆柱形状、棱柱形状、圆锥台形状、棱锥台形状。
突出部44是筒状部42的轴向的一端的在与配置有多孔膜20的一端相反的一侧的一端,向筒状部42的径向外侧突出。突出部44例如在筒状部42的周向上,以约120°的间隔设置有三个。然而,突出部44的数量及形状并不限定于此。突出部44可以是在筒状部42的周向上连续的环状。
当保持部件40插入到培养容器60的内部时,突出部44以悬挂在培养容器60的侧壁部64的边缘的长度突出。保持部件40通过突出部44卡定于培养容器60的侧壁部64的边缘。
如图2a所示形状的培养器件通常被称为细胞培养插入物(cellcultureinsert)。
接着,对本发明的制造方法的工序进行说明。在本发明中“工序”的术语不仅包括独立的工序,而且即使在无法与其他工序明确地区分的情况下,只要可以实现该工序的所期望的目的,则也包括在该术语中。
本发明的细胞层叠体的制造方法包括下述工序(a)和工序(b)。图3是表示本发明的制造方法的一例的示意图,是用以说明工序(a)及工序(b)的示意图。在图3中,箭头g表示重力方向。
工序(a):在多孔膜2由保持部件4保持为在与培养容器6的内底面不接触的位置对置于内底面的状态、而且在重力方向g上培养容器6的底部在上方且多孔膜2在下方的状态下,在与培养容器6的内底面和多孔膜2的表面接触的液体培养基中培养第一细胞11。
工序(b):在多孔膜2由保持部件4保持为在与培养容器6的内底面不接触的位置对置于内底面的状态、而且在重力方向g上培养容器6的底部在下方且多孔膜2在上方的状态下,多孔膜2的下侧表面上培养第一细胞11,在多孔膜2的上侧表面上培养第二细胞12。
在本发明中“培养”不需要一定伴随细胞的增殖,无论有无增殖,只要维持细胞的生存则包括在该术语中。
在工序(a)中成为在重力方向g上培养容器6的底部在上方且多孔膜2在下方的状态。在工序(a)中,含有第一细胞11的细胞悬浮液以与培养容器6的内底面和多孔膜2的表面接触的方式配置于培养容器6与多孔膜2之间,在该状态下培养第一细胞11。通过在培养容器6的内底面与细胞悬浮液中所包含的液体培养基之间起作用的表面张力,液体培养基保持在多孔膜2上,并抑制液体培养基通过多孔膜2的孔而落下。从而,作为多孔膜2,能够将开口率高的多孔膜使用于细胞层叠体的制造中。多孔膜2优选由保持部件4保持为在培养容器6的内底面的附近相对于培养容器6的内底面平行或大致平行地对置的状态。多孔膜2与培养容器6的内底面的距离例如为0.5mm~10mm。
在工序(a)中,液体培养基中的第一细胞11因自重而向重力方向g移动,并粘附于多孔膜2。工序(a)是在多孔膜2上粘附并培养第一细胞11的工序。
作为工序(a)中的细胞培养的条件,可以适用通常的细胞培养条件。例如适用在温度37℃且5%(v/v)co2浓度的孵化器内的培养。培养期间优选为直至第一细胞11在多孔膜2上的粘附稳定为止的期间。
在工序(b)中成为在重力方向g上培养容器6的底部在下方且多孔膜2在上方的状态。在工序(b)中,在多孔膜2的下侧表面上培养第一细胞11,在多孔膜2的上侧表面上培养第二细胞12。在多孔膜2的下侧表面上培养的第一细胞11是在工序(a)中在多孔膜2的朝向培养容器6的内底面的一侧的表面上培养的第一细胞11,该细胞在工序(b)中被持续培养。
作为工序(b)中的细胞培养的条件,可以适用通常的细胞培养条件。例如适用在温度37℃且5%(v/v)co2浓度的孵化器内的培养。培养期间优选为直至在多孔膜2的两面细胞汇合为止的期间。例如能够通过基于光学显微镜的观察而判断细胞已汇合。在培养期间,可以进行培养基更换。
参考图4对本发明的制造方法的一实施方式进行说明。图4所示的实施方式是使用如图2b所示形状的培养器件的制造方法,图4的(1)~(5)分别对应于下述工序(1)~工序(5)。在图4中,箭头g是重力方向。根据包括工序(1)~工序(5)的实施方式,能够简单地实现本发明的制造方法。
工序(1):将包含第一细胞11的细胞的悬浮液置于培养容器6的内底面。
在工序(1)中,优选以与培养容器6的内侧面不接触的方式将细胞悬浮液置于内底面。这是为了防止在工序(3)中细胞悬浮液顺着培养容器6的内侧面落下。作为防止细胞悬浮液顺着培养容器6的内侧面落下的方式,此外还可以举出将多孔膜2的主表面的大小设为在整个圆周上与培养容器6的内侧面接触的大小。
在工序(1)中置于培养容器6的内底面的细胞悬浮液的量优选为相当于由培养容器6的内底面和多孔膜2夹住的空间的容积的量。第一细胞11的接种密度相对于多孔膜2的面积例如为1.0×103~1.0×106细胞/cm2。
工序(2):将具备多孔膜2的保持部件4设置于培养容器6,使多孔膜2接触到置于培养容器6的内底面的细胞悬浮液。
通过实施工序(2),成为含有第一细胞11的细胞悬浮液与培养容器6的内底面和多孔膜2的表面接触的状态(换言之,由培养容器6的内底面和多孔膜2的表面夹住细胞悬浮液的状态)。以下,在制造方法的说明中,将具备多孔膜2的保持部件4和培养容器6成为一体的器件称为“培养器件”。
工序(3):在重力方向g上培养容器6的底部在上方且多孔膜2在下方的状态下,在与培养容器6的内底面和多孔膜2的表面接触的液体培养基中培养第一细胞11。
以将具备多孔膜2的保持部件4设置于培养容器6的状态使培养器件上下倒置,接着,将培养器件静放于孵化器内,由此实现工序(3)。细胞悬浮液中所包含的第一细胞11因自重而在重力方向g上移动,并粘附于多孔膜2。
工序(4):在重力方向g上培养容器6的底部在下方且多孔膜2在上方的状态下,在多孔膜2的上侧表面接种第二细胞12。
从孵化器取出培养器件并再次倒置,接着,在多孔膜2上接种包含第二细胞12的细胞悬浮液,由此实现工序(4)。第二细胞12的接种密度例如为1.0×103~1.0×106细胞/cm2。第二细胞12的接种之前或接种之后,优选在第一细胞11侧追加液体培养基。
工序(5):在重力方向g上培养容器6的底部在下方且多孔膜2在上方的状态下,在多孔膜2的下侧表面上培养第一细胞11,在多孔膜2的上侧表面上培养第二细胞12。
紧接着工序(4),通过将培养器件静放于孵化器内而实现工序(5)。在工序(5)的期间,可以进行培养基更换。在第一细胞11及第二细胞12中的至少一种为干细胞的情况下,将分化诱导为目标体细胞的分化诱导因子添加到培养基。
经过工序(1)至工序(5)而得到细胞层叠体,该细胞层叠体具备:多孔膜2;配置于多孔膜2的一个表面并包含第一细胞11的细胞层;配置于多孔膜2的另一表面并包含第二细胞12的细胞层。
以下,对本发明的细胞层叠体的制造方法中所使用的细胞进行说明。
第一细胞和第二细胞可以是相同种类的细胞,也可以是不同种类的细胞。根据本发明的细胞层叠体所模拟的活体组织而选择细胞种的组合。
在本发明的制造方法的一实施方式,第一细胞和第二细胞是不同种类的细胞。第一细胞和第二细胞两种细胞例如是选自包括实质细胞(例如肝实质细胞或胰实质细胞)、间质细胞(例如周皮细胞)、肌细胞(例如平滑肌细胞、心肌细胞或骨格肌细胞)、成纤维细胞、神经细胞、内皮细胞(例如血管内皮细胞或淋巴管内皮细胞)、上皮细胞(例如肺泡上皮细胞、口腔上皮细胞、胆管上皮细胞、肠管上皮细胞、胰管上皮细胞、肾上皮细胞、肾小管上皮细胞或胎盘上皮细胞)及分化为它们中的任一种的细胞(例如祖细胞、间充质干细胞或多能干细胞)的组中的两种细胞。
作为用作第一细胞或第二细胞的多能干细胞,例如可以举出胚胎干细胞(embryonicstemcell;es细胞)、诱导性多能干细胞(inducedpluripotentstemcell;ips细胞)、胚胎生殖细胞(embryonicgermcell;eg细胞)、胚胎癌细胞(embryonalcarcinomacell;ec细胞)、多能成体祖细胞(multipotentadultprogenitorcell;map细胞)、成体多能干细胞(adultpluripotentstemcell;aps细胞)、muse细胞(multi-lineagedifferentiatingstressenduringcell:多谱系分化应激持久细胞)等。在本发明的制造方法的工序(b)中,将分化诱导为目标体细胞的分化诱导因子添加到培养基中,使多能干细胞分化为体细胞。
在本发明的制造方法中,将与第一细胞及第二细胞不同的不同种类的细胞(称为“第三细胞”。可以说1种,也可以是多种。)可以与第一细胞及第二细胞中的至少一种一同进行培养。由此,在多孔膜的单面或双面形成与第一细胞或第二细胞一同包含第三细胞的细胞层。例如第一细胞是实质细胞,第二细胞是间质细胞,第三细胞是神经细胞。
在本发明的制造方法中,根据所模拟的活体内组织来选择第一细胞和第二细胞的组合,还根据需要通过选择第三细胞而得到模拟了活体内组织的组织模型。在动物组织中,在一个细胞层与另一个细胞层之间通常存在基底膜(basementmembrane)。在通过本发明的制造方法得到的组织模型中,多孔膜相当于基底膜。
作为第一细胞及第二细胞红的至少一种,以再现病情的目的可以使用具有基因突变的细胞或源自患者的细胞。
在本发明的制造方法的一实施方式中,第一细胞是平滑肌细胞或分化为平滑肌细胞的细胞,第二细胞是血管内皮细胞或分化为血管内皮细胞的细胞。本实施方式的制造方法提供一种细胞层叠体即血管壁模型,该细胞层叠体在多孔膜的一个表面上配置了血管内皮细胞层,在多孔膜的另一表面上配置了平滑肌细胞层。
细胞悬浮液的制备或细胞培养中所使用的液体培养基,根据成为对象的细胞种类而被选择。作为具体的培养基,例如可以举出在dmem(dulbecco'smodifiedeagle'smedium:杜尔贝科改良伊格尔培养基)、dmem:f-12(dulbecco'smodifiedeaglemedium:nutrientmixturef-12:杜尔贝科改良伊格尔培养基:营养混合物f-12)、emem(eagle'sminimalessentialmedium:伊格尔最低必要培养基)、memα(minimumessentialmediumalpha:最低必要培养基-α)、bme(basalmediumeagle:伊格尔基本培养基)等哺乳动物细胞用基本培养基中添加细胞增殖因子,并根据细胞种类进行了优化的培养基。作为这种培养基,能够以市售品获得。液体培养基可以是根据共同培养的细胞种类混合了多种培养基的培养基。液体培养基的ph例如为ph7.0~8.0。液体培养基优选为细胞因自重而在重力方向上可以移动的比重及粘度。
通过本发明的细胞层叠体的制造方法而得到细胞层叠体,其具备:
多孔膜;
第一细胞层,配置在多孔膜的一个表面;及
第二细胞层,配置在多孔膜的另一表面。
在本发明的细胞层叠体的制造方法中,作为多孔膜而使用具有蜂窝结构的多孔膜,由此得到细胞层叠体,其具备:
多孔膜,具有蜂窝结构;
第一细胞层,配置在具有蜂窝结构的多孔膜的一个表面;及
第二细胞层,配置在具有蜂窝结构的多孔膜的另一表面。
在本发明的细胞层叠体的制造方法中,作为多孔膜而使用具有蜂窝结构的多孔膜,并将第一细胞作为平滑肌细胞或分化为平滑肌细胞的细胞,将第二细胞作为血管内皮细胞或分化为血管内皮细胞的细胞,由此得到细胞层叠体(即,血管壁模型),该细胞层叠体具备:
多孔膜,具有蜂窝结构;
平滑肌细胞层,配置在具有蜂窝结构的多孔膜的一个表面;及
血管内皮细胞层,配置在具有蜂窝结构的多孔膜的另一表面。
在本发明的制造方法中,若使用具有蜂窝结构的多孔膜,则能够制造细胞培养时的、一个表面的细胞与另一表面的细胞之间的细胞间相互作用被激活,并具有与活体内组织近似的结构及功能的细胞层叠体。从而,根据本发明的制造方法,能够使用具有蜂窝结构的多孔膜来制造血管内皮细胞的细胞间粘附发展为与活体内的血管壁接近的状态的血管壁模型。
作为血管壁模型,优选使化学物质在血管内皮细胞层的细胞之间不会自由地通过,即,优选具有屏障功能。可推测为如下:在通过本发明的制造方法而得到的血管壁模型中,血管内皮细胞的细胞间粘附发展为与活体内的血管壁接近的状态。为了使用血管壁模型更准确地进行药物评价,希望血管壁模型具有与活体内的血管壁近似的结构及功能,其结果,通过本发明的制造方法而得到的血管壁模型可以成为药物评价优异的方式。
通过本发明的制造方法而得到的细胞层叠体的用途并不受限定。通过本发明的制造方法而得到的细胞层叠体作为对活体内的移植材料、药物评价用或病情评价用的组织模型、或替代动物实验的试验用组织是有用的。
实施例
以下,由实施例对本发明的实施方式进行说明,但是本发明的实施方式并不受这些实施例的限定。
下述中,有关物质浓度,“m”表示摩尔浓度,1m=1mol/l。
以下实施例中使用的化学物质等的缩写为如下。
egm:endothelialcellgrowthmedium:内皮细胞生长培养基
fitc:fluoresceinisothiocyanate:异硫氰酸荧光素
hbss:hanks'balancedsaltsolution:汉克斯的平衡盐溶液
hcm:honeycombmembrane:蜂窝膜
huasmc:humanumbilicalarterysmoothmusclecell、人脐动脉平滑肌细胞
huvec:humanumbilicalveinendothelialcell、人脐静脉内皮细胞
pbs:phosphatebufferedsaline:磷酸盐缓冲盐水
tem:tracketchedmembrane:径迹蚀刻膜
<实施例1>
[细胞培养的器材]
·24孔板:悬浮培养用(#662-102、greiner)
·tem插入物:过滤器部中具备te膜的24孔悬挂式插入物(wellhanginginsert)(#mcmp24h48、millipore)。图5中示出本插入物所具备的te膜的显微镜图像。te膜为开口直径5.7μm、膜厚10.6μm、开口率12.4%、聚对苯二甲酸乙二醇酯制。
·hcm插入物:在过滤器部中具备具有蜂窝结构的多孔膜的24孔悬挂式插入物。图5中示出本插入物所具备的多孔膜的显微镜图像。多孔膜为开口直径5.0μm、膜厚2.2μm、开口率55%、聚丁二烯制。
·hcm的包覆材料:纤连蛋白(#33016-015、invitrogen)
[细胞]
·血管内皮细胞:huvec(#c2517as、lonza)
·平滑肌细胞:huasmc(#c-12500、promocell)
[液体培养基、细胞剥离用试剂]
·huvec用:egm-2(#cc-3162、lonza)
·huasmc用:smoothmusclecellgrowthmedium2kit:平滑肌细胞生长培养基2试剂盒(#c-22162、promocell)
·accutase(at104-500、innovativecelltechnologies:创新电池技术)
[hcm的灭菌处理]
(1)在一张24孔板的孔中,以500μl/孔加入70%(v/v)的乙醇,在另外两张24孔板的孔中,以500μl/孔加入了pbs。另外,准备了加入了70%(v/v)的乙醇的杯子。
(2)在加入了乙醇的杯子中浸渍hcm插入物,接着,将hcm插入物置于加入了乙醇的孔中,hcm以浸渍于乙醇中的方式放置,并静放了5分钟。
(3)从乙醇中取出hcm插入物,使用吸气器从hcm插入物的内侧去除乙醇,并立即转移到加入了pbs的孔中,hcm以浸渍于pbs中的方式放置,并注入了1ml的pbs。
(4)从pbs中取出hcm插入物,使用吸气器从hcm插入物的内侧去除pbs,并立即转移到加入了pbs的孔中,hcm以浸渍于pbs中的方式放置,并注入了1ml的pbs。
(5)以将hcm插入物浸渍于pbs中的状态放入减压干燥器中,对hcm进行了除气。
(6)用显微镜确认到在hcm插入物中没有破损、附着物及hcm的扭曲。
[hcm的纤连蛋白包覆]
(1)将纤连蛋白溶解于pbs中,制备出浓度为30μg/ml的纤连蛋白溶液。
(2)在24孔板的孔的中心部点滴了70μl的纤连蛋白溶液。
(3)从pbs中取出hcm插入物,使用吸气器从hcm插入物的内侧去除pbs,并立即承载于孔上的纤连蛋白溶液的斑点上,并将hcm浸渍于纤连蛋白溶液中。
(4)将100μl的纤连蛋白溶液注入到hcm插入物的内侧,并在室温下放置了1小时(或者在4℃下放置了一夜。)。
[使用了hcm插入物的细胞培养(细胞层叠体的制造)]
(1)在24孔板的孔的中心部,以圆顶状放置了80μl的huasmc的细胞悬浮液。
(2)在huasmc的细胞悬浮液上承载完成涂布的hcm插入物,并由孔的底面和hcm夹住细胞悬浮液。
(3)在保持由孔的底面和hcm夹住细胞悬浮液的状态下,使板及hcm插入物倒置。在倒置状态下放入孵化器(37℃、5%(v/v)co2)中,培养了16小时。
(4)在hcm插入物的外侧,添加了1200μl的smoothmusclecellgrowthmedium2kit(平滑肌细胞生长培养基2试剂盒)。从孵化器中取出,并使板及hcm插入物的上下恢复原状,在转移到加入了培养基的孔之后,在hcm插入物的内侧接种了300μl的huvec的细胞悬浮液。
(5)放入孵化器(37℃、5%(v/v)co2)中,培养了80小时。
各细胞的接种条件为如下所述。
·huasmc:培养面积0.785cm2、接种密度1.0×104细胞/cm2、细胞悬浮液80μl
·huvec:培养面积0.32cm2、接种密度5.0×104细胞/cm2、细胞悬浮液300μl
通过上述培养而得到在过滤器的上表面配置了血管内皮细胞层,在过滤器的下表面配置了平滑肌细胞层的hcm插入物(称为“vec/smc-hcm插入物”。)。图6中示出对cd31进行了荧光免疫染色的上表面的细胞层和对α-平滑肌肌动蛋白进行了荧光免疫染色的下表面的细胞层。
根据上述操作分别制作出:在过滤器的上表面上配置血管内皮细胞层、且在过滤器的下表面上未配置细胞层的hcm插入物(称为“vec-hcm插入物”。);及在过滤器的下表面上配置平滑肌细胞层、且在过滤器的上表面上未配置细胞层的hcm插入物(称为“smc-hcm插入物”。)。
[使用了tem插入物的细胞培养(基于现有方法的细胞层叠体的制造)]
在将tem插入物上下倒置的状态下,在过滤器上接种huasmc,并放入孵化器(37℃、5%(v/v)co2)中培养了16小时。接着,将tem插入物设置于24孔板的孔中,在tem插入物的内侧接种huvec,在tem插入物的外侧添加了1200μl的smoothmusclecellgrowthmedium2kit(平滑肌细胞生长培养基2试剂盒)。接着,放入孵化器(37℃、5%(v/v)co2)中培养了80小时。
对tem插入物的各细胞的接种条件与对hcm插入物的各细胞的接种条件相同。
通过上述培养而得到在过滤器的上表面上配置了血管内皮细胞层,在过滤器的下表面上配置了平滑肌细胞层的tem插入物(称为“vec/smc-tem插入物”。)。
根据上述操作分别制作出:在过滤器的上表面上配置血管内皮细胞层、且在过滤器的下表面上未配置细胞层的tem插入物(称为“vec-tem插入物”。);及在过滤器的下表面上配置平滑肌细胞层、且在过滤器的上表面上未配置细胞层的tem插入物(称为“smc-tem插入物”。)。
[物质渗透性的评价]
(1)将fitc-葡聚糖70(70kda、sigma)溶解于2mg、8ml的hbss(+)(084-08965、wakopurechemicalindustries,ltd.)中,制备出浓度为250μg/ml的fitc-葡聚糖70溶液,并进行遮光而保管。
(2)在24孔板的第1列~第3列的各孔中,各加入了900μl的hbss(+)。
(3)从培养基中取出具备细胞层叠体的插入物,使用吸气器从插入物的内侧去除培养基,并置于第1列的孔中。
(4)在置于第1列的孔中的插入物的内侧添加200μl的fitc-葡聚糖70溶液,并在37℃下孵化了10分钟。
(5)将插入物转移到第2列的孔中,并在37℃下孵化了10分钟。
(6)将插入物转移到第3列的孔中,并立即在板上覆盖铝板进行遮光。
(7)分别用移液管来混合第1列及第2列的孔内的试样溶液,从各孔中分别取出100μl,并转移到96孔黑色板,覆盖铝板进行遮光。
(8)使用读板器(enspire、perkinelmer),以ex/em=485nm/530nm、光照射次数60次测定了试样溶液中的fitc的荧光强度。
图7中示出第1列的孔的试样溶液中的fitc的相对荧光强度(即,添加fitc-葡聚糖70溶液后过10分钟的fitc-葡聚糖70的相对泄漏量)。图7所示图示出以在过滤器的两面未形成细胞层的插入物中的荧光强度为基准的相对荧光强度(relativefluorescenceintensity)。
tem插入物在vec-tem插入物中相对荧光强度为3.0±0.5%(n=5),在smc-tem插入物中相对荧光强度为8.2±2.9%(n=5),在vec/smc-tem插入物中相对荧光强度为0.4±0.2%(n=5)。平滑肌细胞层通常在细胞之间的结合并不是很紧密,尽管如此,在smc-tem插入物中相对荧光强度为上述值,因此推测为在tem插入物中tem本身发挥对fitc-葡聚糖70的屏障功能。
hcm插入物在vec-hcm插入物中相对荧光强度为19.3±10.2%(n=5),在smc-hcm插入物中相对荧光强度为67.4±6.1%(n=5),在vec/smc-hcm插入物中相对荧光强度为0.4±0.3%(n=5)。在hcm的一个表面形成血管内皮细胞层,在另一表面形成平滑肌细胞层,由此获得了对fitc-葡聚糖70的屏障功能。
<实施例2>
[细胞培养的器材]
·24孔板:悬浮培养用(#662-102、greiner)
·hcm插入物:在过滤器部中具备具有蜂窝结构的多孔膜的24孔悬挂式插入物。多孔膜为开口直径3.0μm、膜厚1.2μm、开口率55%、聚碳酸酯制。
·hcm的包覆材料:胶原蛋白irattail(#354236、corning)
[细胞]
·血管内皮细胞:大鼠血管内皮细胞(#cap-r0001、angioproteomie)
·平滑肌细胞:大鼠平滑肌细胞(#r-asm-580、lonza)
[液体培养基、细胞剥离用试剂]
·大鼠血管内皮细胞用:ratendothelialcellgrowthmedium(#cap-03,cap-04、angioproteomie)
·大鼠平滑肌细胞用:dmem:f-12(1:1)培养基(#be04-687q、lonza)
·accutase(at104-500、innovativecelltechnologies:创新电池技术)
[hcm的灭菌处理]
与实施例1相同地进行了hcm的灭菌处理。
[hcm的胶原蛋白包覆]
(1)将胶原蛋白i溶解于0.2n的乙酸溶液中,制备出浓度为50μg/ml的胶原蛋白i液。
(2)将70μl的胶原蛋白i液点滴在24孔板的孔的中心部。
(3)从pbs取出hcm插入物,使用吸气器从hcm插入物的内侧去除pbs,并立即承载于孔上的胶原蛋白i液的斑点上,将hcm浸渍于胶原蛋白i液中。
(4)将100μl的胶原蛋白i溶液注入到hcm插入物的内侧,并在室温下放置了4小时(或者在4℃下放置了一夜)。
(5)添加500μl的pbs,中和了hcm。
[使用了hcm插入物的细胞培养(细胞层叠体的制造)]
(1)在24孔板的孔的中心部,以圆顶状放置了80μl的大鼠平滑肌细胞的细胞悬浮液。
(2)在大鼠平滑肌细胞的细胞悬浮液上承载完成涂布的hcm插入物,并由孔的底面和hcm夹住细胞悬浮液。
(3)在保持由孔的底面和hcm夹住细胞悬浮液的状态下,使板及hcm插入物倒置。在倒置状态下放入孵化器(37℃、5%(v/v)co2)中,培养了16小时。
(4)在hcm插入物的外侧添加了1200μl的ratendothelialcellgrowthmedium(大鼠内皮细胞生长培养基)。从孵化器中取出,使板及hcm插入物的上下恢复原状,在转移到加入了培养基的孔中之后,在hcm插入物的内侧接种了300μl的大鼠血管内皮细胞的细胞悬浮液。
(5)放入孵化器(37℃、5%(v/v)co2)中,培养了80小时。
各细胞的接种条件为如下所述。
·大鼠平滑肌细胞:培养面积0.785cm2、接种密度1.0×104细胞/cm2、细胞悬浮液80μl
·大鼠血管内皮细胞:培养面积0.32cm2、接种密度5.0×104细胞/cm2、细胞悬浮液300μl
通过上述培养而得到在过滤器的上表面配置了血管内皮细胞层,在过滤器的下表面配置了平滑肌细胞层的hcm插入物(称为“vec/smc-hcm插入物”。)。图8中示出对ve-cadherin进行荧光免疫染色的上表面的细胞层和对calponin进行了荧光免疫染色的下表面的细胞层。
如图8所示,清楚地观察到形成汇合的细胞层和局部存在血管内皮钙粘蛋白。局部存在血管内皮钙粘蛋白表示血管内皮细胞彼此之间牢固地接合(细胞间连接的形成),是实际的血管壁的特征之一。在hcm的一个表面上形成血管内皮细胞层,在另一表面上形成平滑肌细胞层,由此能够制作具有与活体组织相同的结构的细胞层叠体。
[对生理活性物质的反应的评价]
(1)将0.1mg(100un)凝血酶(#t7009-100un、sigma)溶解于100μl的生理盐水中,制备出浓度为1000u/ml的凝血酶溶液。将其用hbss(+)进一步稀释,制备出25u/ml、100u/ml的凝血酶溶液。
(2)在24孔板的各孔中各加入了900μl的hbss(+)。
(3)从培养基中取出具备细胞层叠体的插入物,使用吸气器从插入物的内侧去除培养基并置于孔中。
(4)在置于孔中的插入物的内侧,添加200μl的hbss(+)(对照)、25u/ml的凝血酶溶液、100u/ml的凝血酶溶液中的任一种,在37℃下孵化了30分钟。
(5)通过显微镜观察到细胞层叠体的状态。在图9中示出(红色荧光:ve-cadherin和绿色荧光:与α-smoothmuscleactin的重合图像)细胞层叠体的显微镜图像。
如图9所示,通过添加凝血酶而观察到伴随肌动蛋白应力纤维活化的细胞收缩的状态。在图9的上段所示的箭头方向上观察到细胞收缩。凝血酶浓度越高,细胞收缩程度越强。确认到在hcm的一个表面上具备血管内皮细胞层、且在另一表面上具备平滑肌细胞层的细胞层叠体,与活体组织相同地,与生理活性物质进行反应。
2017年6月9日申请的日本专利申请2017-114755号的公开其全部内容通过参考而援用于本说明书。
本说明书中所记载的所有文献、专利申请及技术标准,以与具体且分别记载通过参考而援用各文献、专利申请及技术标准之情况相同之程度,通过参考而援用于本说明书中。
符号说明
2多孔膜
4保持部件
6培养容器
11第一细胞
12第二细胞
20多孔膜
22贯穿孔
24隔壁
40保持部件
42筒状部
44突出部
60培养容器
62底部
64侧壁部
- 还没有人留言评论。精彩留言会获得点赞!