用于增强低聚糖利用的工程化的微生物的制作方法
相关申请
本申请要求2017年6月30日提交的美国临时申请号62/527,182的优先权,所述申请据此以引用的方式整体并入。
背景技术:
低聚糖是低分子量碳水化合物,其含有具有介于2与10之间的聚合度(dp)的糖部分。低聚糖可从天然来源中获得,并且也可合成得到。一些微生物天然地消耗低聚糖,并利用低聚糖作为其能量来源。低聚糖的各种天然来源包括牛乳、蜂蜜、甘蔗汁、黑麦、大麦、小麦、大豆、小扁豆、芥菜、水果和蔬菜如洋葱、芦笋、甜菜、朝鲜蓟、菊苣、韭菜、大蒜、香蕉、雪莲果、番茄和竹笋。常见的低聚糖制造方法包括多糖的水解、双糖或单糖底物的化学和酶聚合。多糖的酸、碱和酶水解产生具有所需结构和功能特性的低聚糖。一般说来,酶促法由于其高选择性和产率及环境友好性质而对低聚糖合成是优选的。其他低聚糖可通过引入外源性基因被工程化以实现低聚糖的消耗。
功能性低聚糖已成为食品和膳食补充剂中有价值的组分。它们对结肠微生物的消化和发酵的抗性使低聚糖具有营养优势。除了作为膳食纤维、甜味剂和保湿剂,它们还被誉为益生元。其有益效果包括从抗氧化、抗炎、免疫调节、抗高血压和抗过敏到抗癌、神经保护及皮肤屏障功能和水合作用的改善。生物活性低聚糖的日益流行加速了从新的、可持续的来源产生它们的研究。
低聚糖常被用作碳源或原料,以便为用于产生所需产物的基因修饰的微生物中的发酵或其它代谢过程提供燃料。然而,此过程的效率受到基因修饰的微生物有效利用所提供的碳源的能力的限制。此外,所有天然和常规的基因工程化低聚糖利用系统在低聚糖运输到微生物中期间或在低聚糖裂解期间都会损失能量。这种能量损失降低了微生物生产化学物质的效率,从而又增加了生产的成本和时间。因此,需要用于优化微生物对低聚糖的利用以减少生产化学物质的时间和费用的组合物和方法。
技术实现要素:
提供了呈现增强的低聚糖利用的微生物。在某些实施方案中,所述微生物包含以下一种或多种基因修饰:i)提高质膜atpase蛋白(pma1)的活性,和/或ii)降低蔗糖非发酵蛋白(snf3)的活性,和/或iii)降低恢复型葡萄糖转运蛋白(rgt2)的活性,和/或iv)降低g蛋白偶联受体1蛋白(gpr1)的活性。在某些实施方案中,导致i)、ii)、iii)和iv)的这些基因修饰分别在质膜atpase基因(pma1)、蔗糖非发酵基因(snf3)、葡萄糖转运基因(rgt2)和g蛋白偶联受体1基因(gpr1)中产生。
与亲代微生物相比,本文所述的微生物具有提高的利用低聚糖从那些低聚糖的代谢中产生目标产物的能力。因此,提供了通过在含有低聚糖的培养基中培养本公开的微生物并从培养基中获得目标产物来产生所述目标产物的方法。
在一些实施方案中,微生物是细菌或真菌,例如丝状真菌或酵母。在特定实施方案中,微生物是酵母,例如酿酒酵母。
附图说明
图1显示组成型活性pma1的引入在胞外葡萄糖不存在下改善低聚糖的利用。
图2显示胞外葡萄糖感受器snf3和rgt2的破坏在胞外葡萄糖不存在下改善低聚糖的利用。
图3显示组成型活性pma1与破坏snf3rgt2胞外葡萄糖感受器的组合在胞外葡萄糖不存在下协同地改善低聚糖的利用。
图4示出了塔格糖(作为所需产物的一个实例)产量在具有snf3和rgt2破坏的菌株中的增加。
图5示出了seqidno.1的序列。
图6示出了seqidno.2的序列。
图7示出了seqidno.3的序列。
图8示出了seqidno.4的序列。
图9示出了2fl(作为所需产物的一个实例)产量在具有snf3和rgt2破坏的菌株中的增加。
具体实施方式
定义
为了方便起见,在这里收集了说明书、实施例和所附权利要求书中使用的某些术语。
除非上下文另外清楚地指出,如本文所用的单数形式“一个”、“一种”及“所述”也意图包括复数形式。
术语“约”意指如由本领域普通技术人员所确定的,在特定值的可接受误差范围内,这部分地取决于如何测量或测定该值,即,测量体系的限制。当术语“约”或“大致”在含有成分或条件如温度之量的组合物的情况下使用时,这些值包括规定的值,其变动范围为0-10%的所述值(x±10%)。
术语“包括(including)”、“包括(includes)”、“具有(having)”、“具有(has)”、“拥有(with)”或其变型以类似于术语“包含(comprising)”的方式为包含性的。术语“组成”及组成的语法变型涵盖仅具有所列要素并且排除任何其它要素的实施方案。短语“基本上由……组成(consistingessentiallyof)”或“基本上由……组成(consistsessentiallyof)”涵盖含有指定材料或步骤的实施方案及包括不实质上影响实施方案的基本和新型特征的材料和步骤的那些实施方案。
范围用简写的方式表示,以避免详细地列举和描述范围内的每个值。因此,当为一个值指定范围时,可以选择范围内的任何适当值,并且这些值包括范围的上限值和下限值。举例来说,2至30的范围表示2和30的端值,以及2至30之间的中间值,并且所有中间范围都涵盖在2至30内,如2至5、2至8、2至10等等。
如本文所用的术语“基因修饰”是指改变微生物中的基因组dna。典型地,基因修饰改变由所改变的基因编码的蛋白质的表达和/或活性。
术语“低聚糖”是指长度不同的单糖聚合物并且包括:蔗糖(1个葡萄糖单体和1个果糖单体)、乳糖(1个葡萄糖单体和1个半乳糖单体)、麦芽糖(1个葡萄糖单体和1个葡萄糖单体)、异麦芽糖(2个葡萄糖单体)、巴糖(1个葡萄糖单体和1个果糖单体)、海藻糖(2个葡萄糖单体)、海藻酮糖(1个葡萄糖单体和1个果糖单体)、纤维二糖(2个葡萄糖单体)、纤维三糖(3个葡萄糖单体)、纤维四糖(4个葡萄糖单体)、纤维五糖(5个葡萄糖单体)和纤维六糖(6个葡萄糖单体)。
术语“微生物”是指能够在有或没有修饰的情况下进行低聚糖消耗或利用的原核或真核微生物。
术语“提高的利用”是指与亲代微生物相比微生物在低聚糖消耗上的改善,具体来说是低聚糖消耗率的增加、低聚糖消耗开始之前初始时间的减少、产率(定义为制得的产物与消耗的起始材料的比率)的提高和/或微生物消耗给定量的低聚糖所花费的总体时间的减少。
术语“亲代微生物”是指被操纵以产生基因修饰的微生物的微生物。例如,如果基因在微生物中通过一个或多个基因修饰而突变,那么被修饰的微生物为携带一个或多个基因修饰的微生物的亲代微生物。
术语“消耗率”是指由在给定的时期在给定的培养体积中具有给定细胞密度的微生物消耗的低聚糖之量。
术语“所需化合物”是指在有或没有修饰的情况下由微生物从低聚糖中产生的化合物。为了产生所需化合物,可能需要进行除那些需要消耗低聚糖的修饰以外的修饰。所需化合物包括塔格糖、2’-岩藻糖基乳糖、人乳低聚糖和阿洛酮糖。
术语“产生率”是指由在给定的时期在给定的培养体积中具有给定细胞密度的微生物产生的所需化合物之量。
术语“基因”包括基因的编码区以及上游和下游调控区。上游调控区被称作基因的启动子区。下游调控区被称作终止子区。基因在本文中以小写和斜体形式的基因名称表示,而蛋白质以大写和非斜体形式的蛋白质名称表示。例如,pma1(斜体)表示编码pma1蛋白的基因;而pma1(非斜体和大写)表示pma1蛋白。
与参照序列至少60%、65%、70%、75%、80%、85%、90%、95%、96%、97%、98%、99%或100%的序列同一性是指使用本领域中已知的算法如blast算法在两个序列之间进行的比较。
“变体”是与参照基因或蛋白质偏离的基因或蛋白质序列。术语“同种型”、“同型”和“类似物”也指的是基因或蛋白质的“变体”形式。变体可具有“保守”变化,其中取代的氨基酸具有类似的结构或化学特性,例如,用异亮氨酸取代亮氨酸。变体可具有“非保守”变化,例如,用色氨酸取代甘氨酸。类似的微小变化还可包括氨基酸缺失或插入,或两者兼有。在确定哪些氨基酸残基可被替换、插入或缺失时,可以使用本领域中公知的计算机程序进行指导。
“外源性核酸”是指已被人工地引入细胞中的核酸、dna或rna。这种外源性核酸可以是或不是天然地见于其所引入的细胞中的序列或其片段的拷贝。
“内源性核酸”是指天然地存在于微生物中的核酸、基因、多核苷酸、dna、rna、mrna或cdna分子。内源性序列为微生物“原生的”,即固有的。
术语“突变”是指对基因的基因修饰,包括对开放阅读框、上游调控区和下游调控区的修饰。
核酸序列的异源宿主细胞是指不天然地含有核酸序列的细胞。
“嵌合核酸”包含连接到第二核苷酸序列的第一核苷酸序列,其中第二核苷酸序列不同于与第一核苷酸序列天然存在于的细胞中的第一核苷酸序列相关的序列。
当可利用rna聚合酶全酶时,组成型启动子表达可操作地连接的基因。在组成型启动子的控制下的基因表达不取决于诱导物的存在。
诱导型启动子仅在诱导物存在下表达可操作地连接的基因。诱导物激活转录机制,所述转录机制诱导与诱导型启动子可操作地连接的基因的表达。
在某些方面中,本文公开了能够将低聚糖转化成目标产物的基因工程化的微生物。例如,本文所述的微生物可将乳糖转化成塔格糖或人乳低聚糖(hmo),如2’-岩藻糖基乳糖(2-fl)和乳-n-四糖(lnt),或将蔗糖转化成阿洛酮糖。本文还公开了通过在适当的低聚糖存在下培养本文所述的微生物并回收目标产物来产生所述目标产物的方法。
本公开的某些实施方案提供包含一种或多种选自以下的基因修饰的微生物:
i)与亲代微生物中的pma1活性相比提高所述微生物中的pma1活性的基因修饰,
ii)与亲代微生物中的snf3活性相比降低所述微生物中的snf3活性的基因修饰,
iii)与亲代微生物中的rgt2活性相比降低所述微生物中的rgt2活性的基因修饰,以及
iv)与亲代微生物中的gpr1活性相比降低所述微生物中的gpr1活性的基因修饰。
在具体实施方案中,i)提高pma1活性的基因修饰是对质膜atpase基因(pma1)的基因修饰,ii)降低snf3活性的基因修饰是对蔗糖非发酵基因(snf3)的基因修饰,iii)降低rgt2活性的基因修饰是对葡萄糖转运基因(rgt2)的基因修饰,并且iv)降低gpr1活性的基因修饰是对g蛋白偶联受体1基因(gpr1)的基因修饰。
pma1的一个实例是由序列seqidno:1提供,其为来自酿酒酵母的pma1。来自不为酿酒酵母的微生物(特别是来自酵母)的pma1的同源物可用于本公开的微生物和方法中。适用于本公开中的pma1的同源物的非限制性实例是由uniprot条目表示:a0a1u8i9g6、a0a1u8h4c1、a0a093v076、a0a1u8fcy1、q08435、a0a1u7y482、a0a1u8glu7、p22180、a0a1u8g6c0、a0a1u8iav5、a0a1u8fq89、p09627、a0a199vnh3、p05030、p28877、a0a1u8i3u0、q0exl8、a0a1u8i3v7、p49380、q07421、a0a1d8pj01、p54211、p37367、p07038、q0q5f2、g8bgs3、a0a167f957、m5ene2、a0a1b8gqt5、o74242、q9gv97、q6vau4、a0a177akn9、a0a1j6kb29、a0a2h9zyj6、a0a251uim1、a0a251usm2、d2dvw3、m5bx73、q6fxu5、a3lp36、g3ari4、9nsp9、a0a167c712、g2we85、f2qnm0、a6zuy5、c7gk65、a0a142grj4、w0t7k4、b3ldt4、a0a0h5by16、a0a1b2j5t9、e7db83、q9ur20、f4na03、q96th7、f4na02、i2g7p2、c4pgl3、f4na00、f4n9z6、q7z8b7、f4n9z9、a0a1l4aap4、o94195、a0a1d1ykt6、a0a0u1ylr0、a0a0f8dbr8、a0a1c7n6n1、a0a2n6p2l5、a0a2c5wy03、o14437、t1vyw7、t1vy71、a1kab0、c0qe12、k0nag7、a0a0h3j1i1、a0a1q9d817、a0a068mzp7、d1jed6、a0a2k8wre9、a0a1a8yfd7、a0a1a8yg89、i2g7p8、d9pn36、d1ji19、b6iuj9、b1xp54、h8w7g4、h6sl18、g8lcw3、l8ajp6、q5zfr6、a0a1d7qsr3、a0a1q2tyg8、f4n054、a0a1q9ctb2、a0a1q9ejv5、a0a1d1xee3、a0a0f7gae0、d2dvw4、a0a0a9yx23、a0a1q9elw6。本文所列的uniprot条目以引用的方式整体并入。
pma1的额外同源物是本领域中已知的且这类实施方案在本公开的范围内。例如,pma1的同源物与seqidno:1具有至少60%、65%、70%、75%、80%、85%、90%、95%或99%的序列同一性。
snf3的一个实例是由序列seqidno:2提供,其为来自酿酒酵母的snf3。来自不为酿酒酵母的微生物(特别是来自酵母)的snf3的同源物可用于本公开的微生物和方法中。适用于本公开中的snf3的同源物的非限制性实例是由uniprot条目表示:w0tfh8、q6fnu3、a0a0w0cex1、g2wbx2、a6zxd8、j6egx9、p10870、c7gv56、b3lh76、a0a0l8rl87、a0a0k3c9l0、m7wsx8、a0a1u8heq5、g5ebn9、a8x3g5、a3lzs0、g3aq67、a0a1e4rgt4、a0a1b2j9b3、f2qp27、e3mdl0、a0a2c5x045、g0nwe1、a0a0h5s3z1、a0a2g5vcg9、a0a167er19、a0a167ddu9、a0a167cy60、a0a167cew8、a0a167er43、a0a167f8x4、a0a1b8gc68、a0a177a9b0、e3eis7、e3e8b6、a0a0a9z0q2。本文所列的uniprot条目以引用的方式整体并入。
snf3的额外同源物是本领域中已知的且这类实施方案在本公开的范围内。例如,snf3的同源物与seqidno:2具有至少60%、65%、70%、75%、80%、85%、90%、95%或99%的序列同一性。
rgt2的一个实例是由序列seqidno:3提供,其为来自酿酒酵母的rgt2。来自不为酿酒酵母的生物体(特别是来自酵母)的rgt2的同源物可用于本公开的微生物和方法中。rgt2的同源物的非限制性实例是由uniprot条目表示:a0a0u1maj7、n4tg48、a0a1q8rpy1、n4u7i0、a0a1l7ssq2、a0a1l7vb15、a0a0c4e497、a0a1l7uan6、a0a0j0cu17、a0a1l7vma9、s0ed22、a0a1l7sd48、n1r8l8、a0a1l7v0n4、s3byd3、e4uuu6、n4upt5、n4u030、a0a0i9yk83、s0djs4、a0a0u1lwh9、a0a0k6fsj2、n1s6k7、a0a0j6f3e5、a0a1e4rs51、n4utn2、a0a0g2e6d5、a0a1j9r914、a0a0f4gqx7、a0a1s9rlb9、a3m0n3、j9pf54、a0a074wc52、a0a0k6gi66、n1qhs4、g2wxk0、b2vvl4、b2wdk7、a0a1j9s6a1、g4n0e9、l7jeu7、l7ina5、a0a0l1he99、a0a0j8ql36、a0a0h5ckw2、a0a0j6y4e2、w0vmg0、g2wqd8、a0a1c1wv61、a0a1s9rl33、c9sba9、a0a0g2hy75、j3p244、n1qk04、a0a0n0nqr9、a0a1s7uj19、g2xfe7、c9swz3、r8buy9、m7syh1、a0a1e1miv2、a0a1e1llk3、a0a1e1lje1、l7j4y3、l7i304、a0a1l7xu29、a0a136jcy3、a0a0j8rg81、a0a177dw33、a0a1l7x792、w9c8u1、b2vxl1、a0a0l1hmg8、a0a178dqw4、a0a167v6f7、a0a166wr60、a0a162klt6、a0a1l7x3d1、g3jqx8,q7s9u8、e9f7a6、a0a1s7hpx9、a0a0g2g564、a0a0w0d0b3、a6zxi9、q12300、c7gkz0、g2wc23、a0a0h5cat9、j4u3y8、a0a0l8rl54。本文所列的uniprot条目以引用的方式整体并入。
rgt2的额外同源物是本领域中已知的且这类实施方案在本公开的范围内。例如,rgt2的同源物与seqidno:3具有至少60%、65%、70%、75%、80%、85%、90%、95%或99%的序列同一性。
gpr1的一个实例是由序列seqidno:4提供,其为来自酿酒酵母的gpr1。来自不为酿酒酵母的微生物(特别是来自酵母)的gpr1的同源物可用于本公开的微生物和方法中。gpr1的同源物的非限制性实例是由uniprot条目表示:a0a1s3alf0、a0a0q3md25、a0a146rbq8、a0a0p5sha9、a2ari4、q9bxb1、q9z2h4、f1mlx5、u3dqd9、i2cvt9、i0fi44、k7d663、k7asz6、a0a1u7q769、u3esi5、t1e5b8、a0a0f7za01、j3rzw5、a0a094zhc9、w6ul90、a0a0p6j7q8、l5kyc3、b7p6n0、b0blw3、a2ahq2、a0a151n8w7、a0a146rcw3、a0a0x3nyb9、a0a0p5y3g9、w5uab2、a0a0p5ic44、a0a090xf51、a0a146nrv7、a0a0x3q0r0、a0a0p6ird7、l9jfb7、a0a146ygg2、a0a146wg88、q12361、b3lgt6、a0a0n8a6f9、p0dm44、w6jm29、a0a1a8lc80、a0a0n8a4d4、q7z7m1、a0a1s3g1q8、a0a1u7qgh1、a6zxt8、a0a1u8c0f6、d3zju9、a0a1s3kgl3、g5b385、l9kny9、a0a1s3aqm3、a0a087uxx9、a0a0l8vw24、a0a0p6ar08、q9hbx8、q3uvd5、a0a1u7uef2、a0a146xmf9、a0a146qtv1、a0a1s3id45、l5ktu9、a0a1a8elt4、a0a0n7zmx8、a0a0p5q3t8、a0a1a8n9z4、a0a1a8d807、a0a1a8cvg1、a0a1a8umb1、a0a1a8jq07、a0a1a8p7n2、a0a1a8hl38、e7fe13、a0a1s3fzl3、a0a0p7wlq9、h2kqn3、a0a1s3wja9、a0a146pka1、l5llq3、f1q989、a0a0f8aky3、a0a0p7vr95、a0a1u8c8i3、a0a034vim3、a0a0n8bfd4、a0a146xmj1、a0a0n8bdm1、a0a1a8ktj1、a0a1a7x706、a0a0r4ite3、a0a1u7s4h0、a0a1s3aq94、a0a1u7ucp2、l8hma8、a0a0q3p3v6、a0a1a8cdg3、d6w7n2、a0a1e1xmy8、a0a1a8acl5、a0a1s3wnv2、t0mhy5、a0a1s3g113、v8p2x5、a0a1s3kv51、a0a1s3g018、a0a1s3pup5、a0a1u8c7x5、s9wp18、a0a1s3aql8、a0a0n8enf1、k7cig0、a0a147bfy7、a0a1s3fzk9、a0a1u7tuh0、a0a1u8bx93、a0a091dkn5、a0a146w919、a0a147b2k7、a0a146xnl4、a0a091dtx9、a0a0q3uqb0、a0a146wh37、e9qdd1、q58y75、a0a096mki0、a0a1s3s901、q14bh6、a0a1s3aq42、a0a0p5sv49、a0a0p5p299、a0a0p5wcr4、k7cht8、a0a1u7u0q5、a0a1s3exd4、a0a146y6g0、a0a061hxq0、a0a1s3aq84、a0a1s2znq3、a0a1u7uee6、a0a1s3g013、a0a1u7qjg4、s7n7m1、a0a1s3g108、a0a1u8c8h8和a0a1u8c7x0。
gpr1的额外同源物在本领域中是已知的且这类实施方案在本公开的范围内。例如,gpr1的同源物与seqidno:4具有至少60%、65%、70%、75%、80%、85%、90%、95%或99%的序列同一性。
在某些实施方案中,本公开的微生物包含与亲代微生物中的pma1活性相比提高所述微生物中的pma1活性的基因修饰。
pma1蛋白是h+-atpase并将质子泵出细胞,从而形成用于摄取糖、氨基酸及其它营养素的膜电位。pma1具有十个跨膜结构域和三个胞质结构域。pma1的n端和c端都位于胞质中。酵母pma1具有细长的胞质尾,其在葡萄糖饥饿期间抑制h+-atpase活性。组成型活性pma1在葡萄糖饥饿期间缺乏h+-atpase活性的抑制。因此,组成型活性pma1在葡萄糖存在下以及葡萄糖不存在下皆有活性。
在本公开的具体实施方案中,所述微生物包含与亲代微生物中的pma1活性相比提高所述微生物中的pma1活性的pma1中的基因修饰。与亲代微生物中的pma1活性相比提高所述微生物中的pma1活性的基因修饰的非限制性实例包括以下一种或多种:a)用可操作地连接至内源性pma1上的外源性启动子取代内源性启动子;b)经由染色体外遗传物质表达pma1;c)将pma1的一个或多个拷贝整合到所述微生物的基因组中;d)对所述内源性pma1的修饰成产生修饰的pma1,所述修饰的pma1编码组成型活性pma1或与未修饰的pma1相比具有提高的活性的pma1,e)将包含pma1的染色体外遗传物质引入到所述微生物中,所述pma1编码组成型活性pma1或与相应野生型pma1相比具有提高的活性的pma1;或f)将编码组成型活性pma1或与相应野生型pma1相比具有提高的活性的pma1的pma1的一个或多个拷贝整合到所述微生物的基因组中。还设想了在本段落中描述的突变a)至f)的任何组合。
在一些实施方案中,内源性启动子被外源性启动子取代,所述外源性启动子以比所述内源性启动子高的水平诱导pma1的表达。在某些实施方案中,外源性启动子对其中外源性启动子取代内源性启动子的微生物有特异性。例如,如果被修饰的微生物是酵母的话,那么可使用酵母特异性外源性启动子。外源性启动子可为组成型启动子或诱导型启动子。
组成型酵母特异性启动子的非限制性实例包括:pcyc、padh、pste5、酵母adh1、cyc100最小、cyc70最小、cyc43最小、cyc28最小、cyc16最小、ppgk1、pcyc或pgpd。来自酵母的组成型启动子的额外实例和来自不为酵母的微生物的组成型启动子的实例为熟练技术人员所知且这类实施方案在本公开的范围内。
诱导型酵母特异性启动子的非限制性实例包括:gal1、mfa1、mfa2、ste3、ura3、fig1、eno2、dld、jen1、mcyc和ste2。来自酵母的诱导型启动子的额外实例和来自不为酵母的微生物的诱导型启动子的实例为熟练技术人员所知且这类实施方案在本公开的范围内。
在一些实施方案中,提高pma1活性的基因修饰包括在微生物中经由包含pma1的染色体外遗传物质表达pma1。包含pma1并且编码pma1的染色体外遗传物质典型地含有经由pma1控制pma1表达的启动子。另外,染色体外遗传物质还可含有可选标记基因和复制起点。
取决于所用的微生物类型,染色体外遗传物质可为线性或圆形质粒、酵母人工染色体或2μ环。适用于本公开中的染色体外遗传物质的额外实例是本领域中公知的并且这类实施方案在本公开的范围内。
在某些实施方案中,pma1的一个或多个拷贝被整合到微生物的基因组中。在一些实施方案中,pma1的一个或多个拷贝可具有与微生物中的内源性pma1同一的序列。在其它实施方案中,pma1的一个或多个拷贝可具有与微生物中的内源性pma1不同的序列。
在额外实施方案中,微生物中的内源性pma1失活并且将编码组成型活性pma1的pma1作为染色体外遗传物质引入微生物中或掺入到微生物的基因组中。
在某些实施方案中,微生物包含对内源性pma1的修饰成产生编码组成型活性pma1的修饰的pma1。在一些实施方案中,对内源性pma1的修饰产生修饰的pma1,所述修饰的pma1编码包含由mason等人(2014),eukaryoticcell13:43–52所述的突变的组成型活性pma1。mason等人的参考文献(特别是第1图和第2图)以引用的方式整体并入本文。
因此,在某些实施方案中,对内源性pma1的修饰产生编码组成型活性pma1的修饰的pma1,所述组成型活性pma1为与相应野生型pma1相比缺少来自c端的至少2至约30个、优选至少3至约30个氨基酸的pma1。在某些实施方案中,具有编码seqidno:1的pma1的内源性pma1的酿酒酵母被基因修饰成产生编码截短的pma1的修饰的pma1,所述截短的pma1缺少来自seqidno:1的c端的至少2至约30个、优选至少3至约30个氨基酸。
在一些实施方案中,具有编码seqidno:1的pma1的内源性pma1的酿酒酵母被基因修饰成产生具有提高的活性的修饰的pma1,其中所述修饰的pma1在seqidno:1的911位处的丝氨酸突变为天冬氨酸和/或在seqidno:1的912位处的苏氨酸突变为天冬氨酸。在某些实施方案中,具有编码seqidno:1的pma1的内源性pma1的酿酒酵母如chomvong等人,biorxivpreprint(可在万维网:dx.doi.org/10.1101/076364上获得)中所述被基因修饰。chomvong等人的参考文献以引用的方式整体并入本文。
在一些实施方案中,提高pma1活性的修饰包含对torc1、fpr1和/或sit4中的一个或多个的一种或多种修饰。提高pma1活性的torc1、fpr1和/或sit4中的突变包括mahmoud等人(2017),febslett.,doi:10.1002/1873-3468.12673中所述的突变。mahmoud等人的参考文献以引用的方式整体并入本文。
在一些实施方案中,将包含编码组成型活性pma1的pma1的一个或多个拷贝的染色体外遗传物质引入微生物中。包含编码组成型活性pma1的pma1的染色体外遗传物质可在组成型或诱导型启动子的控制下。早先所述的组成型或诱导型启动子可用于这类实施方案中。
在其它实施方案中,将编码组成型活性pma1的pma1的一个或多个拷贝整合到微生物的基因组中。编码组成型活性pma1并掺入到微生物基因组中的pma1可在组成型或诱导型启动子的控制下。早先所述的组成型或诱导型启动子可用于这类实施方案中。
在某些实施方案中,本公开的微生物包含以下基因修饰,这些基因修饰降低或消除与亲代微生物中的相应蛋白质的活性相比微生物中snf3、rgt2和/或gpr1的活性。
snf3蛋白是调节葡萄糖转运的质膜低葡萄糖感受器。它是含有12个预测的跨膜区段和己糖转运蛋白诱导所需的长c端尾的高亲和力感受器。snf3还感测果糖和甘露糖。
rgt2是调节葡萄糖转运的质膜高葡萄糖感受器。它是含有12个预测的跨膜区段和己糖转运蛋白诱导所需的长c端尾的低亲和力感受器。通过yck1p/yck2p对所述尾部的磷酸化促进结合至hxt辅阻遏物、mth1p和std1p。
gpr1是与gpa2p和plc1p蛋白相互作用的g蛋白偶联受体以便经由camp和pka途径整合碳和氮营养信号。
在某些实施方案中,与亲代微生物中的相应蛋白质的活性相比降低或消除微生物中的snf3、rgt2和/或gpr1的活性的基因修饰包括对异源三聚g蛋白(gpa2)的核苷酸结合α亚基的一种或多种基因修饰,其灭活或消除gpa2的活性。可降低或消除snf3、rgt2和/或gpr1的活性的gpa2中的突变的实例提供于nazarko等人(2008),cellbiolint.;32(5):502-4中。nazarko等人的参考文献以引用的方式整体并入本文。
在一些实施方案中,降低或消除与亲代微生物中的相应蛋白质的活性相比微生物中的snf3、rgt2和/或gpr1活性的基因修饰包括对异源三聚g蛋白(gpa2)的核苷酸结合α亚基的一种或多种基因修饰,灭活或消除gpa2的活性的这些基因修饰包括编码htr1、mth1和/或rgt1蛋白的基因中的一个或多个突变。可降低或消除snf3、rgt2和/或gpr1活性的htr1、mth1和/或rgt1蛋白中的突变的实例提供于schulte等人(2000),jbacteriol.;182(2):540-2中。schulte等人的参考文献以引用的方式整体并入本文。
与亲代微生物中的相应蛋白质的活性相比降低或消除微生物中的snf3、rgt2和/或gpr1活性的额外突变是本领域中已知的且这类实施方案在本公开的范围内。
在具体实施方案中,本公开的微生物包含snf3、rgt2和/或gpr1中的基因修饰,这些基因修饰降低或消除与亲代微生物中的相应蛋白质的活性相比微生物中的snf3、rgt2和/或gpr1的活性。
在一些实施方案中,降低或消除snf3、rgt2和/或gpr1的活性的基因修饰包括以下一种或多种:a)snf3、rgt2和/或gpr1的失活,其中失活的snf3、rgt2和/或gpr1不编码snf3、rgt2和/或gpr1;b)snf3、rgt2和/或gpr1中的突变,其中突变的snf3、rgt2和/或gpr1编码无活性或活性与亲代微生物中的相应蛋白质的活性相比降低的snf3、rgt2和/或gpr1;c)snf3、rgt2和/或gpr1的启动子中的突变,其中突变的启动子造成与亲代微生物中的相应蛋白质的表达相比snf3、rgt2和/或gpr1的表达减少;d)用可操作地连接至内源性snf3、rgt2和/或gpr1的编码区上的外源性启动子取代来自snf3、rgt2和/或gpr1的内源性启动子,其中所述外源性启动子造成snf3、rgt2和/或gpr1无表达或造成snf3、rgt2和/或gpr1的表达与亲代微生物中的相应蛋白质的表达相比减少。还设想了在本段落中描述的突变a)至d)的任何组合。
snf3、rgt2和/或gpr1的失活可通过以下一种或多种获得:a)编码区的完全或部分缺失;b)在编码区内引入移码突变;c)以破坏snf3、rgt2和/或gpr1活性的方式插入一个或多个核苷酸;d)在编码区中引入终止密码子;或在本段落中描述的a)至d)的任何组合。在一些实施方案中,可用不编码snf3、rgt2和/或gpr1的突变的snf3、rgt2和/或gpr1取代内源性snf3、rgt2和/或gpr1。
在特定实施方案中,本公开提供了一种微生物、优选酵母、更优选酵母属、且甚至更优选酿酒酵母,所述微生物包含下列基因修饰或基因修饰的组合:
1)产生与相应未修饰的pma1相比具有提高的活性的pma1或组成型活性pma1的基因修饰和造成snf3失活的基因修饰,
2)产生与相应未修饰的pma1相比具有提高的活性的pma1或组成型活性pma1的基因修饰和造成rgt2失活的基因修饰,
3)产生与相应未修饰的pma1相比具有提高的活性的pma1或组成型活性pma1的基因修饰和造成gpr1失活的基因修饰,
4)产生与相应未修饰的pma1相比具有提高的活性的pma1或组成型活性pma1的基因修饰、造成snf3失活的基因修饰和造成rgt2失活的基因修饰,
5)产生与相应未修饰的pma1相比具有提高的活性的pma1或组成型活性pma1的基因修饰、造成snf3失活的基因修饰和造成gpr1失活的基因修饰,
6)产生与相应未修饰的pma1相比具有提高的活性的pma1或组成型活性pma1的基因修饰、造成rgt2失活的基因修饰和造成gpr1失活的基因修饰,
7)造成snf3失活的基因修饰和造成rgt2失活的基因修饰,
8)造成snf3失活的基因修饰和造成gpr1失活的基因修饰,
9)造成rgt2失活的基因修饰和造成gpr1失活的基因修饰,
10)造成snf3失活的基因修饰、造成rgt2失活的基因修饰和造成gpr1失活的基因修饰,
11)产生与相应未修饰的pma1相比具有提高的活性的pma1或组成型活性pma1的基因修饰、造成snf3失活的基因修饰、造成rgt2失活的基因修饰和造成gpr1失活的基因修饰,
12)产生与相应未修饰的pma1相比具有提高的活性的pma1或组成型活性pma1的基因修饰,所述组成型活性pma1在具有序列seqidno:1的pma1或所述pma1的与seqidno:1具有至少90%、优选至少95%序列同一性的同源物的c端处具有至少2至约30个、尤其至少3至约30个氨基酸的截短;造成snf3失活的基因修饰;和造成rgt2失活的基因修饰,
13)产生与相应未修饰的pma1相比具有提高的活性的pma1或组成型活性pma1的基因修饰,所述组成型活性pma1在具有序列seqidno:1的pma1或所述pma1的与seqidno:1具有至少90%、优选至少95%序列同一性的同源物的c端处具有至少2至约30个、尤其至少3至约30个氨基酸的截短;造成snf3失活的基因修饰;和造成gpr1失活的基因修饰,
14)产生与相应未修饰的pma1相比具有提高的活性的pma1或组成型活性pma1的基因修饰,所述组成型活性pma1在具有序列seqidno:1的pma1或所述pma1的与seqidno:1具有至少90%、优选至少95%序列同一性的同源物的c端处具有至少2至约30个、尤其至少3至约30个氨基酸的截短;造成rgt2失活的基因修饰;和造成gpr1失活的基因修饰,
15)产生与相应未修饰的pma1相比具有提高的活性的pma1或组成型活性pma1的基因修饰,所述组成型活性pma1在具有序列seqidno:1的pma1或所述pma1的与seqidno:1具有至少90%、优选至少95%序列同一性的同源物的c端处具有至少2至约30个、尤其至少3至约30个氨基酸的截短;造成snf3失活的基因修饰;造成rgt2失活的基因修饰;和造成gpr1失活的基因修饰,
16)产生与相应未修饰的pma1相比具有提高的活性的pma1或组成型活性pma1的基因修饰,所述组成型活性pma1在具有序列seqidno:1的pma1或所述pma1的与seqidno:1具有至少90%、优选至少95%序列同一性的同源物的c端处具有两个或三个氨基酸的截短;造成snf3失活的基因修饰;和造成rgt2失活的基因修饰,
17)产生与相应未修饰的pma1相比具有提高的活性的pma1或组成型活性pma1的基因修饰,所述组成型活性pma1在具有序列seqidno:1的pma1或所述pma1的与seqidno:1具有至少90%、优选至少95%序列同一性的同源物的c端处具有至少两个或三个氨基酸的截短;造成snf3失活的基因修饰;和造成gpr1失活的基因修饰,
18)产生与相应未修饰的pma1相比具有提高的活性的pma1或组成型活性pma1的基因修饰,所述组成型活性pma1在具有序列seqidno:1的pma1或所述pma1的与seqidno:1具有至少90%、优选至少95%序列同一性的同源物的c端处具有至少两个或三个氨基酸的截短;造成rgt2失活的基因修饰;和造成gpr1失活的基因修饰,
19)产生与相应未修饰的pma1相比具有提高的活性的pma1或组成型活性pma1的基因修饰,所述组成型活性pma1在具有序列seqidno:1的pma1或所述pma1的与seqidno:1具有至少90%、优选至少95%序列同一性的同源物的c端处具有至少两个或三个氨基酸的截短;造成snf3失活的基因修饰;造成rgt2失活的基因修饰;和造成gpr1失活的基因修饰,
20)产生与相应未修饰的pma1相比具有提高的活性的pma1或组成型活性pma1的基因修饰,所述组成型活性pma1在具有序列seqidno:1的pma1或所述pma1的与seqidno:1具有至少90%、优选至少95%序列同一性的同源物的c端处具有至少两个或三个氨基酸的截短;造成snf3失活的基因修饰,
21)产生与相应未修饰的pma1相比具有提高的活性的pma1或组成型活性pma1的基因修饰,所述组成型活性pma1在具有序列seqidno:1的pma1或所述pma1的与seqidno:1具有至少90%、优选至少95%序列同一性的同源物的c端处具有至少两个或三个氨基酸的截短;造成rgt2失活的基因修饰,
22)产生与相应未修饰的pma1相比具有提高的活性的pma1或组成型活性pma1的基因修饰,所述组成型活性pma1在具有序列seqidno:1的pma1或所述pma1的与seqidno:1具有至少90%、优选至少95%序列同一性的同源物的c端处具有至少2至约30个、尤其至少3至约30个氨基酸的截短;和造成gpr1失活的基因修饰。
在一些实施方案中,基因工程化的微生物进一步包含编码伴侣蛋白的外源性核苷酸序列。在优选实施方案中,伴侣蛋白是groesl。
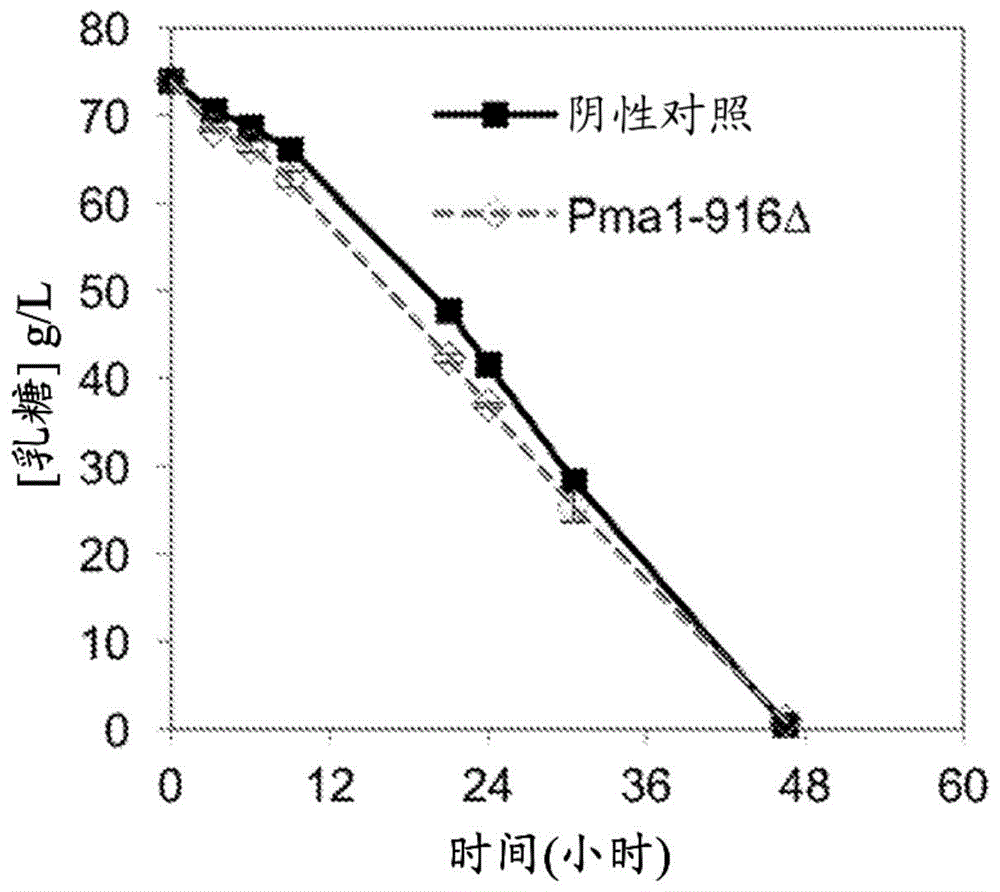
在一些实施方案中,本文所公开的基因修饰的微生物可包含pma1活性的改变。在优选实施方案中,所述改变产生与相应未修饰的pma1相比具有提高的活性的pma1或组成型活性pma1并且在胞外葡萄糖存在或不存在下改善低聚糖利用。例如,可消除在pma1的终止密码子之前的最后三个氨基酸(pma1-916δ),以便改善低聚糖消耗(例如,参见图1)。
在其它实施方案中,本文所公开的基因工程化的微生物可包含胞外葡萄糖感受器活性的改变。在优选实施方案中,所述改变造成胞外葡萄糖感测的消除或减少,以便在胞外葡萄糖存在或不存在下改善低聚糖利用。例如,可消除snf3和rgt2的编码序列(snf3δrgt2δ),以便改善低聚糖消耗(例如,参见图2)。
在具体实施方案中,本文所公开的基因工程化的微生物可包含pma1活性的改变及胞外葡萄糖感受器活性的清除或降低。例如,可消除在pma1的终止密码子之前的最后三个氨基酸并且使微生物的snf3和rgt2的编码序列(pma1-916δsnf3δrgt2δ)失活,以便改善低聚糖消耗(例如,参见图3)。
在特定实施方案中,本文所公开的基因工程化的微生物可包含pma1活性和/或胞外葡萄糖感受器活性的改变,以便改善所需化合物(例如,塔格糖、2’-岩藻糖基乳糖、阿洛酮糖、人乳低聚糖)的产生。例如,具有snf3δrgt2δ的微生物,其塔格糖的产量是由曲线下面积计算得到,提高了52%(例如,参见图4)。
用于产生本文所述的基因修饰的微生物的微生物可选自酵母属,如酿酒酵母(s.cerevisiae)、巴氏酵母(s.pastorianus)、beticus酵母(s.beticus)、发酵酵母(s.fermentati)、奇异酿酒酵母(s.paradoxus)、葡萄汁酵母(s.uvarum)和贝酵母(s.bayanus);裂殖酵母属,如粟酒裂殖酵母(s.pombe)、日本裂殖酵母(s.japonicus)、八孢裂殖酵母(s.octosporus)和嗜冷裂殖酵母(s.cryophilus);有孢圆酵母属,如戴尔凯氏有孢圆酵母(t.delbrueckii);克鲁维酵母属,如马克斯克鲁维酵母(k.marxianus);毕赤酵母属,如树干毕赤酵母(p.stipitis)、巴斯德毕赤酵母(p.pastoris)或安格斯毕赤酵母(p.angusta,);接合酵母属,如拜氏接合酵母(z.bailii);酒香酵母属,如间型酒香酵母(b.intermedius)、布鲁塞尔酒香酵母(b.bruxellensis)、异酒香酵母(b.anomalus)、班图酒香酵母(b.custersianus)、纳氏酒香酵母(b.naardenensis)、纳努斯酒香酵母(b.nanus);德克拉酵母属,如布鲁塞尔德克拉酵母(d.bruxellensis)和异常德克拉酵母(d.anomala);梅奇酵母属某些种;伊萨酵母属,如东方伊萨酵母(i.orientalis);克勒克酵母属,如柠檬形克勒克酵母(k.apiculata);短梗霉属,如出芽短梗霉(a.pullulans)。
在一些实施方案中,除产生pma1、snf3、rgt2和/或gpr1中的变化的基因修饰之外,本文所述的微生物还包含:调控的gdp-l-岩藻糖生物合成途径;引入编码α-1,2岩藻糖基转移酶的外源性多核苷酸;和/或弱的β-半乳糖苷酶活性。
gdp-l-岩藻糖合成途径可通过以下至少一种来调控:增加的gdp-o-甘露糖生物合成、nadph的再生、以及鸟嘌呤核苷酸生物合成途径的操纵。外源性α-1,2岩藻糖基转移酶可来自幽门螺杆菌、秀丽隐杆线虫、褐家鼠、小家鼠、大肠杆菌、脆弱拟杆菌或智人。
在一些实施方案中,微生物包含两步氧化还原途径。所述两步氧化还原途径可包含醛糖还原酶和半乳糖醇-2-脱氢酶。
除了产生pma1、snf3、rgt2和gpr1中的变化的基因修饰之外,本文所述的微生物还包含美国专利号8,431,360、8,765,410、9,012,177及美国专利申请公布20170152538中所述的基因修饰,所有这些专利都以引用的方式整体并入本文。
本公开的微生物能够利用以下低聚糖:例如蔗糖、乳糖、麦芽糖、异麦芽糖、异麦芽酮糖、海藻糖、海藻酮糖、纤维二糖、纤维三糖、纤维四糖、纤维五糖或纤维六糖。在具体实施方案中,本文所述的微生物与亲代微生物相比具有更强的利用低聚糖的能力。在特定实施方案中,低聚糖的利用在微生物的胞质液中发生。
在一些实施方案中,本文所述的微生物能够将乳糖转化成塔格糖。在具体实施方案中,本文所述的微生物与亲代微生物相比具有更强的将乳糖转化成塔格糖的能力。在特定实施方案中,乳糖向塔格糖的转化在微生物的胞质液中发生。
在一些实施方案中,本文所述的微生物能够将乳糖转化成2’-fl。在具体实施方案中,本文所述的微生物与亲代微生物相比具有更高的将乳糖转化成2’-fl的能力(例如,参见图9)。在特定实施方案中,乳糖向2’-fl的转化在微生物的胞质液中发生。
在一些实施方案中,微生物能够将蔗糖转化成阿洛酮糖。在具体实施方案中,本文所述的微生物与亲代微生物相比具有更强的将蔗糖转化成阿洛酮糖的能力。在特定实施方案中,蔗糖向阿洛酮糖的转化在微生物的胞质液中发生。
因此,本公开的进一步实施方案提供了通过以下步骤产生目标产物的方法:在适当的条件下在含有适当低聚糖的适当培养基中培养本文所述的微生物持续适当的时间段,以及从培养基中回收所述目标产物。
在某些实施方案中,本公开提供了通过以下步骤产生塔格糖的方法:在适当的条件下在含有乳糖的培养基中培养本文所述的微生物持续适当的时间段及从培养基中回收塔格糖。
在某些实施方案中,本公开提供了通过以下步骤产生2’-fl的方法:在适当的条件下在含有乳糖的培养基中培养本文所述的微生物持续适当的时间段及从培养基中回收2’-fl。
在某些实施方案中,本公开提供了通过以下步骤产生阿洛酮糖的方法:在适当的条件下在含有蔗糖的培养基中培养本文所述的微生物持续适当的时间段及从培养基中回收阿洛酮糖。
在优选实施方案中,微生物属于酵母属。在甚至更优选的实施方案中,微生物是酿酒酵母。
在某些实施方案中,培养基含有约10g/l酵母提取物、20g/l胨和约40g/l低聚糖,尤其是乳糖或蔗糖。在具体实施方案中,微生物(尤其是酵母)在30℃下生长。
额外的培养基、适于培养微生物的条件及从培养基中回收目标产物的方法是本领域中公知的并且这类实施方案在本公开的范围内。
实施例
菌株和培养基
使酿酒酵母在30℃下生长并维持在ypd培养基(10g/l酵母提取物、20g/l胨、20g/l葡萄糖)上。所有基因均为染色体表达。利用低聚糖的菌株含有纤维二糖转运蛋白(cdt-1)和β-葡糖苷酶(gh1-1)。产塔格糖的菌株含有cdt-1、gh1-1和木糖还原酶(xr)、半乳糖醇2-脱氢酶(gdh))。pma1-916δ突变如由mason等人所述具有c端截短。snf3和rgt2的编码区在snf3δrgt2δ菌株中被消除。在30℃下,在ypl培养基(10g/l酵母提取物、20g/l胨、40g/l乳糖)中进行实验。
发酵和代谢物分析
将单一菌落的一式三份在30℃下接种于20mlypd中过夜。将细胞离心并用无菌水洗涤两次。在ypl培养基中的最终发酵体积是5ml。在600nm下的初始光密度是20。将细胞在30℃和250rpm下培育。在配备有rezexrfq-fastacidh10x7.8mm柱的prominencehplc(shimazu,kyoto,japan)上,通过高效液相色谱法测定乳糖浓度。将柱用0.01n硫酸以1ml/min的流率在55℃下洗脱。使用配备有carbopacpa20柱的ics-3000离子色谱系统(dionex,sunnyvale,ca,usa)测定塔格糖浓度。将柱用koh梯度以0.4ml/min的流率在30℃下洗脱。
组成型活性pma1的引入在胞外葡萄糖不存在下改善低聚糖的利用(例如图1)。消除pma1的终止密码子之前最后三个氨基酸(pma1-916δ),以便改善低聚糖消耗。
snf3和rgt2的清除或减少在胞外葡萄糖的存在或不存在下改善低聚糖的利用(例如,参见图2)。消除snf3和rgt2的编码序列(snf3δrgt2δ),以便改善低聚糖消耗。进行基因修饰以便改善所需化合物(例如,塔格糖、2’-岩藻糖基乳糖、阿洛酮糖、人乳低聚糖)的产生。例如,具有snf3δrgt2δ的微生物,其塔格糖的产量是由曲线下面积计算得到,提高了52%(例如,参见图4)。具有snf3δrgt2δ的微生物能够将乳糖转化成2’-fl。具有snf3δrgt2δ的微生物与亲代微生物相比具有更高的将乳糖转化成2’-fl的能力(例如,参见图9)。
组成型活性pma1的引入与snf3和rgt2的清除或减少的组合在胞外葡萄糖不存在下协同地改善低聚糖的利用(例如,参见图3)。pma1的终止密码子之前的最后三个氨基酸被消除并且使来自微生物的snf3和rgt2的编码序列(pma1-916δsnf3δrgt2δ)失活,以便改善低聚糖的消耗。
以引用的方式并入
在本文中引用的各专利、公开的专利申请及非专利参考文献据此以引用的方式整体并入。
等价方案
本领域技术人员将会认识到或利用常规实验即可确定本文所述的本发明的具体实施方案的许多等价方案。这类等价方案意图由以下权利要求所涵盖。
- 还没有人留言评论。精彩留言会获得点赞!