α-淀粉酶、组合物和方法与流程
本公开涉及具有α-淀粉酶活性的多肽和包含此类多肽的组合物。本公开进一步涉及编码此类多肽的多核苷酸,包含编码此类多肽的基因的工程化核酸构建体、载体和宿主细胞,所述工程化核酸构建体、载体和宿主细胞也能够产生此类多肽。此外,本公开涉及重组产生此类多肽或此类组合物的方法,以及在工业环境中使用或应用由此产生的多肽或组合物的方法,例如,用于淀粉处理(如液化、糖化和/或发酵)或饮料制备。
背景技术:
淀粉由直链淀粉(15%-30%w/w)和支链淀粉(70%-85%w/w)的混合物组成。直链淀粉由具有从约60,000至约800,000的分子量(mw)的α-1,4-连接的葡萄糖单元的线性链组成。支链淀粉是每24-30个葡萄糖单元含有α-1,6分支点的支链聚合物;其mw可高达一亿。
α-淀粉酶通过随机切割内部的α-1,4-糖苷键水解淀粉、糖原和相关多糖。α-淀粉酶已用于多种不同目的,如淀粉液化、糖化、发酵、酿造、烘焙、纺织品脱浆、纺织品洗涤、纸张和纸浆工业中的淀粉修饰以及动物饲料中可消化性的增加。
根据工业应用,适合于这些工业过程的α-淀粉酶可以是多种多样的。因此,本领域始终需要具有改善或不同性质(如最佳ph、最佳温度、底物特异性和/或热稳定性)的替代α-淀粉酶。
本公开的一个目的是提供具有α-淀粉酶活性的某些多肽、编码所述多肽的多核苷酸、可用于产生此类多肽的核酸构建体、包含所述多肽的组合物、以及制备和使用此类多肽的方法。
技术实现要素:
本发明的多肽、组合物以及使用或应用所述多肽或组合物的方法。所述多肽、组合物和方法的方面和实施例描述于以下独立编号的段落中。
1.在一方面,一种具有α-淀粉酶活性的多肽,所述多肽选自由以下组成的组:
(a)包含氨基酸序列的多肽,所述氨基酸序列优选
与seqidno:3的多肽具有至少90%同一性;
(b)包含氨基酸序列的多肽,所述氨基酸序列优选
与seqidno:3的催化结构域具有至少90%同一性;
(c)包含氨基酸序列的多肽,所述氨基酸序列优选
与seqidno:3的接头和催化结构域具有至少90%同一性;
(d)由多核苷酸编码的多肽,所述多核苷酸优选至少在低严格条件下、更优选至少在中严格条件下、甚至更优选至少在中高严格条件下、最优选至少在高严格条件下和甚至最优选至少在极高严格条件下与以下项杂交
(i)seqidno:1的成熟多肽编码序列,
(ii)包含seqidno:1的成熟多肽编码序列的基因组dna序列,或者
(iii)(i)或(ii)的全长互补链;
(e)由多核苷酸编码的多肽,所述多核苷酸包含与seqidno:3的多肽编码序列优选具有至少90%同一性的核苷酸序列;
(f)变体,所述变体包含seqidno:3的多肽的一个或多个(例如,几个)氨基酸的取代、缺失和/或插入;
(g)在从表达宿主分泌过程中通过信号肽酶或翻译后修饰对seqidno:2的多肽进行加工而产生的成熟多肽;和
(h)(a)、(b)、(c)、(d)、(e)、(f)或(g)的多肽的片段,所述片段具有α-淀粉酶活性。
2.在另一方面,一种多核苷酸,所述多核苷酸包含编码如段落1所述的多肽的核苷酸序列。
3.在另一方面,一种载体,所述载体包含有效地连接至一个或多个控制序列的如段落2所述的多核苷酸,所述控制序列控制所述多肽在表达宿主内的产生。
4.在另一方面,一种重组宿主细胞,所述重组宿主细胞包含如段落2所述的多核苷酸。
5.在如段落4所述的宿主细胞的一些实施例中,所述宿主细胞是产乙醇微生物。
6.在如段落4或5所述的宿主细胞的一些实施例中,所述宿主细胞进一步表达和分泌一种或多种选自下组的另外的酶,该组包含蛋白酶、半纤维素酶、纤维素酶、过氧化物酶、脂解酶、木聚糖酶、脂肪酶、磷脂酶、酯酶、过水解酶、角质酶、果胶酶、果胶酸裂合酶、甘露聚糖酶、角蛋白酶、还原酶、氧化酶、酚氧化酶、脂加氧酶、木质素酶、葡糖淀粉酶、支链淀粉酶、植酸酶、鞣酸酶、戊聚糖酶、malanase、β-葡聚糖酶、阿拉伯糖苷酶、透明质酸酶、软骨素酶、漆酶、转移酶或其组合。
7.在另一方面,一种组合物,所述组合物包含如段落1所述的多肽。
8.在如段落7所述的组合物的一些实施例中,所述组合物进一步包含蛋白酶、半纤维素酶、纤维素酶、过氧化物酶、脂解酶、木聚糖酶、脂肪酶、磷脂酶、酯酶、过水解酶、角质酶、果胶酶、果胶酸裂合酶、甘露聚糖酶、角蛋白酶、还原酶、氧化酶、酚氧化酶、脂加氧酶、木质素酶、葡糖淀粉酶、支链淀粉酶、植酸酶、鞣酸酶、戊聚糖酶、malanase、β-葡聚糖酶、阿拉伯糖苷酶、透明质酸酶、软骨素酶、漆酶、转移酶或其组合。
9.在另一方面,一种产生具有α-淀粉酶活性的多肽的方法,所述方法包括:
(a)在有利于产生所述多肽的条件下培养如段落4所述的宿主细胞;和
(b)回收所述多肽。
10.在另一方面,一种使用如段落1所述的具有α-淀粉酶活性的多肽处理含淀粉材料的方法。
11.在另一方面,一种糖化淀粉底物的方法,所述方法包括
将所述淀粉底物与如段落1所述的具有α-淀粉酶活性的多肽接触;和
糖化所述淀粉底物以产生包含葡萄糖的糖类物质。
12.在如段落11所述的方法的一些实施例中,其中糖化所述淀粉底物产生高葡萄糖糖浆。
13.在如段落11或12所述的方法的一些实施例中,其中所述高葡萄糖糖浆包含选自以下列表的葡萄糖量,该列表由以下组成:至少95.5%葡萄糖、至少95.6%葡萄糖、至少95.7%葡萄糖、至少95.8%葡萄糖、至少95.9%葡萄糖、至少96%葡萄糖、至少96.1%葡萄糖、至少96.2%葡萄糖、至少96.3%葡萄糖、至少96.4%葡萄糖、至少96.5%葡萄糖和至少97%葡萄糖。
14.在如段落10-12中任一项所述的方法的一些实施例中,所述方法进一步包括将所述高葡萄糖糖浆发酵成终产物。
15.在如段落14所述的方法的一些实施例中,其中糖化和发酵作为同时糖化和发酵(ssf)工艺进行。
16.在如段落14或15所述的方法的一些实施例中,其中所述终产物是醇,例如乙醇。
17.在如段落14或15所述的方法的一些实施例中,其中所述终产物是选自下组的生物化学品,该组由以下组成:氨基酸、有机酸、柠檬酸、乳酸、琥珀酸、谷氨酸一钠、葡糖酸、葡萄糖酸钠、葡萄糖酸钙、葡萄糖酸钾、葡萄糖酸δ-内酯、异抗坏血酸钠、ω3脂肪酸、丁醇、赖氨酸、衣康酸、1,3-丙二醇、生物柴油和异戊二烯。
18.在如段落11-17中任一项所述的方法的一些实施例中,其中所述淀粉底物是约5%至99%、15%至50%或40%至99%干固体(ds)。
19.在如段落11-18中任一项所述的方法的一些实施例中,其中所述淀粉底物选自小麦、大麦、玉米、黑麦、稻、高粱、麸、木薯、买罗高粱、粟、马铃薯、甘薯、木薯淀粉及其任何组合。
20.在如段落11-19中任一项所述的方法的一些实施例中,其中所述淀粉底物包括液化淀粉、糊化淀粉或颗粒状淀粉。
21.在如段落11-20中任一项所述的方法的一些实施例中,所述方法进一步包括向所述淀粉底物中添加己糖激酶、木聚糖酶、葡萄糖异构酶、木糖异构酶、磷酸酶、植酸酶、支链淀粉酶、β-淀粉酶、葡糖淀粉酶、蛋白酶、纤维素酶、半纤维素酶、脂肪酶、角质酶、海藻糖酶、异淀粉酶、氧化还原酶、酯酶、转移酶、果胶酶、水解酶、α-葡萄糖苷酶、β-葡萄糖苷酶或其组合。
22.在另一方面,一种将如段落11-21中任一项所述的方法应用于产生糖类物质的方法。
23.在另一方面,一种由段落22所述的方法产生的糖类物质。
24.在另一方面,一种糖化和发酵淀粉底物以产生终产物的方法,所述方法包括
将所述淀粉底物与如段落1所述的具有α-淀粉酶活性的多肽接触;
糖化所述淀粉底物以产生包含葡萄糖的糖类物质;和
将所述糖类物质与发酵生物接触以产生终产物。
25.在如段落24所述的方法的一些实施例中,其中发酵作为同时糖化和发酵(ssf)工艺进行。
26.在如段落24或25所述的方法的一些实施例中,其中所述终产物是醇,例如乙醇。
27.在如段落24或25所述的方法的一些实施例中,其中所述终产物是选自下组的生物化学品,该组由以下组成:氨基酸、有机酸、柠檬酸、乳酸、琥珀酸、谷氨酸一钠、葡糖酸、葡萄糖酸钠、葡萄糖酸钙、葡萄糖酸钾、葡萄糖酸δ-内酯、异抗坏血酸钠、ω3脂肪酸、丁醇、赖氨酸、衣康酸、1,3-丙二醇、生物柴油和异戊二烯。
附图说明
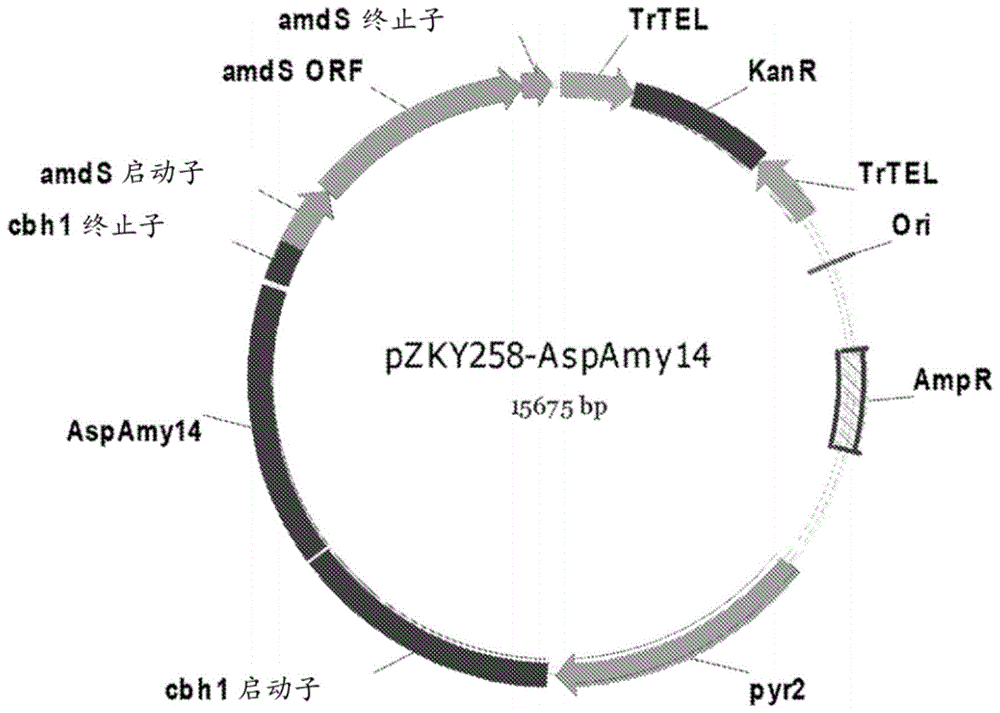
图1描绘了携带aspamy14α淀粉酶合成基因的pzky258表达载体
图2示出了aspamy14和acaaα淀粉酶的淀粉增溶活性的剂量响应曲线。小图a示出了在ph3.7下的结果,小图b示出了在ph4.5下的结果
图3(小图a、b和c)示出了实例11中描述的aspamy14和各种同源真菌α淀粉酶的muscle多蛋白序列比对。
具体实施方式
描述了来自曲霉属(aspergillus)的具有α-淀粉酶活性的多肽和包含此类多肽的组合物。本公开进一步涉及编码此类多肽的多核苷酸,包含编码此类多肽的基因的工程化核酸构建体、载体和宿主细胞,所述工程化核酸构建体、载体和宿主细胞也能够产生此类多肽。此外,本公开还涉及重组产生此类多肽或此类组合物的方法,以及在工业环境中使用或应用由此产生的多肽或组合物的方法,例如,用于淀粉液化、糖化、发酵以及食品或饮料制备。下文详细描述了所述组合物和方法的这些和其他方面。
在描述本发明的组合物和方法的各个方面和实施例之前,描述了以下定义和缩写。
1.定义和缩写
根据这一详细说明,以下缩写和定义适用。应当注意单数形式“一个/一种(a/an)”和“所述(the)”包括复数个指示物,除非上下文中另有清楚地指示。因此,例如提及“酶”包括多个此类酶,并且提及“剂量”包括提及一个或多个剂量以及本领域普通技术人员已知的其等效物,等等。
将本文件组织成几部分以便于阅读;然而,读者将领会的是,在一个部分中进行的陈述可能适用于其他部分。以这种方式,用于本公开的不同部分的标题不应被解释为限制。
除非另有定义,否则本文使用的所有技术和科学术语具有与本领域普通技术人员通常所理解的相同的含义。下文提供了以下术语。
1.1.缩写和首字母缩略词
除非另外说明,以下缩写/首字母缩略词具有以下含义:
abts2,2-连氮基-双-3-乙基苯并噻唑啉-6-磺酸
cdna互补dna
dna脱氧核糖核酸
dpn具有n个亚基的糖聚合度
ds或ds干固体
ga葡糖淀粉酶
gau/gds葡糖淀粉酶活性单元/克干固体
irs不可溶残留淀粉
kda千道尔顿
mw分子量
ncbi国家生物技术信息中心
pahbah对羟基苯甲酸酰肼
peg聚乙二醇
pi等电点
pi性能指数
ppm百万分率,例如μg蛋白质/克干固体
rna核糖核酸
sds-page十二烷基硫酸钠-聚丙烯酰氨凝胶电泳
ssf同时糖化和发酵
ssu/g固体可溶淀粉单元/克干固体
sp.物种
trga里氏木霉葡糖淀粉酶
w/v重量/体积
w/w重量/重量
v/v体积/体积
wt%重量百分比
℃摄氏度
h2o水
dh2o或di去离子水
dih2o去离子水,milli-q过滤
g或gm克
μg微克
mg毫克
kg千克
μl和μl微升
ml和ml毫升
m摩尔的
mm毫摩尔的
μm微摩尔的
u单位
sec秒
min(s)分钟/分钟
hr(s)小时/小时
do溶解的氧
etoh乙醇
eq.当量
n正常
pdb蛋白质数据库
cazy碳水化合物活性酶数据库
tris-hcl三(羟甲基)氨基甲烷盐酸盐
hepes4-(2-羟乙基)-1-哌嗪乙磺酸
ms/cm毫西门子/厘米
cv柱体积
1.2.定义
术语“淀粉酶”或“淀粉分解酶”是指这样的酶:除其他事项之外,其能够催化淀粉的降解。α-淀粉酶是切割淀粉中的α-d-(1→4)o-糖苷键的水解酶。通常,α-淀粉酶(ec3.2.1.1;α-d-(1→4)-葡聚糖葡聚糖水解酶)定义为内切作用的酶,其以随机方式切割淀粉分子内的α-d-(1→4)o-糖苷键,产生含有三个或更多个(1-4)-α-连接的d-葡萄糖单元的多糖。相反,外切作用的淀粉分解酶,例如β-淀粉酶(ec3.2.1.2;α-d-(1→4)-葡聚糖麦芽糖水解酶)和一些产物特异性淀粉酶,如产麦芽的α-淀粉酶(ec3.2.1.133)从底物的非还原端切割多糖分子。β-淀粉酶、α-葡糖苷酶(ec3.2.1.20;α-d-葡糖苷葡糖水解酶)、葡糖淀粉酶(ec3.2.1.3;α-d-(1→4)-葡聚糖葡糖水解酶)以及产物特异性淀粉酶(如麦芽四糖苷酶(ec3.2.1.60)和麦芽六糖苷酶(ec3.2.1.98))可以产生特定长度的麦芽低聚糖或富含特定麦芽寡糖的糖浆。
术语“淀粉”是指由植物的复合多糖碳水化物组成的任何材料,该复合多糖碳水化物由具有化学式(c6h10o5)x(其中“x”可以是任何数目)的直链淀粉和支链淀粉组成。所述术语包括植物基材料,如谷物、谷类、草、块茎和根,并且更具体地,从小麦、大麦、玉米、黑麦、稻、高粱、麸、木薯、粟、买罗高粱、马铃薯、甘薯、和木薯淀粉获得的材料。术语“淀粉”包括颗粒状淀粉。术语“颗粒状淀粉”是指未加工的淀粉,即生淀粉,例如,尚未经受糊化的淀粉或者已经受淀粉的糊化温度或低于淀粉的糊化温度的淀粉。
关于多肽,术语“野生型”、“亲本”或“参考”是指在一个或多个氨基酸位置处不包含人为取代、插入或缺失的天然存在的多肽。类似地,关于多核苷酸,术语“野生型”、“亲本”或“参考”是指不包含人为核苷变化的天然存在的多核苷酸。然而,注意编码野生型、亲本、或参考多肽的多核苷酸不限于天然存在的多核苷酸,并且涵盖编码野生型、亲本、或参考多肽的任何多核苷酸。
参考野生型多肽应理解为包括多肽的成熟形式。术语“成熟多肽”在本文被定义为在翻译和任何翻译后修饰(如n末端加工、c末端截短、糖基化、磷酸化等)之后呈其最终形式的多肽。待分泌的多肽被易位至内质网(er)。短疏水性n末端信号肽促进了这一点,其允许从细胞质到er腔的共翻译或翻译后易位,并通常由13至36个主要是疏水性氨基酸组成(序列前)(ng等人,1996;zimmermann等人,2011)。在信号肽被er驻留信号肽酶切割并被分子伴侣和折叠酶正确折叠后,蛋白质随后被转运至高尔基网。随后,蛋白质被递送到它们的最终细胞位置,可能是er、高尔基体、分泌小泡、过氧化物酶体、核内体、液泡、细胞壁或细胞外部(最近由delic等人,2013综述)。先前的研究已表明,细胞对每种蛋白质的折叠、分泌和加工能力均不同,并且n末端氨基酸可能影响分泌前导序列的切割(wang等人,2014)。一些蛋白质在翻译后被修饰,例如,通过从蛋白质前体上切割,因此,在其n末端可能具有不同的氨基酸。根据实验条件,确切的n末端序列也易于表现出独特的模式。
关于多肽,术语“变体”是指与指定的野生型、亲本或参考多肽不同的多肽,因为它包括一种或多种天然存在的或人造的氨基酸取代、插入或缺失。类似地,关于多核苷酸,术语“变体”是指在核苷酸序列中与指定的野生型、亲本或参比多核苷酸不同的多核苷酸。野生型、亲本或参考多肽或多核苷酸的身份将从上下文中显而易见。
在本发明的α-淀粉酶的情况下,“活性”是指α-淀粉酶活性,其可以如本文所述进行测量。
术语“重组”当用于提及主题细胞、核酸、蛋白质或载体时,表明受试者已经从其天然状态被修饰。因此,例如,重组细胞表达在天然(非重组)形式的细胞中未发现的基因,或以不同于自然界发现的水平或在不同于自然界发现的条件下表达天然基因。重组核酸与天然序列不同在于一个或多个核苷酸,和/或有效地连接到异源序列,例如表达载体中的异源启动子。重组蛋白质可以与天然序列不同在于一个或多个氨基酸,和/或与异源序列融合。包含编码淀粉酶的核酸的载体是重组载体。
术语“纯化的”是指处于相对纯状态的材料(例如,分离的多肽或多核苷酸),例如,至少约90%纯、至少约95%纯、至少约98%纯或甚至至少约99%纯。
术语“富集的”是指约50%纯、至少约60%纯、至少约70%纯或甚至至少约70%纯的材料(例如,分离的多肽或多核苷酸)。
关于酶的术语“热稳定的”和“热稳定性”是指酶在暴露于升高的温度后保持活性的能力。酶(例如淀粉酶)的热稳定性通过以分钟、小时或天给出的其半衰期(t1/2)来测量,在此期间酶活性的一半在限定条件下丧失。半衰期可以通过测量例如暴露于(即,受挑战于)升高的温度后的残余α-淀粉酶活性来计算。
关于酶的“ph范围”是指在其下酶显示催化活性的ph值的范围。
关于酶的术语“ph稳定”和“ph稳定性”涉及在一个宽范围内的ph值下,酶保持预定时间段(例如,15min.、30min.、1小时)的活性的能力。
术语“氨基酸序列”与术语“多肽”“蛋白质”和“肽”同义,并且可互换地使用。当此类氨基酸序列显示出活性时,它们可以被称为“酶”。使用针对氨基酸残基的常规单字母或三字母密码,采用标准氨基端-至-羧基端取向(即n→c)表示氨基酸序列。
术语“核酸”涵盖能够编码多肽的dna、rna、异源双链体、以及合成分子。核酸可以是单链的或双链的,并且可以被化学修饰。术语“核酸”和“多核苷酸”可互换地使用。由于遗传密码是简并的,可以使用多于一个密码子来编码具体的氨基酸,并且本发明的组合物和方法涵盖编码具体氨基酸序列的核苷酸序列。除非另有说明,核酸序列以5′-至-3′取向呈现。
术语“杂交”是指如在印迹杂交技术和pcr技术期间发生的,一条核酸链与互补链形成双链体(即碱基对)的过程。严格杂交条件通过在以下条件下杂交来例证:65℃和0.1xssc(其中1xssc=0.15mnacl、0.015m柠檬酸三钠,ph7.0)。杂交的双链核酸的特征在于熔融温度(tm),其中一半杂交的核酸与互补链不配对。双链体内错配的核苷酸降低tm。
“合成”分子是通过体外化学或酶促合成而不是通过生物产生的。
在将核酸序列插入细胞的上下文中,术语“引入”意指本领域已知的“转染”、“转化”或“转导”。
“宿主菌株”或“宿主细胞”是已经引入了表达载体、噬菌体、病毒或其他dna构建体,包括编码目的多肽(例如,淀粉酶)的多核苷酸的生物体。示例性宿主菌株是能够表达目的多肽和/或发酵糖的微生物细胞(例如,细菌、丝状真菌和酵母)。术语“宿主细胞”包括从细胞产生的原生质体。
关于多核苷酸或蛋白质的术语“异源”是指不是天然存在于宿主细胞中的多核苷酸或蛋白质。
关于多核苷酸或蛋白质的术语“内源”是指天然存在于宿主细胞中的多核苷酸或蛋白质。
术语“表达”是指基于核酸序列产生多肽的过程。所述过程包括转录和翻译两者。
“选择性标记”或“可选择标记”是指能够在宿主中被表达以促进选择携带所述基因的宿主细胞的基因。可选择标记的实例包括但不限于在宿主细胞上赋予代谢优势(如营养优势)的抗微生物剂(例如,潮霉素、博来霉素或氯霉素)和/或基因。
术语“载体”是指设计用于将核酸引入一种或多种细胞类型的多核苷酸序列。载体包括克隆载体、表达载体、穿梭载体、质粒、噬菌体颗粒、盒等。
“表达载体”是指包含编码目的多肽的dna序列的dna构建体,所述编码序列与能够在适合的宿主中影响dna表达的适合控制序列有效地连接。此类控制序列可以包括影响转录的启动子,控制转录的任选的操纵子序列,编码mrna上适合的核糖体结合位点的序列,增强子以及控制转录和翻译终止的序列。
术语“有效地连接”意指:指定组分处于允许它们以预期方式起作用的关系(包括但不限于并列)。例如,调控序列与编码序列有效地连接,使得编码序列的表达受调控序列的控制。
“信号序列”是与蛋白质的n-末端部分附接的氨基酸序列,所述氨基酸序列有利于蛋白质在细胞外的分泌。细胞外的蛋白质的成熟形式缺乏在分泌过程中被切除的信号序列。
“生物学活性的”是指具有指定生物活性,例如酶活性的序列。
术语“比活性”是指在特定条件下每单位时间通过酶或酶制剂可转化为产物的底物的摩尔数。比活度通常表示为单元(u)/mg蛋白质。
“包含淀粉酶的经培养的细胞材料”或类似语言是指包含淀粉酶作为组分的细胞裂解物或上清液(包括介质)。细胞材料可以来自异源宿主,其在培养物中生长,目的是产生淀粉酶。
“序列同一性百分比”是指当使用具有默认参数的clustalw算法比对时,具体序列具有与指定参考序列中的氨基酸残基相同的至少一定百分比的氨基酸残基。参见thompson等人(1994)nucleicacidsres.[核酸研究]22:4673-4680。clustalw算法的默认参数是:
空位开放罚分:10.0
空位延伸罚分:0.05
蛋白质权重矩阵:blosum系列
dna权重矩阵:iub
延迟发散序列%:40
空位分隔距离:8
dna转换权重:0.50
列表亲水残基:gpsndqekr
使用负性矩阵:关
切换特殊残基罚分:开
切换亲水罚分:开
切换结束空位分隔罚分关。
与参考序列相比,缺失被视为不同一的残基。包括在任一末端发生的缺失。例如,从c末端缺失五个氨基酸残基的变体500-氨基酸残基多肽将相对于亲本多肽具有99%的序列同一性百分比(495/500个相同残基×100)。此类变体将被语言“与亲本具有至少99%的序列同一性的变体”所涵盖。
“融合”多肽序列通过两个受试多肽序列之间的肽键连接,即有效地连接。
术语“聚合度”(dp)是指给定的糖中脱水吡喃葡萄糖单元的数目(n)。dp1的实例是单糖葡萄糖和果糖。dp2的实例是二糖麦芽糖和蔗糖。术语“de”或“右旋糖当量”被定义为还原糖(即d-葡萄糖)的百分比,作为糖浆中总碳水化合物的分数。
术语“干固体含量”(ds)是指基于干重百分比的、浆料的总固体。术语“浆料”指含有不可溶固体的水性混合物。
短语“同时糖化和发酵(ssf)”是指生物化学品的生产过程,其中在同一工艺步骤中存在微生物,例如产乙醇微生物和至少一种酶,例如淀粉酶。ssf包括在相同的反应容器中同时将淀粉底物(颗粒状、液化的或溶解的)水解为糖类物质(包括葡萄糖)和将糖类物质发酵为醇类或其他的生物化学品或生物材料。
“产乙醇微生物”是指具有将糖或其他糖类物质转化为乙醇的能力的微生物。
术语“生物化学品”是指微生物的代谢物,如柠檬酸、乳酸、丁二酸、谷氨酸一钠、葡糖酸、葡萄糖酸钠、葡萄糖酸钙、葡萄糖酸钾、葡萄糖酸δ-内酯、异抗坏血酸钠、ω3脂肪酸、丁醇、异丁醇、氨基酸、赖氨酸、衣康酸、其他有机酸、1,3-丙二醇、维生素类、或异戊二烯、或者其他生物材料。
术语“发酵饮料”是指通过包括发酵工艺(例如微生物发酵,如细菌和/或真菌发酵)的方法生产的任何饮料。“啤酒”是这种发酵饮料的一个实例,并且所述术语“啤酒”意指包括通过发酵/酿造含淀粉的植物材料生产的任何发酵的麦芽汁。通常,啤酒仅生产自麦芽或辅料、或麦芽与辅料的任何组合。
术语“约”是指参考值的±15%。
2.本发明使用的具有α-淀粉酶活性的多肽
在第一方面,本发明涉及包含氨基酸序列的多肽,所述氨基酸序列与seqidno:3的多肽优选具有至少90%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%和甚至至少99%的氨基酸序列同一性,并且具有α-淀粉酶活性。
在一些实施例中,本发明的多肽是包含以下氨基酸序列的同源多肽,所述氨基酸序列与seqidno:3的多肽相差十个氨基酸、优选地相差九个氨基酸、优选地相差八个氨基酸、优选地相差七个氨基酸、优选地相差六个氨基酸、优选地相差五个氨基酸、更优选地相差四个氨基酸、甚至更优选地相差三个氨基酸、最优选地相差两个氨基酸、并且甚至最优选地相差一个氨基酸。
在一些实施例中,本发明的多肽是seqidno:3的多肽的变体或其具有α-淀粉酶活性的片段。
在一些实施例中,本发明的多肽是包含seqidno:2的氨基酸22至499的催化区,通过clustalxhttps://www.ncbi.nlm.nih.gov/pubmed/17846036预测。
在一些实施例中,本发明的多肽是包含seqidno:2的氨基酸22至550的催化区和接头区,通过clustalxhttps://www.ncbi.nlm.nih.gov/pubmed/17846036预测。
在第二方面,本发明的α-淀粉酶包含相对于seqidno:3的氨基酸序列的一个或几个氨基酸残基的保守取代。表i中列出了示例性保守氨基酸取代。一些保守突变可以通过遗传操作产生,而其他通过用其他方式将合成的氨基酸引入多肽中产生。
表1.保守氨基酸取代
在一些实施例中,本发明的α-淀粉酶包含相对于seqidno:3的氨基酸序列具有一个或几个氨基酸残基缺失、取代、插入或添加。在一些实施例中,本发明的α-淀粉酶通过保守取代一个或几个氨基酸残基而衍生自seqidno:3的氨基酸序列。在一些实施例中,本发明的α-淀粉酶相对于seqidno:3的氨基酸序列通过缺失、取代、插入或添加一个或几个氨基酸残基而衍生自seqidno:3的氨基酸序列。在所有情况下,表述“一个或几个氨基酸残基”是指10个或更少,即1、2、3、4、5、6、7、8、9或10个氨基酸残基。
在另一实施例中,本发明还涉及seqidno:3的碳水化合物结合结构域变体,所述变体在一个或多个(例如,几个)位置处包含取代、缺失和/或插入。
本发明的淀粉酶可以是“前体”、“未成熟的”或“全长”,在这种情况下它们包括信号序列;或“成熟”,在这种情况下,它们缺少信号序列。成熟形式的多肽通常是最有用的。除非另有说明,本文使用的氨基酸残基编号是指相应淀粉酶多肽的成熟形式。只要所得的多肽保留淀粉酶活性,本发明的淀粉酶多肽还可以被截短以除去n末端或c末端。
可替代地,所述氨基酸改变具有这样一种性质:改变多肽的物理化学特性。例如,氨基酸改变可以提高多肽的热稳定性、改变底物特异性、改变最适ph等。
使用已知的诱变、重组和/或改组方法、随后进行一个相关的筛选程序可以做出单或多氨基酸取代、缺失和/或插入并对其进行测试,这些相关的筛选程序例如由reidhaar-olson和sauer,1988,science[科学]241:53-57;bowie和sauer,1989,proc.natl.acad.sci.usa[美国国家科学院院刊]86:2152-2156;wo95/17413;或wo95/22625中披露的那些。可以使用的其他方法包括易错pcr、噬菌体展示(例如,lowman等人,1991,biochem.[生物化学]30:10832-10837;美国专利号5,223,409;wo92/06204)和区域定向诱变(derbyshire等人,1986,gene[基因]46:145;ner等人,1988,dna7:127)。
诱变/改组方法可以与高通量自动化筛选方法组合以检测由宿主细胞表达的、克隆的诱变多肽的活性(ness等人,1999,naturebiotechnology[自然生物技术]17:893-896)。可从宿主细胞回收编码活性多肽的诱变的dna分子,并使用本领域的标准方法快速测序。这些方法允许迅速确定目的多肽中单个氨基酸残基的重要性,并且可适用于未知结构的多肽。
淀粉酶可以是“嵌合”或“杂合”多肽,因为其包括来自第一淀粉酶的至少一部分,和来自第二淀粉酶、葡糖淀粉酶、β-淀粉酶、α-葡糖苷酶或其他淀粉降解酶的至少一部分,或甚至其他糖基水解酶,例如但不限于纤维素酶、半纤维素酶等(包括最近被“重新发现”为结构域交换淀粉酶的嵌合淀粉酶)。本发明的淀粉酶可进一步包含异源信号序列,即允许跟踪或纯化等的表位。示例性异源信号序列来自地衣芽孢杆菌(b.licheniformis)淀粉酶(lat)、枯草芽孢杆菌(b.subtilis)(amye或apre)和链霉菌属(streptomyces)cela。
3.产生α-淀粉酶
本发明的α-淀粉酶可以在宿主细胞中产生,例如通过分泌或细胞内表达。在将α-淀粉酶分泌到细胞培养基中后,可以获得包含α-淀粉酶的培养细胞材料(例如,全细胞培养液)。任选地,α-淀粉酶可以从宿主细胞中分离,或甚至从细胞培养液中分离,这取决于最终α-淀粉酶所需的纯度。可以根据本领域熟知的方法克隆和表达编码α-淀粉酶的基因。合适的宿主细胞包括细菌、真菌(包括酵母和丝状真菌)和植物细胞(包括藻类)。特别有用的宿主细胞包括黑曲霉(aspergillusniger)、米曲霉(aspergillusoryzae)、里氏木霉(trichodermareesi)或嗜热毁丝霉(myceliopthorathermophila)。其他宿主细胞包括细菌细胞,例如枯草芽孢杆菌(bacillussubtilis)或地衣芽孢杆菌(b.licheniformis),以及链霉菌属(streptomyces)。
另外,宿主可以表达一种或多种辅酶、蛋白质、肽。这些可以有益于液化、糖化、发酵、ssf和下游处理。此外,除了用于消化各种原料的酶之外,宿主细胞还可以产生乙醇和其他生物化学物质或生物材料。此类宿主细胞可用于发酵或同时糖化和发酵过程,以减少或消除添加酶的需要。
3.1.载体
可以构建包含编码α-淀粉酶的核酸的dna构建体以在宿主细胞中表达。由于遗传密码中已知的简并性,编码相同氨基酸序列的不同多核苷酸可以用常规技术进行设计和制备。优化用于特定宿主细胞的密码子也是本领域熟知的。可以将编码α-淀粉酶的核酸掺入载体。可以使用已知的转化技术(例如以下披露的那些)将载体转移至宿主细胞中。
载体可以是可以转化到宿主细胞中并在宿主细胞内复制的任何载体。例如,包含编码α-淀粉酶的核酸的载体可以在细菌宿主细胞中转化并复制。包含编码α-淀粉酶的核酸的载体还可以被转化并方便地整合至细菌宿主细胞的染色体中(以一个或多个拷贝),并且整合通常被认为是有利的,因为dna序列更可能在细胞中被稳定保持。代表性的有用载体是p2jm103bbi(vogtentanz,proteinexprpurif[蛋白表达纯化],55:40-52,2007),可以用常规技术对其进行修饰并整合至宿主细胞的染色体中,从而使其包含其他dna片段以改善本发明的α-淀粉酶的表达。
用作表达宿主的宿主细胞可以包括,例如,丝状真菌。美国真菌遗传学库存中心(fgsc)的菌种目录列出了适合在真菌宿主细胞中表达的载体。参见fgsc,菌种目录,密苏里大学,网址为www.fgsc.net(最新修改时间为2007年1月17日)。代表性的有用载体是ptrex3gm(参见,公开的美国专利申请20130323798)和pttt(参见,公开的美国专利申请20110020899),它们可以被插入宿主的基因组中。可以用常规技术修饰载体ptrex3gm和pttt,使得它们包含并表达编码本发明的α-淀粉酶多肽的多核苷酸。
可以将编码α-淀粉酶的核酸有效地连接到适合的启动子,其允许在宿主细胞中转录。启动子可以是在选择的宿主细胞中显示转录活性的任何dna序列,并且可以衍生自编码与宿主细胞同源抑或异源的蛋白质的基因。用于指导编码α-淀粉酶的dna序列的转录(特别是在细菌宿主中)的示例性启动子是衍生自以下的启动子:大肠杆菌(e.coli)的乳糖操纵子、天蓝链霉菌(streptomycescoelicolor)琼脂酶基因daga或cela、地衣芽孢杆菌(bacilluslicheniformis)α-淀粉酶基因(amyl)、嗜热脂肪芽孢杆菌(bacillusstearothermophilus)生麦芽糖淀粉酶基因(amym)、解淀粉芽孢杆菌(bacillusamyloliquefaciens)α-淀粉酶基因(amyq)、枯草芽孢杆菌(bacillussubtilis)xyla和xylb基因等。对于在真菌宿主中的转录,有用的启动子的实例是衍生自编码米曲霉(aspergillusoryzae)taka淀粉酶、米氏根瘤菌(rhizomucormiehei)天冬氨酸蛋白酶、黑曲霉(aspergillusniger)中性α-淀粉酶、黑曲霉酸稳定性α-淀粉酶、黑曲霉葡糖淀粉酶、米氏根瘤菌脂肪酶、米曲霉碱性蛋白酶、米曲霉三糖磷酸异构酶或构巢曲霉(a.nidulans)乙酰胺酶的基因的启动子。当编码淀粉酶的基因在细菌物种(如大肠杆菌)中表达时,可以从,例如,包括t7启动子和噬菌体λ启动子的噬菌体启动子中选择适合的启动子。用于在酵母物种中表达的适合的启动子的实例包括但不限于啤酒酵母(saccharomycescerevisiae)的gal1和gal10启动子以及毕赤酵母(pichiapastoris)aox1或aox2启动子。用于在丝状真菌中表达的适合的启动子的实例包括但不限于cbh1,其是来自里氏木霉的内源性诱导型启动子。参见liu等人(2008)“improvedheterologousgeneexpressionintrichodermareeseibycellobiohydrolaseigene(cbh1)promoteroptimization[纤维二糖水解酶i基因(cbh1)启动子优化改善里氏木霉中的异源基因表达],”actabiochim.biophys.sin(shanghai)[生物化学与生物物理学报(上海)]40(2):158-65。
编码序列可以有效地连接到信号序列。编码信号序列的dna可以是与待表达的淀粉酶基因天然相关或来自不同属或物种的dna序列。包含信号序列和启动子序列的dna构建体或载体可以被引入真菌宿主细胞中,并且可以衍生自相同来源。例如,信号序列是有效地连接到cbh1启动子的cbh1信号序列。
表达载体还可以包含适合的转录终止子,并且在真核生物中,聚腺苷酸化序列有效地连接到编码α-淀粉酶的dna序列。终止序列和聚腺苷酸化序列可以适当地来源于与启动子相同的来源。
该载体可以进一步包含使得该载体能够在宿主细胞中复制的dna序列。此类序列的实例是质粒puc19、pacyc177、pub110、pe194、pamb1和pij702的复制起点。
载体还可以包含可选择标记,例如,弥补分离的宿主细胞中的缺陷的基因产物,如枯草芽孢杆菌或地衣芽孢杆菌的dal基因,或赋予抗生素抗性(例如,氨苄西林、卡那霉素、氯霉素或四环素抗性)的基因。此外,载体可以包含曲霉属选择标记,例如amds、argb、niad和xxsc,引起潮霉素抗性的标记,或者选择可以通过共转化(如本领域已知的)实现。参见,例如,国际pct申请wo91/17243。
细胞内表达在某些方面可能是有利的,例如,当使用某些细菌或真菌作为宿主细胞产生大量淀粉酶用于随后的富集或纯化时。淀粉酶的细胞外分泌至培养基中可用于制备包含分离的淀粉酶的培养的细胞材料。
用于分别连接编码淀粉酶的dna构建体、启动子、终止子和其他元件,并将它们插入到含有复制所需信息的适合的载体中的程序是本领域技术人员熟知的(参见,例如,sambrook等人,molecularcloning:alaboratorymanual[分子克隆:实验室手册],第二版,coldspringharbor[冷泉港实验室],1989,和第三版,2001)。
3.2.宿主细胞的转化和培养
包含dna构建体或表达载体的分离的细胞有利地用作重组产生淀粉酶的宿主细胞。通过将dna构建体(以一或多个拷贝)整合到宿主染色体中,可以方便地用编码酶的dna构建体转化细胞。通常认为这种整合是有利的,因为dna序列更可能在细胞中稳定保持。可以根据常规方法,例如,通过同源或异源重组,将dna构建体整合到宿主染色体中。可替代地,可以用如上所述的与不同类型的宿主细胞相关的表达载体转化细胞。
适合的细菌宿主生物的实例是革兰氏阳性细菌物种,如芽孢杆菌属(bacillaceae),包括枯草芽孢杆菌(bacillussubtilis)、地衣芽孢杆菌(bacilluslicheniformis)、迟缓芽孢杆菌(bacilluslentus)、短芽孢杆菌(bacillusbrevis)、嗜热脂肪地芽孢杆菌(geobacillusstearothermophilus)(原嗜热脂肪芽孢杆菌(bacillusstearothermophilus)、嗜碱芽孢杆菌(bacillusalkalophilus)、解淀粉芽孢杆菌(bacillusamyloliquefaciens)、凝结芽孢杆菌(bacilluscoagulans)、灿烂芽孢杆菌(bacilluslautus)、巨大芽孢杆菌(bacillusmegaterium)和苏云金芽孢杆菌(bacillusthuringiensis);链霉菌属(streptomyces)物种,如鼠灰链霉菌(streptomycesmurinus);乳酸菌物种,包括乳球菌属物种(lactococcussp.),如乳酸乳球菌(lactococcuslactis);乳杆菌属物种(lactobacillussp.),包括罗伊氏乳杆菌(lactobacillusreuteri);明串珠菌属物种(leuconostocsp.);片球菌属物种(pediococcussp.);和链球菌属物种(streptococcussp.)。可替代地,可以选择属于肠杆菌科(enterobacteriaceae)(包括大肠杆菌)或假单胞菌科(pseudomonadaceae)的革兰氏阴性细菌物种作为宿主生物。
适合的酵母宿主生物可以选自生物技术相关的酵母物种,例如但不限于酵母物种,如毕赤酵母属物种(pichiasp.)、汉逊酵母属物种(hansenulasp.)或克鲁维酵母属(kluyveromyces)、耶氏酵母属(yarrowinia)、裂殖酵母属(schizosaccharomyces)物种或者酵母属(saccharomyces)物种,包括酿酒酵母(saccharomycescerevisiae),或者属于裂殖酵母属的物种,例如,粟酒裂殖酵母(s.pombe)。甲基营养型酵母物种菌种毕赤酵母可以用作宿主生物。可替代地,宿主生物可以是汉逊酵母属物种。
丝状真菌中适合的宿主生物包括曲霉属(aspergillus)的物种,例如,黑曲霉、米曲霉、塔宾曲霉(aspergillustubigensis)、泡盛曲霉(aspergillusawamori)或构巢曲霉(aspergillusnidulans)。转化曲霉属宿主细胞的适合的程序包括,例如,ep238023中描述的程序。可替代地,镰刀菌属(fusarium)物种(例如,尖孢镰刀菌(fusariumoxysporum))或根瘤菌属(rhizomucor)物种(如米氏根瘤菌(rhizomucormiehei))的菌种可以用作宿主生物。其他适合的菌种包括毁丝霉属(myceliopthora)、嗜热菌属(thermomyces)和毛霉菌属(mucor)物种。此外,木霉属物种可以用作宿主。转化木霉属宿主细胞的适合的程序包括,例如,
从表达宿主缺失基因是有利的,其中可以通过转化的表达载体治愈基因缺陷。已知方法可用于获得具有一种或多种失活基因的真菌宿主细胞。可以通过完全或部分缺失,通过插入失活或通过使基因对其预期目的不起作用的任何其他方式使得所述基因被阻止表达功能性蛋白来完成基因灭活。已克隆的、来自木霉属物种或其他丝状真菌宿主的任何基因均可以缺失,例如,cbh1、cbh2、egl1和egl2基因。基因缺失可通过本领域已知方法通过将待失活的所需基因的形式插入质粒中来完成。
适合的宿主细胞可以是产乙醇的微生物细胞,其可以表达一种或多种本文所述的淀粉酶同源物,和/或其他芽孢杆菌淀粉酶(包括来自地衣芽孢杆菌、嗜热脂肪芽孢杆菌、枯草芽孢杆菌和其他芽孢杆菌属物种),和/或其他来源的淀粉酶。这些可以进一步表达同源或异源淀粉降解酶,例如葡糖淀粉酶,即与宿主细胞不同物种的葡糖淀粉酶。另外,宿主可以表达一种或多种辅助酶、蛋白质和/或肽。这些可以有利于预处理、液化、糖化、发酵、ssf、釜馏、浓缩酒糟可溶物或糖浆等过程。此外,除了用于消化各种原料的酶之外,宿主细胞还可以产生乙醇和其他生物化学物质或生物材料。此类宿主细胞可用于发酵或同时糖化和发酵过程,以减少或消除添加酶的需要。
将dna构建体或载体引入宿主细胞中包括技术例如转化;电穿孔;核显微注射;转导;转染,例如脂质转染介导的和deae-糊精介导的转染;与磷酸钙dna沉淀一起孵育;用dna包被的微粒高速轰击;和原生质体融合。通用转化技术是本领域已知的。参见,例如sambrook等人(2001),同上。异源蛋白质在木霉属中的表达描述于例如美国专利号6,022,725。对于曲霉属菌种的转化,还参考了cao等人(2000)science[科学]9:991-1001。
3.3.表达和发酵
产生淀粉酶的方法可以包括在有利于产生所述酶的条件下如上所述培养宿主细胞,并从细胞和/或培养基中回收所述酶。
用于培养细胞的培养基可以是适合于宿主细胞生长并获得α-淀粉酶多肽表达的任何常规培养基。合适的培养基和培养基组分可从商业供应商获得或可以根据公开的配方(例如,如在美国典型培养物保藏中心(americantypeculturecollection)的目录中所述)来制备。
本领域熟知的任何发酵方法都可以合适用来使如上所述的转化的或衍生的真菌菌株发酵。在一些实施例中,真菌细胞在分批或连续发酵条件下生长。
3.4.淀粉酶活性的鉴定
为了评估淀粉酶在宿主细胞中的表达,测定可以测量表达的蛋白、相应的mrna或α-淀粉酶的活性。例如,适合的测定包括使用适当标记的杂交探针的rna印迹法、逆转录酶聚合酶链式反应和原位杂交。适合的测定还包括测量样品中的淀粉酶活性,例如通过直接测定培养基中的还原糖(如葡萄糖)的测定。例如,可以使用葡萄糖试剂盒no.15-uv(西格玛化学公司(sigmachemicalco.))或仪器如泰克尼康自动分析仪(techniconautoanalyzer)来确定葡萄糖浓度。α-淀粉酶活性还可以通过任何已知的方法测量,如下文所述的pahbah或abts测定。
3.5.富集和纯化α-淀粉酶的方法
分离和浓缩技术是本领域已知的,并且常规方法可用于制备包含本发明的α-淀粉酶多肽的浓缩溶液或肉汤。
发酵后,获得发酵液,通过常规分离技术去除微生物细胞和各种悬浮固体(包括剩余的粗发酵材料),以便获得α-淀粉酶溶液。通常使用过滤、离心、微滤、旋转真空鼓式过滤、超滤、离心然后超滤、提取或色谱法等。
有时可能需要浓缩包含α-淀粉酶多肽的溶液或肉汤以优化回收。使用未浓缩的溶液或肉汤通常会增加孵育时间,以便收集富集或纯化的酶沉淀。
4.用于淀粉降解的组合物和方法
本发明的α-淀粉酶可用于多种工业应用。例如,α-淀粉酶可用于淀粉降解过程中,特别是糊化淀粉的液化、同时液化和糖化、糖化、发酵和/或同时糖化和发酵(ssf)中。
淀粉转化过程可以是设计用于产生用于燃料或饮用的醇(即,可饮用的醇)或者其他生物化学品或生物材料的发酵过程的前体或与其同时进行。本领域普通技术人员知道可以用于生产这些终产物的各种发酵条件。α-淀粉酶的这些各种用途在下文更详细地描述。
4.1.淀粉底物的制备
本领域普通技术人员充分了解可用于制备用于本文公开的工艺中的淀粉底物的可用方法。例如,可以从块茎、根、茎、豆类、谷物或全谷物获得有用的淀粉底物。更具体地,可以从玉米、穗轴、小麦、大麦、黑麦、黑小麦、买罗高粱、西米、粟、木薯、木薯淀粉(tapioca)、高粱、稻、碗豆、菜豆、香蕉、或马铃薯中获得颗粒状淀粉。玉米含有约60%-68%的淀粉;大麦含有约55%-65%的淀粉;粟含有约75%-80%的淀粉;小麦含有约60%-65%的淀粉;以及精米含有70%-72%的淀粉。具体地,考虑的淀粉底物是玉米淀粉和小麦淀粉。来自谷粒的淀粉可以是磨碎的或完整的,并且包括玉米固体,例如籽粒、麸和/或穗轴。淀粉也可以是高度精制的生淀粉或来自淀粉精制过程的原料。各种淀粉也是可商购的。例如,玉米淀粉可获自cerestar,西格玛公司和片山化学工业公司(katayamachemicalindustryco.)(日本);小麦淀粉获自西格玛公司;甘薯淀粉可获自和光纯药工业株式会社(wakopurechemicalindustryco.)(日本);以及马铃薯淀粉可获自纳卡里化学制药公司(nakaarichemicalpharmaceuticalco.)(日本)。
淀粉底物可以是来自研磨的全谷物的粗淀粉,其含有非淀粉级分,例如胚芽残余物和纤维。研磨(milling)可以包括湿研磨或干研磨或者碾磨(grinding)。在湿研磨中,将全谷物浸泡在水或稀释的酸中以将谷粒分离成为其组成部分,例如淀粉、蛋白质、胚芽、油、籽粒纤维。湿研磨有效地分离胚芽与粉(即淀粉颗粒与蛋白质)并且尤其适合生产糖浆。待加工的淀粉可以是高度精制的淀粉质量,例如,至少90%、至少95%、至少97%或至少99.5%的纯度。在干研磨或碾磨中,不将谷粒分级成为其组成部分而将全籽粒碾磨为细粉并通常进行加工。在一些情况下,回收来自籽粒的油和/或纤维。因此除了淀粉之外,干碾磨的谷粒将包含大量的非淀粉碳水化合物。淀粉底物的干碾磨可用于产生乙醇以及其他生物化学品和生物材料。
4.2.淀粉的糊化和液化
术语“液化(liquefaction或liquefy)”意指将糊化淀粉转化为含有较短链可溶性糊精的较低粘度液体的方法,任选地可添加液化诱导酶和/或糖化酶。在一些实施例中,将如上文所述制备的淀粉底物用水制成浆料。淀粉浆料可以含有淀粉,其干固体的重量百分比为约10%-55%、约20%-45%、约30%-45%、约30%-40%或约30%-35%。例如,可以使用计量泵将α-淀粉酶(ec3.2.1.1)添加到浆料中。通常用于该应用的α-淀粉酶是热稳定的细菌α-淀粉酶,如嗜热脂肪地土芽孢杆菌(geobacillusstearothermophilus)α-淀粉酶、细胞噬菌体(cytophaga)α-淀粉酶等,例如,
淀粉加α-淀粉酶的浆料可以通过喷射式蒸煮锅(将其蒸汽加热至80℃-110℃,取决于含淀粉原料的来源)连续泵送。在这些条件下,糊化快速发生,并且酶活性与显著的剪切力相结合而开始水解淀粉底物。在喷射式蒸煮锅中的停留时间是短暂的。然后部分糊化的淀粉可以进入一系列保持在105℃-110℃的保留管中并保持5-8min,以完成糊化过程(“初次液化”)。在85℃-95℃或更高温度下的保留槽中完成针对所需de的水解持续约1至2小时(“二次液化”)。这些槽可含有挡板,以防止反混。如本文所用,术语“二次液化的分钟”是指从二次液化开始到测量右旋糖当量(de)时消逝的时间。然后使浆料冷却至室温。此冷却步骤可以为30分钟至180分钟,例如90分钟至120分钟。液化的淀粉通常为浆料形式,其干固体含量(w/w)为约10%-50%;约10%-45%;约15%-40%;约20%-40%;约25%-40%;或约25%-35%。
使用α-淀粉酶的液化有利地可以在低ph下进行,消除了将ph调节至约ph5.5-6.5的要求。α-淀粉酶可用于在2-7的ph范围内液化,例如,ph3.0-7.5、ph4.0-6.0或ph4.5-5.8。α-淀粉酶可以在约70℃-140℃的温度范围内保持液化活性,例如85℃、90℃或95℃。例如,可以在ph5.8和85℃,或ph4.5和95℃下,在25%ds玉米淀粉的溶液中用800μg淀粉酶进行液化10min。可以使用本领域中许多已知的粘度测定方法中的任何一种测定液化活性。
在使用本发明的α-淀粉酶的具体实施例中,淀粉液化在90℃-115℃的温度范围内进行,目的是产生高纯度葡萄糖糖浆、hfcs、麦芽糖糊精等。
4.3.糖化
可以使用α-淀粉酶,任选地在另外一种或多种酶的存在下,将液化淀粉糖化成富含低dp(例如dp1+dp2)糖的糖浆。糖化的产物的确切组成取决于所使用的酶的组合以及所加工的淀粉的类型。有利地,使用提供的α-淀粉酶可获得的糖浆可以含有糖化淀粉中总寡糖的dp2的重量百分比超过30%,例如,45%-65%或55%-65%。糖化淀粉中(dp1+dp2)的重量百分比可以超过约70%,例如,75%-85%或80%-85%。本发明的淀粉酶还在糖浆产品中产生相对高产率的葡萄糖,例如dp1>20%。
液化通常作为连续工艺进行,而糖化通常作为分批工艺进行。糖化条件取决于液化物的性质和可用的酶类型。在一些情况下,糖化过程可涉及约60℃-65℃的温度和约4.0-4.5的ph(例如ph4.3)。糖化可以在例如约40℃、约50℃、或约55℃至约60℃或约65℃的温度下进行,有必要冷却液化物。可以根据需要调节ph。糖化通常在搅拌槽中进行,这可能需要几个小时来填充或清空。酶通常以固定比率添加到干燥固体中(槽被填充时),或者以单剂量添加(在填充阶段开始时)。制备糖浆的糖化反应通常进行约24-72小时,例如24-48小时。例如,当已经获得最大或所需的de时,通过加热至85℃持续5min来停止反应。随着累积的葡萄糖经由酶促逆转反应和/或用热力学平衡的方法再聚合成异麦芽糖和/或其他逆转产物,进一步孵育将导致更低的de,最终达到约90de。优选地,糖化最佳在约30℃至约75℃的温度范围内进行,例如,45℃-75℃或47℃-75℃。糖化可以在约ph3至约ph7的ph范围内进行,例如,ph3.0-ph6.5、ph3.5-ph5.5、ph3.5、ph3.8或ph4.5。
可以将淀粉酶以组合物的形式添加到浆料中。可以将淀粉酶添加到颗粒状淀粉底物的浆料中。淀粉酶可以作为全培养液,澄清、富集、部分纯化、或纯化的酶添加。淀粉酶也可以作为全培养液产品添加。
可以将淀粉酶作为分离的酶溶液添加到浆料中。例如,淀粉酶可以按由表达这种淀粉酶的宿主细胞产生的培养细胞材料的形式添加。在发酵或ssf过程期间,淀粉酶也可以由宿主细胞分泌到反应介质中,使得酶连续地提供到反应中。产生和分泌淀粉酶的宿主细胞也可以表达另外的酶,例如葡糖淀粉酶。例如,美国专利号5,422,267公开了在酵母中使用葡糖淀粉酶来生产酒精饮料。例如,可以将宿主细胞(例如里氏木霉或黑曲霉、嗜热毁丝霉(myceliopthorathermophila)或酵母)工程化为在糖化期间共表达淀粉酶和葡糖淀粉酶,例如,腐质霉属(humicola)ga、木霉属ga或它们的变体。可以对宿主细胞进行遗传修饰,以便不表达其内源性葡糖淀粉酶和/或其他酶、蛋白质或其他材料。宿主细胞可以被工程化以表达广谱的各种糖解酶。例如,重组酵母宿主细胞可以包含编码葡糖淀粉酶、α-葡糖苷酶、β-淀粉酶、利用戊糖的酶、α-淀粉酶、支链淀粉酶、异淀粉酶、异支链淀粉酶、植酸酶、蛋白酶和/或其他酶的核酸。参见,例如,wo2011/153516a2。
4.4.粗淀粉水解
本发明的α-淀粉酶还可用于颗粒状淀粉或粗淀粉水解(rsh)或者颗粒状淀粉水解(gsh)过程中,以产生预期糖和发酵产物。术语“颗粒状淀粉”是指未煮过的粗淀粉,即在谷类、块茎或谷物中发现的天然形式的淀粉。“粗淀粉水解”过程(rsh)与常规淀粉处理过程不同,包括通常使用细菌α-淀粉酶在高温下液化糊化淀粉,然后在葡糖淀粉酶和发酵生物以及可能的其他酶的存在下同时糖化和发酵。rsh过程包括通常在至少存在淀粉酶和/或葡糖淀粉酶的情况下,在淀粉底物的糊化温度或以下,将颗粒状淀粉顺序或同时糖化和发酵。糊化温度可根据植物物种、植物物种的具体变种以及生长条件而不同。
在细菌、真菌、酵母或产乙醇微生物细胞中表达的本文所述的真菌α-淀粉酶可用于本文所述的粗淀粉水解过程中。
另外,本发明所述的α-淀粉酶以外的α-淀粉酶、葡糖淀粉酶、己糖激酶、木聚糖酶、葡萄糖异构酶、木糖异构酶、磷酸酶、植酸酶、支链淀粉酶、β-淀粉酶、蛋白酶、纤维素酶、半纤维素酶、脂肪酶、角质酶、异淀粉酶、氧化还原酶、酯酶、转移酶、果胶酶、α-葡糖苷酶、β-葡糖苷酶或其组合也可用于本文所述的粗淀粉水解过程中。所述酶可以与本发明的α-淀粉酶共表达或直接添加至粗淀粉水解过程中。
4.5.发酵
可溶性淀粉水解产物,特别是富含葡萄糖的糖浆,可以通过通常在约32℃的温度下,例如从30℃至35℃(对于产生醇的酵母),使淀粉水解产物与发酵生物接触来发酵。发酵的温度和ph将取决于发酵生物。发酵结束(eof)产物包括代谢产物,如柠檬酸、乳酸、琥珀酸、谷氨酸一钠、葡糖酸、葡萄糖酸钠、葡萄糖酸钙、葡萄糖酸钾、衣康酸和其他羧酸、葡萄糖酸δ-内酯、异抗坏血酸钠、氨基酸、赖氨酸和其他氨基酸、维生素、ω3脂肪酸、丁醇、异戊二烯、1,3-丙二醇、维生素和其他生物材料。
产乙醇微生物包括表达乙醇脱氢酶和丙酮酸脱羧酶的酵母(例如酿酒酵母(saccharomycescerevisiae))和细菌(例如运动发酵单胞菌(zymomonasmoblis))。产乙醇微生物可以表达木糖还原酶和木糖醇脱氢酶,上述两种酶将木糖转化为木酮糖。例如,可以承受更高温度的改善的产乙醇微生物菌株是本领域已知的并且可以使用的。参见liu等人,(2011)shengwugongchengxuebao[生物工程学报]27:1049-56。酵母菌的商业来源包括ethanol
糖化和发酵过程可以作为ssf过程进行。例如,发酵可以包括乙醇的随后的富集、纯化和回收。在发酵期间,肉汤或“啤酒”的乙醇含量可以达到约8%-18%v/v,例如14%-15%v/v。可以蒸馏培养液以产生富集的,例如96%纯的乙醇溶液。此外,可以用co2洗涤器收集通过发酵产生的co2、压缩并销售用于其他用途,例如碳酸饮料或干冰生产。来自发酵过程的固体废物可用作富含蛋白质的产品,例如牲畜饲料。
如前所述,可以用在整个ssf中连续表达和分泌淀粉酶的真菌细胞进行ssf过程。表达淀粉酶的真菌细胞也可以是发酵微生物,例如产乙醇微生物。因此,可以使用表达足够淀粉酶的真菌细胞进行乙醇生产,从而更少地需要或不需要外源地添加酶。真菌宿主细胞可以来自适当工程化的真菌菌株。除了淀粉酶之外,还可以使用表达和分泌其他酶的真菌宿主细胞。此类细胞可以表达葡糖淀粉酶和/或支链淀粉酶、植酸酶、α-葡糖苷酶、异淀粉酶、β-淀粉酶纤维素酶、木聚糖酶、其他半纤维素酶、蛋白酶、β-葡糖苷酶、果胶酶、酯酶、氧化还原酶、转移酶、或其他酶。
4.6.后发酵及来自后发酵的产物
通过以下产生发酵产物(如乙醇):通过液化和糖化、或先液化后ssf、或先糖化后发酵(粗淀粉过程),首先将含淀粉的材料降解为可发酵的糖,并使用发酵生物将糖直接或间接转化为希望的发酵产物。例如,通过蒸馏从发酵的醪液(通常称为“啤酒”或“啤酒醪液”)中回收液体发酵产物,如乙醇,所述蒸馏将希望的发酵产物与其他液体和/或固体分离。剩余级分,称为“全釜馏物”,例如,通过离心分离成固相和液相。固相称为“湿饼”(或“湿酒糟”或“wdg”),液相(上清液)称为“稀釜馏物”。将湿饼干燥以提供“干酒糟谷物”(ddg),用作动物饲料中的营养物。通常将稀釜馏物蒸发以提供冷凝液和糖浆(或“浓釜馏物”),或者可替代地将其作为“逆流”直接循环至浆料槽。冷凝物可以在排出前先送到甲烷化器,或可以循环至浆料槽。可以将主要由极限糊精和不可发酵糖组成的糖浆共混到ddg中,或在干燥之前将其添加到湿饼中,以产生ddgs(含可溶物的干酒糟谷物)。
已知商业上使用衍生自发酵过程(如乙醇生产过程)的各种副产物和残余物。已知酒糟的残余物或副产物,以及谷类和其他食品工业生产的副产物作为动物饲料的蛋白质和能量来源具有一定的价值。此外,来自副产物(如全釜馏物、湿饼、稀釜馏物、ddg和/或ddgs)的油可以作为单独的副产物回收,用于生物柴油生产或其他产品。
副产物(如ddg、ddgs或wdg)包含蛋白质、纤维、脂肪和未转化的淀粉。湿饼可用于奶牛饲养场。干ddg可用于家畜,例如,奶牛、肉牛和猪饲料以及家禽饲料。虽然蛋白质含量很高,但如果用作动物饲料,氨基酸组成不太适合单胃动物。此外,副产物含有大量粗纤维(cf),它们是由纤维素、半纤维素和不易消化的材料(如木质素)组成的结构性碳水化合物。粗纤维级分中纤维素和木质素的比例还确定了粗纤维的消化率及其在肠中的溶解度。可溶性非淀粉多糖(nsp)无法被单胃动物(如猪和家禽)消化,并且由于它们与水的结合能力而导致粘度增加,这可能导致湿粘的粪便和湿垫料。nsp的另一作用是所谓的“营养封装”。实质上,淀粉、蛋白质、油和其他营养物质被封装在植物细胞内,植物细胞是一种不可渗透的屏障,阻止了细胞内营养物质的充分利用。
此外,可溶性nsp可能会导致发酵过程中粘度升高,并可能影响生产过程中发酵副产物(如ddgs)的分离和干燥条件。
因此,已使用许多特定加工或处理方法,并正在研究这些特定加工或处理方法以改善发酵过程中副产物的质量。例如,在乙醇产生过程中,将酶添加至液化、糖化、发酵或ssf、全釜馏物、湿饼和/或稀釜馏物等,已被用于改善该过程中的固液分离,和/或改变或改善副产物的产率和/或质量。另外,这些酶还被用作获取残余淀粉的途径或作为获取残余淀粉的途径被研究,并且在某些情况下,作为获取与玉米纤维相关的纤维素和/或半纤维素糖的途径或作为获取与玉米纤维相关的纤维素和/或半纤维素糖的途径被研究。然后,合适的宿主可利用这些糖产生发酵产物,包括乙醇。本发明的淀粉酶可以在这些过程中使用,以及其他淀粉降解酶,如本发明所述的α-淀粉酶以外的α-淀粉酶、葡糖淀粉酶、己糖激酶、木聚糖酶、葡萄糖异构酶、木糖异构酶、磷酸酶、植酸酶、支链淀粉酶、β-淀粉酶、蛋白酶、纤维素酶、半纤维素酶、脂肪酶、角质酶、异淀粉酶、氧化还原酶、酯酶、转移酶、果胶酶、α-葡糖苷酶、β-葡糖苷酶或其组合,甚至半纤维素酶、纤维素酶。可以在该过程中的任何步骤添加酶。
5.包含α-淀粉酶的组合物
在一些实施例中,可以将包含与seqidno:3的氨基酸序列具有至少约90%、至少具有约95%同一性的氨基酸序列的多肽用于酶组合物中。
α-淀粉酶(ec3.2.1.1)可以与葡糖淀粉酶(ec3.2.1.3)例如,木霉属葡糖淀粉酶或其变体组合。示例性葡糖淀粉酶是里氏木霉葡糖淀粉酶(trga)及其变体,其具有优异的比活性和热稳定性。参见美国公开申请号2006/0094080、2007/0004018和2007/0015266(美国丹尼斯科公司)。trga的适合变体包括具有葡糖淀粉酶活性并且与野生型trga具有至少80%、至少90%、或至少95%序列同一性的变体。α-淀粉酶有利地增加由trga催化的糖化过程中产生的葡萄糖的产率。
可替代地,葡糖淀粉酶可以是衍生自植物(包括藻类)、真菌、或细菌的另一种葡糖淀粉酶。例如,葡糖淀粉酶可以是黑曲霉g1或g2葡糖淀粉酶或其变体(例如boel等人,(1984)emboj.[欧洲分子生物学学会杂志]3:1097-1102;wo92/00381;wo00/04136(诺和诺德公司(novonordiska/s));和泡盛曲霉葡糖淀粉酶(例如wo84/02921(cetus公司))。其他考虑的曲霉葡糖淀粉酶包括具有增强的热稳定性的变体,例如,g137a和g139a(chen等人(1996)prot.eng.[蛋白工程]9:499-505);d257e和d293e/q(chen等人(1995)prot.eng.[蛋白工程]8:575-582);n182(chen等人(1994)biochem.j.[生物化学期刊]301:275-281);a246c(fierobe等人(1996)biochemistry[生物化学],35:8698-8704);和在位置a435和s436有pro残基的变体(li等人(1997)proteineng.[蛋白工程]10:1199-1204)。其他考虑的葡糖淀粉酶包括踝节菌属(talaromyces)葡糖淀粉酶,特别是衍生自埃默森踝节菌(t.emersonii)(例如wo99/28448(诺和诺德公司))、嗜热篮状菌(t.leycettanus)(例如美国专利号re32,153(cpc国际公司))、t.duponti或嗜热踝节菌(t.thermophilus)(例如美国专利号4,587,215)。考虑的细菌葡糖淀粉酶包括来自梭菌属(clostridium)的葡糖淀粉酶,特别是热淀粉酶梭状芽孢杆菌(c.thermoamylolyticum)(例如ep135138(cpc国际公司))和热氢硫酸梭菌(c.thermohydrosulfuricum)(例如wo86/01831(密歇根大学生物技术研究所(michiganbiotechnologyinstitute))。适合的葡糖淀粉酶包括衍生自米曲霉的葡糖淀粉酶,例如wo00/04136(诺和诺德公司a/s)中seqidno:2所示的葡糖淀粉酶。可商购的葡糖淀粉酶也适合,如amg200l;amg300l;santmsuper和amgtme(诺维信公司);
可以与淀粉酶一起使用的其他适合的酶包括植酸酶、蛋白酶、支链淀粉酶、β-淀粉酶、异淀粉酶、不同的α-淀粉酶、α-葡萄糖苷酶、纤维素酶、木聚糖酶、其他半纤维素酶、β-葡糖苷酶、转移酶、果胶酶、脂肪酶、角质酶、酯酶、氧化还原酶或其组合。例如,脱支酶,如异淀粉酶(ec3.2.1.68),可以按本领域普通技术人员熟知的有效量添加。支链淀粉酶(ec3.2.1.41),例如
β-淀粉酶(ec3.2.1.2)是外切作用的生麦芽糖淀粉酶,其催化1,4-α-糖苷键水解成支链淀粉和相关的葡萄糖聚合物,从而释放出麦芽糖。已经从各种植物和微生物中分离出β-淀粉酶。参见fogarty等人(1979)在progressinindustrialmicrobiology[工业微生物学进展],第15卷,第112-115页。这些β-淀粉酶的最佳温度范围为40℃至65℃,并且最佳ph范围为约4.5至约7.0。考虑的β-淀粉酶包括但不限于来自大麦
包含本发明淀粉酶的组合物可以是水性或非水性配制品、颗粒、粉末、凝胶、浆料、糊剂等,其可进一步包含本文列出的另外的酶中的任何一种或多种,以及缓冲液、盐、防腐剂、水、共溶剂、表面活性剂等。
出于所有目的,本文引用的所有参考文献均通过引用以其全文并入本文。为了进一步说明组合物和方法及其优点,给出以下具体实例,应理解它们是说明性的而不是限制性的。
实例
实例1
曲霉属物种α-淀粉酶(aspamy14)的序列
基于序列同源性,从曲霉属物种菌株中鉴定出命名为aspamy14的真菌α-淀粉酶的蛋白序列。订购编码aspamy14的合成基因,作为用于在里氏木霉中表达的密码子优化的基因。编码aspamy14的密码子优化的合成基因如seqidno:1所示:
atgaagtggaccgtctctctcttccctttgctgtccttgttcggtcagacagcccatgccctcaccccagcacaatggcgcagccagtcaatctacttcctgatgaccgaccgcttcggtcgaacggacaattctacaactgccgcctgcaacactgctgacagagtttgtacttcgataacggcactcgggtgcatgtactgatgtgtgcaggtatactgcggtggtagctggcaggggatcatcaatcatgtatgagtggattatgatggatattctctgtttgatactaacgccaccagctcgattacatccaaggaatgggattcactgccatctggatcaccccagtcacagagcagttctatgaagacaccggcgacggcacctcctaccatgggtactggcagcagaacatgtaggcattcgtcctcgtttcgtgttcggtgctaatgcatgcagctacaatgtcaattccaactacggaacggcgcaagacctcaagaatctcgccagtgcgttgcacgcgcgcggcatgcacctgatggtcgatgtggttgccaaccacatggtaagctgtctcttcatggaaatataatagaaacgaactgaactggcgtagggctacgacggagccggaaactccgtcgactacggcgttttcgatccgttttcctcttcgagctacttccacccatactgtctcatctccgactacaacaaccagaccaacgtcgaagactgctggctcggagataccactgtttcgttacctgatcttgacacgacaagcacagacgtacgaaatatctggtacgactgggttgaggaactggttgccaactattccagtcagtagcccgcatcatatgagtagggggcgtactgacagccatagtcgatggcctgcgggtcgacacggtaaaacatgttgagaaggacttttggcccggctacaacagcgcagcaggcgtctactgtgtcggtgaggtgttctcgggcgatccggcatacacatgtccataccagaactacatggacggtgtgctcaactacccaatgtgaacatgcctaccttccagaaaaccccagaggctgacacaccgcagctactaccaactcctctatgcgttcgagtcaaccagcggcagcatgagcaacctgtacaacatgatcaactcggttgcctccgactgcaaggatcccaccctactgggcaactttatcgagaaccacgacaacccgcgctttgcttcgtaagtctttcttcctctattcgtgcagtccatgctaaatcccgcagctacacgagtgactactcgcaagcgaagaatgtgatctcgtttatcttcctcaccgatggcatccccatcgtctacgccggacaggaacagcactacagcggcggcagcgacccagccaaccgcgaggccacctggctatccgcatactcaaccggcgccacgctgtacacctggatcgcgtcgacaaacaagatccgcaagctggcgatatccaaggacacgggatacgtggaggccaaggtatgcgcacacccccggctctgtagctcacgctaacgcggacagaacaaccccttctactacgactccaatacgatcgccatgcgcaagggaaccaccgccggtgcgcaggtcatcaccgtcttgagcaacaagggcgcgtcgggtagctcctacaccctctccttgagcggtacgggctacgccgccggcgcgaccctggtcgagatgtacacctgcaccacggccactgtagactcaagcggcaacctcccggttctaatgacatccggtttgcccagagtgtttctaccgtcgtcttgggtaagtggcagcggtctttgcggctccgctgtctctactacactcacgacagtttccactacgctcacgacagtcgccgcgaccacgacgtcgaccacgacatcgaccacgacatcgaccacgacatcgaccacgacatcgaccacgacatcgaccacgacatcgaccacgacatcgacaacatgcacggccgccacagcccttcccattctcttcgaggaactcgtcacgacaacctacggagagaacatcttcctgaccggctcgatcagccaactgggcagctggaacaccgcctcggccgttgccttgtcggcgagtaagtacaccgcttccaagccggaatggtacgtgaccgtgaccttgcccgtgggcaccacgttccagtacaagtttatcaagaaagaggcggacgggagtgtggcgtgggagagtgatccgaaccgatcgtacacggttccgagtggctgtgcgggtgcgacagtgacggttgttgatacttggaggtga
aspamy14前体蛋白的氨基酸序列如seqidno:2所示。天然信号肽以斜体和下划线显示。
lcms/ms证实的aspamy14的成熟形式的氨基酸序列
如seqidno:3所示:
ltpaqwrsqsiyflmtdrfgrtdnsttaacntadrvycggswqgiinhldyiqgmgftaiwitpvteqfyedtgdgtsyhgywqqniynvnsnygtaqdlknlasalhargmhlmvdvvanhmgydgagnsvdygvfdpfssssyfhpyclisdynnqtnvedcwlgdttvslpdldttstdvrniwydwveelvanysidglrvdtvkhvekdfwpgynsaagvycvgevfsgdpaytcpyqnymdgvlnypiyyqllyafestsgsmsnlynminsvasdckdptllgnfienhdnprfasytsdysqaknvisfifltdgipivyagqeqhysggsdpanreatwlsaystgatlytwiastnkirklaiskdtgyveaknnpfyydsntiamrkgttagaqvitvlsnkgasgssytlslsgtgyaagatlvemytcttatvdssgnlpvlmtsglprvflpsswvsgsglcgsavsttlttvsttlttvaatttstttstttstttstttstttstttstttsttctaatalpilfeelvtttygenifltgsisqlgswntasavalsaskytaskpewyvtvtlpvgttfqykfikkeadgsvawesdpnrsytvpsgcagatvtvvdtwr
实例2
曲霉属物种α-淀粉酶(aspamy14)的表达
aspamy14的dna序列针对aspamy14在里氏木霉中表达得到优化,并将其插入pgxt表达载体(与公开的pct申请wo2015/017256中描述的ptttpyr2载体相同),得到pzky258(图1)。
使用原生质体转化(te’o等人(2002)j.microbiol.methods[微生物学方法期刊]51:393-99)将质粒pzky258转化到适合的里氏木霉菌株中(在公开的pct申请wo05/001036中描述的方法)。在含有乙酰胺作为唯一氮源的固体培养基上选择转化体。在乙酰胺板上生长5天后,收集转化体并在250ml摇瓶中在含有葡萄糖和槐糖混合物的确定成分培养基中发酵。
实例3
aspamy14的纯化
浓缩发酵得到的aspamy14粗样品,并将硫酸铵添加到浓缩样品中,使终浓度达到1m。然后将溶液加载到20mlhipreptmphenylff16/10柱中,该柱用补充有1m(nh4)2so4的20mm乙酸钠(ph5.0)预平衡。使用6个柱体积的0.75m硫酸铵进行洗脱。收集级分并在sds-page上运行。合并含有靶蛋白的级分,浓缩,并将缓冲液交换为20mmnah2po4(ph7.0)。然后将溶液加载到用20mmnah2po4(ph7.0)预平衡的20mlhipreptmqff16/10柱中。使用6个柱体积的0.3nacl进行洗脱。收集级分并在sds-page上运行。合并含有靶蛋白的级分,浓缩,并使用带10kmwco的amiconultra-15装置将缓冲液交换为20mm乙酸钠ph5.0。纯化的样品纯度约为90%,并在-20℃下储存在40%甘油中直至使用。
实例4
aspamy14的马铃薯支链淀粉水解活性
使用比色测定法确定α-淀粉酶活性,以监测还原糖从马铃薯支链淀粉中的释放。活性以每分钟释放的葡萄糖当量表示。通过在15ml锥形管中混合9ml1%(w/w,在水中)马铃薯支链淀粉(西格玛公司,目录号10118)、1ml0.5m缓冲液(ph5.0乙酸钠或ph8.0hepes)和40μl的0.5mcacl2制备底物溶液。通过在水中将原始样品稀释至20ppm,制得纯化的α-淀粉酶样品的储备溶液。在非结合微量滴定板(mtp,康宁公司(corning)3641)中的水中制备酶样品和葡萄糖标准品的系列稀释液。然后添加90μl底物溶液(在50℃下以600rpm预孵育5min)和10μl酶系列稀释液,并混入非结合微量滴定板(mtp,康宁公司3641)中。所有孵育均在热混合器(eppendorf)中在50℃下以600rpm进行10min。孵育后,向每个孔中添加50μl0.5nnaoh以终止反应。使用pahbah方法测量每个孔中存在的总还原糖:将80μl的0.5nnaoh等分到微量滴定板中,然后添加20μl的pahbah试剂[在0.5nhcl中的5%w/v4-羟基苯甲酸酰肼]和10μl的每种反应混合物。将板在95℃下孵育5min,然后在4℃下冷却5秒钟。然后将样品(80μl)转移到聚苯乙烯微量滴定板(costar9017)上,并在410nm处读取吸光度。将所得的吸光度值相对于酶浓度作图,并使用线性回归确定该图的线性区域的斜率。使用上述方法,确定aspamy14的比活性,并与参考真菌α-淀粉酶acaa进行比较(在美国专利号8,945,889中描述)。两种酶的结果如表2所示。
比活性(u/mg)=斜率(酶)/斜率(std)*100
定义:1u=1μmol葡萄糖当量/分钟
表2.aspamy14和acaa对马铃薯支链淀粉的比活性
实例5
aspamy14的ph曲线
使用实例4中所述的pahbah测定方案监测ph(3.0至10.0)对aspamy14活性的影响。缓冲工作溶液由甘氨酸/乙酸钠/hepes(250mm)的组合组成,ph在3.0至10.0之间变化。通过混合896μl1%(w/w,在水中)马铃薯支链淀粉(西格玛公司,目录号10118)、100μl250mm缓冲工作溶液(ph从3.0至10.0)和4μl的0.5mcacl2制备底物溶液。在水中以某个剂量制备酶工作溶液(显示根据剂量响应曲线在线性范围内的信号)。按照与上述针对aspamy14的比活性相同的方案,所有孵育均在50℃下进行10min。减去对照(仅水)的吸光度,通过将最佳ph处的活性定义为100%,将所得值转化为相对活性的百分比。如表3所示,aspamy14显示出与acaa相似的ph曲线,最适ph为4.0。酶保留大于最大活性的70%的ph范围是ph3.3至6.4。
表3.aspamy14和acaa的ph曲线
实例6
aspamy14的温度曲线
如实例4所述,使用pahbah测定方案监测温度(40℃至90℃)对α-淀粉酶活性的影响。通过在15ml锥形管中混合3.6ml1%(w/w,在水中)马铃薯支链淀粉(西格玛公司,目录号10118)、0.4ml0.5mph5.0乙酸钠缓冲液和16μl0.5mcacl2制备底物溶液。在水中以2.5ppm制备酶工作溶液。反应之前,将90μl底物溶液添加到pcr板(axygen,pcr-96-hs-c)中,并在peltier热循环仪(伯乐公司(biorad))中于希望的温度(即40℃至90℃)下孵育5min。然后将10μl稀释的酶添加至底物以引发反应。在pcr仪中孵育10min后,使用与上述aspamy14的比活性相同的方案淬灭反应并进行测量。减去对照(仅水)的吸光度,通过将最佳温度处的活性定义为100%,将所得值转化为相对活性的百分比。如表4所示。aspamy14显示最佳温度70℃,并在54℃至75℃之间保持最大活性的70%以上,而acaa展示最佳温度63℃,在49℃至71℃之间保留最大活性的70%以上。
表4.aspamy14和acaa的温度曲线
实例7
aspamy14的热稳定性
α-淀粉酶aspamy14的热稳定性通过将酶样品在40℃至90℃的温度下预孵育2h之前和之后测量酶活性进行确定。将酶在含有2mmcacl2的50mm乙酸钠缓冲液(ph5.0)中稀释至10ppm,并将50μl等分到pcr条形管中。将试管转移至pcr仪处于40℃至90℃的希望的温度。预孵育2h后,将酶在水中稀释至2.5ppm,并使用支链淀粉/pahbah方法测定它们的残余活性,如实例4中所述。通过将在冰上保存的样品的活性定义为100%,将残余活性转化为相对活性的百分比。热稳定性定义为样品保持活性的50%时的温度。如表5所示,aspamy14在60℃下孵育2h后保留了超过60%的初始活性,而acaa在相同孵育条件下仅保持了5%的残余活性。
表5.aspamy14和acaa的热稳定性
实例8
aspamy14的ph稳定性
ssf通常在ph3.8-4.8和32℃下进行55小时,该过程中使用的酶应能够在整个过程中在此条件下保持其活性。因此,了解酶的低ph稳定性非常有用。在将酶分别在ph3.7和ph4.5下预孵育确定的时长后,通过测量残余酶活性来评估ph稳定性。如实例4所述,使用支链淀粉/pahbah方法测定残余酶活性。通过将样品在水中稀释至400ppm制备酶储备溶液,并储存在4℃下。在每个时间点,将97.5μl稀释缓冲液(50mm乙酸钠缓冲液,ph3.7或4.5,具有2mmcacl2)添加到pcr条形管中,然后添加2.5μl酶储备溶液(400ppm)并充分混合。在32℃下孵育不同时间点后,将酶在水中进一步稀释至2.5ppm,并测定它们的残余活性。通过将未在ph3.7或ph4.5下预孵育的活性定义为100%,将残余活性转化为相对活性的百分比。如表6所示,aspamy14显示出比acaa更大的ph稳定性。在ph3.7下24小时后,aspamy14保留了几乎100%的原始活性,而acaa仅保留了41%。在ph4.5下且孵育48小时后,aspamy14保留了几乎100%的原始活性,而acaa保留了81%。
表6.aspamy14和acaa的ph稳定性
实例9
淀粉溶解测定
淀粉溶解测定的目的是通过在测定结束时测量剩余的不溶性淀粉来评估除去不溶性残余淀粉的酶能力。通过确定每个孔在260nm的光密度(od)来执行此操作。大的淀粉颗粒会散射穿过孔的光;因此,不溶性淀粉浓度越高,od越高。用于溶解测定的底物是amylogel(70%直链淀粉含量hylonvii)和不溶性玉米淀粉(西格玛-奥德里奇公司,批次号:129k0076)的共混物,模拟ssf中使用的真实底物。经由连续离心/倾析用水重复洗涤玉米淀粉和amylogel10次,然后以30%(w/w)悬浮于100mm乙酸钠缓冲液(分别为ph3.7和ph4.5)中,制备所述共混物。将等比例的玉米淀粉和amylogel浆料混合并在100mm乙酸钠(分别为ph3.7和ph4.5)中稀释25倍,然后在121℃下用搅拌棒高压灭菌60分钟。随着混合物冷却,将其在搅拌板上搅拌过夜以防止胶凝。之后,将底物储存在4℃并备用。将溶解底物(150μl)充分混合(搅拌),同时将其添加到uv/vis板(mtp,康宁公司3635)中。转移底物需要大口径吸头。将酶溶液(10μl)添加到每个孔中,终浓度为0至12.5ppm。然后将板在32℃孵育24小时,同时以250rpm振摇。24小时后,将板短暂混合以确保颗粒悬浮。然后在260nm下读板。如图2所示,在ph3.7和4.5下的不溶性淀粉除去方面,aspamy14与acaa相比表现出更好的性能,尤其是在较低的酶剂量下。
实例10
通过同时糖化和发酵(ssf)评估α-淀粉酶
在旨在代表工业同时糖化和发酵(ssf)条件的条件下(在ph4.4,32℃)评估aspamy14和acaa的性能。玉米液化液(34.85%干固体)在-20℃下储存直至融化使用。添加h2so4以将ph调节至4.4,并将固体尿素添加至600ppm。通过将1g干酵母(乙醇红(ethanolred),乐斯福高级发酵公司,法国,#42138)添加至4ml水中并孵育10min将其水化,然后重悬并以1:200的稀释度添加至所述液化液中。将液化液(0.4ml)添加至96深孔微量滴定板的每个孔中,所述板含有蛋白酶(fermgen,杜邦公司,0.124sapu/g干固体)、里氏木霉葡糖淀粉酶变体(3.5μg/g干固体)和α-淀粉酶(0-36μg/g干固体)。将板密封以使气体逸出但不能进入孔中,然后置于32℃的强迫通风(forced-air)孵育器中,以300rpm的速度振摇。
添加0.4ml使反应在47或69小时处停止。0.02nh2so4伴随振摇,然后离心并收集上清液,将其通过0.2微米膜过滤。使用含0.01nh2so4流动相的rezexrfq-fastacid柱(菲罗门公司(phenomenex))通过hplc确定乙醇含量。发酵过程中产生的乙醇列于表7。
sapu:一个分光光度酸性蛋白酶单位(sapu)是在指定条件(ph3.0和37℃)下每分钟释放1μmol酪氨酸的酶活性。该测定基于酪蛋白底物的酶促水解,其中通过分光光度法确定溶解的酪蛋白滤液。
在该测定的条件下,aspamy14在大多数浓度下(特别是在较高浓度下)的性能均优于acaa。
表7.aspamy14和acaa的ssf性能
实例11
成熟α-淀粉酶aspamy14的蛋白序列分析
针对公共和基因组查询专利(publicandgenomequestpatent)数据库(其中搜索参数设置为默认值),使用aspamy14的成熟氨基酸序列(seqidno:3),通过blast检索(altschul等人,nucleicacidsres[核酸研究],25:3389-402,1997)鉴定了相关蛋白质,并且子集分别显示于表8a和8b中。将两个搜索集的百分比同一性(pid)定义为相同残基的数量除以成对比对中经比对残基的数量。表上标有“序列长度”的值对应于以所列出的登录号提及的蛋白质的长度(以氨基酸计),而“比对长度”是针对用于比对和pid计算的序列。
表8a.与从ncbi非冗余蛋白质数据库鉴定的aspamy14成熟序列具有百分比同一性的序列的列表
表8b.与从基因组查询数据库鉴定的aspamy14成熟序列具有百分比同一性的序列的列表
aspamy14(seqidno:3);xp_001209405.1(seqidno:4的氨基酸21-607);edp53736.1(seqidno:5的氨基酸24-630);xp_001265628.1(seqidno:6的氨基酸24-632);oxn35790.1(seqidno:7的氨基酸30-631);oxs03711.1(seqidno:8的氨基酸22-633);us20150337277-0004(seqidno:9的氨基酸22-643);和us20150337277-0006(seqidno:10的氨基酸22-628)的成熟序列的比对使用geneious软件(biomatters有限公司)的muscle程序以默认参数进行(robertc.edgar.muscle:multiplesequencealignmentwithhighaccuracyandhighthroughput[muscle:具有高精度和高通量的多重序列比对]nucl.acidsres.[核酸研究](2004)32(5):1792-1797)。成熟的aspamy14α淀粉酶与各种其他同源序列的多重序列比对如图3所示。
- 还没有人留言评论。精彩留言会获得点赞!