用于支持源自卵巢的细胞或组织发育的装置的制作方法
本发明涉及一种用于支持源自卵巢的细胞或组织中至少一种的发育的装置。特别但非排他性地,本发明的实施方式涉及一种用于支持胚胎发育的微流体装置。还提供了一种包含该装置的系统和该装置的相应用途。
背景技术:
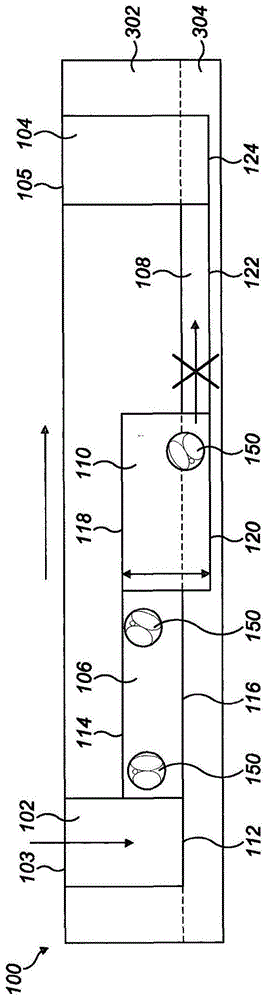
:受精卵成为胚胎的动态过程(称为胚胎发生)的特点是一系列精确定时和协调的事件,这些事件将确定哪些胚胎具有进行基因组激活、发育到囊胚期并随后着床(implant)以产生妊娠并产生健康后代的能力。受精前,卵子(卵母细胞)通过在卵巢卵泡中减数分裂而分裂、扩大并成熟,直到达到称为减数中期ii的减数分裂阶段。此时,卵母细胞被释放到输卵管中,并受精,输卵管是连接卵巢和子宫的管状结构。受精后,哺乳动物受精卵开始其向子宫的旅程,在例如诸如鼠、牛和人类等物种中,该旅程历时3至7-8天,在此期间,由于纤毛的推动和平滑肌介导的蠕动,着床前胚胎会经历流体流动并受到剪切应力(shearstress)。随着行进,受精卵分裂。第一次裂解产生两个相同的细胞,然后再次分裂产生4个细胞,8个细胞,16个细胞(桑椹胚期),依此类推,直到达到囊胚期。例如,在诸如小鼠、牛和人类等物种中,16细胞桑椹胚的外部细胞分裂产生细胞的外缘(滋养外胚层)和细胞的内芯(内部细胞团),这是细胞特化的第一个证据。在滋养外胚层与内部细胞团的物理分离和分化的同时,充满流体的囊胚腔形成,并且桑椹胚变成囊胚。例如,在小鼠、牛和人类中,在囊胚期(或之后不久),胚胎到达子宫。8细胞期胚胎比囊胚早期对剪切应力更敏感。慢性剪切应力(在12h内为1.2dyncm-2)在囊胚期可致死,而蛋白质透明带覆膜(覆层,被膜,coat)会减弱剪切应力的影响。当它到达子宫时,囊胚会从透明带(该结构最初包围卵母细胞,并且还防止囊胚着床到输卵管壁)中“孵化”出来。新兴的微流体领域使得可成功地在体外重现着床前发育的生理条件。虽然微流体技术最初是在1970年代中期开发的,但首个“芯片实验室(labonchip)”装置是在1990年代初期,其能够将常规实验室设备简化为将微流体设计与生物学相结合的小型平台,尤其是用于细胞生物学的研究。微流体系统可以在封闭且优化的系统中支持辅助生殖技术(art)治疗的多个部分。配子的选择、受精和着床前发育均已在微流体系统中成功完成。由于有了计算模型分析,微流体装置提供了在制造前定制和优化微流体设计的可能性,从而减少了与传统培养技术(例如油下的微滴)相关的处理、应力和人为错误。当前的体外胚胎培养方法主要是基于培养皿中的胚胎,滴加20至100μl的确定成分培养基,并用矿物油或石蜡油覆盖以避免蒸发。机械应力(由使用胚胎处理移液器移动的胚胎引起)或培养环境的变化(例如培养基、ph、温度、o2、张力、添加剂)可能对胚胎的健康具有显著的不利影响。在微流体装置中,机械和生化地评估并处理胚胎/细胞及其微环境的能力,可以更好地了解如何优化art,从而有助于开发更具生理相关性的胚胎培养系统。已经开发出多种微流体装置,使胚胎在微通道或微室中培养,通过使用孔状结构或阀固定在适当的位置(参见例如us2007/0231901a1、us6,695,765b1和wo2011/160430a1)。技术实现要素:根据本发明的第一方面,提供了一种用于支持(承载,supporting)细胞沉积物发育的装置,所述细胞沉积物包含来源于卵巢的细胞或组织中的至少一种,该装置包括:入口孔、出口孔和设置在入口孔和出口孔之间的封闭式培养室;将入口孔流体连接(耦连,coupling)至培养室的入口通道;将培养室流体连接至出口孔的出口容器(或接收器(receptacle));其中,出口容器(或接收器)经设置尺寸以防止细胞沉积物从中通过。适当地,出口容器是出口室和/或至少一个出口通道。换言之,提供了一种用于支持细胞沉积物发育的装置,该细胞沉积物包含来源于卵巢的细胞或组织中的至少一种,该装置包括:入口孔、出口孔和设置在入口孔和出口孔之间的封闭式培养室;将入口孔流体连接至培养室的入口通道;将培养室流体连接至出口孔的出口室和/或至少一个出口通道;其中,出口室和至少一个出口通道(即,至少一个出口通道中的每一个)中的至少一个经设置尺寸以防止细胞沉积物从中通过。也就是说,该装置可以包括将培养室流体连接至出口孔的至少一个出口通道,其中至少一个出口通道的每一个经设置尺寸以防止细胞沉积物从中通过。可替代地,该装置可以包括将培养室流体连接至出口孔的出口室(例如经由至少一个出口通道),其中出口室(以及可选的至少一个出口通道)经设置尺寸以防止细胞沉积物从中通过。适合地,此种装置还可以包括多个入口孔、多个培养室(每个培养室设置在相应的入口孔和出口孔之间)和多个入口通道,每个入口通道能将相应的入口孔流体连接至其对应的培养室。出口室可以将每个培养室流体连接至出口孔。适当地,该装置是微流体的。适当地,入口通道被构造为通过入口孔与培养室之间的毛细管作用而使流体流动。适当地,至少一个出口通道中的每一个被构造为通过培养室和出口孔之间的毛细管作用而使流体流动。适当地,入口通道从入口孔的下部延伸到培养室的上部。适当地,入口孔的下壁与入口通道的下壁共面。适当地,入口通道的上壁与培养室的上壁共面。适当地,至少一个出口通道中的每一个从培养室的下部延伸至出口孔的下部。适当地,培养室的下壁与至少一个出口通道中的每一个的下壁共面。适当地,至少一个出口通道中的每一个的下壁与出口孔的下壁共面。适当地,至少一个出口通道中的每一个的高度和/或宽度小于细胞沉积物的直径。适当地,至少一个出口通道中的每一个的高度和/或宽度小于或等于细胞沉积物直径的50%。适当地,入口通道经设置尺寸以允许发育的材料通过。适当地,入口通道的最小横截面尺寸是发育的材料直径的至少1.5倍。适当地,培养室为基本上圆形、卵形或椭圆形,并且具有恒定的高度。适当地,培养室的直径或宽度大于或等于入口通道的宽度。适当地,培养室的容积(体积,volume)为约3nl至约100μl。适当地,入口孔和出口孔各自具有约2至约20μl的容积。适当地,入口孔包含倾斜的下部,其中倾斜的下部朝着入口通道的开口以0度至90度的角度倾斜。适当地,入口通道的容积基本上等于至少一个出口通道的总容积。适当地,该装置包括多个出口通道。适当地,多个出口通道各自在培养室和出口孔之间基本平行地延伸。适当地,与多个出口通道中的另一个相比,多个出口通道中的至少一个具有不同的容积。适当地,该装置还包括限定在该装置的外壁和与该外壁间隔开的内壁之间的储库(reservoir),其中储库在入口孔、出口孔、培养室、入口通道和至少一个出口通道周围延伸并且被构造为在其中保留一定体积的流体。根据本发明的第二方面,提供了任何前述权利要求的装置用于支持细胞沉积物的发育的用途,该细胞沉积物包含源自卵巢的细胞或组织中的至少一种。适当地,源自卵巢的细胞或组织选自卵母细胞、卵巢卵泡、卵巢组织和胚胎,任选地其中胚胎选自受精卵、透明带、卵裂期胚胎、桑椹胚和囊胚。根据本发明的第三方面,提供了一种用于支撑胚胎发育的微流体装置,该装置包括:入口孔、出口孔和设置在入口孔和出口孔之间的封闭式培养室;将入口孔流体连接至培养室的入口通道;将培养室流体连接至出口孔的至少一个出口通道;其中至少一个出口通道中的每一个经设置尺寸以防止受精卵期胚胎从中通过。适当地,入口通道被构造为通过入口孔与培养室之间的毛细管作用而使流体流动。适当地,至少一个出口通道中的每一个被构造为通过培养室和出口孔之间的毛细管作用而使流体流动。适当地,入口通道从入口孔的下部延伸到培养室的上部。适当地,入口孔的下壁与入口通道的下壁共面。适当地,入口通道的上壁与培养室的上壁共面。适当地,至少一个出口通道中的每一个均从培养室的下部延伸至出口孔的下部。适当地,培养室的下壁与至少一个出口通道中的每一个的下壁共面。适当地,至少一个出口通道中的每一个的下壁与出口孔的下壁共面。适当地,至少一个出口通道中的每一个的高度和/或宽度小于受精卵期胚胎的直径。适当地,至少一个出口通道中的每一个的高度和/或宽度小于或等于受精卵期胚胎直径的50%。适当地,入口通道经设置尺寸以允许囊胚期胚胎通过。适当地,入口通道的最小横截面尺寸是囊胚期胚胎直径的至少1.5倍。适当地,培养室的形状为基本上圆形、卵形或椭圆形,并且具有恒定的高度。适当地,培养室的直径或宽度大于或等于入口通道的宽度。适当地,培养室的容积为约3nl至约100μl。适当地,入口孔和出口孔各自具有约2至约20μl的容积。适当地,入口孔包括倾斜的下部,其中倾斜的下部以0度至90度的角度朝向入口通道的开口倾斜。适当地,入口通道的容积基本上等于至少一个出口通道的总容积。适当地,该装置包括多个出口通道。适当地,其中多个出口通道各自在培养室和出口孔之间基本平行地延伸。适当地,与多个出口通道中的另一个相比,多个出口通道中的至少一个具有不同的容积。适当地,该装置还包括限定在装置的外壁和与外壁间隔开的内壁之间的储库,其中储库在入口孔、出口孔、培养室、入口通道和至少一个出口通道周围延伸,并且被构造为在其中保留一定体积的流体。根据本发明的第四方面,提供了第一方面的装置用于培养至少一个胚胎的用途。适当地,至少一个胚胎是哺乳动物胚胎,任选地其中至少一个胚胎选自人类或其它灵长类、啮齿动物、牛、绵羊或猪胚胎。本发明的某些实施方式提供了一种有助于调节和更好地控制胚胎微环境的装置。本发明的某些实施方式提供了一种用于培养胚胎的装置,该装置可以在不需要可能对胚胎的健康有害的矿物油层的情况下使用。本发明的某些实施方式有助于模拟自然流体流动,该自然流体流动带动胚胎通过输卵管到达子宫的着床部位。本发明的某些实施方式提供了一种装置,该装置能够输送胚胎,同时使对胚胎的机械应力最小化(例如降低剪切应力、机械应变等)。与常规装置相比,本发明的某些实施方式允许减少培养基从装置中的蒸发。本发明的某些实施方式允许在体外在着床前胚胎发育阶段期间减少对含有胚胎的培养基的处理。本发明的某些实施方式允许减少培养过程中使用的培养基体积。例如,与许多常规装置中使用的20至100μl相比,所使用的培养基体积可以为约0.01至10μl。附图说明在下文中,将参考附图进一步描述本发明的实施方式,其中:图1a示出了微流体装置和装载到该微流体装置中的胚胎;图1b示出了从图1a的微流体装置取出胚胎;图2示出了可替代的微流体装置的一部分;图3a至3d示出了微流体装置的另一示例;图4a至4c分别以透视图、侧视图和平面图示出了包括微流体装置的系统;图5是说明微流体装置的不同设计的流速的表;图6a是在微流体装置中产生的速度的流体流动分析,入口流速为1.014μlmin-1(τ=1.2dyncm-2),色谱条显示了速度,单位为mm/s;图6b是从入口通道到出口通道的整个装置长度x上平均速度的曲线图;图7显示了设计1(上排)和设计2.4(下排)中微流体室中的流量、梯度和珠粒分布,比例尺为200μm;图8显示了整个中间培养室长度上计算估计的速度曲线,其中弧长是指如箭头所示中间高度处的室宽度;图9a是设计1和设计2.4的计算估计的入口通道壁剪切应力;图9b是手动装载过程中剪切应力场表面图的流体流动计算模型,其中色谱条显示了在流体系统中生成的剪切应力场;图10a至10c示出了微流体装置的另一示例;和图11a至11c示出了微流体装置的另一示例。在附图中,相同的参考数字指代相同的部分。具体实施方式本文的装置可用于支持任何细胞和/或组织的发育,例如源自卵巢的细胞和/或组织。如本文所用,术语“源自卵巢”涵盖直接或间接来源于卵巢的任何细胞和/或组织,包括其分化产物。例如,卵母细胞、卵巢卵泡(诸如始基卵泡(原始卵泡,primordialfollicles)、或卵丘-卵母细胞复合体、窦前卵泡或窦卵泡)和卵巢组织(例如卵巢组织碎片)均被该术语所涵盖。此外,还涵盖胚胎,因为它们最初源自卵巢产物(卵母细胞)并由此间接地源自卵巢。如本文所用,术语“胚胎”涵盖受精卵、透明带、卵裂期胚胎、桑椹胚和囊胚。如本文所用,术语“支持发育”是指维持沉积在装置中的细胞和/或组织的活力并支持细胞材料的细胞生长、细胞分裂和/或细胞分化。沉积在装置中的细胞和/或组织在本文中也称为“细胞沉积物”(即在装置中进行任何细胞分裂和/或细胞分化之前,沉积在装置中的细胞材料)。典型地,细胞沉积物是多细胞沉积物(例如源自卵巢的多细胞产物)。因此,该装置适合于支持包含来源于卵巢的细胞或组织中的至少一种的细胞沉积物(例如受精卵期胚胎)的发育。典型地,细胞沉积物在装置内发育(通过细胞生长和细胞分裂和/或细胞分化)以形成发育的材料。如本文所用,术语“发育的材料”是指要从装置取回的细胞和/或组织(例如囊胚期胚胎)。参考胚胎的发育描述以下实施例。但是,应当理解的是,该装置可以适于培养其它细胞或组织类型。例如,该装置可以做得更大或更小以容纳不同尺寸的组织或细胞。在下面的“替代装置”项下讨论了适用于其它组织和/或细胞类型的替代装置。图1a和1b示出了用于支持胚胎发育的微流体装置100的示例。如本文,术语“微流体装置”是指具有单一尺寸小于1000微米的至少一个流道或导管的装置,其中单一尺寸是指导管的高度或宽度,而不是其长度。微流体装置100包括入口孔102、出口孔104和设置在入口孔102和出口孔104之间的培养室110。微流体装置100还包括将入口孔102流体连接至培养室110的入口通道106以及将培养室110流体连接至出口孔104的出口通道108。培养室110被入口通道106和出口通道108封闭,为来自入口通道和/或出口通道的流体进入和/或离开培养室110提供流体流动路径。入口孔102和出口孔104均被构造为容纳预定体积的流体。入口孔102和出口孔104的每一个都包括开口顶部103、105,可以在其中添加和/或从孔中去除流体(例如使用适当尺寸的移液器)。流体还可以经由流体连接至入口孔102的入口通道106进入和/或离开入口孔102。类似地,流体也可以经由流体连接至出口孔104的出口通道108进入和/或离开出口孔104。出口通道108经设置尺寸以防止受精卵期胚胎(即细胞沉积物)从其中通过。以此方式,如图1a所示,受精卵期胚胎150可在入口孔102的开口顶部103处加载到装置100中(如箭头所示)。胚胎150沿着入口通道106继续行进到培养室110。胚胎150不能通过出口通道108离开培养室110,因为出口通道108的尺寸小于胚胎150。出口通道108阻止胚胎150(即细胞沉积物)从其中通过,从而起到将胚胎150保留在培养室110中的作用。在此示例中,出口通道108的高度(即厚度)小于受精卵期胚胎150的直径。在其它示例中,出口通道108的宽度或高度和宽度可各自小于受精卵期胚胎150(即细胞沉积物)的直径。应当理解的是,在受精卵期,不同物种的胚胎会具有不同的直径。因此,出口通道108的高度和/或宽度可以根据装置中使用的胚胎的种类进行选择。例如,受精卵期的小鼠胚胎直径为约60μm。因此,在用于小鼠胚胎的装置中,出口通道108被构造为具有小于60μm的高度和/或宽度。适当地,出口通道108的高度和/或宽度可以小于或等于受精卵期胚胎150直径的50%。例如,在用于小鼠胚胎的装置中,出口通道108可以被构造为具有小于或等于30μm的高度和/或宽度。可以理解的是,出口通道的高度和/或宽度可以根据要与该装置一起使用的胚胎种类(或者要在装置中使用的不同细胞沉积物)进行放缩(调整,调节,scale)。入口通道106被适当地构造为通过入口孔102和培养室110之间的毛细管作用而使流体流动。因此,流体(任选地含有一个或多个胚胎或其它细胞沉积物)可以通过开口顶部103沉积在入口孔102内。然后通过毛细管作用吸引该流体沿着入口通道106朝向培养室110流动。该过程也可以通过以下相反地进行:经由开口顶部103从入口孔102中去除流体,使得通过毛细管作用吸引培养室110中的流体沿着入口通道106朝向入口孔102流动。在该示例中,出口通道108也被构造为通过培养室110和出口孔104之间的毛细管作用而使流体流动。如此,可通过毛细管作用吸引培养室110中的流体沿出口通道108朝向出口孔104流动。该过程也可以通过以下相反地进行:从入口孔102中去除流体,使得通过毛细管作用吸引培养室110中的流体沿着入口通道106朝向入口孔102流动,从而从培养室110中去除流体,这会致使通过毛细管作用吸引流体从出口孔104朝向培养室110流动。当然,在另一个示例中,培养室110最初可以没有流体(或基本上是空的),并且流体可以在开口顶部105将流体沉积在出口孔104中。然后可以通过毛细管作用吸引沉积在出口孔104中的流体通过出口通道108朝向培养室110流动。因此,可以理解的是,通过经由开口顶部103、105去除和/或沉积流体来调节入口孔102和出口孔104中每一个中的流体水平,可以控制通过装置的流体流动。在此示例中,入口通道106从入口孔102的下部延伸出。也就是说,入口通道106在入口孔102的下端流体连接至入口孔102。因此,入口通道106被构造为从入口孔102的底部吸出流体。入口通道106从入口孔102的下部延伸到培养室110的上部。因此,流体在培养室110的上部流出入口通道106。流体中存在的任何胚胎(即细胞沉积物)将倾向于沉降在培养室110的下部(即底部)。因此,在没有流体朝向入口孔102的方向上流动的情况下,胚胎150被保留在培养室110中。入口孔102的下壁112(即底部)与入口通道106的下壁116适当地共面(即与之连续)。入口通道106的上壁114(即顶部)与培养室110的上壁118适当地共面(即与之连续)。这可以有助于优化流体流动以及胚胎150通过装置100进入培养室110的通道。出口通道108从培养室110的下部适当地延伸至出口孔104的下部。适当地,培养室110的下壁120(即底部)与出口通道122的下壁122和出口孔104的下壁124共面(即与它们连续)。这有助于通过毛细管作用帮助流体从培养室110流向出口孔104。在此示例中,培养室110是基本上圆形的并且具有恒定高度h。培养室110的高度h适当地等于入口通道106的高度加上出口通道108的高度。在其它示例中,培养室可以具有不同的形状(例如卵形、椭圆形、矩形或其他多边形)。应当理解的是,培养室可以经设置尺寸以容纳要沉积在该装置中的胚胎(或其它细胞沉积物)以及容纳要从该装置中取出的胚胎(或其它发育的材料)。适当地,培养室的直径或宽度大于或等于入口通道的宽度。培养室110可以具有约3nl至约100μl的容积。例如,在设计用于小鼠胚胎的装置中,培养室的容积可以为约400至410nl。入口孔102和出口孔104中的每一个的容积可以大于培养室110的容积。入口通道106的容积和出口通道108的容积适当地小于培养室110的容积。例如,入口通道106的容积和出口通道108的容积可以小于培养室110容积的70%。例如,入口通道和出口通道可各自具有约200至500nl的容积。例如,在设计用于小鼠胚胎的装置中,入口通道和出口通道各自的容积可以为约350至400nl。适当地,入口通道的容积等于出口通道的容积。在使用装置100时,将胚胎发育培养基流体(例如ksom)加入到入口孔102。该流体被多次抽吸通过装置100(通过将流体经由开口顶部103装载到入口孔102并相应地经由开口顶部105从出口孔104去除)直到培养室110、入口通道106和出口通道108各自充满流体。为了将一个或多个胚胎150(即细胞沉积物)加载到装置100中,装胚胎沉积在入口孔102中。流体通过开口顶部105从出口孔104去除,以开始在从入口孔102到出口孔104的方向上流体通过装置100的流动(如图1a中的箭头所示)。因此,入口孔102中的流体(包括胚胎或其它细胞沉积物)通过毛细管作用通过入口通道106被吸入培养室110。该流动过程持续直至所有的胚胎均进入了培养室110。然后在培养胚胎150之前将额外的流体沉积在入口孔102和/或出口孔104中。通常可以在囊胚期从装置中取出胚胎(即发育的材料)。但是在一些示例中,在其它发育阶段取出胚胎也是可行的。因此,入口通道106经适当地设置尺寸以允许囊胚期胚胎(即发育的材料)从中通过。应当理解的是,不同物种的胚胎在囊胚期具有不同的尺寸,因此,入口通道106可以根据要在装置中培养的胚胎种类适当地设置尺寸。在其它示例中,胚胎可以在发育的晚期或早期(例如在桑椹胚或孵化的囊胚期)从装置中取出。在此示例中,应当理解的是,可以相应地设置入口通道尺寸以允许较小或较大的胚胎在取回时通过。适当地,入口通道106可以经设置尺寸以便最小横截面直径(例如高度和/或宽度)是囊胚期胚胎(或其它发育的材料)的直径的至少1.5倍。例如,这可以有助于允许囊胚胚胎(或其它发育的材料)容易地通过入口通道,而无需在胚胎上施加过大的剪切应力或其它机械应力。为了取回胚胎(或其它发育的材料),使用例如移液器经由开口顶部103从入口孔102吸取(即去除)流体(见图1b)。然后,流体开始在从出口孔104至入口孔106的方向上通过出口通道108、培养室110和入口通道106流动,由此将胚胎(或其它发育的材料)输送至入口孔102。通过每个入口通道106和出口通道108的流动可以经由毛细管作用。在一些示例中,可以优选地使用例如注射器或移液器帮助施加额外的流动力,以帮助驱除任何被困的胚胎(或其它发育的材料)。该流动过程持续直到所有胚胎(或其它发育的材料)均进入了入口孔102,从而可以经由入口孔102的开口顶部103从装置100中取出。图2示出了微流体装置200的一部分的另一示例。在本示例中,装置200类似于图1a和1b的装置100进行构造,但包括多个出口通道208a-e。在本示例中,存在五个出口通道208,但是其它示例可以包括任意数目的出口通道,例如两个、三个、四个、六个、七个或八个出口通道。与关于图1a和1b的单个出口通道108类似,每个出口通道208从培养室110延伸到出口孔(未示出)。装置200的其它特征可以类似于关于图1a和1b描述的那些特征来构造,因此将不再详细描述。多个出口通道208a-e各自被构造为防止受精卵期胚胎(或其它细胞沉积物)通过,类似于图1a和1b示例中的出口通道108。每个出口通道208a-e适当地在培养室110和出口孔之间彼此基本平行延伸并且可以基本上等距地间隔开。这可以有助于控制培养室中的流体流动方向,并且可以有助于分散培养室110内的多个胚胎(或多个细胞沉积物)。应当理解的是,多个出口通道208会聚成单个出口孔。以这种方式,每个出口通道均会聚到单个出口点(出口端口)。在本示例中,每个出口通道208a-e具有大致相等的高度,设置其尺寸以防止受精卵期胚胎(或其它细胞沉积物)通过。也就是说,每个出口通道的高度都小于受精卵期胚胎(或其它细胞沉积物)的直径。与多个出口通道的另一个相比,多个出口通道的至少一个可以具有不同的容积。例如,每个通道的高度和/或宽度可以与其它通道不同,从而产生不同的通道容积。在其它示例中,多个出口通道中的每一个可以具有相等的容积(即每个出口通道可以具有相同的容积)。例如,与多个出口通道中的另一个相比,多个出口通道中的至少一个可以具有不同的宽度。换言之,出口通道208a-e中一些的宽度可以与其它出口通道的宽度不同。在本示例中,两个最外侧的通道208a、208e宽度相等并且具有所有通道的最大宽度。最内层的中心通道208c宽度最窄,最内层通道两侧的通道208d、208b宽度彼此相等并且具有的宽度在最外侧通道208a、208e和最内侧通道208c之间。换言之,出口通道的宽度从最内侧(中心)通道到最外侧通道增加,从而形成对称的通道构造。多个出口通道的总容积适当地等于或基本上等于入口通道的容积。每个出口通道的分布和相对尺寸(容积和/或宽度和/或高度)可以有助于确定培养室110内的流动特性。例如,出口通道可以被构造为有助于在整个培养室110中均匀地分配流量,从而促进在培养室内均匀地分配和分开胚胎。与一个或多个最内侧通道相比,较大宽度的最外侧出口通道可以有助于促进朝向培养室的外壁流动,从而减少胚胎(或其它细胞沉积物)在中心区域的积聚。在其它示例中,宽度等于培养室宽度(即圆形腔室的腔室半径)的单一出口通道可以在装置内提供最佳的流动分布。然而,可以适当地使用多个通道来帮助防止装置结构坍塌(collapse)。这对于使用某些材料(例如,pdms(聚二甲基硅氧烷))制造的装置特别有利。适当地,出口通道的每一个可以具有小于或等于1∶10的高度∶宽度比。这可以有助于装置制造和装置内的流量分布。在该特定的构造为与小鼠胚胎(细胞沉积物(即受精卵期时胚胎)的近似直径为60μm)一起使用的非限制性示例中,入口通道、出口通道、培养室以及入口孔和出口孔的尺寸如下表所示。宽度高度长度容积入口通道250μm200μm7500μm375nl出口通道(a和e)200μm30μm7500μm45nl出口通道(b和d)150μm30μm7500μm33.7nl出口通道(c)100μm30μm7500μm22.5nl半径高度容积培养室750μm230μm406nl入口/出口孔750μm5000μm8.8μl适当地,在本示例及其它示例中,每个出口通道被构造为具有小于或等于胚胎在受精卵期(或其它细胞沉积物)的直径的50%的高度,以防止胚胎(或其它细胞沉积物)逃离培养室。图3a至3d示出了图2的微流体装置的制造。但是下面描述的制造过程也可以适用于本文描述的任何其它示例。如图3a所示,装置300包括上层302和下层304。上层302和下层304中的每一个都可以使用标准软光刻技术由pdms形成,例如d.qinetal“softlithographyformicroandnanoscalepatterning,”nat.protoc.,vol.5,no.3,pp.491-502,mar.2010所述。在其它示例中,上层可以使用软光刻或其它合适的技术由任何合适的材料形成。上层302包括第一和第二孔306、308,其对应于装置的入口孔和出口孔。在上层302的下侧,形成从第一孔306向第二孔308延伸的通道308(或凹槽)。通道308的长度对应于装置的入口通道106的长度。上层的下侧还包括凹陷区域310,该凹陷区域310的尺寸和形状对应于装置的培养室110的上部。凹陷区域310与通道308连续,使得装置的入口通道流体连接至培养室的上部。下层304的上侧包括对应于培养室110的下部的第一凹陷312和对应于出口孔的下部的第二凹陷314。下层304的上侧还包括在第一凹陷312和第二凹陷314之间延伸的至少一个凹槽。至少一个凹槽中的每一个对应于装置的各个出口通道。将上层302和下层304以面对面的构造组装以形成如图3a和3b所示的装置。在图1a和1b中也可以看到这些层的组装件。如图3b所示,可以使用移液器316将液体(任选地含有细胞沉积物,例如一个或多个胚胎)沉积到入口孔中。尽管在图3a至3d所示的示例中,装置具有基本上矩形的外部形状,但其它外部形状也可以适用。例如,装置可以具有基本上圆形、卵形、正方形、矩形或其它多边形的外部形状。图4a至4c示出了微流体装置400的另一示例。微流体装置400与本文所述的其它装置相似,但附加地包括储库402。储库402限定在外壁404和与外壁404间隔开的内壁406之间。储库402被构造为围绕装置的中心部分延伸,该装置包括入口孔、出口孔、培养室、入口通道和至少一个出口通道。因此,储库402环绕装置的中心部分。储库402被构造为在其中保留一定体积的流体。用流体填充储库402可有助于避免或减少细胞沉积物发育过程中的蒸发。图4b是图4a的装置的侧视图,并且示出了入口孔103的替代构造。在本示例中,入口孔包括倾斜的下部103’。倾斜的下部103’朝向入口通道106的开口倾斜。倾斜部分相对于入口通道的倾斜角度可以为0度至90度。例如,倾斜角度可以为约45度。倾斜部103’可以有助于将移液器定位在入口孔中,并且将流体从移液器引导到与入口通道106的开口直接相邻的区域。在其它示例中,出口孔和/或入口孔可以包括类似的倾斜的下部。本文所述的任何装置均可用于培养至少一个胚胎(支持其发育)。至少一个胚胎可以是哺乳动物胚胎。在一些示例中,装置可用于同时培养多个胚胎,例如2至10个胚胎,或4至6个胚胎。至少一个胚胎可以选自人类或其它灵长类动物、啮齿动物、牛、绵羊或猪胚胎。使用图1至4(或本文描述的任何其它示例)中任一个的装置以支持小鼠胚胎发育的方法的非限制性示例如下。将装置放置在60mmart培养皿中,并在储库中用4ml经过胚胎测试的水包围。这种潮湿的环境消除了对大型培养基储库的需求。通过在入口孔中添加10μlksom液滴并从出口孔吸取培养基10次来准备装置。然后将10μl新鲜ksom液滴加入到入口和出口,然后在5%co2、5%o2的潮湿氮气中于37℃下预平衡过夜。为了加载胚胎,从入口孔和出口孔中去除10μl培养基液滴,然后使用135μm移液器吸头将胚胎放置在入口通道口处的入口孔内。然后通过毛细管作用从通道出口吸取培养基直到所有胚胎进入中心腔室。然后将10μl预平衡的ksom液滴加入到入口孔和出口孔,然后在minc台式培养箱中在5%co2、5%o2的潮湿氮气中于37℃下培养。在培养结束时,使用相同的135μm移液器吸头从入口孔吸取以取回胚胎,直至所有装载的胚胎均被取回。应当理解的是,该方法的各个方面可以适于支持其它细胞沉积物(包括不同物种的胚胎)的发育。例如,代替ksom,可以使用其它培养基。另外,可以调整培养环境(例如不同的温度,替代性气体比例和/或组合,替代性培养箱等)。可以对如上所述的详细布置进行各种修改。尽管上面已将通过装置的流体流动大体描述为通过毛细管作用的流动,但在一些示例中,流体(任选地含有胚胎或其它细胞沉积物)的流动可以通过附加力来启动或协助,例如使用例如注射器或移液器手动注射或在入口孔和/或出口孔处提供额外的流体压力。在其它示例中,可以使用泵来协助在装置内提供恒定的流体流动。尽管上面已将示例描述为由pdms形成,但其它材料也可以适用,例如其它塑料或聚合物。例如,该装置可以由聚苯乙烯形成。这对于具有单个出口通道的实例可以特别有利,以帮助提供额外的强度。尽管上述培养室以及入口孔和出口孔的形状通常为圆形或椭圆形,但不同形状的腔室和孔也可以适用。例如,培养室和/或入口孔和/或出口孔可以是大致正方形、矩形、椭圆形、六边形或任何其它规则或不规则多边形形状。尽管上文已经将入口通道描述为经设置尺寸以允许囊胚胚胎通过,但在其它装置中,入口通道可以经适当地设置尺寸以允许在要取回期(发育的材料)的胚胎(或其它细胞沉积物)通过。通常,入口通道的横截面可以大于从培养室收回的发育的材料的最大横截面。在包括多个出口通道的示例中,可以任何合适的方式构造出口通道的宽度和/或高度。适当地,出口通道的高度可以全部相等,并且每个出口通道的宽度可以根据培养室内所需的流动特性进行选择。尽管上文将每个出口通道的高度:宽度比描述为小于或等于1:10,但也可以使用其它比率。例如,高度:宽度比可以为1:20至1:5或适当地为1:15至1:8或更适当地为1:12至1:8。尽管本文将装置描述为通常适合于支持一个或多个胚胎的发育和/或培养,但是该装置也可以适合于支持其它相似大小的组织类型的发育和/或培养。例如,该装置可以适合于支持卵母细胞(卵子)、卵巢卵泡(例如始基卵泡或窦前卵泡)、卵丘卵母细胞复合体和卵巢组织的发育和培养。在一些示例中,如图10a-c所示的示例,培养室510的高度恰好等于入口通道506的高度。也就是说,入口通道506和培养室510共面(即培养室510的上壁和下壁分别与入口通道506的上壁和下壁共面)。换言之,入口通道506从入口孔502的下部延伸到培养室510,在入口通道506的下壁和培养室510的下壁之间没有“台阶”。这样的布置可以是有益的,因为当由两层制造装置时(以图3的方式),所有的流体通道特征(结构,features)都可以在单层内产生。特别地,可以例如由3d打印模具在顶层522内产生对应于入口孔、入口通道、培养室、出口通道和出口孔的孔和通道。底层524可以保持平坦(即,其上没有特征)。以这种方式,在最终装置的组装过程中不需要对准,从而简化了制造和组装。此外,入口通道和培养室之间没有“台阶”允许在提取之前将培养物培养到更大的尺寸。在一些示例中,如图11a和11b所示的示例,装置可以包括将培养室流体连接至出口孔的出口室。当装置包括多于一个培养室(并且类似地多于一个入口孔和入口通道)时,包括出口室特别有用。也就是说,出口室可用于将出口孔与多个培养室流体连接,每个培养室均与入口孔流体连接。以这种布置,可以在单独的培养室中单独培养胚胎,但保持流通(communication)以利用旁分泌/自分泌因子的潜在益处。在本示例中,装置600的出口室650经由出口通道608(在某些示例中可能是多个出口通道)将培养室(在本示例中,四个培养室6101-4)流体连接至出口孔。每个培养室6101-4经由相应的入口通道6061-4流体连接至相应的入口孔6031-4。可以理解的是,出口室650可用于将任意数量的培养室流体连接到出口孔605。例如,出口室650可以将2、3、4、5(如图11c所示)或更多个培养室610流体连接到出口孔605。在本示例中,出口室650从每个培养室6101-4的下部延伸出或至少部分地围绕每个培养室6101-4的下部。适当地,每个培养室6101-4的下壁与出口室650的下壁共面。出口通道608从出口室650朝向出口孔延伸。在本示例中,出口室650经设置尺寸以防止细胞沉积物(适当地受精卵期胚胎)从中通过。也就是说,出口室650阻断胚胎150(即细胞沉积物)从中通过,由此将胚胎保留在相应的培养室6101-4中。在本示例中,出口室650的高度(即厚度)小于受精卵期胚胎的直径。在一些示例中,出口通道608也可以经设置尺寸以防止细胞沉积物从中通过。例如,出口通道608(或多个出口通道中的至少一个)可以具有与出口室650相同的高度(即厚度)。在其它示例中,出口通道的高度可以比出口室650高。在一些示例中,出口室可以是出口通道的一部分(即并入其中)。例如,出口室可以是出口通道的喇叭端(flaredend)或扩大端(enlargedend)。替代装置本文详细描述了一种适合于支持胚胎发育的装置。但是,类似的装置也可以用来支持任何细胞沉积物(例如任何细胞和/或组织,例如,源自卵巢的细胞和/或组织)的发育。如本文所用,术语“源自卵巢”涵盖直接或间接来源于卵巢的任何细胞和/或组织,包括其分化产物。例如,卵母细胞、卵巢卵泡(诸如始基卵泡、或卵丘-卵母细胞复合体、窦前卵泡或窦卵泡)和卵巢组织(例如卵巢组织碎片)均被该术语所涵盖。此外,还涵盖胚胎,因为它们最初源自卵巢产物(卵母细胞)并由此间接地源自卵巢。如本文所用,术语“胚胎”涵盖受精卵、透明带、卵裂期胚胎、桑椹胚和囊胚。如本文所用,术语“支持发育”是指维持沉积在装置中的细胞和/或组织的活力并支持细胞材料的细胞分裂和/或细胞分化。沉积在装置中的细胞和/或组织在本文中也称为“细胞沉积物”(即在装置中进行任何细胞分裂和/或细胞分化之前,沉积在装置中的细胞材料)。典型地,细胞沉积物是多细胞沉积物(例如源自卵巢的多细胞产物)。因此,该装置适合于支持包含来源于卵巢的细胞或组织中的至少一种的细胞沉积物(例如受精卵期胚胎)的发育。典型地,细胞沉积物在装置内发育(通过细胞生长、细胞分裂和/或细胞分化)以形成发育的材料。如本文所用,术语“发育的材料”是指要从装置取回的细胞和/或组织。因此,提供了一种用于支持细胞沉积物的发育的装置,该细胞沉积物包含源自卵巢的细胞或组织中的至少一种,该装置包括:入口孔、出口孔和设置在入口孔和出口孔之间的封闭式培养室;将入口孔流体连接至培养室的入口通道;将培养室流体连接至出口孔的至少一个出口通道;其中,至少一个出口通道中的每一个经设置尺寸以防止细胞沉积物从中通过。适当地,该装置可以是微流体装置。可以理解的是,当支持源自卵巢的细胞或组织的发育时,出口通道经设置尺寸以防止最初沉积在装置中的细胞或组织(即细胞沉积物)从中通过。如此,出口通道经设置尺寸以防止细胞沉积物离开培养室。如本文详述的,当细胞沉积物是受精卵胚胎时,出口通道经设置尺寸以防止受精卵胚胎从中通过。该受精卵胚胎被防止离开培养室并可以保留在装置内足够长的时间以支持该胚胎的发育(例如,支持受精卵胚胎细胞分裂和/或分化成进一步发育的胚胎,诸如透明带、桑椹胚或囊胚)。类似地,当细胞沉积物是卵母细胞时,出口通道经设置尺寸以防止该卵母细胞从中通过。该卵母细胞被防止离开培养室,并且可以在装置内保留足够长的时间以支持卵母细胞发育(例如支持卵母细胞的细胞生长、细胞分裂和/或分化为生育性卵子)。类似地,当细胞沉积物为卵巢卵泡时,出口通道经设置尺寸以防止该卵巢卵泡从中通过。该卵巢卵泡被防止离开培养室,并且可以保留在该装置中足够长的时间以支持该卵巢卵泡的发育(例如支持该卵巢卵泡的细胞生长、细胞分裂和/或分化)。类似地,当细胞沉积物是卵巢组织时,出口通道经设置尺寸以防止该卵巢组织从中通过。该卵巢组织被防止离开培养室,并且可以保留在该装置中足够长的时间以支持该卵巢组织的发育(例如支持该卵巢组织的细胞生长、细胞分裂和/或分化)。类似地,当细胞沉积物包括透明带时,出口通道经设置尺寸以防止细胞沉积物(包括透明带)从中通过。该包括透明带的细胞沉积物被防止离开培养室,并且可以保留在该装置内足够长的时间以支持该包括透明带的细胞沉积物的发育(例如支持该细胞沉积物/透明带的细胞分裂和/或分化为进一步发育的胚胎,诸如桑椹胚或囊胚)。类似地,当细胞沉积物为桑椹胚时,出口通道经设置尺寸以防止该桑椹胚从中通过。该桑椹胚被防止离开培养室,并且可以保留在装置中足够长的时间以支持该桑椹胚的发育(例如支持该桑椹胚的细胞分裂和/或分化为进一步发育的胚胎,诸如囊胚)。类似地,当细胞沉积物是囊胚时,出口通道经设置尺寸以防止囊胚从中通过。该囊胚被防止离开培养室,并且可以保留在装置中足够长的时间以支持该囊胚的发育(例如,支持该囊胚的细胞分裂和/或分化为进一步发育的胚胎,诸如着床前胚胎)。本文装置的其它特征(例如入口孔、入口通道和培养室)可以根据细胞沉积物和/或发育的材料进行类似地设置尺寸或调整。例如,入口孔、入口通道和培养室可以经设置尺寸以容纳和/或允许通过发育的材料,以便可以从装置中取出发育的材料。类似于以上讨论的出口通道的尺寸变化,本领域技术人员可以理解如何放缩入口孔、入口通道和培养室以容纳不同尺寸的细胞沉积物和/或发育的材料。本文详细描述了关于小鼠受精卵(“细胞沉积物”)和小鼠囊胚(“发育的材料”)的尺寸考虑因素的非限制性示例,并且可以外推用于其它细胞沉积物(例如其它哺乳动物受精卵)和发育的材料(例如其它哺乳动物囊胚)。通过以下非限制性实施例说明本发明的其它方面。实施例材料和方法微流体装置设计和制造使用标准的软光刻技术用聚二甲基硅氧烷(pdms,184,downcorning,mi,usa)制成微流体装置。该程序在带有su-82050和2035负性光刻胶的100级无尘室中进行。简言之,使用su-8旋涂(目标厚度100、200和30μm)4”硅晶圆(si-mat,kaufering,germany)。旋转速度越低,获得平坦层的硬度就越大,因此通过旋涂两层100μm的层而不是一层唯一层来获得200μm层。烘烤后,通过40,000dpi印刷的mylar掩模(jdphotodata,uk)将抗蚀剂层暴露于uv光下,并在烘烤晶圆后最终用su-8显影剂处理以去除未曝光的抗蚀剂。随后,制备10:1pdms预聚物:固化剂混合物,倾倒在su8模具上,彻底脱气并放置在70℃的烘箱中固化过夜。之后,用锋利的刀将pdms层切开并从模具中脱下。通过使用不锈钢圆形冲头在pdms层上冲出1/16”孔来打开进入微流体室的端口。最后,通过使用氧等离子体处理(600mt,100w,40s)粘合两层来组装装置。该过程可以去除污染物(化学物质),氧化并活化表面,但也可用作抗菌和抗微生物处理。因此,一旦组装完成,立即使用一次性无菌注射器向装置注入胚胎测试水并在4℃下保存,直到用于保持高湿度。计算模型为了评估和比较流速、速度场以及预测剪切应力与微流体装置几何形状的关系,使用comsolmultiphysics5.2a模拟了其中的流体流动。为了生成3d模型,首先使用计算机辅助设计(autodeskautocad2017)软件创建微流体设计。然后将设计几何导入到comsol库中。与以前的研究一样,将装置内部的流体模拟为具有密度(ρ=1000kgm-3)和粘度(μ=1x10-3pas)的不可压缩的均匀牛顿流体。comsol模拟还假定在所分析的流速下所描述的装置中的所有流动都是完全层流的,雷诺数(re)比湍流阈值(2300)低几个数量级。雷诺数通常定义为惯性力与粘性力之比。由于缓慢的体积流量和可忽略的惯性效应,微流体学的一般假设是雷诺数≤1。该模型基于不可压缩牛顿流体的稳态navier-stokes方程:其中v和p是速度矢量和压力。无滑移边界条件(noslipboundaryconditions)应用于微型装置壁。将平面速度曲线应用于入口通道,同时将零压力条件应用于出口。分析了色谱中速度场的表面图和培养室内速度场波动的线图。还通过comsol基于底壁或顶壁正上方的速度梯度计算了底壁或顶壁的剪切速率(γ)。然后将剪切速率乘以粘度(μ)以确定我们的微流体装置内的壁剪切应力场(τ=μγ)。流量表征荧光珠粒测定为了表征装置内的流体流动并且追踪流体随入口和出口通道的不同微型装置几何形状的动态变化(图3a至3d),使用了4.8μm荧光聚苯乙烯珠粒。使用gilson移液器,通过毛细现象珠粒溶液灌注通过装置。为了在手动将胚胎/珠粒加载到装置中时产生朝向出口的流动并且模拟实验条件,在排空入口和出口储库后,在入口储库中释放出3ml的液滴。使用照相机和软件通过荧光显微镜监测和记录流动。在494/512nm激发/发射光谱中拍摄图像和视频。使用imagej软件测量珠粒路径的长度除以曝光时间,评估图像框架。所得速度在comsol中用于微型装置内流体的剪切应力评估。荧光素为了进一步评估培养室内的流动与入口和出口通道的关系,使用了0.05mgml-1荧光素溶液。如前所述,在入口储库中释放出3ml的微滴,并使用带有照相机和软件的荧光显微镜进行荧光素流动室图随时间变化的时间推移评估。微流体装置加载和取回测试使用ez-grip移液器(riconsumables)手动加载和取回75.4μm聚苯乙烯珠粒(ppx-800-10,5%w/v),以分别模拟加载和取回流动作用下的实验小鼠胚胎行为,以及测试微流体装置的处理。在显微镜和采集软件的支持下,评估了不同设计的入口和出口通道在装载过程中珠粒散布以及从腔室的珠粒取回。鼠胚胎生产根据既定协议,mrcharwell生产了来自c57/b6株的鼠胚胎。在根据ref进行卵巢过度刺激后,取回成熟鼠m2卵母细胞-卵丘复合体(occ)。进行体外受精(ivf)。假定受精卵在ivf后冷冻保存,并通过dryshipper运送到利兹大学(universityofleeds)。鼠胚胎培养与取回根据mrc协议将鼠假定受精卵解冻。简言之,将胚胎吸管在空气中放置30s,然后将其倒入室温水中,直到内容物明显融化(约10s)。在封口处将吸管切开,将塞子一分为二,然后用吸管将内容物推入60mmivf疏水性培养皿中。将胚胎温育5分钟,然后在37℃下在100μlm2培养基中洗涤2次,每次5分钟。然后通过3x10μl在油下预平衡的ksom液滴洗涤胚胎,然后培养。双通道装置双通道装置配备有至入口和出口(入口和出口孔)的储库。入口孔填充有250μlksom并且从出口孔将培养基抽吸10次。然后将两个储库中的培养基替换为250μl新鲜培养基,并进行预平衡过夜。在胚胎加载时,从每个储库去除250μl培养基。使用135μl移液器吸头将胚胎放置在入口的通道口处。然后从通道出口吸出培养基直到所有胚胎均进入了中心培养室。然后使储库充满250μl预平衡的ksom培养基。在胚胎取回时,从入口储库去除250μl培养基并且使用135μm移液器吸头在入口孔处抽吸并收集胚胎。然后在常规培养箱中在37℃下在5%co2、5%o2的潮湿氮气中培养装置。宽通道装置将宽通道装置放置在60mmart培养皿中,并用4ml胚胎测试水包围。这种潮湿的环境消除了对大型培养基储库的需求。通过向通道入口添加10μlksom液滴并将培养基从通道出口抽吸10次来准备装置。然后向入口和出口添加10μl新鲜ksom液滴,然后在37℃下在5%co2、5%o2的潮湿氮气中预平衡过夜。为了加载胚胎,从入口和出口储库去除10μl培养基液滴,然后使用135μm移液器吸头将胚胎放置在入口内通道口。从通道出口抽吸培养基直到所有胚胎均进入了中心室。然后向通道入口和出口添加10μl预平衡的ksom液滴,然后在minc台式培养箱中,在37℃下在5%co2、5%o2的潮湿氮气中培养。使用一系列临床和研究art实验室常用的灯和移液器胚胎处理装置,胚胎加载同样成功且实用。结果与讨论微流体结构设计为了贴切模拟胚胎在输卵管内从受精卵到囊胚期的生理旅程,设计微流体装置以包括(i)总容积(不包括储库)小于1μl(5-50μl是当前在更常规的培养技术中用于培养基滴加的容积),(ii)一个入口和(iii)通过位于两个不同水平的具有不同厚度的两个微流体通道连接到培养室的一个出口储库,和(iv)厚度为30μm的较窄的出口通道,其远小于小鼠胚胎(直径约100μm)的尺寸,这对于加载期间在施加流动时防止小鼠胚胎流出是必要的。这种微流体结构是通过将两层pdms粘合在一起而获得的(图3)。设计的尺寸适于与小鼠胚胎(在囊胚期的直径为约100μm,其在孵化的囊胚期可以扩大至大于150μm)一起操作,并且适于在加载和取回期间最小化通道内的壁剪切应力(wss)(1.2dyncm-2剪切应力会在12小时内导致囊胚致死)。为了优化微流体装置内的流动并且促进胚胎加载/取回,减少胚胎/壁接触的可能性并从而减少施加在它们上的应力,评价了包括两个不同入口通道矩形截面的更多设计(图5)。微流体装置中的流动可以用无体积力(质量力,bodyforces)的均匀粘性牛顿流体的不可压缩navier-stokes方程来描述,并且由体积流率和微流体结构的几何形状确定。为了根据最大可承受的剪切速率确定微流体装置的尺寸,如先前所示,可以容易地找到具有圆形横截面或宽矩形横截面(高度-宽度比为约0)的管道的体积流率(q)、几何尺寸和剪切应力之间的关系。由于微细加工过程,微系统中的流道通常是矩形的,其高度(h)与宽度(w)相当。在这种情况下,剪切速率可以计算为傅立叶级数的总和。所得方程采用以下形式:其中函数f(x)如下:根据以上等式,并考虑到入口通道的正方形截面,针对两种入口通道设计均计算出为确保wss低于1.2dyncm-2有害阈值所需的流速(如图5所示)。估计的流速值与微流体网络中使用的典型流速一致,其中层流和无湍流对于最小化弯曲和分支点处的非稳态流至关重要。如所预期的,在相同的流速下,设计2允许在入口通道中获得设计1的约1/13的wss(分别为0.087dyncm-2和1.2dyncm-2)。较大的通道横截面和较低的水力阻力(rh)导致培养室内的速率较低并且将入口通道内的剪切应力降低至低于致死wss值。comsolmultiphysics5.2a的计算模型为了评估出口通道几何形状如何影响整个装置内的流速和速度场,在提议设计(设计2.1–设计2.4)的comsol模拟上应用1.014μlmin-1的流速。如图6所示,在加载过程中,入口通道(水力阻力∝1010pasm-1)的速度分布图首先由于培养室的存在而展平,然后由于水力阻力增加(高达1012-13pasm-1)而再次上升至高于出口通道的初始值以上。从暖色到冷色的色调差异代表了从设计2.1到设计2.4的出口通道内不断减小的水力阻力(图6)。在所提议的设计之间,设计2.4对流动施加较低的水力阻力,并且出口通道布置在腔室的一半附近,因此沿横截面方向显示了培养室内较宽的速度分布(图8)。根据在comsol上发现的计算结果,并按照标准的光刻工艺,制造并组装了具有设计1和设计2.4的装置以进行进一步表征。流动特性和剪切应力分析借助4.8μm荧光聚苯乙烯珠粒,表征了设计1和设计2.4的装置内流动随入口和出口通道尺寸的变化。确定微型装置的流速和追踪微型装置的流体动力学对于表征提议设计中的培养条件至关重要。使用柔性移液器(ez-grip)通过手动加载来创建流动。设计1和2.4的入口通道的最大速度值分别估计为0.25mms-1和0.4mms-1,其对应于0.156μlmin-1(re=0.026)和1.17μlmin-1(re=0.087)的流速。如所预期的,由于较低的水力阻力,与设计1相比,设计2.4的特点是具有更高的流动分布,这在加载和取回胚胎期间会有所帮助,并且与使wss低于致死值1.2dyncm-2所需的理论阈值(分别为1.014μlmin-1和13.91μlmin-1)相比,这两种装置均显示出更低的流速。将估计的入口速度应用于comsol模型,以预测微流体系统中的剪切应力(图9)。设计1和设计2.4均具有远低于阈值的剪切速率的特点,其中一些临界点(约3.5dyncm-2)靠近出口通道口,此处的wss超过有害值。然而,如下所报道的通过胚胎生物测试所证明的,由于较短的处理时间(几秒)并且由于在胚胎无法到达的节段处(通道厚度30μm<平均胚胎直径)达到了这些值,所以这些临界值不会影响胚胎活力。在评估了速度之后,为了更好地表征微流体室内的流动分布,使荧光素溶液流入室内(图7)。根据计算分析预测,带有设计2.4的微流体装置可提供更宽且更高的分布(图7)。考虑到营养因子在室内的更好扩散(例如荧光素),以及施加在胚胎上的瞬态机械刺激,这些结果表明,胚胎均质地散布在室内并接受等量的营养。此外,如果在胚胎发育期间必须更新培养基,则设计2.4中更新了整个室的体积。取而代之的是使用75.4μm的聚苯乙烯珠粒来模拟加载和回收测试期间的胚胎行为。在手动加载过程中,珠粒未被推入入口通道而是轻轻释放在其入口处,然后通过毛细作用(由更高的流速增强的物理现象)从流动流中运送到培养室内。实际上,设计为2.4的装置内的流速更高(1.17μlmin-1),这使其更易于使用。正如预期的,与设计1相比,设计2.4的微流体腔室中的珠粒也倾向于更好地散布在整个腔室的整个宽度中(图7)。这可以避免胚胎之间的接触并且取而代之的是保持有利于胚胎之间的旁分泌信号传导的相互距离,同时避免分泌的产物在它们周围培养基中的有害积累。装置培养物的蒸发和渗透压变化由于初步测试中的蒸发损失,设计2装置中使用了保持250μlksom的培养基储库。将装置在大型培养皿中培养,每天补充培养基,用胚胎测试水包围,或者不加湿或不更换培养基。在用油覆盖的储库中不存在储库体积的变化(250μl±0),但是所有其它条件下的体积均显著降低。与用水包围的装置(220μl±5,p<0.05)相比,每天(202μl±6)或每2天(193μl±3.3)更换培养基的装置具有显著更低的体积。然而,与油覆盖的储库相比,注水(泛水,water-flooded)装置的渗透度没有显著增加。与油覆盖的装置(252mosmkg-1±6.4)相比,每2天(336mosmkg-1±10)或每天更换培养基的装置(298mosmkg-1±12)中培养3天后的渗透度增加,并且与注水装置(261mosmkg-1±1.2)相比,每2天更换培养基的装置中的渗透度增加,每天更换培养基的装置则未增加。与对照装置相比,在培养基补给和潮湿培养皿中,蒸发损失和渗透压增加均显著较小。双通道装置中的胚胎发育在设计2装置中培养胚胎,每天更换250μl储库的培养基或在大型培养皿中用水包围以减少蒸发。这两种装置条件之间不存在卵裂或囊胚率的差异。装置卵裂率(94.44±2.53,n=15)和囊胚率(90%±6.3)与微滴培养无统计学差异(分别为94.73%±1.563,n=13和94%±1.8,p=0.3684)。宽通道装置中的胚胎发育将宽通道装置(设计2.4)放置在60mm培养皿中,并用胚胎测试水包围。所得的潮湿微环境避免了对大型培养基储库的需求,并且在培养过程中向通道的入口和出口添加了10μlksom液滴。尽管培养基倾向于通过被动泵送而流向出口侧,但在3天培养期间,这些液滴的总体积没有显著变化。胚胎发育与液滴培养无显著差异,具有相似的卵裂率(93.94%±3.2,n=11相对于对照94.73%±1.6,n=11,p=0.8)、囊胚率(96%±2.1相对于对照94%±1.8,p=0.37)和孵化率(11.11%±3.5,n=4相对于对照20.83%±9.5,n=5,p=0.33)。结论在本项研究中,发明人提出了一种封闭式新型优化微流体系统,其能够支持体外胚胎生长并且改善体外操纵的胚胎的发育能力。设计了入口通道-培养室-出口通道的结构化装置,在流速、速度场、剪切应力方面研究并比较了入口和出口通道的不同横截面在胚胎加载、生长和取回上性能。首先进行了理论方法和计算模拟,随后通过磁珠和胚胎的实践实验进行了确认。发明人发现,当施加相同的流速时,较宽的入口通道可确保微培养室内较低的速度和wss分布以及较宽的流动分布。这允许在加载期间获得更宽的胚胎散布和在取回期间更有效的胚胎回收。通过排空入口储库以在腔室中产生回流,也可以更容易地从本发明的微流体腔室中取回胚胎,后期将对此进行进一步的评估。在60mmivf培养皿内温育装置,用胚胎测试水淹没,防止了显著蒸发损失。通过工业标准小鼠胚胎测定测试了胚胎毒性。胚胎发育类似于对照微滴,94.4%相对于94.7%的卵裂率和96%相对于94%的囊胚率。这一数据表明,本发明的装置是完全胚胎安全的,支持胚胎成功发育至囊胚期而无需更换培养基或油覆层。在人类ivf中,通常在体外发育胚胎,然后着床到子宫中。遗憾的是,ivf目前与两个重要问题相关,这两个问题至少部分地源于无法充分支持胚胎体外发育通过不同阶段并且无法评估单个胚胎的生殖潜力:(i)着床率低,和(ii)多胎妊娠率高。本微流体装置也旨在解决这些问题,其通过改善操作的胚胎质量来减少对动物的使用,并且有利于使用只能用于转移晚期胚胎的非手术胚胎转移技术。在以下编号的段落中描述了其它方面。1.一种用于支持胚胎发育的微流体装置,该装置包括:入口孔、出口孔和设置在入口孔和出口孔之间的封闭式培养室;将入口孔流体连接至培养室的入口通道;将培养室流体连接至出口孔的至少一个出口通道;其中,至少一个出口通道的每一个均经设置尺寸以防止受精卵期胚胎从中通过。2.根据段落1的微流体装置,其中入口通道被构造为通过入口孔和培养室之间的毛细管作用而使流体流动。3.根据段落1或段落2的微流体装置,其中至少一个出口通道中的每一个被构造为通过培养室和出口孔之间的毛细管作用而使流体流动。4.根据任一前述段落的微流体装置,其中入口通道从入口孔的下部延伸至培养室的上部。5.根据任一前述段落的微流体装置,其中入口孔的下壁与入口通道的下壁共面。6.根据任一前述段落的微流体装置,其中入口通道的上壁与培养室的上壁共面。7.根据任一前述段落的微流体装置,其中至少一个出口通道中的每一个从培养室的下部延伸至出口孔的下部。8.根据任一前述段落的微流体装置,其中培养室的下壁与至少一个出口通道中的每一个的下壁共面。9.根据任一前述段落的微流体装置,其中至少一个出口通道中的每一个的下壁与出口孔的下壁共面。10.根据任一前述段落的微流体装置,其中至少一个出口通道中的每一个的高度和/或宽度小于受精卵期胚胎的直径。11.根据段落10的微流体装置,其中至少一个出口通道中的每一个的高度和/或宽度小于或等于受精卵期胚胎直径的50%。12.根据任一前述段落的微流体装置,其中入口通道经设置尺寸以允许囊胚期胚胎通过。13.根据段落12的微流体装置,其中入口通道的最小横截面尺寸是囊胚期胚胎直径的至少1.5倍。14.根据任一前述段落微液体装置,其中培养室为基本上圆形、卵形或椭圆形,并具有恒定的高度。15.根据任一前述段落的微液体装置,其中培养室的直径或宽度大于或等于入口通道的宽度。16.根据任一前述段落的微流体装置,其中培养室具有约3nl至约100μl的容积。17.根据任一前述段落的微流体装置,其中入口孔和出口孔各自具有约2至约20μl的容积。18.根据任一前述段落的微流体装置,其中入口孔包含倾斜的下部,其中倾斜的下部以0至90度的角度朝向入口通道的开口倾斜。19.根据任一前述段落的微流体装置,其中入口通道具有基本等于至少一个出口通道的总容积的容积。20.根据任一前述段落的微流体装置,其包含多个出口通道。21.根据段落20的微流体装置,其中多个出口通道各自在培养室和出口孔之间基本平行地延伸。22.根据段落20或段落21的微流体装置,其中与多个出口通道中的另一个相比,多个出口通道的至少一个具有不同的容积。23.根据任一前述段落的微流体装置,还包括限定在装置的外壁和与外壁间隔开的内壁之间的储库,其中储库在入口孔、出口孔、培养室、入口通道和至少一个出口通道的周围延伸并且被构造为在其中保留一定体积的流体。24.任一前述段落的装置用于培养至少一个胚胎的用途。25.根据段落24的装置的用途,其中至少一个胚胎是哺乳动物胚胎,任选地其中至少一个胚胎选自人类或其它灵长类动物、啮齿动物、牛、绵羊或猪胚胎。在整个本说明书的描述和权利要求中,词语“包括”和“包含”及其变型是指“包括但不限于”,并且它们不旨在(且不)排除其它部分、添加剂、组分、整数或步骤。在整个本说明书的描述和权利要求中,除非上下文另有要求,否则单数包含复数。特别地,在使用不定冠词的情况下,本说明书应被理解为考虑了复数和单数,除非上下文另有要求。结合本发明的特定方面、实施方式或实施例描述的特征、整数、特性、化合物、化学部分或基团应理解为适用于本文所述的任何其它方面、实施方案或实施例,除非与其不相容。在本说明书(包括任何所附权利要求、摘要和附图)中公开的所有特征和/或如此公开的任何方法或工艺的所有步骤可以以任何组合方式进行组合,但其中至少一些此类特征和/或步骤互斥的组合除外。本发明不限于任何前述实施方式的细节。本发明扩展至本说明书(包括任何所附权利要求、摘要和附图)中公开的特征的任何新的一个或任何新的组合,或扩展至如此公开的任何方式或工艺的步骤的任何新的一个或任何新的组合。读者的注意力转向关连本申请与本说明书同时或在本说明书之前提交并且与本说明书一起公开供公众查阅的所有论文和文献,并且所有此类论文和文献的内容均通过引用并入本文。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1