表达L-谷氨酸氧化酶和过氧化氢酶的重组载体、工程菌及应用与α-酮戊二酸的生产方法与流程
本发明涉及分子生物技术及酶工程领域,具体而言,涉及表达l-谷氨酸氧化酶和过氧化氢酶的重组载体、工程菌及应用与α-酮戊二酸的生产方法。
背景技术:
α-酮戊二酸是生物体三羧酸循环和氨基酸代谢的关键节点,可通过谷氨酸脱氢酶加氨或转氨酶生成谷氨酸,广泛运用于膳食、医疗、化妆品、精细化工等领域,甚至体育运动领域也将其作为减轻氨积累伤害的辅助类补品,市场需求大于供给,价格较高。目前合成α-酮戊二酸主要有三种方法:有机化学合成、发酵积累和酶法转化。
有机合成传统的方法有酰基腈化物水解法、草酸类乙酯水解法,需几步才能到达,较为繁琐,污染严重;发酵积累法已经取得较大突破,葡萄糖培养光滑球拟酵母积累α-酮戊二酸,64h达到43.7g/l;用甘油培养解脂耶氏酵母,117h达到186g/l,虽然产量已经很高,但其他杂酸较多,分离纯化难度大,且发酵周期过长,尚未实现工业化生产。
技术实现要素:
本申请实施例提供了一种表达l-谷氨酸氧化酶和过氧化氢酶的重组载体、工程菌及应用与α-酮戊二酸的生产方法,通过构建高效表达的重组载体,方便生产;通过重组载体获得工程菌,方便进行全细胞催化,通过工程菌催化转化的方法能提高α-酮戊二酸的得率。
在本申请的第一方面,提供了表达l-谷氨酸氧化酶和过氧化氢酶的重组载体,重组载体包括表达l-谷氨酸氧化酶的l-谷氨酸氧化酶基因lgox、表达过氧化氢酶的过氧化氢酶基因cat以及调控l-谷氨酸氧化酶基因lgox和过氧化氢酶基因cat表达的调控序列sd;l-谷氨酸氧化酶基因lgox的碱基序列如seqidno.1所示,过氧化氢酶基因cat的碱基序列如seqidno.2所示,调控序列sd的碱基序列如seqidno.3所示。
通过共表达l-谷氨酸氧化酶和过氧化氢酶转化谷氨酸盐生产α-酮戊二酸的原理如下:
通过l-谷氨酸氧化酶转化谷氨酸盐为α-酮戊二酸,同时产生过氧化氢,随着反应的进行过氧化氢的浓度会增加,就会抑制反应的进行,所以通过过氧化氢酶的作用,降解过氧化氢并生成水和氧气,保证反应的持续有效进行。
本实施例中通过在表达载体中调控l-谷氨酸氧化酶基因lgox和过氧化氢酶基因cat表达的调控序列sd,调控序列sd具有核糖体结合的位点并调控l-谷氨酸氧化酶基因lgox和过氧化氢酶基因cat表达,达到l-谷氨酸氧化酶和过氧化氢酶的表达量的配合平衡,实现较佳的反应速率,提高α-酮戊二酸的产率。
本申请的第二方面,提供了上述的表达l-谷氨酸氧化酶和过氧化氢酶的重组载体在制备α-酮戊二酸中的应用。
本申请的第三方面,提供了表达l-谷氨酸氧化酶和过氧化氢酶的工程菌,工程菌包括表达l-谷氨酸氧化酶的l-谷氨酸氧化酶基因lgox、表达过氧化氢酶的过氧化氢酶基因cat以及调控l-谷氨酸氧化酶基因lgox和过氧化氢酶基因cat表达的调控序列sd;l-谷氨酸氧化酶基因lgox的碱基序列如seqidno.1所示,过氧化氢酶基因cat的碱基序列如seqidno.2所示,调控序列sd的碱基序列如seqidno.3所示。
本申请的第四方面,提供了上述的表达l-谷氨酸氧化酶和过氧化氢酶的工程菌在制备α-酮戊二酸中的应用。
本申请的第五方面,提供了一种α-酮戊二酸的生产方法,生产方法包括以下步骤:
构建表达l-谷氨酸氧化酶和过氧化氢酶的重组载体,将重组载体转化感受态细胞,得到工程菌;
工程菌经过初级培养得到发酵菌体;
将发酵菌体接种于生物反应器的反应液中进行反应,生产得到α-酮戊二酸。
在实施例中,通过构建共表达表达l-谷氨酸氧化酶和过氧化氢酶的重组载体(重组载体的骨架载体可以有多种选择,本发明不做具体限定),并将该操作载体转化到感受态细胞(感受态细胞可以有多种选择,本申请中不做具体限定)得到能共表达表达l-谷氨酸氧化酶和过氧化氢酶的工程菌,然后通过扩大培养得到菌体,将菌体用于全细胞催化反应,就能产生并得到α-酮戊二酸。
前述第五方面的一些实施例中,初级培养包括一级培养和二级培养,一级培养的条件为37℃的温度条件下,220-250rpm培养8-12h;一级培养至od600为3.8-4.1转接进行二级培养,二级培养的条件为37℃的温度条件下,200-235rpm培养4-5h。
本实施例中,通过逐级扩大培养,能快速获得足够的菌体进行催化反应。
前述第五方面的一些实施例中,二级培养后还包括补充培养,补充培养是将二级培养的菌液转接至发酵培养基进行发酵,发酵培养基的ph和/或溶氧上升,添加补料培养基,培养至od600达到22-28时,开始降温至29-30℃,加入0.1-0.2mm的iptg诱导培养11-14h,得到发酵菌体。
通过在二级培养后,继续补充营养液并培养,获得高浓度的菌体,能在生物反应器中保持菌体一定的浓度,提高反应效率;而且通过添加iptg诱导,获得大量蛋白的表达和产生,菌体会累积产生大量的l-谷氨酸氧化酶和过氧化氢酶,通过酶催化反应生成得到α-酮戊二酸。
前述第五方面的一些实施例中,一级培养基为lb培养基,二级培养基为tb培养基,发酵培养基含有酵母膏28g/l,蛋白胨15g/l,甘油10g/l,三水合磷酸氢二钾16.4g/l,磷酸二氢钾2.3g/l,七水合硫酸镁0.3g/l,柠檬酸铁铵0.1g/l;补料培养基含有酵母膏100g/l,蛋白胨30g/l,甘油400g/l。
前述第五方面的一些实施例中,发酵菌体与反应液的料液比为20-35g/l。
发酵产生的菌体中含有大量的l-谷氨酸氧化酶和过氧化氢酶,通过发酵菌体与反应液合适的配比,l-谷氨酸氧化酶和过氧化氢酶催化反应,能提高反应的速度,避免过低的发酵菌体,造成长时间的发酵,影响生产效率。
前述第五方面的一些实施例中,反应液包括谷氨酸盐,生物反应器的反应液反应的温度为30℃的温度,260-320rpm,并控制ph为6.5-7.0。
发酵液中添加谷氨酸盐(包括谷氨酸钠、谷氨酸钾等)作为反应底物,能反应生成α-酮戊二酸。
与现有技术相比,本发明的有益效果包括:本发明提供的表达l-谷氨酸氧化酶和过氧化氢酶的重组载体,通过在载体中插入调控l-谷氨酸氧化酶基因lgox和过氧化氢酶基因cat表达的调控序列sd,提高l-谷氨酸氧化酶和过氧化氢酶转化底物生成α-酮戊二酸的能力,具有较好的实际使用价值。
附图说明
为了更清楚地说明本发明实施例的技术方案,下面将对实施例中所需要使用的附图作简单地介绍。应当理解,以下附图仅示出了本发明的某些实施例,因此不应被看作是对范围的限定。对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他相关的附图。
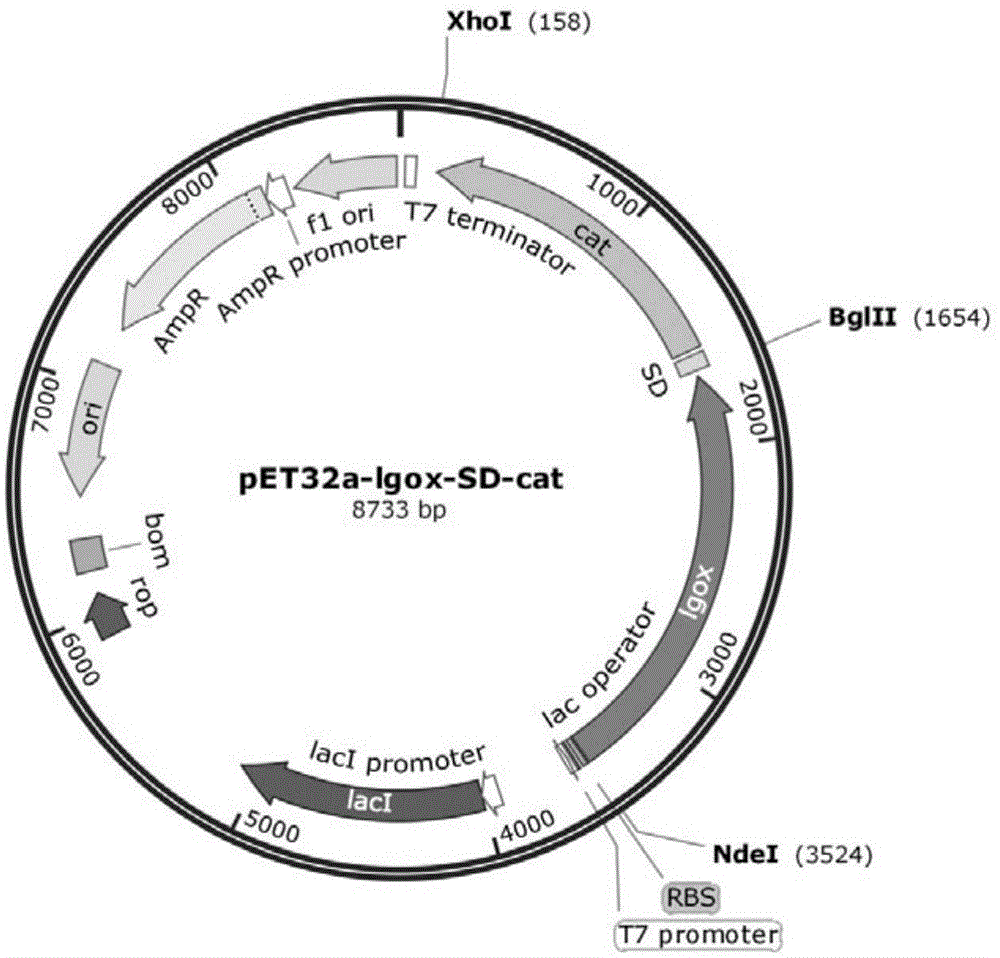
图1为本发明实验例提供1重组载体结构图;
图2为本发明实验例1提供的l-谷氨酸氧化酶和过氧化氢酶表达量的sds-page蛋白质电泳分析检测图。
具体实施方式
下面将结合实施例对本发明的实施方案进行详细描述,但是本领域技术人员将会理解,下列实施例仅用于说明本发明,而不应视为限制本发明的范围。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
以下结合实施例对本发明的特征和性能作进一步的详细描述。
实施例1
本实施例提供一种表达l-谷氨酸氧化酶和过氧化氢酶的重组载体和工程菌,该重组载体包括表达l-谷氨酸氧化酶的l-谷氨酸氧化酶基因lgox、表达过氧化氢酶的过氧化氢酶基因cat以及调控l-谷氨酸氧化酶基因lgox和过氧化氢酶基因cat表达的调控序列sd;l-谷氨酸氧化酶基因lgox的碱基序列如seqidno.1所示,过氧化氢酶基因cat的碱基序列如seqidno.2所示,调控序列sd的碱基序列如seqidno.3所示。
表达l-谷氨酸氧化酶和过氧化氢酶的重组载体和工程菌的获得过程如下:
1.1根据streptomycesafghaniensis772的l-谷氨酸氧化酶基因去全长序列进行优化并去掉序列的信号肽,得到l-谷氨酸氧化酶基因,并设计扩增引物扩增l-谷氨酸氧化酶基因,并将l-谷氨酸氧化酶基因连接到t载体,构建得到t-lgox载体;
1.2根据短小芽孢杆菌过氧化氢酶基因进行优化得到过氧化氢酶基因cat,设计引物序列并将调控序列sd设计到引物上,通过扩增,得到sd序列-过氧化氢酶基因cat并连接到puc57载体,得到puc57-sd-cat载体;
1.3选用合适的内切酶双酶切t-lgox载体、puc57-sd-cat载体和pet32a载体骨架系统;回收酶切片段,并用t4连接酶将酶切的连接双酶切的片段,得到表达l-谷氨酸氧化酶和过氧化氢酶的pet32a-lgox-sd-cat重组载体,载体结构图见图1;
1.4将得到的pet32a-lgox-sd-cat重组载体转化dh5α感受态细胞中,提取质粒并转到大肠杆菌bl21(de3)中,得到表达l-谷氨酸氧化酶和过氧化氢酶的工程菌pet32a-lgox-sd-cat/bl21(de3)。
将重组载体转化的化到大肠杆菌bl21(de3)感受态细胞中,涂板培养15h,挑单菌落于lb试管中培养9h,转接到tb培养基中诱导培养16h,通过sds-page检测表达量,结果如图2所示,选定双酶均正常表达的菌,即成功获得工程菌pet32a-lgox-sd-cat/bl21(de3),保存若干支永久菌甘油管于超低温冰箱中待用。
因此,可以将pet32a-lgox-sd-cat重组载体或工程菌pet32a-lgox-sd-cat/bl21(de3)用于共表达l-谷氨酸氧化酶和过氧化氢酶。
实施例2
本实施例提供一种α-酮戊二酸的生产方法,生产方法的步骤如下:
1.1参考实施例1的方法构建pet32a-lgox-sd-cat重组载体和工程菌pet32a-lgox-sd-cat/bl21(de3);
1.2将工程菌pet32a-lgox-sd-cat/bl21(de3)接种到一级培养基lb中,进行初级培养的一级培养阶段,一级培养的条件为37℃的温度条件下,220rpm培养12h;至od600为3.8;
1.3将一级培养的菌液转移至二级培养基tb中继续初级培养的二级培养阶段培养,二级培养的条件为37℃的温度条件下,200rpm培养4h;
1.4将二级培养的菌体接种到添加有发酵培养基(发酵培养基含有酵母膏28g/l,蛋白胨15g/l,甘油10g/l,三水合磷酸氢二钾16.4g/l,磷酸二氢钾2.3g/l,七水合硫酸镁0.3g/l,柠檬酸铁铵0.1g/l)的发酵罐中37℃培养4h-5h;
1.5当发酵罐中ph和溶氧开始上升的时候,添加补料培养基(补料培养基含有酵母膏100g/l,蛋白胨30g/l,甘油400g/l),菌体浓度od600达到28的时候,降温处理,并用0.1mm的iptg诱导培养14h,收集菌体备用;
1.6将步骤1.5中收集的菌体取150g菌体以20g/l的料液比加入到7.5l反应液中,反应液中含有1370.4g的味精(l-谷氨酸钠),在30℃的温度,260rpm并通入无菌空气转化培养;
1.7用4mol/l的硫酸控制ph为6.5-7.0,检测反应液中不含l-谷氨酸钠,溶氧大于50%,反应完毕。
实施例3
本实施例提供一种α-酮戊二酸的生产方法,生产方法的步骤如下:
1.1参考实施例1的方法构建pet32a-lgox-sd-cat重组载体和工程菌pet32a-lgox-sd-cat/bl21(de3);
1.2将工程菌pet32a-lgox-sd-cat/bl21(de3)接种到一级培养基lb中,进行初级培养的一级培养阶段,一级培养的条件为37℃的温度条件下,250rpm培养8h;至od600为4.1;
1.3将一级培养的菌液转移至二级培养基tb中继续初级培养的二级培养阶段培养,二级培养的条件为37℃的温度条件下,235rpm培养5h;
1.4将二级培养的菌体接种到添加有发酵培养基(发酵培养基含有酵母膏28g/l,蛋白胨15g/l,甘油10g/l,三水合磷酸氢二钾16.4g/l,磷酸二氢钾2.3g/l,七水合硫酸镁0.3g/l,柠檬酸铁铵0.1g/l)的发酵罐中37℃培养4h-5h;
1.5当发酵罐中ph和溶氧开始上升的时候,添加补料培养基(补料培养基含有酵母膏100g/l,蛋白胨30g/l,甘油400g/l),菌体浓度od600达到22的时候,降温处理,并用0.2mm的iptg诱导培养11h,收集菌体备用;
1.6将步骤1.5中收集的菌体取262.5g菌体以35g/l的料液比加入到7.5l反应液中,反应液中含有1370.4g的味精(l-谷氨酸钠),在30℃的温度,320rpm并通入无菌空气转化培养;
1.7用4mol/l的硫酸控制ph为6.5-7.0,检测反应液中不含l-谷氨酸钠,溶氧大于50%,反应完毕。
实施例4
本实施例提供一种α-酮戊二酸的生产方法,生产方法的步骤如下:
1.1参考实施例1的方法构建pet32a-lgox-sd-cat重组载体和工程菌pet32a-lgox-sd-cat/bl21(de3);
1.2将工程菌pet32a-lgox-sd-cat/bl21(de3)接种到一级培养基lb中,进行初级培养的一级培养阶段,一级培养的条件为37℃的温度条件下,240rpm培养9h;至od600为4;
1.3将一级培养的菌液转移至二级培养基tb中继续初级培养的二级培养阶段培养,二级培养的条件为37℃的温度条件下,220rpm培养5h;
1.4将二级培养的菌体接种到添加有发酵培养基(发酵培养基含有酵母膏28g/l,蛋白胨15g/l,甘油10g/l,三水合磷酸氢二钾16.4g/l,磷酸二氢钾2.3g/l,七水合硫酸镁0.3g/l,柠檬酸铁铵0.1g/l)的发酵罐中37℃培养4h-5h;
1.5当发酵罐中ph和溶氧开始上升的时候,添加补料培养基(补料培养基含有酵母膏100g/l,蛋白胨30g/l,甘油400g/l),菌体浓度od600达到22的时候,降温处理,并用0.2mm的iptg诱导培养11h,收集菌体备用;
1.6将步骤1.5中收集的菌体取200g菌体以26.67g/l的料液比加入到7.5l反应液中,反应液中含有1370.4g的味精(l-谷氨酸钠),在30℃的温度,300rpm并通入无菌空气转化培养;
1.7用4mol/l的硫酸控制ph为6.5-7.0,检测反应液中不含l-谷氨酸钠,溶氧大于50%,反应完毕。
实验例1
参考实施例1的方法构建pet32a-lgox-sd-cat重组载体和工程菌pet32a-lgox-sd-cat/bl21(de3)。
工程菌培养:在无菌环境下移种工程菌pet32a-lgox-sd-cat/bl21(de3)于一级培养基中,在温度37℃、转速240rpm条件下培养9h,od600达到3~4后接种到二级培养基中(接种量10%),在温度37℃、转速220rpm下培养4~5h;再接种到发酵罐中37℃培养(接种量10%),ph和溶氧上升时开启补料,菌浓度od600达到22~28时,开始降温至30℃,加入0.1mm的诱导剂iptg诱导培养12小时放罐,收集菌体待用。
转化实验:称取200g湿菌体悬浮于7.5l水中,倒入10l生物反应器,另称取1370.4g味精逐渐投入,30℃、300rpm、通无菌空气转化,用4mol/l硫酸控制ph6.5~7.0。转化24~28h,tlc检测没有l-谷氨酸钠后放罐,溶氧大于50%,转化完毕。经hplc检测,α-酮戊二酸含量为123.37g/l,转化率93.25%。
实验例2
工程菌培养:在无菌环境下移种工程菌pet32a-lgox-sd-cat/bl21(de3)于一级培养基中,在温度37℃、转速240rpm条件下培养9h,od600达到3~4后接种到二级培养基中(接种量10%),在温度37℃、转速220rpm下培养4~5h;再接种到发酵罐中37℃培养(接种量10%),ph和溶氧上升时开启补料,菌浓度od600达到22~28时,开始降温至30℃,加入0.15mm的诱导剂iptg诱导培养12小时放罐,收集菌体待用。
转化实验:量取1.5l发酵菌液,加入去离子水定容7.5l,倒入10l生物反应器,另称取1370.4g味精逐渐投入,30℃、300rpm、通无菌空气转化,用4mol/l硫酸控制ph6.5~7.0。转化24~28h,tlc检测没有l-谷氨酸钠后放罐,溶氧大于50%,转化完毕。经hplc检测,α-酮戊二酸含量为120.4g/l,转化率91.03%。
实验例3
工程菌培养:在无菌环境下移种工程菌pet32a-lgox-sd-cat/bl21(de3)于一级培养基中,在温度37℃、转速240rpm条件下培养9h,od600达到3~4后接种到二级培养基中(接种量10%),在温度37℃、转速220rpm下培养4~5h;再接种到发酵罐中37℃培养(接种量10%),ph和溶氧上升时开启补料,菌浓度od600达到22~28时,开始降温至30℃,加入0.20mm的诱导剂iptg诱导培养12小时放罐,收集菌体待用。
转化实验:量取1.7l发酵菌液,加入去离子水定容7.5l,倒入10l生物反应器,另称取1370.4g味精逐渐投入,30℃、300rpm、通无菌空气转化,用4mol/l硫酸控制ph6.5~7.0。转化24~28h,tlc检测没有l-谷氨酸钠后放罐,溶氧大于50%,转化完毕。经hplc检测,α-酮戊二酸含量126.3g/l,转化率为95.46%。
经后处理得到98.5%的α-酮戊二酸晶体,总收率为80~85%。
综上所述,本发明实施例提供的表达l-谷氨酸氧化酶和过氧化氢酶的重组载体、工程菌及应用与α-酮戊二酸的生产方法获得能高效表的重组载体,通过转化细胞,获得高效表达系统,并沟通过发酵能高效转化谷氨酸盐并转化成α-酮戊二酸,并提高底物谷氨酸盐转化成α-酮戊二酸的效率,提高产品的得率和回收率。
以上所描述的实施例是本发明一部分实施例,而不是全部的实施例。本发明的实施例的详细描述并非旨在限制要求保护的本发明的范围,而是仅仅表示本发明的选定实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
sequencelisting
<110>四川吉晟生物医药有限公司
<120>表达l-谷氨酸氧化酶和过氧化氢酶的重组载体、工程菌及应用与α-酮戊
二酸的生产方法
<170>patentinversion3.5
<210>1
<211>1863
<212>dna
<213>streptomycesafghaniensis
<400>1
atgccgtctgctgaccgtggtgctgacttcgaccgttgcctggctgttgctcgtgctctg60
ctggttctggacaccgacaaccgtccgctggttccgcgttaccagcgtgttctggaaaaa120
ggtctgccggctcagcgtcgtacccgtccgaaaaacgttctggttatcggtgctggtccg180
gctggtctggttaccgcttggctgctgaaaaaagctggtcaccgtgttaccgttctggaa240
gctaacggtaaccgtgctggtggtcgtatcaaaaccttccgtaacggtggtcacgaacac300
gctgaacagccgttcgctgacccgcgtcagtacgctgaagctggtgctatgcgtatcccg360
ggttctcacccgctggttatggaactgatcgaccagttcggtctgaaaaaacgtcgtttc420
cactacgttgacgttgacaacgaaggtcgtccggctggtcgtacctggatccacgttaac480
ggtatccgtatgcgtcgtgctgactacgctcgtgctccgcgtcgtatcaaccgttctttc540
ggtgttccgcgtgctcgttgggacaccccggctgctgctatcctgcgttctgttctggac600
ccggttcgtgacgaattctcttacgttaacggtgacggtaaacgtgttgacaaaccgctg660
ccggaacgtctgcgtggttgggctcgtgttgttcagcgtttcggtgactggtctatgttc720
cgtttcctgaccgaacacgctggtctggacgaacgtaccatcgacctgatcggtaccctg780
gaaaacctgacctctcgtctgccgctgtctttcatccactctttcaccggttcttctctg840
atctctccggacaccccgttctacgaactggaaggtggtaccgctgttctgccggacgct900
ctgctggaacgtgttcgtggtgacgttcgtttcgaccgtcgtgttacccgtatcgaatac960
caccacccggaccgtccgtctccggacaccgaacacgttcgtggtaaaggtccgcacgtt1020
tgggttgacaccgtttctgaaggtcgtgacggtccggttgttcgtgaacagttcaccgct1080
gacgttgctgttgttaccgttccgttctctggtctgcgtcacgttcagatcgctccgccg1140
atgtcttacggtaaacgtcgtgctgtttgcgaactgcactacgactctgctaccaaagtt1200
ctgctggaattctctcgtcgttggtgggaattcgacgaagctgactggaaacgtgaactg1260
caggctatcgctccgggtctgtacgacgcttaccgtaccggtcgtgctgctggtgacggt1320
tctctgctgggtgctcacccgtctgttccgggtggtcacatcaccgctggtcagcgtacc1380
cactacgctgctaaccgtgctatcgctcgtgaccagccggaagctgttgacgttgttggt1440
ggtggttctgtttctgacaacgctaaccgtttcatgttccacccgtctcacccggttccg1500
ggttctgctggtggtgttgttctggcttcttactcttgggctgacgacgctctgcgttgg1560
gactctctggacgacgaagctcgttacccgcacgctctgtgcggtctgcagcaggtttac1620
ggtcagcgtatcgaagttttctactctggtgctggtcgtacccagtcttggctgcgtgac1680
ccgtacgcttacggtgaagcttctgttctgctgccgggtcagcacaccgaactgctgccg1740
gctatcccggttcgtgaaggtccgctgcacttcgctggtgaccacacctctgttaaaccg1800
gcttggatcgaaggtgctgttgaatctgctgttcgtgctgctctggaaatccacaccgct1860
taa1863
<210>2
<211>1476
<212>dna
<213>bacilluspumilus
<400>2
atgaccaactctaaccacaaaaacctgaccaccaaccagggtgttccggttggtgacaac60
cagaactctcgtaccgctggtcaccgtggtccgaccttcctggacgactaccacctgatc120
gaaaaactggctcacttcgaccgtgaacgtatcccggaacgtgttgttcacgctcgtggt180
gctggtgcttacggtgttttcgaagttgaaaactctatggaaaaacacaccaaagctgct240
ttcctgtctgaagaaggtaaacagaccgacgttttcgttcgtttctctaccgttatccac300
ccgaaaggttctccggaaaccctgcgtgacccgcgtggtttcgctgttaaattctacacc360
gaagaaggtaactacgacctggttggtaacaacctgccgatcttcttcatccgtgacgct420
ctgaaattcccggacatggttcactctctgaaaccggacccggttaccaacatccaggac480
ccggaccgttactgggacttcatgaccctgaccccggaatctacccacatgctgacctgg540
ctgttctctgacgaaggtatcccggctaactacgctgaaatgcgtggttctggtgttcac600
accttccgttgggttaacaaatacggtgaaaccaaatacgttaaataccactggcgtccg660
tctgaaggtatccgtaacctgtctatggaagaagctgctgaaatccaggctaacgacttc720
cagcacgctacccgtgacctgtacgaccgtatcgaaaacggtaactacccggcttgggac780
ctgtacgttcagctgatgccgctgtctgactacgacgacctggactacgacccgtgcgac840
ccgaccaaaacctggtctgaagaagactacccgctgcagaaagttggtcgtatgaccctg900
aaccgtaacccggaaaacttcttcgctgaaaccgaacagtctgctttcaccccgtctgct960
ctggttccgggtatcgaagcttctgaagacaaactgctgcagggtcgtctgttctcttac1020
ccggacacccagcgtcaccgtctgggtgctaactacatgcgtatcccggttaactgcccg1080
tacgctccggttcacaacaaccagcaggacggtttcatgaccaccacccgtccgtctggt1140
cacatcaactacgaaccgaaccgttacgacgaccagccgaaagaaaacccgcactacaaa1200
gaatctgaacaggttctgcacggtgaccgtatggttcgtcagaaaatcgaaaaaccgaac1260
gacttcaaacaggctggtgaaaaataccgttcttactctgaagaagaaaaacaggctctg1320
atcaaaaacctgaccgctgacctgaaagacgttaacgacaaaaccaaactgctggctatc1380
tgcaacttctaccgtgctgacgaagactacggtcagcgtctggctgactctctgggtgtt1440
gacatccgttcttacctgcagggttctatgaaataa1476
<210>3
<211>20
<212>dna
<213>人工合成
<400>3
agatctggaaggaatacaaa20
- 还没有人留言评论。精彩留言会获得点赞!