一种用于粘结金属材料和水凝胶的桥连分子及其制备方法和应用与流程
本发明属于有机功能分子合成领域,特别涉及一种用于粘结金属材料和水凝胶的桥连分子及其制备方法和应用。
背景技术:
随着现代医学的发展,人工可植入医疗器械受到业界广泛关注和高度重视。然而,人体组织与器官的高度结构复杂性使得单一结构和组分的人工修复器械无法满足临床中的多样化的实际需求。基于此,结合柔性水凝胶材料与刚性医用合金材料开发一类新型仿生可植入医疗器械成为一种可行的新思路。
目前,尽管人们在技术上仍无法模仿生物体系的复杂结构,但发展具有仿生结构与功能的新一代医用可植入器械仍具有重要的基础研究意义和广阔的临床应用前景。水凝胶类材料泛指一类具有三维网络状交联结构的亲水性高分子,因其具有较高的水含量、可调节的机械性能、较好的生物相容性和可降解性等特点,能够更好的适应人体组织的生化与力学环境;而通过适当的化学修饰,可引入具有生物活性的官能基团,实现对多种细胞行为的调控。因此,水凝胶材料已经广泛用于替代和修复人体中软性组织器官。另一方面,医用金属/合金材料,如钛合金和镁合金等,因其具有高机械强度和抗疲劳特性,可用于支撑、保护以及对硬组织的修复替代等。然而,如何实现水凝胶与刚性医用金属材料之间的高强度粘合,是当前相关领域研究的一个难点和创新点。
另外,实际应用中,如:修复组织和生理环境复杂性或需要临时改变水凝胶在医用金属上的位置、植入材料后发生感染类问题需重新更换等,需要将水凝胶材料和医用金属材料进行方便快捷的分离,因此,如何实现水凝胶与刚性医用金属材料之间的快速分离,也是当前相关领域研究的热点。
技术实现要素:
为了克服上述现有技术的缺点与不足,本发明的首要目的在于提供一种用于粘结金属材料和水凝胶的桥连分子。
本发明另一目的在于提供上述用于粘结金属材料和水凝胶的桥连分子的制备方法。
本发明再一目的在于提供上述用于粘结金属材料和水凝胶的桥连分子在实现水凝胶与金属材料界面高强度粘合中的应用,尤其是在制备结合柔性水凝胶材料与刚性医用金属材料的仿生可植入医疗器械中的应用。
本发明的目的通过下述方案实现:
一种用于粘结金属材料和水凝胶的桥连分子,其结构通式如下所示:
其中,r1表示含有至少一种可以与水凝胶网络交联的官能团的基团,其中与水凝胶网络交联的官能团包括但不限于烯基、炔基、氨基、邻苯二酚、甲基丙烯酸酯、甲基丙烯酰胺、丙烯酸酯、丙烯酰胺、巯基和羟基;r1优选为甲基丙烯酰胺基团、甲基丙烯酸酯基团或者丙烯酸酯基团;
r2表示含有至少一种可与金属材料键合的官能团的基团,其中与金属材料键合的官能团包括但不限于羧酸盐、邻苯二酚、磷酸盐、吡啶类含氮杂环和硫辛酸;优选为羧酸盐或硫辛酸基团;
x1-x2表示动态化学键、简单的连接基团或者含有至少一种刺激性响应基团的连接基团,其中简单的连接基团包括但不限于烷基、烯基、酮基和醚基中的一种或以上连接基团中的至少两种组合;刺激响应基团包括但不限于ph敏感基团、温度敏感基团、氧化还原敏感基团和光响应基团,当桥连分子中含有刺激性响应官能团时,以此类桥连分子作用于金属材料和水凝胶材料的界面时,即可实现两者的高强度粘合以及在外界特定刺激下的应需分离。
优选的,所述的ph敏感基团包括但不限于叔胺、仲胺、磺酸基;所述的温度敏感基团包括但不限于酰胺基和醚;所述的氧化还原敏感基团包括但不限于二硫基、氨基、炔基和烯基;所述的光响应基团包括但不限于叶绿酸、芳香族叠氮基团和邻硝基苯甲醇衍生物。
优选地,所述桥连分子的结构式为以下结构式中的一种:
上述优选的桥连分子的结构式中,与水凝胶网络交联的官能团为甲基丙烯酰胺基团、甲基丙烯酸酯基团或者丙烯酸酯基团;与金属键合的官能团的基团分别为羧酸盐或硫辛酸基团,而桥连分子2中含有氧化还原敏感基团二硫基。
一种上述的用于粘结金属材料和水凝胶的桥连分子的制备方法,包括以下步骤:
当为桥连分子1时,其制备方法包括以下步骤:将12-氨基十二酸和三乙胺溶于有机溶剂中,随后加入甲基丙烯酸酐搅拌反应,反应结束后即获得桥连分子1,反应式如下所示:
桥连分子1的制备方法中:
所述的12-氨基十二酸、甲基丙烯酸酐与三乙胺的用量比为1~10.0g:1~20ml:1~50ml;所述的有机溶剂的用量满足每1~10g的12-氨基十二酸对应加入20~300ml的有机溶剂;
所述的有机溶剂为四氢呋喃、二氯甲烷、氯仿和丙酮中的至少一种;
所述的搅拌反应是指在冰水浴搅拌反应4~36h;搅拌反应完成后,还包括用去离子水萃取除去杂质的步骤。
当为桥连分子2时,其制备方法包括以下步骤:将亚二巯基二乙酸溶于乙酸酐中进行反应,得到环形二硫酸酐,然后将得到的环形二硫酸酐与甲基丙烯酸羟乙酯溶于有机溶剂,搅拌反应,即得到桥连分子2,反应式如下所示:
桥连分子2的制备方法中:
所述的亚二巯基二乙酸与乙酸酐的质量体积比为0.1~2.0g:1.0~20ml;所述的有机溶剂的用量满足每0.2~2.0g的甲基丙烯酸羟乙酯对应加入10~30ml的有机溶剂;所述的将亚二巯基二乙酸溶于乙酸酐中进行反应的温度为0~40℃,反应时间为4~24h;
所述的有机溶剂为氯仿、n,n-二甲基甲酰胺、丙酮、四氢呋喃、异丙醇、n,n-二甲基乙酰胺和二氯甲烷中的至少一种,优选为二氯甲烷或四氢呋喃;
所述的环形二硫酸酐与甲基丙烯酸羟乙酯的用量满足环形二硫酸酐的原料亚二巯基二乙酸与甲基丙烯酸羟乙酯的质量比为0.1~2.0:0.2~2.0;所述的有机溶剂的用量满足每0.2~2.0g的甲基丙烯酸羟乙酯对应加入10~30ml的有机溶剂;
所述的搅拌反应是指在冰水浴环境中,转速为100~1000rpm下搅拌反应12~72h,反应结束后还包括一个采用凝胶色谱柱在石油醚和乙酸乙酯体积比(0.5~4):1混合溶剂作用下进行纯化的步骤。
当为桥连分子3时,其制备方法包括以下步骤:将硫辛酸,4-二甲氨基吡啶,二环己基碳二亚胺和丙烯酸羟乙酯加入到冰浴下的有机溶剂中,搅拌反应,反应结束后即得到桥连分子3,反应式如下所示:
桥连分子3的制备方法中:
所述的硫辛酸、4-二甲氨基吡啶,二环己基碳二亚胺和丙烯酸羟乙酯的用量比为(0.5~20g):(0.05~2g):(1.5~60g):(0.3~12ml);所述的有机溶剂的用量满足每0.5~20g的硫辛酸对应加入10~300ml的有机溶剂;
所述的有机溶剂为四氢呋喃、二氯甲烷、氯仿和丙酮中的至少一种;
所述的搅拌反应是指在冰浴下搅拌反应4~36h,反应结束后还包括一个通过去离子水洗涤纯化的步骤。
本发明的制备方法中所述的搅拌均是为了使原料之间充分的接触,加快反应速度,本领域常规的搅拌速度均可实现,因此并不需要限定搅拌速度,搅拌速度优选为100~1000rpm。
上述的用于粘结金属材料和水凝胶的桥连分子在实现水凝胶与金属材料界面高强度粘合中的应用,尤其是在制备结合柔性水凝胶材料与刚性医用金属材料的仿生可植入医疗器械中的应用。
所述的水凝胶包括各种能基于原位聚合交联机理与r1基团进行交联的水凝胶;所述的金属材料包括各种常用于医用器械的金属及其合金。
所述的用于粘结金属材料和水凝胶的桥连分子在实现水凝胶与金属材料界面高强度粘合中的应用,具体包括以下步骤:
(1)将桥连分子溶于溶剂中配置成桥连分子溶液,然后作用于金属材料的表面得到桥连分子修饰的金属材料表面;
(2)将水凝胶前体涂覆于步骤(1)所得桥连分子修饰的金属材料表面,通过一定条件下的反应即可同时完成水凝胶的固化以及水凝胶通过桥连分子与金属材料界面的高强度粘合。
步骤(1)所述溶剂为丙酮、乙醇、四氢呋喃、二氯甲烷、三氯甲烷和异丙醇中的至少一种。
步骤(1)所述金属材料为镍、镁、钛、铬、铝、钴、金、银、铂金等金属中的一种或者以上金属中的至少两种形成的合金或不锈钢。
步骤(1)所述桥连分子溶液中桥连分子的质量分数为0.1~10wt%;
步骤(1)所述桥连分子溶液的用量满足:每1cm2的金属材料表面对应使用0.001~10ml的桥连分子溶液,优选为每1cm2的金属材料表面对应使用0.001~0.01ml的桥连分子溶液。
步骤(1)所述作用于金属材料的表面是指通过即时喷涂、粘附、浸涂和浸泡中的至少一种将溶液作用于金属材料的表面,作用时间为0.01~24h;
步骤(2)所述水凝胶前体选自以下质量份数的组分a和b中的一种:
组分a:1.5~3.5份聚乙二醇双丙烯酸酯(pegda)、0.1~0.5份海藻酸钠、0.001~0.5份含ca2+化合物、0.027~0.063份光引发剂和5~15份水;
组分b:1~4份丙烯酰胺(aam)、0.1~0.5份海藻酸钠、0.001~0.5份含ca2+化合物、0.02~0.04份n,n′-二甲基双丙烯酰胺(交联剂)、0.025~0.095份过硫酸铵(引发剂)、5~15份水和0.0025~0.01份四甲基乙二胺。
组分a和组分b中所述的含ca2+化合物为硫酸钙、碳酸钙、草酸钙、氯化钙中的至少一种。
步骤(2)所述的反应包括水凝胶前体的交联固化反应以及水凝胶和桥连分子的原位聚合反应,两种反应同时进行。所述的交联固化反应是指在200~400nm紫外光或400~900nm可见光下照射0.01~24h;所述的原位聚合反应是指在室温下反应0.01~24h;
当桥连分子中含有刺激性响应基团时,可在需要时对水凝胶和金属材料界面进行应激分离,具体实施方法如下实例。
当桥联分子中x1-x2含有ph敏感基团时,所述应激分离的方法为在水凝胶与金属材料界面处涂覆酸、碱试剂,改变环境酸碱度,所选ph敏感基团会发生解离;当桥联分子中x1-x2含有温度敏感基团时,所述应激分离的方法为在0~100℃间改变温度,进而破坏分子结构;当桥联分子中x1-x2含有氧化还原敏感基团时,所述应激分离的方法为涂覆氧化型谷胱甘肽、还原性谷胱甘肽和二硫苏糖醇中的至少一种,或其他具有相似还原效果的试剂;优选的谷胱甘肽或二硫苏糖醇的用量满足1cm2的粘合界面使用0.005~5g。
本发明中未标明温度的都是在室温下操作,所述的室温为5~35℃。
本发明的机理为:
本发明从形成水凝胶聚合物网络的官能团化学结构与金属材料的自身属性出发,在桥连分子中引入分别可与金属表面和水凝胶作用的官能团,设计其分子端基的化学交联位点(如桥连分子端基双键与水凝胶共聚交联、端基羧基与金属配位作用)。进一步的,在其分子内部引入响应性基团,即可在适当的外界信号刺激下,实现桥连分子的应需裂解。以此类桥连分子为“分子界面纽带”,可通过原位喷涂、浸涂等即时高效的表面修饰方法在多种金属表面接入化学锚点,并通过原位聚合反应,使得桥连分子的两个端基官能团可分别与水凝胶和金属表面进行键合,达到二者之间的高强度粘合效果。当使用含有响应性基团的桥连分子时,则可以在实现高强度粘合的基础之上,进一步通过外部刺激响应,快速断开桥连分子,进而使水凝胶与金属达到应需分离的效果。
本发明相对于现有技术,具有如下的优点及有益效果:
本发明中桥连分子的合成简单、重复性好、可以放大制备,而整个表面处理和粘合过程便捷、高效、温和,具有较好的生物安全性,有望广泛应用于生物医学的相关领域,具有较高的临床应用价值。
附图说明
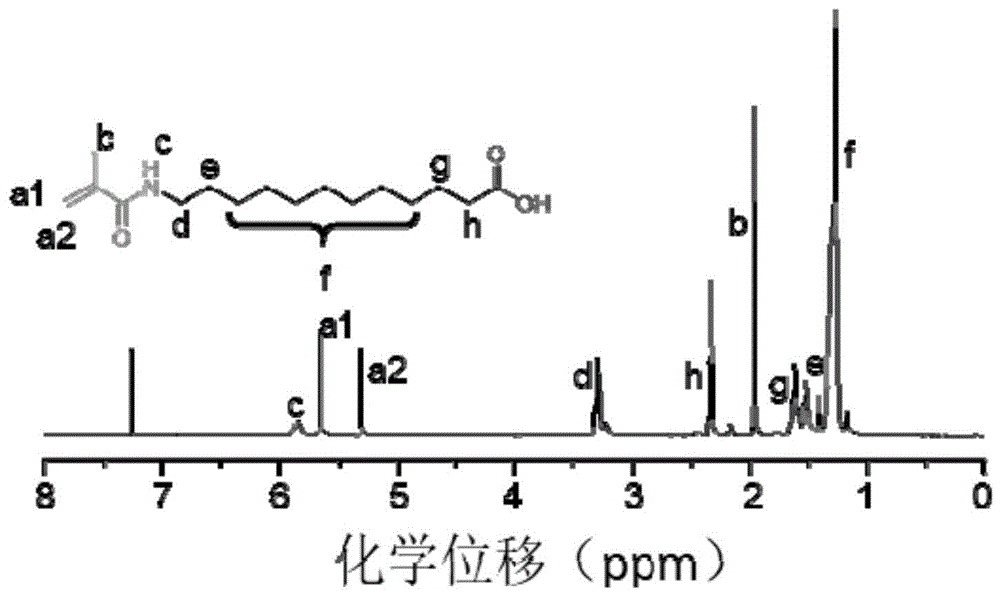
图1为实施例1制备的桥连分子1的1hnmr谱图。
图2为实施例3制备的桥连分子2的1hnmr谱图。
图3为实施例7制备的桥连分子3的1hnmr谱图。
图4为空白铝表面与水凝胶的粘合界面(a)和实施例9制备的桥连分子1修饰铝表面与水凝胶的粘合界面(b)的宏观图。
图5为本发明中桥连分子对金属材料基板和水凝胶进行粘合和利用谷胱甘肽分离界面的过程示意图。
图6为空白铝表面与水凝胶的粘合界面(a)和实施例12制备的桥连分子2修饰铝表面与水凝胶的粘合界面(b)宏观图。
图7为实施例12中将谷胱甘肽作用于界面粘合处后水凝胶与金属分离图。
图8为实施例13制备的桥连分子2修饰不锈钢表面与水凝胶的粘合界面和空白不锈钢表面与水凝胶的粘合界面剥离曲线图。
图9为实施例13中谷胱甘肽处理前(a)后(b)水凝胶与基板表面分离过程图。
图10为实施例14中将谷胱甘肽作用于界面粘合处前后的界面剥离强度曲线图。
具体实施方式
下面结合实施例和附图对本发明作进一步详细的描述,但本发明的实施方式不限于此。
实施例中所用试剂如无特殊说明均可从市场常规购得。实施例中未注明温度的均指在室温下进行。
实施例1
将1g12-氨基十二酸和1ml三乙胺溶于20ml四氢呋喃中,随后加入1ml甲基丙烯酸酐,冰水浴中机械搅拌(转速为1000rpm)4h。随后采用1l去离子水萃取除去杂质,获得桥连分子1。
本实施例所制备的桥连分子的核磁共振氢谱图(1hnmr)如图1所示,从图1可以看出本发明成功合成了桥连分子1。
实施例2
将10g12-氨基十二酸和50ml三乙胺溶于300ml四氢呋喃中,随后加入20ml甲基丙烯酸酐,冰水浴中机械搅拌(转速为300rpm)36h。随后采用10l去离子水萃取除去杂质,获得桥连分子1。
本实施例所制备的桥连分子的核磁共振氢谱图(1hnmr)与图1一致,说明本发明成功合成了桥连分子1。
实施例3
将0.1g亚二巯基二乙酸溶于1.0ml的乙酸酐中,0℃条件下反应24小时得到环形二硫酸酐,随后加入0.2g的甲基丙烯酸羟乙酯和10ml二氯甲烷,在冰水浴环境下,机械搅拌(转速为100rpm)72h,最后采用凝胶色谱柱在石油醚和乙酸乙酯体积比4:1混合溶剂作用下纯化得到桥连分子2。
本实施例所制备的桥连分子2的核磁共振氢谱图(1hnmr)如图2所示,从图2可以看出本发明成功合成了桥连分子2。
实施例4
将2.0g亚二巯基二乙酸溶于20ml的乙酸酐中,40℃条件下反应4小时得到环形二硫酸酐,随后加入2.0g的甲基丙烯酸羟乙酯和30ml二氯甲烷,在冰水浴环境下,机械搅拌(转速为1000rpm)12h,最后采用凝胶色谱柱在石油醚和乙酸乙酯体积比0.5:1混合溶剂作用下纯化得到桥连分子2。
本实施例所制备的桥连分子2的核磁共振氢谱图(1hnmr)与图2一致,说明本发明成功合成了桥连分子2。
实施例5
将1.82g亚二巯基二乙酸溶于15ml的乙酸酐中,25℃条件下反应18小时得到环形二硫酸酐,随后加入1.6g的甲基丙烯酸羟乙酯和25ml二氯甲烷,在冰水浴环境下,机械搅拌(转速为600rpm)18h,最后采用凝胶色谱柱在石油醚和乙酸乙酯体积比3:1混合溶剂作用下纯化得到桥连分子2。
本实施例所制备的桥连分子2的核磁共振氢谱图(1hnmr)与图2一致,说明本发明成功合成了桥连分子2。
实施例6
将1.5g亚二巯基二乙酸溶于12ml的乙酸酐中,30℃条件下反应12小时得到环形二硫酸酐,随后加入1.3g的甲基丙烯酸羟乙酯和20ml二氯甲烷,在冰水浴环境下,机械搅拌(转速为300rpm)20h,最后采用凝胶色谱柱在石油醚和乙酸乙酯体积比1.5:1混合溶剂作用下纯化得到桥连分子2。
本实施例所制备的桥连分子2的核磁共振氢谱图(1hnmr)与图2一致,说明本发明成功合成了桥连分子2。
实施例7
将0.5g的硫辛酸,0.05g的4-二甲氨基吡啶,1.5g二环己基碳二亚胺和0.3ml丙烯酸羟乙酯加入到冰浴环境中的四氢呋喃(10ml)中,机械搅拌(转速为700rpm)4h完成反应。随后使用1l离子水进行清洗,即得桥连分子3。
本实施例所制备的桥连分子3的核磁共振氢谱图(1hnmr)如图3所示,从图3可以看出本发明成功合成了桥连分子3。
实施例8
将20g的硫辛酸,2g的4-二甲氨基吡啶,60g二环己基碳二亚胺和12ml丙烯酸羟乙酯加入到冰浴环境中的二氯甲烷(300ml)中,机械搅拌(转速为100rpm)36h完成反应。随后使用10l离子水进行清洗,即得桥连分子3。
本实施例所制备的桥连分子3的核磁共振氢谱图(1hnmr)与图3一致,说明本发明成功合成了桥连分子3。
实施例9
(1)将实施例1制备得到的桥连分子1溶于无水乙醇,配制成浓度为1wt%的桥连分子溶液,喷涂于金属铝的表面(10ml/cm2),反应1h得到桥连分子1修饰的铝表面;
(2)取1.5gpegda(mn=20000),0.10g天然高分子海藻酸钠和27mg光引发剂irgacure2959溶于5ml的去离子水中,随后加入68mg硫酸钙混合均匀制得水凝胶前体;
(3)以步骤(1)中得到的桥连分子1修饰的铝表面作为基底,将步骤(2)所得水凝胶前体涂覆在桥连分子1修饰的铝表面,反应4h完成水凝胶-铝的界面粘合,其中,在200nm紫外光交联固化1h完成水凝胶的制备,同时通过原位聚合反应4h完成水凝胶-铝的界面粘合。
作为对照,在空白铝表面上采用步骤(3)相同的方法进行水凝胶的交联固化,完成水凝胶-铝的界面粘合。
图4为空白铝表面与水凝胶的粘合界面(a)和实施例9制备的桥连分子1修饰铝表面与水凝胶的粘合界面(b)的宏观图。从图4中可以看出,由于桥连分子1的存在,水凝胶与金属界面发生了超强粘合作用,当进行剥离时可以看到典型的撕裂现象。
实施例10
(1)将实施例2制备得到的桥连分子1溶于乙醇,配制成浓度为1wt%的桥连分子溶液,浸涂于金属镍的表面(1ml/cm2),反应0.5h,得到桥连分子1修饰的镍表面;
(2)取4.0gaam单体、0.50g天然高分子海藻酸钠、10mg硫酸钙、40mg的n,n′-二甲基双丙烯酰胺(交联剂)、95mg过硫酸铵(引发剂)、15ml去离子水(溶剂)和10mg四甲基乙二胺混合均匀得到水凝胶前体;
(3)以步骤(1)制备的桥连分子1修饰的镍表面为基底,将步骤(2)所得水凝胶前体涂覆在桥连分子1修饰的镍表面,反应18h完成水凝胶-镍的界面粘合,其中,400nm可见光交联固化15h完成水凝胶制备,同时通过原位聚合反应18h完成水凝胶-镍的界面粘合。
实施例11
(1)将实施例3制备得到的桥连分子2溶于无水乙醇,配制成浓度为0.1wt%的桥连分子溶液,喷涂于金属钛的表面(10ml/cm2),反应0.01h得到桥连分子2修饰的钛表面;
(2)取1.5gpegda(mn=20000),0.10g天然高分子海藻酸钠和27mg光引发剂irgacure2959溶于5ml的去离子水中,随后加入68mg硫酸钙混合均匀制得水凝胶前体;
(3)以步骤(1)中得到的桥连分子2修饰的钛表面作为基底,将步骤(2)所得水凝胶前体涂覆在桥连分子修饰的钛表面,反应4h完成水凝胶-钛的界面粘合,其中,在200nm紫外光交联固化0.5h完成水凝胶的制备,同时通过原位聚合反应4h完成水凝胶-钛的界面粘合。
将谷胱甘肽作用于界面粘合处,用量为0.005g/cm2,检测水凝胶与桥连分子修饰的钛表面的分离过程,本发明中桥连分子对金属基板和水凝胶进行粘合和利用谷胱甘肽分离界面的过程示意图如图5所示。
实施例12
(1)将实施例4制备得到的桥连分子2溶于四氢呋喃中,配制成浓度为10wt%的桥连分子溶液,喷涂于金属铝的表面(0.001ml/cm2),反应24h得到桥连分子2修饰的铝表面;
(2)取3.5gpegda(mn=20000),0.10g天然高分子海藻酸钠和63mg光引发剂irgacure2959溶于15ml的去离子水中,随后加入340mg硫酸钙混合均匀制得水凝胶前体;
(3)以步骤(1)中得到的桥连分子2修饰的铝表面为基底,将步骤(2)所得水凝胶前体涂覆在桥连分子修饰的铝表面,反应24h完成水凝胶-铝的界面粘合,其中,在400nm紫外光交联固化24h完成水凝胶的制备,同时通过原位聚合反应24h完成水凝胶-铝的界面粘合。
作为对照,在空白铝表面上采用步骤(3)相同的方法进行水凝胶的交联固化,完成水凝胶-铝的界面粘合。
检测基板在桥连分子2修饰前后二者界面的粘合情况,图6为空白铝表面与水凝胶的粘合界面(a)和实施例12制备的桥连分子2修饰铝表面与水凝胶的粘合界面(b)宏观图。由图6可知,由于桥连分子2的存在,水凝胶与金属界面发生了超强粘合作用,当进行剥离时可以看到典型的撕裂现象。
将谷胱甘肽作用于界面粘合处,用量为5g/cm2,图7为实施例12中将谷胱甘肽作用于界面粘合处后水凝胶与金属分离图。从图中可以看出水凝胶与金属发生分离,谷胱甘肽破坏桥连分子2中的双硫键,进而使桥连分子2断开。
实施例13
(1)将实施例5制备得到的桥连分子2溶于无水乙醇中,配制成浓度1wt%的桥连分子2溶液,浸润于不锈钢金属的表面(0.01ml/cm2),反应0.1h得到桥连分子2修饰的不锈钢表面;
(2)将1.0g的aam单体、0.15g天然高分子海藻酸钠、5mg硫酸钙、20mg的n,n′-二甲基双丙烯酰胺(交联剂)、25mg过硫酸铵(引发剂)、5ml去离子水(溶剂)和2.5mg四甲基乙二胺混合制得水凝胶前体;
(3)以步骤(1)制备的桥连分子2修饰的不锈钢表面为基底,将步骤(2)所得水凝胶前体涂覆在桥连分子2修饰的不锈钢表面,反应18h完成水凝胶-不锈钢的界面粘合,其中,在900nm可见光交联固化1h完成水凝胶制备,同时通过原位聚合反应18h完成水凝胶-不锈钢的界面粘合。
作为对照,在空白不锈钢表面上采用步骤(3)相同的方法进行水凝胶的交联固化,完成水凝胶-不锈钢的界面粘合。
通过剥离强度试验机定量测试水凝胶-不锈钢在桥连分子2修饰前后的界面粘合强度。图8为实施例13制备的桥连分子2修饰不锈钢表面与水凝胶的粘合界面和空白不锈钢表面与水凝胶的粘合界面剥离曲线图。结果显示,经桥连分子2修饰的不锈钢-水凝胶界面结合强度远高于空白不锈钢-水凝胶,说明本发明制备的桥连分子2可以实现水凝胶和刚性医用金属材料之间的高强度粘合。
可将谷胱甘肽作用于桥连分子2修饰的不锈钢表面与水凝胶的界面粘合处,用量为0.5g/cm2,考察水凝胶与桥连分子2修饰的不锈钢表面的分离过程。谷胱甘肽处理前(a)后(b)水凝胶与基板表面分离过程图如图9所示。
实施例14
(1)将实施例6制备得到的桥连分子2溶于二氯甲烷,配制成浓度为1wt%的桥连分子2溶液,浸涂于金属镍的表面(0.01ml/cm2),反应0.5h,得到桥连分子2修饰的镍表面;
(2)取4.0gaam单体、0.50g天然高分子海藻酸钠、10mg硫酸钙、40mg的n,n′-二甲基双丙烯酰胺(交联剂)、95mg过硫酸铵(引发剂)、15ml去离子水(溶剂)和10mg四甲基乙二胺混合均匀得到水凝胶前体;
(3)以步骤(1)制备的桥连分子2修饰的镍表面为基底,将步骤(2)所得水凝胶前体涂覆在桥连分子修饰的镍表面,反应18h完成水凝胶-镍的界面粘合,其中,400nm可见光交联固化15h完成水凝胶制备,同时通过原位聚合反应18h完成水凝胶-镍的界面粘合。
将谷胱甘肽作用于界面粘合处,用量为0.25g/cm2,采用剥离强度试验机定量测试,加入谷胱甘肽前后剥离强度的变化。图10为实施例14中将谷胱甘肽作用于界面粘合处前后的界面剥离强度曲线图。可以看出由于谷胱甘肽破坏了桥连分子2结构使粘合作用消失,其粘合强度显著降低。
实施例15
(1)将实施例5制备得到的桥连分子2溶于异丙醇,配制成浓度为1wt%的桥连分子2溶液,将金属钴浸入溶液中(0.01ml/cm2)反应0.1h,得到桥连分子2修饰的钴表面;
(2)取2.5gpegda(mn=20000),0.15g天然高分子海藻酸钠和30mg光引发剂irgacure2959溶于10ml的去离子水中,随后加入80mg硫酸钙混合均匀制得水凝胶前体;
(3)以步骤(1)制备的桥连分子2修饰的钴表面为基底,将步骤(2)所得水凝胶前体涂覆在桥连分子2修饰的钴表面,反应24h完成水凝胶-钴的界面粘合,其中,在200nm紫外光交联固化4h完成水凝胶的制备,同时通过原位聚合反应24h完成水凝胶-钴的界面粘合。
将二硫苏糖醇作用于界面粘合处,用量为0.1g/cm2,同样可以观察到水凝胶与金属材料基板的分离。
实施例16
(1)将实施例4制备得到的桥连分子2溶于丙酮,配制成浓度为0.5wt%的桥连分子2溶液,喷涂于金属铬的表面(0.01ml/cm2)反应0.1h,得到桥连分子2修饰的铬表面;
(2)取2.5gaam单体、0.20g天然高分子海藻酸钠、6mg硫酸钙、25mg的n,n′-二甲基双丙烯酰胺(交联剂)、80mg过硫酸铵(引发剂)、12.5ml去离子水(溶剂)和7.5mg四甲基乙二胺混合均匀得到水凝胶前体;
(3)以步骤(1)制备的桥连分子2修饰的铬表面为基底,将步骤(2)所得水凝胶前体涂覆在桥连分子2修饰的铬表面,反应18h完成水凝胶-铬的界面粘合,其中,在450nm可见光交联固化24h完成水凝胶的制备,同时通过原位聚合反应24h完成水凝胶-铬的界面粘合。
将二硫苏糖醇作用于界面粘合处,用量为2g/cm2,同样可以观察到水凝胶与金属基板材料的分离。
实施例17
(1)将实施例7制备得到的桥连分子3溶于四氢呋喃,配制成浓度为0.1wt%的桥连分子溶液,浸涂于金属铜的表面(1ml/cm2),反应0.8h,得到桥连分子3修饰的铜表面;
(2)取4.0gaam单体、0.50g天然高分子海藻酸钠、10mg硫酸钙、40mg的n,n′-二甲基双丙烯酰胺(交联剂)、95mg过硫酸铵(引发剂)、15ml去离子水(溶剂)和10mg四甲基乙二胺混合均匀得到水凝胶前体;
(3)以步骤(1)制备的桥连分子3修饰的铜表面为基底,将步骤(2)所得水凝胶前体涂覆在桥连分子3修饰的铜表面,反应20h完成水凝胶-铜的界面粘合,其中,400nm可见光交联固化15h完成水凝胶制备,同时通过原位聚合反应20h完成水凝胶-铜的界面粘合。当进行剥离时,可看到典型的撕裂现象。
实施例18
(1)将实施例8制备得到的桥连分子3溶于乙醇,配制成浓度为1wt%的桥连分子溶液,浸涂于金属金的表面(5ml/cm2),反应1h,得到桥连分子3修饰的金表面;
(2)取4.0gaam单体、0.50g天然高分子海藻酸钠、10mg硫酸钙、40mg的n,n′-二甲基双丙烯酰胺(交联剂)、95mg过硫酸铵(引发剂)、15ml去离子水(溶剂)和10mg四甲基乙二胺混合均匀得到水凝胶前体;
(3)以步骤(1)制备的桥连分子3修饰的金表面为基底,将步骤(2)所得水凝胶前体涂覆在桥连分子3修饰的金表面,反应18h完成水凝胶-金的界面粘合,其中200nm紫外光交联固化18h完成水凝胶制备,同时通过原位聚合反应24h完成水凝胶-镍的界面粘合。当进行剥离时,可看到典型的撕裂现象。
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!