一种益母草多糖的制备方法及其用途与流程
本发明涉及了一种益母草均一多糖-lap-1、其制备方法及用途,属于医药技术领域。
背景技术:
益母草为唇形科植物益母草leonurusartemisia(laur.)s.y.huf的新鲜或干燥地上全草,始载于《神农本草经》,具有活血调经、利尿消肿、清热解毒的功效,为临床上治疗月经不调、痛经、经闭、恶露不尽、水肿尿少、急性肾炎水肿的常用中药,由于疗效确切,被民间称为“血家圣药”、“经产良药”。益母草在国内分布范围广,易于栽培,已开发出多种剂型,涉及药品、保健品、食品、化妆品等行业,包括益母草片、复方益母草胶囊、益母草颗粒、益母草注射液等多种产品。益母草药材的药效物质基础研究前期主要集中在已经发现的小分子化学成分上,如益母草碱,水苏碱,前益母草素等,但已有的研究成果尚未全面阐释益母草多种活性作用的科学内涵。目前有学者开始关注益母草中的大分子类物质,如多糖类成分,但是,也仅限于提取分离益母草水溶性粗多糖,且提取分离得到的水溶性粗多糖的组成复杂,多糖含量较低,难以体现益母草多糖的药理作用。
近年来,多种新的提取技术被应用于多糖的提取制备工艺研究中,有效地提高了其提取效率。已有研究表明超声波在多糖提取过程中利用其空化作用和机械效应破坏生物细胞壁,加速浸提物的溶出,能提高多糖的得率。
益母草具有很好的活血祛瘀作用。已有文献报道,益母草水提物可降低血浆抗凝血酶iii的活性、减少血浆凝血酶原片段1+2的含量,扩张肠系膜一级微静脉、一级微动脉口径,改善微血流的流态,降低流态的积分值,明显增强纤维蛋白溶解活性。
抗凝血药是通过影响凝血过程中的某些凝血因子阻止凝血过程的药物,可用于防治血管内栓塞或血栓形成的疾病,预防中风或其它血栓性疾病。正常人由于有完整的血液凝固系统和抗凝及纤溶系统,所以血液在血管内既不凝固也不出血,始终自由流动完成其功能,但当机体处于高凝状态或抗凝及纤溶减弱时,则发生血栓栓塞性疾病。血栓的形成常常会引起血管系统的局部血液凝固,通常导致严重损害健康的相关疾病,如心脏病发作、中风。引起血栓形成的危险因素由异常高脂血症、高血糖症、血浆纤维蛋白原升高、血压升高和癌症等,这些血栓性疾病已成为死亡的主要原因,因此迫切需要安全、有效的抗凝血药物。
本发明采用超声波辅助提取法和多种柱层析分离、纯化方法,从益母草药材中获得了纯度较高的均一多糖-lap-1,采用色谱学,光谱学,波谱学等技术和方法,全面解析了lap-1的结构特征,在此基础上,进一步探讨了lap-1的抗凝血活性,揭示了lap-1是益母草药材发挥活血祛瘀作用的有效成分之一,可以应用于与凝血相关及其他疾病的治疗,迄今为止尚未发现有关该均一多糖的分离制备及用途的文献报道。
技术实现要素:
本发明要解决的技术问题是如何从益母草水提物中超声提取获得益母草多糖粗品的方法以及从益母草多糖粗品中分离纯化得到益母草均一多糖lap-1的方法。
本发明要解决的技术问题还包括研究并阐述益母草均一多糖lap-1的结构特征,及研究其在抗凝血药物中的应用。
所述的获得益母草多糖粗品的方法,其特征是,包括以下步骤:
第一步,将益母草全草干燥品粉碎后加入乙醇,回流脱脂,将脱脂后的原料加入去离子水,加热超声提取,将提取液浓缩,加入石油醚完全去除脂质后,加入sevage试剂,完全去除蛋白,乙醇沉淀,真空干燥得到本发明所述的益母草水提物。
第二步,将益母草水提物溶解于去离子水,加入大孔树脂,去除溶液中的色素和蛋白质,保留脱色液,将脱色液过滤,然后浓缩,加入乙醇沉淀出益母草多糖,真空干燥后得到本发明的益母草多糖粗品(lap),其多糖含量占总固体重量的50%以上。
所述的分离纯化得到益母草均一多糖的方法,其特征是,包括以下步骤:
第一步,将上述方法获得的益母草多糖粗品(lap)溶解于去离子水,用离子交换柱进行分离纯化,以去离子水洗脱,用硫酸苯酚比色法跟踪检测。
第二步,去离子水洗脱后,以氯化钠溶液进行洗脱,用硫酸苯酚比色法跟踪检测,收集均一组分,再采用分子筛柱层析,以去离子水洗脱,用硫酸苯酚比色法跟踪检测,收集益母草多糖均一组分,冷冻干燥,即得到本发明所述的益母草均一多糖(lap-1),其多糖含量占总固体的90%以上。
利用上述的提取分离纯化方法制备得到的益母草均一多糖(lap-1)及其结构特征。
上述的抗凝血益母草多糖在制备抗凝血药物方面的应用。
所述方法中,超声提取是在超声仪中完成,超声功率为100~250w。
所述方法中,超声提取温度在20~70℃。
所述方法中,超声提取时间为20~70分钟。
所述方法中,提取所用的料液比为20~70。
所述方法中,大孔树脂为阴离子交换树脂。
所述方法中,大孔树脂脱色时间为1~3小时。
所述方法中,离子交换树脂为二乙胺基乙基纤维素(deae-52)。
所述方法中,分子筛凝胶填料为sephacryls-400。
所述的本发明的多糖在制备抗凝血药物方面的应用,其特征是,将上述方法获得的益母草多糖粗品(lap),益母草均一多糖(lap-1)应用于人体血浆中对活化部分凝血活酶时间(aptt),对凝血酶原时间(pt),对凝血酶时间(tt)均具有一定的抗凝血作用,因此可应用于制备抗凝血药物。
所述方法中,益母草多糖粗品(lap)多糖含量在50%以上。
所述方法中,益母草均一多糖(lap-1)多糖含量在90%以上,酸性糖含量在20%以上,分子量为10kda左右。
所述方法中,益母草均一多糖(lap-1)含有甘露糖,核糖,鼠李糖,葡萄糖醛酸,半乳糖醛酸,葡萄糖,半乳糖,木糖,阿拉伯糖,岩藻糖,摩尔比为7.93∶1.04∶6.58∶1∶9.08∶5.08∶4.29∶6.88∶5.45∶3.15。主要糖苷键键型有→4,6-β-甘露糖-(1→,α-galpa-(1→,→4-α-半乳糖醛酸-(1→,→4-α-葡萄糖-(1→,→4,6-α-葡萄糖-(1→,→4,6-α-半乳糖-(1→,t-β-半乳糖,α-葡萄糖醛酸-(1→,β-葡萄糖-(1→,α-阿拉伯糖-(1→,→3-α-阿拉伯糖-(1→,→5-α-阿拉伯糖-(1→,α-鼠李糖-(1→,→2-α-鼠李糖-(1→,→2,4-α-鼠李糖-(1→。
有益效果
本发明采用超声提取分离方法从益母草中分离得到益母草粗多糖(lap),并对该粗多糖进行了纯化获得益母草均一多糖(lap-1),对益母草均一多糖(lap-1)的结构进行了解析;并对益母草粗多糖(lap),益母草均一多糖(lap-1)的体外凝血效果进行考察,结果表明两种多糖均具有良好的凝血效果,且益母草均一多糖(lap-1)优于益母草粗多糖(lap),两者均可用于制备抗凝血药物的用途;通过以上技术进行有效集成,显著提高了益母草粗多糖(lap)和益母草均一多糖(lap-1)的提取率、缩短了提取时间,降低了提取成本,促进了益母草资源的综合利用,由于益母草多糖具有可食性,用于制备药物安全无毒害,因此可以将益母草均一多糖(lap-1)应用于制备抗凝血的药物或者保健食品,拥有广阔的应用前景,具有良好的社会效益和经济效益。
附图说明
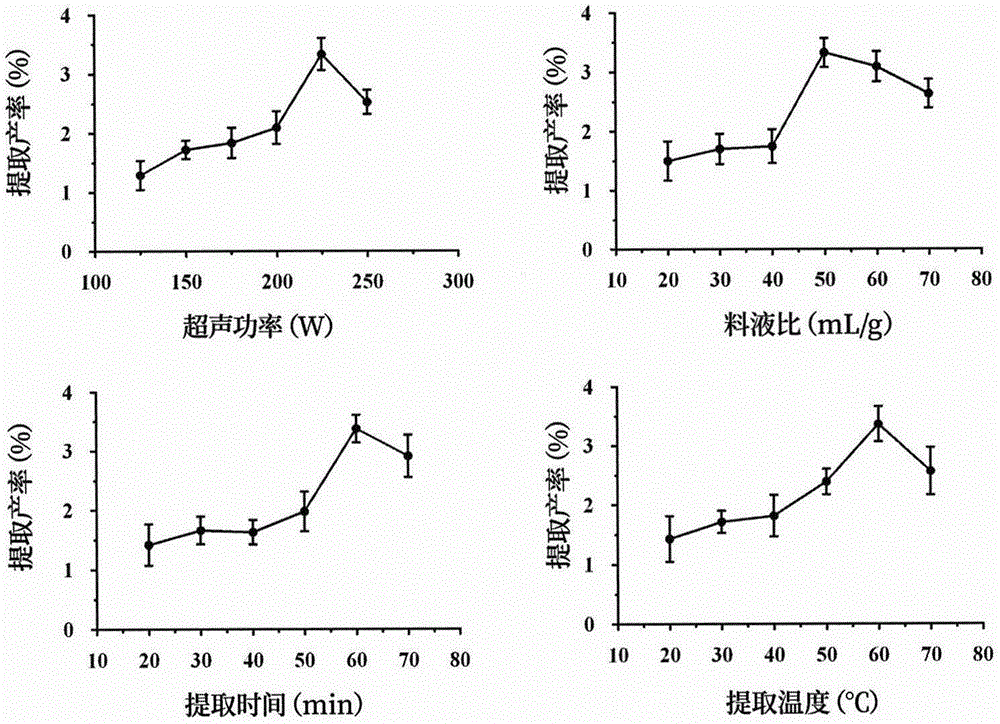
图1为本发明中益母草多糖粗品(lap)提取条件单因素分析。
图2为本发明中益母草多糖粗品(lap)提取条件响应面分析。
图3为本发明中益母草均一多糖(lap-1)高效分子排阻色谱。
图4为本发明中益母草均一多糖(lap-1)的单糖组成图谱。
图5为本发明中益母草均一多糖(lap-1)的紫外-可见扫描光谱。
图6为本发明中益母草均一多糖(lap-1)的红外光谱。
图7为本发明中益母草均一多糖(lap-1)的核磁共振谱图。
具体实施方式
下面结合实施例对本发明作详细的说明,本发明的优点和特点将会随着描述而更为清楚。但这些实施例仅是范例性的,并不对本发明的范围构成任何限制。本领域技术人员应该理解的是,在不偏离本发明的精神和范围下可以对本发明技术方案的细节和形式进行修改或替换,但这些修改和替换均落入本发明的保护范围内。说明书及实施例中采用的药材、填料、化学试剂等,如未特殊说明均按常规实验条件进行操作,或按供应商提供的说明进行操作。
实施例1:益母草粗多糖粗品(lap)的制备方法
称取粉碎后过80目筛的益母草全草药材10g于提取容器中,加入5倍体积乙醇,回流脱脂3小时,6层纱布除去上清后将样品烘干。将烘干后样品至于反应容器中,加入去离子水200~700ml,辅以超声波法提取。所述超声波法提取具体为:按料液比20~70ml/g加入去离子水,提取时间为20~70min,提取温度为20~70℃,超声功率为100~250w;提取结束后过滤得提取液,将提取液浓缩,向多糖溶液中加入无水石油醚搅拌震荡使之成乳状,静置使溶液上下分层为止,去除石油醚层;重复以上操作3-4次,直到石油醚层无油状小液滴出现,表明脱脂完成。加入sevage试剂于脱脂后的多糖溶液,充分溶解放置于摇床内振荡后离心,去除变性蛋白层,取上清液;将上清液重复上述步骤重复处理3-5次,直到没有白色的胶状物质产生,即无变性的蛋白质产生,得到脱蛋白的多糖溶液;加入4倍乙醇沉淀,4℃放置24小时,离心除去上清液,以无水乙醇、丙酮和乙醚洗涤3次,真空干燥得本发明产物益母草水提物。取益母草水提物2g于容器中,充分溶解于40ml去离子水,加入d301-g大孔树脂脱色和除蛋白质,间或搅拌1小时,溶液过滤后浓缩至10ml,加入10ml无水乙醇沉淀,4℃放置24小时。离心除去上清。以无水乙醇洗涤3次,真空干燥得到益母草多糖粗品(lap)。
本发明的工艺参数由单因素实验(表1、图1)及响应面实验(表2、图2、图3)确定,结果见表2、表3。根据上述结果分析得出,影响益母草多糖粗品(lap)提取产率的因素,主次顺序为料液比>超声功率>提取温度>提取时间。即料液比为53ml/g,超声功率为240w,提取温度为60℃,提取时间为60min时,益母草粗多糖粗品(lap)产率最高。响应面预测产率为3.36%,验证试验中益母草粗多糖粗品(lap)产率为3.45±0.27%。
表1响应面实验因素水平
表2益母草多糖粗品(lap)的响应面优化产率分析
表3响应面法实验因素及结果分析
a表明差异具有显著性(p<0.01)
b表明差异具有显著性(p<0.05).
c表明差异不具有显著性
实施例2:益母草均一多糖(lap-1)的制备方法
取益母草多糖粗品(lap)200mg,充分溶解于去离子水,上已平衡好的deae-52离子交换柱,规格为(2.6×30cm),平衡液为去离子水,上样体积为10ml,先以300ml去离子水洗脱,再以0-2mol/l的nacl溶液洗脱,分部收集,硫酸苯酚法跟踪检测,合并相同组分。离子交换柱分离所得益母草多糖水洗组分上sephacryls-400分子筛柱层析,以去离子水洗脱。柱规格为(1.0×100cm),分部收集,硫酸苯酚法跟踪检测,合并相同组分。冷冻干燥,得到均一益母草均一多糖(lap-1)。
实施例3:益母草均一多糖(lap-1)的理化性质测定
1.多糖含量测定
精确称取干燥至恒重待测样品适量,配制成0.1mg/ml多糖溶液,采用硫酸苯酚法和间羟联苯法,在490nm和525nm处,分光光度法测定总糖和酸性糖含量,以葡萄糖计算益母草多糖粗品(lap)总糖含量为52.23±2.89%,酸性糖含量为9.67±1.12%,益母草均一多糖(lap-1)总糖含量为92.11±4.97%,酸性糖含量为26.50±2.09%。
2.蛋白含量测定
精密称取干燥至恒重待测样品10mg,配制成1mg/ml多糖溶液后进行测定,采用考马斯亮蓝法,在595nm处,分光光度法测定总蛋白含量,以牛血清白蛋白计算益母草多糖粗品(lap)总蛋白含量为2.18±0.56%,益母草均一多糖(lap-1)未检测到蛋白。
3.ph测定
参照中国药典2015版附录viigph测定法操作规程进行操作,益母草均一多糖(lap-1)ph为6.3±0.1。
4.元素分析
取益母草均一多糖(lap-1)适量,于有机元素分析仪上进行c、h、n元素分析,其元素组成比为28.51%/4.9%/2.1%(c/h/n)。
5.旋光度分析
将待测样品干燥至恒重后,配制成1mg/ml溶液,用旋光仪测定旋光度,由公式[α]dt=100α/lc计算比旋度。其中c:溶液浓度(g/100ml);α:旋光度;l:玻管长度(dm)。益母草均一多糖(lap-1)旋光度为+19°。
6.纯度及相对分子质量分析
高效液相色谱法:以shodexsugarks-805(8mmid×300mm)为高效液相色谱柱,采用示差折光检测器。色谱条件为:h2o为流动相,流速1ml/min,样品浓度为1mg/ml每次进样35μl,检测时间30min。依次以标准分子量多糖dextrant-5、t-10、t-20、t40、t70绘制保留时间与各分子量对数关系标准曲线,再测样品的保留时间,根据标准曲线求得样品的分子量。结果见图3,lap-1的分子量为12.41kda且为对称的均一峰。
7.单糖组成分析
称取5mglap-1于安瓿瓶中,加入1ml2m三氟乙酸溶解,用酒精喷灯封口,于100℃沸水浴中水解8h。水解产物转移至蒸发皿中,在80℃条件下蒸干,用1ml甲醇洗涤3次,去除多余tfa,冷却后加入1ml双蒸水溶解水解样品。将上述水解液8000rpm离心5min后取100μl加入100μl0.6m氢氧化钠溶液,涡旋混匀后加入200μl0.5mol/lpmp甲醇溶液,混匀后置于70℃烘箱中反应100min。反应结束后取出,冷却至室温,再加入200μl0.3m盐酸中和氢氧化钠,并用双蒸水补足至1ml。用1ml氯仿萃取去除过量的pmp,涡旋后静置15min,吸取上清再加入1ml氯仿,如此重复3次。最后吸取200μl水相,8000rpm离心5min,上清则作为样品溶液。结果如图4所示,lap-1由甘露糖,葡萄糖胺,核糖,鼠李糖,葡萄糖醛酸,半乳糖醛酸,葡萄糖,半乳糖,木糖,阿拉伯糖,岩藻糖组成,其摩尔比为7.93∶1.04∶6.58∶1∶9.08∶5.08∶4.29∶6.88∶5.45∶3.15。
9.紫外光谱分析
取适量lap-1,配制成浓度为1mg/ml的溶液,在200-700nm范围内扫描。如图5所示,lap-1在260nm、280nm处无吸收,说明其不含蛋白质和核酸。
10.红外光谱分析
称取5mglap-1,溴化钾压片后置于红外光谱仪上在400-4000cm-1区间扫描。如图6所示,3385.8cm-1附近的强宽峰,2940.4cm-1附近的弱峰为多糖中oh伸缩振动,ch伸缩振动和ch变形振动的特征峰。1629.6cm-1处的特征吸收则来自于c=o的强对称吸收和羰基中c-h的变形振动。1091.9cm-1附近的吸收峰与c-o-c的伸缩振动相关。此外,865.0cm-1和917.6cm-1处的特征峰证明lap-1中存在着α-d-吡喃糖苷和β-d-吡喃糖苷。
11.核磁波谱分析
精密称取适量lap-1溶于d2o中,检测温度为30℃,使用varian-500核磁波谱仪进行分析。结果如图7所示,lap-1主要由→4,6-β-manp-(1→,α-galpa-(1→,→4-α-galpa-(1→,→4-α-glcp-(1→,→4,6-α-glcp-(1→,→4,6-α-galp-(1→,t-β-galp,α-glcpa-(1→,β-glcp-(1→,α-araf-(1→,→3-α-araf-(1→,→5-α-araf-(1→,α-rhap-(1→,→2-α-rha-(1→,→2,4-α-rha-(1→组成,具体谱图对应解析如表4所示。
表4益母草多糖的核磁共振氢谱和碳谱的化学位移归属
实施例4:体外抗凝血活性研究
活化部分凝血活酶(aptt)通过影响内源性系统来延长凝血时间,其基本原理是在体外模仿人体内环境,待测血浆与活化部分凝血活酶通过涡旋混匀器混合均匀,通过滴加氯化钙,激活内源性凝血系统,血液凝固所需时间即为aptt值。凝血酶时间(tt)用来检测血浆的凝血酶时间,适量的凝血酶将血浆样品中的纤维蛋白原转变成纤维蛋白,血液凝固所需时间即为凝血酶时间(tt)。凝血酶原时间(pt)用于血液外源性凝血途径的检测。pt的原理是血液一旦接触到含钙离子物质,即刻激发凝血效应,凝血酶原转化为凝血酶,继而引发连锁反应,纤维蛋白原转化为纤维蛋白,血液便会凝固。取新鲜健康人体血液,在低速下下离心10min,取上清液为富血小板血浆(prp),将prp在高速下离心10min,上清液为贫血小板血浆(ppp)。取不同浓度的益母草粗糖(lap)和益母草精品多糖(lap-1)50μl与贫血小板血浆200μl,通过涡旋混匀器混合均匀,取混合后的样品25μl,加入同体积的aptt试剂、pt试剂或ti试剂,混匀,在血凝仪上37℃孵育3分钟,滴加25μl同温度下预热的氯化钙溶液,记录血液凝固时间即为益母草粗糖和益母草精品多糖的aptt值。以生理盐水和肝素钠分别作为阴性对照和阳性对照,按上述方法同样操作,每个多糖组分样品测量6次。结果如表5所示,与空白组相比,阳性药物肝素钠、lap-1均可以显著延长aptt,pt和tt,lap可显著延长aptt和tt(p<0.05或p<0.01)。lap在浓度达到4mg/ml时,其对于aptt和tt的延长作用最为明显,达到29.38±0.80s和11.80±0.31s。4mg/ml的lap-1对aptt,pt和tt的延长作用最强,分别能达到29.38±0.80s,14.60±0.45s,11.80±0.31s。与传统药物肝素钠相比,lap-1的药效温和,具有毒性较低,不易产生自发性出血等不良反应等优势,综合上述数据分析可以得出,益母草均一多糖lap-1在体外具有一定抗凝血作用,可开发为抗凝血药物,并进一步应用于凝血相关疾病的治疗。
表5lap与lap-1的体外凝血试验结果
注:与空白组比较,*表明p<0.05;**表明p<0.01。
- 还没有人留言评论。精彩留言会获得点赞!