一种高粪菌活性离心力的确定方法与流程
本发明属于粪菌移植技术领域,特别涉及一种高粪菌活性离心力的确定方法。
背景技术:
肠道微生物生态系统是哺乳动物体内最复杂和最大的微生态系统,肠道菌群种类多达1000余种,细菌总数多达100万亿,是宿主细胞数量的10倍。肠道菌群主要分布于结肠。结肠菌数量为1012个/g肠内容物,而回肠菌、空肠菌和十二指肠菌依次为107个/g肠内容物、104个/g肠内容物、103个/g肠内容物。居于远端肠道内的菌群紧贴肠黏膜表面,并与上皮细胞粘连,形成细菌生物膜菌群,从而影响肠道的通透性。同时,还与营养物质的吸收、分布、代谢、排泄以及肠道免疫系统密切相关。2007年,美国国立卫生研究院启动了“人类微生物组计划”,也称“人类第二基因组计划”。欧盟也开展metahit计划,即人体肠道宏基因组研究计划。对肠道菌群的深入研究,将帮助我们更好地了解人体微生态系统与人类健康和疾病的关系。
粪菌移植(fmt)就是将健康人粪便中的功能菌群,移植到患者胃肠道内,重建具有正常功能的肠道菌群,实现肠道及肠道外疾病的治疗。在国际合作组对此词进行统一之前,少数情况下被译为“粪便移植”、“肠菌治疗”和“肠菌移植”或“肠微生态移植”。2017年,肝病领域顶级期刊《hepatology》以封面文章刊登了来自厦门大学附属中山医院团队关于肠菌移植治疗慢性乙型肝炎的重要研究结果。该研究中证实肠菌移植(imt)对于乙肝e抗原(hbeag)阳性慢性乙型肝炎的患者有一定的疗效,可以诱导那些进行了长期的抗病毒治疗后仍为hbeag阳性患者的抗原清除。holvoet等发现经过fmt12周后,9例病人(75%)的肠易激综合症(ibs)及腹胀得到缓解,腹部不适、腹痛、腹胀及胀气分别下降21%、26%、35%及37%。整体生活质量改善12.9%。一年后回访发现ibs症状显著缓解,说明fmt对ibs具有长效的缓解效果。迄今为止,fmt被认为是安全有效的治疗方法,未见严重不良事件.部分患者接受fmt治疗当天出现腹泻,少数患者出现嗳气、腹胀、腹痛、便秘等症状在移植后2天内大部分消失。另有报道显示个别患者在首次接受移植后出现寒战、发热等症状,但大都可自行缓解。另外,fmt的治疗效果依赖于供体选择、移植途径及剂量等,还依赖于fmt操作过程中活菌的比例。在fmt的操作中,粪菌的分离及离心速率是很重要的影响因素。
目前临床在粪菌移植过程中采用的离心力不统一,这使得粪菌的活性难以达到最佳状态。以活菌的整体比例及群落结构来对不同离心力下的粪菌进行评估,从而找到能够兼顾高粪菌活性与稳定群落结构的离心条件,目前国内外尚无相应的文章或专利进行介绍。一方面如果离心力太大,粪菌由于机械碰撞而活菌比例下降,而如果离心力太小,离心收集到的粪菌较少,会造成大量的粪菌损失。
技术实现要素:
本发明的目的是针对现有技术的缺陷,提供能够兼顾高粪菌活性与稳定粪菌菌群结构的方法,从而保证粪菌移植效果,使得粪菌移植的流程更加标准化。
为实现上述目的,本发明提供如下技术方案:一种高粪菌活性离心力的确定方法,具体包括如下操作步骤:
s1:将收集的粪便100~200g溶解于750ml~1000ml的0.9%nacl溶液中,经处理去除残渣,得到粪菌;
s2:对得到的粪菌进行活菌和死菌的流式细胞计数;
s3:将得到的粪菌用0.9%nacl进行洗涤,取部分样本分别置于不同离心力下进行离心,对菌体称重,同时对得到的菌体提取dna并进行高通量16srdna测序。
优选的,步骤s3中离心条件为:4℃条件下,离心力使用范围为4000~6000g,离心时间为5~10min。
本发明的技术效果和优点:
本发明涉及一种高粪菌活性离心力的确定方法,按照所述的离心力进行粪菌的回收提取。将采集的新鲜粪便经过搅拌、离心、重悬等步骤后再将粪菌置于保存液中,使用不同离心力,从粪菌活菌比例及菌群结构,一方面保证回收提取得到的粪菌具有较高的活菌比例,另一方面保证粪菌稳定的微生物菌群结构,为粪菌移植的标准化提供了可能。
本发明中涉及到的离心力很好的兼顾肠道菌群活菌比例,从而保证了粪菌移植效果,目前临床上无本发明所描述的类似方法面市。
本发明中涉及到的粪菌中活菌的比例,是采用专门区分活菌与死菌的染料进行染色,再借助流式细胞仪对粪菌中的活菌进行具体计数,目前临床上无本发明所描述的类似方法面市。
本发明中涉及到的粪菌菌群结构及组成,是采用高通量测序,对离心得到的粪菌经dna提取后进行16srdna测序分析,评估不同离心力下的菌群结构及组成,为粪菌移植的标准化提供了重要的评估方法。
附图说明
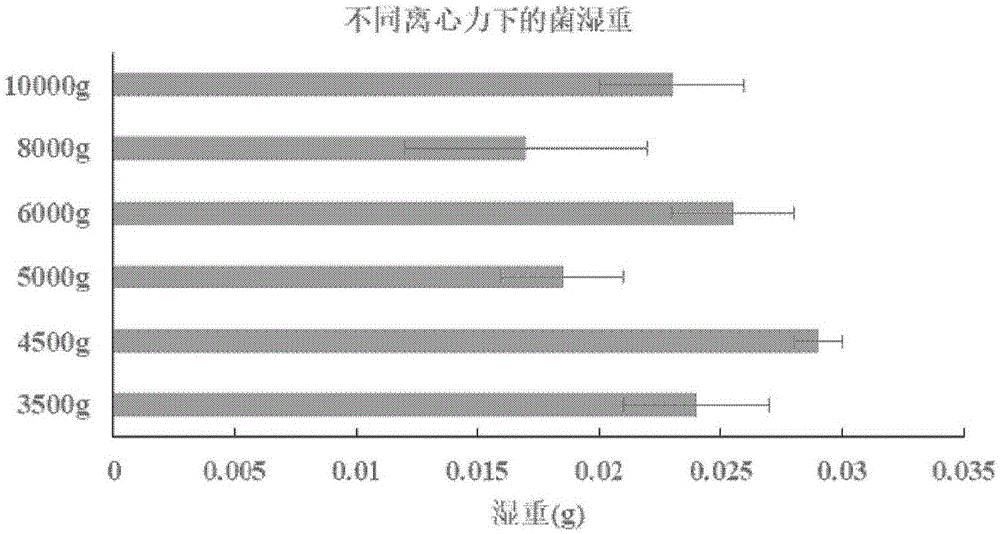
图1是粪便样本经不同离心力处理后得到的菌体重量结果比较图;
图2是利用流式细胞计数粪便样本经不同离心力处理后得到的粪菌活菌与死菌比例图;
图3是粪便样本经不同离心力处理样本的细菌多样性指数比较图;
图4是粪便样本经不同离心力处理样本的细菌群落结构比较图;
图5是粪便样本经不同离心力处理的细菌差异矩阵anosim分析图。
具体实施方式
下面将结合本发明实施例,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
一种高粪菌活性离心力的确定方法,具体包括如下操作步骤:
s1:将收集的粪便100~200g溶解于750ml~1000ml的0.9%nacl溶液中,经南京法迈特科技发展有限公司仪器及耗材处理去除残渣,得到粪菌;
s2:对得到的粪菌用live/deadbaclighttmbacterialviabilityandcountingkit进行活菌和死菌的流式细胞计数;
s3:将得到的粪菌用0.9%nacl进行洗涤,取部分样本分别置于不同离心力下进行离心,在4℃条件下,离心力使用范围为4000~6000g,离心时间为5~10min,对菌体称重,同时对得到的菌体提取dna并进行高通量16srdna测序。
具体步骤如下:
(1)采集了3位健康供体的粪便样本,并利用粪菌分离系统分离得到相应的粪菌液;
(2)对得到的粪菌液,取1m1分装至2ml离心管,在4℃条件下经3500g,4500g,5000g,6000g,8000g及10000g离心5~10min;
(3)称取各离心处理后得到的菌体重量;
(4)对得到的菌体进行流式细胞计数,操作步骤为:
1)将肠菌液进行适度稀释(稀释100倍,10μl加到990μl)的浓度调整到od600=0.5左右;
2)取987μl的0.85%nacl溶液于2ml离心管中;
3)分别加入1.5μl的3.34mmsyto9及30mmpi染料;
4)加入10μl经稀释的肠菌液;
5)室温黑暗条件下孵育15min;
6)流式参数设置后再观察,看活菌/死菌比值;
(5)称取0.5g样本,用试剂盒进行dna的提取,送往测序公司进行高通量16srdnav3-v4测序,获得序列后进行后续生物信息分析,得到菌群分析结果。
从图1可知,在离心力为4500g时,离心得到的菌体重量最大,在6000g和10000g时,得到的菌体重量次之,但各离心力下得到的菌体重量无显著性差别。
从图2可知,图片黄色区域为活菌区域,以syto9染料染色,紫色区域为死菌区域,以pi染料染色。(a)3500g;(b)4500g;(c)5000g;(d)6000g;(e)8000g;(f)10000g。
从图3可知,不同离心力下细菌多样性指数无显著性差异。
从图4可知,各离心力处理下的细菌群落结构无明显差别,这说明不同离心力对菌群结构影响很小。
如上所述,按照不同的离心力来离心菌体,不同离心力下的细菌群落结构及组成差异较小,但是得到的菌体湿重及活菌比例存在着较大差异,因此,通过选择合适的离心力以维持较好的粪菌活性,将会为今后的粪菌移植工作提供有效性保障。
最后应说明的是:以上所述仅为本发明的优选实施例而已,并不用于限制本发明,尽管参照前述实施例对本发明进行了详细的说明,对于本领域的技术人员来说,其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!