一种合成劳拉替尼的溴代物中间体及催化合成劳拉替尼的方法与流程
本发明涉及药物合成领域,具体涉及的是一种合成劳拉替尼的溴代物中间体及催化合成劳拉替尼的方法。
背景技术:
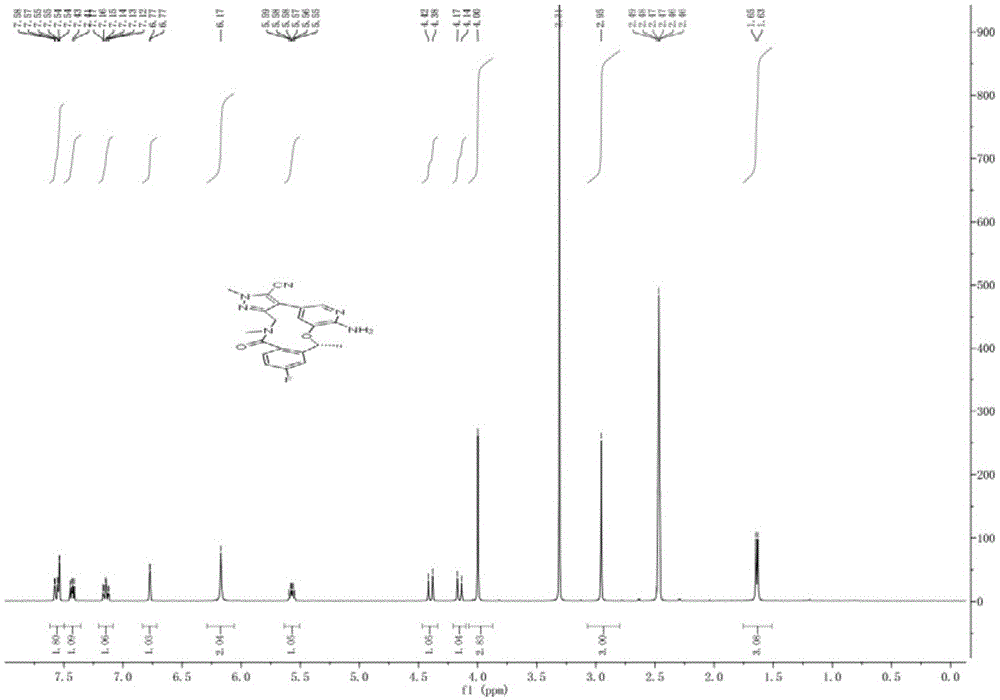
:劳拉替尼(lorlatinib)为强效的,双重alk/ros1的抑制剂,其结构如下所示:临床研究表明:劳拉替尼能够显著抑制细胞增殖,并诱导细胞凋亡,并且表现出显著的抗肿瘤活性。基于劳拉替尼良好的抗肿瘤活性效果,一系列专利文献和论文期刊报道了关于劳拉替尼原料药或其中间体的生产工艺及其工艺改进方法,如专利号为:wo.2014207606a1,报道了如下所示的合成工艺:但是,上述合成路线中,suzuki偶联反应收率只有43%,且所用催化剂较贵,上述工艺路线不仅生产成本过高,且总体收率较低,同时,原料药的工艺化制备产生的“三废”量较大。技术实现要素:本发明所要解决的技术问题在于:提供了一种合成劳拉替尼的溴代物中间体及催化合成劳拉替尼的方法。本发明是通过以下技术方案解决上述技术问题的:一种合成劳拉替尼的溴代物中间体,结构如化合物1所示:优选地,所述化合物1的合成路线如下:上述合成劳拉替尼的溴代物中间体的制备方法,包括以下步骤:称取化合物x于三口烧瓶中,加甲基叔丁基醚作为溶剂,搅拌、升温至25-35℃后,于酸性条件下脱boc保护基,保温反应3-4h后,tlc检测至反应完全,得到化合物1。优选地,所述酸性条件下脱boc保护基为将盐酸气通入至反应体系中或将三氟乙酸溶液加入至反应体系中。优选地,以化合物1为起始原料制备劳拉替尼,合成路线如下所示:本发明同时公开采用上述合成劳拉替尼的溴代物中间体为起始原料催化合成劳拉替尼的方法,合成路线如下如下:所述催化合成劳拉替尼的方法包括以下步骤:s1、化合物3的制备:依次称取化合物1、化合物2于反应器中,加入有机溶剂,搅拌分散,搅拌分散过程中往反应体系中依次加入dipea、hatu后,反应体系升温至75-85℃,保温反应4-5h反应完全,反应体系降温至室温,经萃取、分离后得到化合物3;s2、劳拉替尼的制备:依次称取化合物3、碳酸钾、有机金属钯催化剂,加入至反应器中,反应器中加入有机溶剂后,往反应体系中通入氮气驱赶空气,反应体系升温至70-80℃,保温反应4-5h反应完全,tlc检测反应至完全,反应体系降温至室温,反应液经萃取、分离后得到。优选地,所述步骤s1中化合物1与化合物2、dipea、hatu的摩尔比为:1:1.1:1.2:3。优选地,所述步骤s2中化合物3与碳酸钾的摩尔比为:1:2,所述有机金属钯催化剂的添加量为化合物3质量的7%。本发明相比现有技术具有以下优点:本发明公开一种合成劳拉替尼的溴代物中间体及催化合成劳拉替尼的方法,相比现有技术,本发明提供了一种合成劳拉替尼的溴代物中间体,及采用该中间体为起始原料催化合成劳拉替尼的方法。提供了一条颖颖的劳拉替尼的合成工艺路线,相对传统的工艺路线,本发明公开的合成工艺路线不仅成本低、且收率高,环保绿色,具有工业化应用前景。附图说明图1是本发明实施例4中劳拉替尼的氢谱图;图2是本发明实施例4中制备得到的劳拉替尼的液相图;其中,液相图为将实施例4中制备得到劳拉替尼采用lc-ms进行检测,液相图为lc-ms检测谱图中的液相图部分;图3是本发明实施例4中制备得到的劳拉替尼的质谱图;其中,质谱图为将实施例4中制备得到劳拉替尼采用lc-ms进行检测,质谱图为lc-ms检测谱图的质谱图部分。具体实施方式下面对本发明的实施例作详细说明,本实施例在以本发明技术方案为前提下进行实施,给出了详细的实施方式和具体的操作过程,但本发明的保护范围不限于下述的实施例。实施例1一种合成劳拉替尼的溴代物中间体,结构如化合物1所示:实施例2合成劳拉替尼的溴代物中间体即化合物1的制备:采用盐酸脱boc保护基以化合物x为起始原料,采用如下所示的合成路线制备化合物1:化合物1的制备方法如下:称取化合物x(32.8g,0.1mol)于三口烧瓶中,加入2l的甲基叔丁基醚作为溶剂,搅拌、升温至25℃后,将盐酸气通入至反应体系中,脱boc保护基,保温反应4h后,tlc检测至反应完全,盐酸过量时,采用氢氧化钠溶液脱盐酸,得到化合物1(22.4g),收率98.2%。实施例3合成劳拉替尼的溴代物中间体即化合物1的制备:采用三氟乙酸脱boc保护基以化合物x为起始原料,采用如下所示的合成路线制备化合物1:化合物1的制备方法如下:称取化合物x(32.8g,0.1mol)于三口烧瓶中,加入2l的甲基叔丁基醚作为溶剂,搅拌、升温至35℃后,将0.13mol的三氟乙酸加入至反应体系中,保温反应3h后,tlc检测至反应完全,得到化合物1(22.1g),收率96.7%。实施例4劳拉替尼的制备以化合物1为起始原料,采用如下所示的合成路线催化合成劳拉替尼:催化合成劳拉替尼的方法包括以下步骤:s1、化合物3的制备:依次称取化合物1(22.8g,0.1mol、)、化合物2(38.94g,0.11mol)于反应器中,加入500ml的dmf,搅拌分散,搅拌分散过程中往反应体系中依次加入dipea(15.51g,0.12mol)、hatu(114.12g,0.3mol),反应体系升温至80℃,保温反应4h反应完全,反应体系降温至室温,反应液中加入600ml乙酸乙酯和800ml的水,进行萃取,萃取所得水层,每次以600ml的乙酸乙酯进行重复萃取,重复萃取2次后,合并乙酸乙酯层,乙酸乙酯层洗涤2次后,浓缩乙酸乙酯,即得化合物3(50.4g),收率89.4%;s2、劳拉替尼的制备:将化合物3(28.2g,0.05mol)、碳酸钾(13.8g,0.1mol)、1.97gpd(dppf)2cl2作为催化剂(催化剂质量为化合物1质量的7%),加入至反应器中,加入300ml的1,4-二氧六环作为溶剂,通氮气驱赶反应器中空气,反应体系升温至75℃,保温反应4h,tlc检测反应完全,将反应液浓缩干,加入乙酸乙酯300ml,水200ml,搅拌、分层,收集有机相,水层用乙酸乙酯300ml再萃取一次,合并有机相,有机相浓缩后进行柱层析分离,得到劳拉替尼(35.52g),收率87.5%。通过上述方法制备得到的劳拉替尼,采用氢谱进行结构表征,如图1所示。其中,图2为劳拉替尼的lc-ms检测谱图中的液相图检测部分,谱图中各峰号的起始时间、保留时间、结束时间、峰高、峰面积、峰面积百分比如表1所示:表1其中,图3为劳拉替尼的lc-ms检测谱图中的质谱检测部分,谱图中各质/荷比的离子峰值、丰度如表2所示:表2质/荷比电荷数丰度407.231119472474407.407811165409.25408.412715367392.5409.23661378438.09429.21471786435.31430.217911269463.25445.19021267908.06835.406311447246.25836.40941750105.06。以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明的保护范围之内。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1