多并稠环共轭大分子及其制备方法和应用与流程
本发明涉及太阳能电池和光探测器领域,具体涉及多并稠环共轭大分子及其制备方法和应用。
背景技术:
近年来,有机太阳能电池发展迅速,由于其具有重量轻、柔性好、加工方式简单、可大面积制备并且成本低等优点,受到学术界和工业界的广泛关注。钙钛矿太阳能电池近年来由于效率的快速提升得到了学术界和工业界巨大的关注。有机光探测器作为一种新型光电探测器也是有机电子学研究的重要方向。目前,基于聚合物给体与富勒烯受体共混制备的有机太阳能电池的光电转换效率已突破11%。这显示出有机太阳能电池的巨大应用前景。聚合物材料由于其较高的摩尔消光系数,较宽的太阳光谱吸收,使得光伏器件的光电转换效率较高。然而,聚合物也有不足之处,比如:不确定的分子结构,多分散性的分子量分布,较难的批次重复性,不易纯化等问题。与聚合物不同,有机稠环小分子和大分子半导体材料由于具有确定的分子结构及分子量,以及具有批次稳定及纯化简单且纯度高等优点,使得有机稠环小分子和大分子太阳能电池研究渐趋于热。
由于富勒烯衍生物拥有足够大的电子亲和力、各向同性的电子传输性能、较匹配的电子能级等优点,使得富勒烯衍生物(pc61bm和pc71bm)成为受体材料里的明星分子,一直占据着主导地位。然而pcbm也存在着诸多缺点,如较弱的可见光吸收、较难的能级调控、复杂繁琐的提纯过程等。新型有机多并稠环大分子具有强可见区吸收特性,作为光伏材料特别适合于有机太阳能电池和光探测器,由于其能级易于调控还可以作为钙钛矿太阳能电池的修饰层,电子传输层或光捕获层掺杂成分。因此合成新型的受体材料依然非常有必要。
技术实现要素:
本发明的目的在于提供一种新型的能够用于太阳能电池和光探测器作为电子给体或电子受体材料的具有较强的光吸收、较高的电荷传输性能以及合适的电子能级的多并稠环共轭大分子及其制备方法和应用。
为了实现上述目的,本发明一方面提供一种多并稠环共轭大分子,该共轭大分子为下式(1)所示的化合物:
其中,基团b、基团c和基团d形成共轭体系;各个基团b各自独立地表示1-10个噻吩共轭稠环结构或1-10个呋喃共轭稠环结构;各个基团c各自独立地表示0-10个噻吩共轭稠环结构或0-10个呋喃共轭稠环结构;基团d表示取代或未取代的萘环结构;且当两个基团b均为1个噻吩结构时,c不均为0;
两个基团a各自独立地选自以下结构:
各个z各自独立地选自c、n、si和ge;
各个x、各个x'和各个y各自独立地选自o、s或se;
m为0-6的整数;n为0-6的整数;p为0-6的整数;q为0-6的整数;
各个r3-r9各自独立地选自h、卤素、c1-c30的烷基、c1-c30的烷氧基、c1-c30的烷硫基和c6-c30的芳基。
本发明第二方面提供上述多并稠环共轭大分子的制备方法,该方法包括:
在碱性化合物存在下且在有机溶剂中,将下式(2)所示的化合物与式(a)所示的化合物进行脱水缩合反应,得到式(1)所示的化合物;其中,
式(a)选自以下化合物中的一种或多种:
本发明第三方面提供一种含有上述多并稠环共轭大分子中的一种或多种的光伏材料或光探测材料。
本发明第四方面提供一种太阳能电池,该电池中的光伏材料含有上述多并稠环共轭大分子。
本发明第五方面提供一种上述太阳能电池的制备方法,该方法包括:将所述多并稠环共轭大分子配置于光捕获层和/或电子传输层和/或修饰层中。
本发明第六方面提供一种光探测器,该光探测器包括光捕获的活性层,其中,所述光捕获的活性层中电子给体材料和/或电子受体材料含有上述多并稠环共轭大分子中的一种或多种。
本发明第七方面提供一种光探测器的制备方法,其中,该方法包括将含有上述多并稠环共轭大分子中的一种或多种的电子给体材料和/或电子受体材料用于形成光捕获的活性层。
本发明提供的多并稠环共轭大分子,具有较强的光吸收、较高的电荷传输性能以及合适的电子能级,适合于作为光伏材料或光探测材料应用于制备太阳能电池或光探测器中。
附图说明
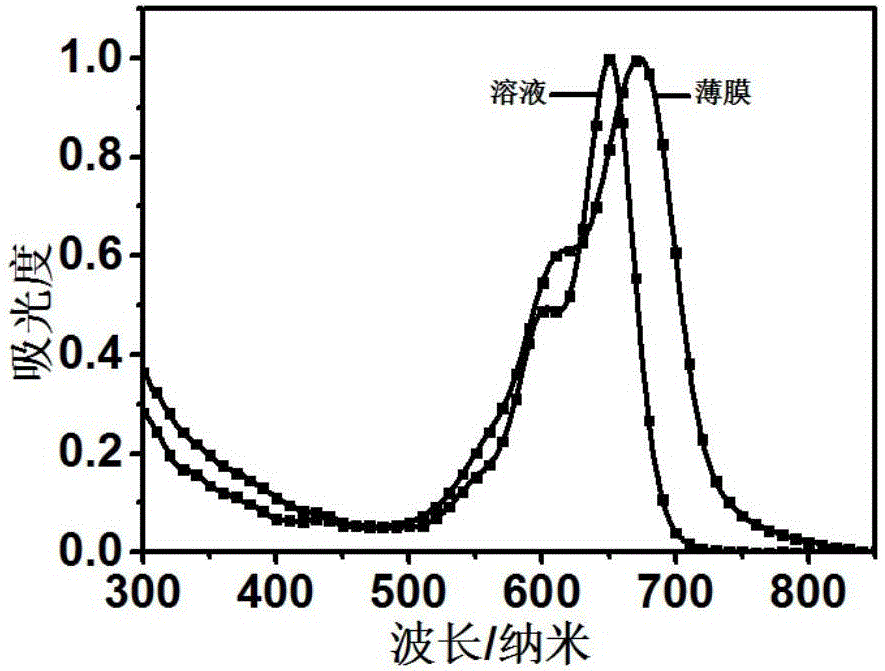
图1为本发明的实施例1所得的式(1-8-a-3)所示的多并稠环共轭大分子的紫外-可见吸收光谱,其中,溶液是指以氯仿为溶剂制得的溶液(10-6mol/l),薄膜是指氯仿溶液旋涂成的薄膜(100纳米厚度)。
图2为本发明的实施例1所得的式(1-8-a-3)所示的多并稠环共轭大分子的循环伏安曲线。
图3为实施例8所得的太阳能电池的电流-电压曲线(i-v)曲线。
图4为实施例9所得的太阳能电池的i-v曲线。
图5为实施例10所得的太阳能电池的i-v曲线。
图6为实施例11所得的太阳能电池的i-v曲线。
图7为实施例12所得的太阳能电池的i-v曲线。
图8为实施例13所得的太阳能电池的i-v曲线。
图9为实施例14所得的太阳能电池的i-v曲线。
图10为实施例15所得的钙钛矿太阳能电池的i-v曲线。
具体实施方式
在本文中所披露的范围的端点和任何值都不限于该精确的范围或值,这些范围或值应当理解为包含接近这些范围或值的值。对于数值范围来说,各个范围的端点值之间、各个范围的端点值和单独的点值之间,以及单独的点值之间可以彼此组合而得到一个或多个新的数值范围,这些数值范围应被视为在本文中具体公开。
本发明中,各个基团各自独立地选自表示,当各个基团同时且在化合物中多处出现时,它们都是独立地选择,可以是相同的,也可以是不同的,例如,尽管
本发明中,
本发明中,含有该
本发明第一方面提供了一种多并稠环共轭大分子,其特征在于,该共轭大分子为下式(1)所示的化合物:
式(1)中的各个基团如发明内容部分所限定的。
根据本发明,为了能够获得光吸收更强、电荷传输性能更高以及电子能级更为合适共轭分子,优选地,各个基团b各自独立地表示1-5个噻吩共轭稠环结构或1-5个呋喃共轭稠环结构;各个基团c各自独立地表示0-5个噻吩共轭稠环结构或0-5个呋喃共轭稠环结构;各个z各自独立地选自c、n和si;各个x、各个x'和各个y各自独立地选自o或s;m为0-4的整数;n为0-4的整数;p为0-4的整数;q为0-4的整数;各个r3-r9各自独立地选自h、卤素、c1-c20的烷基、c1-c20的烷氧基、c1-c20的烷硫基和c6-c24的芳基。
更优选地,各个基团b各自独立地表示1-4个噻吩共轭稠环结构;各个基团c各自独立地表示0-4个噻吩共轭稠环结构或0-4个呋喃共轭稠环结构;各个r3-r5和各个r7-r8各自独立地选自h、卤素、c1-c10的烷基、c1-c10的烷氧基、c1-c10的烷硫基和c6-c12的芳基;各个r6和各个r9各自独立地选自h、卤素、c4-c15的烷基、c4-c15的烷氧基、c4-c15的烷硫基和c6-c12的芳基。
更进一步优选地,各个z选自c;各个r3-r5和各个r7-r8各自独立地选自h、f、cl、br、i、甲基、乙基、正丙基、正丁基、甲氧基、乙氧基、正丙氧基、正丁氧基、甲硫基、乙硫基、正丙硫基和正丁硫基;各个r6和各个r9各自独立地选自h、正丁基、正戊基、正己基、正辛基、2-乙基己基、正丁氧基、正戊氧基、正己氧基、正辛氧基、2-乙基己氧基、正丁硫基、正戊硫基、正己硫基、正辛硫基和2-乙基己硫基。
在本发明的一种优选的实施方式中,各个基团b各自独立地表示1-3个噻吩共轭稠环结构;各个基团c各自独立地表示1-3个噻吩共轭稠环结构或1-3个呋喃共轭稠环结构。
其中,n为0,可认为r2表示不存在,那么基团a与式(1)所示的化合物的稠环单元主体直接连接,形成共轭结构。
其中,c1-c30的烷基的具体实例例如可以为:甲基、乙基、正丙基、异丙基、正丁基、异丁基、叔丁基、正戊基、正己基、正庚基、正辛基、正壬基、正癸基、2-乙基己基等。而本发明的其他范围的烷基,也可根据情况从该具体实例中进行选择。
其中,c1-c30的烷氧基的具体实例例如可以为:甲氧基、乙氧基、正丙氧基、异丙氧基、正丁氧基、异丁氧基、叔丁氧基、正戊氧基、正己氧基、正庚氧基、正辛氧基、正壬氧基、正癸氧基、2-乙基己氧基等。而本发明的其他范围的烷氧基,也可根据情况从该具体实例中进行选择。
其中,c1-c30的烷硫基的具体实例例如可以为:甲硫基、乙硫基、正丙硫基、异丙硫基、正丁硫基、异丁硫基、叔丁硫基、正戊硫基、正己硫基、正庚硫基、正辛硫基、正壬硫基、正癸硫基、2-乙基己硫基等。而本发明的其他范围的烷硫基,也可根据情况从该具体实例中进行选择。
其中,c6-c30的芳基的具体实例例如可以为:苯基、苄基、对甲苯基等。而本发明的其他范围的芳基,也可根据情况从该具体实例中进行选择。
其中,位于化合物(1)的结构两侧的两个基团b应当理解为与化合物(1)中部和两端结构一起构成共轭结构,其中,其各自独立地表示1-10个噻吩共轭稠环结构或1-10个呋喃共轭稠环结构,当基团b为1个噻吩共轭稠环结构或1个呋喃共轭稠环结构,实际上两边各有1个噻吩或呋喃基团与中部结构和两端结构形成共轭大分子的基本结构;例如,当基团b为2个以上噻吩共轭稠环结构,可以理解为正噻吩结构
对于基团d,其是取代或未取代的萘环结构,这样的萘环结构与式(1)所示的基团c形成稠环结构,这样的稠环结构例如可以为如下式所示的:
优选地,该共轭大分子为下式中所示的化合物中的一种:
其中,各个r10和各个r11各自独立地选自h、卤素、c1-c30的烷基、c1-c30的烷氧基和c1-c30的烷硫基,优选选自h、卤素、c1-c20的烷基、c1-c20的烷氧基和c1-c20的烷硫基,更优选选自h、卤素、c4-c15的烷基、c4-c15的烷氧基和c4-c15的烷硫基,更进一步优选选自h、正丁基、正戊基、正己基、正辛基、2-乙基己基、正丁氧基、正戊氧基、正己氧基、正辛氧基、2-乙基己氧基、正丁硫基、正戊硫基、正己硫基、正辛硫基和2-乙基己硫基。
本发明的多并稠环共轭大分子的具体实例选自如下式所示的化合物:
定义:基团a-1为
所述多并稠环共轭大分子为下式中所示的化合物中的一种:
式(1-8-a-1):式(1-8-a)中,z均为c,a均为基团a-1,r2不存在,r10和r11均为h,r1均为
式(1-10-a-1):式(1-10-a)中,z均为c,a均为基团a-1,r2不存在,r10和r11均为h,r1均为
式(1-10-b-1):式(1-10-b)中,z均为c,a均为基团a-1,r2不存在,r10和r11均为h,r1均为
式(1-12-b-1):式(1-12-b)中,z均为c,a均为基团a-1,r2不存在,r10和r11均为h,r1均为
本发明第二方面提供一种上述多并稠环共轭大分子的制备方法,该方法包括:
在碱性化合物存在下且在有机溶剂中,将下式(2)所示的化合物与式(a)所示的化合物进行脱水缩合反应,得到式(1)所示的化合物;其中,
式(a)选自以下化合物中的一种或多种:
该方法中,所涉及的化合物的各个基团如上文中所描述的,本发明在此不再赘述。
其中,式(2)所示的化合物可以根据上文中的多并稠环共轭大分子的结构进行选择,优选地,式(2)所示的化合物为下式中的一种或多种:
式(2)所示的化合物的具体实例例如可以为下式中的一种或多种:
式(2-8-a-1):式(2-8-a)中,z均为c,r2不存在,r10均为正己基且r11均为h,r1均为
式(2-10-a-1):式(2-10-a)中,z均为c,r2不存在,r10均为正己基且r11均为h,r1均为
式(2-10-b-1):式(2-10-b)中,z均为c,r2不存在,r10均为正己基且r11均为h,r1均为
式(2-12-b-1):式(2-12-b)中,z均为c,r2不存在,r10均为正己基且r11均为h,r1均为
根据本发明,式(2)所示的化合物可以是市售品,也可以通过本领域常规的方法制得,例如通过丁基锂反应上醛基进行制备(例如采用adv.mater.,2015,27,1170–1174;j.am.chem.soc.,2016,138,4955-4961等文献中记载的方法进行制备)。
根据本发明,式(a)所示的化合物可以根据基团a进行适当地选择,例如,式(a)所示的化合物的具体实例可以包括:
根据本发明,式(a)所示的化合物可以是市售品,也可以通过本领域常规的方法制得,在此不再赘述。
根据本发明,所述式(2)所示的化合物两端连接的醛基能够与式(a)所示的化合物发生脱水缩合,从而形成式(1)所示的化合物,其中,对所述式(2)所示的化合物与式(a)所示的化合物的用量并无特别的限定,只要能够制得式(1)所示的化合物即可,优选情况下,式(2)所示的化合物与式(a)所示的化合物的摩尔比为1:2-100,更优选为1:4-10。
根据本发明,该反应在碱性化合物存在下进行,从而可以为反应体系提供碱性环境,所述碱性化合物例如可以为哌啶、吡啶和三乙胺中一种或多种。对碱性化合物的用量并无特别的限定,只要能够提供碱性环境并有助于所述脱水缩合反应的进行即可,例如相对于1mmol式(2)所示的化合物,所述碱性化合物的用量为0.1-1000mmol,更优选为1-50mmol。
根据本发明,所述有机溶剂例如为氯仿和/或二氯甲烷。其中,相对于1mmol式(2)所示的化合物,所述有机溶剂的用量例如可以为20-500ml(优选为40-400ml)。
根据本发明,优选情况下,所述脱水缩合反应的条件包括:温度为20-100℃(例如50-100℃),时间为10min-48h(例如10-20h)。更优选地,所述脱水缩合反应的条件包括:温度为60-80℃,时间为10-15h。
为了能够保证反应的顺利进行,该方法还包括在进行反应之前,将反应体系保持在惰性气氛下,例如可以在将原料都加毕后,向反应体系通入非活泼性气体20-40min以除去空气。所述非活泼性气体例如可以为氩气、氦气、氮气等。
根据本发明,为了能够从反应液中提取出式(1)所示的化合物,该方法还包括后处理步骤,例如将脱水缩合反应产物与甲醇(相对于100ml反应液总体积,甲醇的用量例如可以为200-1000ml)混合,然后进行固液分离,将所得固相采用硅胶色谱柱(可以采用200-300目的硅胶,洗脱剂可以为体积比为1:0.2-3的石油醚和二氯甲烷混合液)进行层析分离。
本发明第三方面提供一种含有上述多并稠环共轭大分子中的一种或多种的光伏材料或光探测材料。
根据本发明,对所述光伏材料并无特别的限定,只要含有本发明的上述多并稠环共轭大分子即可,该光伏材料优选是指太阳能电池中的光捕获的活性层中电子给体材料和/或电子受体材料;或者电子传输层和/或修饰层中的光伏材料(例如对于钙钛矿太阳能电池来说)。
例如,可以将电子给体聚合物材料pbndt-ftaz与本发明提供的共轭分子以重量比为0.5-4:1进行组合来作为所述光伏材料,特别是作为太阳能电池的光捕获活性层材料,其中,特别是本发明提供的多并稠环共轭大分子优选作为电子受体材料。
其中,聚合物材料pbndt-ftaz的结构单元如下所示:
其中,-c6h13表示正己基,-c4h9表示正丁基。该聚合物材料pbndt-ftaz的制备例如可参考文献(j.am.chem.soc.2011,133,4625)中的方法进行,本发明在此不再赘述。
根据本发明,对所述光探测材料并无特别的限定,只要含有本发明的上述多并稠环共轭大分子即可。
本发明第四方面提供一种太阳能电池,该电池中的光伏材料含有上述多并稠环共轭大分子。
根据本发明,本发明对太阳能电池的构造并无特别的限定,只要其采用的光伏材料含有本发明的多并稠环共轭大分子即可,这样就可以有效地提高太阳能电池的光电转换效率。例如,所述太阳能电池为有机太阳能电池、钙钛矿太阳能电池等。
其中,当该电池为包括光捕获的活性层的有机太阳能电池时,所述光捕获的活性层中电子给体材料和/或电子受体材料含有所述多并稠环共轭大分子中的一种或多种。
当该电池为包括电子传输层、钙钛矿光捕获层和修饰层的钙钛矿太阳能电池时,所述光捕获层和/或电子传输层和/或修饰层中含有所述多并稠环共轭大分子中的一种或多种。
特别是,本发明的共轭分子优选作为电子受体材料与其他电子给体材料组合以形成太阳能电池的光捕获的活性层。作为这样的电子给体材料例如可以为聚合物材料pbndt-ftaz,如上文中所定义的。
其中,聚合物材料pbndt-ftaz可以与本发明提供的共轭大分子以重量比为0.5-4:1进行组合来形成光捕获的活性层。
本发明第五方面提供一种上述太阳能电池的制备方法,该方法包括:将所述多并稠环共轭大分子配置于含光伏材料的层中。
根据本发明,对太阳能电池的制备过程并无特别的限定,可以采用本领域常规的方法进行。
其中,对于有机太阳能电池,所述含光伏材料的层可以为光捕获的活性层。
对于钙钛矿太阳能电池,所述含光伏材料的层可以为光捕获层和/或电子传输层和/或修饰层。
根据本发明,所述有机太阳能电池的制备过程例如可以包括:对于反向结构器件:在作为阴极的导电玻璃(例如氧化铟锡玻璃,ito)上涂覆zno层作为阴极修饰层(厚度例如可以为20-50nm),干燥后,再在zno层上涂覆上聚合物材料pbndt-ftaz与本发明提供的共轭大分子的混合物作为活性层,干燥后,再真空蒸镀上氧化钼(厚度例如可以为5-10nm)和ag(厚度例如可以为50-100nm)作为阳极。对于正向结构器件:与反向结构器件不同的是,采用例如由聚3,4-乙撑二氧噻吩-聚苯乙烯磺酸盐的聚合物组合形成的聚合物层代替zno层,聚3,4-乙撑二氧噻吩-聚苯乙烯磺酸盐也表示pedot:pss;金属钙代替氧化钼;al代替ag。
根据本发明,钙钛矿太阳能电池的制备过程例如可以包括:将作为阴极的氧化铟锡(ito)玻璃先用洗洁剂清洗,然后依次用去离子水、丙酮、异丙醇超声清洗,干燥后旋涂一层约30nm厚的电子传输层(例如sno2),退火30分钟,备用。将上述多并稠环共轭大分子溶于dmf中(例如浓度为0.25mg/ml),再加入适量pbi2,而后将混合均匀后的溶液旋涂于上述电子传输层上,在70℃下退火20分钟,冷却后将碘甲脒(fai)/碘甲胺(mai)2:1)混合溶液旋涂在上面,150℃下退火15分钟,得到本发明提供的共轭大分子掺杂的钙钛矿层,最后旋涂80mg/ml的2,2',7,7'-四[n,n-二(4-甲氧基苯基)氨基]-9,9'-螺二芴(spiro-ometad)溶液作为空穴传输层。在活性层上真空(绝对压力为2×10-5pa)蒸镀厚度150nm左右的金属ag作为太阳能电池的阳极。
本发明提供的共轭分子具有较强的可见光及近红外区吸收峰,例如在600-800nm的波长范围内具有强吸收峰;该共轭分子热稳定性良好,可耐受340℃左右的温度而不分解;循环伏安法测试结果表明,其homo能级和lumo能级可以与大部分通用的电子给体材料能级匹配,且其具有较好的接受电子或空穴能力,非常利于作为太阳能电池的光伏材料,特别是电子受体和/或电子给体材料,尤其是作为电子受体材料。
本发明第六方面提供一种光探测器,该光探测器包括光捕获的活性层,其中,所述光捕获的活性层中电子给体材料和/或电子受体材料含有上述多并稠环共轭大分子中的一种或多种。
本发明对于光探测器的构造并无特别的限定,可以采用本领域的常规构造,只要其包括本发明的上述多并稠环共轭大分子即可,这样便可获得优良的光探测效果。
本发明第七方面提供一种光探测器的制备方法,其中,该方法包括将含有上述多并稠环共轭大分子中的一种或多种的电子给体材料和/或电子受体材料用于形成光捕获的活性层。
本发明对于光探测器的制备过程并无特别的限定,可以采用本领域的光探测器的制备过程,只要其包括本发明的上述多并稠环共轭大分子即可,这样便可获得优良的光探测效果。
以下将通过实施例对本发明进行详细描述。
以下例子中:分子结构式中-c6h13均为正己基,-c4h9均为正丁基,-c2h5均为乙基。1hnmr是采用bruker公司avance400/300型号的核磁共振仪测量的。ms(maldi)是采用brukerdaltonicsbiflexiiimaldi-tofanalyzer型号的质谱仪进行测量的。紫外-可见吸收光谱和可见光透过光谱是采用jascov-570spectrophotometer型号的紫外-可见分光光度计进行测量的。循环伏安曲线是采用chi660celectrochemicalworkstation型号的循环伏安测试仪进行测量的。i-v曲线是通过b2912aprecisionsource/measureunit(agilenttechnologies)测量的,从i-v曲线可以得到短路电流、开路电压、填充因子和光电转换效率等参数。聚合物材料pbndt-ftaz的制备例如可参考文献(例如j.am.chem.soc.2011,133,4625)中的方法进行。式(a-2-2,a-2-3,a-2-4)所示的化合物是根据“j.am.chem.soc.2017,139,1336–1343”中的方法制备得到。
制备例1
该制备例用于说明式(2-8-a-3)所示的化合物的制备方法。
如上反应式所示,将式ib1所示的化合物(124mg,0.1mmol;购自苏州纳凯科技有限公司)、四氢呋喃(20ml)加入到反应容器中,通氩气,在-78℃下搅拌1h。缓慢滴加正丁基锂(0.19ml,0.3mmol,1.6m),在-78℃下搅拌2h,加入n,n-二甲基甲酰胺(36.6mg,0.5mmol),将反应产物缓慢回到室温(约25℃),搅拌过夜(约12h)。然后加入水(0.2ml)淬灭,使用饱和食盐水和二氯甲烷萃取,用硫酸镁干燥,旋干,得到的沉淀物用硅胶色谱柱(采用200-300目的硅胶,洗脱剂为体积比为2:1的石油醚/二氯甲烷)进行层析分离,得到亮黄色固体(98mg,收率为75.6%),即为式(2-8-a-3)所示的化合物。1hnmr(400mhz,cdcl3):δ9.72(s,2h),7.93(d,j=8.7hz,2h),7.60(m,2h),7.19(d,j=8.1hz,8h),7.08(d,j=8.1hz,8h),2.58(m,12h),1.59(m,12h),1.31(m,36h),0.89(m,18h).ms(maldi):m/z1294.2(m+).
制备例2
该制备例用于说明式(2-10-a-3)所示的化合物的制备方法。
如上反应式所示,将式ib2所示的化合物(135mg,0.1mmol;购自苏州纳凯科技有限公司)、四氢呋喃(20ml)加入到反应容器中,通氩气,在-78℃下搅拌1h。缓慢滴加正丁基锂(0.19ml,0.3mmol,1.6m),在-78℃下搅拌2h,加入n,n-二甲基甲酰胺(36.6mg,0.5mmol),将反应产物缓慢回到室温(约25℃),搅拌过夜(约12h)。然后加入水(0.2ml)淬灭,使用饱和食盐水和二氯甲烷萃取,用硫酸镁干燥,旋干,得到的沉淀物用硅胶色谱柱(采用200-300目的硅胶,洗脱剂为体积比为2:1的石油醚/二氯甲烷)进行层析分离,得到亮黄色固体(105mg,收率为75.2%),即为式(2-10-a-3)所示的化合物。1hnmr(400mhz,cdcl3):δ9.73(s,2h),7.96(d,j=8.7hz,2h),7.62(m,2h),7.16(d,j=8.1hz,8h),7.09(d,j=8.1hz,8h),2.56(m,12h),1.55(m,12h),1.32(m,36h),0.88(m,18h).ms(maldi):m/z1405.3(m+).
制备例3
该制备例用于说明式(2-10-b-3)所示的化合物的制备方法。
如上反应式所示,将式ib3所示的化合物(135mg,0.1mmol;购自苏州纳凯科技有限公司)、四氢呋喃(20ml)加入到反应容器中,通氩气,在-78℃下搅拌1h。缓慢滴加正丁基锂(0.19ml,0.3mmol,1.6m),在-78℃下搅拌2h,加入n,n-二甲基甲酰胺(36.6mg,0.5mmol),将反应产物缓慢回到室温(约25℃),搅拌过夜(约12h)。然后加入水(0.2ml)淬灭,使用饱和食盐水和二氯甲烷萃取,用硫酸镁干燥,旋干,得到的沉淀物用硅胶色谱柱(采用200-300目的硅胶,洗脱剂为体积比为2:1的石油醚/二氯甲烷)进行层析分离,得到亮黄色固体(107mg,收率为76.3%),即为式(2-10-b-3)所示的化合物。1hnmr(400mhz,cdcl3):δ9.74(s,2h),7.95(d,j=8.7hz,2h),7.62(m,2h),7.17(d,j=8.1hz,8h),7.07(d,j=8.1hz,8h),2.55(m,12h),1.56(m,12h),1.32(m,36h),0.88(m,18h).ms(maldi):m/z1404.1(m+).
制备例4
该制备例用于说明式(2-12-b-3)所示的化合物的制备方法。
如上反应式所示,将式ib4所示的化合物(146mg,0.1mmol;购自苏州纳凯科技有限公司)、四氢呋喃(20ml)加入到反应容器中,通氩气,在-78℃下搅拌1h。缓慢滴加正丁基锂(0.56ml,0.9mmol,1.6m),在-78℃下搅拌2h,加入n,n-二甲基甲酰胺(36.6mg,0.5mmol),将反应产物缓慢回到室温(约25℃),搅拌过夜(约12h)。然后加入水(0.2ml)淬灭,使用饱和食盐水和二氯甲烷萃取,用硫酸镁干燥,旋干,得到的沉淀物用硅胶色谱柱(采用200-300目的硅胶,洗脱剂为体积比为2:1的石油醚/二氯甲烷)进行层析分离,得到亮黄色固体(114mg,收率为74.9%),即为式(2-12-b-3)所示的化合物。1hnmr(400mhz,cdcl3):δ9.77(s,2h),7.95(d,j=8.7hz,2h),7.61(m,2h),7.14(d,j=8.1hz,8h),7.07(d,j=8.1hz,8h),2.54(m,12h),1.57(m,12h),1.31(m,36h),0.86(m,18h).ms(maldi):m/z1518.3(m+).
制备例5
该制备例用于说明式(a-4-1)所示的化合物的制备方法。
如上反应式所示,将化合物t1(200mg,1.3mmol;按照文献dyesandpigments2016,134,129中的方法合成)、丙二腈(171mg,2.6mmol)、乙醇(20ml)加入到反应容器中,通氩气,在25℃下搅拌30分钟。缓慢加入乙酸钠(132mg,1.6mmol),在25℃下搅拌2h,加入水(30ml),搅拌1.5h。然后加入浓盐酸调节ph=2,用滤纸过滤,水洗(400ml),得到的沉淀物用硅胶色谱柱(采用200-300目的硅胶,洗脱剂为三氯甲烷)进行层析分离,得到橙色固体(85mg,收率为32%),即为式(a-4-1)所示的化合物。1hnmr(400mhz,cdcl3):δ8.64(d,j=2.4hz,1h),8.07(d,j=2.4hz,1h),4.00(s,2h).ms(ei):m/z200(m+).
制备例6
该制备例用于说明式(a-2-2)和(a-2-3)所示的化合物的制备方法。
如上反应式所示,将5-氟-1,3-茚二酮(820mg,5mmol;购自ark公司)、丙二腈(660mg,10mmol)、乙醇(30ml)加入到反应容器中,通氩气,在25℃下搅拌30分钟。缓慢加入乙酸钠(492mg,6mmol),在25℃下搅拌2h,加入水(40ml),搅拌1.5h。然后加入浓盐酸调节ph=2,用滤纸过滤,水洗(300ml),得到的沉淀物用硅胶色谱柱(采用200-300目的硅胶,洗脱剂为体积比为1:5的甲醇/三氯甲烷)进行层析分离,得到灰白色固体(610mg,收率为57.5%),即为式(a-2-2)所示的化合物(占71mol%)和式(a-2-3)所示的化合物(占29mol%)的混合物。混合物的1hnmr(400mhz,cdcl3):δ8.68(dd,j=8.8hz,0.28h),7.61(dd,j=8.2hz,0.72h),8.01(m,0.76h),7.61(m,0.36h),7.55(m,1h),3.76(d,2h).ms(ei):m/z212(m+).
制备例7
该制备例用于说明式(a-2-4)所示的化合物的制备方法。
如上反应式所示,将5,6-二氟-1,3-茚二酮(201mg,1.1mmol;按照文献planells,m.;robertson,n.eur.j.org.chem.2012,2012,4947中的方法合成)、丙二腈(145mg,2.2mmol)、乙醇(20ml)加入到反应容器中,通氩气,在25℃下搅拌30分钟。缓慢加入乙酸钠(107mg,1.3mmol),在25℃下搅拌2h,加入水(30ml),搅拌1.5h。然后加入浓盐酸调节ph=2,然后用滤纸过滤,用水洗(400ml),得到的沉淀物用硅胶色谱柱(采用200-300目的硅胶,洗脱剂为体积比为1:1的甲醇/三氯甲烷)进行层析分离,得到棕色固体(115mg,收率为44.6%),即为式(a-2-4)所示的化合物。1hnmr(400mhz,cdcl3):δ8.46(dd,j=6.4hz,1h),7.76(t,j=7.6hz,1h),3.76(s,2h).ms(ei):m/z230(m+)
实施例1
本实施例用于说明本发明的共轭大分子及其制备方法。
如上反应式所示,将上述制备例1所得的式(2-8-a-3)所示的化合物(129mg,0.1mmol)、式(a-2-1)所示的化合物(92mg,0.4mmol)、吡啶(0.8ml,0.96mmol)和氯仿(30ml)加入到反应容器中,通氩气25min,而后在65℃下回流12h。冷却至室温(约25℃)后,将反应产物倒入至200ml甲醇中并过滤,得到的沉淀用硅胶色谱柱(采用200-300目的硅胶,洗脱剂为体积比为1:2的石油醚/二氯甲烷)进行层析分离,得到蓝色固体(147mg,收率为89.1%),即为式(1-8-a-3)所示的多并稠环共轭大分子。1hnmr(400mhz,cdcl3):δ8.95(s,2h),8.75(m,2h),7.98(m,2h),7.76(m,8h),7.23(d,j=8.4hz,8h),7.14(d,j=8.1hz,8h),2.57(m,12h),1.59(m,12h),1.26(m,36h),0.87(m,18h).ms(maldi):m/z1645.3(m+).
该式(1-8-a-3)所示的多并稠环共轭大分子的紫外-可见吸收光谱如图1所示,表明其在600-800nm的波长范围内具有强吸收峰,最大摩尔消光系数为2.7×105m–1·cm–1,薄膜在710nm左右处吸收最强;薄膜的最大吸收峰比溶液中的红移30nm。
循环伏安测得的循环伏安曲线如图2所示,可见homo能级为-5.49ev,lumo能级为-3.73ev,带隙为1.59ev,表明式(1-8-a-3)所示的多并稠环共轭大分子具有较好的电子接受能力,可以与大部分通用的电子给体材料能级匹配。
实施例2
本实施例用于说明本发明的共轭大分子及其制备方法。
如上反应式所示,将上述制备例1所得的式(2-8-a-3)所示的化合物(129mg,0.1mmol)、制备例5所得的式(a-4-1)所示的化合物(80mg,0.4mmol)、吡啶(0.8ml,0.96mmol)和氯仿(30ml)加入到反应容器中,通氩气25min,而后在65℃下回流15h。冷却至室温(约25℃)后,将反应产物倒入至200ml甲醇中并过滤,得到的沉淀用硅胶色谱柱(采用200-300目的硅胶,洗脱剂为体积比为1:2的石油醚/二氯甲烷)进行层析分离,得到蓝色固体(145mg,收率为87.6%),即为式(1-8-a-19)所示的多并稠环共轭大分子。1hnmr(400mhz,cdcl3):δ8.95(s,2h),8.79(m,2h),7.96(m,2h),7.75(m,4h),7.24(d,j=8.4hz,8h),7.17(d,j=8.4hz,8h),2.56(m,8h),1.56(m,12h),1.23(m,20h),0.86(m,12h).ms(maldi):m/z1657.2(m+).
该式(1-8-a-19)所示的多并稠环共轭大分子的紫外-可见吸收光谱表明其在600-800nm的波长范围内具有强吸收峰,最大摩尔消光系数为2.9×105m–1·cm–1,薄膜在720nm左右处吸收最强;薄膜的最大吸收峰比溶液中的红移32nm。
循环伏安测得其homo能级为-5.47ev,lumo能级为-3.76ev,带隙为1.57ev,表明式(1-8-a-19)所示的多并稠环共轭大分子具有较好的电子接受能力,可以与大部分通用的电子给体材料能级匹配。
实施例3
本实施例用于说明本发明的共轭大分子及其制备方法。
如上反应式所示,将上述制备例1所得的式(2-8-a-3)所示的化合物(129mg,0.1mmol)、制备例6所得的式(a-2-2)和式(a-2-3)所示的化合物的混合物(85mg,0.4mmol)、吡啶(0.8ml,0.96mmol)和氯仿(30ml)加入到反应容器中,通氩气25min,而后在65℃下回流15h。冷却至室温(约25℃)后,将反应产物倒入至200ml甲醇中并过滤,得到的沉淀用硅胶色谱柱(采用200-300目的硅胶,洗脱剂为体积比为1:2的石油醚/二氯甲烷)进行层析分离,得到蓝色固体(156mg,收率为91.2%),即为式(1-8-a-f1)所示的多并稠环共轭大分子,其为式(1-8-a-7)、式(1-8-a-11)和式(1-8-a-27)所示的化合物的混合物。1hnmr(400mhz,cdcl3):δ8.86(s,2h),8.71(dd,j=4.0hz,0.5h),8.36(dd,j=1.6hz,1.5h),7.92(dd,j=5.2hz,1.5h),7.59(dd,j=2.8hz,0.5h),7.48(m,4h),7.42(m,2h),7.11(m,16h),2.58(m,12h),1.54(m,12h),1.31(m,36h),0.94(m,18h).ms(maldi):m/z1714.2(m+).
该式(1-8-a-f1)所示的上述三种多并稠环共轭大分子的混合物的紫外-可见吸收光谱表明其在600-800nm的波长范围内具有强吸收峰,最大摩尔消光系数为3.2×105m–1·cm–1,薄膜在733nm左右处吸收最强;薄膜的最大吸收峰比溶液中的红移25nm。
循环伏安测得其homo能级为-5.48ev,lumo能级为-3.81ev,带隙为1.54ev,表明式(1-8-a-f1)所示的上述三种多并稠环共轭大分子的混合物具有较好的电子接受能力,可以与大部分通用的电子给体材料能级匹配。
实施例4
本实施例用于说明本发明的共轭大分子及其制备方法。
如上反应式所示,将上述制备例1所得的式(2-8-a-3)所示的化合物(259mg,0.2mmol)、制备例7所得的式(a-2-4)所示的化合物(166mg,0.72mmol)、吡啶(0.8ml,0.96mmol)和氯仿(30ml)加入到反应容器中,通氩气25min,而后在65℃下回流15h。冷却至室温(约25℃)后,将反应产物倒入至200ml甲醇中并过滤,得到的沉淀用硅胶色谱柱(采用200-300目的硅胶,洗脱剂为体积比为1:2的石油醚/二氯甲烷)进行层析分离,得到蓝色固体(298mg,收率为87%),即为式(1-8-a-15)所示的多并稠环共轭大分子。1hnmr(300mhz,cdcl3):δ8.79(s,2h),8.51(m,2h),7.73(s,2h),7.65(m,4h),7.31(d,j=7.5hz,8h),7.10(d,j=7.2hz,8h),2.58(m,12h),1.56(m,12h),1.25(m,36h),0.87(m,18h).ms(maldi):m/z1718.5(m+).
该式(1-8-a-15)所示的多并稠环共轭大分子的紫外-可见吸收光谱表明其在600-800nm的波长范围内具有强吸收峰,最大摩尔消光系数为2.8×105m–1·cm–1,薄膜在743nm左右处吸收最强;薄膜的最大吸收峰比溶液中的红移26nm。
循环伏安测得其homo能级为-5.50ev,lumo能级为-3.86ev,带隙为1.51ev,表明式(1-8-a-15)所示的多并稠环共轭大分子具有较好的电子接受能力,可以与大部分通用的电子给体材料能级匹配。
实施例5
本实施例用于说明本发明的共轭大分子及其制备方法。
如上反应式所示,将上述制备例2所得的式(2-10-a-3)所示的化合物(280mg,0.2mmol)、制备例7所得的式(a-2-4)所示的化合物(166mg,0.72mmol)、吡啶(0.8ml,0.96mmol)和氯仿(30ml)加入到反应容器中,通氩气25min,而后在65℃下回流15h。冷却至室温(约25℃)后,将反应产物倒入至200ml甲醇中并过滤,得到的沉淀用硅胶色谱柱(采用200-300目的硅胶,洗脱剂为体积比为1:2的石油醚/二氯甲烷)进行层析分离,得到蓝色固体(311mg,收率为85%),即为式(1-10-a-15)所示的多并稠环共轭大分子。1hnmr(300mhz,cdcl3):δ8.79(s,2h),8.53(m,2h),7.73(s,2h),7.65(m,4h),7.31(d,j=7.5hz,8h),7.13(d,j=7.2hz,8h),2.57(m,12h),1.54(m,12h),1.24(m,36h),0.88(m,18h).ms(maldi):m/z1829.5(m+).
该式(1-10-a-15)所示的多并稠环共轭大分子的紫外-可见吸收光谱表明其在600-900nm的波长范围内具有强吸收峰,最大摩尔消光系数为3.1×105m–1·cm–1,薄膜在765nm左右处吸收最强;薄膜的最大吸收峰比溶液中的红移27nm。
循环伏安测得其homo能级为-5.48ev,lumo能级为-3.82ev,带隙为1.48ev,表明式(1-10-a-15)所示的多并稠环共轭大分子具有较好的电子接受能力,可以与大部分通用的电子给体材料能级匹配。
实施例6
本实施例用于说明本发明的共轭大分子及其制备方法。
如上反应式所示,将上述制备例3所得的式(2-10-b-3)所示的化合物(280mg,0.2mmol)、制备例7所得的式(a-2-4)所示的化合物(166mg,0.72mmol)、吡啶(0.8ml,0.96mmol)和氯仿(30ml)加入到反应容器中,通氩气25min,而后在65℃下回流15h。冷却至室温(约25℃)后,将反应产物倒入至200ml甲醇中并过滤,得到的沉淀用硅胶色谱柱(采用200-300目的硅胶,洗脱剂为体积比为1:2的石油醚/二氯甲烷)进行层析分离,得到蓝色固体(318mg,收率为87%),即为式(1-10-b-15)所示的多并稠环共轭大分子。1hnmr(300mhz,cdcl3):δ8.83(s,2h),8.53(m,2h),7.76(s,2h),7.67(m,4h),7.31(d,j=7.5hz,8h),7.12(d,j=7.2hz,8h),2.57(m,12h),1.54(m,12h),1.28(m,36h),0.87(m,18h).ms(maldi):m/z1830.1(m+).
该式(1-10-b-15)所示的多并稠环共轭大分子的紫外-可见吸收光谱表明其在600-900nm的波长范围内具有强吸收峰,最大摩尔消光系数为3.0×105m–1·cm–1,薄膜在766nm左右处吸收最强;薄膜的最大吸收峰比溶液中的红移28nm。
循环伏安测得其homo能级为-5.49ev,lumo能级为-3.82ev,带隙为1.47ev,表明式(1-10-b-15)所示的多并稠环共轭大分子具有较好的电子接受能力,可以与大部分通用的电子给体材料能级匹配。
实施例7
本实施例用于说明本发明的共轭大分子及其制备方法。
如上反应式所示,将上述制备例4所得的式(2-12-b-3)所示的化合物(303mg,0.2mmol)、制备例7所得的式(a-2-4)所示的化合物(166mg,0.72mmol)、吡啶(0.8ml,0.96mmol)和氯仿(30ml)加入到反应容器中,通氩气25min,而后在65℃下回流15h。冷却至室温(约25℃)后,将反应产物倒入至200ml甲醇中并过滤,得到的沉淀用硅胶色谱柱(采用200-300目的硅胶,洗脱剂为体积比为1:2的石油醚/二氯甲烷)进行层析分离,得到蓝色固体(342mg,收率为88%),即为式(1-12-b-15)所示的多并稠环共轭大分子。1hnmr(300mhz,cdcl3):δ8.77(s,2h),8.55(m,2h),7.72(s,2h),7.67(m,2h),7.32(d,j=7.5hz,8h),7.13(d,j=7.2hz,8h),2.57(m,12h),1.55(m,12h),1.23(m,36h),0.88(m,18h).ms(maldi):m/z1941.5(m+).
该式(1-12-b-15)所示的多并稠环共轭大分子的紫外-可见吸收光谱表明其在600-900nm的波长范围内具有强吸收峰,最大摩尔消光系数为3.3×105m–1·cm–1,薄膜在788nm左右处吸收最强;薄膜的最大吸收峰比溶液中的红移30nm。
循环伏安测得其homo能级为-5.45ev,lumo能级为-3.78ev,带隙为1.45ev,表明式(1-12-b-15)所示的多并稠环共轭大分子具有较好的电子接受能力,可以与大部分通用的电子给体材料能级匹配。
实施例8
本实施例用于说明本发明的太阳能电池。
将作为阴极的氧化铟锡(ito)玻璃(购自深圳南玻浮法玻璃有限公司)先用洗洁剂清洗,然后依次用去离子水、丙酮、异丙醇超声清洗,干燥后旋涂一层30nm厚的zno阴极修饰层,200℃下干燥30分钟,备用。
1.5mg上述式(1-8-a-3)所示的多并稠环共轭大分子与1mg聚合物给体材料pbndt-ftaz在0.1ml氯仿中进行混合得到混合液,而后将其旋涂于上述zno层上,干燥后即可获得光捕获活性层(有效面积为4mm2)。在活性层上真空(绝对压力为2×10-5pa)蒸镀厚度5nm左右moo3(购自百灵威科技有限公司)和80nm左右的金属ag作为太阳能电池的阳极。
用配有am1.5滤光片(san-eielectricco.,ltd.的xes-70s1型号)模拟太阳光源,在100mw/cm2光强下对器件进行光伏性能测试,光强通过标准单晶硅太阳能电池(购自vlsistandardsinc)校准。所得的i-v曲线使用b2912aprecisionsource/measureunit(agilenttechnologies)进行测量,通过labview软件由计算机进行控制。
所得的i-v曲线如图3所示。通过图3所示的i-v曲线可得该太阳能电池的开路电压voc为0.97v,短路电流jsc为14.45ma·cm-2,填充因子ff为72%,光电转换效率pce为10.09%。
实施例9
本实施例用于说明本发明的太阳能电池。
根据实施例8所述的方法,不同的是,采用1.5mg的式(1-8-a-19)所示的多并稠环共轭大分子的混合物替代式(1-8-a-3)所示的多并稠环共轭大分子,最终制得太阳能电池并进行测试。
所得的i-v曲线如图4所示。通过图4所示的i-v曲线可得该太阳能电池的开路电压voc为0.96v,短路电流jsc为15.34ma·cm-2,填充因子ff为66%,光电转换效率pce为9.71%。
实施例10
本实施例用于说明本发明的太阳能电池。
根据实施例8所述的方法,不同的是,采用1.5mg的式(1-8-a-f1)所示的多并稠环共轭大分子替代式(1-8-a-3)所示的多并稠环共轭大分子,最终制得太阳能电池并进行测试。
所得的i-v曲线如图5所示。通过图5所示的i-v曲线可得该太阳能电池的开路电压voc为0.96v,短路电流jsc为16.46ma·cm-2,填充因子ff为72%,光电转换效率pce为11.37%。
实施例11
本实施例用于说明本发明的太阳能电池。
根据实施例8所述的方法,不同的是,采用1.5mg的式(1-8-a-15)所示的多并稠环共轭大分子替代式(1-8-a-3)所示的多并稠环共轭大分子,最终制得太阳能电池并进行测试。
所得的i-v曲线如图6所示。通过图6所示的i-v曲线可得该太阳能电池的开路电压voc为0.90v,短路电流jsc为19.65ma·cm-2,填充因子ff为70%,光电转换效率pce为12.37%。
实施例12
本实施例用于说明本发明的太阳能电池。
根据实施例8所述的方法,不同的是,采用1.5mg的式(1-10-a-15)所示的三种多并稠环共轭大分子的混合物替代式(1-8-a-3)所示的多并稠环共轭大分子,最终制得太阳能电池并进行测试。
所得的i-v曲线如图7所示。通过图7所示的i-v曲线可得该太阳能电池的开路电压voc为0.94v,短路电流jsc为20.26ma·cm-2,填充因子ff为68%,光电转换效率pce为12.95%。
实施例13
本实施例用于说明本发明的太阳能电池。
根据实施例8所述的方法,不同的是,采用1.5mg的式(1-10-b-15)所示的多并稠环共轭大分子替代式(1-8-a-3)所示的多并稠环共轭大分子,最终制得太阳能电池并进行测试。
所得的i-v曲线如图8所示。通过图8所示的i-v曲线可得该太阳能电池的开路电压voc为0.93v,短路电流jsc为20.64ma·cm-2,填充因子ff为67%,光电转换效率pce为12.86%。
实施例14
本实施例用于说明本发明的太阳能电池。
根据实施例8所述的方法,不同的是,采用1.5mg的式(1-12-b-15)所示的多并稠环共轭大分子替代式(1-8-a-3)所示的多并稠环共轭大分子,最终制得太阳能电池并进行测试。
所得的i-v曲线如图9所示。通过图9所示的i-v曲线可得该太阳能电池的开路电压voc为0.99v,短路电流jsc为21.37ma·cm-2,填充因子ff为62%,光电转换效率pce为13.08%。
实施例15
本实施例用于说明本发明的钙钛矿太阳能电池。
将作为阴极的氧化铟锡(ito)玻璃(购自深圳南玻浮法玻璃有限公司)先用洗洁剂清洗,然后依次用去离子水、丙酮、异丙醇超声清洗,干燥后旋涂一层30nm厚的sno2电子传输层,150℃下退火30分钟,备用。
0.25mg上述式(1-8-a-3)所示的多并稠环共轭大分子溶于1mldmf中,再加入500mgpbi2,而后将混合均匀后的溶液旋涂于上述电子传输层上,在70℃下退火20分钟,冷却后将碘甲脒(fai)/碘甲胺(mai)2:1)混合溶液旋涂在上面,150℃下退火15分钟,得到上述多并稠环共轭大分子(1-8-a-3)掺杂的钙钛矿层,最后旋涂80mg/ml的2,2',7,7'-四[n,n-二(4-甲氧基苯基)氨基]-9,9'-螺二芴(spiro-ometad)溶液作为空穴传输层。在活性层上真空(绝对压力为2×10-5pa)蒸镀厚度150nm左右的金属ag作为太阳能电池的阳极。
用配有am1.5滤光片(san-eielectricco.,ltd.的xes-70s1型号)模拟太阳光源,在100mw/cm2光强下对器件进行光伏性能测试,光强通过标准单晶硅太阳能电池(购自vlsistandardsinc)校准。所得的i-v曲线使用b2912aprecisionsource/measureunit(agilenttechnologies)进行测量,通过labview软件由计算机进行控制。
所得的i-v曲线如图10示。通过图10所示的i-v曲线可得该太阳能电池的开路电压voc为1.004v,短路电流jsc为23.58ma·cm-2,填充因子ff为80.7%,光电转换效率pce为19.11%。
以上详细描述了本发明的优选实施方式,但是,本发明并不限于此。在本发明的技术构思范围内,可以对本发明的技术方案进行多种简单变型,包括各个技术特征以任何其它的合适方式进行组合,这些简单变型和组合同样应当视为本发明所公开的内容,均属于本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!