软枣猕猴桃幼苗性别早期鉴定分子标记及其应用的制作方法
本发明属于软枣猕猴桃人工培育与分子生物学领域,具体涉及一种软枣猕猴桃幼苗性别早期鉴定分子标记及其应用。
背景技术:
世界猕猴桃产业的发展源于二十世纪初,而我国猕猴桃产业发展始于上世纪七十年代末期。早期栽培种植的品种主要来自于中华猕猴桃复合体(actinidiachinensisplanch.var.chinensis)中的中华猕猴桃原变种(actinidia.chinensisplanch.var.chinensis)和美味猕猴桃变种(a.chinensisplanch.var.deliciosaa.chev.)。软枣猕猴桃[a.arguta(siebold&zucc.)planch.exmiq.]则是近年来发展最为迅速的新兴栽培品种。
从形态上看,猕猴桃属植物的花类型为完全花,其中绝大多数种类属于功能性雌雄异株。猕猴桃属植物在实生育种过程中童期一般为5~7年,由于其特殊的遗传背景,后代常出现雄性多于雌性的现象。众所周知,作为果树类经济作物,其雌株的培育价值、经济价值和生产需求明显大于雄株,目前的人工育种工作也主要集中在雌性品种选育方面。因此,如能开发出用于幼苗早期性别鉴定的标记或方法,将会节约大量的人力、物力、时间等育种成本,加速育种进程。
已有研究人员开展了类似的研究,如李旭等尝试利用生理生化鉴定等方法进行雌雄性别的鉴定(李旭,曹万万,姜丹等:基于形态观察法和生理生化法的软枣猕猴桃性别鉴别研究.北方园艺,2014(24):6-9.);陈晓玲等利用同工酶分析法进行雌雄性别的鉴定(陈晓玲,梁红,朱东华:猕猴桃不同性别过氧化物酶及酯酶同工酶分析.农业与技术,2004,24(1):40-43.),但上述方法其结果易受环境因素影响,准确性普遍较低。
dna分子标记是以个体间核苷酸序列变异为基础,是生物个体遗传变异的直接反映,利用其可以检测出生物个体之间核苷酸序列上的差异,为雌雄异株植物早期性别鉴定提供了新的途径。
目前,已有一些关于猕猴桃属植物性别鉴定分子标记研究的报道。例如,smx和smy1是由gill等通过集团分离分析法(bulksegregantanalysis,bsa),利用二倍体中华猕猴桃实生群体开发的scar(sequencecharacterizedamplifiedregion)标记(gillgp,harveycf,gardnerrc,etal.developmentofsex-linkedpcrmarkersforgenderidentificationinactinidia.theoretical&appliedgenetics,1998,97(3):439-445.),其中,smx为雌性特异性标记,smy1为雄性特异性标记;经测试,smx仅能鉴定3个家系中的1个家系的性别,而不能用于另外2个家系,而smy1的鉴定准确率达88%,能够有效区分中华猕猴桃性别。又例如,a001、a002和a003是张琼等在山梨猕猴桃(a.rufa)和中华猕猴桃的种间杂交f1代群体中,利用rad-seq技术开发的ssr(simplesequencerepeats)标记(zhangq,liucy,liuyf,etal.high-densityinterspecificgeneticmapsofkiwifruitandtheidentificationofsex-specificmarkers.dnaresearch,2015,22(5):367-375.),其可靠性在该研究中所用群体的174个f1代个体中得到验证;a001为雌性特异性标记,不仅在该f1代中表现出较高的准确性,而且能够鉴别另外3份山梨猕猴桃种质资源(‘山梨3’、‘山梨4’和‘山梨5’)的性别;a002和a003在雌性个体和雄性个体中分别扩增出大小不同的差异性片段,可用于鉴定植株性别;然而,测试发现仅有使用a003或者将a001和a002配合使用才可以鉴定研究中所用到的所有中华猕猴桃和山梨猕猴桃植株的性别。然而,目前研究发现的上述标记仅在报道所涉及研究材料样本中得到了验证,通过前期我们在软枣猕猴桃已知性别的品种或单株上进行测试,上述标记均不具有性别特异性。
虽然关于软枣猕猴桃性别标记的研究也有报道(李旭,吴松权,姜明亮等:软枣猕猴桃性别相关的srap分子标记.江苏农业科学,2016,44(8):69-71.),但相关研究中并未发现具有性别特异性的条带,且获得测试结果需要对多个并不稳定的多态性条带进行复杂的聚类分析,而所得聚类分析结果与样品的性别匹配率也仅能达到70%。不仅如此,上述测试方法通用性较差,测试过程操作复杂,所需人力和时间成本较高,且其结果稳定性易受试验操作影响,导致测试结果准确性较低。鉴于此,开发一种通用性好、操作简单、稳定性好、准确性高的针对软枣猕猴桃实生苗性别早期鉴定的分子标记对于软枣猕猴桃人工培育产业而言具有重要的现实意义。
技术实现要素:
本发明的目的是提供一种新的且行之有效的软枣猕猴桃实生幼苗性别早期鉴定分子标记物。
首先,本发明提供了一种软枣猕猴桃幼苗性别早期鉴定分子标记,所述分子标记的正向引物序列为:5′–tctcgccatcttcaaccattt–3′,反向引物序列为:5′–atcttggcgtatctcggcttt–3′。
进一步地,利用所述分子标记的正向引物和反向引物对软枣猕猴桃基因组dna进行扩增,其扩增产物长度为304bp,序列如下:
tctcgccatcttcaaccatttctcctcgcctggttatcctcacgcaaatggtcaagtagacgtcaccgatagaactatcctaagaactctaaaggtgaggttagaaaagtctaagggtgaatgggcataagaccttcagatcatgctatgggattaccacacgacaagcagaattcctacaggtgagatgccgtattctatggtatataggacagaatcaatcatacttgtggagataggaatgccgagcttcaagacctcaaattttgacaaggagaacaacaaagccgagatacgccaagat。
进一步地,本发明还涉及上述分子标记在软枣猕猴桃性别辅助选育中的应用。
同时,本发明还涉及上述分子标记在猕猴桃性别辅助选育中的应用。
此外,本发明还提供了一种软枣猕猴桃性别辅助选育试剂盒,所述试剂盒中含有上述分子标记的引物对。
最后,本发明还提供了一种软枣猕猴桃性别早期鉴定方法,包括以下步骤:
(1)软枣猕猴桃基因组dna的提取:
摘取软枣猕猴桃幼嫩叶片,置于液氮中冷冻之后,保存于-80℃冰箱中;取冷冻叶片组织100~200mg,装入放有1粒钢珠的2mlep管中,再次于液氮中冷冻,用磨样机研磨至细粉状,利用植物基因组dna提取试剂盒提取样品基因组dna,将模板dna浓度稀释至20ng/μl,保存于-20℃冰箱中备用;
(2)标记引物序列:
正向引物序列:5′–tctcgccatcttcaaccattt–3′,
反向引物序列:5′–atcttggcgtatctcggcttt–3′;
(3)pcr反应体系:
浓度为400nmol·l-1的正向引物——1μl,
浓度为400nmol·l-1的反向引物——1μl,
ddh2o——6μl,
pcrmix——10μl,
浓度为20ng/μl的dna模板——2μl;
(4)pcr扩增程序:
(5)结果判定:
出现特异性条带的为雄性样品,无条带出现的为雌性样品。
进一步地,上述软枣猕猴桃性别早期鉴定方法,其pcr反应体系中所述pcrmix为含染料的2×taqpcrmastermix。
通过在已知性别的95份软枣猕猴桃单株中进行检测,本发明分子标记及鉴定方法的测试准确率可达94.7%,且本发明分子标记和方法通用性好、操作简单、稳定性好,具有很好的应用前景,本发明方法的推广应用将对软枣猕猴桃人工培育产业的发展产生积极地推动作用。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
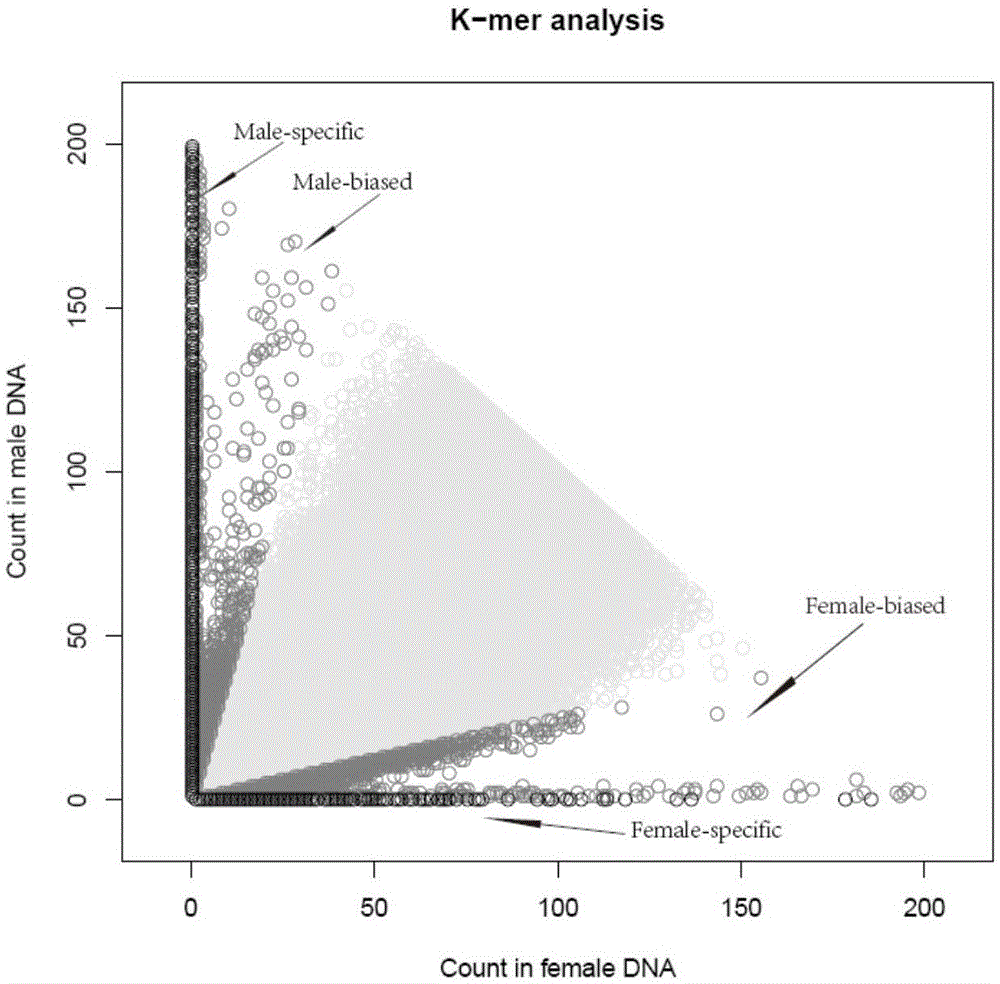
图1为雄性混池和雌性混池特异的kmer分布图。
图2为利用本发明分子标记进行软枣猕猴桃性别鉴定结果图。
图3为退火温度为67℃时利用smy1标记进行软枣猕猴桃性别鉴定结果图。
图4为退火温度为67℃时利用a001标记进行软枣猕猴桃性别鉴定结果图。
图5为退火温度为65℃时利用a002标记进行软枣猕猴桃性别鉴定结果图。
图6为a001标记在软枣猕猴桃基因组dna中的扩增结果。
图7为a002标记在软枣猕猴桃基因组dna中的扩增结果。
具体实施方式
以下通过特定的具体实例说明本发明的实施方式,本领域技术人员可由本说明书所揭露的内容轻易地了解本发明的其他优点与功效。本发明还可以通过另外不同的具体实施方式加以实施或应用,本说明书中的各项细节也可以基于不同观点与应用,在没有背离本发明的精神下进行各种修饰或改变。
在进一步描述本发明具体实施方式之前,应理解,本发明的保护范围不局限于下述特定的具体实施方案;还应当理解,本发明实施例中使用的术语是为了描述特定的具体实施方案,而不是为了限制本发明的保护范围。
除非另外定义,本发明中使用的所有技术和科学术语与本领域技术人员通常理解的意义相同。除实施例中使用的具体方法、设备、材料外,根据本领域技术人员对现有技术的掌握及本发明的记载,还可以使用与本发明实施例中所述的方法、设备、材料相似或等同的现有技术的任何方法、设备和材料来实现本发明。
实施例1:软枣猕猴桃特异性性别标记引物的开发
(一)利用〔红宝石星(软枣猕猴桃品种)×11-17(软枣雄)〕杂交实生群体雌雄株各15株加2个雌雄株亲本,提取dna建立bsa混池;应用illuminahiseq测序技术平台进行测序,进行生物信息学分析,包括基因组组装和与参考基因组比对统计、snp检测与注释、smallindel检测与注释,进行性别决定基因关联分析并开发引物序列。
测序共获得31gbp的rawdata,过滤后得到的cleandata为30gbp,q30达到92.67%,平均每个个体测序深度为15x。样品与参考基因组平均比对率为87.42%,平均覆盖深度为15x,基因组覆盖度为74.81%(至少覆盖1x)。
2个样品与参考基因组之间共获得约2510个snp,698个indel,r01获得47917、r02获得54913个sv变异。样品与参考基因组之间检测发生snp非同义突变、indel突变、sv的基因,并对dna水平变异的基因进行了kegg、go、cog、nr、swissprot数据库注释。
(二)性别决定基因关联分析并开发引物序列
(1)性别特异kmer(片段)分析
为了获取性别相关候选reads,我们通过perl脚本先对雄性和雌性混池做质量过滤,得到高质量的序列。然后对所得高质量序列进行kmer分析,拿到候选的性别特异reads,为下步组装做准备。两个混池的序列都以35kmer进行切割,我们选取了以“ag”开头的kmer,从而降低kmer总数,以达到在不影响性别鉴定准确率的前提下,优化计算速度,缩短分析时间周期的目的。
下一步,计算每个kmer在雄性混池和雌性混池的频率,并根据两混池的频率总和进行过滤,如果雄性混池+雌性混池的最低频率大于2同时小于200,该kmer将留下来,进行性别特异reads的鉴定。
得到满足以上过滤条件的kmer后,比较雄性混池和雌性混池的每个kmer频率,如果该kmer在雌性混池的频率为0,即可作为雄性混池特异的kmer保留下来,附图1显示了雄性混池和雌性混池特异的kmer分布情况,最后得到一个雄性混池特异性kmer库,将与该库对应的雄性混池双端reads提取出来,留作后续的组装。
(2)候选雄性特异的原始数据
通过第一步的分析,得到了14,052,363条reads作为候选的雄性特异的双端测序数据。
(3)候选雄性特异序列组装
利用saopdenovo2软件对上述候选雄性特异双端测序数据进行组装,该软件采用默认参数,最终组装得到5786条序列。但是从附图2的male-biased和female-biased可看出,雄性特异kmer对应的reads在雌性混池中也可能存在,也就是说,组装获得的5786条序列中既包含雄性特异的序列又包含非特异的序列,因此需要进行进一步过滤。
(4)雄性特异序列鉴定
通过bowtie比对(不允许有错配),分别将雄性混池和雌性混池的原始reads比对到步骤3所得到的组装序列中,分析两混池reads的比对情况,我们可以将组装序列分为两部分:雄性特异序列和待鉴定序列。如果组装序列在雄性混池中有测序深度,而在雌性混池中无任何的比对数据,则该序列是雄性特异序列,不符合该条件的统称为待鉴定序列,结果得到19对雄性特异序列。
(5)雄性特异基因预测及其功能注释
对这38条雄性特异序列进行基因预测,通过augustus基因预测软件的网页版分析,得到9个基因。最后,对这9个基因进行nr、cog、go、pfam、trembl和swissprot注释。
(三)根据雄性特异基因设计引物,进行pcr验证
根据测序所得的9条雄性特异序列,分别设计9对引物,1%琼脂糖凝胶电泳检测pcr产物。在pcr验证建库群体及其他野生自然群体95株以后,确定开发引物的适用性。
测序得到9条雄性特异片段,分别对应9对引物。从所有9对引物中筛选获得了2对引物,具有雄性特异性,分别是primer5.1和primer11;其余7对引物中,引物primer1.1、primer2.2及primer6.1未扩增出任何清晰的条带;引物primer3.1和primer4.1有清晰条带,但无性别特异性。
实施例2:软枣猕猴桃性别早期鉴定方法
(一)软枣猕猴桃叶片基因组dna的提取
(1)采样及保存:取软枣猕猴桃幼嫩叶片,置于液氮中冷冻之后,保存于-80℃冰箱。
(2)叶片基因组dna的提取及保存:取冷冻叶片组织100~200mg,装入放有1粒钢珠的2mlep管中,再次于液氮中冷冻,用磨样机研磨至细粉状。使用北京普乐海生物科技有限公司生产的植物基因组dna快速提取试剂盒(全称:dh08ctab植物基因组dna快速提取试剂盒),ctab法提取样品基因组dna,具体提取步骤按照试剂盒说明进行。将模板dna浓度稀释至20ng/μl,保存于-20℃冰箱中备用。
(3)主要仪器型号:
离心机为eppendorfcentrifuge5810r型;
微量紫外分光光度计为nanodrop1000型;
凝胶成像系统为jy04s-3e型(北京君意东方电泳设备有限公司)。
(二)引物序列信息(5′–3′)
正向引物序列:5′–tctcgccatcttcaaccattt–3′,
反向引物序列:5′–atcttggcgtatctcggcttt–3′。
(三)pcr体系(20μl)
使用20μlpcr反应体系含正向和反向引物浓度400nmol·l-1各1μl、ddh2o6μl、pcrmix10μl、20ng/μl模板dna2μl。
试验所用pcrmix生产商为北京康为世纪生物科技有限公司,2×taqpcrmastermix(dye),目录号:cw0682s(1ml)、cw0682m(5ml)、cw0682l(25ml)。
pcr体系组成:
引物f(正向引物)——1μl(浓度为400nmol·l-1);
引物r(反向引物)——1μl(浓度为400nmol·l-1);
ddh2o——6μl;
pcrmix——10μl;
dna模板——2μl(浓度为20ng/μl)。
(四)pcr程序
pcr扩增程序为:94℃预变性5min,94℃30s,65℃退火40s,72℃40s(后三个步骤35个循环),72℃延伸2min,4℃保存20min。
所使用的pcr仪为c1000touchthermalcycler和s1000thermalcycler。
pcr程序:
(五)结果显示
如附图2所示,在雄性样品中出现特异性条带,雌性样品没有条带出现。
(六)新开发标记证明
我们对上述引物扩增产物进行回收并测序,产物长度304bp,序列如下:tctcgccatcttcaaccatttctcctcgcctggttatcctcacgcaaatggtcaagtagacgtcaccgatagaactatcctaagaactctaaaggtgaggttagaaaagtctaagggtgaatgggcataagaccttcagatcatgctatgggattaccacacgacaagcagaattcctacaggtgagatgccgtattctatggtatataggacagaatcaatcatacttgtggagataggaatgccgagcttcaagacctcaaattttgacaaggagaacaacaaagccgagatacgccaagat.
将上述序列在gene-bank中进行blast分析,未得到相似序列,说明是一条全新的标记引物。
对比例:现有猕猴桃性别标记在软枣猕猴桃上的应用检测
(一)引物来源及信息
smx及smy1标记引物参考gill等的方法;a001、a002及a003标记引物参考张琼等的方法。所用引物均由上海生工生物工程有限公司合成,具体引物信息见下表1。
表1本研究所用的5个猕猴桃性别标记引物信息
(二)smx、smy1、a001、a002及a003性别标记在软枣猕猴桃中的通用性验证
在预实验阶段,我们利用参考文献中的pcr条件,以上述5个分子标记为引物,以16株软枣猕猴桃(雌性8株,雄性8株)的dna样品为模板,所得产物中均未发现性别特异条带。
因此,为了更好地验证其通用性,进行了体系优化试验。选择6个雄性样品和6个雌性样品dna作为模板进行体系优化试验,筛选合适的退火温度,优化试验的体系和程序如下:
(1)使用20μl反应体系,含10μl1×taqpcrmastermix(dye)、正向和反向引物各400nmol·l-1、20ng模板dna;
(2)pcr扩增程序为:94℃预变性5min,94℃30s,52℃~68℃(分别是52℃、53.1℃、55.2℃、58.2℃、61.9℃、64.9℃、67℃和68℃)30s,72℃40s,35个循环,最后72℃2min;
(3)pcr扩增产物采用1%琼脂糖凝胶电泳及8%聚丙烯酰胺凝胶电泳检测,以每个标记所对应的产物中多态性条带清晰、长度一致为合适退火温度的检测依据;
(4)使用合适的退火温度验证各个标记在其他软枣猕猴桃样品中的通用性。
(三)验证结果
(1)smx、smy1标记在已知性别软枣猕猴桃样品中的体系优化和性别鉴定通用性验证
利用12份软枣猕猴桃样品基因组dna进行smy1和smx标记的体系优化试验,结果显示:
smy1标记在软枣猕猴桃基因组dna中扩增最适退火温度为67℃,见附图3,且扩增出的片段长度分别为400bp左右和200bp左右,明显小于参考文献中smy1的产物片段长度(参考文献中,该引物的产物长度为770bp);而退火温度低于64.9℃时则不能有效扩增出多态性片段。
smx标记在利用6个雄性样品和6个雌性样品为材料的初步验证试验中,smx标记的扩增结果未在任何一个样品中扩增出清晰并且一致的条带,多态性表现差,无性别特异性,因此没有继续扩大样本验证。
(2)a001、a002和a003标记在已知性别软枣猕猴桃样品中的体系优化和性别鉴定通用性验证
利用软枣猕猴桃6个雄性样品和6个雌性样品设计试验,进行a001、a002和a003三个标记的扩增体系优化。
a001标记在软枣猕猴桃中的最适退火温度为67℃,如附图4所示,退火温度为67℃时,扩增产物中出现两条多态性片段,但并没有表现出性别差异;
a002标记在软枣猕猴桃中的最适退火温度在65℃,如附图5所示,退火温度为65℃时,得到一条清晰的多态性条带,且在6个雌性样品中,有两个样品没有条带出现;
a003标记扩增产物中,未检测出任何清晰的多态性条带,故在进一步的验证试验中,仅利用标记a001和a002进行验证,放弃使用a003。
分别利用29个雄性样品和35个雌性样品对a001和a002两个标记在软枣猕猴桃中的通用性进行进一步验证,附图6和附图7显示了两个标记在部分样品基因组dna中的扩增结果。结果显示:a001和a002的扩增产物中,均有多态性片段出现,但两个标记对软枣猕猴桃种质资源都没有表现出性别特异性。
以上对本发明优选的具体实施方式和实施例作了详细说明,但是本发明并不限于上述实施方式和实施例,在本领域技术人员所具备的知识范围内,还可以在不脱离本发明构思的前提下作出各种变化。
sequencelisting
<110>中国农业科学院郑州果树研究所
<120>软枣猕猴桃幼苗性别早期鉴定分子标记及其应用
<130>2019
<160>3
<170>patentinversion3.3
<210>1
<211>21
<212>dna
<213>人工序列
<400>1
tctcgccatcttcaaccattt21
<210>2
<211>21
<212>dna
<213>人工序列
<400>2
atcttggcgtatctcggcttt21
<210>3
<211>304
<212>dna
<213>人工序列
<400>3
tctcgccatcttcaaccatttctcctcgcctggttatcctcacgcaaatggtcaagtaga60
cgtcaccgatagaactatcctaagaactctaaaggtgaggttagaaaagtctaagggtga120
atgggcataagaccttcagatcatgctatgggattaccacacgacaagcagaattcctac180
aggtgagatgccgtattctatggtatataggacagaatcaatcatacttgtggagatagg240
aatgccgagcttcaagacctcaaattttgacaaggagaacaacaaagccgagatacgcca300
agat304
- 还没有人留言评论。精彩留言会获得点赞!