苯甲酸类化合物及其制备方法和应用与流程
本发明涉及新型苯甲酸类化合物,涉及其在预防和治疗或缓解脑缺血或急慢性心肌梗死后缺血疾病方面的应用,本发明也涉及其在预防和治疗或缓解渐冻症或渐冻人症(肌萎缩性脊髓侧索硬化症,amyotrophiclateralsclerosis,als)方面的应用,属药物化学领域。
背景技术:
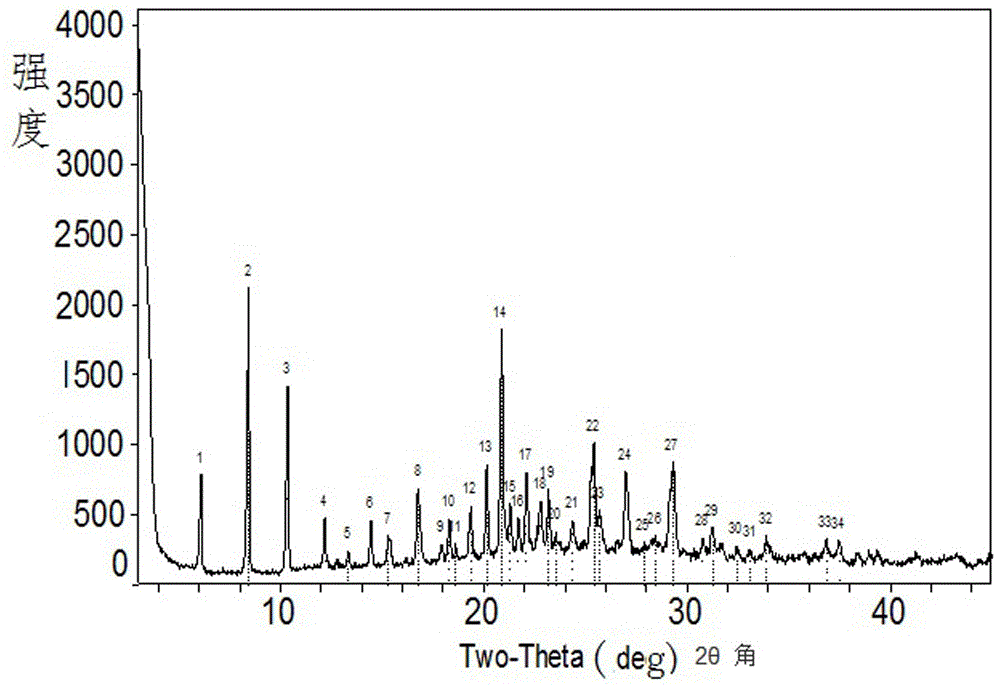
:心脑血管疾病尤其是冠状动脉粥样硬化以及由此导致的缺血性心脑疾病目前仍为严重困扰人类健康的常见疾病。据不完全统计,全球每年心脑血管疾病的死亡人数占总死亡人数的30%,其中缺血性心脑疾病占40%以上。中国有脑卒中病人约700万人,心梗病人约200万人。随着人们生活水平的提高,其发病率和死亡率均呈上升趋势。尽管目前临床上通过溶栓,冠脉搭桥,经皮冠状动脉介入技术等手段可显著缓解缺血性心脑细胞损伤,但是由急性心梗和脑梗所致的心脑细胞死亡,仍然严重影响疾病的愈后,导致死亡率增高。丁苯酞是目前批准上市的治疗脑卒中的药物。常俊标等人对其进行了结构改进,疗效显著提高。其中,候选药物bzp(结构式a)正在临床试验中(200810230890.x)。丁苯酞的代谢研究结果表明(x.diao,drugmetabdispos2013,41,430),侧链的终端两个碳极容易被p450氧化,丁苯酞在人体内代谢产物的分布如下所示),成人口服丁苯酞200毫克后1小时,其代谢产物m3-2,m2,m5-2的总和是有效药物nbp的16倍。因此,在末端两碳作进一步的改进,将很可能发现更有效的治疗心脑缺血相关疾病的药物。用丁苯酞治疗渐冻症的临床试验目前正在美国进行。技术实现要素:本发明的目的之一是通过对丁苯酞和bzp的末端结构改进,提供新一代苯甲酸类化合物,用于治疗脑梗或心肌缺血性以及渐冻症等疾病。其氘代类似物和其前药也包括在本发明范围内。为实现本发明目的,本发明对丁苯酞和bzp的末端结构改进,合成了一系列新型bzp衍生物。本发明提供的新型苯甲酸类化合物,具有式i或其盐ii结构:其中,x是h,i,br,cl,f,cn,氨基及其衍生物;在苯环上单取代;r1是c2-10的烷基,取代c2-10烷基,正丁烷基除外;m是有机胺离子或金属离子。优选:x是h,i,br,cl,f,cn,氨基;r1是c3-5的烷基,环丙烷取代的c3-5烷基,氟取代的c3-5烷基,正丁烷基除外;m是k、na、ca、zn或mg离子。更优选:x是br或f;r1是c3-5的烷基,环丙烷取代的c3-5的烷基,氟取代的c3-5烷基,正丁烷基除外;m是k、na或ca离子。本发明化合物i和ii中的r1取代基,更优先选择如下结构:本发明所述新型苯甲酸类化合物优选具有式iii-x化合物:x是br,f;m是k、na、ca、zn或mg离子。本发明进一步提供化合物i-x用于制备预防、治疗和缓解脑缺血疾病的药物。本发明更进一步提供化合物i-x用于制备预防、治疗和缓解心肌缺血疾病的药物。本发明更进一步提供化合物i-x用于制备预防、治疗和缓解渐冻症的药物。化合物i-x的氘代类似物也包括在本发明范围内。本发明更进一步提供化合物i-x的制备方法如下:化合物1在aibn(偶氮二异丁腈)存在下用nbs(n-溴代琥珀酰亚胺)溴化得到化合物2。不经纯化,化合物2在水中加热水解生成化合物3。化合物3与相应的格氏试剂反应得到内酯4。接着用碱水解生成盐5。本发明有益效果:1、动物实验结果表明,本发明合成的新化合物对脑缺血再灌注损伤均具有明显的保护作用。bzp和化合物14-16都对脑缺血再灌注后脑血流量恢复有显著作用,尤其化合物15(恢复到术前的95.6%)对恢复脑血流量的作用比bzp的更明显。新合成的化合物都显著降低脑缺血梗死面积,减轻脑细胞损伤,尤其是化合物15对脑缺血后脑梗死面积形成的抑制作用(抑制率为75.3%)是丁苯酞钾(26.4%)的三倍。2、人肝微粒体中的体外稳定性试验表明,化合物15在其中的半衰期(t1/2)是19.09小时,显著长于bzp的4.17小时和丁苯酞钾的小于1小时。3、小鼠急性毒性试验结果表明,化合物15的毒性较丁苯酞钾和bzp的显著降低,其半数致死剂量达到1036毫克,大大高于丁苯酞钾的373毫克和bzp的330毫克。4、化合物15和其钙盐17的药效、生物稳定性和毒性都相当。5、本发明发现,化合物5盐的类型极大地影响其物理性质。钠盐化合物15很难得到结晶,空气中极易吸水。而且,反应中过量的碱(naoh)无法除去,这一方面影响产品的纯度,另一方面,过剩的碱导致分子内的羟基与氟原子发生闭环反应。用氢氧化钾开环化合物12得到的钾盐得不到固体。而钙盐化合物17很容易从水溶液中结晶析出,有容易制备、不吸水、适合大规模生产的特点。所以,本发明中的钾盐和钠盐不易得到高纯度的产品,不利大规模生产。所以下列化合物也都包括在本发明之内。因此,本发明有望用于治疗脑梗或心肌缺血性疾病和渐冻症药物的开发。附图说明图1为本发明化合物17晶型a的x射线粉末衍射(xrpd)图谱。具体实施方式下面的实施例可以帮助本领域的技术人员更全面的理解本发明,但不以任何方式限制本发明。实施例1:化合物8的制备将原料6(2.0g,9.39mmol)和nbs(n-溴代琥珀酰亚胺)(1.84g,1.5mmol),aibn(偶氮二异丁腈)(154mg,0.94mmol)加入到四氯化碳(30ml)中。反应混合物回流2h,冷却至室温,过滤。蒸去溶剂得到化合物7。加入水(10ml)后回流1h,冷却,加入etoac(200ml)萃取,有机相用饱和食盐水洗,无水硫酸钠干燥,过滤,蒸去溶剂得到化合物8(2.05g,95%),不经纯化直接用于下一步反应。实施例2:化合物10的制备将镁条(0.63g,26.22mmol)加入到三口瓶中,加入干燥的thf(四氢呋喃)(20ml)和一粒碘,在氮气保护,50℃逐渐滴加4-溴-1-丁烯(2.95g,21.83mmol)的thf(2ml)溶液引发反应,滴加完毕后回流反应2h。将化合物8(1.0g,4.37mmol)溶于thf(10ml)中,在氮气保护,0℃滴加新制备的格式试剂,滴加完后升至室温反应2h,在0℃滴加1nhcl淬灭,蒸去thf,加入dcm溶解,加入1nhcl调ph至2,室温反应过夜,加入etoac(100ml),分离出有机相,无水硫酸钠干燥,过滤,蒸去溶剂,剩余物用硅胶柱纯化得白色固体化合物9(325mg,28%)。1hnmr(400mhz,cdcl3)δ8.05(d,j=1.7hz,1h),7.81(dd,j=8.1,1.8hz,1h),7.35(d,j=8.1hz,1h),5.84(ddt,j=17.0,10.2,6.6hz,1h),5.48(dd,j=8.3,3.7hz,1h),5.15–5.01(m,2h),2.37–2.20(m,2h),2.18–2.07(m,1h),1.86(dtd,j=14.2,8.5,5.4hz,1h);m/z(es+)(m+h)+=268。在三口瓶中加入干燥的dcm(二氯甲烷)(5ml),在氮气保护下加入1.0m的二乙基锌的正己烷溶液(2.4ml,2.4mmol)冷却至-10℃,缓慢滴加三氟乙酸(277mg,2.4mmol)的dcm(5ml)溶液,加完后反应20min,缓慢滴加二碘甲烷(652mg,2.4mmol)的dcm(5ml)溶液,滴加完后反应20min,缓慢滴加化合物9(50mg,0.19mmol)的dcm(5ml)溶液,滴加完后升至室温,反应2-3h,在0℃下滴加饱和氯化铵溶液淬灭,萃取,分离有机相,有机相用无水硫酸钠干燥,过滤,蒸去溶剂,剩余物经硅胶柱层析纯化得化合物10白色固体(45mg,86%)。1hnmr(400mhz,cdcl3)δ8.04(d,j=1.3hz,1h),7.80(dd,j=8.1,1.7hz,1h),7.35(d,j=8.1hz,1h),5.53(dd,j=8.2,3.9hz,1h),2.23–2.11(m,1h),1.86(dtd,j=14.3,8.5,5.6hz,1h),1.47–1.31(m,2h),0.78–0.63(m,1h),0.54–0.39(m,2h),0.18–0.03(m,2h);m/z(es+)(m+h)+=282。实施例3:化合物12的制备将镁条(125mg,5.22mmol)加入到三口瓶中,加入干燥的thf(5ml)和一粒碘,在氮气保护,加热条件下逐渐滴加(4-溴丁氧基)(叔丁基)二甲基硅烷(1.16g,4.35mmol)的thf(4ml)溶液引发反应,滴加完毕,回流反应2h得到格式试剂。将化合物8(200mg,0.87mmol)溶于thf(5ml)中,在氮气保护下,0℃滴加新制备的格式试剂,滴加完毕升至室温反应2h,在0℃滴加1nhcl淬灭,蒸去thf,加入dcm(50ml)溶解,加1nhcl调ph至2,室温反应过夜,萃取,分离出有机相,无水硫酸钠干燥,过滤,蒸去溶剂,剩余物经硅胶柱层析纯化得化合物11白色固体(45mg,18%)。1hnmr(400mhz,cdcl3)δ8.02(d,j=1.7hz,1h),7.78(dd,j=8.1,1.8hz,1h),7.33(d,j=8.1hz,1h),5.45(dd,j=7.8,4.0hz,1h),3.68–3.62(m,2h),2.54(s,1h),2.15–2.05(m,1h),1.84–1.72(m,1h),1.69–1.46(m,4h)。将化合物11(45mg,0.16mmol)溶于dcm(3ml),冷却至-78℃,氮气保护下,缓慢滴加dast(二乙胺基三氟化硫)(77mg,0.48mmol)的dcm(3ml)溶液,滴加完后升至室温反应2h,加水淬灭,萃取,分离出有机相,有机相用无水硫酸钠干燥,过滤,蒸去溶剂,剩余物经硅胶柱层析纯化得化合物12白色固体(26mg,58%)。1hnmr(400mhz,cdcl3)δ8.05(d,j=1.6hz,1h),7.82(dd,j=8.1,1.7hz,1h),7.35(d,j=8.1hz,1h),5.48(dd,j=7.9,3.9hz,1h),4.53(tt,j=5.4,2.7hz,1h),4.42(tt,j=5.4,2.7hz,1h),2.18–2.06(m,1h),1.85–1.71(m,3h),1.69–1.59(m,2h)。19fnmr(376mhz,dmso)δ-218.60。m/z(es+)(m-h)+=286。实施例4:化合物13的制备将镁条(151mg,6.29mmol)加入到三口瓶中,加入干燥的thf(5ml)和一粒碘,在氮气保护,加热条件下逐渐滴加1-溴-4,4,4-三氟丁烷(1.0g,5.24mmol)的thf(2ml)溶液引发反应,滴加完毕,回流反应2h。化合物8(240mg,1.05mmol)溶于thf(5ml)溶液中,在氮气保护下,0℃滴加新制备的格式试剂,滴加完后升至室温反应2h,在0℃下滴加1nhcl淬灭,蒸去thf,加入dcm(20ml),加1nhcl调ph至2,室温反应过夜,萃取,分离出有机相,无水硫酸钠干燥,过滤,蒸去溶剂,剩余物经硅胶柱层析纯化得化合物13白色固体(110mg,33%)。1hnmr(400mhz,cdcl3)δ8.06(s,1h),7.83(dd,j=8.1,1.7hz,1h),7.35(d,j=8.1hz,1h),5.47(dd,j=7.2,3.6hz,1h),2.26–2.14(m,3h),1.87–1.73(m,3h)。19fnmr(376mhz,dmso)δ-66.12。m/z(es+)(m+h)+=324。实施例5:化合物14的制备将化合物10(30mg,0.11mmol)溶于meoh/h2o(4ml,1:1)溶液中,加入naoh(8.6mg,0.21mmol)在50℃搅拌5h。蒸去溶剂,多次加入乙醚带干。剩余产物加入乙醚溶解,过滤,滤液0℃放置过夜,有大量产物析出,过滤,得化合物14白色固体(19mg,59%)。1hnmr(400mhz,dmso)δ7.89(d,j=7.4hz,1h),7.79(s,1h),7.36(d,j=7.8hz,1h),7.12(d,j=8.1hz,1h),4.54(d,j=5.9hz,1h),1.87–1.61(m,2h),1.23(s,1h),1.11–0.97(m,1h),0.63(s,1h),0.33(d,j=7.3hz,2h),-0.06(s,2h);m/z(es+)(m-na)-=297。实施例6:化合物15的制备将化合物12(93mg,0.33mmol)溶于meoh/h2o(11ml,1:1)溶液中,加入naoh(26mg,0.65mmol),在50℃搅拌5h。蒸去溶剂,多次加入乙醚带干。得化合物15乳白色固体(93mg,95%)。1hnmr(400mhz,dmso)δ8.12(d,j=8.0hz,1h),7.77(s,1h),7.35(d,j=8.1hz,1h),7.12(d,j=8.1hz,1h),4.57–4.40(m,2h),4.35(dd,j=14.9,8.9hz,1h),1.69–1.53(m,4h),1.49–1.35(m,1h),1.22(d,j=9.5hz,1h);19fnmr(376mhz,dmso)δ-216.41。m/z(es+)(m-na)-=303。实施例7:化合物16的制备将化合物13(100mg,0.31mmol)溶于meoh/h2o(10ml,1:1)溶液中,加入naoh(25mg,0.62mmol),在50℃搅拌5h。蒸去溶剂,多次加入乙醚带干。浓缩后的产物加入乙醚过滤,溶液低温放置过夜,有大量产物析出,过滤,得化合物16白色固体(50mg,44%)。m/z(es+)(m-na)-=339。实施例8:化合物17的制备将化合物12(5.0g,17.4mmol,1.0eq)溶于50ml甲醇中,加入naoh(870.7mg,20.9mmol,1.2eq),在70℃搅拌4h。旋干即得白色固体钠盐,加入50ml水,用1mhoac调节至ph为7-8,60℃下滴加用25ml水溶解的一水合醋酸钙(1.57g,8.7mmol,0.5eq),滴数滴有固体析出,停止滴加,搅拌20分钟,将剩余溶液滴加进去,搅拌1h,室温冷却,过滤,水洗,甲醇洗,乙醚洗,真空干燥得化合物17白色固体5.32g,产率97%。1hnmr(400mhz,dmso)δ7.88(d,j=1.9hz,2h),7.44(dd,j=8.2,2.2hz,2h),7.28(d,j=8.2hz,2h),6.88(brs,2h),4.89(s,2h),4.44(t,j=6.0hz,2h),4.32(t,j=6.0hz,2h),1.69-1.54(m,8h),1.49-1.39(m,2h),1.33-1.22(m,2h);19fnmr(376mhz,dmso)δ-216.3;m/z(esi)[m-na]-=303。化合物17的稳定晶体形式为晶型a,使用cu-kα辐射,所述晶体形式的x射线粉末衍射(xrpd)在衍射角2θ为6.10,8.43,10.36,12.18,13.34,14.46,15.30,16.77,17.93,18.31,18.60,19.36,20.16,20.88,21.30,21.70,22.10,22.81,23.18,23.57,24.37。处有特征峰,其中2θ值误差范围为±0.2(见图1)。化合物17的稳定晶体形式为晶型a在下列特征峰衍射角2θ处具有特征峰及其相对强度(%):实施例9:动物药效实验实验材料和方法1.实验过程1.1.动物适应:动物到达设施后,将其饲养于严格控制环境条件的动物饲养间中,饲养间的温度维持在20~24℃,湿度30~70%。通过温湿度计对饲养间的温度和湿度进行实时监控,并且每天对温度和湿度记录两次(上午和下午各1次)。动物饲养间的采光由一个电子定时开灯系统来控制,每天开灯12小时关灯12小时(7:00am点开灯,19:00pm关灯)。1.2.实验过程:雄性sd大鼠,适应5-7天后开始实验,手术开始时体重200~250g左右。实验当天,大鼠用10%水合氯醛0.35ml/100g腹腔注射麻醉后,将大鼠固定于保温装置的手术台,分离颈总动脉,至颈外动脉和颈内动脉分叉处,小心分离颈外动脉,使用灭菌的mcao专用拴线,经颈外动脉插入颈内动脉,插入线栓直到线栓标记处(约18mm±0.5mm),拴线头部抵达大脑中动脉起始部,缺血2小时后,将线栓拔出至颈外动脉处,使血流再灌注。其中再灌注后行为学评分<1者将被剔除。手术后将大鼠放于保温毯直至苏醒。24h后,进行神经行为学评分,麻醉后取血,edta-k2抗凝,离心分离上清,-80℃保存。处死大鼠取脑进行ttc染色评价梗死面积。本次实验将分3天完成,每天每组n=3-4只大鼠。1.3.术中监测:分别于术前,缺血后以及再灌注后使用激光多普勒仪记录脑血流量1.4.终点剔除标准:1)脑部未梗死;2)蛛网膜下腔出血1.5.日常监控:自动物抵达设施起,实验人员及兽医进行每日笼边观察,健康状况和体重每周至少监测一次。1.6.分组:本实验总共60只动物,术后随机进行分组。各组情况如下表:1.7.药品配制:精密称取待测药,加入生理盐水溶解,配制浓度为1.5mg/ml。1.8.给药及记录方案:给药前将配置好的药物从4℃冰箱取出,恢复至室温后给药。给药体积为2ml/kg。1.9.终点实验:1.9.1.神经行为学评分:再灌注24h后分别进行神经行为学评分。采用改良longa评分法,共分6个等级,采用0-5分法,0:正常,无神经功能缺损;1分:左侧前爪不能完全伸展,轻度神经功能缺损;2分:行走时,时而向左侧(瘫痪侧)运动;3分:行走时,一直向左侧(瘫痪侧)转圈;4分:向左侧(瘫痪侧)瘫倒;5分:不能自发行走,有意识丧失。1.9.2.脑梗死比例:大鼠co2吸入安乐死/水合氯醛(330mg/kg麻醉),经心脏采血,取大脑放入脑槽行冠状切片(每片2mm),使用1%ttc(1g/100ml)在37℃避光染色15min,染色后脑片拍照后使用imageproplus6.0分析梗死面积比例。梗死区面积/脑总面积为梗死面积比例。1.9.3.收集血浆做进一步检测,-80℃保存。2.数据分析及统计:所有的数据被录入到excel文档中,并以平均值±标准误的方式表示,显著性差异采用单因素方差分析方法加dunnett’s分析进行比较。p值小于0.05被认为有显著性差异,p值小于0.01被认为有极显著性差异。实验结果表1.化合物对脑缺血再灌注大鼠脑血流量的影响组号术后/术前再灌注/术前sham195.7%vehicle216.2%83.6%bzp315.2%91.1%本发明化合物14413.5%88.3%本发明化合物15516.8%95.6%本发明化合物16614.3%89.8%本发明化合物17715.5%95.3%手术过程中,插入线栓后大鼠脑血流量降低70%以上,再灌注后脑血流量恢复,表明tmcao模型成功建立。根据表1数据可见,bzp和化合物14-16都对脑缺血再灌注后脑血流量恢复有显著作用,尤其化合物15、17(恢复到术前的95.6%)对恢复脑血流量的作用比bzp(91.1%)更明显。表2.化合物对脑缺血再灌注大鼠脑梗死面积的影响组号梗死百分比梗死面积抑制率sham10%vehicle252.2%0%丁苯酞钾337.5%26.4%bzp420.6%57.5%本发明化合物15512.0%75.3%本发明化合物17611.8%77.4%根据表2的结果可见,造模后未用药时,梗死面积达到52.2%%,而bzp和化合物15的使用都显著地减少脑缺血再灌注大鼠脑梗死面积,尤其是化合物15,对脑缺血再灌注大鼠脑梗死面积减少的最为显著,降低到12.0%,脑梗死面积显著小于丁苯酞钾的37.5%和bzp的20.2%。钙盐化合物17减少脑缺血再灌注大鼠脑梗死面积的效果与钠盐化合物15相当。本发明的动物实验证明,bzp和化合物14-16均可以改善tmcao引起的脑损伤,其中化合物15效果最好,并与化合物17相当。表1,化合物15使血流量恢复95.6%,而bzp只恢复91.1%。表2,化合物15使脑梗死面积降低到12.0%,而bzp只能降低到20.2%%,丁苯酞钾最差仍有37.5%。使脑血流量恢复和降低脑梗死面积两个方面,本发明化合物15比bzp和丁苯酞两者更优。化合物17是化合物15的钙盐,两者的药效相当。实施例10:人微粒体中稳定性1实验材料1.1药品与试剂受试物bzp和化合物15,纯度97%以上,由河南美泰宝生物制药有限公司制备并提供。内标phpb;磷酸二氢钾和磷酸氢二钾为分析纯,购自生工生物工程(上海)有限公司;人肝微粒体(hlm)购自上海瑞德肝脏疾病研究中心;甲醇为质谱纯,购自fisher公司;乙酸铵为分析纯,购自国药集团化学试剂有限公司;1.2仪器与设备accela液相色谱系统,美国thermo公司;tsqquantumultra质谱系统,美国thermo公司;2实验方法2.1样品前处理精密吸取50μl肝微粒体温孵液,依次加入50μl内标溶液、150μl甲醇,于涡旋混合器上涡旋30s混合均匀,13000r·min-1离心5min,小心吸取上清液用0.22μm滤膜过滤,取滤液进样10μl,进行lc/ms/ms分析。2.2人肝微粒体代谢反应1000μl反应系统中丁苯酞系列化合物(2μg/ml)和人肝微粒体(1.0mg/ml)、nadph(2mm)以及磷酸盐缓冲液(100mm,ph=7.4)。甲醇浓度不超过0.1%(v/v)。首先将mtb系列化合物、肝微粒体在磷酸盐缓冲液中37℃水浴下预温孵5min,然后加入nadph启动反应,反应0、5min、10min、20min、30min、40min、60min、120min后,立即取出放入冰浴,并向系统中加入50μl内标和150μl冰冻甲醇终止反应。然后按样品前处理方法处理,进行lc/ms/ms分析。2.3数据处理利用das3.0药代动力学软件将mtb系列化合物在浓度-时间数据进行曲线拟合,计算消除半衰期(t1/2)。3实验结果表3mtb系列化合物在人肝微粒体中的稳定性(t1/2)丁苯酞钾bzp化合物14化合物15化合物17t1/2(h)<14.172.4419.0919.30结果表明,在人肝微粒体中,丁苯酞钾的半衰期小于1小时,bzp为4.17小时,而氟化物15和17的半衰期显著延长,分别达到19.09和19.30小时。可见,氟化物使化合物稳定,完全可以1天用药1次。实施例11:小鼠的急性毒性将药物溶解于水,配成不同的浓度,通过小鼠尾静脉注射,观察死亡率,计算出导致一半用药小鼠死亡的剂量。结果如下(表4):表4mtb系列化合物急性半数致死剂量丁苯酞钾bzp化合物15化合物17t1/2(h)373mg/kg330mg/kg1036mg/kg1100mg/kg结果表明,化合物15和17的毒性相当,都比丁苯酞钾和bzp的显著降低。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1