一种促进拟茎点霉产生大量分生孢子的方法与流程
本发明属于微生物培养技术领域,涉及一种促进拟茎点霉产生大量分生孢子的方法。
背景技术:
拟茎点霉属(phomopsis)属半知菌亚门、腔孢纲、球壳孢目、球壳孢科,其种类多、分布广,有900多个种,大多分布在亚热带、热带。可寄生于70多种不同科的草本和木本植物,引起大量作物的严重病害,同时,该属中部分种也是植物内生真菌,活性次级代谢产物非常丰富,可用于抗菌、抗肿瘤、抗炎等,这些代谢产物有着广泛的应用前景。拟茎点霉属一般产生甲乙两型分生孢子,其中甲型(初生孢子):单孢、直和通常含两个油球,常为椭圆状;乙型(次生孢子):单胞、线形、不含油球、直和一端常为钩状。但不少在寄主植物上未见乙型分生孢子,或在某些条件下不产生乙型或甲型分生孢子。这给鉴定及分类带来一定的难度。由于真菌纯培养条件下的形态特征是真菌分类鉴定的重要手段,因此,研究拟茎点霉的产孢条件优化至关重要。
关于拟茎点霉属的产孢优化条件,国内外已有一些研究发现。louisemorin(1990)在研究旋花拟茎点霉时发现,该菌在大麦粒培养基可形成大量分生孢子[morinl.1990.productionofconidiabyphomopsisconvolvulus.canadianjournalofmicrobiology36(2):86-91]。罗利娟研究8种拟茎点霉纯培养下的产孢条件,发现pda培养基上菌丝生长较快,但形成载孢体较慢。同时此研究也发现光照时间过长会导致载孢体被淹没于菌丝中。
目前,近几年关于拟茎点霉属真菌的产孢优化研究较少。其中产孢条件冗长,培养基组成较复杂,耗时较长,很难同时提高产孢速率及产孢数量,对实验的开展造成一定困难。
技术实现要素:
发明目的:针对现有技术中存在的不足,本发明的目的是提供一种促进拟茎点霉产生大量分生孢子的方法,以期实现由传统pda培养即可实现获得大量分生孢子。
技术方案:为了实现上述发明目的,本发明采用的技术方案为:
一种促进拟茎点霉产生大量分生孢子的方法,步骤如下:
1)采用pda培养基在固体平板上活化拟茎点霉菌种,获得到菌丝体;
2)采用打孔法取步骤1)的菌丝体接种于装有pda培养基的培养皿中,置于黑暗培养箱培养;
3)待拟茎点霉菌丝长满整个培养基,成白色,絮状后,转移至黑光灯下或黑暗培养条件下,继续培养,产生大量分生孢子,总分生孢子产量不小于1.0×1011个/皿。
步骤1)中,将保存于4℃冰箱内拟茎点霉取出,用取菌环挑取0.5cm直径菌块,移入固体平板pda中进行活化,置于25℃黑暗培养箱培养5天,菌丝体铺满整个pda培养基,菌落成白色,絮状。
步骤2)中,采用打孔法,取直径为0.5cm的菌块接种于pda培养基中,置于25℃黑暗培养箱培养5天。
步骤2)中,培养皿为直径为9厘米的塑料皿,培养基的厚度为0.4cm。
步骤3)中,待拟茎点霉菌丝长满整个培养基,成白色,絮状后,转移至黑光灯下,20℃,培养6天。
步骤3)中,在已经产孢子的培养基中加入无菌水3ml浸满整个菌丝体,用无菌枪头将整个菌丝体从培养基中刮下来,通过无菌水溶解,分离出来,重复两至三遍,确保整个培养基菌丝体完全分离出培养基,制备粗孢子液,将滤膜折叠成一侧3层,另一侧1层模式,放入漏斗中,将粗孢子液进行过滤,提取过滤后的孢子液,稀释至合适倍数,用血球计数板计数孢子数。
血球板计数法记录孢子数:取一块洁净干燥的血球计数板,盖上干净的盖玻片,将孢子液震荡均匀后用移液枪吸取10μl菌悬液从血球计数板两槽处滴加菌悬液,待菌悬液浸满计数室,静置5min后镜检计数,在40倍放大倍数下计数,统计分生孢子数量,取平均值。
步骤3)中,黑光处理后于培养皿可见明显的孢子堆,平均孢子堆数量达到109个/皿,每个孢子堆所含孢子数平均达到5.6×109个。
步骤3)中,总分生孢子产量达1.5×1011个/皿,其中甲型孢子数:1.4×1011个/皿,乙型孢子数:1.1×1010个/皿。
有益效果:与现有技术相比,本发明的促进拟茎点霉产生大量分生孢子的方法,以塑料培养皿结合黑光处理条件,使得培养皿可见明显的孢子堆,平均孢子堆数量达到109个/皿,每个孢子堆所含孢子数平均达到5.613×109个,总分生孢子产量达1.502×1011个/皿,其中甲型孢子数(圆球):1.39×1011个/皿,乙型孢子数(杆状):1.12×1010个/皿。产生了大量乙型孢子,可生长速率远远大于以往拟茎点霉的产孢子方法,且实现了基于传统的pda培养方式获得大量分生孢子,具有很好的实用性和先进性。
附图说明
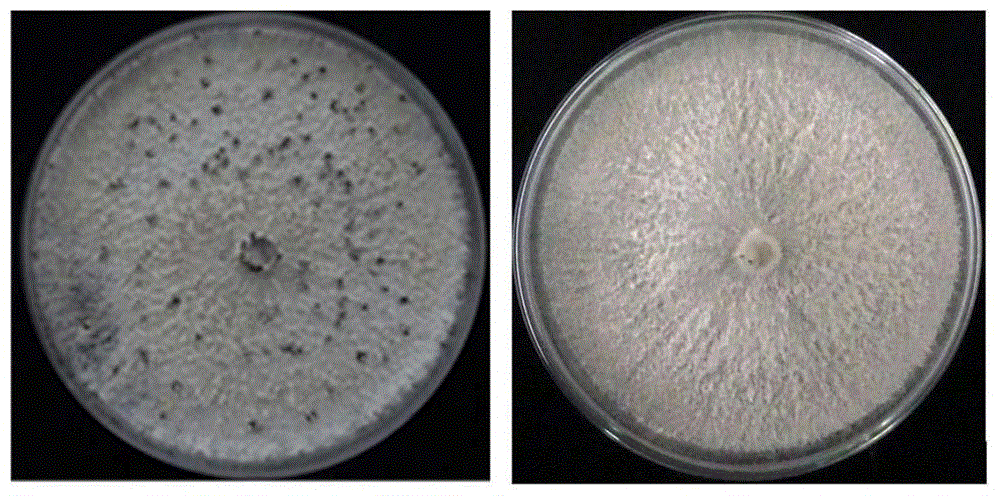
图1是黑光处理后于培养皿可见明显的孢子堆图;左图为黑光条件培养6天,右图为黑暗条件培养6天;
图2是不同培养基厚度培养结果图;左图为0.4cm培养6天,右图为0.6cm培养6天;
图3是不同材料培养皿培养结果图;左图为玻璃材质培养10天,右图为塑料材质培养10天;
图4是不同光照条件培养结果图;左图为日光培养10天,中间图为黑暗培养10天,右图为黑光(近紫外光)培养10天;
具体实施方式
下面结合具体实施例对本发明做进一步的说明。
以下实施例中所使用的pda培养基,配方为:土豆200g,葡萄糖20g,琼脂15~20g,水1000ml,ph值自然。
以下实施例中所使用的拟茎点霉菌种,为[王勇,吴小芹.苏北杨树溃疡病类型及其病原的致病力[j].南京林业大学学报(自然科学版),2008,32(5)]中公开的拟茎点霉(phomopsismacrospore),社会公众可以获得。
实施例1
一种促进拟茎点霉产生大量分生孢子的方法,包括将拟茎点霉菌种活化、固体培养基上得到菌丝体和分生孢子血球计数等步骤,具体过程如下:
1)拟茎点霉菌种活化:将保存于4℃冰箱内拟茎点霉取出,将保存于4℃冰箱内拟茎点霉(phomopsismacrospore)取出,用取菌环挑取0.5cm直径菌块,移入固体平板pda中进行活化,置于25℃黑暗培养箱培养5天,待其菌丝体铺满整个pda培养基,菌落成白色,絮状。则进行下一步实验。
2)将上一步在固体培养基上获得到菌丝体,采用打孔法,取直径为0.5cm的菌块接种于装有pda培养基的培养皿中(培养皿是直径为9厘米的塑料皿,pda培养基的厚度0.4cm),置于25℃黑暗培养箱培养5天。
3)待拟茎点霉菌丝长满整个培养基,成白色,絮状后,转移至黑光灯下,20℃,培养6天。
4)总孢子液的提取:在已经产孢子的培养基中加入无菌水3ml浸满整个菌丝体,用无菌枪头将整个菌丝体从培养基中刮下来,通过无菌水溶解,分离出来,重复两至三遍,确保整个培养基菌丝体完全分离出培养基,制备粗孢子液,将滤膜折叠成一侧3层,另一侧1层模式,放入漏斗中,将粗孢子液进行过滤,提取过滤后的孢子液。稀释至合适倍数,用血球计数板计数孢子数。
5)血球板计数法记录孢子数:取一块洁净干燥的血球计数板,盖上干净的盖玻片,将孢子液震荡均匀后用移液枪吸取10μl菌悬液从血球计数板两槽处滴加菌悬液,待菌悬液浸满计数室,静置5min后镜检计数。在40倍放大倍数下计数,统计分生孢子数量,取平均值。
黑光处理后于培养皿可见明显的孢子堆(图1),平均孢子堆数量达到109个/皿。每个孢子堆所含孢子数平均达到5.613×109个。总分生孢子产量达1.502×1011个/皿,其中甲型孢子数(圆球):1.39×1011个/皿,乙型孢子数(杆状):1.12×1010个/皿。
实施例2
一种促进拟茎点霉产生大量分生孢子的方法,具体步骤如下:
1)拟茎点霉菌种活化:将保存于4℃冰箱内拟茎点霉取出,用取菌环挑取0.5cm直径菌块,移入固体平板pda中进行活化,置于25℃黑暗培养箱培养5天,待其菌丝体铺满整个pda培养基,菌落成白色,絮状。
2)将上一步在固体培养基上获得到菌丝体,采用打孔法,取直径为0.5cm的菌块接种于装有pda培养基的培养皿中,置于25℃黑暗培养箱培养5天;其中,培养皿为直径为9厘米的塑料皿,培养基的厚度为0.4和0.6cm。
3)待拟茎点霉菌丝长满整个培养基,成白色,絮状后,置于25℃黑暗培养箱培养6天。
4)总孢子液的提取:在上述培养基中加入无菌水3ml浸满整个菌丝体,用无菌枪头将整个菌丝体从培养基中刮下来,通过无菌水溶解,分离出来,重复两至三遍,确保整个培养基菌丝体完全分离出培养基,制备粗孢子液,将滤膜折叠成一侧3层,另一侧1层模式,放入漏斗中,将粗孢子液进行过滤,提取过滤后的孢子液。稀释至合适倍数,用血球计数板计数孢子数。
5)血球板计数法记录孢子数:取一块洁净干燥的血球计数板,盖上干净的盖玻片,将孢子液震荡均匀后用移液枪吸取10μl菌悬液从血球计数板两槽处滴加菌悬液,待菌悬液浸满计数室,静置5min后镜检计数。在40倍放大倍数下计数,统计分生孢子数量,取平均值。
0.4cm处理后培养皿见(图2),总分生孢子产量达3.53×1010个/皿,其中甲型孢子数:3.53×1010个/皿,乙型孢子数为:0个/皿。
0.6cm处理后培养皿见的(图2),总分生孢子产量达1.75×1010个/皿,其中甲型孢子数:1.75×1010个/皿,乙型孢子数为:0个/皿。
实施例3
一种促进拟茎点霉产生大量分生孢子的方法,具体步骤如下:
1)拟茎点霉菌种活化:将保存于4℃冰箱内拟茎点霉取出,用取菌环挑取0.5cm直径菌块,移入固体平板pda中进行活化,置于25℃黑暗培养箱培养5天,待其菌丝体铺满整个pda培养基,菌落成白色,絮状。
2)将上一步在固体培养基上获得到菌丝体,采用打孔法,取直径为0.5cm的菌块接种于装有pda培养基的培养皿中,置于25℃黑暗培养箱培养5天;其中,培养皿为直径为9厘米的塑料皿或玻璃皿,pda培养基厚度0.4cm。
3)待拟茎点霉菌丝长满整个培养基,成白色,絮状后,置于25℃黑暗培养箱培养10天。
4)总孢子液的提取:在上述培养基中加入无菌水3ml浸满整个菌丝体,用无菌枪头将整个菌丝体从培养基中刮下来,通过无菌水溶解,分离出来,重复两至三遍,确保整个培养基菌丝体完全分离出培养基,制备粗孢子液,将滤膜折叠成一侧3层,另一侧1层模式,放入漏斗中,将粗孢子液进行过滤,提取过滤后的孢子液。稀释至合适倍数,用血球计数板计数孢子数。
5)血球板计数法记录孢子数:取一块洁净干燥的血球计数板,盖上干净的盖玻片,将孢子液震荡均匀后用移液枪吸取10μl菌悬液从血球计数板两槽处滴加菌悬液,待菌悬液浸满计数室,静置5min后镜检计数。在40倍放大倍数下计数,统计分生孢子数量,取平均值。
塑料培养皿中可见明显的孢子堆(图3),总分生孢子产量达2.75×1010个/皿,其中甲型孢子数:2.50×1010个/皿,乙型孢子数为2.5×109个/皿。
玻璃处理后于培养皿见(图3)总分生孢子产量达6.60×109个/皿,其中甲型孢子数为6.60×109,乙型孢子数:0个。
实施例4
一种促进拟茎点霉产生大量分生孢子的方法,具体步骤同实施例2,其中,步骤2)中的培养皿为塑料培养皿。步骤3)中,分别转移至黑光灯下照射24h/天,黑暗条件下,及白光灯下照射24h/天,培养10天。
黑光处理后培养皿可见(图4)总分生孢子产量达7.33×1011个/皿,其中甲型孢子数:5.62×1011个/皿,乙型孢子数为:1.71×1011个/皿。
黑暗处理后培养皿可见(图4),总分生孢子产量达4.977×1010个/皿,其中甲型孢子数(圆球):4.73×1010个/皿,乙型孢子数为(杆状)2.475×109个/皿。
光照处理后培养皿可见(图4),总分生孢子产量达9.41×109个/皿,其中甲型孢子数:8.08×1010个/皿,乙型孢子数为:1.33×1010个/皿。
- 还没有人留言评论。精彩留言会获得点赞!