一种骨髓来源的破骨细胞培养方法与流程
本发明涉及一种骨髓来源的破骨细胞培养方法,属于细胞培养技术领域。
背景技术:
破骨细胞(osteoclast,oc)是骨吸收的主要功能细胞,在骨发育、生长、修复、重建中具有重要的作用。破骨细胞起源于血系单核-巨噬细胞系统,是一种特殊的终末分化细胞,它可由其单核前体细胞通过多种方式融合形成巨大的多核细胞。破骨细胞是骨疾病研究领域的主要对象。破骨细胞的提取培养是骨疾病研究领域中最常用到的主要实验技术手段之一,如何能高效快捷地得到破骨细胞是进行研究的首要任务。
传统的破骨细胞培养方法为第一天取2只5周龄的icr小鼠股骨和胫骨,用1ml无菌注射器吸取适量的无血清α-mem培养液冲洗出内腔中的骨髓,直至骨髓腔发白。反复吹打成细胞悬液,以100μm细胞筛网过滤至10ml离心管。1200r/min离心5min。弃上清,加入5ml红细胞裂解液,轻轻吹打混匀,在冰上裂解5min,1000r/min离心5min。弃上清,加入5ml含10%fbs的培养基,混匀细胞,1000r/min离心5min。弃上清后加入适量含10%fbs的培养基重悬细胞,吹打均匀并接种于75cm2的培养瓶中,于37℃、体积分数5%co2培育箱中静置培养过夜。第二天收集细胞上清液,置于10ml的离心管中,1200r/min离心5min,弃去上清,加入5ml10%fbs吹打均匀计数,向细胞悬液中加入巨噬细胞集落刺激因子(m-csf)使其终浓度为30ng/ml,将细胞悬液吹打均匀,细胞密度1.8×105/cm2种于96孔板中,每孔100μl。第三天吸弃上清去除不贴壁细胞,加入含30ng/mlm-csf的10%的fbs200μl。第五天吸弃上清,换液,加入含100ng/mlrankl+50ng/mlm-csf的10%fbs200μl。第七天和第九天吸弃上清,换液,加入含100ng/mlrankl+50ng/mlm-csf的10%fbs200μl。第十一天结束实验。
上述技术方案,具有明显不可逾越的缺点:耗时长:需要十一天才能达到效果;效率低:当前的步骤繁琐,消耗精力;使用的诱导因子多,消耗经费;得到的破骨细胞的单核细胞(破骨细胞前体细胞)纯度不高。
因此,研发一种高效的细胞培养方法,缩短培养时间,降低培养成本,增强实验效果,具有广阔的应用前景和巨大的市场价值。
技术实现要素:
针对现有技术的不足及实际的需求,本发明提供一种培养破骨细胞的方法,所述方法创造性地将细胞培养实验时常缩短到五天,有效使破骨细胞纯度更大,从特征形态、标志mrna表达、骨吸收功能方面均有相当甚至更好的效果。具有广阔的应用前景和巨大的市场价值,为细胞培养提供了新的思路和方法。
为达此目的,本发明采用以下技术方案:
一种骨髓来源的破骨细胞培养方法,其特征在于,将已提取的骨髓用分离液处理后获得单核细胞,清洗后将所得的单核细胞加完全培养基和巨噬细胞集落刺激因子(m-csf),接种于96孔板中,于第二天加含有rankl和m-csf培养基培养。
所用完全培养基,是在无血清memalphabasic培养基中添加胎牛血清fbs和分离液双抗溶液制成的。
优选地,所述完全培养基,是在无血清memalphabasic培养基中添加15%胎牛血清fbs和1%分离液双抗溶液制成的。
所述破骨细胞培养方法的步骤如下:
1)在无菌条件下提取小鼠股骨后,利用匀浆冲洗液冲洗出骨髓腔中的骨髓,获得骨髓原液;离心,弃上清,样本稀释液重悬细胞,备用;
2)于5ml玻璃采血管依次小心加入分离液1、分离液2和步骤1)所得细胞悬液,离心;此时离心管中由上至下分为六层,得到第二层为骨髓单核细胞。
3)吸取步骤2)中第二层到10ml离心管中,加入5ml洗涤液,混匀细胞,离心,弃上清;
4)加入5ml清洗液重悬步骤3)所得细胞,离心,弃上清后加入适量含15%fbs的完全培养基重悬细胞,计数,向细胞悬液中加入巨噬细胞集落刺激因子(m-csf),将细胞悬液吹打均匀,种于96孔板中,每孔100μl,进行37℃恒温培养。
5)第二天弃上清,换液,加入含100ng/mlrankl+50ng/mlm-csf的15%fbs280μl。置于37℃恒温培养,于第5天培养完全,结束实验。
优选地,步骤1)离心转速为450g,离心时间为10min;
步骤2)所述分离液1与分离液2体积比为3:1,优选地步骤2)先后加入分离液1:4ml、分离液2:1.33ml,制成梯度界面,每加一层,液面分层一定要清晰;
优选地步骤2)离心需使用水平转子离心机。离心转速为500g,离心时间为30min。
优选地,步骤3)所述离心转速为400g,离心时间为10min。
优选地,步骤4)所述离心转速为250g,离心时间为10min;
优选地,使m-csf终浓度为30ng/ml,96孔板中细胞密度为1.8×105/cm2。
所述具体步骤如下:
1)将5周龄的icr小鼠脱臼处死,置于75%酒精中浸泡5min,于在无菌条件下取小鼠股骨和胫骨,用1ml注射器吸取6ml匀浆冲洗液冲洗出内腔中的骨髓,直至骨髓腔发白。
2)以100μm细胞筛网过滤步骤1)所得细胞悬液至10ml离心管。以450g,离心10min。弃上清,加入0.6ml样本稀释液重悬细胞。
3)取一只5ml玻璃采血管,依次小心加入4ml分离液1、1.33ml分离液2和步骤2)所得细胞悬液,制成梯度界面,每加一层,液面分层一定要清晰。使用水平转子离心机离心30min,转速为500g。此时离心管中由上至下分为六层,得到第二层为骨髓单核细胞。
4)吸取第二层到10ml离心管中,加入5ml洗涤液,混匀细胞。以400g,离心10min。
5)步骤4)离心完全后,弃上清,加入5ml清洗液重悬所得细胞。以250g,离心10min。弃上清后加入适量含15%fbs的完全培养基重悬细胞,向细胞悬液中加入巨噬细胞集落刺激因子(m-csf)使其终浓度为30ng/ml,将细胞悬液吹打均匀,使细胞密度1.8×105/cm2种于96孔板中,每孔100μl,进行37℃恒温培养。
6)第二天将步骤5)培养所得孔板弃上清,换液,加入含100ng/mlrankl+50ng/mlm-csf的15%fbs280μl。置于37℃恒温培养,于第5天培养完全,结束实验。
以上所述任一方法可在制备治疗骨质疏松疾病药物中的应用。
与现有技术相比,本发明具有如下有益效果:
本发明所提供的方法可以简单快速分离出骨髓中的单核细胞且使得到的单核细胞纯度更大,同时不影响破骨细胞的培养效率。
本发明提供的技术方案能显著节约时间,目前能达到五天培养细胞且完成筛药实验,达到事半功倍的效果;简化实验流程,精简实验步骤,可以显著提高效率;节省精力,轻松完成工作;
本发明成本低,用到少量成本昂贵的诱导因子rankl和m-csf,效果显著,得到破骨细胞纯度大,适应高强度的科研工作,为破骨细胞培养提供新的思路和视野,具有广阔的应用前景和巨大的市场价值。
附图说明
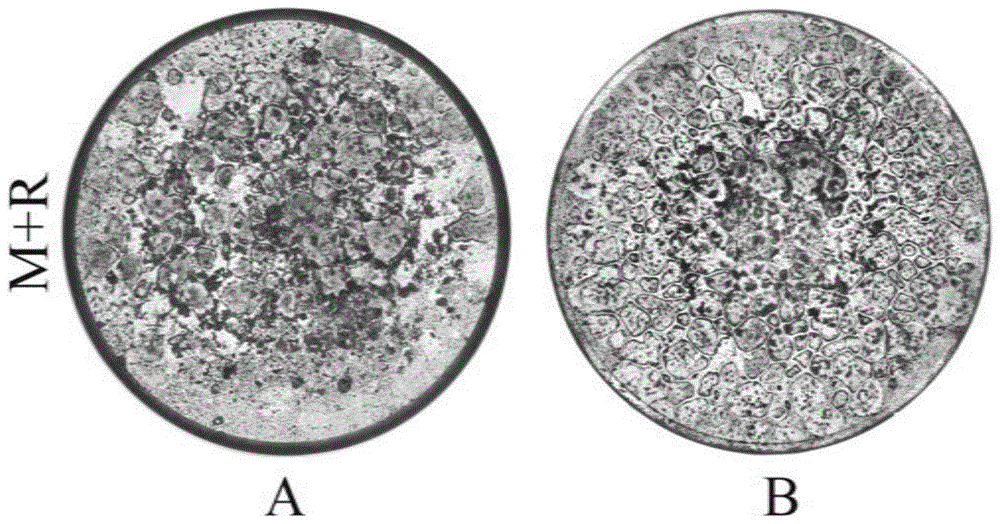
图1为不同方法培养的破骨细胞96孔全景图;
(a,为传统方法,b,为本发明)
图2为不同方法培养的破骨细胞生长面积占96孔全孔面积比图,注:与a组相比:*p<0.05,**p<0.01;
(a,为传统方法,b,为本发明)
图3为不同培养方法酸性磷酸酶活性及破骨细胞数目;注:与空白组相比:*p<0.05,**p<0.01;
(a,为传统方法,b,为本发明)
图4为不同倍镜下不同培养方法骨片侵蚀图
(a,为传统方法,b,为本发明)
图5为不同培养方法骨片扫描电镜图及骨片侵蚀面积比图;注:与空白组相比:*p<0.05,**p<0.01;
(a,为传统方法,b,为本发明)
图6为不同培养方法破骨细胞肌动蛋白环图
(a,为传统方法,b,为本发明)
图7为不同培养方法破骨细胞肌动蛋白环荧光半定量图;注:与空白组相比:*p<0.05,**p<0.01;
(a,为传统方法,b,为本发明)
图8为不同培养方法破骨细胞标志基因mrna水平图;注:与空白组相比:*p<0.05,**p<0.01
(a,为传统方法,b,为本发明)
具体实施方式
以下通过实施例形式对本发明的上述内容再作进一步的详细说明,但不应将此理解为本发明上述主题的范围仅限于以下的实施例,凡基于本发明上述内容所实现的技术均属于本发明的范围。
实施例1:
1.完全培养基的配置
在memalphabasic培养基中添加15%胎牛血清fbs和1%分离液双抗溶液制成的。
2.小鼠骨髓单核细胞的分离与培养
将5周龄的icr小鼠脱臼处死,置于75%酒精中浸泡5min,于在无菌条件下取小鼠股骨和胫骨,用1ml注射器吸取6ml匀浆冲洗液冲洗出内腔中的骨髓,直至骨髓腔发白。以100μm细胞筛网过滤所得细胞悬液至10ml离心管。以450g,离心10min。弃上清,加入0.6ml样本稀释液重悬细胞。取一只5ml玻璃采血管,依次小心加入4ml分离液1、1.33ml分离液2和细胞悬液,制成梯度界面,每加一层,液面分层一定要清晰。使用水平转子离心机离心30min,转速为500g。此时离心管中由上至下分为六层,得到第二层为骨髓单核细胞。吸取第二层到10ml离心管中,加入5ml洗涤液,混匀细胞。以400g,离心10min。弃上清,加入5ml清洗液重悬所得细胞。以250g,离心10min。弃上清后加入适量含15%fbs的完全培养基重悬细胞,向细胞悬液中加入巨噬细胞集落刺激因子(m-csf)使其终浓度为30ng/ml,将细胞悬液吹打均匀,使细胞密度1.8×105/cm2种于96孔板中,每孔100μl。进行37℃恒温培养。
3.破骨细胞的培养
第二天将培养单核细胞弃上清,换液,于孔板中加入含100ng/mlrankl+50ng/mlm-csf的15%fbs280μl。置于37℃恒温培养,于第5天培养完全,结束实验。
实施例2:
1.完全培养基的配置
在memalphabasic培养基中添加10%胎牛血清fbs和1%分离液双抗溶液制成的。
2.小鼠骨髓单核细胞的分离与培养
取2只5周龄的icr小鼠股骨和胫骨,用1ml无菌注射器吸取适量的无血清α-mem培养液冲洗出内腔中的骨髓,直至骨髓腔发白。反复吹打成细胞悬液,以100μm细胞筛网过滤至10ml离心管。1200r/min离心5min。弃上清,加入5ml红细胞裂解液,轻轻吹打混匀,在冰上裂解5min,1000r/min离心5min。弃上清,加入5ml10%的fbs,混匀细胞,1000r/min离心5min。弃上清后加入适量10%的fbs重悬细胞,吹打均匀并接种于75cm2的培养瓶中,于37℃、体积分数5%co2培育箱中静置培养过夜。第二天,收集过夜的培养瓶细胞上清液,置于10ml的离心管中,1200r/min离心5min,弃去上清,加入5ml10%fbs吹打均匀计数,向细胞悬液中加入巨噬细胞集落刺激因子(m-csf)使其终浓度为30ng/ml,将细胞悬液吹打均匀,细胞密度1.8×105/cm2种于96孔板中,每孔100μl。第三天,吸弃上清去除不贴壁细胞,加入含30ng/mlm-csf的10%的fbs200μl。
3.破骨细胞的培养
第五天,单核细胞吸弃上清,换液,于孔板加入含100ng/mlrankl+50ng/mlm-csf的10%fbs200μl。第七天,吸弃上清,换液,加入含100ng/mlrankl+50ng/mlm-csf的10%fbs200μl。第九天,吸弃上清,换液,加入含100ng/mlrankl+50ng/mlm-csf的10%fbs200μl。第十一天,结束实验。
本方法与实施例1的区别在于:实验操作费时费力,需要十一天,步骤繁琐,耗费精力,得到的破骨细胞纯度较小,使用较多昂贵的细胞因子,成本高。
实施例3:
用显微镜axioverta1型倒置显微镜(zeiss)对实施例1和实施例2的96孔板的每孔细胞进行拍摄(50倍),每孔拍摄照片约20张左右,将照片进行拼和,形成整孔的全貌图,如图1所示。(a组为实施例2培养方法,b组为实施例1培养方法)imagej软件计算破骨细胞生长面积与全孔面积之比,a组破骨细胞生长面积占孔板面积的64.56%,b组占88.48%,且b组与a组相比具有显著差异(p<0.01),如图2所示。优化后的培养方式培养的破骨细胞在孔板的生长面积更广,如下图所示,在以相同种板密度所培养的破骨细胞,破骨细胞数目更多,生长更为密集,呈镶嵌状。
实施例4:
按实施例2得到单核细胞,第五天,吸弃上清,换液,于孔板加入含100ng/mlrankl+50ng/mlm-csf和一定浓度淫羊藿苷的10%fbs200μl。第七天,吸弃上清,换液,加入含100ng/mlrankl+50ng/mlm-csf和一定浓度淫羊藿苷的10%fbs200μl。第九天,吸弃上清,换液,加入含100ng/mlrankl+50ng/mlm-csf和一定浓度淫羊藿苷的10%fbs200μl。培养至第十一天,为a组;按实施例1得到单核细胞,第二天将培养单核细胞弃上清,换液,于孔板中加入含100ng/mlrankl+50ng/mlm-csf和一定浓度淫羊藿苷的15%fbs280μl。置于37℃恒温培养至第5天,为b组.如图3,测a组和b组破骨细胞数目和酸性磷酸酶活性。随在0.1-100μmol/l,随着淫羊藿苷浓度的升高破骨细胞数目和酶活性呈现剂量依赖抑制,且b组破骨细胞(0-6.2u/l)比a组酸性磷酸酶活性(0-4.4u/l)更高,数目(0-120左右)比a组(0-50左右)更多,b组酸性磷酸酶活性范围更大也给破骨细胞体外药物给药带来更为精准的浓度。
实施例5:
按实施例2操作方法,从加入诱导因子算起,骨片与破骨细胞细胞一起培养72h,为a组,按实施例1操作方法,为b组。如图4所示,经甲苯胺蓝染色后,被侵蚀的骨陷窝被染成深蓝色,陷窝形状大小不一,呈不规则状,并且相互连接,陷窝颜色越深,其深度越深。给药组吸收陷窝较空白组明显减少,陷窝颜色变浅,陷窝侵蚀深度变浅,说明药物加入后破骨细胞的数目和骨吸收功能被显著抑制。a组和b组空白组培养的破骨细胞均有较好的侵蚀骨片的功能,且给药淫羊藿苷后均能抑制破骨细胞骨吸收的能力。
在500倍下拍得,如图5,扫描电镜照片可以看到a组和b组的骨吸收陷窝呈连珠状,且b组的骨吸陷窝连接更为密集,对骨吸收面积进行半定量,计算骨吸收面积与骨片总面积之比可得,b组的骨吸收率约为93.5%,a组约为63.6%,b组骨吸收率显著高于a组(p<0.01)。a组和b组分别给药淫羊藿苷后,骨吸收陷窝明显减少,且具有显著性差异。
实施例6:
破骨细胞的溶骨作用与含微丝构成的肌动蛋白环的形成关系密切,用ifluortm488标记鬼笔环肽标记肌动蛋白,按实施例4方法分为a,b两组,荧光结果显示a组和b组破骨细胞的肌动蛋白呈环状,通过肌动蛋白环可以观察到破骨细胞形状,两组分别给以淫羊藿苷后,破骨细胞皱缩变小变少,如图6所示。对荧光进行半定量计算破骨细胞的荧光累积光密度,如图7所示,a组和b组的累积荧光光密度无显著性差异,在分别给药后,光密度显著降低(p<0.01)。可见a组和b组的破骨细胞肌动蛋白环无明显区别,在形态与功能结构上b组与a组相似。细胞骨架是一个动态结构,在破骨细胞中尤其活跃,这也是破骨细胞发生迁移、变形发挥骨吸收的基础。
实施例7:
按实施例4方法分为a,b两组,其中a组分为空白组和加淫羊藿组,b组分为空白组和加淫羊藿组,用pcr测定caii、cathepsink、itga5、itgb3、mmp9、rank、trap基因表达如8所示。ctsk为组织蛋白酶k,可以降解骨胶原产生吸收陷窝,反应破骨细胞数量和功能;trap为抗酒石酸酸性磷酸酶,是破骨细胞特异性酶;rank核因子κb受体活化因子,是rankl刺激破骨细胞成熟的唯一靶受体,通过它可直接调控破骨细胞的形成、分化和成熟;成熟的破骨细胞表达整合素,尤以αvβ3对破骨细胞黏附作用最为重要,整合素αvβ3分为两个亚基itga5、itgb3;mmp-9(基质金属蛋白9)可降解细胞外骨基质,在破骨细胞的迁移、侵袭和锚着过程中发挥作用;破骨细胞产酸主要是caii(ii型碳酸酐酶),介导骨吸收。如图8-a所示,a组和b组分别以空白组为对照,给以淫羊藿苷阳性药物后,7个破骨细胞标志基因mrna的水平均显著性降低(p<0.05,p<0.01),如图8-b所示,以a空白组为对照,b组的标志基因mrna的水平均高于a组,且具有显著性差异(p<0.01),尤其是trap和αvβ3mrna的水平,表明b组的破骨细胞各标志基因mrna的水平表达更高。
虽然本发明已以较佳的实施例公开如上,但其并非用以限定本发明,任何熟悉此技术的人,在不脱离本发明的精神和范围内,都可以做各种改动和修饰,因此本发明的保护范围应该以权利要求书所界定的为准。
- 还没有人留言评论。精彩留言会获得点赞!