用于治疗乳腺癌的雌激素受体降解剂的制作方法
本发明涉及某些新颖化合物或其药用盐,它们具有抗癌活性并且因此潜在有用于治疗人体或动物体的方法。本发明还涉及用于制造所述化合物的方法、含有它们的药物组合物以及它们在治疗方法中的用途,例如用于制造供预防或治疗温血动物(如人)的癌症用的药物,包括用于预防或治疗癌症。本发明还涉及为雌激素受体的选择性下调调节剂的化合物。
背景技术:
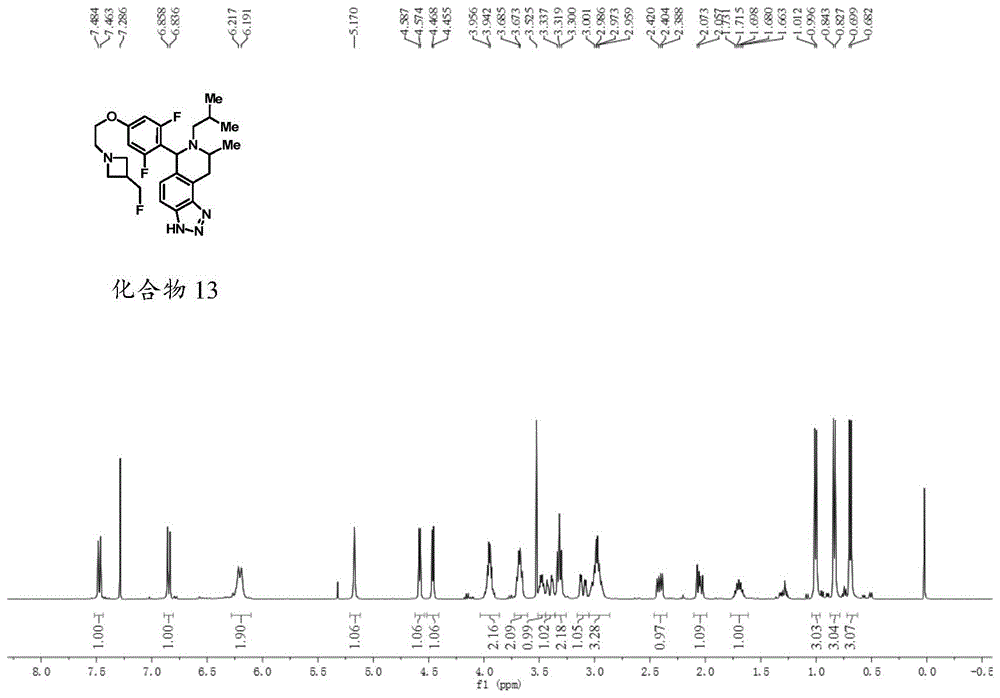
:雌激素受体α(erα、esr1、nr3a)和雌激素受体β(erβ、esr2、nr3b)是类固醇激素受体,这些类固醇激素受体是大的细胞核受体家族的成员。结构类似于所有核受体,erα是由六个功能域(命名为a-f)构成的(达尔曼-赖特(dahlman-wright)等人,《药理学评论》(pharmacol.rev.),2006,58:773-781)并且被分类为配体依赖性转录因子,因为在其与特异性配体(雌性性别类固醇激素17b雌二醇(e2))关联之后该络合物结合至命名为雌激素受体元件(ere)基因组序列中,并且与共调控因子相互作用来调节靶基因的转录。该erα基因位于6q25.1上并且编码595aa蛋白,并且由于替代性剪接和翻译起始位点,可以产生多种同种型。除了dna结合域(结构域c)和配体结合域(结构域e),该受体还包含n-末端(a/b)结构域、连接c和e结构域的铰链(d)结构域、以及c-末端延伸(f结构域)。虽然era和erb的c和e结构域是相当保守的(分别为96%和55%氨基酸一致性),但a/b、d和f结构域的保守性差(低于30%氨基酸一致性)。这两种受体都参与女性生殖道的调节和发育,并且此外在中枢神经系统、心血管系统和在骨代谢中起作用。er的基因组作用发生在细胞的核中,此时该受体直接地(直接激活或经典途径)或间接地(间接激活或非经典途径)结合ere。在不存在配体的情况下,er与热休克蛋白hsp90和hsp70关联,并且该关联的分子伴侣机器稳定配体结合域(lbd),使得其可接近配体。配体化的er从热休克蛋白中解离,导致受体构象变化,从而允许二聚化、dna结合、与共激活物或共阻抑物相互作用并调节目标基因表达。在非经典途径中,ap-1和sp-1是被受体的两种同种型所使用的替代性调控dna序列以调节基因表达。在这个实例中,er不直接与dna相互作用,但通过与其他dna结合转录因子例如c-jun或c-fos相关联(库什纳(kushner)等人,《纯应用化学》(pureappliedchemistry)2003,75:1757-1769)。er影响基因转录的精确机制了解很少,但似乎由dna结合的受体招募的多种核因子介导。共调控因子的募集主要是由两个蛋白表面af2和af1介导的,af2和af1分别位于e-结构域和a/b结构域中。af1是由生长因子调控的并且其活性取决于细胞和启动子环境,然而af2完全依赖于用于活性的配体结合。虽然两个结构域虽然可以独立地发挥作用,最大er转录活性是通过经由两个结构域(祖克曼(tzukerman)等人,《分子内分泌学》(mol.endocrinology),1994,8:21-30)的协同相互作用实现的。虽然er被认为是转录因子,但它们还可通过非基因组机制发挥作用,如通过在e2给予之后在一个时标中于组织中的快速er作用所证明的,该时标对于基因组作用被认为太快。对雌激素的快速作用负责的受体是否是相同的细胞核er或不同的g-蛋白偶联类固醇受体仍不清楚(沃纳(warner)等人,《类固醇》(steroids),2006,71:91-95),但越来越多的e2诱导途径已经被鉴定,例如mapk/erk途径和内皮一氧化氮合酶的活化以及pi3k/akt途径。除了配体依赖性通路,erα还已经显示通过af-1具有配体独立性活性,通过生长因子信号例如胰岛素样生长因子1(igf-1-1)和表皮生长因子(egf),af-1已经与mapk的刺激相关联。af-1的活性依赖于ser118的磷酸并且er与生长因子信号传导之间的交互作用(crosstalk)的实例是通过mapk响应于生长因子如igf-1和egf的ser118的磷酸化(加藤(kato)等人,《科学》(science),1995,270:1491-1494)。大量的结构不同的化合物已经被显示结合至er。一些化合物如内源性配体e2充当受体激动剂,然而其他竞争性地抑制e2结合并且作为受体拮抗剂。这些化合物可以被分成2种类别,取决于它们的功能效应。选择性雌激素受体调节剂(serm)如它莫西芬(它莫西芬)具有充当受体激动剂和拮抗剂两者的能力,取决于细胞和启动子情况连同er同种型靶向。例如它莫西芬在乳腺癌中充当一种拮抗剂,但在骨、心血管系统和子宫中充当部分激动剂。所有serm似乎充当af2拮抗剂并且通过af1派生其部分激动剂特征。第二组,以氟维司群(fulvestrant)作为一个实例,被分类为完全拮抗剂,并且经由af1和af2结构域的完全抑制通过在化合物结合的配体结合域(lbd)中诱导独特构象变化(其导致螺旋12与lbd的其余部分之间的相互作用完全消除,从而阻断辅因子招募)能够阻断雌激素活性(韦克林(wakeling)等人,《癌症研究》(cancerres.),1991,51:3867-3873;派克(pike)等人,《结构》(structure),2001,9:145-153)。erα的细胞内水平在e2的存在下通过泛素/蛋白体(ub/26s)途径来下调。配体化的erα的聚泛素化通过至少三个酶来催化;经泛素-激活酶e1活化的泛素是通过e3泛素连接酶结合异肽经由e2与赖氨酸残基缀合,并且然后聚泛素化的erα被导向蛋白体用于降解。虽然er-依赖性转录调节和er的蛋白体-介导的降解是连接的(纳德(lonard)等人,《分子细胞》(mol.cell),2000,5:939-948),但转录在本身是对erα降解是不需要的,并且转录起始复合物的组装是足以靶向erα用于细胞核蛋白酶体的降解。此e2诱导的降解过程被认为对其能力是所必需的,以响应于用于细胞增殖、分化和代谢的要求而快速激活转录(斯蒂倪恩(stenoien)等人,《分子细胞生物学》(mol.cellbiol.),2001,21:4404-4412)。氟维司群也被划分为选择性雌激素受体下调调节剂(serd)、拮抗剂的子集,这些拮抗剂也可以经由26s蛋白酶体途径诱导erα的快速下调。相反,serm如它莫西芬可以增加erα水平,虽然对转录的作用类似于针对serd所见到的。约70%的乳腺癌表达er和/或孕酮受体,意味着在生长方面这些肿瘤细胞依赖激素。其他癌症如卵巢癌和子宫内膜癌也被认为在生长方面依赖于erα信号传导。用于此类患者的疗法可以通过以下项抑制er信号传导:拮抗配体结合至er,例如它莫西芬,其被用来治疗在绝经前和绝经后两者环境中的早期和晚期er阳性乳腺癌);拮抗和下调erα,例如氟维司群,其被用来治疗女性乳腺癌,尽管进行了用它莫西芬或芳香酶抑制剂的剂疗法,但是其仍进展;抑或阻断雌激素合成,例如芳香酶抑制剂,其被用来治疗早期和晚期er阳性乳腺癌。尽管这些疗法对乳腺癌治疗具有极其阳性影响,但肿瘤表达er的相当大数目的患者展示对存在的er疗法的从头(denovo)抗性或对这些疗法随着时间发展的抗性。已经描述了多种不同机制来解释对第一次它莫西芬治疗的抗性,其主要涉及它莫西芬从充当拮抗剂的转变为充当激动剂,这是通过某些辅因子更低亲和力地结合至通过这些辅因子的过度表达被偏置(off-set)的它莫西芬-erα复合物,抑或通过第二位点的形成,这些第二位点促使它莫西芬-erα复合物与通常不结合到该复合物上的辅因子的相互作用。由于表达特异性辅因子(其驱使它莫西芬-erα活性)的细胞的过度生长的结果抗性因此能够出现。还存在以下可能性,其他生长因子信号传导路径直接激活该er受体或共激活物,以驱使独立于配体信号传导的细胞增殖。最近,在esr1中的突变已经在转移性er-阳性患者衍生的肿瘤样品和患者衍生的异种移植模型(pdx)中在从17%-25%变化的频率下被鉴定为可能的抗性机制。这些突变在导致突变功能蛋白的配体结合结构域中是主要地,但非排他性地;氨基酸变化的实例包括ser463pro、val543glu、leu536arg、tyr537ser、tyr537asn和asp538gly,其中在氨基酸537和538处的变化构成大多数当前描述的变化。这些突变先前在癌症基因组阿特拉斯数据库(cancergenomeatlasdatabase)表征的原发性乳房基因组样品中未检测到。对于er表达阳性的390个原发性乳腺癌样品中在esr1中检测到的不是单突变(癌症基因组阿特拉斯网络,2012自然(nature),490:61-70)。该配体结合结构域突变被认为具有发展为响应于芳香酶抑制剂内分泌疗法的抗性,因为在不存在雌二醇的情况下,这些突变体受体显示出基本的转录活性。在氨基酸537和538处突变的er的晶体结构显示两突变体有利于er的激动剂构象,这是通过位移螺旋12的位置以允许共激活物招募并且由此模仿激动剂活化的野生型er。公开数据已经显示内分泌疗法如它莫西芬和氟维司群仍然可以结合至er突变体并且在某种程度上抑制转录激活,以及氟维司群能够降解try537ser,但可以需要更高剂量用于完全受体抑制(托伊(toy)等人,《自然遗传学》(nat.genetics),2013,45:1439-1445;罗宾逊(robinson)等人,《自然遗传学》,2013,45:144601451;李,s(li,s.)等人《细胞报告》(cellrep.),4,1116-1130(2013))。因此是可行的是某些具有化学式(i)的化合物或其药用盐将能够下调和拮抗突变型er,尽管在此时期未知esr1突变是否与改变的临床结果关联。不管哪个抗性机制或抗性机制的组合机制发生,许多仍然是依赖于er-依赖性活性,并且通过serd机构去除受体提供了从细胞中去除erα受体的最好方式。氟维司群是目前唯一经serd批准用于临床用途的,又尽管其机制特性,该药物的药理学特性具有有限的疗效,这是由于当前每月500mg剂量的限制,其导致与在体外乳腺细胞系实验中所见的受体的完全下调相比在患者样品中的受体小于50%的周转(沃德尔(wardell)等人,《生化药学》(biochem.pharm.),2011,82:122-130)。因此,对新er靶向试剂存在着需要,其具有所需药物特性和serd机制以在早期、转移性和获得性抗性情况下提供增强的益处。技术实现要素:本发明的化合物已发现具有强力抗肿瘤活性,有用于抑制由恶性疾病引起的不受控制的细胞增殖。本发明的这些化合物通过(作为最低限度)充当serd提供抗肿瘤作用。根据本发明的另一个方面,提供式i的化合物及其立体异构体、互变异构体或药用盐:其中:y1为crb或n;y2为-(ch2)-、-(ch2ch2)-或nra;y3为nra或c(rb)2;其中y1、y2和y3中的一个为n或nra;ra选自h、c1-c6烷基、c2-c8烯基、炔丙基、c3-c6环烷基和c3-c6杂环基,所述基团任选取代有一个或多个独立选自以下的基团:f、cl、br、i、cn、oh、och3和so2ch3;rb独立选自h、-o(c1-c3烷基)、c1-c6烷基、c2-c8烯基、炔丙基、-(c1-c6烷二基)-(c3-c6环烷基)、c3-c6环烷基和c3-c6杂环基,所述基团任选取代有一个或多个独立选自以下的基团:f、cl、br、i、cn、-ch2f、-chf2、-cf3、-ch2cf3、-ch2chf2、-ch2ch2f、oh、och3和so2ch3;z1选自crarb、c(o)和键;cy选自c6-c20芳二基、c3-c12碳环二基、c2-c20杂环二基和c1-c20杂芳二基;z2选自o、s、nra、c1-c6烷二基、c1-c6氟烷二基、o-(c1-c6烷二基)、o-(c1-c6氟烷二基)、c(o)和键;r1、r2、r3和r4独立选自h、f、cl、br、i、-cn、-ch3、-ch2ch3、-ch(ch3)2、-ch2ch(ch3)2、-ch2oh、-ch2och3、-ch2ch2oh、-c(ch3)2oh、-ch(oh)ch(ch3)2、-c(ch3)2ch2oh、-ch2ch2so2ch3、-ch2op(o)(oh)2、-ch2f、-chf2、-ch2nh2、-ch2nhso2ch3、-ch2nhch3、-ch2n(ch3)2、-cf3、-ch2cf3、-ch2chf2、-ch(ch3)cn、-c(ch3)2cn、-ch2cn、-co2h、-coch3、-co2ch3、-co2c(ch3)3、-coch(oh)ch3、-conh2、-conhch3、-conhch2ch3、-conhch(ch3)2、-con(ch3)2、-c(ch3)2conh2、-nh2、-nhch3、-n(ch3)2、-nhcoch3、-n(ch3)coch3、-nhs(o)2ch3、-n(ch3)c(ch3)2conh2、-n(ch3)ch2ch2s(o)2ch3、-no2、=o、-oh、-och3、-och2ch3、-och2ch2och3、-och2ch2oh、-och2ch2n(ch3)2、-op(o)(oh)2、-s(o)2n(ch3)2、-sch3、-s(o)2ch3、-s(o)3h、环丙基、环丙基酰胺基团、环丁基、氧杂环丁烷基、氮杂环丁烷基、(1-甲基氮杂环丁烷-3-基)氧基、n-甲基-n-氧杂环丁烷-3-基氨基、氮杂环丁烷-1-基甲基、苄基氧基苯基、吡咯烷-1-基、吡咯烷-1-基-甲酮、哌嗪-1-基、吗啉代甲基、吗啉代-甲酮和吗啉代;r5选自h、c1-c9烷基、c3-c9环烷基、c3-c9杂环基、c6-c9芳基、c6-c9杂芳基、-(c1-c6烷二基)-(c3-c9环烷基)、-(c1-c6烷二基)-(c3-c9杂环)、c(o)rb、c(o)nra、so2ra和so2nra,其任选取代有一个或多个卤素、cn、ora、n(ra)2、c1-c9烷基、c3-c9环烷基、c3-c9杂环、c6-c9芳基、c6-c9杂芳基、c(o)rb、c(o)nra、so2ra和so2nra;r6选自h、f、cl、br、i、-cn、-ch3、-ch2ch3、-ch(ch3)2、-ch2ch(ch3)2、-ch2oh、-ch2och3、-ch2ch2oh、-c(ch3)2oh、-ch(oh)ch(ch3)2、-c(ch3)2ch2oh、-ch2ch2so2ch3、-ch2op(o)(oh)2、-ch2f、-chf2、-ch2nh2、-ch2nhso2ch3、-ch2nhch3、-ch2n(ch3)2、-cf3、-ch2cf3、-ch2chf2、-ch2ch2f、-ch(ch3)cn、-c(ch3)2cn、-ch2cn、-co2h、-coch3、-co2ch3、-co2c(ch3)3、-coch(oh)ch3、-conh2、-conhch3、-conhch2ch3、-conhch(ch3)2、-con(ch3)2、-c(ch3)2conh2、-nh2、-nhch3、-n(ch3)2、-nhcoch3、-n(ch3)coch3、-nhs(o)2ch3、-n(ch3)c(ch3)2conh2、-n(ch3)ch2ch2s(o)2ch3、-no2、=o、-oh、-och3、-och2ch3、-och2ch2och3、-och2ch2oh、-och2ch2n(ch3)2、-op(o)(oh)2、-s(o)2n(ch3)2、-sch3、-s(o)2ch3、-s(o)3h、环丙基、环丙基酰胺基团、环丁基、氧杂环丁烷基、氮杂环丁烷基、(1-甲基氮杂环丁烷-3-基)氧基、n-甲基-n-氧杂环丁烷-3-基氨基、氮杂环丁烷-1-基甲基、苄基氧基苯基、吡咯烷-1-基、吡咯烷-1-基-甲酮、哌嗪-1-基、吗啉代甲基、吗啉代-甲酮和吗啉代;且其中所述烷二基、氟烷二基、芳二基、碳环二基、杂环二基和杂芳二基任选取代有一个或多个独立选自以下的基团:f、cl、br、i、-cn、-ch3、-ch2ch3、-ch(ch3)2、-ch2ch(ch3)2、-ch2oh、-ch2och3、-ch2ch2oh、-c(ch3)2oh、-ch(oh)ch(ch3)2、-c(ch3)2ch2oh、-ch2ch2so2ch3、-ch2op(o)(oh)2、-ch2f、-chf2、-cf3、-ch2cf3、-ch2chf2、-ch2ch2f、-ch(ch3)cn、-c(ch3)2cn、-ch2cn、-ch2nh2、-ch2nhso2ch3、-ch2nhch3、-ch2n(ch3)2、-co2h、-coch3、-co2ch3、-co2c(ch3)3、-coch(oh)ch3、-conh2、-conhch3、-con(ch3)2、-c(ch3)2conh2、-nh2、-nhch3、-n(ch3)2、-nhcoch3、-n(ch3)coch3、-nhs(o)2ch3、-n(ch3)c(ch3)2conh2、-n(ch3)ch2ch2s(o)2ch3、-no2、=o、-oh、-och3、-och2ch3、-och2ch2och3、-och2ch2oh、-och2ch2n(ch3)2、-op(o)(oh)2、-s(o)2n(ch3)2、-sch3、-s(o)2ch3、-s(o)3h、环丙基、环丙基酰胺基团、环丁基、氧杂环丁烷基、氮杂环丁烷基、(1-甲基氮杂环丁烷-3-基)氧基、n-甲基-n-氧杂环丁烷-3-基氨基、氮杂环丁烷-1-基甲基、苄基氧基苯基、吡咯烷-1-基、吡咯烷-1-基-甲酮、哌嗪-1-基、吗啉代甲基、吗啉代-甲酮和吗啉代。根据本发明的另一个方面,提供式i的化合物及其立体异构体、互变异构体或药用盐,其中y1为n且y3为c(rb)2。根据本发明的另一个方面,提供式i的化合物及其立体异构体、互变异构体或药用盐,其中ra选自h、c1-c6烷基和c2-c8烯基,所述基团任选取代有一个或多个独立选自以下的基团:f、cl、br、i、cn和oh。根据本发明的另一个方面,提供式i的化合物及其立体异构体、互变异构体或药用盐,其中ra选自h和c1-c6烷基,所述基团任选取代有一个或多个独立选自以下的基团:f、cl、br、i、cn和oh。根据本发明的另一个方面,提供式i的化合物及其立体异构体、互变异构体或药用盐,其中ra为h。根据本发明的另一个方面,提供式i的化合物及其立体异构体、互变异构体或药用盐,其中rb独立选自h、-o(c1-c3烷基)、c1-c6烷基、c2-c8烯基、炔丙基、-(c1-c6烷二基)-(c3-c6环烷基),所述基团任选取代有一个或多个独立选自以下的基团:f、cl、br、i、cn、-ch2f、-chf2、-cf3、-ch2cf3、-ch2chf2、-ch2ch2f、oh、och3和so2ch3。根据本发明的另一个方面,提供式i的化合物及其立体异构体、互变异构体或药用盐,其中rb独立选自h、-o(c1-c3烷基)、c1-c6烷基,所述基团任选取代有一个或多个独立选自以下的基团:f、cl、br、i和oh。根据本发明的另一个方面,提供式i的化合物及其立体异构体、互变异构体或药用盐,其中rb为c1-c6烷基,所述基团任选取代有一个或多个独立选自以下的基团:f、cl、br和i。根据本发明的另一个方面,提供式i的化合物及其立体异构体、互变异构体或药用盐,其中y2为-(ch2)-。根据本发明的另一个方面,提供式i的化合物及其立体异构体、互变异构体或药用盐,其中cy为c6-c20芳二基或c1-c20杂芳二基。根据本发明的另一个方面,提供式i的化合物及其立体异构体、互变异构体或药用盐,其中cy为c6-c20芳二基。根据本发明的另一个方面,提供式i的化合物及其立体异构体、互变异构体或药用盐,其中cy为c6-c10芳二基。根据本发明的另一个方面,提供式i的化合物及其立体异构体、互变异构体或药用盐,其中c6-c20芳二基为苯二基。根据本发明的另一个方面,提供式i的化合物及其立体异构体、互变异构体或药用盐,其中所述c6-c20芳二基任选取代有一个或多个独立选自以下的基团:f、cl、br、i、-cn、-ch3、-ch2ch3、-ch(ch3)2、-ch2ch(ch3)2、-ch2oh、-ch2och3、-ch2ch2oh、-c(ch3)2oh、-ch(oh)ch(ch3)2、-c(ch3)2ch2oh、-ch2ch2so2ch3、-ch2op(o)(oh)2、-ch2f、-chf2、-cf3、-ch2cf3、-ch2chf2、-ch2ch2f、-ch(ch3)cn、-c(ch3)2cn、-ch2cn、-ch2nh2、-ch2nhso2ch3、-ch2nhch3、-ch2n(ch3)2、-co2h、-coch3、-co2ch3、-co2c(ch3)3、-coch(oh)ch3、-conh2、-conhch3、-con(ch3)2、-c(ch3)2conh2、-nh2、-nhch3、-n(ch3)2、-nhcoch3、-n(ch3)coch3、-nhs(o)2ch3、-n(ch3)c(ch3)2conh2、-n(ch3)ch2ch2s(o)2ch3、-no2、=o、-oh、-och3、-och2ch3、-och2ch2och3、-och2ch2oh、-och2ch2n(ch3)2、-op(o)(oh)2、-s(o)2n(ch3)2、-sch3、-s(o)2ch3和-s(o)3h。根据本发明的另一个方面,提供式i的化合物及其立体异构体、互变异构体或药用盐,其中所述c6-c20芳二基任选取代有一个或多个独立选自以下的基团:f、cl、br、i、-cn、-ch2f、-chf2、-cf3、-ch2cf3、-ch2chf2、-ch2ch2f、-nh2、-nhch3、-n(ch3)2、-nhcoch3、-no2、=o、-oh、-och3、-och2ch3和-sch3。根据本发明的另一个方面,提供式i的化合物及其立体异构体、互变异构体或药用盐,其中所述c6-c20芳二基任选取代有一个或多个独立选自以下的基团:f、cl、br、i、-ch2f、-chf2、-cf3、-ch2cf3、-ch2chf2和-ch2ch2f。根据本发明的另一个方面,提供式i的化合物及其立体异构体、互变异构体或药用盐,其中所述c6-c20芳二基任选取代有一个或多个独立选自以下的基团:f、cl、br和i。根据本发明的另一个方面,提供式i的化合物及其立体异构体、互变异构体或药用盐,其中苯二基任选取代有一个或多个独立选自以下的基团:f、cl、br和i。根据本发明的另一个方面,提供式i的化合物及其立体异构体、互变异构体或药用盐,其中苯二基取代有一个或多个f。根据本发明的另一个方面,提供式i的化合物及其立体异构体、互变异构体或药用盐,其中r1、r2、r3和r4独立选自h、f、cl、br、i、-cn、-ch3、-ch2ch3、-ch(ch3)2、-ch2ch(ch3)2、-ch2oh、-ch2och3、-ch2ch2oh、-c(ch3)2oh、-ch(oh)ch(ch3)2、-c(ch3)2ch2oh、-ch2ch2so2ch3、-ch2op(o)(oh)2、-ch2f、-chf2、-ch2nh2、-ch2nhso2ch3、-ch2nhch3、-ch2n(ch3)2、-cf3、-ch2cf3、-ch2chf2、-ch(ch3)cn、-c(ch3)2cn、-ch2cn、-co2h、-coch3、-co2ch3、-co2c(ch3)3、-coch(oh)ch3、-conh2、-conhch3、-conhch2ch3、-conhch(ch3)2、-con(ch3)2、-c(ch3)2conh2、-nh2、-nhch3、-n(ch3)2、-nhcoch3、-n(ch3)coch3、-nhs(o)2ch3、-n(ch3)c(ch3)2conh2、-n(ch3)ch2ch2s(o)2ch3、-no2、=o、-oh、-och3、-och2ch3、-och2ch2och3、-och2ch2oh、-och2ch2n(ch3)2、-op(o)(oh)2、-s(o)2n(ch3)2、-sch3、-s(o)2ch3、-s(o)3h、环丙基、环丁基、氧杂环丁烷基和氮杂环丁烷基。根据本发明的另一个方面,提供式i的化合物及其立体异构体、互变异构体或药用盐,其中r1、r2、r3和r4独立选自h、f、cl、br、i、-cn、-ch3、-ch2ch3、-ch(ch3)2、-ch2ch(ch3)2、-ch2oh、-ch2och3、-ch2ch2oh、-c(ch3)2oh、-ch2f、-chf2、-ch2nh2、-cf3、-ch2cf3、-ch2chf2、-ch2cn、-co2h、-coch3、-co2ch3、-conh2、-conhch3、-nh2、-nhch3、-n(ch3)2、-nhcoch3、-no2、-oh、-och3、-och2ch3、-sch3、-s(o)3h、环丙基和环丁基。根据本发明的另一个方面,提供式i的化合物及其立体异构体、互变异构体或药用盐,其中r1、r2、r3和r4独立选自h、f、cl、br、i、-cn、-ch3、-ch2ch3、-ch2oh、-ch2f、-chf2、-ch2nh2、-cf3、-ch2cf3、-ch2chf2、-ch2cn、-co2h、-coch3、-co2ch3、-conh2、-nh2、-nhch3、-n(ch3)2、-no2、-oh、-och3、-och2ch3、-sch3、环丙基和环丁基。根据本发明的另一个方面,提供式i的化合物及其立体异构体、互变异构体或药用盐,其中r1、r2、r3和r4独立选自h、f、cl、br、i、-cn、-ch3、-ch2ch3、-ch2oh、-ch2f、-chf2、-ch2nh2、-cf3、-ch2cf3、-ch2chf2、-ch2cn、-coch3、-nh2、-nhch3、-oh、-och3、-och2ch3、-sch3。根据本发明的另一个方面,提供式i的化合物及其立体异构体、互变异构体或药用盐,其中r1、r2、r3和r4独立选自h、f、cl、br、i、-ch3、-ch2ch3、-ch2oh、-ch2f、-chf2、-cf3、-ch2cf3、-ch2chf2、-coch3、-oh、-och3、-och2ch3。根据本发明的另一个方面,提供式i的化合物及其立体异构体、互变异构体或药用盐,其中r1和r2中的一个为h。根据本发明的另一个方面,提供式i的化合物及其立体异构体、互变异构体或药用盐,其中r1和r2为h。根据本发明的另一个方面,提供式i的化合物及其立体异构体、互变异构体或药用盐,其中r3为h且r4为-ch3。根据本发明的另一个方面,提供式i的化合物及其立体异构体、互变异构体或药用盐,其中r3为-ch3且r4为h。根据本发明的另一个方面,提供式i的化合物及其立体异构体、互变异构体或药用盐,其中r5选自h、c1-c9烷基、c3-c9环烷基、c3-c9杂环基、c6-c9芳基、c6-c9杂芳基、-(c1-c6烷二基)-(c3-c9环烷基)和-(c1-c6烷二基)-(c3-c9杂环),其任选取代有一个或多个卤素、cn、ora、n(ra)2、c1-c9烷基、c3-c9环烷基、c3-c9杂环、c6-c9芳基和c6-c9杂芳基。根据本发明的另一个方面,提供式i的化合物及其立体异构体、互变异构体或药用盐,其中r5选自h和c1-c9烷基,其任选取代有一个或多个卤素、cn、ora、n(ra)2、c1-c9烷基、c3-c9环烷基、c3-c9杂环、c6-c9芳基和c6-c9杂芳基。根据本发明的另一个方面,提供式i的化合物及其立体异构体、互变异构体或药用盐,其中r5为任选取代有一个或多个卤素的c1-c9烷基。根据本发明的另一个方面,提供式i的化合物及其立体异构体、互变异构体或药用盐,其中r5为任选取代有一个或多个卤素的c1-c6烷基。根据本发明的另一个方面,提供式i的化合物及其立体异构体、互变异构体或药用盐,其中r6选自h、f、cl、br、i、-cn、-ch3、-cf3、-no2、-oh、-och3和-sch3。根据本发明的另一个方面,提供式i的化合物及其立体异构体、互变异构体或药用盐,其中r6选自h、f、cl、br、i、-cn、-ch3、-cf3、-oh和-och3。根据本发明的另一个方面,提供式i的化合物及其立体异构体、互变异构体或药用盐,其中r6选自h、f、cl、br、i、-ch3和-oh。根据本发明的另一个方面,提供式i的化合物及其立体异构体、互变异构体或药用盐,其中r6为h。根据本发明的另一个方面,提供式i的化合物及其立体异构体、互变异构体或药用盐,其中所述式i为式ia:根据本发明的另一个方面,提供式i的化合物及其立体异构体、互变异构体或药用盐,其中所述式i为式ib:根据本发明的另一个方面,提供式i的化合物及其立体异构体、互变异构体或药用盐,其中所述式i为式ic:其中r7为f、cl、br、i、-cn、-ch3、-ch2ch3、-ch(ch3)2、-ch2ch(ch3)2、-ch2oh、-ch2och3、-ch2ch2oh、-c(ch3)2oh、-ch(oh)ch(ch3)2、-c(ch3)2ch2oh、-ch2ch2so2ch3、-ch2op(o)(oh)2、-ch2f、-chf2、-ch2nh2、-ch2nhso2ch3、-ch2nhch3、-ch2n(ch3)2、-cf3、-ch2cf3、-ch2chf2、-ch(ch3)cn、-c(ch3)2cn、-ch2cn、-co2h、-coch3、-co2ch3、-co2c(ch3)3、-coch(oh)ch3、-conh2、-conhch3、-conhch2ch3、-conhch(ch3)2、-con(ch3)2、-c(ch3)2conh2、-nh2、-nhch3、-n(ch3)2、-nhcoch3、-n(ch3)coch3、-nhs(o)2ch3、-n(ch3)c(ch3)2conh2、-n(ch3)ch2ch2s(o)2ch3、-no2、=o、-oh、-och3、-och2ch3、-och2ch2och3、-och2ch2oh、-och2ch2n(ch3)2、-op(o)(oh)2、-s(o)2n(ch3)2、-sch3、-s(o)2ch3、-s(o)3h、环丙基、环丙基酰胺基团、氧杂环丁烷基、氮杂环丁烷基、(1-甲基氮杂环丁烷-3-基)氧基、n-甲基-n-氧杂环丁烷-3-基氨基、氮杂环丁烷-1-基甲基、苄基氧基苯基、吡咯烷-1-基、吡咯烷-1-基-甲酮、哌嗪-1-基、吗啉代甲基、吗啉代-甲酮或吗啉代;n选自0、1、2、3和4;且r8为h或-ch3。根据本发明的另一个方面,提供式i的化合物及其立体异构体、互变异构体或药用盐,其中r7为f、cl、br、i、-cn、-ch3、-ch2ch3、-ch(ch3)2、-ch2ch(ch3)2、-ch2oh、-ch2och3、-ch2ch2oh、-c(ch3)2oh、-ch(oh)ch(ch3)2、-c(ch3)2ch2oh、-ch2ch2so2ch3、-ch2op(o)(oh)2、-ch2f、-chf2、-ch2nh2、-ch2nhso2ch3、-ch2nhch3、-ch2n(ch3)2、-cf3、-ch2cf3、-ch2chf2、-ch(ch3)cn、-c(ch3)2cn、-ch2cn、-co2h、-coch3、-co2ch3、-co2c(ch3)3、-coch(oh)ch3、-conh2、-conhch3、-conhch2ch3、-conhch(ch3)2、-con(ch3)2、-c(ch3)2conh2、-nh2、-nhch3、-n(ch3)2、-nhcoch3、-n(ch3)coch3、-nhs(o)2ch3、-n(ch3)c(ch3)2conh2、-n(ch3)ch2ch2s(o)2ch3、-no2、=o、-oh、-och3、-och2ch3、-och2ch2och3、-och2ch2oh、-och2ch2n(ch3)2、-op(o)(oh)2、-s(o)2n(ch3)2、-sch3、-s(o)2ch3、-s(o)3h、环丙基、环丁基、氧杂环丁烷基或氮杂环丁烷基。根据本发明的另一个方面,提供式i的化合物及其立体异构体、互变异构体或药用盐,其中r7为f、cl、br、i、-cn、-ch3、-ch2ch3、-ch(ch3)2、-ch2ch(ch3)2、-ch2oh、-ch2och3、-ch2ch2oh、-c(ch3)2oh、-ch2f、-chf2、-ch2nh2、-cf3、-ch2cf3、-ch2chf2、-ch2cn、-co2h、-coch3、-co2ch3、-conh2、-conhch3、-nh2、-nhch3、-n(ch3)2、-nhcoch3、-no2、-oh、-och3、-och2ch3、-sch3、-s(o)3h、环丙基或环丁基。根据本发明的另一个方面,提供式i的化合物及其立体异构体、互变异构体或药用盐,其中r7为f、cl、br、i、-ch3、-ch2ch3、-ch2oh、-ch2f、-chf2、-cf3、-ch2cf3、-ch2chf2、-coch3、-oh、-och3或-och2ch3。根据本发明的另一个方面,提供式i的化合物及其立体异构体、互变异构体或药用盐,其中r7为f、cl、br或i。根据本发明的另一个方面,提供式i的化合物及其立体异构体、互变异构体或药用盐,其中r7为f。根据本发明的另一个方面,提供式i的化合物及其立体异构体、互变异构体或药用盐,其中n选自1、2、3和4。根据本发明的另一个方面,提供式i的化合物及其立体异构体、互变异构体或药用盐,其中n选自0、1、2和3。根据本发明的另一个方面,提供式i的化合物及其立体异构体、互变异构体或药用盐,其中n选自1、2和3。根据本发明的另一个方面,提供式i的化合物及其立体异构体、互变异构体或药用盐,其中n选自1和2。根据本发明的另一个方面,提供式i的化合物及其立体异构体、互变异构体或药用盐,其中n选自2和3。根据本发明的另一个方面,提供式i的化合物及其立体异构体、互变异构体或药用盐,其中n为2,其中所述式i为式id:根据本发明的另一个方面,提供了具有化学式(i)和(ii)的化合物或其药用盐:在本发明的另一个方面,提供一种如上文所定义的具有化学式(i)的化合物。具有化学式(i)、(ii)的化合物具有一个、两个或三个手性中心并且本发明涵盖纯的手性形式或其以任何比例的混合物。光学活性形式的合成可通过本领域中熟知的有机化学的标准技术,例如通过从光学活性起始物质合成或通过拆分外消旋形式来进行。类似地,可以使用标准实验室技术评估上文所提及的活性。在此所述的化合物的特定对映异构体或非对映异构体的活性可以高于同一化合物的其他对映异构体或非对映异构体。根据本发明的另一个方面,提供一种具有化学式(i)、(ii)的化合物或其药用盐,其是对映异构体过量(ee%)≥95%、≥98%或≥99%的单一对映异构体。适宜地,单一对映异构体以对映异构体过量(ee%)≥99%存在。根据本发明的另一个方面,提供一种药物组合物,该药物组合物包括具有化学式(i)、(ii)的化合物,所述化合物是对映异构体过量(ee%)≥95%、≥98%或≥99%的单一对映异构体;或其药用盐,以及药用稀释剂或载体。适宜地,单一对映异构体以对映异构体过量(ee%)≥99%存在。根据本发明的另一个方面,提供一种具有化学式(i)、(ii)的化合物或其药用盐,其是非对映异构体过量(de%)≥95%、≥98%或≥99%的单一非对映异构体。适宜地,单一非对映异构体以非对映异构体过量(de%)≥99%存在。根据本发明的另一个方面,提供一种药物组合物,该药物组合物包括具有化学式(i)、(ii)的化合物,所述化合物是非对映异构体过量(de%)≥95%、≥98%或≥99%的单一非对映异构体;或其药用盐,以及药用稀释剂或载体。适宜地,单一非对映异构体以非对映异构体过量(de%)≥99%存在。一些具有化学式(i)、(ii)的化合物可以是结晶并且可以具有一种以上晶形。应了解,本发明涵盖任何晶形或非晶形或其混合物,该形式具有有用于serd活性的性质,在本领域中熟知如何通过下文所述的标准测试测定晶形或非晶形对于serd活性的功效。总体上已知可以使用常规技术分析结晶物质,如x射线粉末衍射(也称为xrpd)分析、差示扫描热量测定(也称为dsc)、热解重量分析(也称为tga)、漫反射红外傅里叶变换(drift)光谱法、近红外(nir)光谱法、溶液和/或固态核磁共振光谱法。这些结晶物质的水含量可以通过卡尔费歇尔分析(karlfischeranalysis)测定。具体来说本发明涉及如下内容:1.式i的化合物及其立体异构体、互变异构体或药用盐:其中:y1为crb或n;y2为-(ch2)-、-(ch2ch2)-或nra;y3为nra或c(rb)2;其中y1、y2和y3中的一个为n或nra;ra选自h、c1-c6烷基、c2-c8烯基、炔丙基、c3-c6环烷基和c3-c6杂环基,所述基团任选取代有一个或多个独立选自以下的基团:f、cl、br、i、cn、oh、och3和so2ch3;rb独立选自h、-o(c1-c3烷基)、c1-c6烷基、c2-c8烯基、炔丙基、-(c1-c6烷二基)-(c3-c6环烷基)、c3-c6环烷基和c3-c6杂环基,所述基团任选取代有一个或多个独立选自以下的基团:f、cl、br、i、cn、-ch2f、-chf2、-cf3、-ch2cf3、-ch2chf2、-ch2ch2f、oh、och3和so2ch3;z1选自crarb、c(o)和键;cy选自c6-c20芳二基、c3-c12碳环二基、c2-c20杂环二基和c1-c20杂芳二基;z2选自o、s、nra、c1-c6烷二基、c1-c6氟烷二基、o-(c1-c6烷二基)、o-(c1-c6氟烷二基)、c(o)和键;r1、r2、r3和r4独立选自h、f、cl、br、i、-cn、-ch3、-ch2ch3、-ch(ch3)2、-ch2ch(ch3)2、-ch2oh、-ch2och3、-ch2ch2oh、-c(ch3)2oh、-ch(oh)ch(ch3)2、-c(ch3)2ch2oh、-ch2ch2so2ch3、-ch2op(o)(oh)2、-ch2f、-chf2、-ch2nh2、-ch2nhso2ch3、-ch2nhch3、-ch2n(ch3)2、-cf3、-ch2cf3、-ch2chf2、-ch(ch3)cn、-c(ch3)2cn、-ch2cn、-co2h、-coch3、-co2ch3、-co2c(ch3)3、-coch(oh)ch3、-conh2、-conhch3、-conhch2ch3、-conhch(ch3)2、-con(ch3)2、-c(ch3)2conh2、-nh2、-nhch3、-n(ch3)2、-nhcoch3、-n(ch3)coch3、-nhs(o)2ch3、-n(ch3)c(ch3)2conh2、-n(ch3)ch2ch2s(o)2ch3、-no2、=o、-oh、-och3、-och2ch3、-och2ch2och3、-och2ch2oh、-och2ch2n(ch3)2、-op(o)(oh)2、-s(o)2n(ch3)2、-sch3、-s(o)2ch3、-s(o)3h、环丙基、环丙基酰胺基团、环丁基、氧杂环丁烷基、氮杂环丁烷基、(1-甲基氮杂环丁烷-3-基)氧基、n-甲基-n-氧杂环丁烷-3-基氨基、氮杂环丁烷-1-基甲基、苄基氧基苯基、吡咯烷-1-基、吡咯烷-1-基-甲酮、哌嗪-1-基、吗啉代甲基、吗啉代-甲酮和吗啉代;r5选自h、c1-c9烷基、c3-c9环烷基、c3-c9杂环基、c6-c9芳基、c6-c9杂芳基、-(c1-c6烷二基)-(c3-c9环烷基)、-(c1-c6烷二基)-(c3-c9杂环)、c(o)rb、c(o)nra、so2ra和so2nra,其任选取代有一个或多个卤素、cn、ora、n(ra)2、c1-c9烷基、c3-c9环烷基、c3-c9杂环、c6-c9芳基、c6-c9杂芳基、c(o)rb、c(o)nra、so2ra和so2nra;r6选自f、cl、br、i、-cn、-ch3、-ch2ch3、-ch(ch3)2、-ch2ch(ch3)2、-ch2oh、-ch2och3、-ch2ch2oh、-c(ch3)2oh、-ch(oh)ch(ch3)2、-c(ch3)2ch2oh、-ch2ch2so2ch3、-ch2op(o)(oh)2、-ch2f、-chf2、-ch2nh2、-ch2nhso2ch3、-ch2nhch3、-ch2n(ch3)2、-cf3、-ch2cf3、-ch2chf2、-ch2ch2f、-ch(ch3)cn、-c(ch3)2cn、-ch2cn、-co2h、-coch3、-co2ch3、-co2c(ch3)3、-coch(oh)ch3、-conh2、-conhch3、-conhch2ch3、-conhch(ch3)2、-con(ch3)2、-c(ch3)2conh2、-nh2、-nhch3、-n(ch3)2、-nhcoch3、-n(ch3)coch3、-nhs(o)2ch3、-n(ch3)c(ch3)2conh2、-n(ch3)ch2ch2s(o)2ch3、-no2、=o、-oh、-och3、-och2ch3、-och2ch2och3、-och2ch2oh、-och2ch2n(ch3)2、-op(o)(oh)2、-s(o)2n(ch3)2、-sch3、-s(o)2ch3、-s(o)3h、环丙基、环丙基酰胺基团、环丁基、氧杂环丁烷基、氮杂环丁烷基、(1-甲基氮杂环丁烷-3-基)氧基、n-甲基-n-氧杂环丁烷-3-基氨基、氮杂环丁烷-1-基甲基、苄基氧基苯基、吡咯烷-1-基、吡咯烷-1-基-甲酮、哌嗪-1-基、吗啉代甲基、吗啉代-甲酮和吗啉代;且其中所述烷二基、氟烷二基、芳二基、碳环二基、杂环二基和杂芳二基任选取代有一个或多个独立选自以下的基团:f、cl、br、i、-cn、-ch3、-ch2ch3、-ch(ch3)2、-ch2ch(ch3)2、-ch2oh、-ch2och3、-ch2ch2oh、-c(ch3)2oh、-ch(oh)ch(ch3)2、-c(ch3)2ch2oh、-ch2ch2so2ch3、-ch2op(o)(oh)2、-ch2f、-chf2、-cf3、-ch2cf3、-ch2chf2、-ch2ch2f、-ch(ch3)cn、-c(ch3)2cn、-ch2cn、-ch2nh2、-ch2nhso2ch3、-ch2nhch3、-ch2n(ch3)2、-co2h、-coch3、-co2ch3、-co2c(ch3)3、-coch(oh)ch3、-conh2、-conhch3、-con(ch3)2、-c(ch3)2conh2、-nh2、-nhch3、-n(ch3)2、-nhcoch3、-n(ch3)coch3、-nhs(o)2ch3、-n(ch3)c(ch3)2conh2、-n(ch3)ch2ch2s(o)2ch3、-no2、=o、-oh、-och3、-och2ch3、-och2ch2och3、-och2ch2oh、-och2ch2n(ch3)2、-op(o)(oh)2、-s(o)2n(ch3)2、-sch3、-s(o)2ch3、-s(o)3h、环丙基、环丙基酰胺基团、环丁基、氧杂环丁烷基、氮杂环丁烷基、(1-甲基氮杂环丁烷-3-基)氧基、n-甲基-n-氧杂环丁烷-3-基氨基、氮杂环丁烷-1-基甲基、苄基氧基苯基、吡咯烷-1-基、吡咯烷-1-基-甲酮、哌嗪-1-基、吗啉代甲基、吗啉代-甲酮和吗啉代。2.项1的式i的化合物及其立体异构体、互变异构体或药用盐,其中:y1为n;y2为-(ch2)-;y3为c(rb)2;ra选自h和c1-c6烷基,所述基团任选取代有一个或多个独立选自以下的基团:f、cl、br、i、cn和oh;rb为c1-c6烷基,所述基团任选取代有一个或多个独立选自以下的基团:f、cl、br和i;z1选自crarb、c(o)和键;cy为c6-c10芳二基,其任选取代有一个或多个独立选自以下的基团:f、cl、br和i;z2选自o、s、nra、c1-c6烷二基、c1-c6氟烷二基、o-(c1-c6烷二基)、o-(c1-c6氟烷二基)、c(o)和键;r1、r2、r3和r4独立选自h、f、cl、br、i、-ch3、-ch2ch3、-ch2oh、-ch2f、-chf2、-cf3、-ch2cf3、-ch2chf2、-coch3、-oh、-och3、-och2ch3;r5选自h和c1-c9烷基,其任选取代有一个或多个卤素、cn、ora、n(ra)2、c1-c9烷基、c3-c9环烷基、c3-c9杂环、c6-c9芳基和c6-c9杂芳基;r6选自h、f、cl、br、i、-cn、-ch3、-cf3、-no2、-oh、-och3和-sch3;且其中所述烷二基、氟烷二基、芳二基、碳环二基、杂环二基和杂芳二基任选取代有一个或多个独立选自以下的基团:f、cl、br、i、-cn、-ch2f、-chf2、-cf3、-ch2cf3、-ch2chf2、-ch2ch2f、-nh2、-nhch3、-n(ch3)2、-nhcoch3、-no2、=o、-oh、-och3、-och2ch3和-sch3。3.项1或2的式i的化合物及其立体异构体、互变异构体或药用盐,其中y1为n且y3为c(rb)2。4.项1-3中任一项的式i的化合物及其立体异构体、互变异构体或药用盐,其中y2为-(ch2)-。5.项1-4中任一项的式i的化合物及其立体异构体、互变异构体或药用盐,其中cy为c6-c20芳二基。6.项1-5中任一项的式i的化合物及其立体异构体、互变异构体或药用盐,其中c6-c20芳二基为苯二基。7.项1-6中任一项的式i的化合物及其立体异构体、互变异构体或药用盐,其中苯二基取代有一个或多个f。8.项1-7中任一项的式i的化合物及其立体异构体、互变异构体或药用盐,其中r1和r2为h。9.项1-8中任一项的式i的化合物及其立体异构体、互变异构体或药用盐,其中r3为h且r4为-ch3。10.项1-9中任一项的式i的化合物及其立体异构体、互变异构体或药用盐,其中r5为任选取代有一个或多个卤素的c1-c6烷基。11.项1-10中任一项的式i的化合物及其立体异构体、互变异构体或药用盐,其中r6为h。12.项1的式i的化合物及其立体异构体、互变异构体或药用盐,其中所述式i为式ia:13.项1的式i的化合物及其立体异构体、互变异构体或药用盐,其中所述式i为式ib:14.项1的式i的化合物及其立体异构体、互变异构体或药用盐,其中所述式i为式ic:其中r7为f、cl、br、i、-cn、-ch3、-ch2ch3、-ch(ch3)2、-ch2ch(ch3)2、-ch2oh、-ch2och3、-ch2ch2oh、-c(ch3)2oh、-ch(oh)ch(ch3)2、-c(ch3)2ch2oh、-ch2ch2so2ch3、-ch2op(o)(oh)2、-ch2f、-chf2、-ch2nh2、-ch2nhso2ch3、-ch2nhch3、-ch2n(ch3)2、-cf3、-ch2cf3、-ch2chf2、-ch(ch3)cn、-c(ch3)2cn、-ch2cn、-co2h、-coch3、-co2ch3、-co2c(ch3)3、-coch(oh)ch3、-conh2、-conhch3、-conhch2ch3、-conhch(ch3)2、-con(ch3)2、-c(ch3)2conh2、-nh2、-nhch3、-n(ch3)2、-nhcoch3、-n(ch3)coch3、-nhs(o)2ch3、-n(ch3)c(ch3)2conh2、-n(ch3)ch2ch2s(o)2ch3、-no2、=o、-oh、-och3、-och2ch3、-och2ch2och3、-och2ch2oh、-och2ch2n(ch3)2、-op(o)(oh)2、-s(o)2n(ch3)2、-sch3、-s(o)2ch3、-s(o)3h、环丙基、环丙基酰胺基团、氧杂环丁烷基、氮杂环丁烷基、(1-甲基氮杂环丁烷-3-基)氧基、n-甲基-n-氧杂环丁烷-3-基氨基、氮杂环丁烷-1-基甲基、苄基氧基苯基、吡咯烷-1-基、吡咯烷-1-基-甲酮、哌嗪-1-基、吗啉代甲基、吗啉代-甲酮和吗啉代;n选自0、1、2、3和4;且r8为h或-ch3。15.项1的式i的化合物及其立体异构体、互变异构体或药用盐,其中n为2,其中所述式i为式id:16.项1的式i的化合物及其立体异构体、互变异构体或药用盐,其中所述式i的化合物为下式(i)或(ii)所示的化合物:17.一种药物组合物,其包含项1-16中任一项的化合物和药用载体、助流剂、稀释剂或赋形剂。18.在患者中治疗雌激素受体相关疾病的方法,其包括向所述患者给予治疗有效量的项1-16中任一项的化合物。19.项18的方法,其中所述雌激素受体相关疾病为选自以下的癌症:乳腺癌、肺癌、卵巢癌、子宫内膜癌、前列腺癌和子宫癌。20.项1-16中任一项的化合物在制备用于治疗雌激素受体相关疾病的药物中的用途。21.项20的用途,其中所述雌激素受体相关疾病为选自以下的癌症:乳腺癌、肺癌、卵巢癌、子宫内膜癌、前列腺癌和子宫癌。部分化合物结构附图说明图1.化合物13的1h-nmr谱图;图2.化合物13的13c-nmr谱图;图3.化合物13的高分辨谱图(正离子);图4.化合物13的高分辨谱图(负离子);图5.化合物16的1h-nmr谱图;图6.化合物16的ms谱图。具体实施方案下面通过具体的制备实施例和测试例进一步说明本发明。实施例1合成路线:流程11.片段醛i的合成路线:流程2实验操作部分2.片段醛i的合成化合物b:将化合物a(0.50g,2.67mmol)和et3n(0.74ml,5.34mmol)溶于5mlch2cl2中,冷却至0℃,然后缓慢滴加mscl(0.32ml,4.01mmol),反应约1h。反应完全后向溶液中加入2ml10%柠檬酸溶液淬灭,分液,有机相依次用10%柠檬酸溶液(2ml),饱和nahco3溶液(2mlx2)以及饱和nacl(2ml)洗涤,无水na2so4干燥,过滤,减压浓缩得0.53g化合物b,黄色油状物,收率75%,直接用于下一步。化合物c:将化合物b(0.70g,2.67mmol)溶于tbaf(1mthf溶液,5ml,5mmol),回流反应约1h。反应完全后冷却至室温,减压浓缩一半溶剂,加入3mletoac,然后用饱和nacl(4mlx2)洗涤,合并有机相,水相再用2mletoac萃取,合并有机相,然后水洗(2ml),分液,水相用etoac(2mlx3)萃取,合并有机相,饱和nacl洗涤,无水na2so4干燥,过滤,减压浓缩,柱层析得0.36g化合物c,淡黄色油状物,收率73%。1hnmr(400mhz,氯仿-d)δ4.60(d,j=6.0hz,1h),4.48(d,j=6.0hz,1h),4.03(td,j=8.7,1.4hz,2h),3.76(dd,j=8.8,5.3hz,2h),2.95-2.79(m,1h),1.45(s,9h)。化合物d:将化合物c(0.42g,2.22mmol)溶于meoh(5ml),冷却至0℃,然后缓慢滴加稀盐酸(6m,1.11ml,6.66mmol),室温过夜。反应完全后浓缩除去水,得0.27g化合物d,白色固体,收率98%。1hnmr(400mhz,dmso-d6)δ9.34(s,2h),4.65(d,j=5.2hz,1h),4.53(d,j=5.1hz,1h),3.99(td,j=8.7,8.1,3.8hz,2h),3.77(dt,j=11.1,6.2hz,2h),3.23-3.04(m,1h)。化合物f:将化合物e(0.51g,3.9mmol),cs2co3(1.91g,5.85mmol)和2-溴乙醇(0.41ml,5.85mmol)溶于10mldmf中,升温至120℃反应约10h。反应完全后减压浓缩,然后水洗,饱和nacl洗涤,无水na2so4干燥,过滤,浓缩,柱层析得0.49g化合物f,无色油状物,收率72%。1hnmr(400mhz,氯仿-d)δ6.50-6.42(m,3h),4.06(dd,j=5.1,3.6hz,2h),3.98(dd,j=5.1,3.6hz,2h),2.10(dd,j=24.4,7.5hz,1h)。化合物g:将化合物f(0.66g,3.8mmol)和et3n(0.72ml,5.2mmol)溶于10mlch2cl2中,冷却至0℃,然后缓慢滴加mscl(0.32ml,4.01mmol),反应约1h。反应完全后向溶液中加入2ml10%柠檬酸溶液淬灭,分液,有机相依次用10%柠檬酸溶液(2ml),饱和nahco3溶液(2mlx2)以及饱和nacl(2ml)洗涤,无水na2so4干燥,过滤,减压浓缩得0.86g化合物g,淡黄色油状物,收率90%,直接用于下一步。化合物h:将化合物g(0.22g,0.87mmol),k2co3(0.27g,1.92mmol)和化合物d(0.11g,0.88mmol)溶于10mlch3cn中,升温至85℃反应过夜。反应完全后减压浓缩,柱层析得0.17g化合物h,淡黄色油状物,收率80%。1hnmr(400mhz,氯仿-d)δ6.43-6.36(m,3h),4.56(d,j=5.6hz,1h),4.44(d,j=5.6hz,1h),3.92(t,j=5.4hz,2h),3.49(tt,j=7.9,1.9hz,2h),3.18-3.06(m,2h),2.92-2.79(m,3h)。化合物i:将化合物h(0.30g,1.2mmol)溶于5ml干燥thf中,n2保护,冷却至-78℃,然后缓慢滴加tmeda(1.5ml,10mmol)和n-buli(0.85ml,1.3mmol),-78℃反应约0.5h,然后移至室温,缓慢滴加dmf(0.12ml,1.5mmol),室温反应约1h。反应完全后缓慢加入5ml冰水淬灭,40mletoac萃取,有机相依次水洗(20mlx3),饱和nacl洗涤,无水na2so4干燥,过滤,减压浓缩得0.17g化合物i,淡黄色油状物,收率51%。1hnmr(400mhz,氯仿-d)δ10.18(s,1h),6.53-6.44(m,2h),4.56(d,j=5.5hz,1h),4.44(d,j=5.5hz,1h),4.00(t,j=5.4hz,2h),3.48(td,j=7.8,1.5hz,2h),3.15(dd,j=7.7,6.4hz,2h),2.85(t,j=5.4hz,3h)。参考文献[1]wo2014/205138[2]wo2017059139a1目标化合物主体路线实验操作部分:将化合物1(15.0g,68.2mmol)溶入102mldmf中,加入叔丁基胺(21ml,204.6mmol,3.0eq),反应体系于45℃下反应4h,之后降至室温继续反应10h,反应完毕后加入75ml水,在室温下搅拌1h,加入200ml乙酸乙酯,水洗3次,所得有机相真空下除去溶剂,得到橘红色固体18.4g(99%),所得产物不需要纯化直接进行下一步反应。将化合物2(18.4g,67.5mmol)溶入170ml乙醇中,加入氯化铵水溶液20ml(浓度1.0mmol/0.6ml),反应体系在90℃下搅拌加入铁粉19.0g(337.5mmol,5.0eq),之后反应体系在90℃下反应3h,反应完毕后抽滤,将液相收集乙酸乙酯萃取,有机相旋干得到黑色固体14.7g(95%),所得产物不需要纯化直接进行下一步反应。将化合物3(14.7g,64.1mmol)溶入100ml乙酸中,加入亚硝酸钠水溶液100ml(6.5mmol/ml),反应体系在90℃下反应3h,反应结束后加入200ml乙酸乙酯,水洗三次,有机相旋干,层析柱纯化,得到淡黄色固体15.5g(95%)。1hnmr(400mhz,cdcl3)δ1.82(s,9h),7.48(d,j=8.6hz,1h),7.60(d,j=8.8hz,1h),8.18(s,1h)。将二异丙胺11.1ml(79.1mmol,1.3eq)溶入10ml四氢呋喃中,将反应体系冷却至-78℃,加入正丁基锂31.6ml(2.5m正己烷溶液,1.3eq),在-78℃下搅拌0.5h,将化合物4溶入100ml四氢呋喃中,冷却至-78℃,加入新制lda,在-78℃条件下反应1h,加入dmf30ml(400mmol,5.0eq),在-78℃下搅拌反应3h,所有反应过程均在氮气氛围下进行;反应完毕后,加入氯化铵水溶液淬灭,乙酸乙酯萃取,有机相旋干,柱层析纯化,得到淡黄色固体15.6g(70%)。1hnmr(400mhz,cdcl3)δ1.88(s,9h),7.69(d,j=8.8hz,1h),7.84(d,j=8.8hz,1h),10.87(s,1h)。将化合物5(15.6g,55mmol)溶入55ml硝基乙烷中,加入乙酸铵(4.23g,55mmol,1.0eq),反应体系在118℃条件下反应3h,反应完毕后旋干,柱层析纯化,得到淡黄色固体13g(70%)。1hnmr(400mhz,cdcl3)δ1.88(s,9h),2.28(d,j=1.2hz,3h),7.68(s,1h),8.19(d,j=0.8hz,1h)。在100ml烧瓶中加nabh4(216mg,5.7mmol),无水四氢呋喃10ml,于0℃下缓慢加入bf3-et2o(0.877ml,7.1mmol),室温搅拌15min。将化合物6(400mg,1.2mmol)溶于无水四氢呋喃(3ml)并滴加到反应中,反应于75℃回流约5.5h(tlc检测反应)。待反应完,冷却到室温,缓慢加冰水混合物18ml,并加入1nhcl(18ml),于85℃搅拌2h,冷却到室温,用naoh水溶液调节ph为碱性,加少量固体nacl,用二氯甲烷萃取,无水硫酸钠干燥,柱层析(用dcm:meoh/30:1)得到无色油状物241mg。产率:65%。1hnmr(400mhz,cdcl3)δ7.59(d,j=8.8hz,1h),7.49(d,j=8.8hz,1h),3.59(m,1h),3.46–3.33(m,2h),1.87(s,9h),1.27(d,j=6.4hz,3h)。参考文献:syn.commun,1985,15,843-847。将化合物7(470mg,1.0eq)溶解在10ml干燥的ch2cl2中,冷却到0℃,缓慢加入干燥的三乙胺(tea,0.274ml,1.3eq),随后加入tscl(376mg,1.3eq),升到室温下继续搅拌20min左右。tlc检测原料反应完全时,向该反应液中加入h2o(5.0ml)淬灭,用ch2cl2萃取三次,有机层用无水naso4干燥,减压除去有机溶剂,柱层析(ch2cl2作为洗脱剂),得到固体化合物(740mg,产率99%)。1hnmr(400mhz,cdcl3)δ7.34(d,j=2.0hz,2h),7.26(d,j=8.0hz,2h),6.93(d,j=8.0hz,2h),5.57(d,j=6.8hz,1h),3.88-3.81(m,1h),3.43(dd,j=13.6hz,j=10.0hz,1h),3.16(dd,j=13.8hz,j=4.2hz,1h),2.31(s,3h),1.86(s,9h),1.39(d,j=6.4hz,3h)。在n2保护下,将化合物8(150mg,1.0eq)溶解在5ml干燥的thf中,冷却到-78℃,缓慢加入t-buli(1.78ml,1.3m,1.4eq),反应体系变为深红色,在该温度下继续搅拌45min。将中间体醛i溶解在干燥的thf中(1.0ml),随后缓慢加入上述反应体系中,加入时该反应体系颜色退去。在-78℃继续搅拌20min,然后移到室温继续反应30min。tlc检测原料8反应完全时,向该反应液中加入饱和nh4cl淬灭,用乙酸乙酯萃取有机相,有机层用无水naso4干燥,减压除去有机溶剂,柱层析(ch2cl2:meoh=40:1作为洗脱剂),得到淡黄色泡沫状固体化合物9(133mg,产率40%)。其中化合物9里面掺杂一些无法分离的杂质(因此化合物9的产率在20-30%),但不影响下一步反应。参考文献:org.lett.,2017,19,6460-6462。将化合物9(200mg,1.0eq)溶解在5ml干燥的ch2cl2中,冷却到0℃,缓慢加入tfoh(0.5eq),在该温度下继续搅拌10min。tlc检测原料9反应完全时,向该反应液中加入少量氨水,随后加入少量水淬灭,用ch2cl2萃取有机相,有机层用无水naso4干燥,减压除去有机溶剂,柱层析(ch2cl2:meoh=30:1作为洗脱剂),得到淡黄色泡沫状固体化合物10(73mg,产率50%)。其中化合物10里面掺杂一些无法分离的杂质,但不影响下一步反应。参考文献:tetrahedronletters.2017,58,294-297。于100ml反应瓶中加入固体萘(615mg,5.0mmol),将钠块在干燥的石油醚中剪切至细小钠丝,之后快速称量(干燥纸巾吸除表面的石油醚)部分钠丝(115mg,5.0mmol)加入原先的反应瓶,置换氮气。取25ml重蒸thf用注射器加入反应体系,室温搅拌1h以上,可制得新鲜的钠萘复合物(0.2m于thf中),呈深绿色。将装有100mg(0.156mmol,1.0eq)反应底物化合物10的另一个反应瓶置换氮气,于-78℃条件下缓慢滴加3.9ml(0.78mmol,5.0eq)制备好的钠萘复合物溶液,继续在-78℃条件下搅拌3h,检测大部分底物已消耗完毕,-78℃下加入2ml饱和氯化铵淬灭,反应颜色褪去。升至室温后,用乙酸乙酯萃取多次,合并有机相,无水硫酸钠干燥,旋干后借助制备薄层色谱分离纯化(dcm:meoh:17%氨水=100ml:10ml:0.5ml)。产物为无色油状物30mg,产率40%。参考文献:synthesis,2012,44,297-303。1hnmr(400mhz,cdcl3)δ1.38(d,j=6.4hz,3h),1.86(s,9h),2.99(m,3h),3.10(dd,j=16.8hz,j=9.6hz,1h),3.36(t,j=6.8hz,2h),3.61-3.72(m,4h),3.64(dd,j=17.2hz,j=4.4hz,1h),4.03(t,j=5.2hz,2h),4.47(d,j=4.8hz,1h),4.59(d,j=5.2hz,1h),5.76(s,1h),6.44(d,j=10.4hz,2h),6.97(d,j=8.8hz,1h),7.45(d,j=8.8hz,1h)。装有化合物11(50mg,0.1mmol)的反应瓶中加入5ml甲醇溶解后,在搅拌状态下依次加入异丁醛(35mg,0.5mmol,5.0eq)、腈基硼氢化钠(13mg,0.2mmol,2.0eq)和催化量乙酸(2-3滴),室温条件下搅拌4h以上。tlc检测反应,底物有剩余时可补加少量异丁醛和氰基硼氢化钠继续反应。反应完全时加入饱和nahco3溶液调ph至中性,旋干大部分溶剂后二氯甲烷萃取,合并有机相,无水硫酸钠干燥,水相需用过量三氯化铁处理。旋干有机相后制备薄层色谱分离纯化(dcm:meoh=100ml:5ml)。产物为无色油状物41mg,收率75%。1hnmr(400mhz,cdcl3)δ0.71(d,j=6.4hz,3h),0.84(d,j=6.8hz,3h),1.03(d,j=6.4hz,3h),1.70(m,1h),1.85(s,9h),2.04-2.10(m,2h),2.47(dd,j=12.8hz,j=5.6hz,1h),2.88(m,3h),3.25(t,j=6.8hz,2h),3.36(dd,j=16.4hz,j=3.2hz,1h),3.37-3.61(m,4h),3.96(t,j=5.2hz,2h),4.46(d,j=5.2hz,1h),4.58(d,j=5.2hz,1h),5.16(s,1h),6.38(d,j=9.6hz,2h),6.86(d,j=8.4hz,1h),7.38(d,j=8.8hz,1h)。将30mg(0.055mmol)化合物12装入15ml封管中,加入环己烷1.5ml和三氟甲磺酸0.5ml,体系加热至100℃封管密闭反应持续12h以上。tlc检测,底物反应完全后用饱和碳酸氢钠调ph至中性,氯仿多次萃取,合并有机相,无水硫酸钠干燥。旋干有机相后制备薄层色谱分离纯化(dcm:meoh:17%氨水=100ml:15ml:2ml)。产物为淡黄色粉末16mg,收率60%。参考文献:tetrahedron,1991,47,9449。最终产物13(实施例1)数据:淡黄色粉末。收率:60%;1hnmr(400mhz,cdcl3)δ0.67(d,j=6.8hz,3h),0.81(d,j=6.4hz,3h),0.98(d,j=6.4hz,3h),1.66(m,1h),2.04(dd,j=12.8hz,j=8.0hz,1h),2.39(dd,j=12.8hz,j=6.4hz,1h),2.91-3.00(m,3h),3.09(dd,j=16.4hz,j=4.0hz,1h),3.30(t,j=7.2hz,2h),3.38(dd,j=16.4hz,j=4.8hz,1h),3.46(q,j=5.2hz,1h),3.63-3.68(m,2h),3.88-3.97(m,2h),4.44(d,j=5.2hz,1h),4.56(d,j=5.2hz,1h),5.15(s,1h),6.18(d,j=10.4hz,2h),6.82(d,j=8.8hz,1h),7.45(d,j=8.4hz,1h);δ12.4,20.4,20.9,26.5,30.8,31.3,31.5,47.8,54.6,56.2(q,j=3.8hz),57.4,57.6,66.3,82.8,84.4,98.4,111.8,113.0(t,j=15.7hz),122.4,125.8,133.4,138.4(d,j=213.7hz),158.9(t,j=14.1hz),162.3(dd,j=247.4hz,j=11.2hz);hrmsm/zc26h32f3n5o[m-h]+计算值:486.2486,实测值:486.2581;[m+h]+:488.2632,实测值:488.2640。实施例2合成路线:片段7a的合成将化合物7-1(8.00g,86.8mmol)和2,6-二甲基吡啶(11.2g,104mmol)溶于100ml二氯甲烷后,在-10℃加入tf2o(26.9g,95.5mmol),反应混合液在0℃下搅拌2小时,lcms显示反应完全。反应混合液依次用100ml水,100ml2nhcl,100ml饱和碳酸氢钠溶液洗涤后,用无水硫酸钠干燥,过滤,浓缩得到棕色油状化合物7a(9.16g)。1hnmr(400mhzcdcl3)δ4.41(d,j=18.4hz,2h),1.45(d,j=20.8hz,2h)。片段12-3a的合成化合物b:将化合物a(16.7g,89.2mmol)和三乙胺(10.8g,107mmol)溶于160ml二氯甲烷,在0℃和30min内缓慢滴加入mscl(11.2g,98.1mmol)的40ml二氯甲烷溶液,反应混合物在25℃下搅拌4小时,lcms显示反应完全。反应混合液用100mlx2的水洗涤后,用200ml二氯甲烷萃取,合并后的有机相用无水硫酸钠干燥,过滤,浓缩得到黄色油状化合物b(25.0g),不经分离直接用于下一步反应。化合物c:将化合物b(25.0g,94.2mmol)溶于tbaf(1.00m,400ml)的thf溶液,在80℃下搅拌6小时,tlc显示反应完全,反应混合液冷却到20℃后,加入200ml水后,减压浓缩thf,水相用200mlx8的乙酸乙酯萃取,合并的有机相再用1000ml水洗,无水硫酸钠干燥,过滤,浓缩得到的混合物经硅胶柱层析(ea/pe从0%至15%)得到无色油状化合物c。1hnmr(400mhzcdcl3)δ4.57(d,j=6.0hz,1h),4.46(d,j=6.0hz,1h),4.03-3.99(m,2h),3.76-3.72(m,2h),2.89-2.81(m,1h),1.43(s,9h)。化合物12-3a:将化合物c(11.5g,60.8mmol)溶于100ml二氯甲烷后加入tfa(35.5g,311mmol),反应混合物在20℃下搅拌24小时,tlc显示反应完全。反应混合液浓缩至干得到红色油状化合物12-3a(23.5g)。1hnmr(400mhzcdcl3)δ9.96(s,2h),8.93-8.88(m,2h),4.60(d,j=4.8hz,1h),4.49(d,j=4.8hz,1h),4.04-4.01(m,2h),3.83-3.81(m,2h),3.16-3.06(m,1h)。片段12a的合成化合物12-2:将化合物12-1(25.0g,192mmol),2-溴乙醇(36.0g,288mmol),碳酸铯(93.9g,288mmol)溶于500mldmf溶液后在120℃下搅拌16小时,lcms显示反应完全。减压浓缩除去dmf后,加入500ml水并用300mlx3乙酸乙酯萃取,合并后的有机相用无水硫酸钠干燥,过滤,浓缩得到的混合物经硅胶柱层析(ea/pe从0%至5%)得到黄色油状化合物12-2(25.6g,73.9%)。1hnmr(400mhzcdcl3)δ6.47-6.42(m,3h),4.05-4.03(m,2h),3.95(s,2h),2.11(s,1h)。化合物12-3:将化合物12-2(20.0g,115mmol)和三乙胺(16.3g,161mmol)溶于200ml二氯甲烷后在0℃缓慢滴加mscl(15.9g,138mmol),反应混合物在20℃下搅拌16小时,lcms显示反应完全。100ml的10%柠檬酸加入到反应混合液中,分层,有机相用200ml10%柠檬酸,200mlx2饱和碳酸氢钠水溶液,200ml饱和食盐水洗涤,合并后的有机相用无水硫酸钠干燥,过滤,浓缩得到黄色固体12-3(28.5g,94.2%)。1hnmr(400mhzcdcl3)δ6.49-6.42(m,3h),4.57-4.55(m,2h),4.22-4.20(m,2h),3.09(s,3h)。化合物12a:将化合物12-3a(23.0g,113mmol)溶于250ml乙腈后,加入碳酸钾(70.4g,509mmol),然后加入化合物12-3(28.5g,113mmol),反应混合物在85℃反应12小时,lcms显示反应完全。反应混合液用500ml水稀释后,浓缩,水相用200mlx3二氯甲烷分层,合并后的有机相用500ml饱和食盐水洗涤,用无水硫酸钠干燥,过滤,浓缩后经硅胶柱层析得到黄色油状化合物12a(11.5g,31.9%)。1hnmr(400mhzcdcl3)δ6.42-6.37(m,3h),4.56(d,j=5.6hz,1h),4.44(d,j=5.6hz,1h),3.92-3.89(m,2h),3.50-3.46(m,2h),3.15-3.12(m,2h),2.83-2.80(m,3h)。目标化合物主体路线实验操作部分:将化合物7(13.0g,41.8mmol)和dipea(8.10g,62.7mmol)溶于100ml2,4-二氧六环,加入化合物7a(14.1g,62.7mmol),反应混合物在85℃下搅拌48小时,lcms显示反应完全。经冷却后,反应混合物中加入100ml乙酸乙酯和200ml水萃取分层,水相再用100mlx2乙酸乙酯萃取分层,合并后的有机相用无水硫酸钠干燥,过滤,浓缩,再经硅胶柱层析(ea/pe从0%至100%)得到黄色胶状化合物8(12.2g,73.3%)。1hnmr(400mhzcdcl3)δ7.54(d,j=8.8hz,1h),7.44(d,j=8.8hz,1h),3.50-3.47(m,1h),3.33-3.28(m,2h),2.86-2.76(m,2h),1.84(s,9h),1.33(d,j=3.2hz,3h),1.28(d,j=3.2hz,3h),1.10(d,j=6.0hz,3h)。将化合物8(12.0g,31.1mmol)溶于120mlthf后,在0℃下加入三乙胺(25.2g,249mmol),然后加入boc2o(27.2g,124mmol)。反应混合物在50℃下反应12小时,lcms显示反应完全。冷却后,反应混合中加入100ml乙酸乙酯和200ml水萃取分层,水相用100mlx2的乙酸乙酯萃取分层,合并后的有机相用无水硫酸钠干燥,过滤,浓缩,经硅胶柱层析(ea/pe从0%至6%)得到白色固体化合物9(14.3g,92.3%)。1hnmr(400mhzcdcl3)δ7.52(d,j=9.2hz,1h),7.43(d,j=8.8hz,1h),4.19(s,1h),3.72-3.56(m,3h),3.36-3.28(m,1h),1.84(s,9h),1.46-1.22(m,19h)。将化合物9(14.3g,29.5mmol)溶于140ml甲醇后,加入pd(dppf)cl2(23.7g,32.4mmol)和醋酸钠(12.3g,150mmol),反应在80℃和co下搅拌169小时,lcms显示还剩下19.6%化合物9。反应混合液冷却到20℃后,用硅藻土过滤,滤液经浓缩后硅胶柱层析(ea/pe从0%至10%)得到黄色油状化合物10(4.44g,31.5%)。1hnmr(400mhzcdcl3)δ7.97(d,j=9.2hz,1h),7.56(d,j=8.8hz,1h),4.13-4.08(m,1h),3.94(s,5h),3.75-3.47(m,1h),3.33-3.24(m,1h),1.84(s,9h),1.38-1.21(m,20h)。将化合物10(4.30g,9.25mmol)溶于50mlthf后,在-60℃下加入libh4(706mg,32.4mmol),反应混合物在-60℃下搅拌1小时,然后升温至20℃下搅拌47小时,lcms显示反应完全。反应混合物降温至0℃后,缓慢滴加80ml饱和氯化铵溶液,用40ml乙酸乙酯萃取分层,水相再用40mlx2乙酸乙酯萃取分层,合并后的有机相用200ml饱和食盐水水洗,用无水硫酸钠干燥,过滤,浓缩后得到白色固体化合物11(4.10g)。1hnmr(400mhzcdcl3)δ7.61-7.45(m,2h),4.85-4.76(m,2h),4.57(s,0.5h),4.04(s,0.6h),3.70-3.43(m,3h),3.21-3.11(m,1h),1.85(s,9h),1.45-1.16(m,19h)。将化合物11(4.00g,9.16mmol)溶于40ml二氯甲烷后,在20℃下加入dmp(4.27g,10.1mmol),反应混合液在该温度下搅拌4小时,lcms显示反应完全。反应混合物加入60ml的aq.nahco3/na2s2o3(1:1)后,用40mlx2二氯甲烷萃取分层,合并的有机相用200ml饱和食盐水洗涤,无水硫酸钠干燥,过滤,浓缩后经硅胶柱层析(ea/pe从0%至10%)得到黄色胶状化合物12(3.91g,97.5%)。1hnmr(400mhzcdcl3)δ10.5(s,1h),7.97(d,j=7.6hz,1h),7.64(s,1h),4.17-3.92(m,3.5h),3.60-3.21(m,1.5h),2.83-2.78(m,0.4h),1.84(s,9h),1.48-1.22(m,18h)。将化合物12a(6.60g,26.9mmol)溶于40mlthf,加入tmeda(8.34g,71.8mmol),然后在-78℃下加入n-buli(2.5m,10.8ml),反应混合物在-78℃下搅拌40分钟,然后化合物12(3.90g,8.97mmol)的20mlthf溶液加入反应混合物,并在该温度下搅拌20分钟后,升温至20℃并搅拌5小时,lcms显示还剩下26%化合物12a,反应混合物加入80ml饱和氯化铵溶液,用40mlx3乙酸乙酯萃取分成,合并后的有机相用150ml饱和食盐水水洗,无水硫酸钠干燥,过滤,浓缩,经硅胶柱层析(meoh/dcm从0%至10%)得到黄色油状化合物13(2.00g,29.4%)。1hnmr(400mhzcdcl3)δ7.76-7.74(m,1h),7.62-7.50(m,1h),6.43(d,j=10.8hz,2h),4.55(d,j=6.0hz,1h),4.43(d,j=5.6hz,1h),3.91-3.88(m,2.7h),3.58-3.35(m,4h),3.14(t,j=6.4hz,2.6h),2.85-2.79(m,2.7h),1.84(s,9h),1.48-1.25(m,15h),0.97(s,3h)。将化合物13(2.57g,3.78mmol)溶于20ml二氯甲烷后加入dmp(1.76g,4.16mmol),反应混合物在20℃下搅拌12小时,lcms显示反应完全。反应混合物加入60ml的aq.nahco3/na2s2o3(1:1)后,用40mlx2二氯甲烷萃取分层,合并的有机相用150ml饱和食盐水洗涤,无水硫酸钠干燥,过滤,浓缩后经硅胶柱层析(ea/pe从0%至56%)得到黄色胶状化合物14(1.90g,51.2%)。1hnmr(400mhzcdcl3)δ7.51(s,2h),6.49(d,j=9.6hz,2h),4.56(d,j=5.2hz,1h),4.45(d,j=4.6hz,1h),3.99-3.91(m,4h),3.51-3.48(m,3h),3.18-3.14(m,3h),2.92-2.79(m,3.6h),1.84(s,9h),1.40-1.23(m,18h)。将化合物14(1.90g,2.80mmol)溶于20ml二氯甲烷后加入tfa(7.70g,67.5mmol),反应混合物在20℃下搅拌4小时,然后在30℃下搅拌1小时后,lcms显示反应完全。反应混合物经减压浓缩得到红色油状化合物15(1.90g)。将化合物15(1.90g,3.29mmol)溶于20ml甲醇,加入tfa(7.70g,67.5mmol)和nabh3cn(4.13g,65.8mmol),反应混合物在20℃下搅拌30分钟,升温至50℃搅拌12小时后,lcms显示反应完全。反应混合物经减压浓缩,用30mlx3二氯甲烷和30ml饱和碳酸氢钠水溶液萃取分层,有机相合并后用50ml饱和食盐水水洗,用无水硫酸钠干燥,过滤,浓缩后,经硅胶柱层析(meoh/dcm从0%至5%)得到黄色油状化合物15a(0.9g)。1hnmr(400mhzcdcl3)δ7.35(d,j=8.4hz,1h),6.80(d,j=8.8hz,1h),6.36(d,j=10.4hz,2h),5.22(s,1h),4.55(d,j=5.2hz,1h),4.44(d,j=4.8hz,1h),3.91-3.88(m,3h),3.53-3.48(m,3h),3.37-3.36(m,1h),3.17-3.14(m,2h),2.85-2.81(m,3h),2.39-2.28(m,2h),1.82(s,9h),1.24-1.15(m,7h),1.04(d,j=6.4hz,3h)。将化合物15a(20mg,35.6μmol)溶于hcooh(1.71mg,35.6μmol),加入hcl(12m,0.5ml),反应混合物在80℃下搅拌96小时,lcms显示生成了23.8%目标化合物,反应混合物用5mnaoh和饱和碳酸氢钠水溶液调节ph至8,用100mlx3二氯甲烷萃取,合并后的有机相用50ml饱和食盐水水洗,无水硫酸钠干燥,过滤,浓缩后得到的粗品经制备型tlc(dcm/meoh=10/1)得到黄色固体合物16(15mg)。1hnmr(400mhzcdcl3)δ7.42(d,j=8.8hz,1h),6.77(d,j=8.8hz,1h),6.19(d,j=10.8hz,2h),5.24(s,1h),4.55(d,j=4.8hz,1h),4.44(d,j=4.8hz,1h),3.94-3.90(m,2h),3.72-3.64(m,4h),3.29(t,j=6.8hz,2h),3.13-2.88(m,5h),2.37-2.26(m,1h),1.17(t,j=22.8hz,6h),1.01(d,j=6.4hz,3h)。测试例3erαtr-fret测试准备1x改良tris-hcl蛋白缓冲液,混合后待用。将待检测化合物实施例1检测终浓度为10μm,配置成终浓度的200倍浓度,即2mm。依次做3倍稀释,共稀释10个浓度。用echo550分别往反应板加入稀释好的化合物每孔100nl,每孔加入5nl雌二醇(1.5nm)。准备1x蛋白混合液:先按照下表准备2xgst-erα-lbd/mab抗gst-eu混合溶液。配置2x生物素-src1/抗生蛋白链菌素-xl665混合溶液。把以上两种2xgst-nr-lbd/mab抗gst-eu溶液和2x生物素-src2/抗生蛋白链菌素-xl665溶液按体积1:1混合均匀;将1x蛋白混合溶液加入384孔板每个孔,每孔加20μl,并将384孔板放入离心机室温1000转离心10秒,取出后在室温放置3小时后使用envision多功能酶标仪读数。读数665和615(纳米)值,并以615值做校正值,最终数值表示为665值/615值;抑制率按照以下公式计算:x是每个浓度的“665值比615值”。min是加了0.2mm阳性对照化合物和5nl3nm(1.5nm)雌二醇的“665值比615值”平均值。max是dmso和5nl3nm(1.5nm)雌二醇的“665值比615值”平均值。将数据导入graphpadprism并使用log(agonist)vs.response--variableslope进行曲线拟。拟合公式:y=bottom+(top-bottom)/(1+10^((logec50-x)*hillslope))erαtr-fret实验数据化合物ic50(nm)最大抑制率实施例12.3101.3azd94964.499.80他莫昔芬142.9100.4氟维司群4.0103.4测试例4erβtr-fret测试准备1x改良tris-hcl蛋白缓冲液,混合后待用。将待检测化合物实施例1检测终浓度为10μm,配置成终浓度的200倍浓度,即2mm。依次做3倍稀释,共稀释10个浓度。用echo550分别往反应板加入稀释好的化合物每孔100nl,每孔加入5nl雌二醇(1.5nm)。准备1x蛋白混合液:先按照下表准备2xgst-erβ-lbd/mab抗gst-eu混合溶液。配置2x生物素-src1/抗生蛋白链菌素-xl665混合溶液。把以上两种2xgst-nr-lbd/mab抗gst-eu溶液和2x生物素-src2/抗生蛋白链菌素--xl665溶液按体积1:1混合均匀;将1x蛋白混合溶液加入384孔板每个孔,每孔加20μl,并将384孔板放入离心机室温1000转离心10秒,取出后在室温放置3小时后使用envision多功能酶标仪读数。读数665和615(纳米)值,并以615值做校正值,最终数值表示为665值/615值;抑制率按照以下公式计算:x是每个浓度的“665值比615值”。min是加了0.2mm阳性对照化合物和5nl3nm(1.5nm)雌二醇的“665值比615值”平均值。max是dmso和5nl3nm(1.5nm)雌二醇的“665值比615值”平均值。将数据导入graphpadprism并使用log(agonist)vs.response--variableslope进行曲线拟。拟合公式:y=bottom+(top-bottom)/(1+10^((logec50-x)*hillslope))erβtr-fret实验数据化合物ic50(nm)最大抑制率实施例180.2100.3azd9496167.1101.0他莫昔芬988.699.4氟维司群12.8100.6测试例5mcf-7细胞增殖试验在96孔板中接种mcf-7(中国科学院典型培养物保藏委员会细胞库,tchu74细胞,培养基为含10%fbs(gibco,10099-141),1%丙酮酸(sigma,s8636),1%非必须氨基酸(sigma,m7145)的mem(hyclone,sh30024.01b)培养基,接种密度为4,000个细胞/孔,细胞在37℃、5%co2条件下培养。将化合物配置成20mm的储存液,用100%dmso梯度稀释成1000终浓度,再用含2%fbs的培养基稀释20倍。培养24小时后去掉培养基,每孔加入90μl含2%fbs的培养基和10μl药物,对照组加入10μldmso,轻轻振荡混匀,空白组只含100μl2%fbs培养基,放置37℃、5%co2培养箱中培养,72小时后加入50μl混合后的celltiter-glo(promega,g7571),振荡混匀,室温放置10min,测定化学发光信号值,阴性对照为0.5%dmso孔。mcf-7细胞增殖试验实验数据化合物ic50(nm)实施例11.53实施例26.16azd949613.53化合物1*2.68他莫昔芬874.5氟维司群2.54备注:*化合物1来自于专利pct/ep2017/059234,wo2017/182493a1中的example1。测试例6体外人体肝微粒体稳定性试验除空白对照组外,向96孔板每个孔加入10μl浓度为10mm的待测化合物,再加入80μl的微粒体溶液(用100mm磷酸钾溶液配制0.5mg/ml的微粒体蛋白溶液),并在37℃下培养10分钟。向ncf60加入10μl浓度为100mm的磷酸钾缓冲液到ncf60,在37℃下放置1小时。在试验预处理后,向每个孔加入10μlnadph以激活反应,反应体系个组分的浓度如下表所示:组分终浓度微粒体0.5mg蛋白/ml待测化合物1μμ对照1μμmeoh0.99%dmso0.01%在37℃下,按照下表所示时间进行培养和操作:向每孔加入300μl的反应淬灭溶液((冷却(4℃)的乙腈溶液,溶液里包含浓度为100ng/ml的甲苯磺丁脲(tolbutamide)和浓度为100ng/ml的拉贝洛尔(labetalol))以便终止反应,将盛有待测样品的96孔板置于摇床上摇动约10分钟后,并将96孔板放入离心机室温4000转离心20分钟,准备8个新的96孔板,并且每个孔里添加300μl蒸馏水,再转移100μl上清液混合后,进行lc/ms/ms检测和分析,并按照如下公式计算:体外微粒体稳定性实验数据备注:*化合物1来自于专利pct/ep2017/059234,wo2017/182493a1中的example1。测试例7人体肝微粒体cyp抑制实验按照下表准备待测化合物在不同浓度的测试溶液:按照下表准备阳性对照化合物:按照下表准备底物溶液:加入20μl的底物溶液到对应的孔里面,加入20μl的pb到空白对照组;加入2μl的待测化合物和阳性对照到相应的孔里面,加入2μl溶剂到未加入抑制剂的组或空白对照中;准备hlm工作溶液(humanlivermicrosome人体肝脏微粒体溶液(用100mm磷酸钾溶液配制0.25mg/ml的微粒体蛋白溶液),加入158μlhlm工作溶液到各个孔里面,在37℃下预热10分钟后,加入20μlnadph溶液,混合后在37℃的水浴锅里面培养10分钟;加入400μl淬灭溶液,然后放入离心机室温4000转离心20分钟,转移200μl上清液至100μlhplc用水中,并混匀10分钟,样品可供lc/ms/ms检测和分析。人体肝微粒体cyp抑制实验数据备注:*化合物1来自于专利pct/ep2017/059234,wo2017/182493a1中的example1。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1