一种抗氧化肽NV13重组基因的生物表达及应用的制作方法
本发明属于分子生物学领域,具体涉及一种抗氧化肽nv13重组基因的生物表达及应用及成药性研究。
背景技术:
氧化是许多恶化现象的重要原因,例如食物腐败和许多人类疾病(包括心血管疾病,糖尿病,炎性疾病和衰老)等。因此,自由基诱导的机体器官氧化是大多数疾病的主要病因,并且自由基也是食物变质的关键诱因。在食品中使用非天然人工抗氧化剂,例如丁基化羟基苯甲醚(bha)等,由于其潜在的健康危害和具有毒性作用,故而受到严格的管制。因此,添加天然的抗氧化剂作为合成的抗氧化剂的替代物己经成为了食品安全的必然趋势,越来越受到研究者甚至大众的关注。
抗氧化肽是目前研究较多的一种生物活性肽,抗氧化肽对抑制、延缓脂质氧化,保护人体组织器官免受自由基侵害的有特定作用。抗氧化肽的抗氧化活性与多肽的相对分子质量大小、氨基酸序列、氨基酸侧链基团、金属盐络合有关。抗氧化肽的抗氧化活性是由其分子供氢的能力和自身结构的稳定性决定的。抗氧化肽的作用机理是直接作用在自由基,或是间接消耗掉容易生成自由基的物质,防止发生进一步反应。
多肽的体外抗氧化活性体外化学试验是筛选具有清除自由基活性物质的重要手段,目前报道的有4大类24种方法,这些方法在不同的研究中均有应用由于不同实验室采用的方法不同,筛选得到的具有抗氧化活性物质的可比,由于不同实验室采用的方法不同,筛选得到的具有抗氧化活性物质,通常有自由基清除能力(如abts·+、dpph·、roo·等自由基清除能力)、还原力、金属离子螯合能力以及抑制亚油酸过氧化的能力在细胞水平上评价多肽的抗氧化活性主要是通过构建细胞的氧化损伤模型,考察多肽对于细胞的保护作用。在动物水平上评价多肽的抗氧化活性是通过构建动物氧化应激模型,考察多肽对于动物组织内各种氧化损伤指标的保护作用。抗氧化剂可以通过氢原子转移及单电子转移两种途径来清除自由基。
技术实现要素:
本发明的目的在于,提供一种抗氧化肽nv13重组基因的生物表达及应用,利用pet载体系统构建了的原核表达载体,然后通过高压液相色谱纯化得到了这条多肽,它包含13个氨基酸残基,分子量为1348.61,等电点为4.13,其氨基酸序列seqid:1所示:天冬酰胺-谷氨酸-天冬氨酸-天冬酰胺-组氨酸-脯氨酸-甘氨酸-丙氨酸-亮氨酸-甘氨酸-谷氨酸-脯氨酸-缬氨酸(asn-glu-asp-asn-his-pro-gly-ala-leu-gly-glu-pro-val)。
本发明的另一个目的在于提供一种抗氧化肽nv13在制备清除dpph自由基药物中的应用。
本发明所述的一种抗氧化肽nv13重组基因的生物表达,利用pet载体系统构建了的原核表达载体,然后通过高压液相色谱纯化得到了多肽,它包含13个氨基酸残基,分子量为1348.61,等电点为4.13,其氨基酸序列seqid:1所示:asn-glu-asp-asn-his-pro-gly-ala-leu-gly-glu-pro-val1510。
所述的一种抗氧化肽nv13在制备清除dpph自由基药物中的应用。
本发明所述的一种抗氧化肽nv13重组基因的生物表达及应用,利用pet载体系统构建原核表达载体并通过高压液相色谱纯化得到这条多肽,然后对它的一些可能存在的生物学功能进行研究过程。
本发明所述的一种抗氧化肽nv13重组基因的生物表达及应用,其中nv13中的n表示天冬酰胺,v表示为最后一个缬氨酸,13为共13氨基酸。
本发明所述的一种抗氧化肽nv13重组基因的生物表达及应用,其有益效果是:本发明中的多肽nv13通过原核基因表达系统表达方法得到,具有分子量小、在大肠杆菌较容易表达,抗氧化活性效果明显。
附图说明
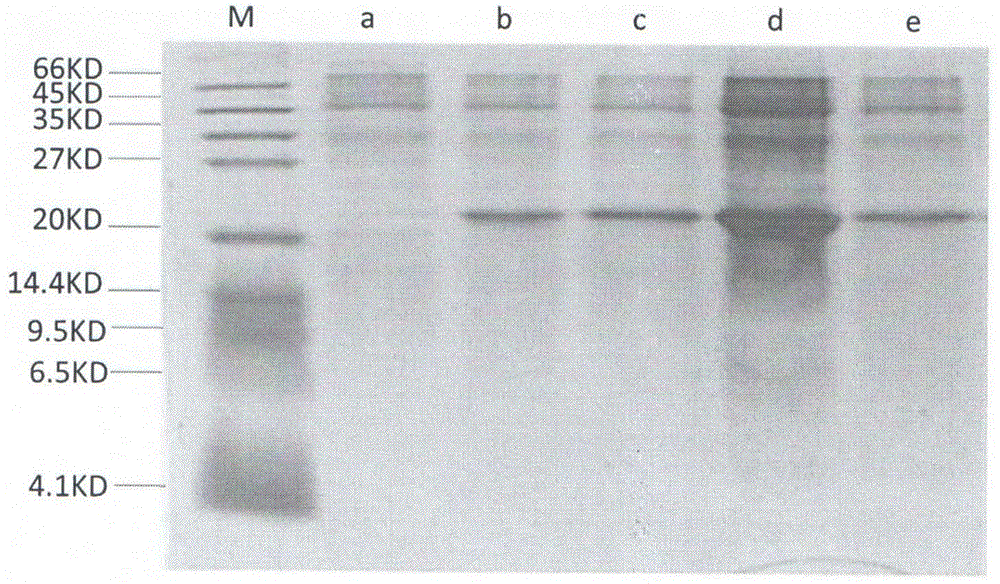
图1为本发明nv13重组蛋白诱导表达电泳示意图,其中m.标准样品;a.诱导前b.24℃,6h诱导;c.24℃,8h诱导;d.24℃,10h;e.28℃,12h;
图2为本发明从ni离子亲和柱洗脱的含有多肽nv13的融合蛋白电泳示意图;
图3为本发明nv13重组蛋白酶切后rp-hplc纯化示意图;
图4为本发明多肽nv13分子量质谱图;
图5为本发明抗氧化肽nv13dpph自由基清除活性示意图,其中所有的实验都是三次结果的平均值。
具体实施方式
下面结合附图对本发明做进一步的描述,本发明的保护范围不局限于所给出的实施例。
实施例1
表达序列的合成:
从ncbi数据库中下载得到抗氧化肽的核苷酸序列核5'-ccatgggcaacgaagataaccatccgggcgcactgggtgaaccggttgaaaacctgtattttcagggttaactcgag-3',为了克隆进表达载体pet32a,在序列5和3端分别加入tev酶切位点和保护碱基,为了后续的融合蛋白切割,在5端还引入了氨基酸序列glu-asn-leu-tyr-phe-gln-glytev酶切割位点;
表达载体的构建:
挑取少量保存pet32a的top10于含氨苄青霉素(本实验所使用浓度均为100μg/ml)的lb固体培养基上划线活化,温度37℃培养24小时,挑取单菌落接种于新鲜的含氨苄青霉素的lb液体培养基中培养至od600值为0.6-1.0左右,用质粒小量提取试剂盒提取pet32a质粒,电泳检测提取结果,将提取的pet32a质粒和携带目的核苷酸序列的puc57质粒进行ncoi和xhoi双酶切,酶切体系按限制性内切酶酶切体系说明书进行,酶切后的质粒电泳检测酶切效果,按照琼脂糖凝胶dna回收试剂盒说明书回收切割开环的pet32a质粒和从puc57质粒切割下来的目的蛋白核苷酸序列,回收的片段用琼脂糖凝胶电泳检测,估计回收片段浓度,将回收的双酶切的pet32a和表达片段用t4dna连接酶连接,温度16℃连接过夜;
大肠杆菌top10感受态细胞够自南京诺唯赞公司;用热激法将重组子转入大肠杆菌top10感受态细胞,转化后的菌株加入普通lb液体培养基,于温度37℃,120rmp振荡培养1小时后取30μl均匀涂布于含有氨苄的lb固体培养基平板;温度37℃倒置培养18-24小时,观察到明显菌落时取出,挑取平板上的单菌落,通过pcr检测质粒中是否含有目的核苷酸序列;pcr正向引物5'gaacgccagcacatggacagc3',反向引物5'gctagttattgctcagcgg3',琼脂糖凝胶电泳检测pcr产物;检测结果呈阳性的克隆接种于1ml新鲜含氨苄的lb液体培养基中培养,温度37℃培养2小时后送测序公司测序;
将测序结果与插入的目的蛋白核苷酸序列进行比对,序列完全一致的克隆从平板中接入含氨苄的lb液体培养基中活化后,用质粒小量提取试剂盒提取质粒后转入大肠杆菌bl21准备表达目的蛋白,构建好的重组表达菌株加入15%甘油保存于温度-20℃冰箱;
重组菌株的诱导表达:
融合蛋白的诱导表达:将保存的重组表达菌株在含有氨苄的固体lb平板上活化,挑取单菌落接种于含氨苄的lb液体培养基中,培养至对数生长期,按2:1000比例转接入新鲜的含氨苄的液体lb培养基,温度37℃180rpm培养4小时,使菌液的od600达到0.6左右,加入iptg至终浓度1mm,温度24℃低转速100rpm诱导10小时,诱导产物冰浴10分钟,于温度4℃,9000rpm离心10分钟,收集菌体,将诱导前后菌体加入还原性上样缓冲液,沸水浴5分钟后跑sds-page电泳检测是否诱导目的蛋白表达;
菌体超声波破碎:将收集到的诱导沉淀物按20:1(重悬液:沉淀物)的比例重悬于bindingbuffer(参照merck的hisbindresin手册)中,充分混匀后,冰上超声充分裂解诱导产物,用6号探头,30%的功率超声3秒,间隔3秒,超声10分钟;
融合蛋白的可溶性分析:取出超声波破碎的液体100μl,温度4℃,12000rpm离心10分钟,分别在上清液和沉淀中加入还原性上样缓冲液,沸水浴后进行sds-page电泳检测;
将测序构建正确的质粒从克隆载体top10中提出后转入表达载体bl21,对重组表达菌株进行iptg诱导检测是否能表达目的蛋白,pet32a采用t7启动子,目的蛋白插入点为ncoi酶切位点之后,在t7启动子与ncoi酶切位点之间还有一段约500bp的核苷酸序列,因此诱导表达的蛋白为融合蛋白;目的蛋白n端之前连接一段173个氨基酸组成的分子量约为19kd的融合蛋白标签;结果如图1所示:构建的多肽nv13重组菌株都能被iptg诱导产生融合蛋白,融合蛋白大小与理论分子量基本吻合,对表达融合蛋白的可溶性分析结果显示图1;
表达蛋白的分离纯化:
融合蛋白的亲和层析:取上清,经0.45μm滤膜过滤,上样于已经平衡好的hisbindresin(merck)亲和柱,步骤如下:
(1)加两倍胶体积去离子水冲洗;
(2)用chargebuffer洗至亲和胶呈明显蓝色;
(3)用bindingbuffer洗两遍,洗去未结合的镍;
(4)按每小时10ml的速度上样;
(5)分别用50mm咪唑和100mm咪唑washbuffer洗一遍,收集样品;
(6)用elutebuffer冲洗,收集样品,至od280降至0.05以下;
(7)用stripbuffer脱镍至亲和胶恢复原先的白色,并用stripbuffer浸泡封存;
目的蛋白的释放:利用tev蛋白酶释放目的蛋白的方法,从ni离子亲和柱洗脱的融合蛋白;
酶切体系:融合蛋白1000ug;250*rtevproteasebuffer4ul;rtev蛋白酶2ul;定容至1000ul;定容缓冲液:50mmnah2po4,150mmnacl;
酶切条件:在温度35℃,酶切2h;
反向高压液相色谱纯化收集的样品进一步过反向高压液相色谱(waters600controller)纯化,以含0.1%三氟乙酸的超纯水,含0.1%三氟乙酸的乙腈构成的洗脱系统进行梯度洗脱,280/216nm紫外检测蛋白浓度,流速1ml/min,纯化得到的样品通过maldi-tofms(abi4700(absciex)检测分子量;
rp-hplc分离结果:从ni离子亲和柱洗脱的融合蛋白利用tev蛋白酶释放目的蛋白后,样品经过0.22滤膜过滤后上样于高压液相色谱c18分析柱,nv13样品在乙腈浓度约19%时从柱子上洗脱下来(图3),图3中箭头所指峰为目的蛋白所在位置;
目的蛋白分子量测定:采用基质辅助激光解吸电离飞行时间质谱4000,qtrapelitelc-ms/mssystem(absciex,concord,on,canada)来鉴定原核表达后所得到的抗氧化nv13的分子量,经expasy网站(http://www.expasy.ch)预测nv13的理论分子量为1348.61,质谱结果为1348.8(图4),两者之间吻合,可以推断hplc洗脱得到的样品为所需要表达的目的蛋白。
实施例2
所述的一种抗氧化肽nv13在制备清除dpph自由基药物中的应用:
实验试剂:dpph(2,2-diphenyl-1-picrylhydrazylhydrate)(2,2′-二苯代苦味酰基苯肼),是一种稳定的以氮为中心的脂性自由基,其结构中含有3个苯环,其甲醇或乙醇溶液呈紫色,在517nm附近有强吸收,当有供氢能力的抗氧化剂存在时,颜色会由深紫色变为浅黄色,在517nm处的吸光度变小,其吸光度变小的程度与清除自由基的能力呈正相关性,因而可用于检测抗氧化活性;
配制6×10-5mdpph(sigma)甲醇溶液:称取1.2mgdpph,溶于500μl甲醇溶液,配成100×保存液,置于温度4℃冰箱保存,使用前用甲醇稀释100倍后成工作液,dpph工作液应尽量避光保存,现配现用;
溶于超纯水的多肽样品加入dpph工作液,体系为100μl,室温避光放置30min,于517nm处检测光吸收,相对于空白对照(与样品同体积的超纯水)光吸收的减少应自由基的清除情况,每个浓度样品做3个平行,紫外分光光度计调零时使用甲醇;
dpph自由基清除率通过以下公式计算:
清除率=[(a0-a1)/a0]×100
其中,a0为空白对照光吸收值,a1为加入样品组光吸收值;
结果表明:dpph自由基是一种相对稳定的自由基,可以接受电子或氢原子形成稳定的反磁性分子,因此,dpph被广泛用于,评价自由基清除活性;检测517nm处的光吸收值可以检测出dpph自由基的清除状况,抗氧化肽nv13对dpph自由基的清除结果如图5所示:dpph法测定结果可知,4mg/ml时,抗氧化肽nv13和bht的dpph自由基清除率分别为63.56%和96.82%,这些研究结果表明,抗氧化肽nv13可以提供一个电子或氢原子来清除dpph自由基。
序列表
<110>中国科学院新疆理化技术研究所
<120>一种抗氧化肽nv13重组基因的生物表达及应用
<160>1
<170>siposequencelisting1.0
<210>1
<211>13
<212>prt
<213>抗氧化肽(nv13)
<400>1
asngluaspasnhisproglyalaleuglygluproval
1510
- 还没有人留言评论。精彩留言会获得点赞!